威士忌是由麦芽和谷物经过糖化、发酵、蒸馏、陈酿和调配等工艺精心制成的蒸馏酒[1-2]。在英国,威士忌被誉为“生命之水”[3]。近年来,威士忌在中国的进口量呈现出显著增长的趋势,但造假现象日益严重[4],如用低价威士忌替代,掺入酒精、调和酒精、调味料和色素等[5]。为有效鉴别威士忌的真伪,检测技术主要有光谱法、色谱法和质谱法。 紫外-可见光谱[6-7]和拉曼光谱[8-9]指纹图谱检测快速,但存在不同设备或实验室之间光谱可比性低,光谱的解释困难等缺点。气相色谱(gas chromatography,GC)和气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)在威士忌真实性鉴别中发挥着重要作用,可应用于威士忌真伪、酒龄、橡木桶陈酿方式等的鉴别[10-13]。元素分析技术虽然在酒类真实性检测中也具有应用[14-15],但在威士忌原产地和类型鉴别的研究并不多[16-17]。然而,这些技术均不适用于外源性酒精的鉴别。
稳定同位素质谱(isotope ratio mass spectrometry,IRMS)具备开展内外源物质检测的潜力,可通过测试样品中稳定同位素比值分辨样品的真伪、产地等[18],在食品真实性鉴别领域得到广泛应用[19],在葡萄酒溯源研究中的应用尤为广泛[20-24]。由于C4和C3两种不同植物光合作用代谢途径所得产物碳稳定同位素比值(δ13C)存在差异[25],不同原料酿制威士忌中挥发性成分的δ13C也有所差异,如源自C3植物(例如小麦、大麦等谷物)挥发性成分的δ13C值相对于源自C4植物(例如玉米、甘蔗)显著偏负。 威士忌自身发酵产生的挥发性成分与所添加其他外源性成分的δ13C值的差异可以有效应用于掺伪鉴别。 GC-C-IRMS被用于分析威士忌中的醛类和醇类的δ13C,使用雷达图比较真假威士忌的差异[26]。 正丙醇的δ13C值可作为内标应用于威士忌中外源性乙醇的掺假鉴别[27]。 此外,威士忌的δ2H和δ18O值也可应用于正宗威士忌样品和假冒威士忌样品的鉴别[28]。因此,采用稳定同位素比值分辨样品的真伪对于品质安全具有重要意义。
威士忌的主要挥发性风味成分包括乙醛、异丁醇、正丙醇、戊醇、乙酸乙酯、乙醛和乙醇等[2,29]。 有研究使用这6种挥发性成分进行外源性酒精鉴别的研究[27]。因此,本研究通过气相色谱-燃烧-稳定同位素质谱(gas chromatographycombustion-isotope ratio mass spectrometry,GC-C-IRMS)分析威士忌中6种主要挥发性风味成分的δ13C值,通过数据分析建立了一套鉴别威士忌中外源性酒精的方法。以期为威士忌真伪鉴别提供新方法,保障威士忌产品质量。
1 材料与方法
1.1 材料与试剂
129批次威士忌样品(苏格兰威士忌78批次、日本威士忌17批次、美国威士忌15批次、爱尔兰威士忌19批次、假冒威士忌3批次):来源于供应商(深圳海关进口认证样品)。
乙醇同位素标准物质BCR-656 (δ13CV-PDB= (26.91±0.07)‰)(纯度96%):欧洲标准物质中心;异丁醇(纯度99.5%)、正丙醇(纯度99.9%):美国CFW实验室有限公司;异戊醇(纯度99.6%):上海麦克林生化科技股份有限公司;乙醇(色谱纯)、乙酸乙酯(纯度99.9%):阿拉丁生化科技股份有限公司;乙醛(纯度99.7%):德国默克公司。
1.2 仪器与设备
DELTA V Plus同位素质谱仪(配备Trace GC气相色谱仪与GCIsolink接口):美国Thermo Fisher公司;Milli-Q超纯水系统:美国Millpore公司。
1.3 方法
1.3.1 样品分析
由于不同组分挥发性成分在威士忌中的含量不同,因此为了达到较好的分离效率和准确度,本文参考文献[27]方法分别测定乙醇、其他挥发性风味成分。
标准品的配制:除乙醇外,其他挥发性风味成分标准品均无相应的同位素标准值。 因此,本研究以BCR-656作为稳定同位素比值的质量控制标准。乙醇、异丁醇、正丙醇、异戊醇、乙醛标准溶液分别将标准物质用纯净水稀释至0.1%,乙酸乙酯标准溶液将标准品用10%甲醇水稀释至0.1%。乙醛、乙酸乙酯、正丙醇、异丁醇、异戊醇、乙醇标准溶液主要用于检查GC-C-IRMS的色谱性能,确定保留时间。
乙醇δ13C的检测:按照SN/T 5035—2018《出口酒精饮料中乙醇碳稳定同位素比值的测定气相色谱-稳定同位素比率质谱法》,将威士忌样品用一级水稀释至酒精度为10%vol~15%vol后采用GC-C-IRMS分析。 分析条件:HPINNOwax气相色谱柱(30 m×0.25 mm×0.25 μm),进样量0.1 μL,进样口温度250 ℃,载气为高纯氦气(He)(纯度99.999%),流速1.5 mL/min,分流比200∶1。 程序升温条件:初始温度40 ℃,保留1 min,50 ℃/min升温至220 ℃,保留3 min。GC Isolink条件:燃烧管温度1 000 ℃,切入质谱时间100 s;参考气信号强度:3 000 mv。
其他5种挥发性成分δ13C的检测:威士忌样品开瓶后摇匀,一次性注射器(5 mL)吸取威士忌样约2 mL,用0.22 μm水系滤膜过滤至1.5 mL样品瓶中,使用GC-C-IRMS分析。分析条件:HP-INNOwax气相色谱柱(30 m×0.25mm×0.25μm),异丁醇、正丙醇、异戊醇进样量为0.1 μL,乙醛和乙酸乙酯进样量为0.2 μL,进样口温度250 ℃,载气为高纯氦气(He)(纯度99.999%),流速1.0 mL/min,分流比40∶1。程序升温条件:初始温度40 ℃,保留5 min,5 ℃/min升温至90 ℃,保留1 min,再以10 ℃/min升温至220 ℃,保留10 min。GC Isolink条件:燃烧管温度1 000 ℃,切入质谱时间100 s,270 s开启吹气阀以吹掉乙醇,400 s关闭吹气阀切入质谱,乙醛和乙酸乙酯参考气信号强度:1 500 mv,其他化合物参考气信号强度:3 000 mv。
稳定同位素质谱条件:电子电离(electronic ionization,EI)源,离子源电压2.97 kV,真空度1.6×10-6 mBar;电子能量120.8 eV。
1.3.2 稳定性同位素比率的计算
其计算公式为:
式中:R样品为所测样品中重同位素与轻同位素丰度比,即13C/12C;R标准为标准样品中重同位素与轻同位素丰度比。
1.3.3 数据处理
Thermo Electron Isodat version 3.0软件用于同位素比值的计算和数据获取。采用OriginPro 2019b绘图软件进行数据图绘制。
2 结果与分析
2.1 基于挥发性风味成分δ13C值检测的外源性酒精鉴别方法
对129批次威士忌中异丁醇、正丙醇、戊醇(包括异戊醇和活性戊醇)、乙酸乙酯、乙醛和乙醇这6种挥发性风味成分的δ13C值进行检测。 结果表明,威士忌中6种挥发性风味成分的δ13C值不同,正丙醇的平均δ13C值为-18.0‰,乙醇的平均δ13C为-23.4‰,异丁醇、戊醇和乙醛的δ13C值的平均δ13C值为-29.7‰~-27.0‰;乙酸乙酯的δ13C平均值为-31.67‰。由于玉米(C3植物)和不含玉米原料(主要是小麦等C4植物)所酿造威士忌中挥发性成分的δ13C存在显著差异,对含有玉米与不含有玉米原料威士忌的δ13C进行比较,结果见表1。
表1 不同原料威士忌挥发性风味成分的δ13C分布
Table 1 δ13C distribution of whisky with different ingredients‰

原料类型 化合物 正丙醇 异丁醇 戊醇 乙醛 乙酸乙酯 乙醇最小值最大值平均值标准偏差最小值最大值平均值标准偏差最小值最大值平均值标准偏差最小值最大值平均值标准偏差含玉米威士忌不含玉米威士忌苏格兰单一麦芽威士忌苏格兰调配威士忌-21.19-5.00-12.56 4.53-24.82-17.88-21.13 1.70-24.23-17.88-21.27 1.94-22.32-14.34-19.08 1.95-31.73-8.10-20.84 6.29-36.28-25.97-31.46 2.28-36.28-28.84-32.23 1.86-33.57-26.36-28.70 1.63-36.97-13.78-25.02 7.32-35.86-18.48-32.19 2.15-35.86-29.44-32.54 1.34-33.41-30.87-32.31 0.79-30.86-13.56-23.03 4.65-34.66-26.28-29.52 1.44-33.28-26.81-29.38 1.42-31.67-26.20-29.37 1.19-33.45-23.12-29.76 2.46-35.88-28.97-32.75 1.23-37.91-30.28-32.89 1.60-34.82-29.25-32.37 1.22-26.66-12.83-18.12 4.58-28.86-24.04-26.44 0.91-27.84-25.04-26.48 0.73-28.21-20.72-25.40 1.72
由表1可知,含玉米原料威士忌的乙醇δ13C值分布范围为-26.66‰~-12.83‰,不含玉米原料威士忌的乙醇δ13C值分布范围为-28.86‰~-24.04‰。所有样品中仅有一批爱尔兰威士忌,其原料只使用了玉米,乙醇δ13C值为-12.39‰。含玉米原料威士忌由于玉米比例不同,因此其挥发性风味成分δ13C值分布范围更广,δ13C值标准偏差范围为2.46‰~7.32‰;而不含玉米原料的威士忌,其标准偏差范围为0.91‰~2.28‰;苏格兰单一麦芽威士忌中乙醇δ13C值分布范围为-27.84‰~-25.04‰,标准偏差范围为0.73‰~1.94‰;而苏格兰调配威士忌(部分酒的原料中含有玉米)的乙醇δ13C值分布范围为-28.21‰~-20.72‰,标准偏差范围为0.79‰~1.95‰。总体而言,不含玉米原料威士忌的δ13C值比含有玉米原料的威士忌偏负,且不含玉米原料威士忌的δ13C值波动范围远小于后者。因此,若所检测威士忌的乙醇δ13C值超出相应威士忌类型乙醇δ13C值分布范围,则可能存在添加外源性酒精的情况。 由于正丙醇、异丁醇、戊醇、乙醛、乙酸乙酯是威士忌的主要挥发性风味成分,本文所有检测威士忌中均检出该5种挥发性风味成分的δ13C值。因此,若出现任何一种挥发性成分无法测定δ13C值的情况,说明含量极低,可以直接判定为假酒。
2.2 基于挥发性风味成分δ13C值拟合线性截距偏差范围的外源性酒精鉴别方法
对乙醇与正丙醇、异丁醇、乙醛、乙酸乙酯和戊醇这5种挥发性风味成分δ13C值的线性关系进行分析。结果见图1。由图1可知,乙醇与异丁醇、乙醛、正丙醇的δ13C值呈现较好的线性关系,相关系数(r2)分别为0.832、0.868和0.876。而乙醇与戊醇(r2=0.561),乙酸乙酯(r2=0.383)δ13C线性相对较差,这与文献[27]报道的结果相似。 在95%置信区间内,所有样本正丙醇、异丁醇、乙醛线性方程y轴截距的偏差(2倍标准偏差(SD))分别为3.63、5.54和3.57。

图1 威士忌中乙醇与异丁醇(a)、乙醛(b)、正丙醇(c)间δ13C值线性关系
Fig.1 Linear relationship of δ13C values between ethanol and isobutanol(a), acetaldehyde (b), n-propyl alcohol (c) in whisky
由于乙醇与正丙醇、异丁醇、乙醛的δ13C具有良好的线性关系。在95%置信区间内,真实酒类样本应该分布应该在两条虚线范围内。 因此,参考WU H等[30]所建立果汁掺糖检测方法,使用线性方程y轴截距的偏差范围(2倍SD值)作为威士忌掺伪的判定规则,以下公式任何一项不合格均可判定为掺伪:

式中:δ13C异丁醇、δ13C乙醇、δ13C正丙醇、δ13C乙醛分别为异丁醇、乙醇、正丙醇和乙醛的δ13C测定值。
2.3 实际威士忌样品的验证
以苏格兰单一麦芽威士忌(δ13C乙醇=-26.55‰)和美国威士忌(δ13C乙醇=-18.33‰)为样品,分别进行玉米酒精、C3植物源工业酒精的添加实验,酒精添加量为10%、20%、40%、60%,对其δ13C值进行检测,采用乙醇δ13C值范围判定酒精掺假结果见表2,截距的偏差范围判定酒精掺假结果见表3。 由表2可知,对于苏格兰单一麦芽而言,玉米酒精(δ13C乙醇=-11.76‰)掺入比例为40%时可被检测出,掺入C3源工业酒精(δ13C乙醇=-28.86‰)达到60%时才可检测出。而对于美国威士忌,由于含有玉米原料威士忌的碳稳定同位素范围太宽,使得无法正确判定出酒精的添加。 由于不同来源酒精的δ13C存在差异,若所加酒精与威士忌自身乙醇的δ13C相近,则无法实现鉴别。由表3可知,除了对于苏格兰单一麦芽威士忌掺C3源工业酒精没有鉴别出外(两者的碳稳定同位素比值差异极小),其余判定结果均更佳,对苏格兰单一麦芽威士忌可实现玉米酒精(δ13C乙醇=-11.76‰)掺入比例为20%时可被检测出,美国威士忌玉米酒精(δ13C乙醇=-11.76‰)掺入比例为40%时可被检测出,美国威士忌掺入C3源工业酒精(δ13C乙醇=-28.86‰)比例为40%时可被检测出。因此,可以将使用y轴截距的标准差范围判定法与乙醇的碳稳定同位素范围相结合应用于酒精的掺伪鉴别。
表2 乙醇δ13C值范围判定酒精掺假结果
Table 2 Determination of alcohol adulteration results based on the range of δ13C ethanol values‰
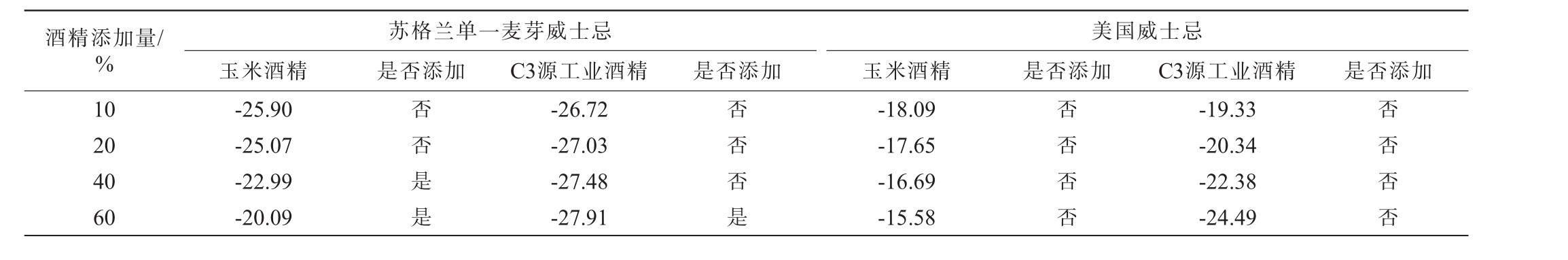
酒精添加量/%10 20 40 60苏格兰单一麦芽威士忌玉米酒精 是否添加 C3源工业酒精-25.90-25.07-22.99-20.09否否是是-26.72-27.03-27.48-27.91是否添加否否否是美国威士忌玉米酒精 是否添加 C3源工业酒精 是否添加-18.09-17.65-16.69-15.58否否否否-19.33-20.34-22.38-24.49否否否否
表3 截距偏差范围判定酒精掺假结果
Table 3 Determination of alcohol adulteration results using the deviation range of intercept‰
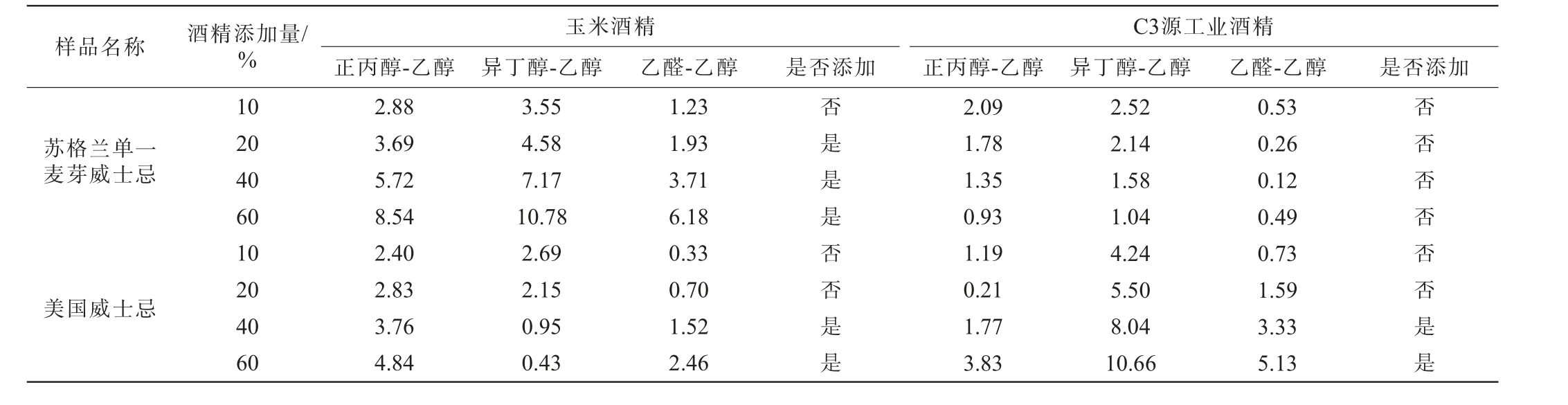
样品名称 酒精添加量/%玉米酒精正丙醇-乙醇 异丁醇-乙醇 乙醛-乙醇是否添加C3源工业酒精正丙醇-乙醇 异丁醇-乙醇 乙醛-乙醇 是否添加苏格兰单一麦芽威士忌美国威士忌10 20 40 60 10 20 40 60 2.88 3.69 5.72 8.54 2.40 2.83 3.76 4.84 3.55 4.58 7.17 10.78 2.69 2.15 0.95 0.43 1.23 1.93 3.71 6.18 0.33 0.70 1.52 2.46否是是是否否是是2.09 1.78 1.35 0.93 1.19 0.21 1.77 3.83 2.52 2.14 1.58 1.04 4.24 5.50 8.04 10.66 0.53 0.26 0.12 0.49 0.73 1.59 3.33 5.13否否否否否否是是
假冒威士忌样品挥发性成分的δ13C值见表4。 由表4可知,1#乙醇的δ13C值为-11.97‰,已经超出了含有玉米原料威士忌的最大限值(-12.83‰),更是远超出了苏格兰调配威士忌δ13C乙醇(-28.21‰~-20.72‰)的限值,说明这瓶酒的酒精显然并非自身发酵产生。2#、3#中乙醇的δ13C值为-20.43‰、-22.53‰,远比苏格兰单一麦芽威士忌的-25.04‰的最大限值偏正。因此,可以推断出均存在掺外源性酒精的情况。此外,1#正丙醇、异丁醇和乙醛的δ13C均未检出,这种情况说明其根本不是正常谷物发酵的酒,属于用酒精、色素与香精勾兑出来的假酒。对于2#、3#,正丙醇-乙醇线性方程的截距偏差计算结果分别为11.44‰和7.81‰,远超过限值3.63‰,因此也可判定存在掺伪。
表4 假冒威士忌样品挥发性成分的δ13C值
Table 4 δ13C value of volatile components in fake whisky‰
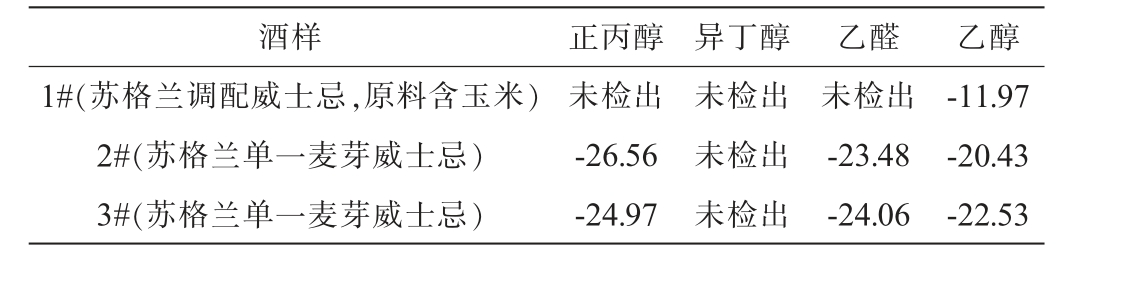
酒样 正丙醇 异丁醇 乙醛 乙醇1#(苏格兰调配威士忌,原料含玉米)2#(苏格兰单一麦芽威士忌)3#(苏格兰单一麦芽威士忌)未检出-26.56-24.97未检出未检出未检出未检出-23.48-24.06-11.97-20.43-22.53
3 结论
基于乙醇的δ13C分布范围判别掺伪。其中,苏格兰单一麦芽威士忌中乙醇的δ13C范围为-27.84‰~-25.04‰,苏格兰调配威士忌中乙醇的δ13C范围为-28.21‰~-20.72‰,含有玉米原料威士忌中乙醇的δ13C范围为-26.66‰~-12.83‰,不含玉米原料威士忌中乙醇的δ13C范围为-28.86‰~-24.04‰。基于拟合线性截距偏差范围(2倍SD值)判别掺伪,威士忌中乙醇与正丙醇、异丁醇、乙醛的δ13C值呈现较好的线性关系,相关系数(R2)分别为0.876、0.832和0.868。酒精添加实验表明,基于拟合线性截距偏差范围的外源性酒精判别方法,除了对于苏格兰单一麦芽威士忌掺C3源工业酒精的判别效果不如乙醇δ13C值分布范围判别方法外,其余判别结果均更佳。综合分析,利用拟合线性的截距偏差范围与乙醇的δ13C分布范围相结合,能实现灵敏鉴别威士忌外源性酒精的目的。本研究表明,稳定同位素技术对于威士忌外源性酒精鉴别具有良好的效果。
[1]WINIEWSKA P,DYMERSKI T,WARDENCKI W,et al.Chemical composition analysis and authentication of whisky[J].J Sci Food Agr,2015,95(11):2159-2166.
[2]张德芹,朱晓春,李拂晓,等.苏格兰不同品牌麦芽威士忌挥发性风味成分分析[J].酿酒科技,2023(6):77-83.
[3]MIGNANI A G, CIACCHERI L, GORDILLO B, et al.Identifying the production region of single-malt Scotch whiskies using optical spectroscopy and pattern recognition techniques[J].Sens Actuators B Chem,2012,171-172:458-462.
[4]NASCIMENTO H D,SILVA M Z F D,ALEXANDRE J B,et al.Chemometric tools associated to chromatographic data to assess the quality and authenticity whiskeys[J].Microchem J,2023,189:108542.
[5]ATLOTT R.Chapter 16.Analytical strategies supporting protected designations of origin for alcoholic beverages[J].Compr Anal Chem, 2013,60:409-438.
[6]ANGELICA R M,MARCIO T,MAURICIO L V,et al.Discrimination of whisky brands and counterfeit identification by UV-Vis spectroscopy and multivariate data analysis[J].Food Chem,2017,229:142-151.
[7]MACKENZIE W M,AYLOTT R I,MACKENZIE W M,et al.Analytical strategies to confirm Scotch whisky authenticity.Part II: Mobile brand authentication[J].Analyst,2004,129(7):607-612.
[8]KIEFER J,CROMWELL A L.Analysis of single malt Scotch whisky using Raman spectroscopy[J].Anal Methods,2017,9(3):511-518.
[9]ELLIS D I, ECCLES R, XU Y, et al.Through-container, extremely low concentration detection of multiple chemical markers of counterfeit alcohol using a handheld SORS device[J].Sci Report,2017,7(1):12082.
[10]KUIPERS J.Authentication of Scotch Whisky by GC analysis using an Agilent J&W CP-Wax 57 CB basic column[Z].Agilent Technologies,2010-10-08.
[11]HEINZ H A,ELKINS J T.Comparison of unaged and barrel aged whiskies from the same Mash Bill using gas chromatography/mass spectrometry[J].Acad J,2019,8(1):1-6.
[12]MICJAL S, IAN G, MONIKA T, et al.A novel approach to assess the quality and authenticity of Scotch Whisky based on gas chromatography coupled to high resolution mass spectrometry[J].Anal Chim Acta,2018,1042:60-70.
[13]XU R,CHEN L,ZHANG H,et al.Characterizing bourbon whiskey via the combination of LC-MS and GC-MS based molecular fingerprinting[J].Food Chem,2023,423:136311.
[14]GAO F,HAO X,ZENG G,et al.Identification of the geographical origin of Ecolly(Vitis vinifera L.)grapes and wines from different Chinese regions by ICP-MS coupled with chemometrics[J].J Food Compos Anal,2022,105:105.
[15]WU H,TIAN L,CHEN B,et al.Verication of imported red wine origin into China using multi isotope and elemental analyses[J].Food Chem,2019,301:125137.
[16]PAWLACZYK A,GAJEK M,JOZWIK K,et al.Multielemental analysis of various kinds of whisky[J].Molecules,2019,24:1193.
[17]ADAM T, DUTHIE E, FELDMANN J.Investigations into the use of copper and other metals as indicators for the authenticity of scotch whiskies[J].J I Brewing,2002,108(4):459-464.
[18]杨华瑞,严虞虞,彭祖茂,等.乙醇C、O、H稳定同位素在白酒掺伪鉴别中的潜在差异分析[J].酿酒科技,2024(3):118-122.
[19]LI C L,KANG X M,NIE J,et al.Recent advances in Chinese food authentication and origin verification using isotope ratio mass spectrometry[J].Food Chem,2023,398:133896.
[20]SU Y Y,ZHANG J C,WANG L H,et al.Assessing geographical origin of Diqing wines based on their elemental and isotopic profiles[J].J Food Compos Anal,2024,125:105671.
[21]COELHO I,MATOS A S,EPOVA E N,et al.Multi-element and multiisotopic profiles of Port and Douro wines as tracers for authenticity[J].J Food Compos Anal,2023,115:104988.
[22]AKAMATSU F, SHIMIZU H, HAYASHI S, et al.Chemometric approaches for determining the geographical origin of Japanese Chardonnay wines using oxygen stable isotope and multi-element analyses[J].Food Chem,2022,371:131113.
[23]WU H,LIN G H,TIAN L,et al.Origin verification of French red wines using isotope and elemental analyses coupled with chemometrics[J].Food Chem,2020,339:127760.
[24]SU Y Y,GAO J,WEN Z S, et al.Geographical origin classification of Chinese wines based on carbon and oxygen stable isotopes and elemental profiles[J].J Food Protect,2020,83(8):1323-1334.
[25]李信萍,刘亚新,齐鹏宇,等.基于稳定同位素的葡萄酒掺糖鉴别技术研究进展[J].中外葡萄与葡萄酒,2022(6):96-103.
[26]PARKER I G,KELLY S D,SHARMAN M.Investigation into the use of carbon isotope ratios(13C/12C)of Scotch whisky congeners to establish brand authenticity using gas chromatography-combustion-isotope ratio mass spectrometry[J].Food Chem,1998,63(3):423-428.
[27]RHODES C N, HEATON K, GOODALL I, et al.Gas chromatography carbon isotope ratio mass spectrometry applied to the detection of neutral alcohol in Scotch whisky:an internal reference approach[J].Food Chem,2009,114(2):697-701.
[28]MEIER-AUGENSTEIN W,KEMP H F,HARDIE S M L.Detection of counterfeit scotch whisky by 2H and 18O stable isotope analysis[J].Food Chem,2012,133(3):1070-1074.
[29]KYRALEOU M,HERB D,REILLY G O,et al.The impact of terroir on the flavour of single malt whiskey new make spirit[J].Foods,2021,10(2):443.
[30]WU H, ZHOU X W, CHEN H Q, et al.A comparative authentication study of fresh fruit and vegetable juices using whole juice and sugarspecific stable isotopes[J].Food Chem,2021,373:131535.