黑果腺肋花楸(black chokeberry),又名野樱莓、黑苦莓等,是一种外观黑紫色且口感酸涩的小浆果,富含有机酸、氨基酸、维生素等营养成分和多酚、黄酮、花青素等活性物质,具有抗氧化、抗衰老、抗炎抑菌等多种生理功效[1-3]。黑果腺肋花楸的抗氧化指数高达160.62 μmol/g,素有“不老莓”之称[3-4]。然而,黑果腺肋花楸及其加工产品具有酸、苦和涩等不良感官特征,严重制约了其开发和深加工的价值。
乳酸菌发酵饮料以乳制品、果汁和谷物等为原料,经过乳酸菌发酵,产生独特的酸味、丰富的风味及特定的生物活性成分[5-6]。该类饮品有助于调节肠道稳态、提升食品的营养价值,并增强其保健功能[7]。XU H Y等[8]研究发现,接种乳酸菌发酵柑橘汁可使总黄酮和多酚的含量分别提高47.29%、60.71%,并提升抗氧化活性。 赵晓彤[2]研究发现,接种植物乳植杆菌和鼠李糖乳杆菌发酵黑果腺肋花楸,均能增加总黄酮含量(45.48%和44.19%)和多酚含量(53.90%和51.82%),并改善其苦涩口感。KWAW E等[9]接种乳酸菌发酵桑葚汁能改善果汁色泽、提高多酚含量和增强抗氧化活性。然而,不同乳酸菌的发酵特性可能存在差异,不同乳酸菌发酵黑果腺肋花楸汁的研究还鲜有报道。
本研究以黑果腺肋花楸汁为原料,接种6种乳酸菌(植物乳植杆菌、嗜酸乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、罗伊氏乳杆菌、副干酪乳杆菌)发酵,比较发酵后乳酸菌生物量、理化指标、色泽、生物活性物质及体外抗氧化活性的差异,并对其品质指标进行相关性分析,研究不同乳酸菌对黑果腺肋花楸汁发酵的影响,旨在筛选出适合黑果腺肋花楸发酵的乳酸菌,为开发黑果腺肋花楸高附加值产品提供有效方法。
1 材料与方法
1.1 材料与试剂
黑果腺肋花楸:产地辽宁;植物乳植杆菌(Lactiplantibacillus plantarum)LP-G18、嗜酸乳杆菌(Lactobacillus acidophilus)LA-G80、干酪乳杆菌(Lactobacillus casei)LC-G11、鼠李糖乳杆菌(Lactobacillus rhamnosus)LR-G14:上海润盈生物工程有限公司;罗伊氏乳杆菌(Lactobacillus reuteri)JYLB-291、副干酪乳杆菌(Lactobacillus paracasei)JLPF-176:山东中科嘉亿生物工程有限公司。
MRS培养基:中山市百微生物技术有限公司;氢氧化钠、浓盐酸、葡萄糖、3,5-二硝基水杨酸、酒石酸钾纳、亚硫酸钠、碳酸钠、硝酸铝、福林酚等(分析纯):国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、花青素鼠李葡糖苷、芦丁、丁香酸、绿原酸、肉桂酸(纯度均>98%):上海阿拉丁试剂有限公司;果胶酶(50 000 U/g)、纤维素酶(40 000 U/g):江苏源盛通生物工程有限公司。
1.2 仪器与设备
SW-CJ-2D型超净工作台:苏州净化设备有限公司;MF1085C型电子分析天平:山东欧莱博仪器有限公司;FE28型pH计:瑞士梅特勒托利多公司;LRH-150型恒温生化培养箱:上海一恒科学仪器有限公司;WF28型色差仪:深圳威福光电科技有限公司;755B型紫外可见分光光度计:上海菁华科技仪器有限公司;1260型高效液相色谱仪:美国安捷伦科技公司。
1.3 方法
1.3.1 发酵黑果腺肋花楸汁的加工工艺流程及操作要点
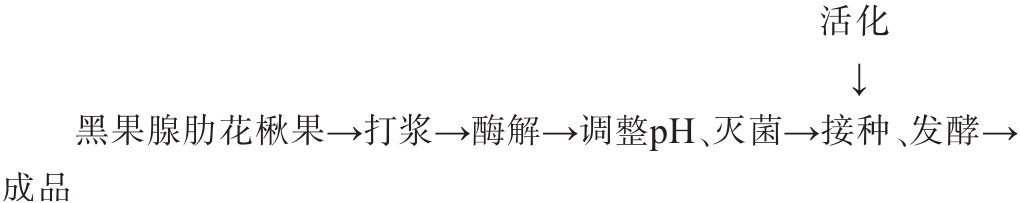
黑果腺肋花楸果汁的制备:挑选无腐烂、无霉变的黑果腺肋花楸果,热水滚烫3~5 s,打浆,加入分别加入0.03%果胶酶(50 000 U/g)和0.03%纤维素酶(40 000 U/g),搅拌均匀,40 ℃酶解4~6 h,沸水浴5 min除酶,冷却至室温后400目滤布过滤,得到澄清的黑果腺肋花楸汁,用NaOH调至pH为5.66±0.10,75 ℃灭菌20 min,冷却至35 ℃后装入1 L无菌发酵瓶。
乳酸菌菌悬液制备:不同乳酸菌菌粉用40 ℃温水活化20 min,接入无菌MRS液体培养基进行培养,置于37 ℃恒温培养18 h,传代2次后,6 000 r/min离心15 min,弃去上清,无菌生理盐水重悬菌体,制备活菌数为108 CFU/mL的菌悬液,4 ℃储存,待用[10]。
接种、发酵:以不接种的黑果腺肋花楸汁作为对照(CK),分别接种植物乳植杆菌LP-G18、嗜酸乳杆菌LA-G80、干酪乳杆菌LC-G11、鼠李糖乳杆菌LR-G14、罗伊氏乳杆菌JYLB-291和副干酪乳杆菌JLPF-176菌悬液,接种量为1%(V/V),样品编号分别为L.pla、L.aci、L.cas、L.rha、L.reu和L.par,盖紧瓶盖,置于37 ℃恒温发酵48 h,还原糖剩余量在48 h内保持恒定发酵结束,即得发酵黑果腺肋花楸汁样品。
1.3.2 理化及微生物指标分析
乳酸菌活菌数测定:参照GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》;pH值测定:参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》;总酸含量测定:参照GB 12456—2021《食品安全国家标准食品中总酸的测定》;还原糖含量测定:参照GB5009.7—2016《食品安全国家标准 食品中还原糖的测定》;可溶性固形物含量测定:参照GB/T 12143—2008《饮料通用分析方法》;颜色参数测定:采用色差仪。
1.3.3 生物活性物质分析
总黄酮的测定:采用亚硝酸钠-硝酸铝法[8],以芦丁当量表示样品总黄酮含量[7]。 总多酚测定:采用福林酚法[11],以没食子酸当量表示样品总多酚含量[11]。总花色苷含量测定:采用pH示差法,以矢车菊素-3-O-葡萄糖苷当量表示样品总花色苷含量[12]。
芦丁含量测定:参照GB/T 19427—2022《蜂胶中12种酚类化合物含量的测定液相色谱-串联质谱法和液相色谱法》;丁香酸、肉桂酸含量测定:参照NY/T 2012—2011《水果及制品中游离酚酸含量的测定》测定;花青素鼠李葡糖苷含量测定:参照SN/T 4675.11—2016《出口葡萄酒中7种花色苷的测定超高效液相色谱法》;绿原酸含量测定:参照GB/T 43733—2024《植物中绿原酸类物质的测定高效液相色谱法》。
1.3.4 抗氧化活性分析
(1)DPPH自由基清除率的测定
参照王晶等[5]的方法测定DPPH自由基清除率,并稍作修改,具体如下:吸取2 mL样品,加入3 mL DPPH甲醇溶液(0.1 mmol/L),混匀后黑暗下反应30 min,在波长510 nm处测定吸光度值,分别以甲醇和去离子水代替样品作为阳性对照和空白对照[5]。DPPH自由基清除率计算公式如下:
式中:A1、A2和A3分别为样品、对照和空白的吸光度值[5]。
(2)羟自由基清除率的测定
参照宋运霞[10]的方法测定羟自由基清除率,并稍作修改,具体如下:吸取200 μL样品,依次加入0.3 mL FeSO4溶液(9 mmol/L)、0.3 mL水杨酸乙醇溶液(9 mmol/L)和0.3 mL H2O2溶液(8.8 mmol/L),用蒸馏水补充至5 mL,混匀后37 ℃反应15 min,在波长510 nm处测定吸光度值,以纯水作为空白对照,不加过氧化氢作为阳性对照[9]。 羟自由基清除率计算公式如下:
式中:A1、A2和A3分别为样品、对照和空白的吸光度值[9]。
(3)还原力的测定
参照LI J等[13]的方法测定还原力,并稍作修改,具体如下:吸取1 mL样品,加入磷酸盐缓冲液(0.2 mol/L,pH 7.4)和1 mL K3[Fe(CN)6]溶液(30 mmol/L),37 ℃黑暗下反应20min,加入1mLC2HCl3O2溶液(0.6mol/L),混匀后4000r/min离心15min,收集2.5mL上清液与1.2mLFeCl3溶液(6mmol/L)混合,加入2.5 mL去离子水,在700 nm处测定吸光度值,以FeSO4摩尔当量表示样品还原力[13]。
1.3.5 数据处理
所有实验均重复3次,结果以“平均值±标准偏差”表示。采用GraphPad Prism 9.3软件进行图形绘制。利用SPSS 23.0软件进行相关性分析和方差分析(ANOVA),P<0.05表示各组之间差异显著。
2 结果与分析
2.1 不同乳酸菌发酵对黑果腺肋花楸汁乳酸菌数量的影响
不同乳酸菌发酵对黑果腺肋花楸汁乳酸菌数的影响见图1。
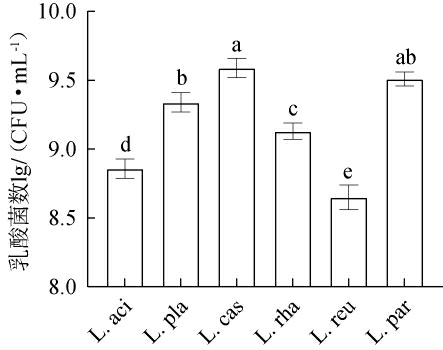
图1 不同乳酸菌发酵对黑果腺肋花楸汁乳酸菌数的影响
Fig.1 Effects of different lactic acid bacteria fermentation on the number of lactic acid bacteria of black chokeberry juice
不同小写字母表示差异显著(P<0.05),下同。
由图1可知,与初始乳酸菌接种量(6.00 lg CFU/mL)相比,6株乳酸菌在黑果腺肋花楸汁中发酵48 h后均呈现增殖现象,乳酸菌数均高于8.50 lg CFU/mL。 表明黑果腺肋花楸汁作为乳酸菌发酵底物有利于乳酸菌的生长繁殖。发酵后,L.cas组乳酸菌数最高,可达9.59 lg CFU/mL,除与L.par组无显著差异(P>0.05)外,显著高于其他乳酸菌发酵组(P<0.05)。表明干酪乳杆菌和副干酪乳杆菌作为常用的果蔬发酵乳酸菌,其生长性能优越,增殖速率快,同样也适用于黑果腺肋花楸汁发酵[14]。L.pla组、L.rha组和L.aci组的乳酸菌数分别为9.34 lg CFU/mL、9.13 lg CFU/mL和8.86lgCFU/mL。此外,L.reu组生物量最低,仅为8.65lgCFU/mL,显著低于其他乳酸菌发酵组(P<0.05)。这是由于罗伊氏乳杆菌是肠道共生菌群的重要成员,其最适生长pH为6.8~7.6,导致在酸性发酵环境的生长速率下降,增殖数量不如其他菌株[15]。 综上,不同乳酸菌均能在黑果腺肋花楸发酵环境中生长繁殖,但生长速率差异较大。
2.2 不同乳酸菌发酵对黑果腺肋花楸汁理化指标的影响
2.2.1 pH及总酸
不同乳酸菌发酵对黑果腺肋花楸汁pH和总酸含量的影响见图2。
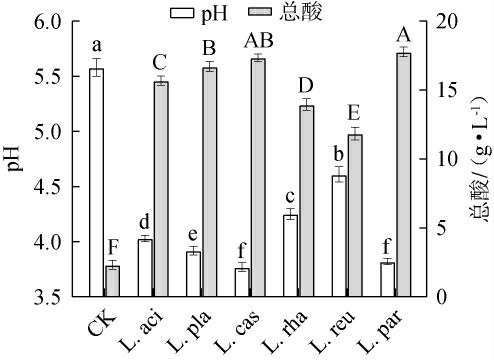
图2 不同乳酸菌发酵对黑果腺肋花楸汁pH和总酸含量的影响
Fig.2 Effects of different lactic acid bacteria fermentation on pH and total acid contents of black chokeberry juice
不同大写(小写)字母表示差异显著(P<0.05)。下同。
由图2可知,对照组的pH值最高(5.58),与黑果腺肋花楸汁初始pH无显著差异(P>0.05),显著高于各乳酸菌发酵组(P<0.05),这与WANG J等[16]研究结果相一致,表明乳酸菌发酵过程中会产生乳酸等酸类物质导致pH值下降。L.cas组和L.par组的pH值分别为3.78和3.81,两组之间无显著差异(P>0.05),显著低于其他乳酸菌发酵组(P<0.05),表明干酪乳杆菌和副干酪乳杆菌的产酸能力优于其他乳酸菌。此外,与对照相比,乳酸菌发酵黑果腺肋花楸汁的总酸含量显著增加(P<0.05),其中L.par组的总酸含量最高,可达17.78 g/L,其次分别为L.cas组和L.pla组,其总酸含量分别为17.35 g/L和16.71 g/L,显著高于其他乳酸菌发酵组(P<0.05)。干酪乳杆菌、副干酪乳杆菌和植物乳植杆菌均是同型发酵乳酸菌,发酵产物主要是乳酸[17]。 乳酸菌发酵过程中pH和总酸的变化与有机酸浓度密切相关[18]。有机酸种类与产量的差异取决于乳酸菌菌株的不同,这解释了本研究中观察到的pH和总酸差异[19]。因此,不同乳酸菌的产酸能力存在一定的差异。
2.2.2 还原糖及可溶性固形物含量
还原糖是黑果腺肋花楸汁中必需的营养物质,也是乳酸菌生长和代谢所需的碳源。由图3可知,对照组中还原糖含量最高,可达43.74 g/L,而接种不同乳酸菌发酵的黑果腺肋花楸汁中还原糖含量显著降低(P<0.05),这与WANG J等[20]研究结果相一致,表明乳酸菌的生长繁殖和酸类物质转化需要消耗大量碳源,导致乳酸菌发酵后还原糖含量下降。 发酵后,L.pla组、L.cas组和L.par组的还原糖含量分别为9.43 g/L、10.07 g/L和9.64 g/L,显著低于其他乳酸菌发酵组(P<0.05),这一结果与图2中pH和总酸含量的结果相一致,干酪乳杆菌、副干酪乳杆菌和植物乳植杆菌通过糖酵解途径将还原糖代谢转化为乳酸。此外,可溶性固形物与发酵品质密切相关,有助于增强发酵产品的口感和品质[16]。对照组中可溶性固形物含量最高,为15.72°Bx,而各乳酸菌发酵的黑果腺肋花楸汁中可溶性固形物含量显著降低(P<0.05),范围为9.52~11.40°Bx,这与WANG J等[16]研究结果相一致,乳酸菌在发酵初期可迅速利用还原糖生长繁殖,并伴随着可溶性固形物含量快速下降,随后缓慢降低。然而本研究观察到的可溶性固形物含量略低于WANG J等[16]报道的乳酸菌发酵黑果腺肋花楸后可溶性固形物含量范围(10.46~12.13 °Bx),造成差异的原因可能是由于不同乳酸菌生长速率、还原糖利用率及产酸速率的不同而导致的差异。 综上,不同乳酸菌的生长代谢差异导致黑果腺肋花楸汁发酵后理化指标特征存在差别。

图3 不同乳酸菌发酵对黑果腺肋花楸汁还原糖和可溶性固形物含量的影响
Fig.3 Effects of different lactic acid bacteria fermentation on the contents of reducing sugar and soluble solid of black chokeberry juice
2.3 不同乳酸菌发酵对颜色参数的影响
L*值(明度)表示颜色的亮度,a*值(红绿色度)表示颜色在红绿轴上的位置,正值偏向红色,负值偏向绿色;b*值(黄蓝色度)表示颜色在黄蓝轴上的位置,正值偏向黄色,负值偏向蓝色。不同乳酸菌发酵对黑果腺肋花楸汁颜色参数的影响见表1。 由表1可知,对照组的L*值、a*值和b*值分别为0.77、3.92和1.55,与各乳酸菌发酵组相比差异显著(P<0.05),表明乳酸菌发酵改变了黑果腺肋花楸汁颜色。发酵48 h后,与对照组相比,乳酸菌发酵能显著提升黑果腺肋花楸汁的L*、a*和b*值(P<0.05),其L*、a*和b*值范围分别为1.23~1.42、5.94~7.01和2.02~2.60,这与WANG J等[16]研究结果相一致,说明乳酸菌发酵有利于改善黑果腺肋花楸汁色泽,使其颜色更偏向红黄色,并提升亮度。此外,利用总色差(ΔE)综合评价接种与未接种乳酸菌的色泽差异。 乳酸菌发酵导致ΔE发生变化。 L.aci组和L.rha组的ΔE分别为3.18和2.83,显著高于其他乳酸菌发酵组(P<0.05),造成差异的原因是由于嗜酸乳杆菌和鼠李糖乳杆菌发酵对黑果腺肋花楸的b*值提升较大,影响发酵后总色差,导致颜色变化较大。一般来说,ΔE(≥2)被认为是发生了显著颜色变化,引起色泽差异[21]。6株乳酸菌发酵组的ΔE均>2,表明乳酸菌发酵会显著影响消费者对黑果腺肋花楸汁的感官评价,可能是由于乳酸菌通过自身产生的催化酶与空气的协同作用共同促进果汁发生颜色变化[21]。此外,浆果中某些具有颜色的天然化合物含量的变化也会造成颜色变化[14]。 综上,乳酸菌发酵可以改善黑果腺肋花楸汁色泽,但不同菌株之间存在差异。
表1 不同乳酸菌发酵对黑果腺肋花楸汁颜色参数的影响
Table 1 Effects of different lactic acid bacteria fermentation on color parameter of black chokeberry juice
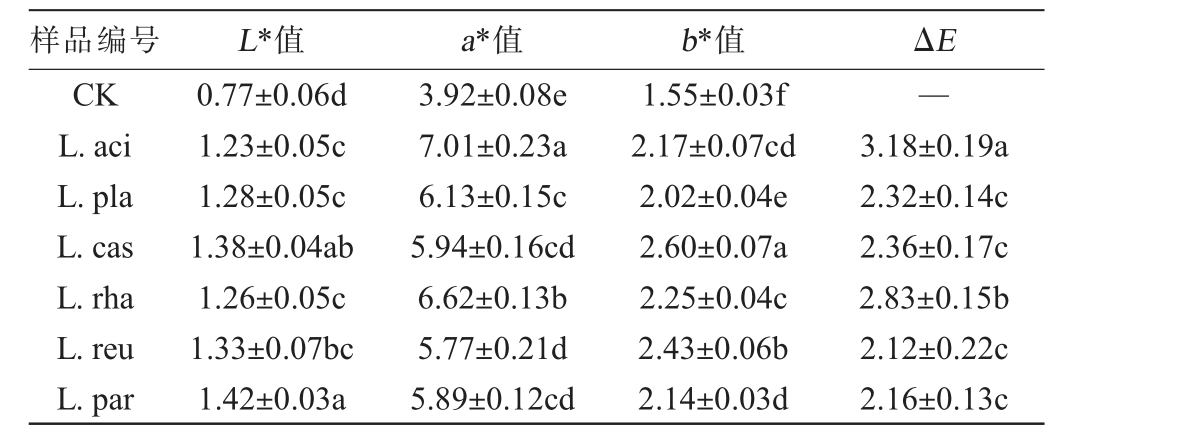
注:同列不同小写字母表示差异显著(P<0.05)。下同。
样品编号 L*值 a*值 b*值 ΔE CK L.aci L.pla L.cas L.rha L.reu L.par 0.77±0.06d 1.23±0.05c 1.28±0.05c 1.38±0.04ab 1.26±0.05c 1.33±0.07bc 1.42±0.03a 3.92±0.08e 7.01±0.23a 6.13±0.15c 5.94±0.16cd 6.62±0.13b 5.77±0.21d 5.89±0.12cd 1.55±0.03f 2.17±0.07cd 2.02±0.04e 2.60±0.07a 2.25±0.04c 2.43±0.06b 2.14±0.03d—3.18±0.19a 2.32±0.14c 2.36±0.17c 2.83±0.15b 2.12±0.22c 2.16±0.13c
2.4 不同乳酸菌发酵对黑果腺肋花楸汁生物活性物质的影响
2.4.1 黄酮类化合物
黄酮类化合物以C6-C3-C6为核心骨架构成的一类天然有机化合物,广泛存在于浆果原料中,具有多种生物活性[21]。不同乳酸菌发酵对黑果腺肋花楸汁中总黄酮含量的影响见图4。由图4可知,对照组中总黄酮含量仅为0.34 g/L,L.aci组、L.pla组、L.cas组、L.rha组、L.reu组和L.par组中总黄酮含量显著高于对照组(P<0.05),其分别提高了85.29%、97.06%、58.82%、52.94%、29.41%和73.53%。其中,L.pla组提高效果最佳,与WANG Z等[22]研究结果相一致,表明乳酸菌发酵能显著提高黑果腺肋花楸汁中总黄酮含量。乳酸菌生长代谢过程中会产生各种不同功效的酶,这些酶能降解浆果细胞壁中纤维素和半纤维素,使得黄酮类化合物更容易被释放,并溶解于发酵果汁中,进而增加果汁的总黄酮含量[23]。因此,乳酸菌发酵可以提高黑果腺肋花楸汁的总黄酮含量,但不同菌株之间存在显著差异(P<0.05)。
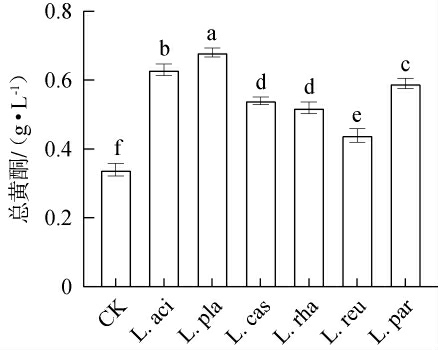
图4 不同乳酸菌发酵对黑果腺肋花楸汁中总黄酮含量的影响
Fig.4 Effects of different lactic acid bacteria fermentation on total flavonoids content of black chokeberry juice
2.4.2 总多酚类化合物
多酚类化合物也是一类具有特殊生物活性的化合物,不仅可影响产品品质,还能影响产品颜色及滋味[10]。 不同乳酸菌发酵对黑果腺肋花楸汁中总多酚含量的影响见图5。由图5可知,发酵48 h后,对照组中总多酚含量最低,仅为1.15 g/L,而L.aci组、L.pla组、L.cas组、L.rha组、L.reu组和L.par组中总多酚含量显著高于对照组(P<0.05),分别提高了66.09%、79.13%、86.96%、92.17%、53.04%和72.17%。其中,L.rha组提高最佳,这一结果与王储炎等[14]研究结果相一致,表明乳酸菌发酵有利于黑果腺肋花楸汁中多酚类化合物的积累。发酵后果汁中较高的总多酚含量可能是由于乳酸菌代谢加速了酶的活性,将复杂的结合态植物化学物质水解成游离形式[24]。不同乳酸菌菌株间总黄酮和总多酚含量的差异可归因于菌株的不同代谢能力及产生水解酶的活性差别[14]。 因此,不同乳酸菌的产酶及代谢差异导致黑果腺肋花楸汁发酵后总多酚含量存在差别。
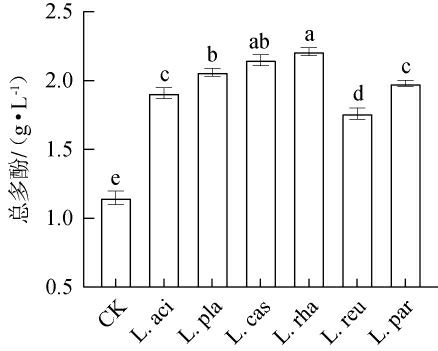
图5 不同乳酸菌发酵对黑果腺肋花楸汁中总多酚含量的影响
Fig.5 Effects of different lactic acid bacteria fermentation on total polyphenol content of black chokeberry juice
2.4.3 总花色苷
花色苷为浆果中广泛分布的一种水溶性色素,除赋予浆果鲜艳的色泽外,还具有抗氧化、抗炎和预防慢性病等生物活性功效[14]。不同乳酸菌发酵对黑果腺肋花楸汁中总花色苷含量的影响见图6。由图6可知,对照组中总花色苷含量为1.06 g/L,而乳酸菌发酵黑果腺肋花楸汁后会造成总花色苷含量降低,显著低于对照组(P<0.05),下降范围为17.92%~46.23%。 其中,L.reu组的保护效果最优,这一结果与LI S J等[25]研究结果相一致,表明乳酸菌发酵会促进花色苷的转化和分解。花色苷的不稳定性和微生物的吸附作用可能是导致乳酸菌发酵后花色苷含量减少的原因[25]。因此,不同乳酸菌发酵对黑果腺肋花楸汁花色苷的保护存在差异。
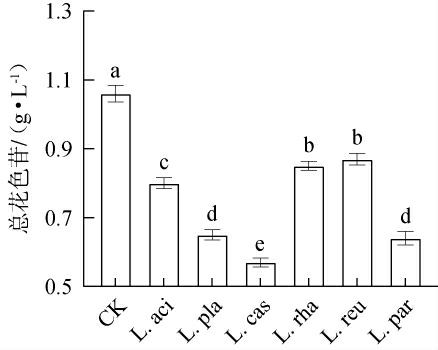
图6 不同乳酸菌发酵对黑果腺肋花楸汁中总花色苷含量的影响
Fig.6 Effects of different lactic acid bacteria fermentation on total anthocyanin content of black chokeberry juice
2.4.4 主要黄酮、多酚和花色苷类化合物
进一步比较不同乳酸菌发酵后黑果腺肋花楸汁中花青素鼠李葡糖苷、芦丁、丁香酸、绿原酸和肉桂酸含量的差异,结果见表2。
表2 不同乳酸菌发酵对黑果腺肋花楸汁中主要黄酮、酚类和花色苷类化合物的影响
Table 2 Effects of different lactic acid bacteria fermentation on main flavonoids, phenols and anthocyanins of black chokeberry juice
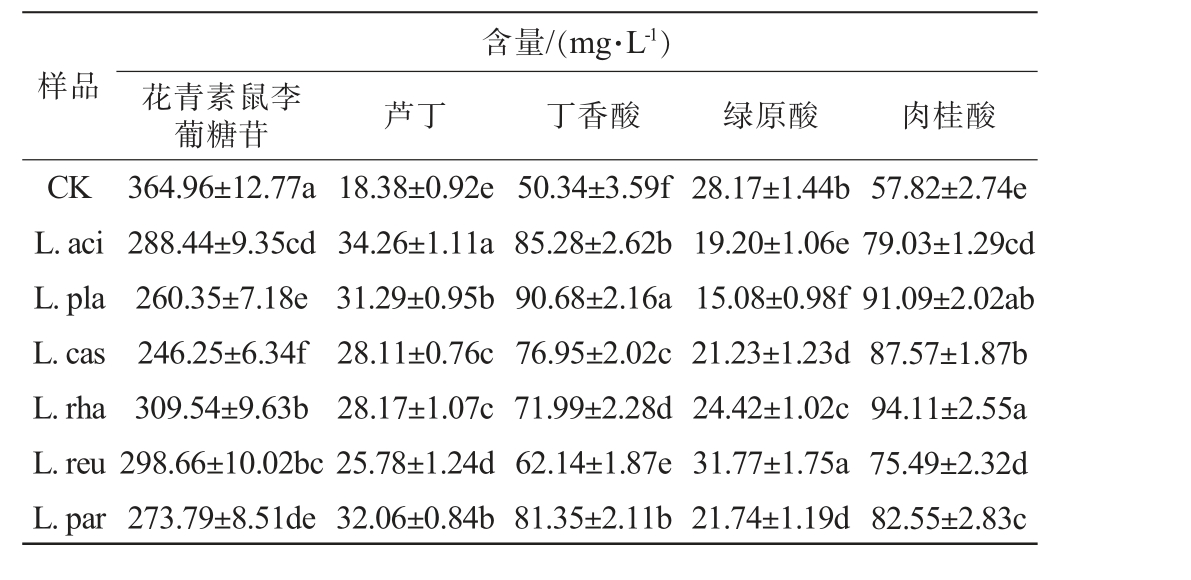
样品含量/(mg·L-1)花青素鼠李葡糖苷 芦丁 丁香酸 绿原酸 肉桂酸CK L.aci L.pla L.cas L.rha L.reu L.par 364.96±12.77a 288.44±9.35cd 260.35±7.18e 246.25±6.34f 309.54±9.63b 298.66±10.02bc 273.79±8.51de 18.38±0.92e 34.26±1.11a 31.29±0.95b 28.11±0.76c 28.17±1.07c 25.78±1.24d 32.06±0.84b 50.34±3.59f 85.28±2.62b 90.68±2.16a 76.95±2.02c 71.99±2.28d 62.14±1.87e 81.35±2.11b 28.17±1.44b 19.20±1.06e 15.08±0.98f 21.23±1.23d 24.42±1.02c 31.77±1.75a 21.74±1.19d 57.82±2.74e 79.03±1.29cd 91.09±2.02ab 87.57±1.87b 94.11±2.55a 75.49±2.32d 82.55±2.83c
由表2可知,对照组中花青素鼠李葡糖苷、芦丁、丁香酸、绿原酸和肉桂酸含量分别为364.96 mg/L、18.38 mg/L、50.34 mg/L、28.17 mg/L和57.82 mg/L。发酵后,L.aci组、L.pla组、L.cas组、L.rha组、L.reu组和L.par组中花青素鼠李葡糖苷含量显著低于对照组(P<0.05),分别降低了20.97%、28.66%、32.53%、15.18%、18.17%和24.98%;L.aci组和L.par组中芦丁含量分别为34.26 mg/L和32.06 mg/L,显著高于其他乳酸菌发酵组(P<0.05),与对照组相比,分别提高了86.40%和74.43%。 乳酸菌发酵后,黑果腺肋花楸汁中丁香酸和肉桂酸含量均显著高于对照组(P<0.05),提高范围分别为23.44%~80.14%和30.56%~62.76%。与对照相比,仅罗伊氏乳杆菌发酵的黑果腺肋花楸汁绿原酸含量增加,其他菌株发酵黑果腺肋花楸汁绿原酸含量显著下降(P<0.05)。由于不同乳酸菌代谢能力及产酶特性的不同而引起的差异。然而本研究观察到的花青素鼠李葡糖苷、芦丁、丁香酸、绿原酸和肉桂酸含量与CHEN M Y等[26]研究结果存在一定的差异,可能是果实品质、种植环境和加工工艺等因素造成的差异。 综上,乳酸菌发酵有利于提高黑果腺肋花楸汁中黄酮和多酚类化合物含量,但不同菌株之间差异明显。
2.5 不同乳酸菌发酵对黑果腺肋花楸汁体外抗氧化活性的影响
酚类化合物可以通过转移氢原子或电子给自由基,从而具有较好的抗氧化活性[24]。不同乳酸菌发酵对黑果腺肋花楸汁中体外抗氧化活性的影响见图7。 由图7可知,对照组的DPPH自由基清除率、羟自由基清除率和还原力分别为55.73%、67.49%和1.21 mmol/L,乳酸菌发酵显著提高了黑果腺肋花楸的DPPH自由基清除能力、羟自由基清除能力和还原力(P<0.05),其DPPH自由基清除率、羟自由基清除能力和还原力的范围分别为75.39%~93.04%、78.05%~91.52%和1.49~1.75 mmol/L。综合来看,菌株L.rha、L.cas、L.par的抗氧化活性较佳。 乳酸菌发酵过程可以提高具有质子供体特性的酚类化合物的生物利用度[13]。此外,酚类物质中碱性糖基、酸性羟基和酚类羟基的数量与体外抗氧化活性有关[9]。由于不同乳酸菌产生超氧化物歧化酶等抗氧化酶的能力不同,造成清除发酵产生的自由基水平差异[10]。乳酸菌在发酵期间会代谢产生丁酸盐、谷胱甘肽和叶酸等具有抗氧化活性的小分子化合物,有利于促进高价离子还原及阻止氧化应激[10]。因此,乳酸菌发酵可提高黑果腺肋花楸的体外抗氧化能力,提升营养价值和保健功效。
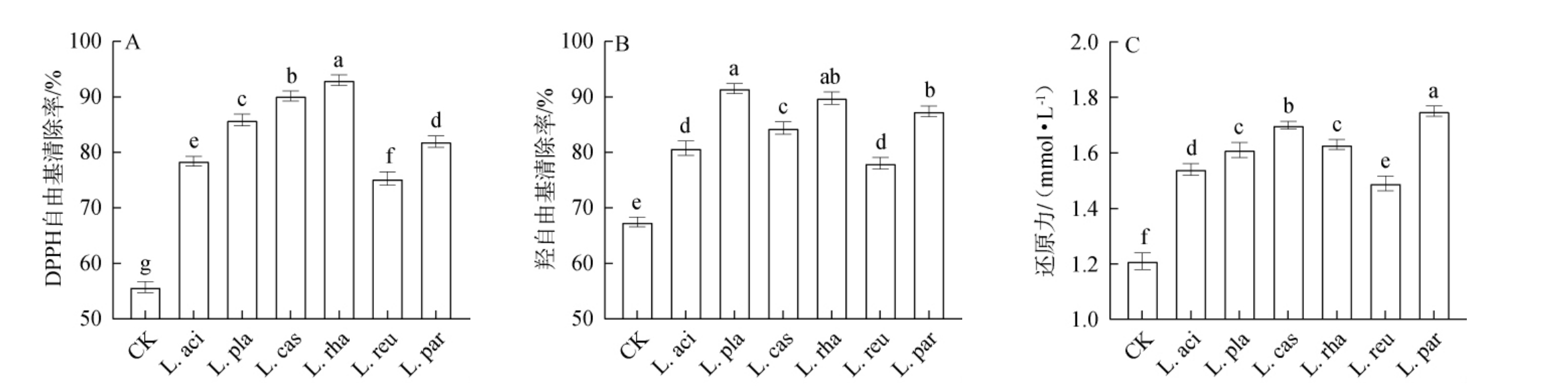
图7 不同乳酸菌发酵对黑果腺肋花楸汁体外抗氧化活性的影响
Fig.7 Effects of different lactic acid bacteria fermentation on in vitro antioxidant activities of black chokeberry juice
2.6 不同乳酸菌发酵后乳酸菌数量、理化指标、色泽特性、生物活性物质与体外抗氧化活性的相关性分析
由图8可知,发酵后,黑果腺肋花楸汁中L*值、总黄酮、总多酚、丁香酸和肉桂酸与DPPH自由基清除率呈显著正相关(R2=0.72、0.73、0.96、0.73和0.94),黑果腺肋花楸汁中总黄酮和总多酚与羟自由基清除率呈显著正相关(R2=0.81和0.90)。 此外,羟自由基清除率与酚酸之间存在显著相关性,特别是丁香酸和肉桂酸(R2=0.81和0.92)。 黑果腺肋花楸汁中总酸、L*值、总黄酮和总多酚与还原力呈显著正相关(R2=0.74、0.81、0.77和0.86),丁香酸和肉桂酸与还原力存在显著正相关(R2=0.78和0.81)。因此,总黄酮、总多酚、丁香酸和肉桂酸与黑果腺肋花楸汁发酵后体外抗氧化活性呈显著正相关,表明酚酸、黄酮类化合物和多酚类化合物具有较强的体外抗氧化活性,与DUAN W H等[27]研究结果相一致。 LI S J等[25]研究发现,接种乳酸菌发酵蓝莓汁能增强体外抗氧化活性。 综上,乳酸菌发酵可通过改变黑果腺肋花楸汁中酚酸、黄酮类化合物和多酚类化合物的含量来提高体外抗氧化能力。
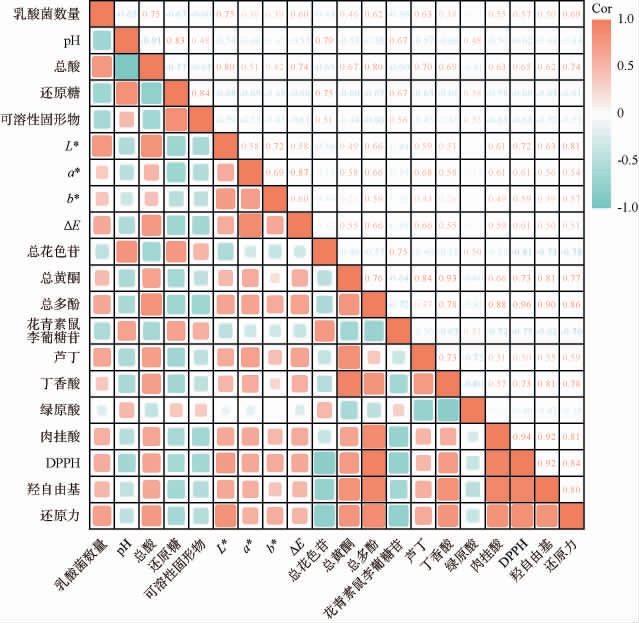
图8 发酵黑果腺肋花楸汁品质指标的相关性分析
Fig.8 Correlation analysis of quality indexes of fermented black chokeberry juice
3 结论
本研究以黑果腺肋花楸汁为底物,对6株乳酸菌发酵黑果腺肋花楸汁的乳酸菌数、理化指标、色泽、生物活性物质及体外抗氧化活性进行分析。结果表明,与对照相比,乳酸菌发酵可以增加乳酸菌数,降低pH、增加总酸、总黄酮和总多酚、总花色苷含量及主要黄酮、酚类和花色苷类化合物含量,降低还原糖含量及可溶性固形物含量,改善色泽,提升体外抗氧化活性。 综合来看,菌株LR-G14、LC-G11、JLPF-176的抗氧化活性较佳。 相关性分析表明,总黄酮、总多酚、丁香酸和肉桂酸与体外抗氧化活性呈显著正相关(P<0.05)。 本研究为开发黑果腺肋花楸发酵产品时挑选特定发酵需求的乳酸菌提供理论参考。
[1]GAO N,SHU C,WANG Y,et al.Polyphenol components in black chokeberry (Aronia melanocarpa)as clinically proven diseases control factors-An overview[J].Food Science and Human Wellness,2024,13(3):1152-1167.
[2]赵晓彤.益生菌发酵黑果腺肋花楸干果及成分与抗氧化活性的研究[D].长春:吉林大学,2023.
[3]王思溥,朱丹,牛广财,等.黑果腺肋花楸酵素自然发酵过程中主要成分与抗氧化活性变化[J].食品工业科技,2023,44(15):93-100.
[4]KULLING S E,RAWEL H M.Chokeberry(Aronia melanocarpa)-A review on the characteristic components and potential health effects[J].Planta Medica,2008,74(13):1625-1634.
[5]王晶,刘鹏莉,肖海滨.功能性乳酸菌发酵赤小豆乳的理化及抗氧化特征[J].食品科技,2022,47(11):172-178.
[6]王超,林小晖,杜冰.乳酸菌发酵型饮料的研究现状与前景[J].饮料工业,2018,21(1):68-70.
[7]DI CAGNO R,CODA R,DE ANGELIS M,et al.Exploitation of vegetables and fruits through lactic acid fermentation[J].Food Microbiol,2013,33(1):1-10.
[8]XU H Y, FENG L X, DENG Y, et al.Change of phytochemicals and bioactive substances in Lactobacillus fermented citrus juice during the fermentation process[J].LWT-Food Sci Technol,2023,180,114715.
[9]KWAW E,MA Y K,TCHABO W,et al.Effect of Lactobacillus strains on phenolic profile,color attributes and antioxidant activities of lactic-acidfermented mulberry juice[J].Food Chem,2018,250:148-154.
[10]宋运霞.接种方式对薏米酒醪品质的影响[J].食品科技,2022,47(12):97-103.
[11]刘文强,董壮壮,孙庆,等.桑叶茶中多酚、黄酮含量与抗氧化作用的相关性研究[J].食品科技,2023,48(2):239-245.
[12]张瑞,景缘,刘静,等.发酵工艺对黑果腺肋花楸果酒贮藏期品质和抗氧化活性的影响[J].中国酿造,2023,42(8):191-196.
[13]LI J,ZHAO W T,PAN X,et al.Improvement of antioxidant properties of jujube puree by biotransformation of polyphenols via Streptococcus thermophilus fermentation[J].Food Chem,2022,13:100214.
[14]王储炎,张继刚,杨柳青,等.3种乳酸菌发酵对蓝莓多酚、原花青素含量及抗氧化活性的影响[J].食品科学,2020,41(24):87-94.
[15]岑秋宇,庞日朝,胡晓敏,等.罗伊乳杆菌对肠屏障功能调节作用的研究进展[J].中国全科医学,2022,25(15):1918-1922.
[16]WANG J,WEI B C,XU J,et al.Influence of lactic acid fermentation on the phenolic profile, antioxidant activities, and volatile compounds of black chokeberry(Aronia melanocarpa) juice[J].J Food Sci, 2024, 89(2):834-850.
[17]史梅莓,伍亚龙,吕鹏军,等.不同乳酸菌接种发酵对泡白菜理化特征及风味的影响[J].食品与发酵工业,2024,50(1):80-88.
[18]李若熙,张楠,罗小丹,等.不同乳酸菌发酵对南酸枣饮料理化指标及功能成分的影响[J].中国酿造,2023,42(6):161-165.
[19]CELE N P, AKINOLA S A, MANHIVI V E, et al.Influence of lactic acid bacterium strains on changes in quality,functional compounds and volatile compounds of mango juice from different cultivars during fermentation[J].Foods,2022,11(5):682.
[20]WANG J, WEI B C, WANG X, et al.Aroma profiles of sweet cherry juice fermented by different lactic acid bacteria determined through integrated analysis of electronic nose and gas chromatography-ion mobility spectrometry[J].Front Microbiol,2023,14:1113594.
[21]MANAGA M G, AKINOLA S A, REMIZE F, et al.Physicochemical parameters and bioaccessibility of lactic acid bacteria fermented chayote leaf (Sechium edule) and pineapple (Ananas comosus) smoothies[J].Front Nutr,2021,8:649189.
[22]WANG Z,TONG Y,TONG Q,et al.Effects of different lactic acid bacteria on phenolic profiles,antioxidant capacities,and volatile compounds in purple sweet potato juice[J].J Food Sci Technol,2024,61(6):1-11.
[23]LIN M, ZHANG J, CHEN X.Bioactive flavonoids in Moringa oleifera and their health-promoting properties[J].J Funct Food,2018,47:469-479.
[24]DEGRAIN A,MANHIVI V,REMIZE F,et al.Effect of lactic acid fermentation on color, phenolic compounds and antioxidant activity in African nightshade[J].Microorganisms,2020,8(9):1324.
[25]LI S J,TAO Y,LI D D,et al.Fermentation of blueberry juices using autochthonous lactic acid bacteria isolated from fruit environment:Fermentation characteristics and evolution of phenolic profiles[J].Chemosphere,2021,276:130090.
[26]CHEN M Y,ZHANG S T,REN Y X,et al.Effects of different brewing technologies on polyphenols and aroma components of black chokeberry wine[J].Foods,2023,12(4):868.
[27]DUAN W H,GUAN Q J,ZHANG H L,et al.Improving flavor,bioactivity,and changing metabolic profiles of goji juice by selected lactic acid bacteria fermentation[J].Food Chem,2023,408:135155.