石榴(Punica granatum Linn.)属于石榴科和千金藤科,是世界著名水果之一。 石榴皮质量约占石榴果实鲜质量的40%,长期以来,在我国石榴加工中,石榴皮除少量晒干入药外,大部分被抛弃,既造成资源的浪费,又污染环境[1]。据《中华人民共和国药典》(一部)[2]所述,石榴皮属于酸性食物,口感苦涩,具有涩肠止泻、生津止渴、驱虫及止血等多重药理作用[3]。 多项研究表明,石榴皮活性成分丰富,具有一定的抗氧化能力,能够延缓衰老,并对肿瘤生长产生抑制作用[4]。此外,石榴皮还具备杀菌、降低血压和血脂等多种生物功能活性,显示出其作为膳食补充物的巨大潜力,对人体健康具有一定益处[5-7]。
微生物发酵是一种绿色友好的现代生物加工技术,广泛应用于食品和中药天然产物的深加工[8]。在发酵过程中,微生物产生水解酶,促进活性成分的释放和转化,从而提高其药理功效[9]。此外,发酵可以改变物料中有毒成分的结构,减少毒副作用[10];同时,发酵是改善食品感官风味的极佳方式,微生物可以分解发酵底物中的营养物质,产生各种游离氨基酸、有机酸和其他风味成分,以及挥发性香气成分,如醇、醛和酯[11]。
研究表明,当不同的菌种对相同的原料进行发酵时,产生的活性物质有一定的差异,从而对其有效成分产生不同的影响[12]。 为了充分挖掘石榴皮的利用价值,本研究在充分查阅文献[13-15]的基础上,选择5株乳酸菌、1株酵母菌、3株霉菌作为发酵菌株,分别对石榴皮进行液态发酵,探究不同菌种对石榴皮品质的影响,为石榴资源的多元开发利用提供不同的菌种选择依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
石榴皮:新疆市和田地区皮山县皮亚勒玛甜石榴;安琪酵母(AY):济宁祥园生物科技有限公司;植物乳植杆菌(Lactiplantibacillus plantarum,LP)HH-LP56、保加利亚乳杆菌(Lactobacillus bulgaricus,LB)HH-LB57、嗜热链球菌(Streptococcus thermophilus,ST)HH-ST08、干 酪 乳 杆 菌(Lactobacillus casei,LC)PB-LC39、嗜酸乳杆菌(Lactobacillus acidophilus,LA)HH-LA26、红 曲 霉(Monascus sp.,Mo)ACCC30352、米 曲 霉(Aspergillus oryzae,AO)CICC2339;毛霉(Mucor sp.,MS):山东和众康源生物科技有限公司。
1.1.2 试剂
儿茶素、芦丁、香草醛、单宁酸(纯度均>99%):福晨(天津)化学试剂有限公司;福林酚、Folin-Denis试剂:厦门海标科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、1,1-二 苯 基-2-三 硝 基 苯 肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH)(均为分析纯):梯希爱(上海)化成工业发展有限公司;2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)(分析纯):阿达玛斯贝塔(上海)化学试剂有限公司;邻苯三酚(分析纯):天津市光复精细化工研究所;浓盐酸(分析纯):武汉市鑫华松化工有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:杭州百思生物科技有限公司。PDB固体培养基:PDB液体培养基中添加2%琼脂。
MRS肉汤培养基:杭州百思生物科技有限公司。 MRS固体培养基:MRS肉汤培养基中添加2%琼脂。
液态发酵培养基[16]:2.2%葡萄糖、2.66%(NH4)2SO4、0.3% NaNO3、0.1% ZnSO4·7H2O、0.1% MgSO4·7H2O、0.2%K2HPO4。
以上培养基均在121 ℃条件下高压蒸汽灭菌20 min,备用。
1.2 仪器与设备
DK-2000-ⅢL电热恒温水浴锅:天津市泰斯特仪器有限公司;HC10002X电子天平:上海花潮电器有限公司;SC-3614低速离心机:安徽中科中佳科学仪器有限公司;TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司;SHP-250B生化培养箱:天津市天宇实验仪器有限公司;SHJ超净工作台:上海汇龙仪表电子有限公司;Synergy HTX多功能酶标仪:美国博腾仪器有限公司;PEN-3型电子鼻:德国AIRSENCE公司;JZ-600精密型色差仪:深圳市金准仪器设备有限公司。
1.3 方法
1.3.1 菌种活化与培养
将酵母菌菌株AY及霉菌菌株Mo、AO、MS分别划线接种于PDB固体培养基,菌株AY在37 ℃条件下连续活化培养2次后,使用接种环挑取单菌落接种于100 mL PDB液体培养基,37 ℃、140 r/min条件下培养至菌体浓度为1×108 CFU/mL的菌悬液备用;菌株Mo、AO、MS于33 ℃条件下分别连续活化培养2次后,使用接种环挑取孢子用无菌水充分稀释,得到孢子浓度为1×108 CFU/mL的孢子悬液,备用。
将乳酸菌菌株LP、LB、ST、LC、LA分别划线接种于MRS固体培养基,37 ℃条件下连续活化培养2次后,使用接种环挑取菌落接种于100 mL MRS液体培养基,37 ℃、140 r/min条件下培养至菌体浓度为1×108 CFU/mL的菌悬液,备用。
1.3.2 石榴皮液态发酵工艺
新鲜的石榴皮用0.15%次氯酸钠溶液浸泡20 min,无菌水复洗2次后,紫外灯照射60 min,每15 min翻面照射。灭菌完成的石榴皮分成质量相同的小块,取25 g石榴皮置于150 mL液态发酵培养基中,接种10%的菌悬液,混合均匀,调整pH为5.5~6.5,放置在恒温恒湿培养箱,在最适温度(乳酸菌和酵母菌37 ℃、霉菌33 ℃)下发酵5 d,得到发酵石榴皮。以未接菌发酵的石榴皮为对照(CK)组。
1.3.3 分析检测方法
(1)理化指标
水解单宁含量的测定:使用Folin-Denis法[17];缩合单宁含量的测定:使用香草醛法[18];鞣花酸含量的测定:参考文献[19];总黄酮含量的测定:参考文献[20];总糖含量的测定:采用反滴定法[21];总纤维含量的测定:采用碘量法[22];总酚含量的测定:采用福林酚法[23]。
(2)抗氧化活性
OH自由基清除率、超氧阴离子(O2-)自由基清除率的测定:分别使用水杨酸法、邻苯三酚自氧化速率法[24];DPPH自由基清除率、ABTS自由基清除率的测定:使用紫外分光光度法[23]。
(3)色泽
取新鲜石榴皮(未发酵组)及CK组和各发酵组石榴皮,观察石榴皮的色泽,并拍照记录。
(4)挥发性物质
采用电子鼻测定挥发性物质[25],测定条件为:传感器流速400.00 mL/min,清洗时间80.00 s,样品检测时间100.00 s,重复三次。
1.3.4 数据处理与统计分析
每个试验重复3次,采用Excel 2021、Origin 2022软件处理数据,采用WinMuster软件对电子鼻检测结果进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 不同菌株液态发酵石榴皮基本理化指标的测定
2.1.1 单宁含量
石榴皮中的主要化学成分为单宁类化合物,含量高达10.4%~21.3%,是石榴皮的重要组成成分,也是影响石榴皮质量的主要因素[26]。 因此,考察不同菌株液态发酵对石榴皮水解单宁含量和缩合单宁含量的影响,结果见图1。
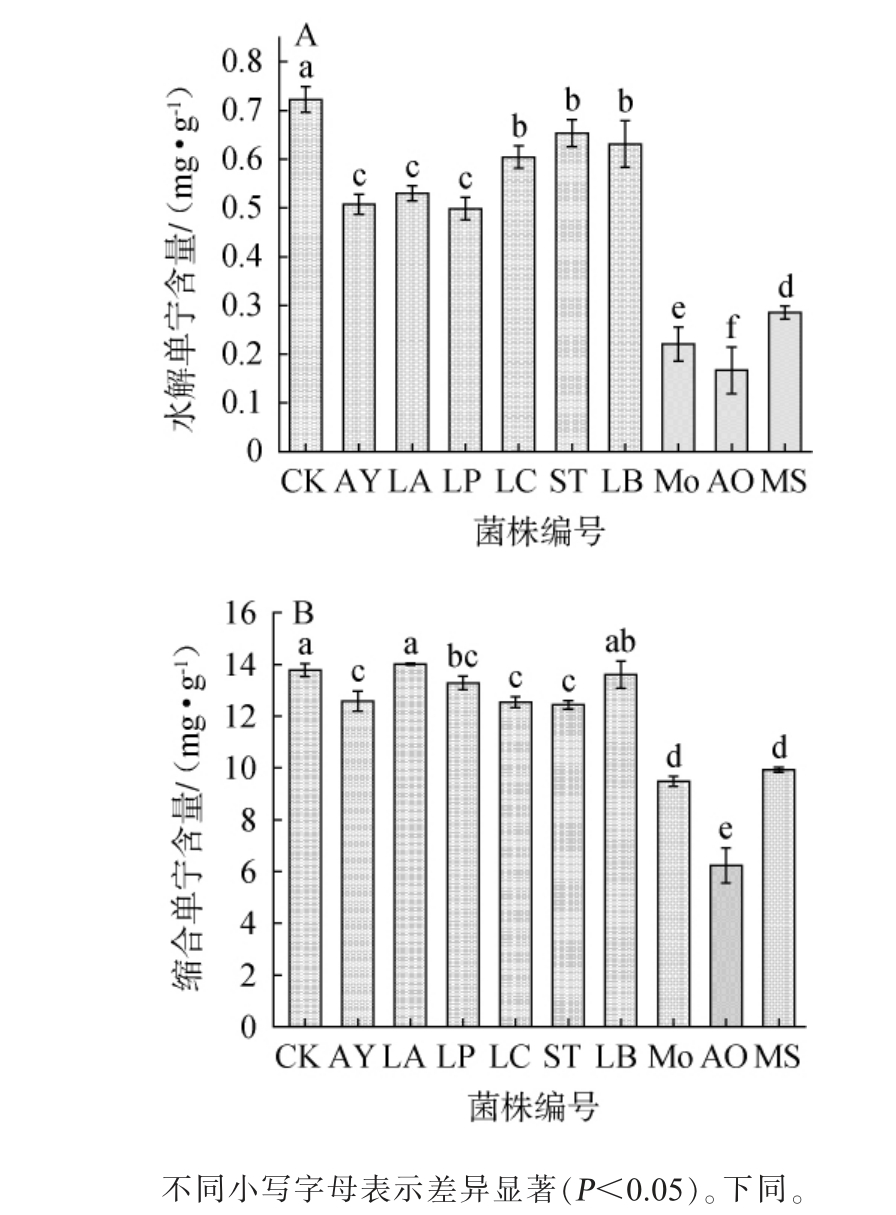
图1 不同菌株液态发酵石榴皮后水解单宁(A)及缩合单宁(B)含量的测定结果
Fig.1 Determination results of hydrolyzed tannin (A) and condensed tannin (B) contents of pomegranate peel after liquid fermentation by different strains
由图1可知,与CK组相比,9株菌株液态发酵石榴皮后均降低了水解单宁含量,除菌株LA外,其余8株菌株液态发酵石榴皮后均降低了缩合单宁的含量。各菌株发酵后石榴皮中的水解单宁含量在0.16~0.65 mg/g之间,整体上各菌株对单宁的降解能力为霉菌>酵母菌>乳酸菌,其中经菌株AO发酵后,石榴皮中水解单宁含量最低,为0.16 mg/g。与水解类单宁相比,缩合类单宁由于受本身结构特点的影响,生物降解较水解类单宁困难[27]。各菌株发酵后石榴皮中的缩合单宁含量在6.23~14.01 mg/g之间,整体上各菌株对缩合单宁的降解能力与水解单宁一致,其中经菌株AO发酵后,石榴皮中的缩合单宁含量最低为6.23 mg/g。 综上,米曲霉AO在降解水解单宁和缩合单宁方面都有显著效果。
目前,对石榴皮发酵后单宁含量变化的研究还很少。兰平等[28]采用青霉(Penicillium sp.)和米曲霉发酵葡萄皮,缩合单宁含量分别降解了52.3%和32.2%;SABAR W P S等[29]采用枯草芽孢杆菌(Bacillus subtilis)与米曲霉共同发酵豆粕,单宁含量降至1%以下;WEN Y L等[30]采用米曲霉固态发酵4种中药残渣后均发现缩合单宁含量有不同程度降解。 这些研究高于本研究大部分单菌发酵的结果,但与米曲霉AO的降解能力相近,证明米曲霉AO更有利于石榴皮发酵后单宁含量的降解。
2.1.2 活性成分含量
石榴是富含抗氧化活性成分的水果,其果皮抗氧化活性成分含量尤其高,且多酚、黄酮及鞣花酸是其发挥抗氧化作用的主要成分[31]。因此,考察不同菌株液态发酵对石榴皮总酚、总黄酮及鞣花酸含量的影响,结果见图2。由图2A可知,与CK组相比,9种菌株液态发酵石榴皮后,总酚含量均呈现不同程度的下降。酵母AY发酵后,石榴皮中的总酚含量为85.27 mg/g;霉菌Mo、AO、MS发酵后,石榴果皮中的总酚含量无显著差异(P>0.05),分别为97.5 mg/g、96.05 mg/g、96.46 mg/g;5株乳酸菌发酵后,石榴皮中的总酚含量差异较大,其中菌株ST发酵石榴皮中的总酚含量最高,为98.53 mg/g,菌株LA发酵石榴皮中的总酚含量最少,为81.34 mg/g。由图2B可知,与CK组相比,酵母菌及5株乳酸菌菌株液态发酵石榴皮后,总黄酮含量降低,而3株霉菌菌株发酵后,总黄酮含量显著升高(P<0.05),且菌株Mo发酵石榴皮中总黄酮含量最高,为6.45 mg/g。由图2C可知,5株菌株发酵后石榴皮中的鞣花酸含量高于CK组,分别为菌株AY、LA、LP、LC、ST,3株霉菌发酵后石榴皮中的鞣花酸含量显著低于CK组(P<0.05),经过菌株LB发酵后鞣花酸含量低于CK组,但差异不显著(P>0.05)。其中,菌株ST发酵石榴皮中鞣花酸含量最高(98.53 mg/g)。 综上,9株菌株液态发酵均会显著降低石榴皮中的总酚含量(P<0.05);3株霉菌液态发酵均会使总黄酮含量得到显著提升(P<0.05),其中菌株Mo发酵后总黄酮含量最高;5株菌株发酵后石榴皮中的鞣花酸含量升高,其中菌株ST发酵后鞣花酸含量最高。
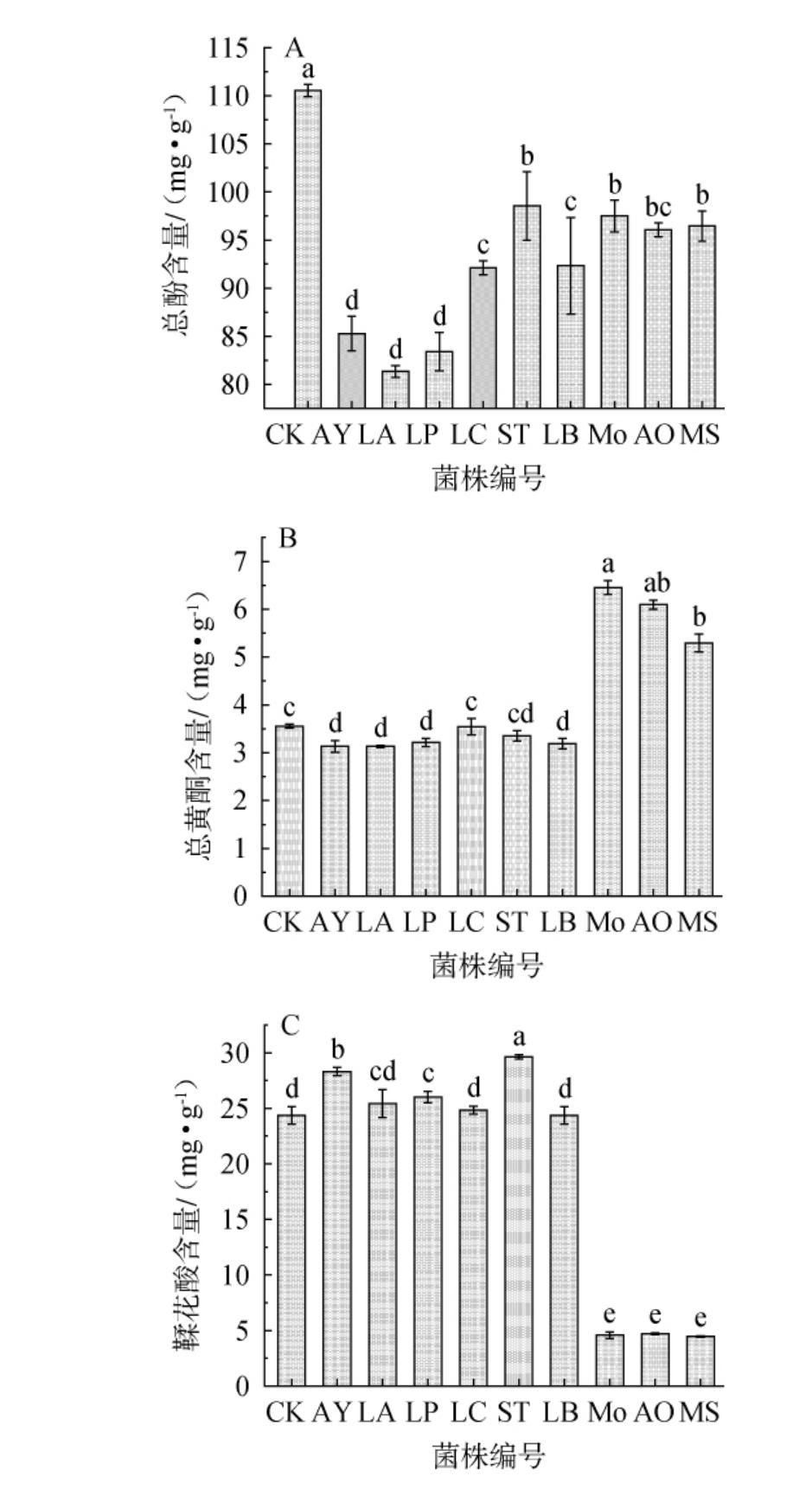
图2 不同菌株液态发酵对石榴皮总酚(A)、总黄酮(B)及鞣花酸(C)含量的影响
Fig.2 Effect of liquid fermentation with different strains on the contents of total phenols (A), total flavonoids (B) and ellagic acid (C) in pomegranate peel
发酵后石榴皮中的总酚含量均出现了下降,总黄酮和鞣花酸含量部分出现下降,可能是发酵过程中微生物降解了部分的酚类、黄酮和鞣花酸[32]。而菌株Mo、AO、MS发酵后产生了更多黄酮类物质,这与霉菌发酵过程中产生的生物酶有关,这些酶不仅在发酵过程中进一步释放与大分子结合的可溶性酚类,还将类黄酮苷元大大转化为更具有生物活性的黄酮苷元[33-34]。
2.1.3 总糖及总纤维含量
在发酵过程中,糖类是微生物生长的重要物质来源,其含量对菌体的生长和产物的合成有着直接的影响[35]。纤维是抗营养因子,指植物细胞壁、多糖、木质素及相关物质的总和,不易被人体消化吸收[36]。因此,考察不同菌株液态发酵对石榴皮总糖及总纤维含量的影响,结果见图3。由图3A可知,与CK组相比,经9株菌株液态发酵石榴皮后,总糖含量均显著下降(P<0.05),且3霉菌菌株下降幅度最大,可能是霉菌更容易利用消耗石榴皮中的糖类物质[37-38]。 其中,菌株LB发酵石榴皮中的总糖含量最高(12.5%),菌株MS发酵石榴皮中的总糖含量最低(3.5%)。由图3B可知,与CK组相比,经酵母菌AY和5株乳酸菌菌株发酵后,石榴皮总纤维含量显著升高(P<0.05),然而经3株霉菌发酵后,总纤维含量均显著降低(P<0.05)。其中,菌株AO发酵石榴皮中总纤维含量最低(20.44%)。 酵母菌AY和5株乳酸菌发酵后石榴皮中总纤维含量升高,原因可能是,乳酸菌和酵母菌分泌的淀粉酶等多糖酶能够溶解细胞间物质,使之暴露出更多的结合类纤维,但这些酶类对纤维的代谢能力较弱,暴露出的纤维素可能没有被大范围分解[39]。3株霉菌发酵石榴皮后总纤维含量,可能是霉菌发酵中会产生多种纤维素酶分解纤维素,使得发酵后石榴皮中的总纤维含量下降[40]。 综上,在液态发酵中霉菌能更好的利用石榴皮中的糖类物质供给菌体的生长,并且能更好的分解抗营养因子纤维素的含量,其中菌株MS对石榴皮中的糖类物质利用最高,菌株AO对石榴皮中总纤维的降解能力最好。
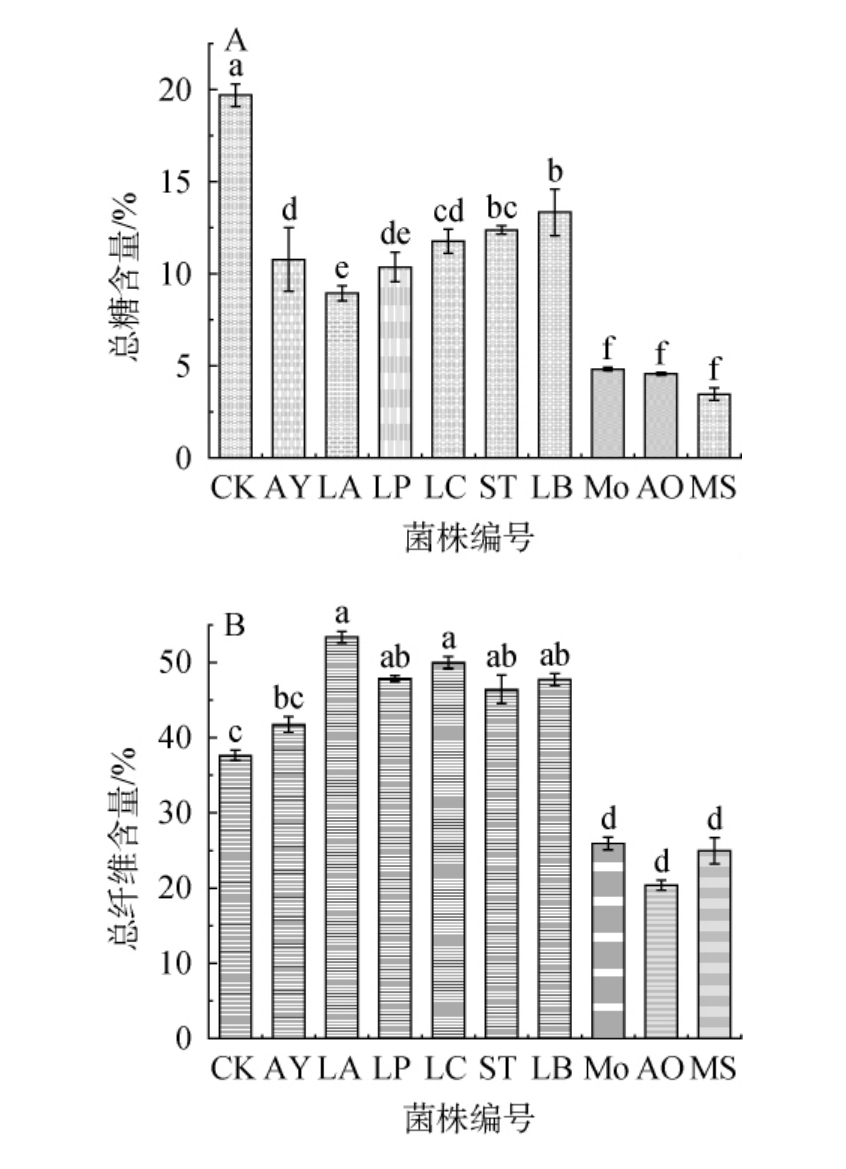
图3 不同菌株液态发酵对石榴皮总糖(A)及总纤维(B)含量的影响
Fig.3 Effect of liquid fermentation with different strains on total sugar(A) and total fiber (B) contents in pomegranate peel
2.2 不同菌株液态发酵石榴皮的抗氧化活性
不同菌株液态发酵对石榴皮抗氧化活性的影响见图4。
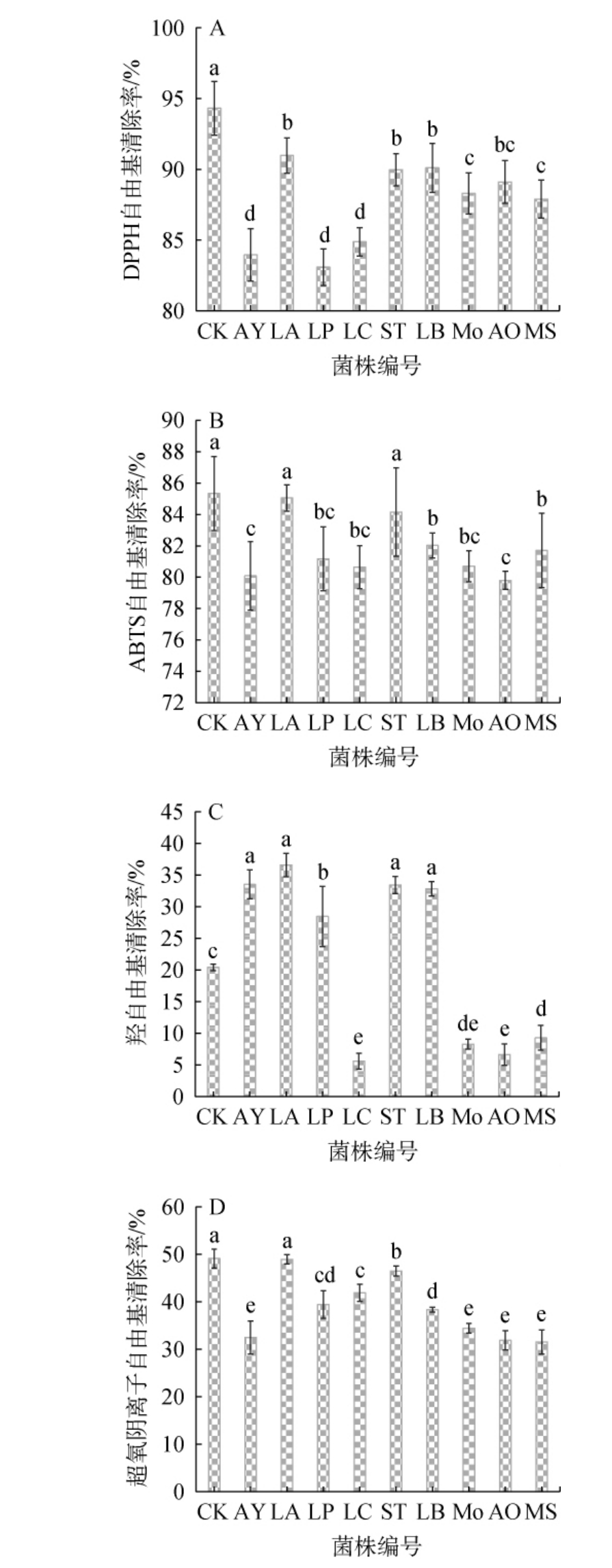
图4 不同菌株液态发酵对石榴皮DPPH(A)、ABTS(B)、羟基(C)及超氧阴离子(D)自由基清除率的影响
Fig.4 Effect of liquid fermentation with different strains on DPPH (A),ABTS (B),·OH-(C), O2-(D) free radicals scavenging rates of pomegranate peel
由图4可知,与CK组相比,9株菌株液态发酵石榴皮后,DPPH、ABTS及超氧阴离子自由基清除率均降低,原因可能是发酵过程中的有机酸和酚类等抗氧化物质可以被微生物代谢或吸附[41],另外谭敏华等[42]研究认为,有机酸和酚类在酶的作用下可以被分解成蛋白质、糖苷类物质致使抗氧化能力有所下降。菌株LC、LP、AY发酵后石榴皮的DPPH自由基清除率较其他菌株相对较低,分别为84.88%、83.08%、83.96%。 菌株LA发酵后石榴皮的DPPH自由基清除率最强(90.98%)。除菌株LA和ST外,其余6株菌株发酵后石榴皮的ABTS自由基清除率均显著低于CK组(P<0.05),其中,菌株LA发酵后石榴皮的ABTS自由基清除能力最强(85.03%),菌株AO最低(79.8%)。 除菌株LC外,酵母菌AY及4株乳酸菌菌株发酵后石榴皮的羟自由基清除率显著高于CK组(P<0.05),羟自由基清除率在28.46%~36.6%之间,菌株LC、Mo、AO、MS发酵后石榴皮的羟自由基清除率均显著低于CK组(P<0.05),其中菌株LC发酵后石榴皮的羟自由基清除率最低。除菌株LA外,所有菌株发酵后石榴皮的超氧阴离子自由基清除率都出现了不同程度的降低,菌株MS发酵后石榴皮超氧阴离子自由基清除率最低(31.79%),菌株LA发酵后石榴皮超氧阴离子自由基清除率最高(49.22%)。 综上,乳酸菌菌株LA发酵后石榴皮对4种自由基的清除率均高于其他菌株,抗氧化能力较好。
2.3 不同菌株液态发酵后石榴皮的色泽
不同菌株液态发酵对石榴皮色泽的影响见图5。由图5可知,未发酵的新鲜石榴皮呈亮黄色,内皮组织完好无损,组织结构清晰,未见明显的褐变发生。 经菌株AY发酵后,石榴皮的整体颜色变为浅黄色;经菌株LP、ST、LA、LC、LB发酵后,石榴皮的颜色相近,都呈现出接近未发酵石榴皮原本的颜色,内表皮结构完整脉络清晰可见,分析原因可能是乳酸菌会代谢产生乳酸,降低pH值,进而抑制了褐变酶的活性[43]。 相比之下,经菌株MS和AO发酵后,石榴皮呈姜黄色,且内表皮严重缺失,并伴随着纤维结构的暴露,但无论是菌株MS还是AO发酵,石榴皮均未观察到明显褐变情况,这可能与AO和MS发酵时会分泌抑制其他导致褐变的酶有关[44]。 经菌株Mo发酵后,石榴皮的整体颜色变为红棕色,可能与其代谢产生的红曲色素有关[45]。

图5 不同菌株液态发酵对石榴皮色泽的影响
Fig.5 Effect of liquid fermentation by different strains on color of pomegranate peel
2.4 不同菌株液态发酵石榴皮挥发性物质分析
不同菌株液态发酵石榴皮的电子鼻分析雷达图见图6。
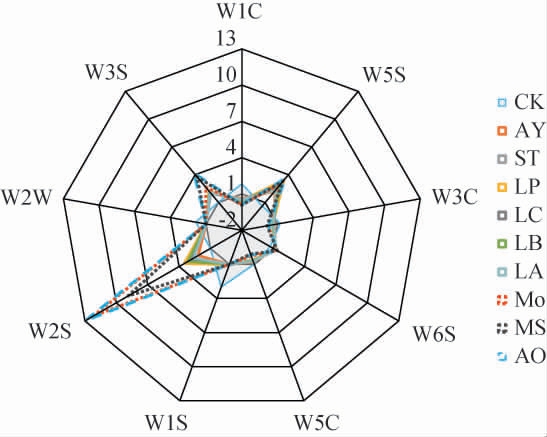
图6 不同菌株液态发酵石榴皮的电子鼻分析雷达图
Fig.6 Radar gram for electron nose analysis of pomegranate peel by liquid fermentation with different strains
由图6可知,经菌株AY、ST、LP、LC、LB、LA发酵后石榴皮的电子鼻分析雷达图轮廓基本一致,仅在传感器W5S(氮氧化物)、W2S(醇醛酮类物质)上的响应值存在差异,表明这6株菌株发酵石榴皮后产生的氮氧化物和醇醛酮类物质存在一定差异。 菌株Mo、AO、MS发酵后石榴皮的电子鼻雷达图轮廓与其他菌株相比存在较大差异,同时在传感器W2S与W3S(长链烷烃类物质)上的响应值大于其他菌株,说明3株霉菌发酵石榴皮后产生了更为丰富的醇醛酮类成分和长链烷烃。进一步基于电子鼻分析结果对不同菌株液态发酵后的石榴皮样品进行PCA,结果见图7。
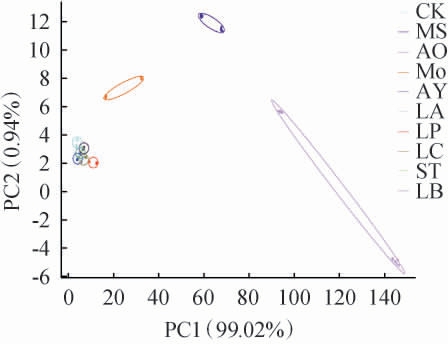
图7 基于电子鼻分析结果不同菌株液态发酵石榴皮的主成分分析结果
Fig.7 Principal component analysis results of pomegranate peel by liquid fermentation with different strains based on electronic nose analysis results
由图7可知,PC1方差贡献率为99.02%,PC2方差贡献率为0.94%,前两个主成分的累计方差贡献率为99.96%,大于85%,说明2个主成分基本能代表样品的基本信息特征。菌株AY、LA、LC、ST、LB发酵的石榴皮存在部分重叠,特别是菌株ST、LA发酵的石榴皮重叠部分极大,说明经这5株菌株发酵后产生的挥发性物质类似。菌株LP、AO、MS、Mo发酵石榴皮挥发性物质均不存在重叠部分,说明发酵的风味具有独特性,与其他菌株相比有较大差异性。
3 结论
本研究比较分析了酵母菌、乳酸菌和霉菌共9株菌株在液态发酵石榴皮5 d后理化成分含量、抗氧化能力、色泽及挥发性成分的变化。 结果表明,米曲霉(Aspergillus oryzae)发酵更利于抗营养因子单宁和总纤维的降解,红曲霉(Monascus sp.)发酵有利于提高总黄酮含量,毛霉(Mucor sp.)发酵对总糖的利用率最高,嗜热链球菌(Streptococcus thermophilus)发酵有利于提高鞣花酸和总酚含量,乳酸菌发酵能更好的保护石榴皮的色泽,霉菌及植物乳植杆菌(Lactiplantibacillus plantarum)发酵后石榴皮挥发性成分独特。
[1]周倩,孙立立,戴衍朋,等.石榴皮、石榴瓤及石榴籽的化学成分比较研究[J].中国中药杂志,2013,38(13):2159-2162.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2020:97
[3]闫晓越,王子琦,王桂林,等.石榴皮多酚提取研究进展[J].山东化工,2022,51(24):79-80,83.
[4]郭璐,夏道宗,张晓熙,等.石榴皮多组分提取工艺优化及多体系抗氧化活性评价[J].中华中医药杂志,2019,34(9):4008-4012.
[5]代倍倍.石榴皮对鸡球虫病的预防与治疗研究[D].武汉:华中农业大学,2022.
[6]郭传琦.石榴籽降糖成分的研究[D].济南:齐鲁工业大学,2013.
[7]田花丽,渠元春,周青辉,等.药食同源石榴的开发应用研究进展[J].粮食与食品工业,2022,29(3):27-31.
[8]LI L Q,SONG A X,WONG W T,et al.Modification and enhanced antiinflammatory activity by Bifidobacterial fermentation of an exopolysaccharide from a medicinal fungus Cs-HK1[J].Int J Biol Macromol,2021,188:586-594.
[9]宋伟,温瑞雪,罗卓婷,等.微生物发酵提升燕麦营养品质研究进展[J].中国粮油学报,2023,38(7):228-237.
[10]LI L,WANG L,FAN W X,et al.The application of fermentation technology in traditional Chinese medicine:A review[J].Am J Chinese Med,2020,48(4):899-921.
[11]ZHU W H, LUAN H W, BU Y, et al.Flavor characteristics of shrimp sauces with different fermentation and storage time[J].LWT-Food Sci Technol,2019,110:142-151.
[12]张程程,翟齐啸,孙志宏,等.食品发酵剂研究进展与发展趋势浅析[J].中国食品学报,2024,24(5):89-102.
[13]SHANG Y F,CAO H,MA Y L,et al.Effect of lactic acid bacteria fermentation on tannins removal in Xuan Mugua fruits[J].Food Chem,2019,274:118-122.
[14]RODRÍGUEZ H,RIVAS L D B,GÓMEZ-CORDOVÉS C,et al.Degradation of tannic acid by cell-free extracts of Lactobacillus plantarum[J].Food Chem,2007,107(2):664-670.
[15]HERNÁNDEZ C M, ESQUIVEL C C J, LARA F, et al.Isolation and evaluation of tannin-degrading fungal strains from the mexican desert[J].Z Naturforsch C,2015,60(11-12):844-848.
[16]刘纪.产冷适应漆酶真菌的筛选、发酵及其酶学性质的研究[D].镇江:江苏大学,2022.
[17]昝志惠,高艳梅,孙墨珑.核桃楸单宁提取及其抗氧化性[J].植物研究,2015,35(3):431-435.
[18]刘乾坤.浸渍酶及多糖对蓝莓酒缩合单宁特性和感官品质的影响[D].武汉:华中农业大学,2022.
[19]许鹏飞.石榴皮五味子发酵液的制备及功效研究[D].上海:上海应用技术大学,2021.
[20]WU C Y, LI T L, QI J, et al.Effects of lactic acid fermentation-based biotransformation on phenolic profiles, antioxidant capacity and flavor volatiles of apple juice[J].LWT-Food Sci Technol,2020,122:109064.
[21]彭科怀,张坤.反滴定法测定食品中总糖的方法[J].现代预防医学,2010,37(22):4319-4321.
[22]刘侠,温俊峰,焦玉荣,等.废弃果核壳中纤维素、半纤维素和木质素含量的测定[J].榆林学院学报,2022,32(2):6-9.
[23]李卓瓦,袁晓芸,赵鑫磊,等.超声波辅助提取石榴根皮多酚工艺优化及其抗氧化活性[J].食品工业科技,2019,40(1):136-142.
[24]张婉君,冯彬,谢笔钧,等.白肉番石榴总黄酮提取工艺优化及体外抗氧化活性分析[J].食品工业科技,2019,40(8):196-201.
[25]盛秀丽,马刘峰,方志刚,等.基于电子鼻和HS-SPME-GC-MS技术分析9种新疆石榴果实挥发性成分[J].食品工业科技,2023,44(6):325-334.
[26]张肖,张立华,卢永慧,等.石榴不同部位化学成分及药用价值研究进展[J/OL].特产研究,1-8[2024-09-30].https://doi.org/10.16720/j.cnki.tcyj.2024.138.
[27]申家豪,郑娟善,梁泽毅,等.植物单宁的微生物降解及其调控反刍动物瘤胃发酵的研究进展[J].动物营养学报,2022,34(5):2798-2811.
[28]兰平,马泽宇,叶柳青,等.微生物降解葡萄皮单宁研究[J].林业工程学报,2017,2(5):58-63.
[29]SUPRAYOGI W P S,RATRIYANTO A,AKHIRINI N,et al.Changes in nutritional and antinutritional aspects of soybean meals by mechanical and solid-state fermentation treatments with Bacillus subtilis and Aspergillus oryzae[J].Bioresource Technol,2022,17:100925.
[30]WEN Y L,YAN L P,CHEN C S,et al.Effects of fermentation treatment on antioxidant and antimicrobial activities of four common Chinese herbal medicinal residues by Aspergillus oryzae[J].J Food Drug Anal,2013,21(2):219-226.
[31]宋子欣,孙倩茹,方嘉璇,等.石榴皮主要活性成分及其在化妆品中的应用研究进展[J].日用化学工业(中英文),2023,53(10):1211-1219.
[32]林登蕃,郑志豪,周映君,等.植物基食品中多酚的生物转化及生物活性研究进展[J].食品科学,2024,45(14):319-327.
[33]GUMIENNA M,SZWENGIEL A,GÓRNA B.Bioactive components of pomegranate fruit and their transformation by fermentation processes[J].Eur Food Res Technol,2016,242(5):631-640.
[34]WANG L,LUO Y,WU Y N, et al.Fermentation and complex enzyme hydrolysis for improving the total soluble phenolic contents, flavonoid aglycones contents and bio-activities of guava leaves tea[J].Food Chem,2018,264:189-198.
[35]张田田,董悦生,侯洪波,等.紫皮石斛多糖酶解及其在发酵酒中的应用[J/OL].食品与发酵工业,1-10[2024-09-30].https://doi.org/10.13995/j.cnki.11-1802/ts.040079.
[36]易兰兰,朱俊红,程文杰,等.植物纤维的降解机制及菌酶协同发酵应用[J].动物营养学报,2024,36(3):1361-1374.
[37]RAJAVAT A S,RAI S,PANDIYAN K,et al.Sustainable use of the spent mushroom substrate of Pleurotus florida for production of lignocellulolytic enzymes[J].J Basic Microbiol,2020,60(2):173-184.
[38]WAN C X,LI Y B.Microbial delignification of corn stover by Ceriporiopsis subvermispora for improving cellulose digestibility[J].Enzyme Microb Tech,2010,47(1):31-36.
[39]何小丽,李冲,张妮娅,等.生物发酵法改善菜粕品质的研究[J].中国粮油学报,2016,31(11):85-91.
[40]易兰兰,朱俊红,程文杰,等.植物纤维的降解机制及菌酶协同发酵应用[J].动物营养学报,2024,36(3):1361-1374.
[41]陈红惠,向德健,高明菊,等.发酵条件对三七叶发酵茶活性物质的影响及抗氧化研究[J].食品工业,2022,43(4):174-179.
[42]谭敏华,张巧苑,于立梅,等.柚子全果果酒发酵工艺优化及其抗氧化活性、挥发性成分分析[J].食品工业科技,2021,42(13):149-155.
[43]梁亚男,叶发银,雷琳,等.苹果汁褐变控制技术研究进展[J].食品与发酵工业,2018,44(3):280-286.
[44]蒲静.曲霉型豆豉褐变工艺影响因素研究[D].贵阳:贵州大学,2021.
[45]高宇琪,廖丽丽,胥世洪,等.燕麦麸皮与红曲粉混合发酵产物的功能成分与理化特性研究[J].食品与发酵科技,2023,59(1):39-44.