食醋是中国传统调味品,具有改善食品风味和色泽的作用。麸醋是四川四大名醋之一,其以麸皮作为主要发酵原材料,经过糖化、酒精发酵以及醋酸发酵3个过程制得[1]。据研究表明,麸皮经过发酵,酯、醇及其衍生物含量提高,赋予发酵食品特殊风味[2-3]。酒精发酵阶段是食醋发酵的重要过程,在此过程中,酿酒酵母(Saccharomyces cerevisiae)将还原糖转化为酒精,酒精作为醋酸发酵底物,直接影响后续醋酸产量[4]。醋酸含量和风味是麸醋最基本的品质指标,酒样中的有机酸和风味物质的种类及含量对麸醋风味的形成具有至关重要影响,因此,提升麸醋酒精发酵阶段的酒精产量、总酸含量和风味对后续醋酸发酵具有重要意义[5-6]。
现有研究表明,乳酸菌和酿酒酵母作为食醋酒精发酵阶段优势菌种,对酒样风味的形成影响较大[7]。混菌发酵对醋的品质的改善及风味的形成具有积极作用。与其他乳酸菌相比,植物乳植杆菌(Lactiplantibacillus plantarum)因具有较好的产酸和生长能力,在混合发酵研究中应用广泛[8-9]。ZHANG M等[10]研究发现,在食醋酒精发酵过程中添加植物乳植杆菌可增加乳酸含量,改善食醋风味;李斌斌等[11]研究发现,接种不同比例的酿酒酵母与植物乳植杆菌对红枣酒的挥发性风味特征和感官品质产生不同影响;LI Y等[12]研究发现,植物乳植杆菌与酵母混合发酵后,苹果酒样品口感丰富性和层次感明显提高;LIU W L等[13]研究表明,同时接种酿酒酵母与植物乳植杆菌进行发酵,能够提高葡萄酒样品中酯类物质的含量,改善样品风味。混菌发酵体系中,菌种接种顺序对酒样品质具有重要影响,多项研究证明可以通过改变菌种的接种顺序来调控酒样发酵性能和风味[14-15]。
本研究以麸皮、曲药、大米粉和小麦粉为主要原料,采用酿酒酵母和植物乳植杆菌为发酵菌种发酵制备麸醋,通过比较各组酒精发酵阶段酒精发酵速度和发酵后酒样的酒精度、还原糖含量、总酸含量和挥发性风味成分,并进行香气感官评价,探究不同时间添加植物乳植杆菌对麸醋酒精发酵阶段品质的影响,为高品质麸醋的工业化生产提供数据基础和理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
麸皮、曲药、大米粉、小麦粉:四川省某食醋企业。
酿酒酵母(Saccharomyces cerevisiae)(白酒王酿酒高活性干酵母):安琪酵母股份有限公司;植物乳植杆菌(Lactiplantibacillus plantarum):广东省微生物菌种保藏中心(GuangDong Microbial Culture Collection Center,GDMCC),编号为No.1.380。
1.1.2 试剂
糖化酶(1.5×105U/mL)、耐高温α-淀粉酶(22417U/mL):四川省某食醋企业;氢氧化钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(均为分析纯):成都市科龙化工试剂厂;2-辛醇(纯度≥99.0%):天津市科密欧化学试剂有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
MRS培养基[16]:蛋白胨10 g,牛肉膏10 g,葡萄糖5 g,酵母膏5 g,无水乙酸钠5 g,吐温80 1 g,磷酸氢二钾2 g,柠檬酸氢二钠2 g,硫酸镁0.2 g,硫酸锰0.05 g,蒸馏水1 000 mL,121 ℃高压灭菌15 min。
1.2 仪器与设备
50/30 μm DVB/CAR/PDMS萃取头:美国Supelco公司;HWS-2608恒温恒湿培养箱:杭州绿博仪器有限公司;52N紫外可见分光光度计:上海诺科仪器仪表有限公司;i-Nose电子鼻测定仪:美国Isenso公司;7890A-5975B气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)仪:安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 种子液制备
将植物乳植杆菌接种至装有400 mLMRS培养基的500 mL锥形瓶中,37 ℃条件下活化培养48 h,取4 mL菌液于400 mL MRS培养基中进行二次活化。取4 mL二次活化后的培养液于400 mL MRS培养基中,37 ℃培养12 h(对数期)即为植物乳植杆菌种子液。 将酿酒酵母加入10倍体积的蒸馏水中,于35 ℃条件下活化40 min后待用[17]。
1.3.2 麸醋的酒精发酵工艺
麸醋的酒精发酵工艺参考杜津昊等[4]的方法,准确称取物料共200 g,按料水比1.0∶2.5(g∶mL)的比例加入到1.8 L发酵罐中,并在45 ℃下搅拌混匀以进行调浆,加入0.05%耐高温α-淀粉酶进行液化(95~97 ℃,30 min),液化结束后,待样品冷却到60 ℃,加入0.5%的糖化酶进行糖化发酵(60 ℃,2.5 h)。 糖化结束后,待样品降温到28 ℃,依次加入活化好的1.2%酿酒酵母和2%植物乳植杆菌种子液,盖上保鲜膜密封,28 ℃条件下发酵7 d。植物乳植杆菌及酿酒酵母的接种时间见表1。
表1 植物乳植杆菌及酿酒酵母的接种时间
Table 1 Inoculation time of Lactiplantibacillus plantarum and Saccharomyces cerevisiae
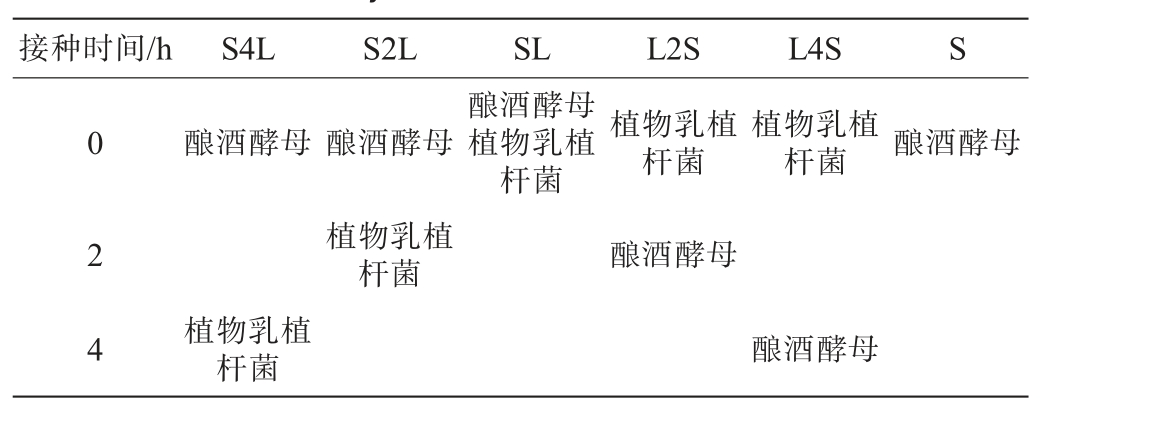
接种时间/h S4L S2L SL L2S L4S S 02 4酿酒酵母 酿酒酵母酿酒酵母植物乳植杆菌植物乳植杆菌植物乳植杆菌酿酒酵母植物乳植杆菌酿酒酵母植物乳植杆菌酿酒酵母
1.3.3 发酵速度的测定
酵母菌在发酵过程中不断释放CO2气体[18],利用CO2质量损失来间接反映菌株的发酵速度。参照李礼等[19]的方法,每隔1 d测定一次质量。
1.3.4 理化指标的测定
酒精度的测定:采用蒸馏酒精度法测定[3];还原糖含量的测定:采用DNS法[20];总酸含量的测定:采用GB 12456—2021《食品中总酸的测定》测定[21]。
1.3.5 香气描述性感官分析
酒样的香气感官评价参照黄婷等[22]的方法,通过粮香、果香、甜香、花香、酸香和青草香5个香气描述词对各组酒样进行感官分析。 由10名专业人员组成评定小组,分别对酒样进行香气感官评价,并对每个术语进行10分制打分。
1.3.6 发性风味物质的测定
参照盛凤云等[23]的方法采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)-气相色谱-质谱联用技术(GC-MS)测定酒样挥发性风味成分。
1.3.7 数据处理与分析
每个实验重复3次,采用Excel 2021及SPSS 21.0软件处理数据,采用Origin 2024软件作图。
2 结果与分析
2.1 酿酒酵母和植物乳植杆菌接种时间对酒样发酵速度的影响
酿酒酵母的植物乳植杆菌接种时间对酒样发酵速度的影响见图1。
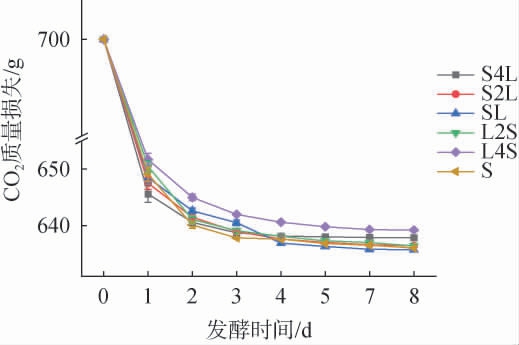
图1 酿酒酵母和植物乳植杆菌接种时间对发酵速度的影响
Fig.1 Effect of Saccharomyces cerevisiae and Lactiplantibacillus plantarum inoculation time on the rate of fermentation
由图1可知,发酵第1天,各组样品质量减少最快,质量变化幅度从大到小依次为S4L、S2L、SL、S、L2S和L4S组,其中,S4L、S2L和SL组质量变化幅度较大,分析其原因可能是酿酒酵母在发酵体系中形成优势菌群,在酒精发酵过程中,质量变化主要由酵母无氧呼吸产生CO2所致[18];S组质量变化略低于S4L、S2L和SL组,可能是因为S4L、S2L和SL组接种植物乳植杆菌,乳酸菌在发酵前期可促进酿酒酵母生长和代谢[24];L2S和L4S组质量变化较少,可能是因为先接种植物乳植杆菌,在营养物质的竞争中其成为优势菌种,导致酿酒酵母可用于酒精发酵的底物减少,此外,乳酸菌特征代谢产物乳酸也会影响酵母酒精发酵[25]。发酵1 d后,各样品质量缓慢减少,并趋近于稳定,即发酵完成。 发酵第1天速率快可能是因为发酵前期还原糖含量高,营养物质丰富,总质量随着糖转化为乙醇和二氧化碳气体而降低;随着发酵的进行,由于糖类被大量消耗,用于产乙醇的物质大量减少,不能为酿酒酵母提供足够的营养物质,质量变化幅度趋于平稳[9]。 L4S组总质量变化幅度最小,S4L组略高于L4S组,其余各组变化相近。 综上,接种植物乳植杆菌影响酒样发酵速度,接种时间越早,酒样第1天质量减少幅度越小,之后质量缓慢下降,并趋于稳定。
2.2 酿酒酵母和植物乳植杆菌接种时间对酒样理化指标的影响
酿酒酵母和植物乳植杆菌接种时间对酒样理化指标的影响见图2。
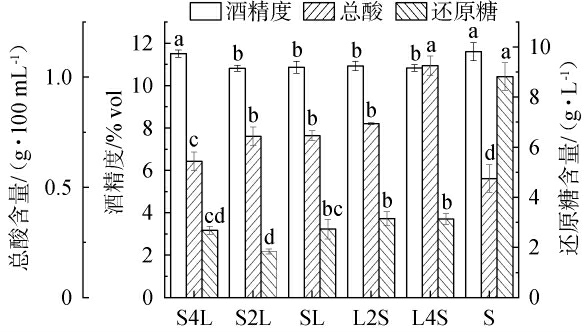
图2 酿酒酵母和植物乳植杆菌接种时间对发酵酒样理化指标的影响
Fig.2 Effect of Saccharomyces cerevisiae and Lactiplantibacillus plantarum inoculation time on physicochemical indexes of fermented liquor samples
不同小写字母表示差异显著(P<0.05)。
由图2可知,在相同发酵条件下,不同时间接种植物乳植杆菌发酵酒样的理化指标存在一定差异。 在酒精度方面,与S组(11.61%vol)相比,除S4L组(11.51%vol)外,其余实验组样品酒精度(10.82%vol~10.93%vol)均显著降低(P<0.05),但这些样品之间酒精度差异不显著(P>0.05);在还原糖含量方面,各实验组酒样的还原糖含量(1.84~3.16 g/L)均显著低于S组(8.82 g/L)(P<0.05)。乙醇是酵母菌特征代谢产物,延迟接种或不接种植物乳植杆菌的样品酒精度相对较高,分析其原因可能是植物乳植杆菌与酿酒酵母在营养物质的争夺中形成竞争关系,菌种接种时间越早,在营养物质的竞争中越易形成优势菌种,越有利于该菌特征代谢产物的形成[26]。混菌发酵酒样的酒精度及还原糖含量低于单菌发酵,分析其原因一方面可能是,酿酒酵母在利用发酵体系中营养物质进行酒精发酵的同时,植物乳植杆菌也会利用一部分糖类等营养物质来满足自身生长和乳酸代谢[27],导致酿酒酵母可利用的营养物质减少[28-29],同时植物乳植杆菌特征分泌代谢产物乳酸在一定程度上也会影响酵母菌生长,进而影响其乙醇代谢途径[30-31]。另一方面,植物乳植杆菌和酿酒酵母所带电荷可能不同,部分酵母菌凝聚沉结在发酵罐底部,无法利用醪液中所有可发酵碳水化合物,使酿酒酵母发酵能力下降,导致样品酒精度有所降低[32]。
总酸含量对酒样风味及后续麸醋风味的形成具有重要影响[3]。在总酸含量方面,各实验组样品的总酸含量(0.62~1.05 g/100 mL)均显著高于S组(0.54 g/100 mL)(P<0.05),且植物乳植杆菌添加时间越早,酒样总酸含量越高,分析原因可能是,植物乳植杆菌接种时间越早,在营养物质的竞争中越易形成优势菌种,促进其特征代谢产物乳酸生成,导致样品总酸含量较高[26]。
综上,接种植物乳植杆菌会降低酒样酒精度,增加总酸含量和提高还原糖的利用率,且总酸含量随植物乳植杆菌接种时间的提前而逐渐增加。
2.3 酿酒酵母和植物乳植杆菌接种时间对酒样挥发性风味成分的影响
酿酒酵母和植物乳植杆菌接种时间对酒样挥发性风味成分的影响见表2。
表2 发酵酒样挥发性风味成分GC-MS分析结果
Table 2 Results of volatile flavor components in fermented liquor samples analyzed by GC-MS

注:“—”表示未检出。
醛酮类其他类种类 化合物棕榈酸乙酯乙酸乙酯己酸乙酯乙酸异戊酯乙酸苯乙酯辛酸乙酯甲酸己酯γ-壬内酯辛酸甲酯2-羟基丙酸乙酯琥珀酸二乙酯油酸乙酯月桂酸乙酯庚酸乙酯壬酸乙酯总含量乙醇苯乙醇异戊醇2-甲基-1-丙醇2,3-丁二醇1-丙醇1-己醇1-壬醇1-辛烯-3-醇总含量醋酸安息香醛壬醛总含量十五烷邻苯二甲醚4-乙基-1,2-二甲氧基苯4-乙烯基愈创木酚2,4-二特丁基苯酚双甘油总含量酯类醇类酸类含量/(μg·L-1)S4L S2L SL L2S L4S S 46.19±2.03 40.01±6.90 29.88±6.01 33.64±6.70 51.30±1.10 26.05±4.90—8.30±1.20 5.74±1.20—1.21±0.21 3.09±1.09 4.28±0.92 3.18±1.18 3.56±0.77 256.43±24.21 15 139.78±529.60 1 282.97±65.90 1 200.74±45.14 110.23±7.27 13.83±1.94 14.58±3.09 15.83±0.93 177.45±13.94 124.64±6.51 53.42±5.32 50.09±1.85 23.30±1.30 43.98±3.53—9.47±1.17 41.49±1.69 3.32±0.31 24.80±2.40—9.16±0.75 203.79±15.38 170.94±16.40 91.48±12.66 69.63±3.16 43.32±3.32 60.79±1.33 49.00±7.56 36.38±8.64 15.73±4.61 48.69±2.78 12.79±0.65 63.54±1.48 97.47±8.18 52.95±6.90 44.03±4.62 35.58±3.59 38.23±4.91—9.38±2.32 1.04±0.04 2.91±0.43 7.86±2.08—3.85±0.15 3.99±0.52 3.85±1.91 364.68±27.13 14 182.84±518.05 1 146.19±42.47 1 174.49±24.47 170.90±18.58 16.98±2.78 18.15±6.33 16.61±6.34 1.81±0.21—16 727.97±519.23 60.34±6.77 3.87±0.56 1.59±0.09 5.46±0.35 5.65±0.67 15.62±1.73 14.53±1.20 16.43±1.00 2.47±0.46 7.47±2.17 62.17±5.23 116.74±9.36 76.24±5.96 55.57±5.84 64.12±5.80 80.97±9.83 45.17±5.45—3.89±1.82 2.01±0.01 108.34±4.04 111.27±5.11 83.30±2.23 88.47±4.32 93.22±4.93 48.91±7.05 25.39±2.93 6.80±0.81 4.11±0.12 8.13±2.17—13.81±0.83 4.28±0.27 8.68±1.77—604.71±26.58 13 518.01±1062.6 2 750.77±80.73 2 552.33±69.44 271.68±18.34 44.52±4.53 33.94±3.15 10.15±0.17 17.62±3.16—19 199.02±1142.12 76.32±5.49 2.99±0.78—2.99±0.48 1.93±0.19 35.35±4.99 41.07±10.78 2.39±0.19 8.54±4.91—89.28±19.06————————17 777.96±553.87 48.23±6.17 3.63±0.03 1.96±0.96 5.59±0.69 2.18±0.01 14.78±0.27 12.37±1.49 7.16±0.27 1.78±0.78 21.95±1.95 60.22±2.77 561.12±28.77 13 932.85±942.65 3 043.90±112.81 2 294.32±35.32 350.79±12.54 71.89±6.49 35.59±3.09 33.38±3.08 14.10±1.51—19 776.82±1017.49 86.98±4.78 12.29±2.29—12.29±1.99 14.53±1.87 39.56±3.87 45.47±2.64 21.09±3.62—49.43±2.41 170.08±12.41 4.81±0.87 3.71±0.77 811.06±68.13 13 056.15±747.04 3 699.47±25.63 2 829.77±38.06 341.58±65.01 78.54±10.30 40.21±5.12—19.56±2.12 4.32±2.31 20 069.6±795.59 101.15±8.52 10.11±1.79 5.86±1.71 15.97±3.2—52.81±7.41 51.85±12.16 7.67±2.61——112.33±20.18 27.18±7.11 5.07±1.93 4.72±0.71 4.16±0.11 485.84±43.93 15 409.68±319.91 1 979.94±69.77 1 805.76±66.69 222.13±23.76 34.12±6.69 33.52±4.01 20.87±2.69 7.92±3.11 1.29±0.23 19 515.23±396.86 39.37±3.70 3.61±1.13—3.61±0.83 1.03±0.03 23.48±3.08 19.37±4.91 11.67±0.83 4.39±0.09 22.29±0.22 82.23±7.16
由表1可知,在各组酒样中挥发性风味物质存在差异, 其原因可能是在混菌发酵体系中,两种菌株因相互作用,使得菌株生长代谢有所差异,最终影响发酵产品风味[29]。从各组酒样中共检出33种挥发性风味物质,包括酯类15种、醇类9种、酸类1种、醛酮类2种、其他类6种,其中酯类、醇类和酸类是主要风味物质。
酯类物质是麸醋的主要挥发性风味物质,对其风味组成有重要影响[33]。酯类物质大多由酵母代谢和酯化反应产生[34]。 各组样品中酯类物质含量最高的是棕榈酸乙酯,其主要呈微弱蜡香和果爵等香气[35],棕榈酸乙酯含量从高到低依次是L4S组(203.79 μg/L)、SL组(177.45 μg/L)、S组(116.74 μg/L)、L2S组(108.34 μg/L)、S2L组(63.54 μg/L)和S4L组(46.19 μg/L)。 其次是乙酸乙酯,是四川麸醋主要特征风味之一[36-37]。 6组样品中乙酸乙酯含量从高到低依次 是L4S 组(170.94 μg/L)、SL 组(124.64 μg/L)、L2S 组(111.27 μg/L)、S2L组(97.47 μg/L)、S组(76.24 μg/L)和S4L组(40.01 μg/L)。 L4S组乙酸乙酯含量最高,可能与该组乙酸含量高,促进酯化反应有关;S4L组乙酸乙酯含量最低,低于S组,表明不同时间接种植物乳植杆菌对乙酸乙酯的形成作用效果不同。此外,己酸乙酯、乙酸异戊酯、乙酸苯乙酯和辛酸乙酯在各实验组酒样酯类物质中占比相对较高。不同时间接种植物乳植杆菌对酯类物质形成的作用效果不同,植物乳植杆菌接种时间越早,酯类物质总含量越高,说明植物乳植杆菌对酯类的合成具有促进作用,但不是每一种酯类物质含量都随植物乳植杆菌接种时间提前而逐渐增加,其原因可能是在混合体系中,酯类的形成不仅受复杂的代谢网络影响,还受到体系中不同化学反应的影响[38]。
醇类物质主要由乳酸菌和酵母菌代谢产生[39],适量的醇类物质使酒样口感丰满,但其含量过高时会导致酒体风味不协调,产生异杂味[40-41]。 除乙醇外,各组样品中含量较高的醇类物质是苯乙醇和异戊醇。苯乙醇和异戊醇都是麸醋中重要风味物质,能赋予食醋特殊的香味,对麸醋风味的形成有重要贡献[36,42-43]。 各组样品中苯乙醇含量从高到低依次是L4S组(3 699.47 μg/L)、SL组(3 043.90 μg/L)、L2S组(2 750.77 μg/L)、S组(1 979.94 μg/L)、S4L组(1 282.97 μg/L)和S2L组(1 146.19 μg/L),异戊醇含量从高到低依次是L4S组(2829.77μg/L)、L2S组(2552.33μg/L)、SL组(2 294.32μg/L)、S 组(1 805.76 μg/L)、S4L 组(1 200.74 μg/L)和S2L 组(1 174.49 μg/L)。样品中其他醇类物质含量相对较少,但对酒样以及食醋醋酸发酵阶段风味形成具有重要贡献,如2,3-丁二醇是酒中的甜味物质,酒中的甜润感和醇厚感,粘稠感与此有关[44]。 植物乳植杆菌接种时间越早,对乙醇生成的抑制作用越大,但能促进其他醇类生成。
酸类物质是食醋主要风味物质之一,在一定程度上决定了食醋的风味和品质[45-46]。醋酸含量从高到低依次是L4S组(101.15 μg/L)、SL组(86.98 μg/L)、L2S组(76.32 μg/L)、S2L组(60.34 μg/L)、S4L组(48.23 μg/L)和S组(39.37 μg/L)。据现有研究表明,醋酸作为麸醋酒精发酵阶段的主要有机酸之一,对后续食醋酒精发酵阶段风味具有一定影响[47]。除L2S组,各实验组样品醋酸含量随植物乳植杆菌接种时间提前而增加。
综上,发酵酒样中酯类、醇类和酸类是主要风味物质,接种植物乳植杆菌影响麸醋酒精发酵阶段的风味,植物乳植杆菌接种时间越早,酯类和醇类物质总含量越高;除L2S组,醋酸含量随植物乳植杆菌接种时间提前而增加。
2.4 植物乳植杆菌接种时间对酒样香气感官品质的影响
发酵酒样的香气感官评价雷达图见图3。
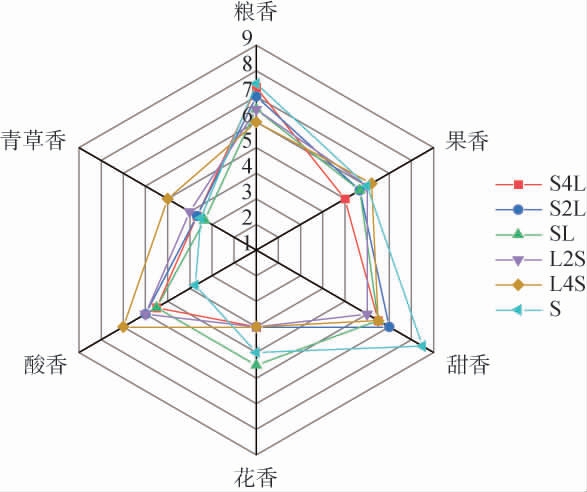
图3 发酵酒样的香气感官分析雷达图
Fig.3 Radar map of aroma sensory analysis of fermented liquor samples
由图3可知,6组样品的香气品质存在差异,即不同时间接种植物乳植杆菌对酒样的风味产生影响。样品原料由大米、小麦、麸皮和曲药组成,多种粮香赋予样品独特风格,S组、S4L组和S2L组酒样的粮香评分相对较高,且植物植乳杆菌接种时间越早,酒样粮香越低,说明植物乳植杆菌代谢产物可能对酒样粮香具有屏蔽作用。酿造麸醋时添加了麸皮,增加了样品果香[48]。L4S组酒样果香评分高于S组,其余各组酒样果香评分均低于S组,且植物乳植杆菌接种时间越晚,酒样果香评分越低,酒样果香可能受植物乳植杆菌和酿酒酵母复杂代谢网络的共同影响。S组甜香评分最高,可能与S组残糖含量高有关[49]。SL组花香评分最高,其次是S组,其余各组花香评分较低,花香和植物乳植杆菌添加时间无明显相关性,可能和风味之间的协同、加成或掩盖等因素有关[50]。 植物乳植杆菌添加时间越早,样品酸香越明显,分析原因可能与植物乳植杆菌发酵代谢产生多种有机酸有关。L4S组青草香评分最高,其次是L2S组,其余各样品青草香评分相差不大,表明青草香与植物乳植杆菌添加有关,异戊醇表达青草香[51]。
综上,接种植物乳植杆菌影响酒样香气感官品质,添加时间越早,酒样粮香越低,但果香、青草香和酸香越突出,接种植物乳植杆菌会抑制酒样甜香。
3 结论
接种植物乳植杆菌能提升麸醋酒精发酵阶段品质和风味,在发酵速率方面,麸醋酒精发酵第一天CO2质量损失最大,之后缓慢减少并趋于稳定,且植物乳植杆菌接种时间越早,CO2质量损失越小。在理化指标方面,接种植物乳植杆菌抑制酒精生成,除S4L组,其余各组酒精度显著降低(P<0.05),但各组间差异不显著(P>0.05);总酸含量随植物乳植杆菌接种时间提前而逐渐增加;接种植物乳植杆菌能显著提高发酵体系还原糖利用率(P<0.05)。在挥发性风味物质方面,酯类、醇类和酸类是发酵酒样主要挥发性风味成分,接种植物乳植杆菌影响酒样风味,植物乳植杆菌接种时间越早,酯类和醇类物质总含量越高;除L2S组,醋酸含量随植物乳植杆菌接种时间提前而增加。植物乳植杆菌接种时间越早,酒样果香、青草香和酸香越突出,但对甜香和粮香具有一定抑制作用。
[1]于华,唐姣,赵佳丽,等.四川麸醋发酵过程中醋醅理化指标及有机酸变化分析[J].中国酿造,2020,39(7):51-55.
[2]王小平,雷激,唐诗,等.酵母发酵改善麸皮食用品质的研究[J].食品工业科技,2016,37(10):231-235,241.
[3]翟红月,苏乐萍,屈磊,等.高酸海棠果麸皮果醋酒精发酵工艺优化及品质分析[J].食品工业,2019,40(3):83-88.
[4]杜津昊,季彬,梁燕,等.响应面法优化荞麦食醋酒精发酵工艺[J].中国酿造,2024,43(5):162-167.
[5]尹永祺,张书玉,韩永斌,等.紫甘薯醋酒精发酵阶段混菌发酵工艺条件优化[J].食品科学,2013,34(11):188-192.
[6]国家国内贸易局.SB/T 10304—1999 中华人民共和国行业标准 麸醋质量标准[J].北京:中国标准出版社,1999.
[7]刘海坡,阚涛,刘彩霞.食醋酒精发酵阶段非挥发性风味物质及微生物群落结构解析[J].食品与发酵工业,2022,48(19):65-69.
[8]莫依灿.乳酸菌对客家黄酒的影响研究[D].广州:仲恺农业工程学院,2017.
[9]周佳乐,李苗云,赵莉君,等.三种肉源乳酸菌生长特性及其发酵特性的研究[J/OL].食品与发酵工业,1-12[2024-12-19].https://doi.org/10.13995/j.cnki.11-1802/ts.039801.
[10]ZHANG M,LI X,MU D,et al.Co-fermentation metabolism characteristics of apple vinegar with Acetobacter pasteurianus and Lactobacillus plantarum[J].J Food Process Pres,2022,46(7):e16605.
[11]李斌斌,李宇辉,刘战霞,等.植物乳杆菌与酿酒酵母混合发酵对红枣酒挥发性风味物质的影响[J].食品工业科技,2023,44(8):170-179.
[12]LI Y,NGUYEN T T H,JIN J,et al.Brewing of glucuronic acid-enriched apple cider with enhanced antioxidant activities through the co-fermentation of yeast (Saccharomyces cerevisiae and Pichia kudriavzevii) and bacteria(Lactobacillus plantarum)[J].Food Sci Biotechnol,2021,30(4):555-564.
[13]LIU W L,FAN M,SUN S Y,et al.Effect of mixed fermentation by Torulaspora delbrueckii, Saccharomyces cerevisiae and Lactobacillus plantarum on the sensory quality of black raspberry wines[J].Eur Food Res Technol,2020,246(8):1573-1581.
[14]贾世宽,陈佳威,郜成军,等.顺序和同时接种乳酸菌对马瑟兰葡萄酒品质的影响[J].食品研究与开发,2023,44(23):48-55.
[15]崔荣荣,刘学礼,乔赫梁,等.鲁氏结合酵母与酿酒酵母顺序发酵对米酒发酵性能及关键香气物质的影响[J].天津科技大学学报,2024,39(4):15-25.
[16]施渺筱,洪蕴,汤鑫鑫,等.自然发酵泡菜中乳酸菌的分离鉴定及其在金刺梨汁发酵中的应用[J].中国酿造,2022,41(1):109-115.
[17]李河,李正涛,张宿义,等.苦荞黄酒的工艺研究[J].食品研究与开发,2016,37(21):68-71.
[18]杜连样.工业微生物学实验技术[M].天津:天津科学技术出版社,1992:49-50.
[19]李礼,陈尚武,张文,等.不同天然香料物质对蜂蜜酒发酵及品质的影响[J].中国酿造,2005,24(8):11-13.
[20]王欢,卢红梅,张义明,等.固态发酵食醋中还原糖、总糖含量测定[J].中国酿造,2011,30(9):172-175.
[21]中华人民共和国国家卫生健康委员会, 国家市场监督管理总局.GB 12456—2021 食品安全国家标准 食品中总酸的测定[S].北京:中国标准出版社,2021.
[22]黄婷,刘丹,赵金松.人工催陈方式对松茸黄酒风味及抗氧化活性的影响[J].中国酿造,2024,43(5):216-223.
[23]盛凤云,徐俊敏,宋科峰,等.发酵温度对黄酒酿造及风味物质形成影响研究[J].酿酒科技,2021(5):56-61.
[24]李先胜,姜铁民,陈历俊.发酵乳中酵母菌和乳酸菌生长的相互影响[J].食品工业科技,2012,33(17):139-141.
[25]NARENDRANATH N V,HYNES S H,THOMAS K C,et al.Effects of Lactobacilli on yeast-catalyzed ethanol fermentations[J].Appl Environ Microbiol,1997,63(11):4158-4163.
[26]万兵.酱香型白酒酿造过程中酿酒酵母和面包乳杆菌交互作用机制解析[D].无锡:江南大学,2022.
[27]徐清萍,尧俊英.液化方式对小米醋酒精发酵阶段的影响[J].中国调味品,2014,39(2):47-50.
[28]HUANG J, WANG Y, REN Y, et al.Effect of inoculation method on the quality and nutritional characteristics of low-alcohol kiwi wine[J].LWT-Food Sci Technol,2022,156:113049.
[29]丁玉萍,王梦泽,刘宇欣,等.单菌与混菌发酵软枣猕猴桃果酒品质比较[J].中国酿造,2023,42(5):145-150.
[30]NARENDRANATH N V,HYNES S H,THOMAS K C,etal.Effects of Lactobacilli on yeast-catalyzed ethanol fermentations[J].Appl Environ Microbiol,1997,63(11):4158-4163.
[31]卢丽,李树峰,佟慧丽,等.乳酸对酵母凋亡及某些相关基因表达的影响[J].东北农业大学学报,2010,41(11):72-76.
[32]毛青钟.论黄酒发酵过程酵母和乳酸杆菌协同作用关系[J].山东食品发酵,2006(1):3.
[33]ZHAO J,DAI X,LIU X,et al.Comparison of aroma compounds in naturally fermented and inoculated Chinese soybean pastes by GC-MS and GC-olfactome-try analysis[J].Food Control,2011,22(6):1008-1013.
[34]CAI J,ZHU B Q,WANG Y H,et al.Influence of pre-fermentation cold maceration treatment on aroma compounds of Cabernet Sauvignon wines fermented in different industrial scale fermenters[J].Food Chem,2014,154:217-229.
[35]张任虎,周崇禅,吴茜,等.不同香型白酒酿造腐乳风味对比研究[J].食品与发酵工业,2023,49(6):210-214.
[36]杜大钊,黄静,王瑞,等.四川麸醋及其陈酿过程中挥发性风味物质解析[J].食品与发酵科技,2020,56(5):1-6.
[37]熊越,贺稚非,李洪军,等.顶空固相微萃取-气质联用分析四川麸醋的香气成分[J].食品科学,2011,32(2):252-255.
[38]LIU S X,LAAKSONEN O,YANG B R.Volatile composition of bilberry wines fermented with non-Saccharomyces and Saccharomyces yeasts in pure,sequential and simultaneous inoculations[J].Food Microbiol,2019,80:25-39.
[39]DU TOIT S C,ROSSOUW D,DU TOIT M,et al.Enforced mutualism leads to improved cooperative behavior between Saccharomyces cerevisiae and Lactobacillus plantarum[J].Microorganisms,2020,8(8):1109.
[40]刁体伟,陈晓姣,冷银江,等.植物源多酚对梨酒抗氧化能力及其感官品质的影响[J].食品与发酵工业,2022,48(23):93-101.
[41]孙中贯,刘琳,王亚平,等.酿酒酵母高级醇代谢研究进展[J].生物工程学报,2021,37(2):429-447.
[42]HO J, JIE M.Pharmacological activity of cardiovascular agents from herbal medicine[J].Cardiovasc Hematol Agents Med Chem,2007,5(4):273-277.
[43]邱雪,黄钧,吴重德,等.热处理对四川麸醋风味组分影响的探究[J].食品科技,2017,42(5):261-266.
[44]王明,王逍,陈嘉杰,等.白酒中特征手性物质的SLE-GC-MS识别方法[J].食品与发酵工业,2021,47(5):180-185.
[45]李丹亚.镇江香醋生产过程中风味物质和功能因子的变化规律[D].无锡:江南大学,2008.
[46]尹俊玲.传统手工和现代工业化生产镇江香醋风味组分的比较研究[D].镇江:江苏大学,2016.
[47]刘彩霞.乳杆菌酸化循环浸米工艺降低黄酒生物胺的研究[D].无锡:江南大学,2020.
[48]王婷婷,许柠,汪丽萍,等.麸胚水分含量对挤压稳定化回填法制备全麦挂面特征风味化合物的影响[J].河南工业大学学报(自然科学版),2022,43(1):65-74.
[49]张佳佳,过伟民,翟振,等.不同香型区烤烟水溶性糖组分含量差异及与感官质量的关系[J].中国烟草科学,2021,42(4):67-72.
[50]陈臣,袁佳杰,杨仁琴,等.食品风味协同作用研究进展[J].食品安全质量检测学报,2020,11(3):663-668.
[51]周文杰,张芳,王鹏,等.基于GC-MS/GC-O结合化学计量学方法研究库尔勒香梨酒的特征香气成分[J].食品科学,2018,39(10):222-227.