中国白酒的酿造工艺传承至今已有数千年,承载着中国悠久的历史文化和民族智慧。浓香型白酒作为我国白酒四大基本香型之一,因其独特的发酵工艺和典型的风味特征而被广泛消费[1]。 浓香型白酒是在开放式多菌共酵体系下,以高粱或配以大米、糯米、玉米等粮谷作为原料,添加中温大曲糖化发酵剂制成糟醅,低温入窖缓慢发酵的一种中国传统固态蒸馏酒。 据中国产业研究院、中国报告大厅数据显示,自2021年以来,浓香型白酒市场规模持续扩大,2021年市场规模为1 106.5亿元,预计到2025年将突破3 000亿元,年增长率超过10%。 泥窖作为浓香型白酒糟醅的发酵容器,糟醅在发酵过程中微生物生态的复杂性和演变的动态性是形成浓香型白酒独特风味和保障品质的关键。 浓香型白酒酿造工艺流程如下:

本文聚焦于浓香型白酒糟醅发酵过程中微生物群落的时空异质性,即微生物群落在时间和空间分布上的不均匀性和复杂性,深入剖析季节变化、原料差异以及窖龄等影响因素对微生物群落演替的影响,并总结近年来在糟醅发酵过程中微生物群落组装机制、丰度分类及风味物质合成机制上的创新研究成果,以期为浓香型白酒发酵过程的优化与调控提供坚实的理论基础和科学指导。
1 糟醅发酵过程微生物群落动态演替的时空异质性
1.1 微生物群落演替时间异质性
浓香型白酒糟醅窖池发酵过程通常为45~90 d。 发酵前期一般时长为10~15 d,发酵中期时长为5~10 d,发酵后期时长为30~60 d,发酵温度变化符合“前缓、中挺、后缓落”的理想控制工艺模式。 在浓香型白酒的糟醅发酵过程中,微生物群落的动态变化是一个复杂且受多种因素影响的过程,其组成和功能呈现出显著的时间异质性。 随着发酵的进行,微生物群落真菌含量逐渐下降,细菌含量逐渐上升[2],发酵前期微生物多样性和丰富度显著高于发酵后期[3],这与微生物在发酵过程所受酸、厌氧等胁迫密不可分。在糟醅发酵过程中,厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)、子 囊 菌 门(Ascomycota)和 担 子 菌 门(Basidiomycota)是相对丰度较高的优势细菌和真菌门[2,4-5]。在发酵前期(10~15 d),受还原糖和淀粉驱动,一系列酵母菌如威克汉姆酵母属(Wickerhamomyces)、哈萨克斯坦酵母属(Kazachstania)、酵母菌属(Saccharomyces)和假丝酵母属(Candida),霉菌如青霉属(Penicillium)和曲霉属(Aspergillus)以及乳杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)、魏斯氏菌属(Weissella)和芽孢杆菌属(Bacillus)等细菌成为优势微生物[4,6]。这些微生物大部分具有糖和醇类化合物代谢功能,积极参与糖化和发酵活动。在发酵中期,发酵温度达到顶峰,乳杆菌属(Lactobacillus)、曲霉属(Aspergillus)、哈萨克斯坦酵母属(Kazachstania)和酵母菌属(Saccharomyces)等是主要优势微生物,该阶段是酒精发酵的旺盛期。 在发酵后期(30~60 d),受酸、厌氧等胁迫,大部分微生物消亡,己酸菌、丁酸菌等梭状芽孢杆菌(Clostridium)、醋酸杆菌属(Acetobacter)、乳杆菌属(Lactobacillus)、酵母菌属(Saccharomyces)和假丝酵母属(Candida)等成为绝对优势微生物[4],这些微生物大部分与水分和酸度成显著正相关,通过产酸与醇结合,生成己酸乙酯、己酸等浓香型白酒特征风味成分[7]。值得一提的是,发酵后期产酸的大部分优势细菌属均来自窖泥,由此可见,白酒的风味与窖泥质量密切相关。 在这些研究中,青霉属(Penicillium)、曲霉属(Aspergillus)和根霉属(Rhizopus)等好氧霉菌随着糟醅发酵的进行相对丰度逐渐降低,尤其是在发酵后期,此时糟醅中大部分优势菌群为耐厌氧、厌氧微生物[4-6,8]。 酵母菌属(Saccharomyces)和乳杆菌属(Lactobacillus)等微生物在整个发酵过程都是优势微生物[3,7-8],这对微生物群落的定向演变起了决定性作用。
1.2 微生物群落演替空间异质性
白酒发酵过程中,微生物群落展现出的空间分布特征,源于其对栖息地异质性的响应[9],这种环境的非均一性造成了糟醅在不同发酵位置的不同特异表型与功能属性,从而引起不同层次糟醅发酵基酒风味品质的差异[10]。因此,探究微生物群落在空间上的分布模式,成为了浓香型白酒研究的焦点之一。 根据基酒风味品质的差异,窖池内的发酵糟醅常常根据高度分为上层、中层和下层糟醅(见图1)。
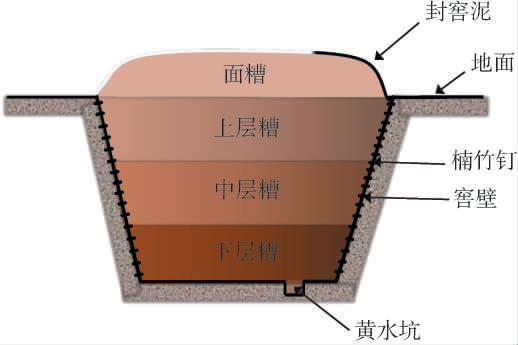
图1 糟醅的空间分布
Fig.1 Spatial distribution of the Zaopei
关于浓香型白酒糟醅发酵过程中微生物群落分布的空间异质性研究表明[3,8,11],泛菌属(Pantoea)、不动杆菌属(Acinetobacter)、克罗彭斯特菌属(Kroppenstedtia)、乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、大洋芽孢杆菌(Oceanobacillus)、葡萄球菌属(Staphylococcus)、枝芽孢杆菌属(Virgibacillus)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)、哈萨克斯坦酵母属(Kazachstania)、假丝酵母属(Candida)、德巴利酵母属(Debaryomyces)、酵母菌属(Saccharomyces)及曲霉属(Aspergillus)等微生物在不同层次糟醅的相对丰度差异是造成微生物群落分布空间异质性的主要原因。 然而,值得注意的是,乳杆菌属(Lactobacillus)、假丝酵母属(Candida)、酵母菌属(Saccharomyces)等优势微生物在糟醅发酵过程中的主导地位是普遍认同的事实,其在糟醅的不同层次上均扮演着主导角色。这表明,尽管微生物群落的空间异质性在浓香型白酒糟醅发酵过程中仍缺乏统一的解释,但主要优势微生物的构成相对稳定,不受或较少受空间位阻的影响。 从微生物多样性角度出发,胡晓龙等[3]研究指出,不同层次的糟醅微生物群落多样性变化规律相似,说明微生物生态在垂直方向上具有一定的稳定性。而汪慧慧等[8]研究则发现,下层糟醅的微生物多样性明显高于上层。这些都与高俊杰[11]研究结论相悖。这些研究说明了微生物空间分布可能受到多种因素影响的复杂性。由于微生物群落在发酵过程中具有空间异质性,导致其代谢产物在空间上具有明显差异。 上层糟醅虽然风味物质总量较少,但酸类和酯类的比例却较为均衡;中层糟醅的风味物质最为丰富,尤其是醇类、酸类和酯类的总浓度较高;而下层糟醅的己酸乙酯和己酸等浓香型特征风味成分含量最高[12-13]。在发酵过程中,随着糟醅深度的加深,酯类和酸类风味物质含量显著增加[14],尤其是中层和下层糟醅的己酸乙酯增幅显著超过上层。
2 糟醅发酵过程微生物演替的影响因子
2.1 不同原料
原料的种类和质量对浓香型白酒的品质有着直接的影响。 不同的粮食原料(如高粱、小麦、大米、糯米、玉米)会因其独特的香气活性物质而影响最终产品的风味。高粱作为主要原料制成的发酵糟醅,不仅为浓香型白酒提供了基础的淀粉来源,还影响酒体的风味和品质。 大量的研究表明,糯高粱最适合酿造优质的浓香型白酒。 在理化性质方面,糯高粱具有支链淀粉含量高、蛋白质、单宁、水分和灰分含量适宜等特点[15-17];在工艺操作方面,糯高粱具有粉碎效果更好、 润料蒸煮时间更短、 淀粉利用率更高等特点,更易被微生物分解利用[16-18];在窖池发酵过程,以糯高粱为主料制成的糟醅温度升幅缓慢,符合浓香型糟醅发酵过程温度“前缓、中挺、后缓落”的理想发酵条件[18-19];在出酒方面,其产酒率与产酒质量均显著高于粳高粱[15,17-21]。
在糟醅发酵过程,高粱等原料的质量直接影响到入窖酒醅的酸度、淀粉、水分和其他理化性质[21],造成微生物发酵环境的差异,进而影响最终产品的风味和质量。 原料决定糟醅微生物的组成,糟醅中的微生物已被多个研究证实其对风味化合物的生成有重要作用[22-25]。LIU M K等[26]通过宏基因组学、宏蛋白质组学和代谢组学技术研究了4个糯高粱品种的浓香型白酒原位发酵,发现不同品种糯高粱在糟醅发酵过程中的微生物组成和相互作用存在显著差异,这导致了其代谢途径(主要是氨基酸和碳水化合物代谢)和理化性质(pH、温度、淀粉含量、还原糖含量和水分含量)等方面都存在显著差异(P<0.05)。由此可见,不同品种高粱糟醅在发酵过程中的微生物组成差异显著,造成了风味物质的多元化代谢。 但如上所述,目前的研究多聚焦于不同高粱品种酿造时产生的理化指标差异,以及由此引发的白酒风味变化和出酒率的高低,而鲜有探讨不同原料对糟醅发酵过程中微生物组成和功能的影响。在白酒实际生产中,应通过选择适合酿造工艺的原料和优化发酵参数来提高白酒的质量。
2.2 不同季节
酿造微生物的动力学可以随季节变化[27],不同的酿造季节为微生物的生长提供了独特的气候环境,如湿度和温度,这些都间接影响了微生物的发酵环境条件。 在浓香型白酒酿造过程中,季节性差异研究在大曲发酵[28]、环境微生物[29]、糟醅发酵过程[30-31]以及基酒风味物质[32]等方向均有涉及。 研究表明[27,30,33],在糟醅发酵过程中,己酸菌属(Caproiciproducens)、甲烷短杆菌属(Methanobrevibacter)、铁还原单胞菌属(Fermentimonas)、醋酸杆菌属(Acetobacter)、泛菌属(Pantoea)、明串珠菌属(Leuconostoc)、产碱杆菌属(Alcaligenes)、酵母菌属(Saccharomyces)、复膜酵母属(Saccharomycopsis)等微生物在冬季的相对丰度较高。而在夏季,盐单胞菌属(Halomonas)、克雷伯氏菌属(Klebsiella)、葡萄球菌属(Staphylococcus)、魏斯氏菌属(Weissella)、芽孢杆菌属(Bacillus)、假丝酵母属(Candida)、毕赤酵母属(Pichia)、丝孢毕赤酵母属(Hyphopichia)、曲霉属(Aspergillus)等微生物相对丰富。 威克汉姆酵母属(Wickerhamomyces)在秋季相对丰度较为突出。 乳杆菌属(Lactobacillus)在夏季和春季的相对丰度均较高。在糟醅发酵过程中,LI L等[30]通过扩增子测序研究不同季节微生物群落的动态演替,发现季节对真菌群落的影响比对细菌群落的影响更显著,与真菌群落相比,细菌群落表现出更高的生态位宽度。 这可能归因于真菌群落的多样性较低,对季节的变化响应较大[34]。 WANG S等[27]研究发现,在浓香型糟醅发酵过程,细菌多样性在冬、夏季较高,真菌多样性在秋季较突出。这与左乾程等[35-36]对酱香型白酒糟醅发酵过程的研究结果一致,与LI L等[30,37]研究结果相反。LI L等[30]研究发现,随机过程在四个季节中都保持了它们在微生物组装中的主导地位,这说明不同季节糟醅发酵过程微生物群落演替主要受生长、死亡、迁移和物种形成等随机事件影响,生物(微生物相互作用)和非生物(环境条件)的干扰对发酵过程的影响相对较小。研究表明[30,38],pH值和环境温度是不同季节微生物群落组装的重要驱动因素,通过影响乳杆菌属(Lactobacillus)、己酸菌属(Caproiciproducens)、互营单胞菌属(Syntrophomonas)和哈萨克斯坦酵母属(Kazachstania)等关键类群的活动,促进己酸乙酯等主要挥发性风味化合物的合成[30,39]。尽管季节性变化对糟醅发酵过程微生物群落的动态演替和功能代谢产生了显著影响,但具体调控机制仍有待深入研究。这方面的探索将有助于更好地理解自然环境如何塑造微生物生态,以及如何通过调整酿造条件来优化白酒的品质和风味。
2.3 不同窖龄
浓香型白酒的生产过程一般可分为三个阶段:大曲(发酵剂)制作、窖池发酵和糟醅蒸馏[40],其主体风味主要受大曲(糖化发酵剂)、窖泥(附着在地下酒窖表面的泥浆)和糟醅(发酵谷物混合物)中发酵微生物的影响。 其中,窖泥中特有的微生物群落,是赋予浓香型白酒独特窖池风味的关键之一[41]。窖泥的微生物生态以厌氧菌为主,其中包括梭菌属(Fusobacterium)、己酸菌属(Caproiciproducens)和异单胞菌属(Heteromonas)等,这些菌在浓香型白酒的风味形成中扮演着重要角色[42-43]。梭菌属(Fusobacterium)以其合成短链及中链脂肪酸(如丁酸和己酸)的能力而闻名[44-45]。 己酸菌属(Caproiciproducens)和沉积菌属(Sedimentibacter)等微生物能合成丰富的直链醇和挥发性酸,这些物质是酯类形成的基础,对酒的香气至关重要。窖池的年龄或称窖龄,对窖泥内的微生物群落结构、理化性质以及最终酒体的风味成分有着显著影响。 相较于新窖泥,老窖泥通常具有更高的pH值、铵态氮、K+和乙酸含量,而新窖泥则含有较高的乙醇、丙酸、乳酸和己酸乙酯等风味物质含量[46]。
多项研究一致指出,在浓香型白酒的酿造过程中,无论是新建窖池还是历史悠久的老窖池,乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、曲霉属(Aspergillus)以及酵母菌属(Saccharomyces)等微生物始终占据主导地位。 这一发现与先前关于窖池微生物群落时空动态特性的研究相吻合,证实了即便窖池的使用年限不同,参与酿造浓香型白酒核心风味的微生物种类保持相对稳定。窖龄虽然对微生物群落的具体组成有一定影响,但其更显著的作用在于提升白酒的风味品质,而非改变主体风味形成的基本物种组成。研究显示[47-49],老窖池与新窖池在糟醅发酵期间所展现的细菌和真菌多样性呈现鲜明对比,老窖池的微生物多样性通常较低,但功能微生物的相对含量却有所提高。这一现象可归因于窖龄的影响——随着时间的积累,窖泥中的微生物群落经历了自然选择和进化,最终形成了一个更为专一且高效的功能微生物生态[50-51]。邱显平等[47]在老窖池糟醅发酵过程发现曲霉属(Aspergillus)、哈萨克斯坦酵母属(Kazachstania)以及嗜热子囊菌属(Thermoascus)的相对丰度显著增高,而新窖池则以酿酒酵母为主。 这种差异可能反映了新窖池较高的酒精产量与老窖池更协调的风味之间的权衡关系。 GUAN T等[48]研究发现,老窖池糟醅发酵过程微生物群落的演替进程较为缓慢,这或许是因为老窖池提供了更加温和的发酵环境(如稳定的温度条件等)。XU S等[49]研究发现,老窖池的糟醅能够迅速消耗早期的淀粉和还原糖,进而产生更高的乙醇含量,而新窖池糟醅则表现出较高的酸度,这一发现与王思浓等[52]的研究结果相佐。 相关性网络分析进一步证明,老窖池糟醅发酵过程中微生物群落结构具有更高的聚集度、复杂性和稳定性[47-48]。目前已有的对新老窖池的研究聚焦在窖泥、窖池环境微生物以及基酒风味的差异上[51,53-56],对新老窖池糟醅发酵过程的深入探讨尚显不足,尤其是关于不同窖龄对白酒品质具体影响机制的理解仍待深化。 未来的研究方向应着重于阐明新老窖池间微生物活动差异如何直接作用于白酒品质,从而为传统酿造技术的科学化提供理论支持。
3 糟醅发酵过程的创新研究进展
3.1 微生物群落组装机制
目前对浓香型白酒糟醅发酵过程的研究正在不断深化,研究者们已逐渐向发酵过程微生物群落的组装机制等方面进行深度研究。微生物群落聚集过程主要由确定性和随机性过程主导,而确定性过程和随机性过程涉及到生态学中的多个理论,包括生态位理论和中性理论。 确定性过程通常指的是那些由环境因素和群落内部相互作用所驱动的、可预测的群落变化过程。 如白酒发酵过程中,某些关键微生物的存在和活动是群落功能和稳定性的驱动因素[57-60]。随机性过程则涉及那些不可预测的、随机发生的群落变化,如随机事件导致的微生物死亡或新物种的迁入。
在浓香型白酒糟醅发酵的过程中,LI L等[30,61-62]研究发现,微生物群落的演变和聚集主要由随机过程所驱动。 这一观点强调了生态漂移、均匀质扩散和扩散限制等随机事件在塑造微生物群落结构和动态变化中的核心作用。值得注意的是,这与YUAN S K等[63]的部分研究结论相反,后者提出糟醅发酵过程中,细菌群落的形成体现为随机性,而真菌群落的组装则受到氨基酸代谢的驱动,表现出一定的确定性。 WEI J L等[62]进一步研究阐明随机过程在引导关键分类群(如曲霉属(Aspergillus)、魏斯氏菌属(Weissella)、嗜热子囊菌属(Thermoascus)等)的组装方面起到了关键作用,这些微生物的活动直接影响了微生物生态网络内的相互作用以及风味物质的代谢谱。研究中反复出现的一个共通点是糟醅发酵过程中的细菌群落动态变化主要受随机过程的支配。 这可能源于细菌群落有更高的多样性,使其具备了更强的环境适应能力和代谢灵活性。 相比之下,真菌群落的多样性较低,可能更容易受到特定环境条件和代谢途径的影响。 深入了解微生物群落的聚集过程,对于揭示生物和非生物因素如何影响糟醅微生物生态系统,以及微生物间的动态演替和相互作用机制具有重要意义。
3.2 不同丰度微生物的共存与贡献
在发酵糟醅的微生物生态中,根据相对丰度的不同,操作分类单元(operational taxonomic units,OTUs)被区分为稀有分类群和丰富分类群,前者指那些相对丰度<0.1%的微生物,而后者则是相对丰度≥0.1%的微生物群体[64-66]。然而,物种的丰富度并非是衡量其对群落贡献的最佳标准[67]。 稀有类群尽管数量上处于劣势,却如同微生物生态系统的“种子库”,对维护生态平衡和系统功能的完整性发挥着不可或缺的作用[68]。
在中国浓香型白酒发酵过程中,糟醅内丰富菌群和稀有菌群的繁殖模式呈现出显著差异[69]。酿造微生态系统中,微生物群落的丰度分布往往呈现偏斜状态,很少有丰富物种与大量的稀有物种共存[68,70]。研究表明,稀有类群相较于丰富类群,对环境变化更为敏感[66],尽管数量上不占优势,但稀有菌群作为发酵过程的关键类群[71],是推动微生物群落组成和功能变化的主要驱动力[60,72]。在发酵环境中,具有较大生物量或参与重大能量转换的丰富类群,如参与反硝化或有机物分解的微生物,对广泛的生态过程产生影响。相比之下,当某一过程较为“狭窄”,即由单一或特定步骤组成时,如固氮、氨氧化等,则很可能由低丰度的微生物群落主导[73-74]。 因此,在白酒糟醅发酵过程中,探索稀有类群对特定、简单代谢途径的潜在影响力,是一个值得深入研究的议题。
深入研究稀有菌群,不仅可以增进人们对物种共存机制的理解,包括生态位分化等稳定机制以及中性理论框架下的均等化机制,还有助于揭示白酒酿造过程中微生物生态学的未解之谜。尽管目前对稀有类群在大曲和发酵过程中的作用已有初步探索,但对其在白酒酿造中详细的生态功能和作用机制的认识仍有待进一步深化。
3.3 微生物相互作用及其对风味物质合成机制的影响
多菌协同发酵是白酒等传统酿造食品生产工艺的典型特色,也是其丰富的风味物质形成的关键所在。 SUN H等[1]通过转录组学等方法深入探讨了老窖互营球菌(Novisyntrophococcus fermenticellae)JN500902(N.902)和老窖梭菌(Clostridium fermenticellae)JN500901(C.901)之间的交互作用机制。研究发现,在共培养体系中,C.901产生的甲酸可被N.902通过还原性乙酰辅酶A途径利用,促进乙酸的生成。 随后,乙酸又被C.901通过逆β-氧化途径利用,这一系列的代谢过程促进了丁酸和己酸的积累,从而丰富了白酒的风味。 LIU T等[75]采用高通量多组学测序技术阐明了甲醇的代谢途径和相关微生物。发现在发酵前期,毕赤酵母属(Pichia)、丝衣霉菌属(Byssochlamys)、青霉属(Penicillium)和曲霉属(Aspergillus)等微生物通过参与丁酸盐和甲烷代谢途径以及果胶降解模块,对甲醇的含量起到了调节作用。FAN J Y等[76]通过宏转录组测序技术揭示了浓香型白酒发酵过程中乳酸合成途径与发酵体系含氧量之间的关联。具体而言,在有氧发酵初期,特定的微生物群如Acetobacter malorum、Acetobacter oryzoeni、Acetobacter pasteurianus、Komagataeibacter xylinus、Pichia membranifaciens 和Saccharomyces cerevisiae通过氮代谢途径合成D-乳酸。而在厌氧发酵后期,Lactobacillus diolivorans和Lactobacillus ozensis则通过异型乳酸发酵途径,以碳源为底物合成D-乳酸,其中L.ozensis的异型乳酸发酵是浓香型白酒发酵过程中乳酸生成的主要途径。
当前,关于浓香型白酒糟醅发酵过程的研究虽广泛,但大多都停留在表面,缺乏对微生物相互作用和风味物质具体合成机制的深入探究。 因此,深入剖析糟醅发酵过程中微生物之间的作用机制、代谢途径以及风味物质的合成机制,对于调控和优化发酵过程,进而提高白酒的质量和产量,具有至关重要的意义。
4 结论与展望
目前对浓香型白酒糟醅发酵过程的研究主要从传统酿造工艺的角度出发,解析微生物群落的动态演替规律及其背后的驱动因素。本文综述了浓香型白酒糟醅发酵过程中微生物群落演变的时空异质性,以及微生物群落在不同季节、原料和窖龄下的动态变化规律。原料、季节和窖龄等因素通过各自的方式影响糟醅中的微生物生态,进而影响发酵进程。原料的差异对糟醅中原有微生物的组成产生影响;季节变化则通过改变入窖条件和发酵环境来影响微生物的演替;不同窖龄的窖池因窖泥质量的差异,对糟醅发酵过程产生影响。 此外,还总结了近年来在糟醅发酵过程微生物群落组装机制、丰度分类及风味物质合成机制方面的创新研究成果,以期为浓香型白酒糟醅发酵过程的优化与调控提供新的视角和方法。
未来的研究应综合运用宏基因组学、宏蛋白组学和宏转录组学等前沿技术,并结合系统生物学的方法,从微观层面深入理解糟醅原料差异、季节变化、窖龄等变量对微生物生态组成和功能的影响,明确糟醅发酵过程中稀有菌群的具体生态功能和微生物相互作用及其对风味物质合成机制的影响。此外,近年来,随着科技的飞速发展和消费者需求的多样化,浓香型白酒也逐步迈入了机械化、智能化生产阶段。尽管已有研究探讨了传统酿造与机械化酿造环境下微生物群落、糟醅品质及基酒风味的差异,但受限于发酵过程中众多复杂变量的影响,对于这两种酿造方式下糟醅发酵过程微生物群落演替的差异,以及由此导致的风味物质具体差异的研究尚处于起步阶段。通过这些研究方向的深入探讨,不仅能够提升浓香型白酒的品质和产量,还能为白酒酿造工艺的现代化和科学化提供坚实的理论依据与技术支持。
[1]SUN H,CHAI L J,FANG G Y,et al.Metabolite-based mutualistic interaction between two novel Clostridial species from pit mud enhances butyrate and caproate production[J].Appl Environ Microbiol,2022,88(13):e0048422-e.
[2]胡晓龙,田瑞杰,李保坤,等.基于宏转录组学技术解析浓香型酒醅活性微生物群落结构及功能变化特征[J].食品科学,2022,43(10):124-132.
[3]胡晓龙,王康丽,余苗,等.浓香型酒醅微生物菌群演替规律及其空间异质性[J].食品与发酵工业,2020,46(10):66-73.
[4]曾波,饶家权,邹永芳,等.浓香型白酒酒醅发酵过程中微生物群落结构演替及其与理化指标相关性[J].食品科学,2024,45(7):111-118.
[5]宋建阳,梁莉莹,岑定运,等.浓香型白酒发酵过程中酒醅微生物群落结构解析及其与风味物质的相关性[J].食品研究与开发,2023,44(14):86-92.
[6]韩兴林,崔磊,常强,等.浓香白酒发酵过程中酒醅微生物结构分析[J].酿酒,2021,48(1):81-86.
[7]高江婧,任聪,刘国英,等.浓香型白酒酒醅风味物质和微生物菌群结构随发酵时间的变化规律[J].食品与发酵工业,2019,45(20):1-6.
[8]汪慧慧,高俊杰,李庆腾,等.浓香型酒醅发酵过程中真核微生物群落的研究[J].食品科技,2022,47(8):14-20.
[9]YANG L, CHEN R, LIU C, et al.Spatiotemporal accumulation differences of volatile compounds and bacteria metabolizing pickle like odor compounds during stacking fermentation of Maotai-flavor Baijiu[J].Food Chem,2023,426:136668.
[10]YANG L,FAN W,XU Y.Chameleon-like microbes promote microecological differentiation of Daqu[J].Food Microbiol,2023,109:104144.
[11]高俊杰.浓香型酒醅发酵过程中挥发性风味物质及细菌菌群结构的动态变化研究[D].济南:齐鲁工业大学,2023.
[12]卫春会,郑自强,李浩,等.浓香型白酒酒醅发酵过程中风味物质时空差异分析[J].食品与发酵工业,2022,48(5):240-246.
[13]王乐,魏功,郭逸臻,等.北方浓香型白酒发酵过程中不同空间层次糟醅理化指标及风味物质的变化[J].中国酿造,2024,43(3):63-71.
[14]雷学俊,杨康卓,张建敏,等.多粮浓香型白酒糟醅中香气成分的空间分布规律[J].食品与发酵工业,2020,46(21):48-54.
[15]邓桥山,刘雅,艾欢秀.不同糯高粱酿造浓香型白酒差异研究[J].酿酒科技,2023(12):56-59.
[16]张雪瓶,罗艳平,陈波,等.不同高粱品种对浓香型白酒生产的影响研究[J].酿酒科技,2022(4):43-47.
[17]杨文斌,艾涛波,罗玥,等.三种不同产地高粱模拟浓香型白酒发酵过程中发酵特性的研究[J].食品工业科技,2019,40(14):170-173,181.
[18]肖银,项兴本,倪永培,等.不同品种高粱在浓香型白酒酿造过程中的对比研究[J].酿酒,2023,50(3):42-47.
[19]王建成,孔茂竹,谭冬,等.不同酿酒高粱理化性质及其酿造特性的对比研究[J].酿酒科技,2022(12):24-31.
[20]晁进福,徐广祥,于水见,等.不同产地(品种)高粱对浓香型大曲白酒出酒率和质量的影响研究[J].酿酒科技,2023(3):70-74,78.
[21]刘茂柯,田新惠,刘成元,等.不同品种高粱酿造浓香型白酒的香味物质组成差异及其影响因素[J].食品工业科技,2023,44(8):107-115.
[22]HU X,TIAN R,WANG K,et al.The prokaryotic community,physicochemical properties and flavors dynamics and their correlations in fermented grains for Chinese strong-flavor Baijiu production[J].Food Res Int,2021,148(1):110626.
[23]LIU C,GONG X,ZHAO G,et al.Liquor flavour is associated with the physicochemical property and microbial diversity of fermented grains in waxy and non-waxy sorghum(sorghum bicolor)during fermentation[J].Front Microbiol,2021,12:618458.
[24]QIAN W, LU Z M, CHAI L J, et al.Cooperation within the microbial consortia of fermented grains and pit mud drives organic acid synthesis in strong-flavor Baijiu production[J].Food Res Int,2021,147.
[25]WANG Z, JI X, WANG S, et al.Sugar profile regulates the microbial metabolic diversity in Chinese Baijiu fermentation[J].Int J Food Microbiol,2021,359:109426.
[26]LIU M K,TANG Y M,LIU C Y,et al.Variation in microbiological heterogeneity in Chinese strong-flavor Baijiu fermentation for four representative varieties of sorghum[J].Int J Food Microbiol,2023,397.
[27]WANG S, XIONG W, WANG Y, et al.Temperature-induced annual variation in microbial community changes and resulting metabolome shifts in a controlled fermentation system[J].mSystems,2020,5(4):00555-20.
[28]JIANG X,PENG Z,ZHU Q,et al.Exploration of seasonal fermentation differences and the possibility of flavor substances as regulatory factors in Daqu[J].Food Res Int,2023,168:112686.
[29]吕丽茹,王晓平,文静,等.浓香型白酒生产区土壤微生物群落结构的季节性变化[J].中国酿造,2022,41(2):60-68.
[30]LI L,WU J,TAO Y,et al.Seasonal dynamics of the microbial community in a strong-flavor Baijiu fermentation[J].J Sci Food Agr,2024,104(11):6605-6614.
[31]尹小满,张宿义,敖宗华,等.不同季节对浓香型白酒发酵的影响[J].酿酒科技,2014(1):51-54,58.
[32]张竞一,柴丽娟,高涛,等.不同季节浓香型白酒基酒风味物质差异分析[J].食品科学,2023,44(12):164-171.
[33]SUN W,XIAO H,PENG Q,et al.Analysis of bacterial diversity of Chinese Luzhou-flavor liquor brewed in different seasons by Illumina Miseq sequencing[J].Ann Microbiol,2016,66(3):1293-1301.
[34]ZHANG K, DELGADO-BAQUERIZO M, ZHU Y G, et al.Space is more important than season when shaping soil microbial communities at a large spatial scale[J].mSystems,2020,5(3):00783-19.
[35]LU L,ZUO Q,CHENG Y,et al.The mechanism of microbial structure and flavor characteristics in Qing-Jiang-flavor Jiupei regulated by different fermentation seasons[J].Food Chem,2024,22:101392.
[36]左乾程.不同季节清酱香型白酒发酵微生物菌群结构多样性特征解析[D].贵阳:贵州大学,2021.
[37]王石垒.气候因子对清香型白酒酿造菌群驱动机制的解析及酿造菌群合成微生物组的构建[D].无锡:江南大学,2021.
[38]KANG J,ZHENG X,YANG X,et al.Contrasting summer versus winter dynamic microbial communities and their environmental driving factors in the solid-state saccharification process of Fuyu-flavor Baijiu[J].Food Res Int,2022,154:111008.
[39]DONG W,ZENG Y,CUI Y,et al.RETRACTED:Unraveling the composition and succession of microbial community and its relationship to flavor substances during Xin-flavor Baijiu brewing[J].Int J Food Microbiol,2022,372:109679.
[40]ZHENG X W,HAN B Z.Baijiu(白酒),Chinese liquor:History,classification and manufacture[J].J Ethnic Food,2016,3(1):19-25.
[41]ZHENG J, LIANG R, ZHANG L, et al.Characterization of microbial communities in strong aromatic liquor fermentation pit muds of different ages assessed by combined DGGE and PLFA analyses[J].Food Res Int,2013,54(1):660-666.
[42]WANG H,GU Y,ZHOU W,et al.Adaptability of a caproate-producing bacterium contributes to its dominance in an anaerobic fermentation system[J].Appl Environ Microbiol,2021,87(20):AEM0120321-AEM.
[43]LIU M K, TANG Y M, GUO X J, et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Res Int,2017,102:68-76.
[44]QIN P,ZOU Y,DAI Y,et al.Characterization a novel butyric acid-producing bacterium Collinsella aerofaciens subsp.Shenzhenensis subsp.Nov[J].Microorganisms,2019,7(3):78.
[45]ZHANG H, MENG Y, WANG Y, et al.Prokaryotic communities in multidimensional bottom-pit-mud from old and young pits used for the production of Chinese strong-flavor Baijiu[J].Food Chem,2020,312:126084.
[46]张会敏,王艳丽,孟雅静,等.浓香型白酒发酵新老窖泥理化因子和原核微生物群落结构差异分析[J].食品科学,2020,41(6):207-214.
[47]邱显平,黄桥,杨静,等.浓香型白酒在新、老窖池发酵过程中酒醅微生物群落结构差异分析[J].中国酿造,2024,43(1):50-56.
[48]GUAN T,LIN Y,CHEN K,et al.Physicochemical factors affecting microbiota dynamics during traditional solid-state fermentation of chinese strong-flavor Baijiu[J].Front Microbiol,2020,11:2090.
[49]XU S,ZHANG M,XU B,et al.Microbial communities and flavor formation in the fermentation of Chinese strong-flavor Baijiu produced from old and new Zaopei[J].Food Res Int,2022,156:111162.
[50]胡斌,罗明有,王松,等.浓香型白酒糟醅细菌多样性与窖龄关联度的研究[J].酿酒科技,2022(8):30-33.
[51]WANG X J, ZHU H M, REN Z Q, et al.Characterization of microbial diversity and community structure in fermentation pit mud of different ages for production of strong-aroma Baijiu[J].Polish J Microbiol,2020,69(2):151-164.
[52]王思浓,张宿义,钟世荣,等.泸型酒新老窖池酒醅理化指标变化的分析研究[J].酿酒科技,2023(4):58-64.
[53]毕天然,黄钧,张宿义,等.不同窖龄及位置窖泥微生物群落和代谢组分的差异[J].食品与发酵工业,2022,48(2):231-237.
[54]敖灵,曾珊,沈才洪,等.不同窖龄窖池酿造浓香型基酒的风味差异分析[J].食品科学,2024,45(19):104-111.
[55]路瑞,唐云,赵亚雄,等.不同窖龄浓香型白酒基酒中高级醇含量变化规律研究[J].酿酒科技,2024(3):59-64,73.
[56]LI Y, LIU S, ZHANG S, et al.Spatiotemporal distribution of environmental microbiota in spontaneous fermentation workshop: The case of Chinese Baijiu[J].Food Res Int,2022,156:111126.
[57]MA S,LUO H,ZHAO D,et al.Environmental factors and interactions among microorganisms drive microbial community succession during fermentation of Nongxiangxing daqu[J].Bioresource Technol,2022,345:126549.
[58]TAN Y,ZHONG H,ZHAO D,et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].Int J Food Microbiol,2019,311:108350.
[59]CHEN L,QIN X,WANG G,et al.Oxygen influences spatial heterogeneity and microbial succession dynamics during Baijiu stacking process[J].Bioresource Technol,2024,403.
[60]BANERJEE S,SCHLAEPPI K,VAN DER HEIJDEN M G A.Keystone taxa as drivers of microbiome structure and functioning[J].Nat Rev Microbiol,2018,16(9):567-576.
[61]王双慧,马世源,李子健,等.酿酒酵母对浓香型白酒发酵过程中微生物群落演替的影响机制[J].食品科学,2024,45(7):103-110.
[62]WEI J L,LU J,NIE Y,et al.Amino acids drive the deterministic assembly process of fungal community and affect the flavor metabolites in Baijiu fermentation[J].Microbiol Spectrum,2023:e02640-22.
[63]YUAN S K,DU H,GZHAO D,et al.Stochastic processes drive the assembly and metabolite profiles of keystone taxa during Chinese strongflavor Baijiu fermentation[J].Microbiol spectrum,2023:e05103-22.
[64]LIU L, CHEN H, LIU M, et al.Response of the eukaryotic plankton community to the cyanobacterial biomass cycle over 6 years in two subtropical reservoirs[J].ISME J,2019,13(9):2196-2208.
[65]WANG Z, LEITE M F A, JIANG M, et al.Responses of soil rare and abundant microorganisms to recurring biotic disturbances[J].Soil Biol Biochem,2023,177:108913.
[66]SONG X, LI Z, SONG C, et al.Rare taxa as the microbial taxa more sensitive to environmental changes drive alterations of daqu microbial community structure and function[J].Food Biosci,2024,59:103983.
[67]LYNCH M D J, NEUFELD J D.Ecology and exploration of the rare biosphere[J].Nat Rev Microbiol,2015,13(4):217-229.
[68]JIA X,DINI-ANDREOTE F,FALCÃO SALLES J.Community assembly processes of the microbial rare biosphere[J].Trends Microbiol, 2018,26(9):738-747.
[69]JIAO S,LU Y.Soil pH and temperature regulate assembly processes of abundant and rare bacterial communities in agricultural ecosystems[J].Environ Microbiol,2019,22(3):1052-1065.
[70]PENG M Y, ZHANG X J, HUANG T, et al. Komagataeibacter europaeus improves community stability and function in solid-state cereal vinegar fermentation ecosystem: Non-abundant species plays important role[J].Food Res Int,2021,150:110815.
[71]DAN H,SONG X,XIANG G,et al.The response pattern of the microbial community structure and metabolic profile of Jiupei to Bacillus subtilis JP1 addition during Baijiu fermentation[J].J Sci Food Agr,2024,104(9):5021-5030.
[72]BERRY D,WIDDER S.Deciphering microbial interactions and detecting keystone species with co-occurrence networks[J].Front Microbiol,2014,5:219.
[73]SCHIMEL J P,SCHAEFFER S M.Microbial control over carbon cycling in soil[J].Front Microbiol,2012,3:348.
[74]FIERER N.Embracing the unknown: disentangling the complexities of the soil microbiome[J].Nat Rev Microbiol,2017,15(10):579-590.
[75]LIU T,CAO Q,YANG F,et al.Multi-omics analysis of the co-regulation of wood alcohol accumulation in Baijiu fermentation[J].Fermentation,2024,10(4):175.
[76]FAN J Y,CHEN J,DU G,et al.Mechanism of lactic acid synthesis during strong-flavor Baijiu fermentation revealed by transcriptomic analysis[J].Food Biosci,2024,58:103780.