酱油酿造一般要经过制曲和酱醪发酵两个阶段。制曲是米曲霉菌种不断扩大培养的过程,分为种曲制备和大曲制备两个阶段。种曲制备通常需要:试管斜面培养、锥形瓶培养和种曲机扩培[1]。大曲制备是以种曲作为起始发酵剂进一步发酵大曲曲料的过程。种曲中的孢子在曲料中充分生长繁殖时会分泌大量酶系,将原料分解为酱油中的呈味物质、芳香物质或它们的前体物质[2]。另外曲料中营养物质丰富,在米曲霉形成生长优势之前很容易污染杂菌,从而抑制米曲霉的生长,使得制曲失败或质量下降[3]。因此,品质优良的种曲,孢子萌发迅速,杂菌生长被抑制,提升了酱油的品质[4]。
麸皮是酱油酿造企业常用的种曲培养基[5],米曲霉孢子的萌发需要糖、氨基酸和无机盐等营养物质,继而吸水膨胀逐渐形成胚管,然后开始生长菌丝[6]。 文志州[7]研究表明,调整不同颗粒度的麸皮比例、豆渣粉和碳酸钠的添加量可以显著改变种曲的孢子数和孢子发芽率。 在麸皮中加入豆皮制成的种曲孢子数高[8]。不同颗粒度的麸皮营养成分和通透性有差异,优化不同颗粒度的麸皮培养基可以改善种曲夹心问题,提高种曲孢子数[5]。添加豆渣,优化培养条件可以提高孢子数[9]。调整面粉、花生粕和金属离子的比例,提高了种曲中性蛋白酶活力[10]。目前研究主要致力于提高种曲的孢子数、出芽率以及酶活力,但是针对米曲霉孢子生理状况的研究鲜见报道。本研究通过在麸皮中添加不同营养物质探究其孢子疏水性、海藻糖含量、出芽率、孢子数的方法,研究碳源、氮源和无机盐的种类及添加量对种曲质量的影响。旨在为酱油生产企业制备优质种曲提供思路,对提高企业种曲质量和酱油品质具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料米曲霉(Aspergillus oryzae)3.042:天津科技大学菌种保藏中心。
1.1.2 试剂
硫酸铵、柠檬酸氢二铵:上海泰坦科技股份有限公司;磷酸氢二钾、吐温-80:天津大茂化学试剂厂;可溶性淀粉、蒽酮、正丁醇、琼脂:北京索莱宝科技有限公司;磷酸二氢钾、氢氧化钠、葡萄糖、氯化钠:天津风船化学试剂有限公司;磷酸氢二钠、磷酸二氢钠、无水硫酸镁:天津北辰区方正试剂厂;果糖、蔗糖、胰蛋白胨、酵母浸粉:北京奥博星生物技术有限公司;香柏油:上海阿拉丁试剂有限公司;实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
豆汁斜面培养基:葡萄糖20 g/L,磷酸二氢钾1 g/L,硫酸铵0.5 g/L,用豆汁定容至1 L,pH值调整至6,加入2%的琼脂粉,加热溶解补齐水分后,分装至试管中,115 ℃高压灭菌15 min。倾斜放置,制作豆汁斜面培养基。
种曲培养基:选大片麸皮与1.1倍蒸馏水充分混匀,取40g加入500mL三角瓶,棉塞密封后,115℃高压灭菌15min。
麸皮浸汁培养基:麸皮中加入5倍蒸馏水煮沸,直至测定数值为5 BH,期间需要补水防止蒸干,高于5 BH需要加水调整至该数值,不足5 BH则需继续煮沸至该数值,纱布过滤后加入2%的琼脂粉,加热溶解补齐水分,取150 mL分装至500 mL三角瓶,115 ℃高压灭菌15 min。
平板计数琼脂(plate count agar,PCA)培养基:胰蛋白胨0.5%,酵母浸粉0.25%,葡萄糖0.1%,琼脂1.5%,蒸馏水配制,pH 6.8~7.2,115 ℃高压灭菌15 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:上海麦克林生化科技有限公司。
孢子洗脱液:NaCl 9 g/L,吐温-80 100 μL/L,115 ℃高压灭菌15 min,4 ℃保存。
磷酸缓冲液(phosphate buffer solution,PBS):NaCl 8 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.58 g/L,KH2PO4 0.27 g/L,pH为7.2~7.4,115 ℃高压灭菌15 min,4 ℃保存。
1.2 仪器与设备
ZHJH-C1115C超净工作台:上海智城分析仪器制造有限公司;ZQZY-AF8ES恒温振荡培养箱:上海知楚仪器有限公司;DSX-24L-I立式压力蒸汽灭菌锅:上海东亚压力容器有限公司;Microfuge 20高速离心机:德国贝克曼化学公司;FE20 实验室pH计:梅特勒-托利多仪器(上海)有限公司;UV-1800型紫外可见分光光度计:上海美谱达仪器有限公司;CX23光学显微镜:日本Olympus公司。
1.3 方法
1.3.1 米曲霉菌株活化
将米曲霉从甘油管中划线至豆汁培养基中,将试管置于30 ℃恒温培养箱中培养,直至米曲霉产生绿色孢子。如此活化至少2次。
1.3.2 种曲制备
在无菌环境下接种3环活化后的米曲霉孢子于种曲培养基中,均匀搅拌后于30 ℃恒温培养。18 h后出现明显结块,进行第一次摇瓶翻曲,待种曲表面再次变白结块,进行第二次摇瓶翻曲,培养72 h后收曲。
补充碳源组:分别在种曲培养基中添加葡萄糖、果糖、蔗糖、乳糖和可溶性淀粉,设置碳源添加量(以碳元素计)分别为1 g/kg、3 g/kg、5 g/kg。
补充氮源组:分别在种曲培养基中添加硫酸铵、磷酸氢二铵、柠檬酸氢二铵、硝酸钾和硝酸钠,设置氮源添加量(以氮元素计)分别为1 g/kg、3 g/kg、5 g/kg。
补充无机盐组:分别在种曲培养基中添加硫酸镁、磷酸二氢钾、磷酸二氢钠、磷酸氢二钾和磷酸氢二钠,设置添加量分别为1 g/kg、3 g/kg、5 g/kg。
1.3.3 孢子悬液制备
在超净工作台中用接种环从试管中取3环米曲霉孢子至孢子洗脱液,混匀后用血球计数板计数,用孢子洗脱液调整孢子浓度为1×107个/mL。
1.3.4 分析检测
(1)种曲孢子数测定
孢子浓度标准曲线绘制:制备孢子悬液,用血球计数板计数,调整孢子悬液的波长600 nm处吸光度值(OD600 nm)于0.2~1.0,以吸光度值(x)为横坐标,孢子数(y)为纵坐标绘制孢子浓度标准曲线,得到标准曲线回归方程为y=-1.685 08+22.036 01x,相关系数R2为0.990 11。
孢子数测定:将米曲霉孢子接种至不同碳源、氮源和无机盐的种曲培养基中制备种曲,而后制备孢子悬液。用紫外分光光度计测定波长600 nm处吸光度值(OD600 nm),并按照标准曲线回归方程计算孢子数。 另外称取5 g新鲜种曲于105 ℃干烘至恒质量,以计算每g绝干种曲的孢子数。
(2)孢子疏水性测定
参考WANG P等[11]的方法并略有修改。取孢子稀释液,离心后以无菌水洗涤沉淀两次,然后以PBS溶液重悬。 混合液在紫外分光光度计测定波长600 nm处的吸光度值A1。在混合液中加入等体积正丁醇,混匀后,静置至两相完全分离。测定下层水相在波长600 nm处的吸光度值A2。孢子疏水性计算公式如下:
(3)海藻糖测定
海藻糖含量测定方法参考LI Q等[12]并略有修改。 用洗脱液收集10 g新鲜种曲的孢子,洗涤后于105 ℃干燥至恒质量,并记录绝干状态下的孢子质量。用4 mL的0.4 mol/L三氯乙酸(trichloroacetic acid,TCA)溶液冰浴浸提绝干孢子30 min,离心收集浸提液。 加TCA继续浸提沉淀中的海藻糖,最后将两次浸提液合并。取100 μL浸提液加无菌水稀释至2 mL,加入5 mL的0.2%蒽酮-硫酸试剂,混匀后煮沸5 min,室温冷却后测定波长630 nm处的吸光度值。以吸光度值(x)为横坐标,海藻糖质量浓度(y)为纵坐标绘制海藻糖标准曲线,得到标准曲线回归方程为y=-0.006 51+0.179 88x,相关系数R2为0.995 28。按照标准曲线回归方程计算样品中海藻糖含量。
(4)孢子出芽率测定
取1 g新鲜种曲于含5个玻璃珠50 mL无菌水中,振荡5 min。取1 mL孢子悬液与9 mL无菌水混匀。用玻璃棒蘸取一滴孢子液于盖玻片上,再用玻璃棒蘸取刚加热融化的PCA培养基,以顺时针方向涂抹,使孢子液和培养基混合均匀。 将盖玻片置于血细胞计数板背面的凹槽上。 在培养皿中加入2 mL无菌水,并放两根牙签,将计数板置于牙签上。将培养皿盖上后于30 ℃条件下培养。在3 h、4 h和5 h时取出计数板在显微镜下观察,需观察计算3~5个视野。 孢子出芽率计算公式如下:
1.3.5 数据处理
所有实验均重复3次,数据采用SPSS 27.0、Origin 2023b进行分析。
2 结果与分析
2.1 不同碳源、氮源及无机盐对孢子数的影响
以麸皮为原料制备的种曲作为对照,考察在麸皮基础上增加不同碳源、氮源及无机盐对种曲中孢子数量的影响见图1。 由图1a可知,与对照相比,葡萄糖和果糖的添加量从1 g/kg升高至5 g/kg时,种曲中孢子的数量均显著增加(P<0.05)。其中,葡萄糖添加量为5 g/kg时孢子数最高,达到113.4×108个/g,比对照组提高了34%。 蔗糖和乳糖添加量>3 g/kg之后才能显著提高孢子数(P<0.05)。可溶性淀粉的添加会显著抑制米曲霉产孢(P<0.05),这与杨兰等[13]研究结果一致。刘雪[14]研究表明,黑曲霉对可溶性淀粉的利用性较差,菌体生长缓慢。

图1 不同碳源(a)、氮源(b)及无机盐(c)添加量对种曲孢子数的影响
Fig.1 Effect of different carbon sources (a), nitrogen sources (b) and inorganic salts (c) addition on spore numbers of seed koji
由图1b可知,当硫酸铵添加量从1 g/kg升高5 g/kg时,孢子数先升高再降低,硫酸铵质添加量为3 g/kg时孢子数最高,为113.5×108个/g。 当磷酸氢二铵、柠檬酸氢二铵、硝酸钠和硝酸钾为补充氮源时,种曲的孢子数显著降低。磷酸二氢钾和磷酸二氢钠能明显促进米曲霉产孢子,当添加量为3 g/kg时,孢子数最高,分别达到106.5×108个/g、104.5×108个/g,与对照相比分别提高了15%和13%。 由图1c可知,硫酸镁、磷酸氢二钾和磷酸氢二钠的添加则不利于孢子的产生。 研究发现,铵态氮比硝酸盐更有利于绿色木霉孢子的形成和生长[15]。这可能是因为铵根离子可以更快地扩散到细胞中并被快速利用所致[16]。
结果表明,葡萄糖、硫酸铵、磷酸二氢钾和磷酸二氢钠的添加可显著提升种曲的孢子数(P<0.05)。其中,葡萄糖的最佳添加量为5 g/kg,而硫酸铵、磷酸二氢钾和磷酸二氢钠的最佳添加量均为3 g/kg。
2.2 不同碳源、氮源及无机盐对种曲孢子疏水性的影响
疏水性强有助于米曲霉孢子粘附在底物上,从而更好地利用营养物质,迅速萌芽生长出菌丝[17]。以麸皮为原料制备的种曲作为对照,考察在麸皮基础上增加不同碳源、氮源及无机盐(添加量均为3 g/kg)对种曲孢子疏水性影响结果见图2。由图2可知,补充碳源组中只有可溶性淀粉的添加会降低孢子的疏水性。补充氮源组中只有硫酸铵的添加能增加孢子的疏水性。添加硫酸镁、磷酸二氢钾和磷酸二氢钠这三种无机盐也能增加孢子的疏水性。在所有营养物质中,添加葡萄糖组的疏水性最高,达到了81%,比对照组提高了12%。这可能是因为葡萄糖能促进米曲霉相关细胞壁疏水糖蛋白的合成[18]。其次硫酸铵组的疏水性为79%。柠檬酸氢二铵的疏水性最低,仅为64%。结果表明,添加葡萄糖、硫酸铵、硫酸镁、磷酸二氢钾和磷酸二氢钠(3 g/kg)可以提升种曲孢子的疏水性。
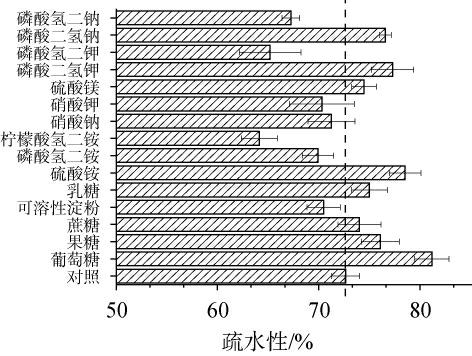
图2 不同碳源、氮源及无机盐对种曲孢子疏水性的影响
Fig.2 Effect of different carbon sources, nitrogen sources and inorganic salts on spore hydrophobicity of seed koji
2.3 不同碳源、氮源及无机盐对种曲孢子中海藻糖含量的影响
海藻糖作为一种相容性溶质,有助于孢子应对热应力、脱水、渗透压、氧化应激、pH值变化和紫外线等环境压力[19]。 另外海藻糖也是孢子的储备碳源,在萌发的初始阶段提供能量[20-21]。但是,种曲孢子中海藻糖的增多反而会阻碍其发芽。以麸皮为原料制备的种曲作为对照,考察在麸皮基础上增加不同碳源、氮源及无机盐(添加量均为3 g/kg)对海藻糖含量的影响结果见图3。由图3可知,5种碳源都能促进海藻糖的积累,其中添加葡萄糖组的种曲孢子中的海藻糖含量提高了48%,这可能是因为葡萄糖可作为底物转化为海藻糖。米曲霉合成海藻糖时首先从尿苷二磷酸葡萄糖转移葡萄糖基残基至6-磷酸葡萄糖以合成6-磷酸海藻糖,然后去磷酸化形成海藻糖[22]。在含有过量葡萄糖的培养基上霉菌产生孢子,其海藻糖含量占其干质量的25%,在限量葡萄糖的培养基上获得的种曲孢子,其海藻糖含量占干质量的1%[23]。 硫酸铵组极大地降低了孢子中海藻糖的含量,比对照组降低了48%。 添加磷酸二氢钾和磷酸二氢钠组的种曲孢子中的海藻糖下降幅度也较大。在正常生理条件下,细胞中的海藻糖含量是稳定的,当细胞处于应激状态下则会发生变化[24]。结果表明,添加硫酸铵、磷酸二氢钾和磷酸二氢钠(3 g/kg)可以最大程度地降低种曲孢子中海藻糖的含量,有利于其发芽。
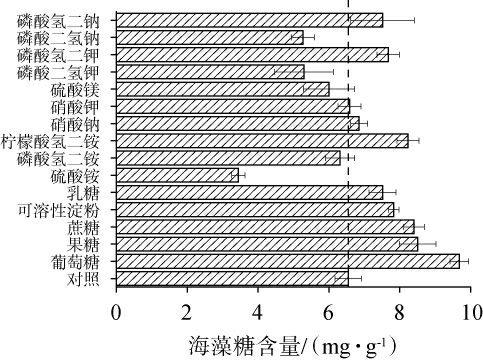
图3 不同碳源、氮源及无机盐对种曲孢子中海藻糖含量的影响
Fig.3 Effect of different carbon sources, nitrogen sources and inorganic salts on trehalose contents in seed koji spores
2.4 不同碳源、氮源及无机盐对种曲孢子出芽率的影响
以麸皮为原料制备的种曲作为对照,考察在麸皮基础上增加不同碳源、氮源及无机盐(添加量均为3 g/kg)对孢子出芽率的影响结果见图4。

图4 不同碳源(a)、氮源(b)及无机盐(c)对种曲孢子出芽率的影响
Fig.4 Effect of different carbon sources (a), nitrogen sources (b) and inorganic salts (c) on spore germination rates of koji seed
由图4a可知,在培养3 h后,含有补充碳源的5种种曲孢子出芽率都低于5%,且与对照差异不大。 培养4 h后,添加葡萄糖的种曲孢子出芽率比对照提高了8%。培养5 h后,所有组种曲的孢子几乎全部出芽。由图4b可知,培养3 h和4 h时硫酸铵组的出芽率分别为38%和95%,分别是对照组的14.9倍和2.5倍。 而添加柠檬酸氢二铵则抑制孢子出芽。由图4c可知,磷酸二氢钾显著促进孢子出芽,在培养3 h和4 h时出芽率分别为5%和85%,分别是对照的2.0倍和2.2倍。其次是磷酸二氢钠组,在培养3 h和4 h时分别是对照的1.5倍和2.0倍。 而磷酸氢二钾组和磷酸氢二钠组在培养5 h后孢子出芽率才都达到86%。磷酸氢二钾和磷酸二氢钠不利于米曲霉生长,导致米曲霉产孢下降,为应对胁迫孢子中积累了大量海藻糖,反而抑制了发芽[25]。另外,磷酸氢二钾组和磷酸氢二钠组的种曲孢子的疏水性也较低,孢子对营养基质的粘附力差,孢子的萌芽缓慢,出芽率较低。 结果表明,添加硫酸铵、磷酸二氢钾和磷酸二氢钠(3 g/kg)可以提升种曲孢子的出芽率。
3 结论
本研究考察了在麸皮中添加不同种类和浓度的营养物质对种曲质量的影响。 结果表明,葡萄糖可以提高米曲霉产孢量、疏水性和海藻糖含量,添加5 g/kg的葡萄糖(以碳元素计)可使种曲中的孢子数提高34%。硫酸铵、磷酸二氢钾和磷酸二氢钠可以提高种曲的孢子数、疏水性和出芽率,添加3 g/kg硫酸铵,种曲孢子数提高23%,出芽率提高15倍;添加3 g/kg磷酸二氢钾,种曲孢子数提高15%,出芽率提高2倍;添加3 g/kg磷酸二氢钠,种曲孢子数提高13%,出芽率提高1.5~2.0倍。 本研究有助于酱油生产企业的稳定、优质制曲,有助于提升酱油生产企业的原油品质,为中国酱油酿造事业的发展奠定了良好的基础。
[1]包启安.酱油科学与酿造技术[M].中国轻工业出版社,2011:299-300.
[2]ITO K,MATSUYAMAA A.Koji molds for Japanese soy sauce brewing:characteristics and key enzymes[J].J Fungi,2021,7(8):658.
[3]闫景勇,刘建华,阮冲冲,等.酱油种曲四阶段培养法及其在圆盘制曲中的应用研究[J].现代食品,2023,29(15):68-72.
[4]黄佳玲,刘建华,刘艳梅,等.种曲接种量对酱油制曲及发酵的影响[J].食品安全导刊,2023(25):143-147,151.
[5]闫景勇,刘建华,董攀登,等.一种复配麸皮培养基的酱油种曲培养工艺[J].食品安全导刊,2023(22):135-139.
[6]OSHEROV N,MAY G S.The molecular mechanisms of conidial germination[J].FEMS Microbiol Lett,2001,199(2):153-160.
[7]文志州.中心组合设计在优化发酵酱种曲培养基中的应用研究[J].中国调味品,2016,41(4):117-121,125.
[8]刘建华.豆皮在酱油种曲生产工艺中的应用[J].食品工业,2022,43(11):46-49.
[9]张长贵,何绍洋,杨心懿.豆渣用于制备酱油种曲的培养研究[J].食品工业,2013,34(4):103-105.
[10]王俊,苏国万,赵谋明.产中性蛋白酶种曲培养基的优化及酶学特性研究[J].现代食品科技,2012,28(8):1002-1006,1017.
[11]WANG P,HE J,SUN Y F,et al.Display of fungal hydrophobin on the Pichia pastoris cell surface and its influence on Candida antarctica lipase B[J].Appl Microbiol Biot,2016,100(13):5883-5895.
[12]LI Q, ZHAO Y, ZHU X, et al.Antifungal efficacy of paeonol on Aspergillus flavus and its mode of action on cell walls and cell membranes[J].LWT-Food Sci Technol,2021,149:111985.
[13]杨兰,赵谋明.外加营养物对酱油种曲孢子数和成曲酶活力的影响[J].食品科学,2009,30(21):297-300.
[14]刘雪.丝状真菌Aspergillus niger A80胞外多聚物的生成特征及其对重金属(Zn、Cd和Pb)的络合效能[D].青岛:中国海洋大学,2014.
[15]JAYASWAL R K,SINGH R,LEE Y S.Influence of physiological and environmental factors on growth and sporulation of an antagonistic strain of Trichoderma viride RSR 7[J].Mycobiology,2003,31(1):36-41.
[16]LIU T,LONG X,ZHOU J P,et al.Fungistatic mechanism of ammonia against nematode-trapping fungus Arthrobotrys oligospora,and strategy for this fungus to survive ammonia[J].mSystems,2021,6(5):e0087921.
[17]CAI F,GAO R W,ZHAO Z,et al.Evolutionary compromises in fungal fitness: hydrophobins can hinder the adverse dispersal of conidiospores and challenge their survival[J].ISME J,2020,14(10):2610-2624.
[18]BOWMAN S M,FREE S J.The structure and synthesis of the fungal cell wall[J].Bioessays,2006,28(8):799-808.
[19]ELBEIN A D,PAN Y T,PASTUSZAK I,et al.New insights on trehalose:a multifunctional molecule[J].Glycobiology,2003,13(4):17R-27R.
[20]RIBEIRO G D,PARANHOS L D H, ELEUTHERIO E C A.Trehalose promotes biological fitness of fungi[J].Fungal Biol,2024,128(8 PtB):2381-2389.
[21]VAN LEEUWEN M R,KRIJGSHELD P,WYATT T T,et al.The effect of natamycin on the transcriptome of conidia of Aspergillus niger[J].Stud Mycol,2013,74(1):71-85.
[22]GANCEDO C,FLORES C L.The importance of a functional trehalose biosynthetic pathway for the life of yeasts and fungi[J].FEMS Yeast Res,2004,4(4-5):351-319.
[23]KALAMPOKIS I F,ERBAN A,AMILLIS S,et al.Untargeted metabolomics as a hypothesis-generation tool in plant protection product discovery:Highlighting the potential of trehalose and glycerol metabolism of fungal conidiospores as novel targets[J].Metabolomics,2020,16(7):1-17.
[24]JIANG C M, GE J X, HE B, et al.Transcriptomic analysis reveals Aspergillus oryzae responds to temperature stress by regulating sugar metabolism and lipid metabolism[J].Plos One,2022,17(9):e0274394.
[25]徐德峰.高活力酸性蛋白酶曲霉融合子的选育及其在酱油发酵中的初步应用[D].广州:华南理工大学,2010.