筒鲜鱼是信阳商城广受欢迎的特色菜品,肉质嫩滑鲜美,有淡淡的竹香[1]。发酵后的鱼肉,水分和灰分含量增加,水分活度降低,水分含量的升高使鱼肉内部组织更加润滑,口感更佳;水分活度的降低在一定程度上抑制细菌的生长,令食物更加稳定[2]。发酵过程中,鱼肉中的蛋白质和脂肪分别被分解为氨基酸和脂肪酸,其不仅大大提高了消化性,而且增加了人体必需的氨基酸,同时氨基酸和脂肪酸等小分子进一步降解形成发酵鱼制品的主体风味成分[3]。
鱼发酵过程中各种微生物相互作用,使得成品的风味[4]、香气[5]等得到改善。发挥作用的微生物主要分为两类:一类有助于鱼的发酵以及风味物质的生成,具体包括乳酸菌、酵母菌和霉菌等;一类对发酵鱼制品的安全构成隐患,主要包括金黄色葡萄球菌(Staphylococcus aureus)和弧菌(Vibrio)等,这些致病菌、腐败菌需在高盐、酸性、低温等条件下才能被较好抑制。但发酵不同鱼肉时,并非都在高盐、酸性、低温条件下制成,因此存在潜在危害的可能性[6]。研究表明,乳酸菌在发酵产品生产过程中,不仅发酵产生以乳酸为主的产物,还具有使产品pH值下降从而抑制有害菌等作用,且乳酸菌能在微好氧环境下代谢产生芳香物质,进而促进食品特殊风味的生成。 此外,邹文广[7]研究发现,乳酸菌还可以促进生物体对营养物质的吸收。各类发酵鱼中的优势菌株均为乳酸菌,如酸鱼中的乳酸菌主要是植物乳植杆菌(Lactiplantibacillus plantarum)、戊糖片球菌(Pedio coccus pentosaceus)、乳酸片球菌(Pediococeus acidilaetici)和链球菌(Streptococcus)[8];臭鳜鱼中的乳酸菌主要是弯曲乳杆菌(Latilactobacillus curvatus)和干酪乳杆菌(Lactobacillus casei)等[9];盐干带鱼中的乳酸菌主要是L.plantarum和短乳杆菌(Lactobacillus brevis)等[10],可见各类发酵鱼中乳酸菌多为乳杆菌属。近几年人们越来越注重发酵鱼中乳酸菌的应用,目前,多数研究主要集中在菌群组成和发酵特性方面[11],而对发酵鱼中优势菌株的生长特性、益生特性等鲜见报道。
在鱼发酵过程中,菌落总数和乳酸菌的数量都在不断变化[12],为确保分离出整个过程优势的乳酸菌,本研究以信阳发酵5 d、10 d和15 d的筒鲜鱼样品为分离源,采用稀释涂布和划线分离法分离纯化乳酸菌,并进行形态学观察。通过肉制品发酵剂的筛选标准筛选优良乳酸菌,将筛选后的优良菌株进行16S rDNA序列分析,确定其种属,再对其生长及产酸特性进行研究,为筒鲜鱼的标准化量产和品质控制奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
发酵5 d、10 d和15 d的筒鲜鱼样品:河南省信阳市商城县大别山农贸市场夏记筒鲜鱼。
金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli):商城北纳创联生物科技有限公司。
1.1.2 试剂
葡萄糖、亚硝酸钠、吐温80:天津市科密欧化学试剂有限公司;K2HPO4、MgSO4·7H2O、MnSO4·4H2O:天津市博迪化工有限公司;柠檬酸氢二铵:中国医药集团上海化学试剂公司;琼脂:天津市巴斯夫化工有限公司;溴甲酚紫:天津基准化学试剂有限公司;胰蛋白胨:北京奥博星生物技术有限责任公司;酵母膏:北京奥博星生物技术有限责任公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、琼脂糖:北京索莱宝科技有限公司;本研究所用试剂均为分析纯或生化试剂。
1.1.3 培养基
MRS液体培养基:参照文献[12]的方法配制。MRS固体培养基:在MRS液体培养基中添加1.5%琼脂粉。
淀粉水解培养基[13]:牛肉膏5 g/L,蛋白胨10 g/L,氯化钠5 g/L,可溶性淀粉2 g/L,琼脂20 g/L,pH 7.0±0.2。
氨基酸脱羧酶培养基[14]:蛋白胨5 g/L,酵母膏3 g/L,葡萄糖1 g/L,16 g/L溴甲酚紫乙醇溶液1 mL/L,L-氨基酸5 g/L或DL-氨基酸10 g/L,pH 6.8。
糖发酵产气培养基:参照文献[15]的方法配制。
营养琼脂培养基[16]:胰蛋白胨10 g,牛肉膏3 g,氯化钠3 g,琼脂18 g,pH 7.0±0.2。
以上培养基均在115 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
LDZM-8OL-III高压灭菌锅:上海申安医疗器械厂;SWCJ-1D生化培养箱、LDZM-8OL-III pH计、SW-CJ-1D超净工作台:上海尚道仪器制造有限公司;BM-220电子天平:启东友铭衡器有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪:德国BIOMETRA;BCD-452WDPF冰箱:青岛海尔股份有限公司;DYY-8C电泳仪:北京市六一仪器厂;JYC-21ES55C电磁炉:杭州九阳生活电器有限公司;GC9800紫外分光光度计:上海科创色谱仪器有限公司;TG16离心机:常州荣华仪器制造有限公司。
1.3 方法
1.3.1 乳酸菌菌株的分离纯化
依据GB/T 9695.19—2008《肉与肉制品 取样方法》,取发酵5 d、10 d和15 d的筒鲜鱼样品各10 g,用消毒之后的剪刀将鱼肉切成小块,再加到含90 mL无菌水的三角瓶中(内含5颗玻璃珠),30 ℃、160 r/min条件下培养30 min,采用无菌水按10倍梯度稀释至10-7。取稀释度为10-5、10-6、10-7的样品150 μL涂布到含有2%碳酸钙的MRS固体培养基上,30 ℃培养36 h,选取菌落30~300之间,分离较好、有代表性的单菌落的平板挑取单菌落,划线分离3次,将分离后的单菌落划线到MRS固体培养基中,30 ℃条件下培养36 h后置于4 ℃冰箱贮存备用。
1.3.2 乳酸菌菌株的筛选
将分离得到的菌株划线接种于MRS固体培养基,30 ℃条件下培养36 h,观察菌株的菌落大小、颜色、湿润度、边缘整齐度等形态特征,并参考《伯杰氏细菌鉴定手册》[17]对菌株进行革兰氏染色、接触酶检验,于100倍油镜下观察菌株的染色结果和细胞形态[18]。
1.3.3 优良乳酸菌菌株的筛选
参考赵德畅等[2,14,19-20]的方法对乳酸菌菌株进行生理生化试验,包括产粘试验、糖发酵产气试验、氨基酸脱羧酶试验、淀粉水解试验、耐NaCl试验、耐亚硝酸盐试验和抑菌试验,筛选优良乳酸菌菌株。
筛选标准采用罗靓芷等[21]的方法略作调整:在肉制品发酵生产过程中,乳酸菌能够耐受6%NaCl和150 mg/kg NaNO2环境、不产粘液、发酵糖类不产气、L-赖氨酸、L-组氨酸和L-精氨酸氨基酸脱羧酶活性阴性、能有效抑制大肠杆菌和金黄色葡萄球菌。
1.3.4 分子生物学鉴定
采用李燕等[12,22]的方法,略作调整:采用细菌基因组DNA提取试剂盒提取优良乳酸菌菌株的基因组DNA,以其为模板,采用引物27F(5'-GAGAGTTTGATCCTGGCTCAG-3')和1492R(5'-CTACGGCTACCTTGTTACGA-3')PCR扩增16S rDNA基因序列。PCR扩增体系:2×ES-Taq-Master Mix 10 μL,27F(10 μmol/L)1 μL,1492R(10 μmol/L)1 μL,基因组DNA模板1 μL,双蒸水(ddH2O)7 μL。PCR扩增程序:95 ℃预变性4 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,共循环36次;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,委托华大基因科技有限公司进行测序。 将测序得到的结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,利用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行比对。选取同源性较高的模式菌株的16S rDNA基因序列,使用MEGA11软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.5 优良乳酸菌菌株的生长及产酸特性研究
生长曲线的测定[23]:将筛选并保存的优良乳酸菌菌株接种于5 mL MRS液体培养基中,30 ℃、200 r/min条件下培养至OD600nm值为1.0左右;按1%(V/V)的接种量接种至MRS液体培养基,30 ℃、150 r/min条件下培养24 h。每隔2 h取样,使用紫外分光光度计测定菌液在波长600 nm处的吸光度值(OD600nm值),以培养时间为横坐标,OD600 nm值为纵坐标,绘制生长曲线。
产酸曲线的测定:按1%(V/V)的接种量接种至MRS液体培养基,30 ℃、150 r/min条件下培养24 h。每隔2 h取样,使用pH计测定菌液的pH值,以培养时间为横坐标,pH值为纵坐标,绘制产酸曲线。
1.3.6 数据处理
使用Excel 2019处理数据,采用SPSS 27进行显著性检验,采用Origin 22制作图表。
2 结果与分析
2.1 乳酸菌菌株的分离纯化及筛选
从发酵5 d、10 d和15 d的筒鲜鱼样品中共分离纯化得到19株形态差异较大的单菌落,编号分别为L5-1~L5-4、L10-5~L10-8、L15-9~L15-19,其中菌株L10-6、L15-12、L15-13、L15-14、L15-17、L15-18和L15-19的接触酶试验结果均呈阳性,确定这7株菌株不是乳酸菌[24]。进一步对12株菌株进行革兰氏染色,观察菌株的细胞形态。12株菌菌株的形态学特征见图1。
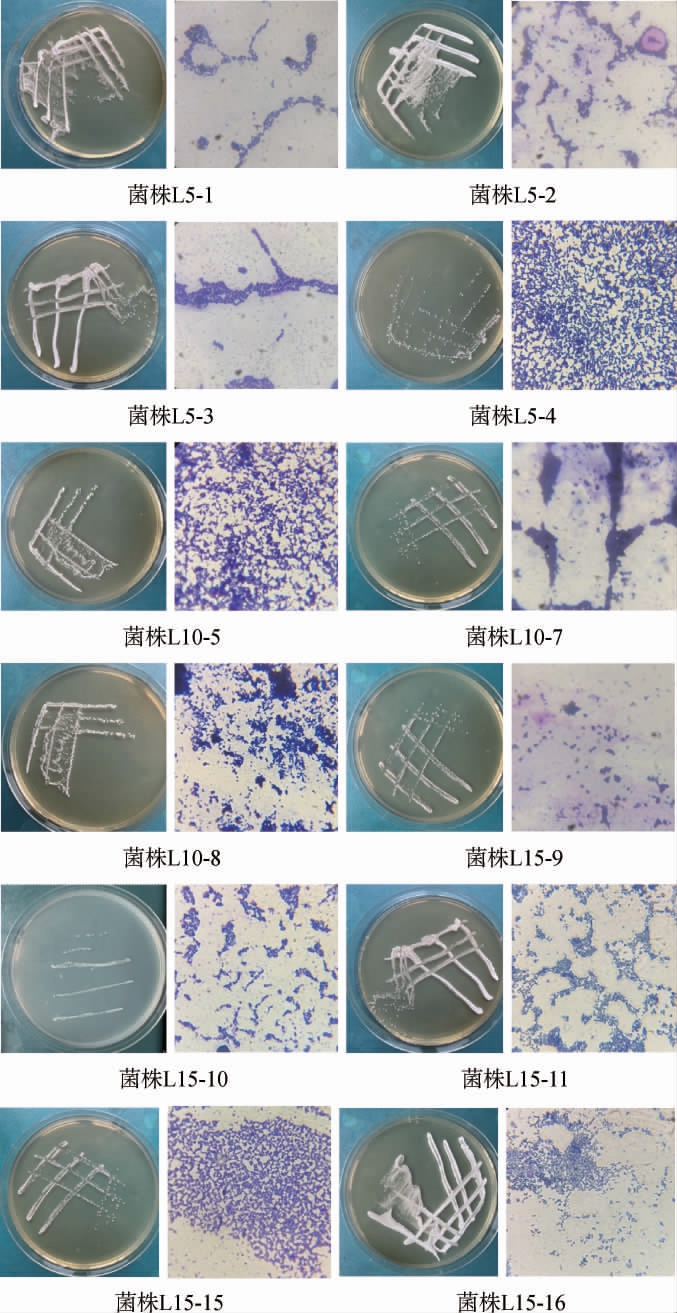
图1 12株乳酸菌菌株的形态学特征
Fig.1 Morphological characteristics of 12 strains of lactic acid bacteria
由图1可知,12株菌株的菌落直径均<2 mm,呈圆形、规则、湿润或较湿润、乳白色、表面光滑;革兰氏染色结果均呈蓝紫色,均为革兰氏阳性菌株,细胞呈球状、链球状或杆状。因此,初步鉴定这12株菌株为乳酸菌菌株。
2.2 优良乳酸菌菌株的筛选
2.2.1 产粘性试验
12株乳酸菌菌株的产粘性试验结果见表1。由表1可知,12株菌株均不产粘。
表1 12株乳酸菌菌株的产粘性试验结果
Table 1 Viscosity test results of 12 strains of lactic acid bacteria

注:“-”表示不产粘。
菌株编号 L5-1 L5-2 L5-3 L5-4 L10-5 L10-7 L10-8 L15-9 L15-10 L15-11 L15-15 L15-16结果 - - - - - - - - - - - -?
2.2.2 糖发酵产气试验
乳酸菌通过糖酵解途径产生乳酸,不产生气体[25],因此,对12株乳酸菌菌株进行糖发酵试验,结果见表2。由表2可知,12株乳酸菌菌株均能发酵麦芽糖、葡萄糖、乳糖和蔗糖,但均不产气。
表2 12株乳酸菌菌株的糖发酵产气试验结果
Table 2 Sugar fermentation with gas production tests results of 12 strains of lactic acid bacteria
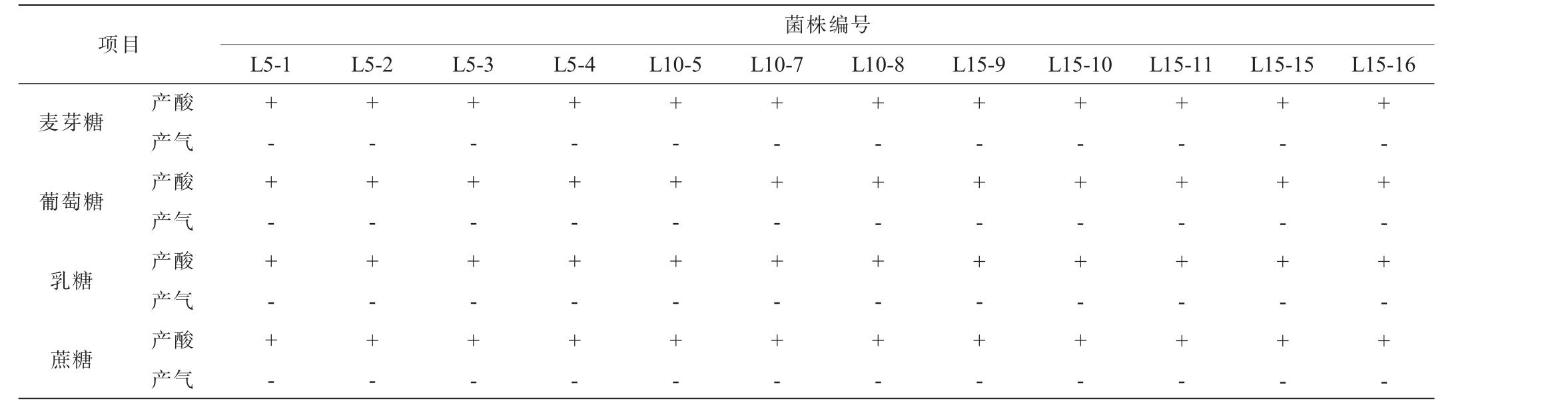
注:“+”表示产酸,“-”表示不产气。
项目菌株编号L5-1 L5-2 L5-3 L5-4 L10-5 L10-7 L10-8 L15-9 L15-10 L15-11 L15-15 L15-16麦芽糖葡萄糖乳糖蔗糖产酸产气产酸产气产酸产气产酸产气+- + - + - + -+- + - + - + -+- + - + - + -+- + - + - + -+- + - + - + -+- + - + - + -+- + - + - + -+- + - + - + -+- + - + - + -+- + - + - + -+- + - + - + -+- + - + - + -
2.2.3 氨基酸脱羧酶试验
微生物在pH值较低并且养分不足的生长条件下,为保证基础生长环境,会利用氨基酸产生碱性活性物质生物胺以提高生长环境的pH[26]。对人体健康威胁较大的组胺、腐胺和尸胺的前体物质分别为组氨酸、精氨酸与赖氨酸[27]。因此,对12株乳酸菌菌株的这3种氨基酸脱羧酶活性进行检测,结果见表3。由表3可知,除菌株L15-16的L-精氨酸脱羧酶试验结果呈阳性外,其他菌株的氨基酸脱羧酶试验结果均呈阴性。
表3 12株乳酸菌菌株的氨基酸脱羧酶试验结果
Table 3 Amino acid decarboxylase test results of 12 strains of lactic acid bacteria
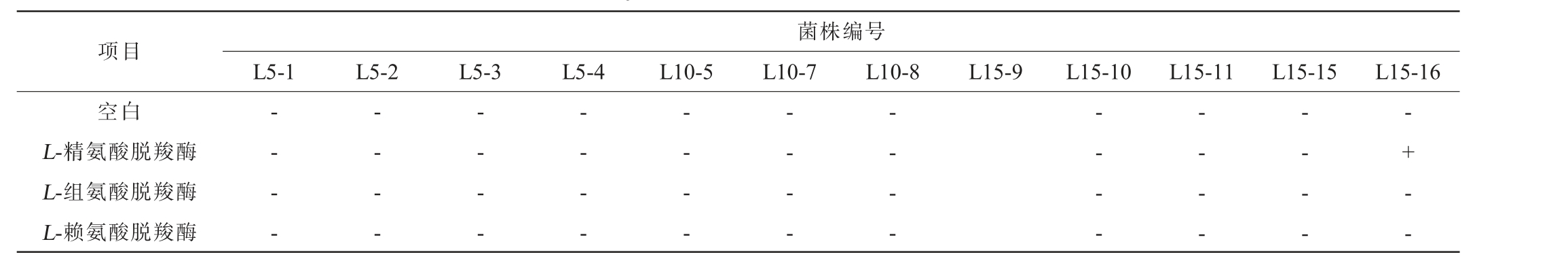
注:“+”表示试验结果呈阳性,“-”表示试验结果呈阴性。
项目菌株编号L5-1 L5-2 L5-3 L5-4 L10-5 L10-7 L10-8 L15-9 L15-10 L15-11 L15-15 L15-16空白L-精氨酸脱羧酶L-组氨酸脱羧酶L-赖氨酸脱羧酶-- - --- - --- - --- - --- - --- - --- - --- - --- - --- - --+ - -
2.2.4 淀粉水解试验
乳酸菌在淀粉培养基中生长一段时间后,培养基中的葡萄糖含量降低,不能满足菌体的生长需求,此条件下部分乳酸菌便被诱导分泌出淀粉酶,水解淀粉,为自身生长提供足够能源,保障自身生长繁殖[28]。12株乳酸菌菌株的淀粉水解能力(48 h)见表4。 由表4可知,12株乳酸菌菌株均能不同程度水解淀粉,其中,菌株L5-1、L5-2、L10-7、L10-8、L15-9、L15-16对淀粉的水解能力较好,水解圈直径均>10 mm。
表4 12株菌株的淀粉水解试验结果
Table 4 Starch hydrolysis test results of 12 strains of lactic acid bacteria
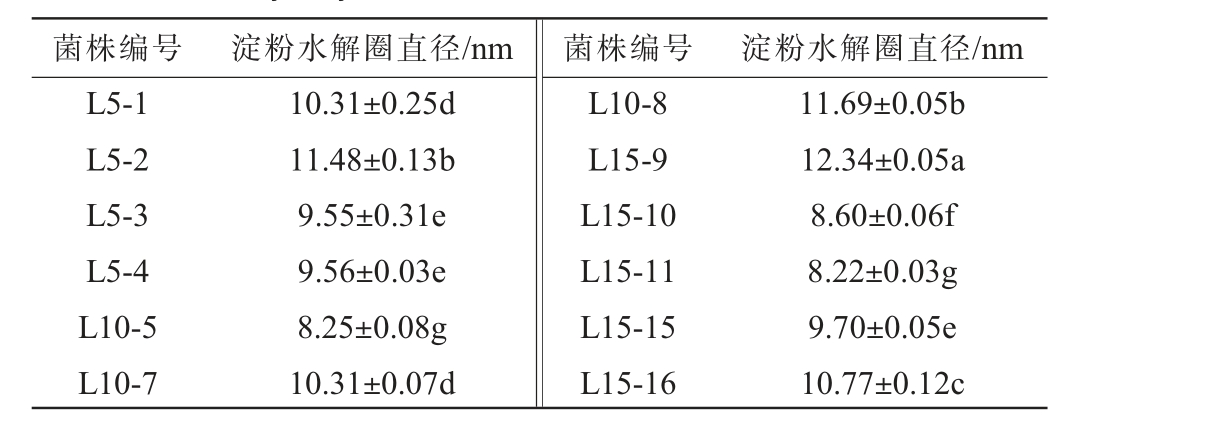
注:同列肩不同字母表示差异显著(P<0.05)。 下同。
菌株编号L5-1 L5-2 L5-3 L5-4 L10-5 L10-7淀粉水解圈直径/nm 菌株编号 淀粉水解圈直径/nm 10.31±0.25d 11.48±0.13b 9.55±0.31e 9.56±0.03e 8.25±0.08g 10.31±0.07d L10-8 L15-9 L15-10 L15-11 L15-15 L15-16 11.69±0.05b 12.34±0.05a 8.60±0.06f 8.22±0.03g 9.70±0.05e 10.77±0.12c
2.2.5 耐NaCl试验
12株乳酸菌菌株对不同NaCl含量的耐受能力见图2。由图2可知,随着培养基中NaCl含量升高,12株菌株的OD600 nm值均逐渐减小,生长均受到一定抑制。 其中,菌株L5-3、L10-8、L15-9在6%NaCl条件下依旧长势良好,说明这3株菌株对NaCl的耐受性较好。
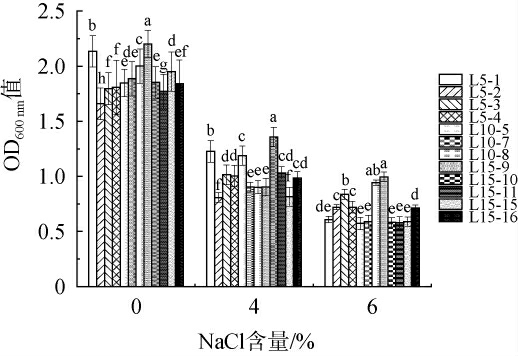
图2 不同NaCl含量对12株乳酸菌菌株生长的影响
Fig.2 Effect of different NaCl contents on the growth of 12 strains of lactic acid bacteria
2.2.6 耐亚硝酸盐试验
12株乳酸菌菌株对不同质量浓度NaNO2的耐受能力见图3。由图3可知,随着NaNO2质量浓度的升高,12株菌株的OD600nm值均逐渐减小,说明生长均受到一定抑制,其中,菌株L5-2、L10-8、L15-9在质量浓度为150 mg/kg的NaNO2的条件下OD600nm值较高,表明这3株菌耐NaNO2能力较强。
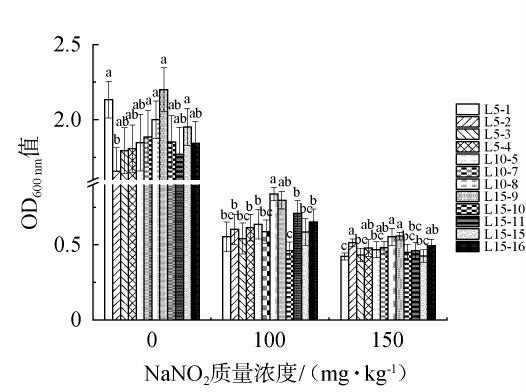
图3 不同NaNO2质量浓度对12株乳酸菌菌株生长的影响
Fig.3 Effect of different NaNO2 contents on the growth of 12 strains of lactic acid bacteria
2.2.7 抑菌试验
12株乳酸菌菌株对金黄色葡萄球菌和大肠杆菌的抑菌效果见表5。 由表5可知,12株乳酸菌菌株对金黄色葡萄球菌和大肠杆菌均有明显的抑制效果,且对金黄色葡萄球菌的抑制效果整体优于大肠杆菌。 其中,菌株L5-1、L15-9抑制金黄色葡萄球菌能力较为突出,菌株L10-8、L15-9抑制大肠杆菌能力较为突出。
表5 12株乳酸菌菌株的抑菌性能
Table 5 Antibacterial performance of 12 strains of lactic acid bacteria
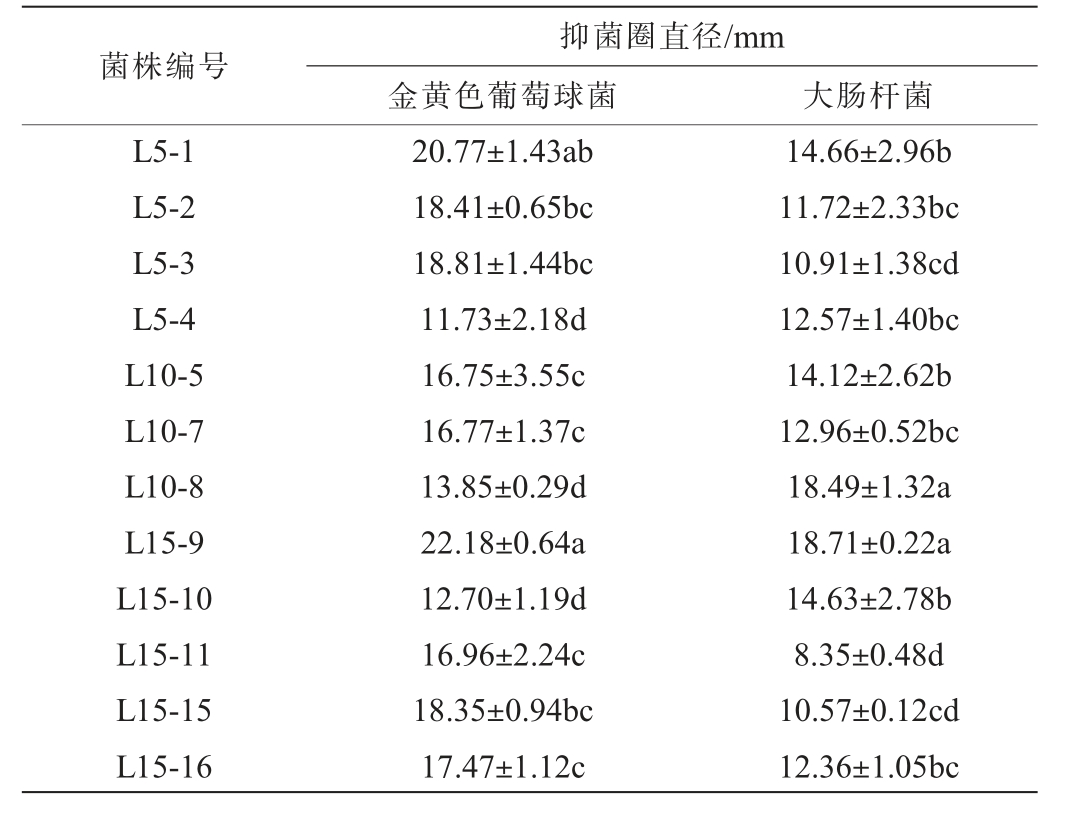
菌株编号抑菌圈直径/mm金黄色葡萄球菌 大肠杆菌L5-1 L5-2 L5-3 L5-4 L10-5 L10-7 L10-8 L15-9 L15-10 L15-11 L15-15 L15-16 20.77±1.43ab 18.41±0.65bc 18.81±1.44bc 11.73±2.18d 16.75±3.55c 16.77±1.37c 13.85±0.29d 22.18±0.64a 12.70±1.19d 16.96±2.24c 18.35±0.94bc 17.47±1.12c 14.66±2.96b 11.72±2.33bc 10.91±1.38cd 12.57±1.40bc 14.12±2.62b 12.96±0.52bc 18.49±1.32a 18.71±0.22a 14.63±2.78b 8.35±0.48d 10.57±0.12cd 12.36±1.05bc
综上,根据罗靓芷等[21]的筛选方法并依据淀粉水解能力、耐NaCl、耐亚硝酸盐能力、抑制大肠杆菌和金黄色葡萄球菌的能力,筛选出优良乳酸菌菌株为菌株L15-9。
2.3 菌株L15-9的分子生物学鉴定
基于16S rDNA基因构建菌株L15-9的系统发育树,结果见图4。 由图4可知,菌株L15-9与植物乳植杆菌(Lactiplantibacillus plantarum)strain CP054259.1聚于同一分支,同源性达到100%,亲缘关系最近,结合菌株L15-9的形态特征,最终鉴定其为一株植物乳植杆菌(Lactiplantibacillus plantarum)。

图4 基于16S rDNA基因序列菌株L15-9的系统进化树
Fig.4 Phylogenetic tree of strain L15-9 based on 16S rDNA gene sequence
李燕[12]研究发现,臭鳜鱼中的优势菌株为清酒乳杆菌(Lactobacillus sakei),与本研究所分离优势菌株不同。 林城杏[20]在贵州6个不同地区的传统高盐发酵酸鱼中分离出42株优良的乳酸菌,经分子生物学鉴定为植物乳植杆菌、短乳杆菌等5种,其中,植物乳杆菌占比较高,与本研究分离结果一致。陈学云等[10]从盐干带鱼中分离纯化出食品乳杆菌(Lactobacillus alimentarius)、戊糖乳杆菌(Lactiplantibacillus pentosus)等,其余6株乳酸菌未能鉴定其种类,戊糖乳杆菌占比较高,为优势菌株。由此可见,不同加工方式发酵鱼中的优势菌株各不相同,但都发挥着至关重要的作用。 特别是在发酵鱼制品中,发酵过程中的优势菌多为乳酸菌,乳酸菌中的植物乳杆菌是发酵鱼制品的关键微生物[29]。
2.4 植物乳植杆菌L15-9的生长及产酸特性
植物乳植杆菌L15-9的生长曲线及产酸曲线见图5。由图5a可知,植物乳植杆菌L15-9在培养2 h后迅速进入对数生长期,12 h后进入稳定生长期,说明菌株L15-9可以快速到达适宜活性。 由图5b可知,培养过程中,pH值变化趋势与生长趋势呈负相关,培养2 h以内有短暂的延滞期,培养2 h后迅速降低pH值,在培养12 h时pH值<4。
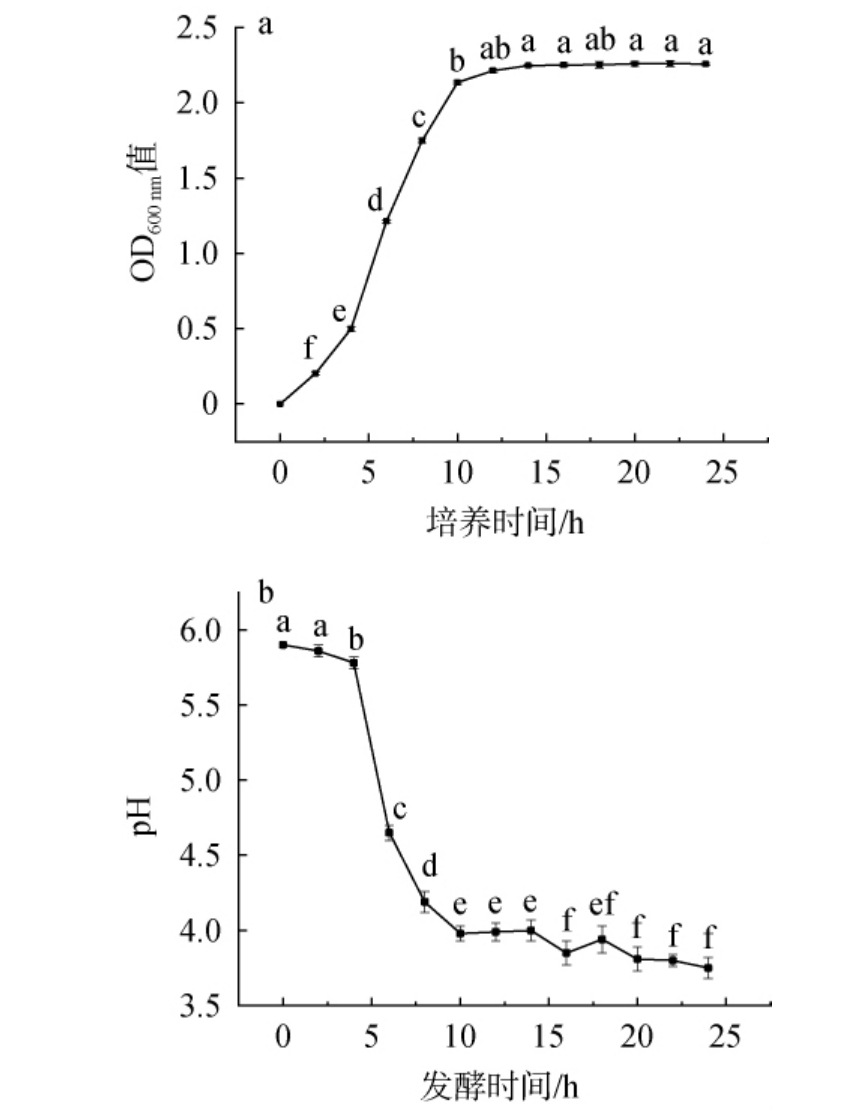
图5 植物乳植杆菌L15-9的生长曲线(a)及产酸曲线(b)
Fig.5 Growth curve (a) and acid production curve (b) of Lactiplantibacillus plantarum L15-9
3 结论
本研究以信阳商城筒鲜鱼为分离源,通过稀释涂布平板法、划线分离得到19株疑似乳酸菌,对其进行接触酶检验及革兰氏染色后初步筛选得到12株乳酸菌菌株。通过对12株菌种的产粘、淀粉水解、耐盐、耐亚硝酸盐、氨基酸脱羧酶活性、抑菌及糖发酵产气等生理生化特性进行研究,筛选出得到一株水解淀粉能力、耐NaCl、亚硝酸盐能力及抑菌能力最强的优良菌株,编号为L15-9。通过分子生物学鉴定其为一株植物乳植杆菌(Lactiplantibacillus plantarum),其能在培养2 h后迅速进入对数生长期,12 h后进入稳定生长期,并在12 h可将pH值降低至4.0以下。 本研究结果为筒鲜鱼品质保证和标准化量产奠定了基础。
[1]郑雪珂,陈晖,陈浩燃,等.筒鲜鱼中优势酵母菌的筛选鉴定及其生长特性分析[J].中国酿造,2024,43(9):79-84.
[2]赵德畅.乳酸菌发酵鱼肉制品的研制[D].上海:上海海洋大学,2010.
[3]李宗军,江汉湖.中国传统酸肉发酵过程中微生物的消长变化[J].微生物学通报,2004(4) :9-13.
[4]YANG Z X,LIU S S,LV J, et al.Microbial succession and the changes of flavor and aroma in Chouguiyu,a traditional chinese fermented fish[J].Food Biosci,2020,37:100725.
[5]ZANG J H, XU Y S, XIA W S, et al.Correlations between microbiota succession and flavor formation during fermentation of Chinese low-salt fermented common carp(Cyprinus carpio L.)inoculated with mixed starter cultures[J].Food Microbiol,2020,90:103487.
[6]卜永士,许惠雅,施文正.传统发酵鱼制品品质及安全性研究进展[J].肉类研究,2021,35(6):69-75.
[7]邹文广.乳酸菌在动物营养中的应用[J].吉林畜牧兽医,2020,41(9):97.
[8]湛剑龙.贵州侗族酸鱼、酸肉中抗氧化乳酸菌的筛选与优化[D].贵阳:贵州大学,2015.
[9]柯泽华.臭鳜鱼风味物质鉴定及优选菌株对其风味的影响研究[D].邯郸:河北工程大学,2021.
[10]陈学云,侯鲁娜,丁玉庭,等.盐干带鱼中乳酸菌的分离鉴定及其生物学特性研究[J].食品工业科技,2010,31(11):165-167.
[11]彭小珍,卢星军,蒋立文.酸鱼的研究现状与研究进展[J].中国酿造,2020,39(8):13-16.
[12]李燕.黄山臭鳜鱼发酵过程中微生物多样性的研究[D].杭州:浙江工商大学,2014.
[13]季祥,乔春燕,蔡禄.餐厨垃圾中乳酸菌的筛选及其发酵条件的优化[J].粮油加工(电子版),2014(8):61-65.
[14]卢士玲,吴桂春,李开雄.发酵肉制品中乳酸菌的分离、筛选和鉴定[J].食品与生物技术学报,2006(3):116-121.
[15]周迎芹,孙子怡,黄晶晶,等.臭鳜鱼源清酒乳杆菌的分离鉴定及其在臭鳜鱼发酵中的应用[J].食品科学,2022,43(12):194-202.
[16]高悦皓.传统泡菜制作与乳酸菌的分离观察[J].食品安全导刊,2022(13):72-76.
[17]布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册(第八版)[M].北京:科学出版社,1984:797-821.
[18]王楠,尹纪元,王英英,等.草鱼源乳酸菌的分离鉴定及其生物学特性研究[J].南方水产科学,2021,17(6):74-84.
[19]孟凡冰,付郑旭,李云成,等.青稞酒曲微生物多样性分析及低温耐盐乳酸菌的分离鉴定[J].成都大学学报(自然科学版),2022,41(4):361-367,372.
[20]林城杏.传统高盐发酵酸鱼乳酸菌菌群结构及强化发酵作用研究[D].贵阳:贵州大学,2019.
[21]罗靓芷,武俊瑞,刘佳艺,等.臭鳜鱼中优良乳酸菌的分离筛选与鉴定[J].食品与发酵工业,2013,39(10):132-136.
[22]王冰聪.产γ-氨基丁酸乳酸菌的筛选及发酵条件的优化[D].长春:长春大学,2019.
[23]孙禹,马艳,王之超,等.海兰褐蛋鸡盲肠中乳酸菌的分离与鉴定[J].饲料研究,2023,46(5):61-64.
[24]叶朋飞,刘静,李秋达,等.富源酸菜源乳酸菌分离鉴定及益生特性研究[J].食品安全导刊,2022,334(5):87-91.
[25]孙建光,高俊莲.乳酸菌对糖和糖醇的分解代谢及其致龋性[J].口腔医学,2007,117(7):384-386.
[26]杨琴.酸鱼中产胺菌的氨基酸脱羧酶基因及功能特性研究[D].贵阳:贵州大学,2020.
[27]景智波,田建军,杨明阳,等.食品中与生物胺形成相关的微生物菌群及其控制技术研究进展[J].食品科学,2018,39(15):262-268.
[28]王学宏.淀粉及其水解产物与碘的显色反应[J].生物学教学,2006(3):69-70.
[29]孙海鑫,陈智慧,王盛美,等.发酵鱼中菌群组成及发酵特性研究进展[J].食品工业科技,2022,43(5):424-431.