豆瓣酱作为中国的传统调味品,具有悠久的历史,集鲜、辣、咸、甜、酸于一体,是川菜等菜系的重要调味料之一,且因其具有的营养价值及独特风味深受人们的欢迎[1-3]。豆瓣酱是以辣椒、蚕豆和面粉为主要原料,经米曲霉(Aspergillus oryzae)和各种微生物发酵而成,其生产工艺主要包括辣椒醅制作、甜瓣子制作及复发酵三个阶段,辣椒醅及甜瓣子分别制成后,按照一定比例混合,加适量盐水,经或不经“翻、晒、露”得到豆瓣酱[4]。各企业参考GB/T 20560—2006《地理标志产品郫县豆瓣》描述的工艺生产豆瓣酱,但局部工艺上的处理不尽相同[5]。
豆瓣酱的传统发酵一般在室内常温进行,时间相对较长,发酵环境及时间对豆瓣酱产品质量影响较大。 随着人们对食品的质量、安全性和方便性的更高要求,豆瓣酱的生产逐渐从传统工艺制作转变为大规模的工业化生产。工业发酵手段的应用可以大大缩短生产时间和成本,实现大批量生产。有研究发现工业发酵无法复制传统发酵豆瓣酱的香气特征[6]。LI X Y等[2]研究发现,传统工艺生产的甜瓣子较现代工业生产的甜瓣子风味物质更丰富;与之相反,TAN X Y等[1]研究发现,现代工业发酵生产的甜瓣子较传统自然发酵的甜瓣子品质更优。 李治华等[7]比较了传统与商用豆瓣酱的挥发性风味成分,结果表明,两者间的差异挥发性风味成分有35种,豆瓣酱的风味主要在复发酵阶段形成。曾艳等[8]研究发现,经红油调配处理的商用豆瓣酱游离氨基酸含量较不经红油处理的豆瓣酱高。曾雪晴等[9-10]对市售多个豆瓣酱样品检测发现,不同样品生物胺含量差异较大,部分产品生物含量存在安全风险。目前,关于不同工艺生产的豆瓣酱品质的研究尚未形成一致结论且报道较少。
生成周期长且模式粗放,可能给传统食品厂带来潜在的安全隐患,此外,生产地理环境和工艺的不同,使得发酵豆制品中存在的微生物和风味物质有一定的相似性和差异性[2]。另外,发酵时长也是影响豆瓣酱品质的重要因素,既往研究多忽略了发酵时间这一变量。 基于此,本研究选取生产周期一致的传统发酵豆瓣酱与工业发酵豆瓣酱产品为研究对象,采用Illumina NovaSeq高通量测序技术对其微生物群落组成进行分析,并采用高效液相色谱(high performance liquid chromatography,HPLC)、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)检测其游离氨基酸、挥发性风味物质及生物胺含量,探讨不同工艺对商用豆瓣酱品质的影响,以期为豆瓣酱工艺的理解及品质控制提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
传统发酵豆瓣酱:采集自成都某知名调味品企业,常温发酵成熟后的甜瓣子(采用沪酿3.042米曲霉制曲)与辣椒醅以质量比1∶3混合,无翻、晒、露工艺。 采集发酵7个月的甜瓣子与9个月的辣椒醅混合的豆瓣酱供分析,标记为TFD。工业发酵豆瓣酱:采集自成都郫县某知名豆瓣酱生产企业,30~32 ℃发酵成熟的甜瓣子(采用沪酿3.042米曲霉制曲)与常温发酵成熟的辣椒醅以质量比1∶3混合后置于发酵池翻、晒、露3个月得豆瓣酱成品。 采集翻、晒、露3个月的豆瓣酱供分析,标记为IFD,其辣椒醅累积发酵时间为9个月,甜瓣子累积发酵时间为7个月,发酵时间与TFD相同,两类豆瓣酱总生产周期均为9个月。
1.1.2 试剂
三氯乙酸、盐酸、氢氧化钠、碳酸氢钠、乙酸、乙酸铵、浓硫酸、三乙胺、异硫氰酸苯酯(均为分析纯):成都市科隆化学品有限公司;氨基酸标准品、乙腈、生物胺标准品(均为色谱纯):美国Sigma-Aldrich公司;4-甲基-2-戊醇(色谱纯):阿法埃莎(中国)化学有限公司;丹磺酰氯(色谱纯):美国霍尼韦尔公司;正己烷、甲醇、丙酮(均为色谱纯):德国Merck公司;基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国BioTek公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Agilent 1260 Infinity II高效液相色谱仪:美国安捷伦科技有限公司;UltimateAminoAcid色谱柱(4.6×250mm,5μm):月旭科技(上海)股份有限公司;TGL-20bR冷冻离心机:上海安亭科学仪器厂;VORTEX-2旋涡混合器:美国GENE公司;TP-214型分析天平:美国Denver公司;Milli-Q超纯水器:美国Millipore公司;GCMS-TQ8040三重四级杆气相色谱-质谱联用仪:日本岛津仪器公司;Agilent J&W DB WAX高分离度气相色谱柱(30 m×0.320 mm×0.25 μm):美国安捷伦公司;GERSTEL多功能自动进样器:德国哲思泰公司;固相微萃取手柄(带有50/30 μm DVB/CAR/PDMS固相微萃取纤维):美国Supelco公司;C18分析色谱柱(250 mm×4.6 mm,5 μm):迪马科技有限公司。
1.3 方法
1.3.1 游离氨基酸及生物胺含量的检测
游离氨基酸含量:参照李雄波[11]建立的HPLC法测定;生物胺含量:采用陈功等[12]报道的方法测定。
1.3.2 挥发性风味成分检测
参照邓维琴等[13]的顶空固相微萃取(headspace solidphase microextraction,HS-SPME)-GC-MS法检测豆瓣酱中的挥发性风味成分,并略作改动。HS-SPME条件:称取样品2.0 g,添加2 mL饱和氯化钠溶液,加入10 μL 0.5 μg/mL 4-甲基-2-戊醇溶液作为内标,使用固相微萃取装置吸附样品中的挥发性风味物质,采用气质联用仪进行检测。
气相色谱条件:DB-WAX毛细管色谱柱(60m×0.25 mm×0.25 μm);载气为高纯氦气(He),流速1 mL/min;进样口温度250 ℃;不分流进样;升温程序为起始温度50 ℃,以10 ℃/min升至85℃(保留1.5min),再以5℃/min升至100℃(保留1min),以2.5 ℃/min升至175 ℃(保持1.5 min),最后以10 ℃/min升至250 ℃/min。
质谱条件:电子电离(electron ionization,EI)源,电子能量70 eV;离子源温度230 ℃;接口温度250 ℃;质量扫描范围35~350 amu;检测器电压0.1 kv;扫描模式scan。
定性和定量分析:由GC-MS得到的色谱图,经计算机在美国国家标准与技术研究院(national institute of standards and technology,NIST)11中比对检索,选取相似度>80(最大值为100)的物质进行定性分析,采用内标法进行半定量分析。
挥发性风味成分香气活力值(odor activity value,OAV)的计算参照彭凯雄等[14-15]的方法,其计算公式如下:
式中:OAVi为物质i的香气活性值;Mi为化合物i的含量,μg/g;Ci为组分i的水中嗅觉阈值质量浓度,mg/kg。
1.3.3 Illumina NovaSeq高通量测序
豆瓣酱样品微生物基因组总DNA提取、聚合酶链式反应(polymerase chain reaction,PCR)扩增及基于Illumina NovaSeq平台的测序均由上海绾塍生物科技有限公司完成。采用338F/806R为引物PCR扩增细菌的16S rRNA V3~V4区序列,采用ITS1F/ITS2R为引物PCR扩增真菌的ITS1区序列。 原始序列数据使用demux插件进行解码处理,采用cutadapt插件进行引物切除,然后使用DADA2插件对序列进行质量过滤、去噪、拼接和嵌合体去除等数据处理。对上述获得的序列按100%的序列相似度进行归并,生成特征性序列(amplicon sequence variants,ASVs),最后采用QIIME2的classify-sklearn算法对100%相似水平的ASVs特征序列进行分类学分析,并在各水平统计每个样品的群落组成。 细菌使用Silva数据库,真菌使用Unite数据库进行比对注释。
1.3.4 数据处理与分析
采用WPS 2016、Origin 2021进行数据统计分析及作图。采用SPSS Statistics 26.0独立样本t-检验进行差异显著性(P<0.05)分析。 用SIMCA 14.1软件进行正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)建模,计算变量重要性投影(variable importance in projection,VIP)值,基于VIP>1选择差异代谢物。
2 结果与分析
2.1 豆瓣酱中游离氨基酸含量分析
氨基酸是豆瓣酱等发酵调味品重要的呈味物质,能够赋予产品鲜、甜、咸等多种味道,是评价产品品质的重要指标之一[16]。两类豆瓣酱中氨基酸含量的检测结果见图1。
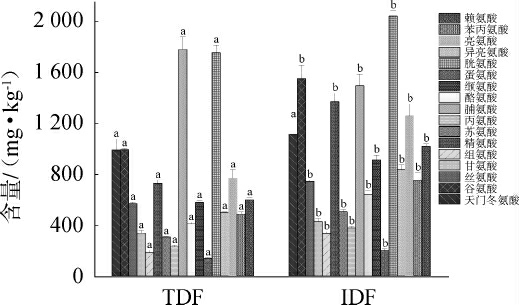
图1 两类豆瓣酱中游离氨基酸含量的检测结果
Fig.1 Determination results of free amino acid contents in two kinds of Doubanjiang
不同小写字母表示两类豆瓣酱差异显著(P<0.05)。下同。
由图1可知,从两类豆瓣酱中均检测出17种相同的氨基酸,TFD 与IFD 样品中的游离氨基酸总量分别为11 335.47 mg/kg、15 563.09 mg/kg。 其中,TFD样品中的脯氨酸含量(1 777.61 mg/kg)高于IFD样品(1 493.24 mg/kg),其余种类氨基酸含量均低于IFD样品。 彭杰等[16]在复发酵1~3个月的工业发酵豆瓣酱中均检测到相对含量较高的脯氨酸,这与本研究的结果一致,分析原因可能是发酵时间延长,酵母细胞自溶会产生高浓度的脯氨酸,其属于甜味型氨基酸[1]。魏依兰等[17]研究发现,豆瓣酱的游离氨基酸大多来自原料蚕豆的蛋白质降解,虽然不同发酵环境、产品类型和原料来源等因素都会对豆瓣酱的游离氨基酸总量差异产生影响,但其组成比例表现出较好的一致性,本研究结果与其相符。 由图1亦可知,TFD与IFD样品中除天门冬氨酸外,其余16种氨基酸含量均差异显著(P<0.05)。TFD与IFD样品中鲜味氨基酸(天门冬氨酸、谷氨酸)占比分别为17.5%与17.1%,甜味氨基酸(脯氨酸、丝氨酸、苏氨酸、甘氨酸、丙氨酸、缬氨酸、异亮氨酸、赖氨酸)占比分别为33.6%与29.3%,苦味氨基酸(亮氨酸、苯丙氨酸、组氨酸、精氨酸、酪氨酸、蛋氨酸)占比分别为33.4%和40.5%,结果表明,IFD样品中的游离氨基酸含量较TFD高,但基于游离氨基酸的呈味角度看,TFD中受消费者青睐的鲜、甜味物质占比更高,游离氨基酸呈味结果更好。
2.2 豆瓣酱中挥发性风味成分分析
挥发性风味物质对食品风味产生决定性作用,显著影响消费者的消费行为[5,18]。通过HS-SPME-GC-MS检测豆瓣酱中的挥发性风味物质,不同类别物质种类数量、含量及占比见图2。
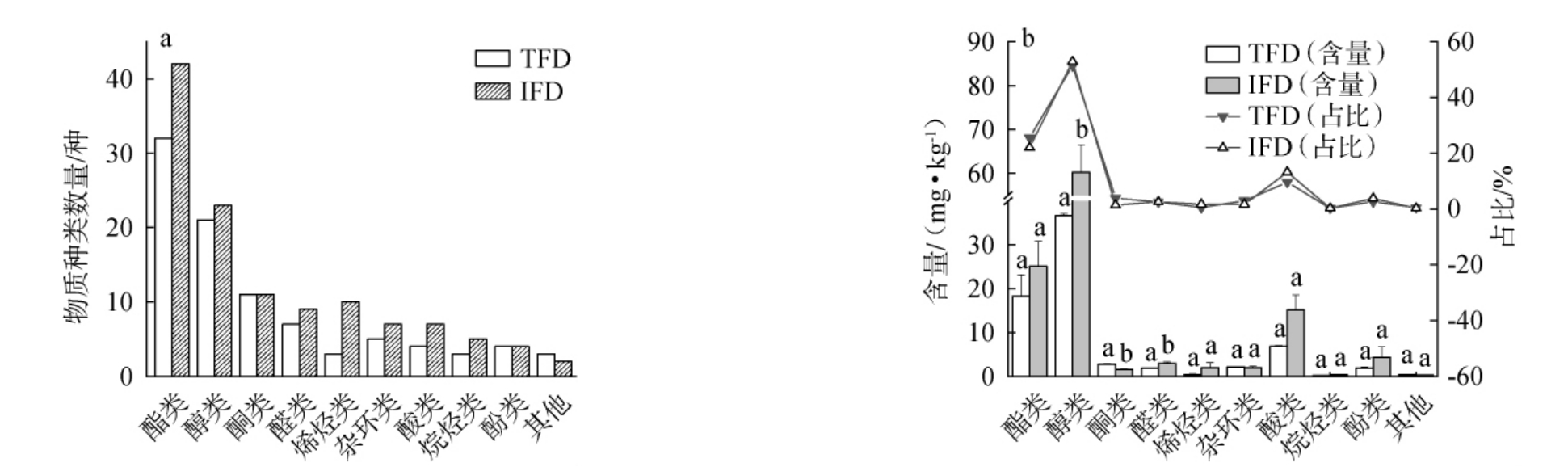
图2 两类豆瓣酱中不同类别挥发性风味物质种类数量(a)、含量及占比(b)
Fig.2 Quantity (a), contents and proportion (b) of various types of volatile flavor compounds in two kinds of Doubanjiang
由图2a可知,从TFD与IFD样品中分别鉴定出93种、120种挥发性风味物质,包括酯类、醇类、酮类、醛类、烯烃类、杂环类、酸类、烷烃类、酚类及其他10类,说明工业发酵豆瓣酱挥发性风味物质种类更多,风味更丰富。
由图2b可知,IFD样品中醇类、酯类、酸类、酚类物质含量较高,占挥发性风味成分总含量的92.4%,TFD样品中醇类、酯类、酸类、酮类物质含量较高,占挥发性风味成分总含量的92.6%,虽然占比相近,但种类存在较大差异。而TAN X Y等[1]研究发现,醇类、酯类、酸类、醛类物质在传统发酵与工业发酵甜瓣子中均为占比最高的挥发性风味成分,累计占比为84.5%~84.7%,且各成分比例呈现出相似性。两类豆瓣酱仅在醇类、酮类、醛类挥发性物质含量上差异显著(P<0.05),TFD样品中醇类物质含量(36.63 mg/kg)显著低于IFD样品(60.24 mg/kg)(P<0.05),其占比(51.40%)与TFD样品(52.88%)基本持平;TFD样品中酮类物质含量(2.78 mg/kg)显著高于IFD样品(1.61 mg/kg)(P<0.05),其占比(3.90%)高于IFD样品(1.41%);TFD样品中的醛类物质含量(1.82 mg/kg)显著低于IFD样品(2.98 mg/kg)(P<0.05),其占比(2.55%)与IFD样品(2.62%)基本持平。 结果表明,两类豆瓣酱在主要风味物质含量组成上,酯类、酸类差异不明显,醇类、醛类、酮类差异显著(P<0.05)。
豆瓣酱在发酵过程中会产生丰富的挥发性风味成分,但豆瓣酱产品的风味主要由一些关键的挥发性成分贡献,OAV代表单一的香气成分对整体香气的贡献程度,一般认为OAV>1的成分可能对总体风味有重要影响[14,19],是关键风味物质。 两类豆瓣酱中OAV>1的关键风味物质见表1。由表1可知,两类豆瓣酱中共检测到45种OAV>1的关键风味物质。TFD样品中,OAV>1的挥发性风味成分有32种,包括酯类8种、杂环类1种、酸类2种、醛类3种、酚类2种、醇类16种;IFD样品中,OAV>1的挥发性风味成分有43种,包括酯类15种、杂环类1种、酮类2种、酸类3种、醛类6种、酚类2种、醇类14种。OAV>10被认为该成分对整体香气贡献极大,对香气具有决定性作用[20],是特征风味物质。TFD样品中OAV>10的特征风味物质有17种,包括芳樟醇、3-甲基丁酸乙酯、桉叶油醇、辛醛、壬醛等;IFD样品中OAV>10的挥发性风味成分有26种,包括芳樟醇、3-甲基丁酸乙酯、4-甲基-戊酸乙酯、β-紫罗兰酮、异戊醛、乙酸、壬醛、3-甲硫基丙醛等。 两类豆瓣酱中OAV>10且差值>1倍的成分有10种,包括十四酸乙酯、3-甲基丁酸乙酯、乙酸乙酯、乙酸、异丁酸、对乙基愈创木酚、对乙基苯酚、(Z)-2,3-丁二醇、苯乙醇、β-紫罗兰酮。 其中,3-甲基丁酸乙酯、3-甲硫基丙醛、异戊醛、对乙基愈创木酚等被报道是豆瓣酱、豆豉、酱油等发酵产品中的关键或特有风味来源[5,15];β-紫罗兰酮仅在IFD样品中检出。综上,两类豆瓣酱中的挥发性风味成分差异较大,这可能主要源于其不同工艺造成的[5]。
表1 两类豆瓣酱中关键风味物质
Table 1 Key flavor compounds in two kinds of Doubanjiang
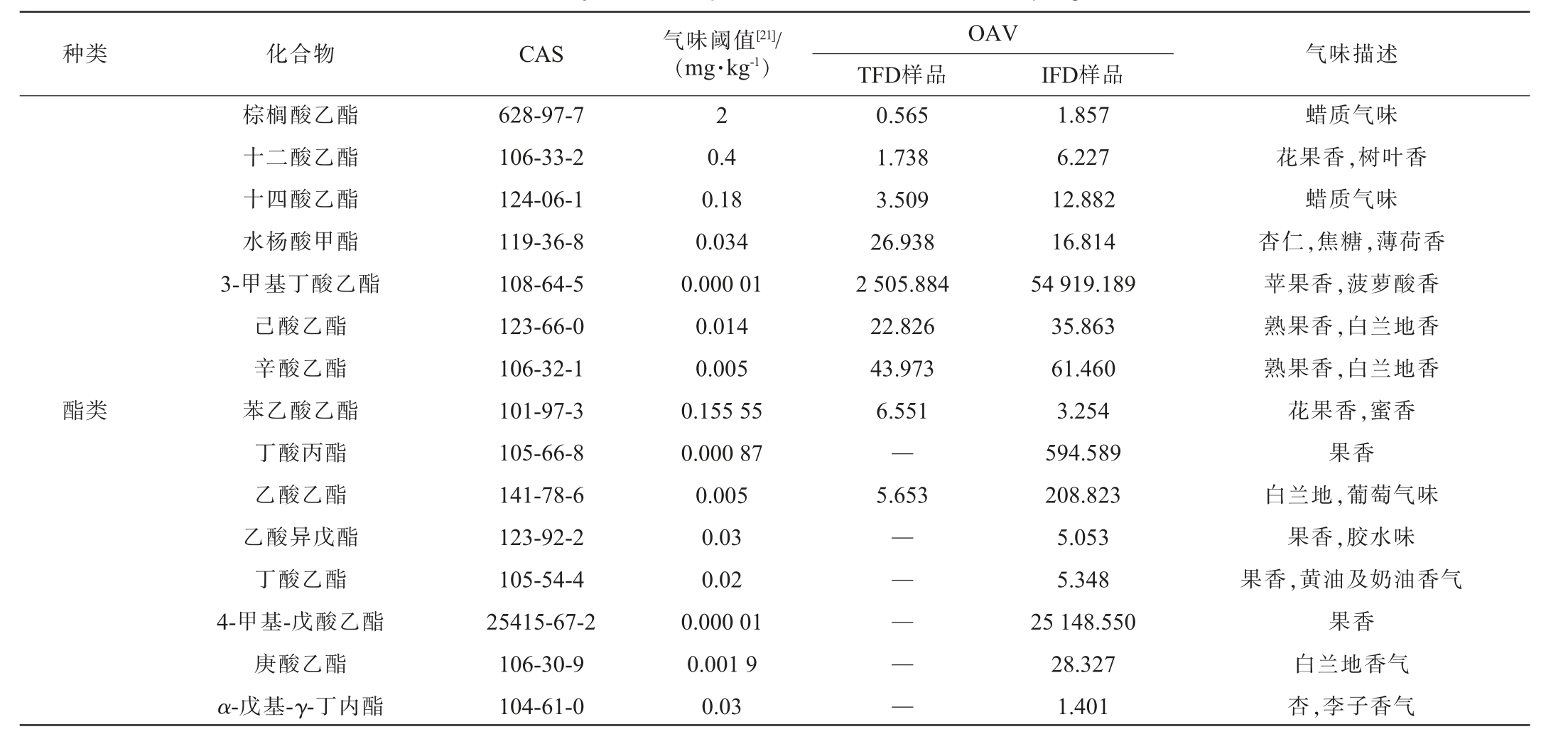
种类 化合物 CAS 气味阈值[21]/(mg·kg-1) 气味描述OAV TFD样品 IFD样品棕榈酸乙酯十二酸乙酯十四酸乙酯水杨酸甲酯3-甲基丁酸乙酯己酸乙酯辛酸乙酯苯乙酸乙酯丁酸丙酯乙酸乙酯乙酸异戊酯丁酸乙酯4-甲基-戊酸乙酯庚酸乙酯α-戊基-γ-丁内酯628-97-7 106-33-2 124-06-1 119-36-8 108-64-5 123-66-0 106-32-1 101-97-3 105-66-8 141-78-6 123-92-2 105-54-4 25415-67-2 106-30-9 104-61-0 2酯类0.4 0.18 0.034 0.000 01 0.014 0.005 0.155 55 0.000 87 0.005 0.03 0.02 0.000 01 0.001 9 0.03 0.565 1.738 3.509 26.938 2 505.884 22.826 43.973 6.551—5.653——1.857 6.227 12.882 16.814 54 919.189 35.863 61.460 3.254 594.589 208.823 5.053 5.348 25 148.550 28.327 1.401蜡质气味花果香,树叶香蜡质气味杏仁,焦糖,薄荷香苹果香,菠萝酸香熟果香,白兰地香熟果香,白兰地香花果香,蜜香果香白兰地,葡萄气味果香,胶水味果香,黄油及奶油香气果香白兰地香气杏,李子香气
续表
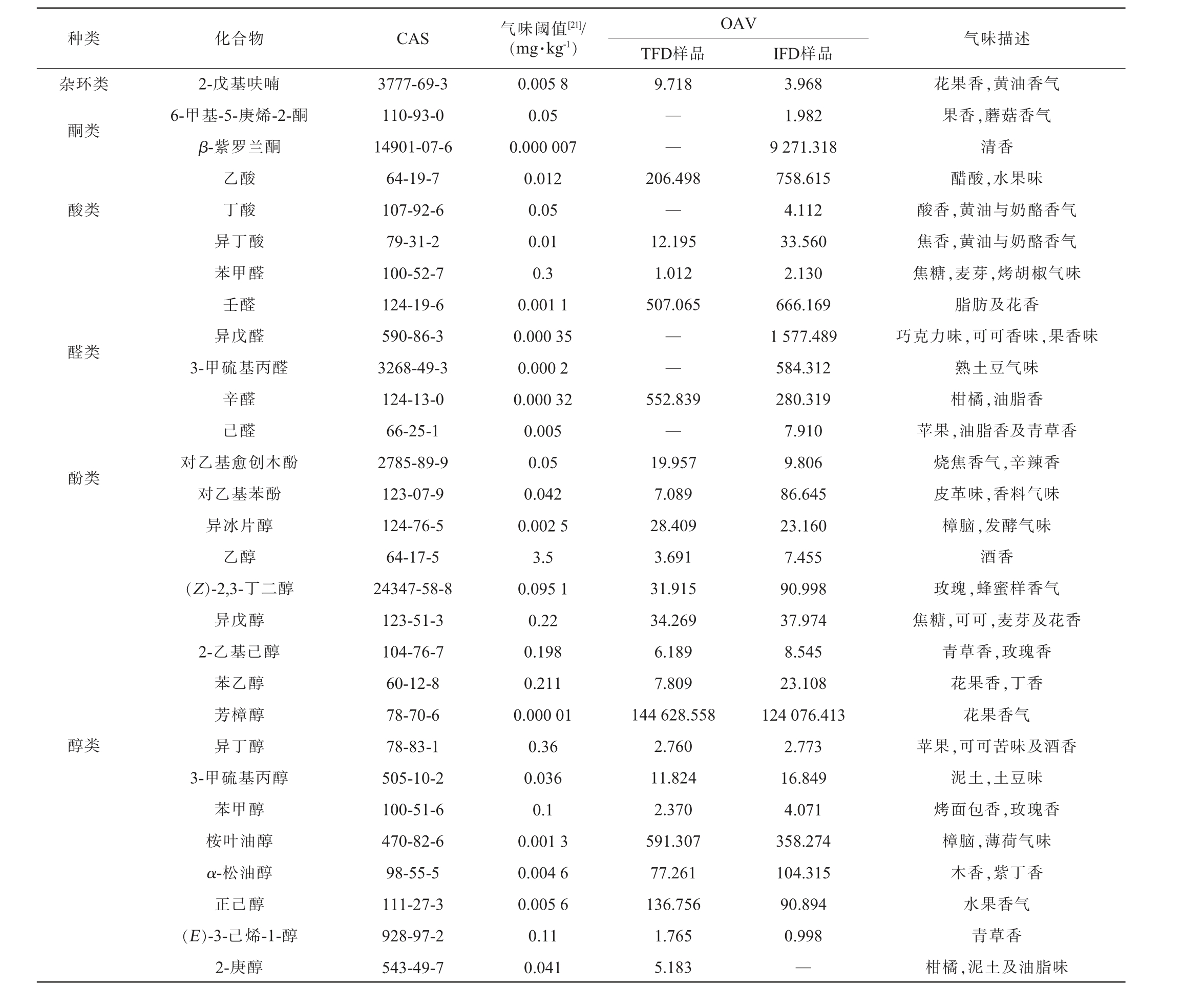
注:“—”表示未检出物质,无法计算OAV;“香气描述”参考:https://www.femaflavor.org/。
OAV TFD样品 IFD样品杂环类种类 化合物 CAS 气味阈值[21]/(mg·kg-1) 气味描述9.718酮类——酸类206.498—12.195 1.012 507.065醛类——酚类醇类2-戊基呋喃6-甲基-5-庚烯-2-酮β-紫罗兰酮乙酸丁酸异丁酸苯甲醛壬醛异戊醛3-甲硫基丙醛辛醛己醛对乙基愈创木酚对乙基苯酚异冰片醇乙醇(Z)-2,3-丁二醇异戊醇2-乙基己醇苯乙醇芳樟醇异丁醇3-甲硫基丙醇苯甲醇桉叶油醇α-松油醇正己醇(E)-3-己烯-1-醇2-庚醇3777-69-3 110-93-0 14901-07-6 64-19-7 107-92-6 79-31-2 100-52-7 124-19-6 590-86-3 3268-49-3 124-13-0 66-25-1 2785-89-9 123-07-9 124-76-5 64-17-5 24347-58-8 123-51-3 104-76-7 60-12-8 78-70-6 78-83-1 505-10-2 100-51-6 470-82-6 98-55-5 111-27-3 928-97-2 543-49-7 0.005 8 0.05 0.000 007 0.012 0.05 0.01 0.3 0.001 1 0.000 35 0.000 2 0.000 32 0.005 0.05 0.042 0.002 5 3.5 0.095 1 0.22 0.198 0.211 0.000 01 0.36 0.036 0.1 0.001 3 0.004 6 0.005 6 0.11 0.041 552.839—19.957 7.089 28.409 3.691 31.915 34.269 6.189 7.809 144 628.558 2.760 11.824 2.370 591.307 77.261 136.756 1.765 5.183 3.968 1.982 9 271.318 758.615 4.112 33.560 2.130 666.169 1 577.489 584.312 280.319 7.910 9.806 86.645 23.160 7.455 90.998 37.974 8.545 23.108 124 076.413 2.773 16.849 4.071 358.274 104.315 90.894 0.998—花果香,黄油香气果香,蘑菇香气清香醋酸,水果味酸香,黄油与奶酪香气焦香,黄油与奶酪香气焦糖,麦芽,烤胡椒气味脂肪及花香巧克力味,可可香味,果香味熟土豆气味柑橘,油脂香苹果,油脂香及青草香烧焦香气,辛辣香皮革味,香料气味樟脑,发酵气味酒香玫瑰,蜂蜜样香气焦糖,可可,麦芽及花香青草香,玫瑰香花果香,丁香花果香气苹果,可可苦味及酒香泥土,土豆味烤面包香,玫瑰香樟脑,薄荷气味木香,紫丁香水果香气青草香柑橘,泥土及油脂味
为进一步明确两类豆瓣酱关键香气成分在风味贡献上具有判别性差异的成分,参照彭凯雄等[14]的方法对OAV>1的关键风味物质进行OPLS-DA分析,并计算VIP值,结果见图3。由图3a可知,样本的R2Y为0.984,极接近1,且样本都置于95%的置信区间内,可以较好地区分组间样品。进一步通过置换检验功能验证模型的可靠性,由图3b可知,模型经200次交叉验证后,模型Q2回归线与横坐标交叉,Q2的点均高于左侧的点,且与纵坐标交叉的截距<0,表明模型不存在过度拟合,所建立的OPLS-DA模型验证有效,能较好的反应样品间物质的差异[14]。OPLS-DA模型的VIP值可以衡量各组分积累差异对各组样本分类判别的影响强度和解释能力,VIP值越大,表明该挥发性风味成分在豆瓣酱样品间的差异程度越大,对豆瓣酱样品间差异的贡献作用也愈明显,VIP>1即可象征重要变量[20],是差异风味物质。由图3b亦可知,两类豆瓣酱样品中VIP>1的差异风味物质有4种,分别为3-甲基丁酸乙酯、4-甲基-戊酸乙酯、芳樟醇、β-紫罗兰酮。 4-甲基-戊酸乙酯、β-紫罗兰酮具有果香和清香气味,在TFD中未检测到;具有花果香气的芳樟醇在两类豆瓣酱中OAV均最高,邵淑贤等[20]在不同产地乌龙茶中也发现这一现象。由表1可知,TFD样品中芳樟醇的OAV高于IFD,因此TFD的花果香气更明显。综上,两类豆瓣酱中对风味具有重要贡献的差异成分为3-甲基丁酸乙酯、4-甲基-戊酸乙酯、芳樟醇、β-紫罗兰酮4种物质,TFD样品花果香气稍明显,IFD样品具有更浓的果香和清香气味。
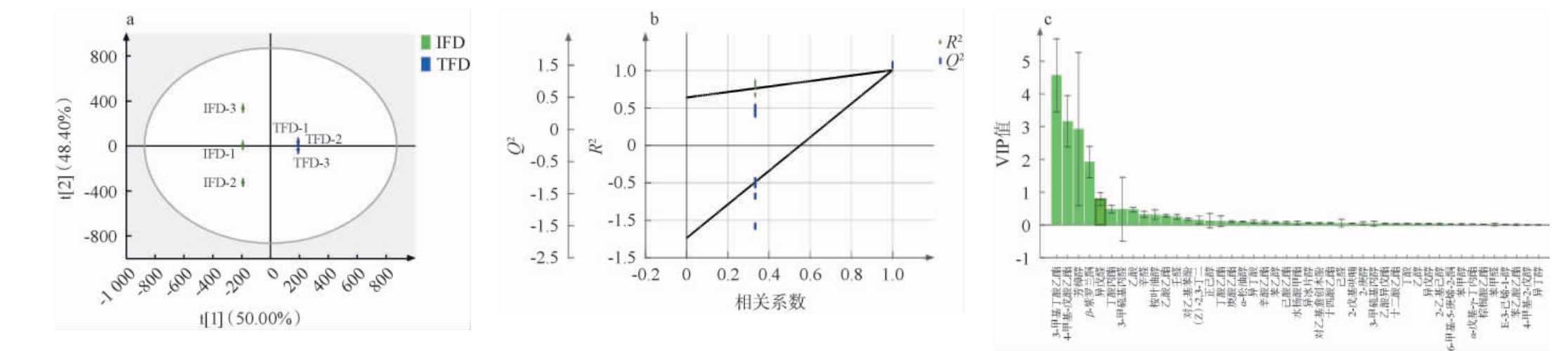
图3 两类豆瓣酱关键风味物质正交偏最小二乘判别分析得分图(a)、200次置换检验结果(b)与变量重要性投影值(c)
Fig.3 Orthogonal partial least-square discriminant analysis score chart (a), 200 permutation test results (b) and variable importance projection value (c) of key flavor substances in two kinds of Doubanjiang
2.3 豆瓣酱中微生物群落组成分析
通过对抽平后的ASV结果进行统计,获得豆瓣酱样本中的微生物群落在各分类水平的具体组成,结果从TFD样品共注释到4个门类、11个纲类、22个目类、31个科类、45个属类真菌群,6个门类、8个纲类、32个目类、60个科类、117个属类细菌群;IFD样品共注释到4个门类、13个纲类、23个目类、30个科类群、40个属类真菌群,7个门类、10个纲类、30个目类、53个科类、113个属类细菌群。总体上,TFD样品微生物群落多样性更高,这可能是由于其相对更开放的生产环境造成的[2]。基于属水平,两类豆瓣酱样品中微生物菌群组成见表2。
表2 基于属水平两类豆瓣酱中微生物群落组成
Table 2 Microbial community composition of two kinds of Doubanjiang based on genus level

注:Others表示平均相对丰度排名20之后的细菌属和排名10之后的真菌属。
细菌属芽孢杆菌属(Bacillus)枝芽孢菌属(Virgibacillus)慢生芽孢杆菌属(Lentibacillus)葡萄球菌属(Staphylococcus)海洋芽孢杆菌属(Oceanobacillus)魏斯氏菌属(Weissella)泛菌属属(Pantoea)四联球菌属(Tetragenococcus)明串球菌属(Leuconostoc)促生乳杆菌属(Levilactobacillus)幼虫依格纳季氏菌属(Ignatzschineria)罗伊氏乳杆菌属(Loigolactobacillus)科萨克氏菌属(Kosakonia)漫游球菌属(Vagococcus)沙雷氏菌属(Serratia)肠杆菌属(Enterobacter)唾液联合乳杆菌属(Ligilactobacillus)链球菌属(Streptococcus)嗜盐单胞属(Halomonas)苍白杆菌属(Ochrobactrum)其他(Others)TFD样品/% IFD样品/%2.13 31.45 25.20 3.10 0.14 6.08 5.16 4.14 2.54 0.44 1.91 1.34 1.28 0.98 0.96 0.86 0.86 0.72 0.10 0.48 10.14 66.80 0.50 0.34 11.92 7.40 1.03 0.14 0.20 0.05 1.93 0.09 0.23 0.15 0.22 0.12 0.20 0.04 0.13 0.7 5 0.35 7.41真菌属晋宁斯塔莫酵母属(Starmerella)拟魏克酵母属(Wickerhamiella)曲霉属(Aspergillus)接合酵母属(Zygosaccharomyces)毕赤酵母属(Pichia)枝孢霉菌属(Cladosporium)镰刀菌属(Fusarium)链格孢霉属(Alternaria)青霉菌属(Penicillium)维希尼克氏酵母属(Vishniacozyma)其他(Others)TFD样品/% IFD样品/%46.25 49.26 00.56 2.27 0.35 0.15 0.18 0.07 0.13 0.05 0.72 27.23 11.37 38.35 8.34 9.97 0.25 0.05 0.14 0.01 0.06 4.22
由表2可知,TFD样品中优势细菌属(相对丰度>0.5%)有16个,分别是Virgibacillus(31.45%)、Lentibacillus(25.20%)、Weissella(6.08%)、Pantoea(5.16%)、Tetragenococcus(4.14%)、Staphylococcus(3.10%)、Leuconostoc(2.54%)、Bacillus(2.13%)、Ignatzschineria(1.91%)、Loigolactobacillus(1.34%)、Kosakonia(1.28%)、Vagococcus(0.98%)、Serratia(0.96%)、Enterobacter(0.86%)、Ligilactobacillus(0.86%)、Streptococcus(0.72%);优势真菌属有4个,分别是Starmerella(46.25%)、Wickerhamiella(49.26%)、Wickerhamiella(2.27%)、Aspergillus(0.56%)。 IFD样品中优势细菌属有7个,分别是Bacillus(66.80%)、Staphylococcus(11.92%)、Oceanobacillus(7.40%)、Levilactobacillus(1.93%)、Weissella(1.03%)、Halomonas(0.75%)、Virgibacillus(0.50%);优势真菌属有5个,分别是Starmerella(27.23%)、Wickerhamiella(11.37%)、Aspergillus(38.35%)、Pichia(9.97%)、Zygosaccharomyces(8.34%)。
由表2可知,两类豆瓣酱样品的优势细菌群落构成差异较大。鲍奕达等[22]研究发现,复发酵阶段酱醅微生物主要由辣椒醅贡献,甜瓣子提供少量微生物。TFD样品的辣椒醅独立发酵9个月后与成熟甜瓣子混合得辣椒酱;而IFD样品的辣椒醅成熟后与甜瓣子混合并经过翻、晒、露3个月的互作形成豆瓣酱。 由此可知,两者在工艺上的差异是微生物群落构成差异的重要原因。YANG M L等[5]研究表明,Bacillus与风味物质苯乙醇、棕榈酸乙酯、十二酸乙酯、2-乙酰基吡咯、β-紫罗兰酮及异戊醇等高度正相关,这些物质在IFD样品中的含量较TFD高(表1),可能是与Bacillus在IFD样品中相对更有优势有关。 Staphylococcus在IFD样品中也更具优势,其能产生蛋白酶、脂肪酶等,将蚕豆蛋白质分解成小多肽和氨基酸,赋予豆瓣酱甜味[2]。Tetragenococcus为产酸菌,能促进酸类物质衍生物的形成[22]。Enterobacter可以赋予产品成熟、柔软的口感特性[3]。Pantoea是一种常见的植物内生菌,其在豆瓣酱发酵过程中的具体作用尚未见详细报道[3,23]。Weissella的相对丰度在TFD与IFD样品中分别排第三和第五,其也是酱油、韩国豆酱等食品中的优势菌群,能促进有机酸、挥发性成分的产生,同时抑制致病菌[2]。
两类豆瓣酱样品的优势真菌属较为相似,但在丰度构成上差异较大,取样时间、样品类别、生产工艺及环境条件中天然存在的真菌都会影响豆瓣酱中存在的最终真菌群落[3]。两类豆瓣酱样品中主要优势真菌为酵母菌、曲霉属。LI X Y等[2]研究发现,Aspergillus在传统发酵豆瓣酱初期短暂出现,之后消失,这可以解释TDF样品中Aspergillus属于优势菌群但含量较低的现象,这可能与TFD样品生产环境相对更开放,受到菌落竞争更剧烈有关,在此环境中酵母菌属在后期更具优势。 IFD样品中Zygosaccharomyces的相对丰度(8.34%)高于TFD样品(2.27%),Zygosaccharomyces可产生进行美拉德反应的前体物质,促进美拉德反应的进行,此外,Zygosaccharomyces与Bacillus在豆瓣酱的高渗透压环境下具有互促效应[5]。本研究显示,这种效应明显,TFD样品中Bacillus的相对丰度(2.13%)远低于IFD样品(66.80%)。张芃芃等[3]研究发现,Vishniacozyma、Alternaria是手工制作辣椒醅的优势菌群,这两类菌属在IFD样品中含量更高,可能是IFD样品的翻、晒、露工艺促进了它们的生长。在IFD样品中,Bacillus与Aspergillus分别为细菌和真菌属中相对丰度最高的菌属,这与LUYH等[24]的研究结果一致。Bacillus、Aspergillus与豆瓣酱中天门冬氨酸、亮氨酸、β-紫罗兰酮、2-乙酰基吡咯的产生有显著正相关关系[5],由表1可知,这4种成分在IFD样品中更高。综上,不同产品微生物群落的差异受生产企业、原料、工艺参数的影响,两类豆瓣酱在工艺上的较大差异是导致其产品中微生物群落差异的重要原因。
2.4 豆瓣酱中生物胺分析
TFD与IFD样品中生物胺总量分别为299.85 mg/kg、272.37 mg/kg,与已有研究[10]比较处于中等含量水平,目前尚未有对传统发酵调味品中生物胺含量的限量规定。两类豆瓣酱样品中均未检测到亚精胺和色胺,其余类别生物胺含量见图4。 有研究发现,酵母菌是豆瓣酱中的优势真菌,并可能促进生物胺的生成[9],因此,TFD样品中的酵母菌相对丰度远高于IFD样品(表2)可能是导致TFD样品中生物胺含量更高的原因之一。另外,有研究发现,Staphylococcus可与假单胞菌属等有害微生物形成竞争关系,抑制有害微生物生长,进而抑制生物胺的产生,提高产品的食品安全性[2,23],因此,IFD样品中Staphylococcus的相对丰度高于TFD(表2)也可能是导致IFD样品中生物胺含量更低的原因。由图4可知,两类豆瓣酱组胺、β-苯乙胺、精胺含量差别较大。 LIANG J等[25]在传统发酵腐乳中检测到组胺含量为210.53 mg/kg,居各类生物胺之首,占比>40%;传统发酵食 品 中Weissella、Tetragenococcus、Leuconostoc 等 微 生 物与组胺的形成密切相关[26]。 因此,TFD样品中组胺含量较高 可 能 与Weissella、Tetragenococcus、Leuconostoc 等 微 生物的相对丰度较高有关。IDF样品中精胺含量更高,可能与其曲霉菌属、Staphylococcus的相对丰度明显高于TFD样品(表2)相关;而IFD中β-苯乙胺含量更低可能与其内具有降解该胺的Bacillus更丰富有关[27]。 综上,微生物作用是豆瓣酱中生物胺形成的主要途径[9],两类豆瓣酱中的生物胺差异与微生物群落差异较大有关。
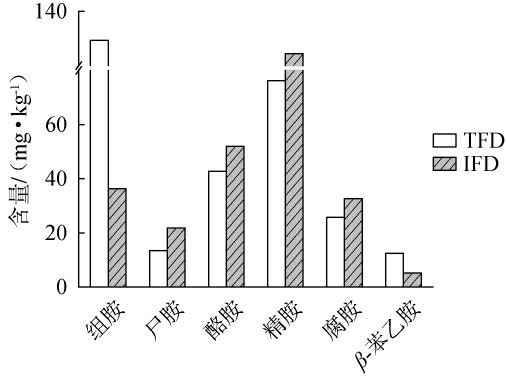
图4 两类豆瓣酱中生物胺含量测定结果
Fig.4 Determination results of biogenic amines contents in two kinds of Doubanjiang
3 结论
生产周期一致的传统发酵与工业发酵生产的商用豆瓣酱在风味品质、安全性及微生物群落组成存在一定差异。 两类豆瓣酱中氨基酸组成一致,但16种游离氨基酸含量差异显著(P<0.05),传统发酵豆瓣酱中鲜、甜味型氨基酸占比更高。 从传统发酵豆瓣酱中共鉴定出风味物质93种,工业发酵豆瓣酱中共鉴定出挥发性风味物质120种,关键风味物质45种,差异风味物质4种,分别为3-甲基丁酸乙酯、4-甲基-戊酸乙酯、芳樟醇与β-紫罗兰酮。传统发酵豆瓣酱表现为花果香气更明显,工业发酵豆瓣酱具有更浓的果香和清香气味。 两类豆瓣酱中的优势群落存在一定差异,传统发酵豆瓣酱中的优势群落(相对丰度>0.5%)为枝芽孢菌属(Virgibacillus)、慢生芽孢杆菌属(Lentibacillus)等16个细菌属和晋宁斯塔莫酵母属(Starmerella)、拟魏克酵母属(Wickerhamiella)等4个真菌属;工业发酵豆瓣酱中的优势群落为芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)等7个细菌属与曲霉属(Aspergillus)、Starmerella等5个真菌属。 传统发酵豆瓣酱的生物胺总量(299.85 mg/kg)高于工业发酵豆瓣酱(272.37 mg/kg),且两者在组胺、β-苯乙胺、精胺含量上差异较大。总体上,工业发酵豆瓣酱生产过程更易受控制,在风味与安全性方面更佳,但传统发酵中微生物群落的多样性带来的影响也值得借鉴。
[1]TAN X Y,LU Y H,LIN X,et al.An insight into volatile and non-volatile compounds of Chinese horsebean-chili-paste meju produced by natural brewing and temperature-controlled brewing methods[J].J Sci Food Agr,2021,101(6):2371-2379.
[2]LI X Y,ZHAO C S, ZHENG C, et al, Characteristics of microbial community and aroma compounds in traditional fermentation of Pixian broad bean paste as compared to industrial fermentationr[J].Int J Food Prop,2017,20:2520-2531.
[3]张芃芃,王世乐,陈福生,等.蚕豆豆瓣酱发酵过程中微生物群落与挥发性风味物质的相关性[J].中国酿造,2023,42(5):41-49.
[4]贾云,钮成拓,郑飞云,等.传统豆瓣酱微生物群落发酵演替规律及其功能分析[J].微生物学报,2021,61(9):2749-2764.
[5]YANG M L,HUANG J,ZHOU R Q,et al.Characterizing the microbial community of Pixian Doubanjiang and analysing the metabolic pathway of major flavour metabolites[J].LWT-Food Sci Technol, 2021, 143:111170.
[6]GAO X Z, LIU H, YI X X, et al.Microbial floral dynamics of Chinese traditional soybean paste(Doujiang)and commercial soybean paste[J].J Microbiol Biotechn,2013,23(12):1717-1725.
[7]李治华,王自鹏,胡静,等.传统与商品郫县豆瓣酱挥发性成分的比较分析[J].现代食品科技,2014,30(4):268-273,219.
[8]曾艳,白艳,余进,等.传统郫县豆瓣和红油郫县豆瓣后发酵过程中风味成分的差异分析[J].食品与发酵工业,2023,49(19):289-295.
[9]曾雪晴.豆瓣酱发酵过程中生物胺及理化指标的变化研究[D].重庆:西南大学,2020.
[10]范智义,邓维琴,李恒,等.不同品牌郫县豆瓣品质指标分析[J].食品与发酵工业,2020,46(13):230-236.
[11]李雄波.含盐量对郫县豆瓣甜瓣子发酵过程的影响及其酿造新工艺的研究[D].成都:成都大学,2020.
[12]陈功,范智义,邓维琴,等.利用高效液相色谱法测定不同发酵时长豆瓣酱中的8种生物胺[J].食品工业科技,2019,40(21):262-267.
[13]邓维琴,陈功,张其圣,等.不同发酵时长郫县豆瓣酱品质对比研究[J].中国调味品,2018,43(11):84-90,94.
[14]彭凯雄,唐群勇,陈晓明.酿酒用生、熟大米挥发性风味物质差异分析[J].中国食品学报,2023,23(11):303-319.
[15]LU Y H,CHI Y L,LV Y P,et al.Evolution of the volatile flavor compounds of Chinese horse bean-chili-paste[J].LWT-Food Sci Technol,2019,102:131-135.
[16]彭杰,冉玉琴,徐炜桢,等.郫县豆瓣后发酵期氨基酸呈味效果评价及其ACE抑制肽动态分析[J].食品工业科技,2020,41(8):1-6,14.
[17]魏依兰,李娜,刘佳莉,等.郫县豆瓣关键滋味组分的鉴定[J].食品工业科技,2023,44(21):358-366.
[18]SUN X X, YU Y M, SALEH A S M, et al.Characterization of aroma profiles of chinese four most famous traditional red-cooked chickens using GC-MS,GC-IMS,and E-nose[J].Food Res Int,2023,173:113335.
[19]陈臣,田同辉,刘政,等.基于感官评价、GC-IMS和GC-MS的中式酸凝奶酪挥发性风味比较[J].食品科学,2023,44(16):228-236.
[20]邵淑贤,徐梦婷,林燕萍,等.基于电子鼻与HS-SPME-GC-MS技术对不同产地黄观音乌龙茶香气差异分析[J].食品科学,2023,44(4):232-239.
[21]范海默特.化合物嗅觉阈值汇编(第二版)[M].北京:科学出版社,2018:1-648.
[22]鲍奕达,张丽杰,郑鹏飞,等.郫县豆瓣发酵过程的微生物多样性及溯源分析[J].微生物学报,2020,60(11):2555-2571.
[23]RECKEM E V, CLAEYS E, CHARMPI C, et al.High-throughput amplicon sequencing to assess the impact of processing factors on the development of microbial communities during spontaneous meat fermentation[J].Int J Food Microbiol,2021,354:109322.
[24]LU Y H,TAN X Y,LV Y P,et al.Physicochemical properties and microbial community dynamics during Chinese horse bean-chili-paste fermentation, revealed by culture-dependent and culture-independent approaches[J].Food Microbiol,2020,85:103309.
[25]LIANG J,LI D,SHI R,et al.Effects of microbial community succession on volatile profiles and biogenic amine during sufu fermentation[J].LWTFood Sci Technol,2019,114:108379.
[26]隋雨萌,王慧平,刘嘉琪,等.传统发酵食品中基于微生物多样性的生物胺形成研究进展[J].食品工业科技,2024,45(2):356-363.
[27]李东蕊.豆瓣酱工业发酵过程中生物胺的生成规律及微生物多样性的研究[D].无锡:江南大学,2020.