褐藻胶,又称海藻酸钠,是由β-1.4-糖苷键连接β-D-甘露糖醛酸和α-L-古罗糖醛酸组成的线性多糖[1-3],采用物理法、化学法或者生物酶法能够降解褐藻胶产生褐藻胶寡糖(alginate oligosaccharide,AOS)。AOS具有抗氧化、抗凝血、抗肿瘤和降血糖等功能[4-5],其分子质量比褐藻胶小,溶解度更高[6-7],应用优势大。与物理法、化学法相比,酶解法制备褐藻胶寡糖具有效率高、条件温和、绿色环保等优点[8],而且酶解制备寡糖的活性往往高于酸降解获得的寡糖[9]。褐藻胶裂解酶作为制备褐藻胶寡糖的重要工具酶[10],通过β-消除机制降解褐藻胶,产生具有非还原性不饱和双键的寡糖[11-13],提高了功能性褐藻胶寡糖的产率[14]。
利用微生物生产褐藻胶裂解酶具有生长速度快、易操控等优势[15],且不同微生物可产生不同特性的褐藻胶裂解酶[16]。目前,产褐藻胶裂解酶的微生物主要有海洋细菌、真菌等,海洋细菌因其独特的生存环境和代谢产物多样性,成为获得褐藻胶裂解酶的主要途径。已报道的产褐藻胶裂解酶的海洋细菌主要包括交替假单胞菌属(Pseudoalteromonas sp.)、弧菌属(Vibrio sp.)、黄 杆菌属(Flavobacterium sp.)等,多为革兰氏阴性菌[17]。 葛东振等[18]通过单因素和正交试验优化了弧菌HB161653产褐藻胶裂解酶的条件,酶活力达到42.1 U/mL;孟青等[19]筛选到一株需钠弧菌(Vibrio natriegens)SK42.001,优化后产褐藻胶裂解酶活力为(5.20±0.14)U/mL。目前,褐藻胶裂解酶仍存在活性不高和稳定性较差的缺点,导致其相关研究仍处于实验室阶段[20],在一定程度上限制了褐藻胶裂解酶在生产上的应用,研究开发可应用于分解褐藻胶的高活力褐藻胶裂解酶具有必要性。
本研究采用透明圈法初筛、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定酶活复筛,从海洋细菌中分离筛选高产褐藻胶裂解酶的菌株,通过形态学观察、生理生化试验和分子生物学技术对其进行菌种鉴定,并以褐藻胶裂解酶活力为响应值,通过单因素和响应面试验对其产酶条件进行优化,提高该菌株产酶能力,为褐藻胶裂解酶的工业化生产及应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
56株海洋细菌(菌株编号为I14、C-X-12-5Ⅱ、C-X-12-6D、C-X-12-1A等):由华南农业大学海洋学院实验室分离自海胆肠道并保藏。
1.1.2 试剂
蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;酵母粉、琼脂粉(均为生化试剂):广州环凯微生物科技有限公司;海藻酸钠、氯化钠、亚硫酸钠(均为分析纯):天津市大茂化学试剂厂;可溶性淀粉(生化试剂)、无水氯化钙(分析纯):天津市百世化工有限公司;10 mmoL/L Tris-HCl缓冲液(分析纯):广州亿涛生物科技有限公司;DNS、酒石酸钾钠、苯酚(均为分析纯):国药集团化学试剂有限公司;革兰氏染色试剂盒:北京索莱宝科技有限公司;芽孢杆菌生化鉴定条:青岛海博生物技术有限公司;其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
LB肉汤:广州环凯微生物科技有限公司。
LB固体培养基[21]:LB肉汤21 g,海盐30 g,琼脂15 g,蒸馏水1 000 mL。
LB液体培养基[21]:LB肉汤21 g,NaCl 10 g,蒸馏水1 000 mL。
初筛培养基[22]:海藻酸钠5 g,(NH4)2SO4 2 g,NaCl 15 g,MgSO4·7H2O 1 g,K2HPO4 2 g,FeSO4·7H2O 0.05 g,琼脂15 g,蒸馏水1 000 mL,pH 7.2。
发酵培养基[22]:海藻酸钠5 g,蛋白胨10 g,酵母粉5 g,NaCl 15 g,蒸馏水1 000 mL,pH 7.2。
以上培养基均采用121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
HYL-C3组合式摇床:山东博科科学仪器有限公司;YX-24HDD手提式压力蒸汽灭菌器:江阴滨江医疗设备有限公司;HH-4数显恒温水浴锅:常州澳华仪器有限公司;AL104万分之一电子天平:瑞士梅特勒-托利多仪器(上海)有限公司;ZDJ-3D全自动电位滴定仪:北京先驱威锋技术开发公司;VersaMax光栅型酶标仪:美国Melecular Devices公司;Axio Observer A1倒置荧光显微镜:德国Carl Zeiss公司;SW-CJ-2F洁净工作台:苏静集团苏州安泰空气技术有限公司;5415 R小型高速冷冻离心机:德国Eppendorf公司。
1.3 方法
1.3.1 高产褐藻胶裂解酶菌株的筛选
初筛:将56株海洋细菌划线接种于LB固体培养基上,于30 ℃条件下活化培养48 h。挑取单菌落分别点种于初筛培养基上,每个平板接种10个菌株,于30 ℃恒温培养48 h,观察菌株周围是否产生透明圈,测量并记录水解透明圈直径(D)与菌落直径(d),计算D/d值,选择D/d 值较大的菌株进行复筛。
复筛:将初筛菌株划线接种于LB固体培养基上,于30 ℃条件下活化培养48 h。挑取单菌落分别接种于LB液体培养基中,30 ℃、180 r/min振荡培养16 h制成种子液,将种子液按3%(V/V)的接种量接种于发酵培养基,于30 ℃、180 r/min条件下振荡培养48 h。取发酵液于4 ℃、12 000 r/min条件下离心10min,采用DNS法测定发酵上清液的褐藻胶裂解酶活力[23],筛选高产褐藻胶裂解酶的菌株。
1.3.2 筛选菌株的鉴定
(1)形态学观察
将筛选菌株划线接种于LB固体培养基,30 ℃条件下培养2 d,观察菌落形态。参考刘烨瑀等[24]的方法对菌株进行革兰氏染色,利用油镜观察菌体的染色特征及细胞形态。
(2)生理生化试验[25]
采用芽孢杆菌生化鉴定条对筛选菌株的生理生化特征进行测定。
(3)分子生物学鉴定[26]
委托北京擎科生物科技有限公司对菌株的基因组DNA进行提取、16S rDNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增并测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,并采用基本局部比对搜索工具(basic local alignment search tool,BLAST)与已知菌种序列进行同源性比对。选取同源性较高的模式菌株的16S rDNA基因序列,利用MEGA-X软件中的邻接法(neighbor-joining,NJ)法构建系统发育树,进行种属鉴定。
1.3.3 筛选菌株产褐藻胶裂解酶发酵条件优化
(1)Plackett-Burman(PB)试验[27]
基于单因素试验结果,向发酵培养基中添加可溶性淀粉作为复合碳源的成分,添加氯化钙作为复合无机盐的成分,在方法1.3.1的基础上,以海藻酸钠添加量(A)、淀粉添加量(B)、蛋白胨添加量(C)、酵母粉添加量(D)、NaCl添加量(E)、CaCl2添加量(F)、初始pH值(G)、发酵温度(H)、发酵时间(J)及装液量(K)为考察因素,以褐藻胶裂解酶活力(Y)为响应值,采用Design Expert 8.0.6软件设计10因素2水平的PB试验,每个因素设置低(-1)和高(+1)2个水平,PB试验因素与水平见表1。
表1 发酵条件优化Plackett-Burman试验因素与水平
Table 1 Factors and levels of Plackett-Burman tests for fermentation conditions optimization

因素 低水平(-1) 高水平(+1)A 海藻酸钠添加量/(g·L-1)B 可溶性淀粉添加量/(g·L-1)C 蛋白胨添加量/(g·L-1)D 酵母粉添加量/(g·L-1)E NaCl添加量/(g·L-1)F CaCl2添加量/(g·L-1)G 初始pH值H 发酵温度/℃J 发酵时间/h K 装液量/(mL·100 mL-1)52511 5 0.1 6 30 24 20 10 5 10 5 30 0.5 8 35 48 30
(2)最陡爬坡试验
在PB试验结果的基础上,确定对褐藻胶裂解酶活力影响最显著的因素,采用Design Expert 8.0.6软件设计7组最陡爬坡试验。
(3)Box-Behnken响应面试验
根据PB试验及最陡爬坡试验结果,以褐藻胶裂解酶活力(Y)为响应值,选择CaCl2添加量(X1)、酵母粉添加量(X2)、发酵温度(X3)为自变量,采用Design Expert 8.0.6软件设计3因素3水平的Box-Behnken响应面试验,试验因素与水平见表2。
表2 发酵条件优化Box-Behnken响应面试验因素与水平
Table 2 Factors and levels of Box-Behnken tests for fermentation conditions optimization

因素X1CaCl2添加量/(g·L-1)X2酵母粉添加量/(g·L-1)X3发酵温度/℃-1水平0 1 0.1 2 30 0.3 4 34 0.5 6 38
1.3.4 褐藻胶裂解酶活力的测定
参考陈朋等[23]的方法并稍作修改:取0.2 mL粗酶液加入具塞刻度试管中,在空白对照管中加入0.2 mL经沸水浴灭活的粗酶液,再加入1.8 mL 10 mg/mL的海藻酸钠底物(采用pH为7.4的10 mmol/L Tris-HCl缓冲液配制),摇匀,于40℃水浴反应20min,加入1.5mLDNS试剂并沸水浴5min,冷却至室温后,加水定容至10 mL,在波长540 nm处测定吸光度值。以葡萄糖质量浓度(X)为横坐标,波长540 nm处的吸光度值(Y)为纵坐标,绘制葡萄糖标准曲线,得到线性回归方程为Y=0.257X-0.224,相关系数R2=0.997 4。 计算褐藻胶裂解酶活力大小,其计算公式如下:
式中:A为粗酶液在波长540 nm处的吸光度值(A540 nm值);A0为灭活粗酶液在波长540 nm处的吸光度值(A540 nm值);K为葡萄糖标准曲线斜率;t为反应时间,min;1 000为mg与μg的换算系数;0.2为酶液添加量,mL。
褐藻胶裂解酶活力单位的定义:1 mL粗酶液在pH 7.4、40 ℃条件下,每1 min水解海藻酸钠底物产生1 μg还原糖所需要的酶量,U/mL。
1.3.5 数据处理
每个试验重复3次,釆用Excel 2019整理数据,结果以“平均值±标准差”表示,使用Design Expert 8.0.6进行试验设计和结果分析,使用Origin 2019作图。
2 结果与分析
2.1 高产褐藻胶裂解酶菌株的筛选
褐藻胶裂解酶在以海藻酸钠为唯一碳源的培养基上发生酶解反应会产生透明水解圈[28],因此,根据水解圈的大小可判别菌株产褐藻胶裂解酶的能力。56株试验菌株在初筛培养基中培养后,结果发现,有8株菌株产生了透明圈,从中筛选4株D/d值较大的菌株作为初筛菌株,结果见图1。

图1 初筛菌株的水解圈直径/菌落直径值
Fig.1 Hydrolysis circle diameter/colony diameter values of preliminary screened strains
不同小写字母表示差异显著(P<0.05)。下同。
由图1可知,菌株I14的D/d值最大,为3.167。 进一步采用DNS法测定4株菌株的褐藻胶裂解酶活力,结果见表3。由表3可知,菌株I14的褐藻胶裂解酶活力最高,为17.08 U/mL,菌株C-X-12-1A的褐藻胶裂解酶活力最低,为2.42 U/mL,因此,选择菌株I14为目的菌株。
表3 初筛菌株的褐藻胶裂解酶活力测定结果
Table 3 Determination results of alginate lyase activity of preliminary screened strains

菌株编号 褐藻胶裂解酶活力/(U·mL-1)I14 C-X-12-5II C-X-12-6D C-X-12-1A 17.08±0.42a 14.84±0.26b 5.39±0.53c 2.42±0.46d
2.2 菌株I14的鉴定
2.2.1 形态学观察
菌株I14在LB固体培养基上的菌落形态及细胞形态见图2。 由图2A可知,菌株I14的菌落呈现乳白色,近圆形,表面湿润、光滑、不透明,中间凸起;革兰氏染色及结果呈紫色,说明该菌株为革兰氏阳性细菌,菌体为短杆状,与迟燕平等[29]筛选产γ-氨基丁酸的贝莱斯芽孢杆菌(Bacillus velezensis)CLYB1形态类似。
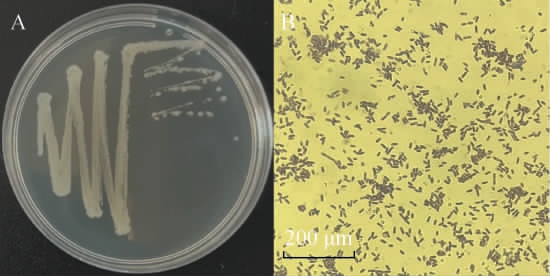
图2 菌株I14的菌落(A)及细胞(B)形态
Fig.2 Colony (A) and cell (B) morphology of strain I14
2.2.2 生理生化试验
菌株I14的生理生化特征见表4。由表4可知,菌株I14的V-P试验结果为阴性,可以利用D-木糖、L-阿拉伯糖、D-甘露醇和淀粉,无法利用柠檬酸盐和丙酸盐,菌株I14能使明胶液化,耐受7%的NaCl,能在pH 5.7的环境下生长以及厌氧生长,能还原硝酸盐。
表4 菌株I14的生理生化特性
Table 4 Physiological and biochemical characteristics of strain I14
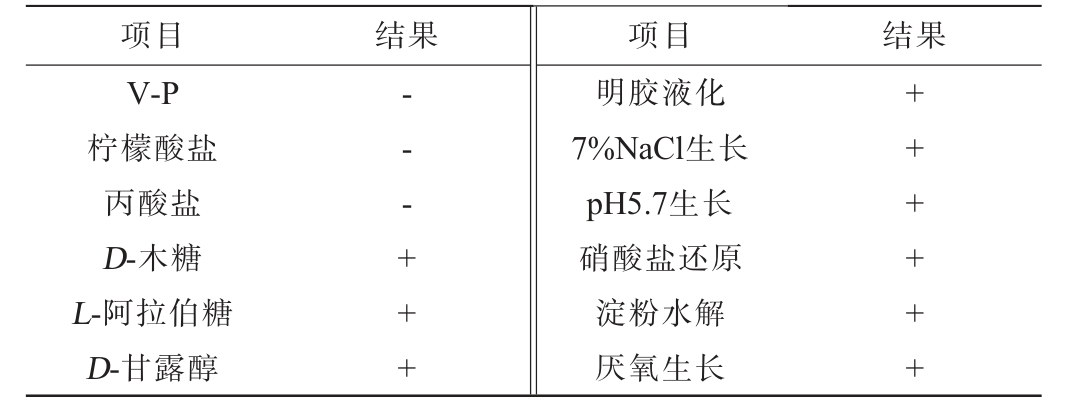
注:“+”代表结果呈阳性;“-”代表结果呈阴性。
项目 结果 项目 结果V-P柠檬酸盐丙酸盐D-木糖L-阿拉伯糖D-甘露醇---+++明胶液化7%NaCl生长pH5.7生长硝酸盐还原淀粉水解厌氧生长++++++
2.2.3 分子生物学鉴定
基于16S rDNA基因序列构建菌株I14的系统发育树,结果见图3。 由图3可知,菌株I14与贝莱斯芽孢杆菌(Bacillus velezensis)FZB42(GenBank登录号为NR075005)处于同一个分支,亲缘关系最近。结合菌株I14的形态学和生理生化特征,将其鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。

图3 基于16S rDNA基因序列菌株I14的系统发育树
Fig.3 Phylogenetic tree of strain I14 based on 16S rDNA gene sequence
2.3 贝莱斯芽孢杆菌I14产褐藻胶裂解酶发酵条件优化
2.3.1 Plackett-Burman试验
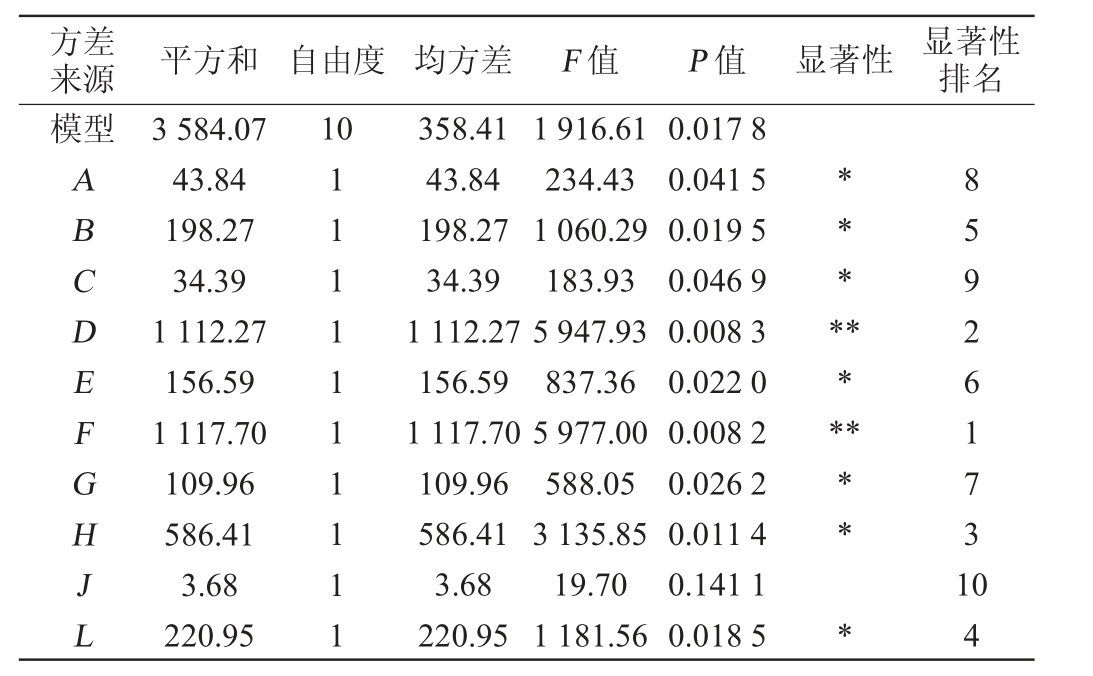
贝莱斯芽孢杆菌I14产褐藻胶裂解酶发酵条件优化PB试验设计及结果见表5,方差分析结果见表6。
表5 Plackett-Burman试验设计及结果
Table 5 Design and results of Plackett-Burman experiments
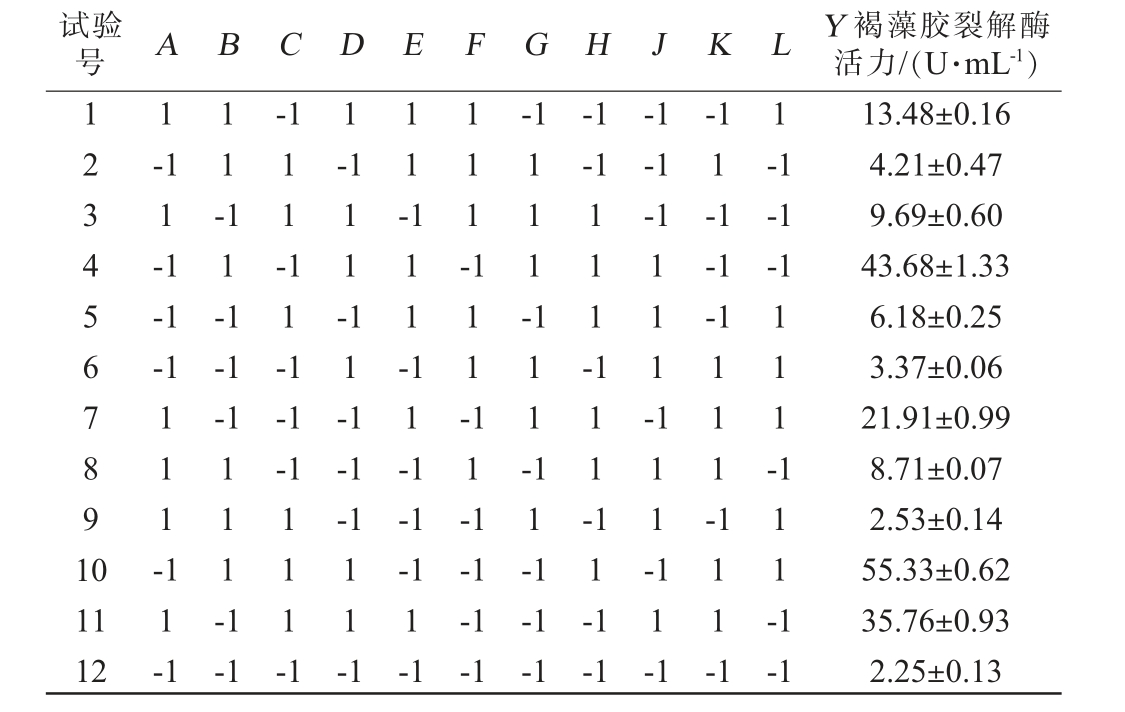
试验号 A B C D E F G H J K L Y 褐藻胶裂解酶活力/(U·mL-1)1234567891 0 1-1 1-1 1-1 1-1-1-1 11--1-1-1 11-1 11-11-11-111--1-1-1 111-111-11-1 111--1 1-1-1-1-1-1-1 111--1-1-1-1 11-1 111-111-11-1 111-11-1 111-11-1 111-111-111-1 111--1-1 11 12 11-1 11-1 111-1-1 111-1 11-1-1-1 1-1-1-1-1-1-1-1 11-1 111-1-1 13.48±0.16 4.21±0.47 9.69±0.60 43.68±1.33 6.18±0.25 3.37±0.06 21.91±0.99 8.71±0.07 2.53±0.14 55.33±0.62 35.76±0.93 2.25±0.13
表6 Plackett-Burman试验结果方差分析
Table 6 Variance analysis of Plackett-Burman experiments
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。 下同。
方差来源 平方和 自由度 均方差 F 值 P 值 显著性 显著性排名模型10 ABCDEFGHJL 3 584.07 43.84 198.27 34.39 1 112.27 156.59 1 117.70 109.96 586.41 3.68 220.95 1111111111 358.41 43.84 198.27 34.39 1 112.27 156.59 1 117.70 109.96 586.41 3.68 220.95 1 916.61 234.43 1 060.29 183.93 5 947.93 837.36 5 977.00 588.05 3 135.85 19.70 1 181.56 0.017 8 0.041 5 0.019 5 0.046 9 0.008 3 0.022 0 0.008 2 0.026 2 0.011 4 0.141 1 0.018 5********** *859261731 04
采用Design Expert 8.0.6对表5试验结果进行多元回归拟合,得到以褐藻胶裂解酶活力(Y)为响应值的多元一次回归方程:Y=17.26-1.91A+4.06B+1.69C+9.63D+3.61E-9.65F-3.03G+6.99H-0.55J+4.29K。
由表6可知,模型显著(P<0.05),决定系数R2=0.999 9,调整决定系数R2adj=0.999 4,说明该模型可靠。10个因素影响贝莱斯芽孢杆菌I14产褐藻胶裂解酶的主次顺序为CaCl2添加量>酵母粉添加量>发酵温度>装液量>可溶性淀粉添加量>NaCl添加量>初始pH值>海藻酸钠添加量>蛋白胨添加量>发酵时间,其中,CaCl2添加量、酵母粉添加量对褐藻胶裂解酶活力的影响极显著(P<0.01),发酵温度、装液量、淀粉添加量、NaCl添加量、初始pH、海藻酸钠添加量、蛋白胨添加量对褐藻胶裂解酶活力的影响显著(P<0.05),发酵时间对褐藻胶裂解酶活力的影响不显著(P>0.01)。 因此,选择影响较大的3个因素CaCl2添加量、酵母粉添加量、发酵温度进行最陡爬坡试验。 确定其他因素的水平分别是海藻酸钠添加量5 g/L、可溶性淀粉添加量5 g/L、蛋白胨添加量10 g/L、NaCl添加量30 g/L、初始pH 6.0、发酵时间24 h、装液量30 mL/100 mL。
2.3.2 最陡爬坡试验
根据Plackett-Burman试验结果,结合各因素的效应值来确定变化方向和步长。酵母粉添加量和发酵温度对褐藻胶裂解酶活力的影响呈现正效应,CaCl2添加量为负效应因素,应选择低水平酵母粉添加量、发酵温度及高水平CaCl2添加量进行爬坡试验,最陡爬坡试验设计及结果见表7。
表7 最陡爬坡试验设计及结果
Table 7 Design and results of the steepest climbing experiments

试验号CaCl2添加量/(g·L-1)酵母粉添加量/(g·L-1)发酵温度/℃褐藻胶裂解酶活力/(U·mL-1)12 3 4 5 6 7 0.60 0.50 0.40 0.30 0.20 0.10 0.05 1.0 2.0 3.0 4.0 5.0 6.0 7.0 28 30 32 34 36 38 40 24.42±0.89 25.26±0.51 39.81±1.00 60.55±0.65 17.73±0.07 31.28±1.28 22.58±0.42
由表7可知,第4组试验条件下,贝莱斯芽孢杆菌I14发酵产褐藻胶裂解酶活力出现最高值,因此,选择试验4的条件(CaCl2添加量0.30 g/L、酵母粉添加量4.0 g/L、发酵温度34 ℃)作为响应面试验因素水平的中心点。
2.3.3 Box-Behnken响应面试验结果
根据PB试验及最陡爬坡试验,以CaCl2添加量(X1)、酵母粉添加量(X2)、发酵温度(X3)为考察因素,以褐藻胶裂解酶活力(Y)为响应值,采用Design Expert 8.0.6设计3因素3水平的Box-Behnken响应面试验,试验设计及结果见表8,方差分析结果见表9。
表8 Box-Behnken响应面试验设计及结果
Table 8 Design and results of Box-Behnken response surface experiments

试验号 X1 X2 X3 Y 褐藻胶裂解酶活力/(U·mL-1)12 3 4 5 6 7 8 9 1 0-1 1 00 0 0 -01 --1 11 0 1 0 1 0 1 0 -1 10 0 -1-1 11 12 13 14 15 16 17 10 0 0 0 0 1 0 0 0 --1 0 00 0 1 0 0 1 1 0 -1 11 0 1 -1 21.41±0.08 19.74±0.11 24.59±0.50 71.99±0.13 74.16±0.09 8.20±0.84 48.95±0.46 80.11±0.26 33.79±0.75 83.42±0.07 15.05±0.06 85.64±0.45 27.27±0.18 46.00±0.50 58.77±0.74 42.60±0.29 28.44±0.04
表9 回归模型方差分析
Table 9 Variance analysis of regression model
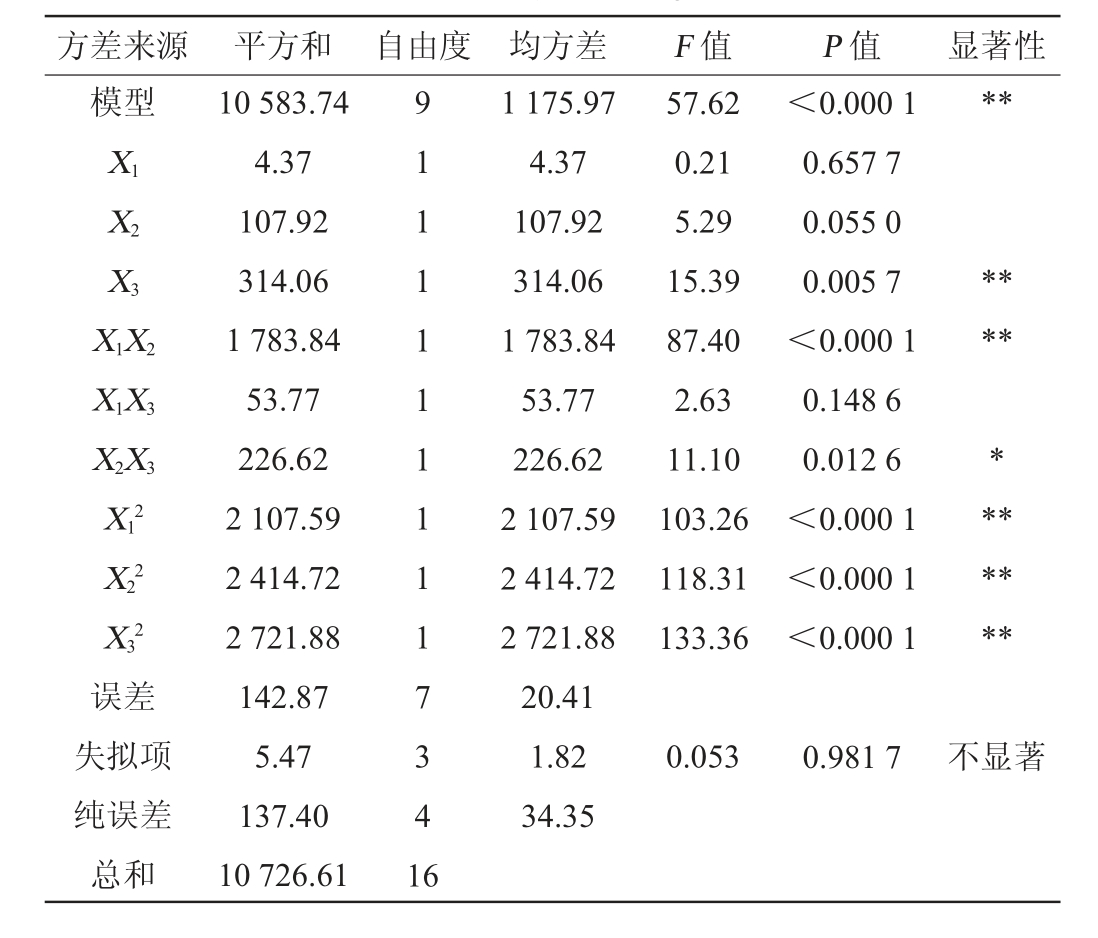
方差来源 平方和 自由度 均方差 F 值 P 值 显著性模型**X1X2X3 X1X2****X1X3 X2X3*X12 X22 X32 57.62 0.21 5.29 15.39 87.40 2.63 11.10 103.26 118.31 133.36<0.000 1 0.657 7 0.055 0 0.005 7<0.000 1 0.148 6 0.012 6<0.000 1<0.000 1<0.000 1******误差失拟项纯误差总和10 583.74 4.37 107.92 314.06 1 783.84 53.77 226.62 2 107.59 2 414.72 2 721.88 142.87 5.47 137.40 10 726.61 91 1 1 1 1 1 1 1 1 7 3 4 1 6 1 175.97 4.37 107.92 314.06 1 783.84 53.77 226.62 2 107.59 2 414.72 2 721.88 20.41 1.82 34.35 0.053 0.981 7不显著
通过软件Design Expert 8.0.6对表8中的试验结果进行多元二次回归拟合分析,得到CaCl2添加量(X1)、酵母粉添加量(X2)、发酵温度(X3)与褐藻胶裂解酶活力(Y)的回归方程:
由表9可知,回归模型极显著(P<0.001),失拟项不显著(P>0.05),说明模型的拟合程度良好;决定系数R2=0.986 7,调整决定系数R2adj=0.969 6,说明模型可信度较高,能够通过该模型预测贝莱斯芽孢杆菌I14发酵产褐藻胶裂解酶酶活力。根据F值可知,各因素影响褐藻胶裂解酶活力的主次顺序为发酵温度>酵母粉添加量>CaCl2添加量。根据P值可知,一次项X3、交互项X1X2、二次项X12、X22及X32对褐藻胶裂解酶活力影响极显著(P<0.01),交互项X2X3的影响显著(P<0.05),其他项影响不显著(P>0.05)。
CaCl2添加量、酵母粉添加量和发酵温度间交互作用对贝莱斯芽孢杆菌I14发酵产褐藻胶裂解酶影响的响应曲面和等高线见图4。由图4可知,CaCl2添加量和酵母粉添加量、酵母粉添加量与发酵温度间交互作用对贝莱斯芽孢杆菌I14发酵产褐藻胶裂解酶影响的等高线图呈椭圆形,交互作用较强,对褐藻胶裂解酶酶活影响较大;而CaCl2添加量和发酵温度间交互作用对贝莱斯芽孢杆菌I14发酵产褐藻胶裂解酶影响的等高线图趋于圆形,交互作用较小,对褐藻胶裂解酶酶活影响较小,这与表9中的方差分析结果一致。
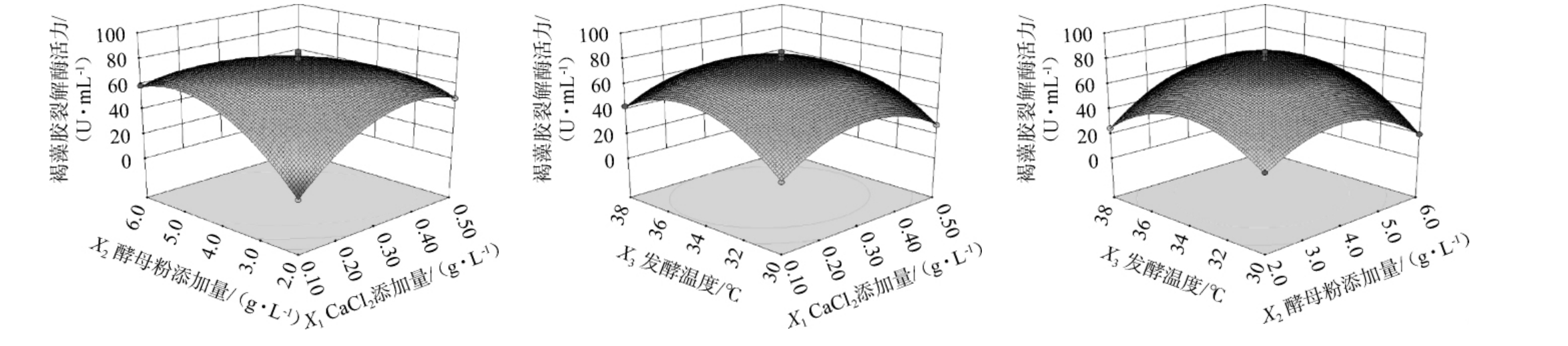
图4 各因素间交互作用对褐藻胶裂解酶活力影响的响应面和等高线
Fig.4 Response surface plots and contour line of effects of interaction between various factors on alginate lyase activity
2.3.4 最佳发酵条件验证
采用Design Expert 8.0.6软件对回归方程进行最优求解,得到贝莱斯芽孢杆菌I14发酵产褐藻胶裂解酶的最优条件为CaCl2添加量0.28 g/L、酵母粉添加量4.29 g/L、发酵温度34.60 ℃,褐藻胶裂解酶活力预测值为79.836 U/mL。为便于实际操作,将最优发酵条件修正为CaCl2添加量0.30 g/L、酵母粉添加量4.30 g/L、发酵温度35 ℃。 在此条件下进行3组平行试验重复验证,获得褐藻胶裂解酶活力为(81.29±1.03)U/mL,与预测值接近,说明模型预测获得贝莱斯芽孢杆菌I14发酵产褐藻胶裂解酶的最优发酵产酶条件可靠。与弧菌属(Vibrio sp.)YY7[30]、芽孢杆菌属(Bacillus sp.)HZ-1[22]、明亮发光杆菌(Photobacterium phosphoreum)[31]等相比,贝莱斯芽孢杆菌I14的褐藻胶裂解酶活力高,具有进一步开发褐藻胶裂解酶实际生产应用的潜力。
3 结论
通过透明圈法初筛及DNS法测定酶活复筛,从56株海洋细菌中筛选得到一株高产褐藻胶裂解酶的菌株I14,经形态观察、生理生化试验及分子生物学技术鉴定其为贝莱斯芽孢杆菌(Bacillusvelezensis)。 采用Plackett-Burman试验、最陡爬坡试验以及Box-Behnken响应面试验,获得贝莱斯芽孢杆菌I14产褐藻胶裂解酶的最优发酵条件:海藻酸钠添加量5 g/L、可溶性淀粉添加量5 g/L、酵母粉添加量4.30 g/L、蛋白胨添加量10 g/L、NaCl添加量30 g/L、CaCl2添加量0.30 g/L、初始pH值6.0、发酵温度35 ℃、发酵时间24 h、装液量30 mL/100 mL。在此条件下,褐藻胶裂解酶活力达到81.29 U/mL,是优化前(17.08 U/mL)的4.76倍。本研究为褐藻胶裂解酶的开发提供新的菌种选择,后续将深入探究其酶学性质,确定酶的产率和稳定性,拓展褐藻胶裂解酶在制备结构不同的褐藻胶寡糖、食品保健等方面的应用。
[1]LI Q,ZHENG L,GUO Z,et al.Alginate degrading enzymes:an updated comprehensive review of the structure, catalytic mechanism, modification method and applications of alginate lyases[J].Crit Rev Biotechnol,2021,41(6):953-968.
[2]崔永燕,杨敏,刘楠,等.褐藻胶寡糖的酶法定向制备及其结构-功能关系的研究进展[J].食品科学,2024,45(10):320-329.
[3]黄友涛,梁青平,高筱雅,等.不同结构褐藻胶寡糖的制备与功效研究进展[J].食品科学,2024,45(1):313-325.
[4]WANG M P, CHEN L, ZHANG Z J.Potential applications of alginate oligosaccharides for biomedicine-A mini review[J].Carbohydr Polym,2021,271:118408.
[5]ZHANG C, LI M, RAUF A, et al.Process and applications of alginate oligosaccharides with emphasis on health benefical perspective[J].Crit Rev Food Sci Nutr,2023,63(3):303-329.
[6]曾斌芬,时瑞,吴曼铃,等.褐藻胶寡糖的功能特性研究进展[J].食品研究与开发,2022,43(13):210-216.
[7]刘以晴,马月云,刘宗浩,等.褐藻胶寡糖的制备、分离及表征研究进展[J].食品工业科技,2022,43(9):456-468.
[8]LIU J,YANG S,LI X,et al.Alginate oligosaccharides:production,biologicalactivities,and potential applications[J].Compr Rev Food Sci F,2019,18(6):1859-1881.
[9]YAGI H,ISOBE N,ITABASHI N,et al.Characterization of a long-lived alginate lyase derived from Shewanella species YH1[J].Mar Drugs,2018,16(1):4.
[10] 高荣,郑志国,鲍时翔,等.产褐藻胶裂解酶菌株筛选与高产酶菌株的ARTP诱变选育[J].中国酿造,2022,41(8):64-69.
[11]BOUCELKHA A, PETIT E, ELBOUTACHFAITI R, et al.Production of guluronate oligosaccharide of alginate from brown algae Stypocaulon scoparium using an alginate lyase[J].J Appl Phycol,2017,29:509-519.
[12]翟婧.海洋细菌Pseudomonas sp.YD-1产褐藻胶裂解酶及酶解产物的研究[D].烟台:烟台大学,2023.
[13]MRUDULAKUMARI V U,LEE O K,LEE E Y.Alginate derived functional oligosaccharides: recent developments, barriers, and future outlooks[J].Carbohydr Polym,2021,267:118158-118175.
[14]ZHANG X Y,TANG Y Q,GAO F,et al.Low-cost and efficient strategy for brown algal hydrolysis: combination of alginate lyase and cellulase[J].Bioresour Technol,2024,397:130481.
[15]孟青.褐藻胶裂解酶产酶菌株挖掘及其催化特性研究[D].无锡:江南大学,2021.
[16]杨子祥,李金梦,宋琨燕,等.海洋寡糖酶法制备研究进展[J].食品工业科技,2023,44(18):458-467.
[17]黄哲,胡睿同,王连顺,等.褐藻寡糖的酶法制备及其在水产养殖中的应用[J].饲料研究,2024,47(2):139-145.
[18]葛东振,鲍时翔,高荣,等.产褐藻胶裂解酶弧菌HB161653的产酶条件优化[J].中国酿造,2022,41(11):199-203.
[19]孟青,江波,周力铖,等.一株产褐藻胶裂解酶的需钠弧菌筛选及酶解产物分析[J].微生物学通报,2022,49(2):421-436.
[20]CHEN C,LI X F,LU C,et al.Advances in alginate lyases and the potential application of enzymatic prepared alginate oligosaccharides: a mini review[J].Int J Biol Macromol,2024,260:129506.
[21]黄彦超,钱凯成,平双双,等.一株源自深海沉积物产中温α-淀粉酶菌株的鉴定及其酶学性质的研究[J].食品工业科技,2018,39(4):111-116,130.
[22]白新峰,贾爱荣,刘雪,等.海参肠道内容物中海藻多糖降解菌的筛选及鉴定[J].生物技术通报,2021,37(6):147-153.
[23]陈朋,朱玥明,韩文佳,等.产褐藻胶裂解酶菌种的筛选、鉴定及发酵条件优化[J].食品科学,2015,36(15):105-111.
[24]刘烨瑀,张金平,陈立功,等.产褐藻胶裂解酶菌株筛选、鉴定与酶学性质研究[J].食品科技,2022,47(9):8-14.
[25]李梦,温少红,王坤阳,等.产褐藻胶裂解酶菌株的筛选与鉴定[J].食品科技,2023,48(7):1-9.
[26]王清龙,陈园园,刘延波,等.高产阿魏酸酯酶菌株的筛选鉴定及产酶条件优化[J].中国酿造,2022,41(10):83-88.
[27]王艺欣,张健,刘芳,等.褐藻胶降解菌株S10鉴定及产酶条件优化[J].微生物学杂志,2023,43(1):66-76.
[28]李昌明.海参肠道微生物多样性分析及菌株s12T褐藻胶裂解酶研究[D].济南:山东大学,2019.
[29]迟燕平,苗新宇,王景会,等.产γ-氨基丁酸贝莱斯芽孢杆菌CLYB1的鉴定及基因组改组选育研究[J].食品工业科技,2023,44(19):167-173.
[30]姚艳艳,刘心田,常丽荣,等.鲍鱼肠道海带降解菌株的筛选、鉴定及粗酶学性质研究[J].食品与发酵工业,2019,45(9):61-66.
[31]刘彩琴,王楠,陈薇青,等.一株明亮发光杆菌产褐藻胶裂解酶的培养基优化[J].食品工业科技,2017,38(8):156-160.