葡萄酒是一种富含氨基酸、蛋白质、维生素、有机酸等营养成分的发酵酒,其中白藜芦醇、儿茶酚等具有美容养颜、抗氧化等功效,对减肥、预防心血管疾病、降血脂等均有促进作用[1]。 二氧化硫是目前葡萄酒生产中最常用的抗氧化剂、抑菌剂,自20世纪80年代,二氧化硫使用的安全性引起了越来越多的关注。 过多二氧化硫的使用会对葡萄酒造成不好的感官体验甚至影响消费者的健康,在保证葡萄酒质量的同时,减少二氧化硫的添加已成为葡萄酒产业的趋势[2]。 一些具有抗氧化性或抑菌性的生物试剂、无机化学试剂及一些非热物理手段走进人们的视野。 一些二氧化硫替代品,如溶菌酶、壳聚糖、二甲基二碳酸盐等物质,以及新型非热杀菌技术,如超声波、超高压、脉冲电场等被用于食品中,起到抗氧化及灭菌的作用,但这些二氧化硫替代品及新型非热杀菌技术应用在葡萄酒中的研究相对较少。 本文将国内外一些抗氧化剂和抑菌剂,以及新型非热杀菌技术的研究进行梳理,总结归纳了在葡萄酒酿造中抗氧化剂、抑菌剂及新型非热杀菌技术的作用及效果,为在酿造过程中减少二氧化硫的添加提供参考,以期建立低二氧化硫酿造工艺,酿造出优质葡萄酒。
1 二氧化硫在葡萄酒生产中的特性、作用及危害
二氧化硫作为一种食品添加剂,具有漂白、防腐和抗氧化功能,常以焦亚硫酸钾、焦亚硫酸钠、亚硫酸钠、亚硫酸氢钠、低亚硫酸钠等形式用于食品生产。在葡萄酒酿造过程中,二氧化硫通常被认为可起到抗氧化和防腐作用,国标GB 2760—2024《食品安全国家标准食品添加剂使用标准》规定非甜型葡萄酒二氧化硫最大使用量为250 mg/L,甜型葡萄酒及果酒系列产品最大使用量为400 mg/L(以二氧化硫残留量计),且需要注意的是同一功能的食品添加剂(相同色泽着色剂、防腐剂、抗氧化剂)在混合使用时,各自用量占其最大使用量的比例之和应≤1[3]。 前人研究显示,二氧化硫的抗氧化性原理主要包括清除葡萄酒中的氧化物副产物及使酒中氧化酶失活[4]。 二氧化硫是葡萄酒中还原性最强的化合物之一[4],主要分为游离态(分子态、游离亚硫酸氢离子、亚硫酸离子)和结合态(结合态亚硫酸氢加合物,可转化为游离二氧化硫),其中游离亚硫酸氢离子含量最高。葡萄酒中不同形态的二氧化硫特性和作用见表1。
表1 葡萄酒中不同形态二氧化硫特性和作用
Table 1 Characteristics and effects of different sulfur dioxide form in wine

二氧化硫形态 特性和作用 目标浓度或限量(以SO2当量表示)游离态分子态游离亚硫酸氢离子(HSO3-)亚硫酸离子(SO32-)结合态亚硫酸氢加合物总量(游离态+结合态SO2)抑菌抗氧化抗氧化、抑菌对总SO2有贡献抗氧化、抑菌在葡萄酒中不低于0.6~0.8 mg/L,不高于2 mg/L游离态SO2(大部分是HSO3—)为20~40 mg/L游离态SO2在少数葡萄酒产区有规定,如加拿大<70 mg/L在葡萄酒pH下,其比例小于总SO2的1%弱键加合物释放出游离亚硫酸后,可以增加游离态SO2美国:所有葡萄酒<350 mg/L,“未加硫”葡萄酒<10 mg/L;澳大利亚:低糖葡萄酒(糖分35 g/L)<300 mg/L,甜葡萄酒<250 mg/L
在葡萄酒的pH下,二氧化硫主要以HSO3-形式存在,抑制多酚氧化酶的活性,防止葡萄酒褐变。分子态的二氧化硫具有抑菌的作用,能控制各种发酵微生物的繁殖、呼吸等活动。在发酵过程中二氧化硫能抑制不需要的细菌和酵母的生长,从而避免葡萄酒生产和储存过程中的微生物腐败;在葡萄酒装瓶前添加二氧化硫可以延长保质期,减少形成异味的可能性[5]。 二氧化硫作为葡萄酒生产中的重要辅料,其用量应受到严格控制,二氧化硫使用不当会对葡萄酒的发酵、颜色、风味以及人体健康产生不良影响。过量的二氧化硫会使过敏体质者和哮喘病人引发恶心、呕吐、腹痛、头晕、呼吸困难等敏感症状,严重的时候也会危及生命[6]。 SILVA F V M等[7]研究表明,二氧化硫会使人体产生过敏反应、头痛、哮喘、皮炎、腹痛、腹泻和支气管收缩,还会发生胃肠道症状、荨麻疹、血管性水肿、低血压甚至休克等反应。 王震[6]研究发现,二氧化硫添加不当对脑组织、肺、心脏、胃、血液、红细胞、肝脏、脾脏等都有毒性,会严重影响消费者的健康。 在酒精发酵过程中,过量的二氧化硫会使得酵母菌提前终止活动,影响糖分向酒精的转化[8];二氧化硫过量也会抑制葡萄酒的“苹果酸—乳酸发酵”过程,不利于葡萄酒风味的改善和葡萄酒的稳定[9]。在葡萄酒感官方面,二氧化硫容易与花色素结合生成无色的不稳定的亚硫酸色素化合物,对红葡萄酒颜色的保持有负面影响;另外,二氧化硫使用不当或者用量过高时,会在还原条件下形成H2S,让葡萄酒具有臭鸡蛋的气味,影响葡萄酒的风味[10]。
2 葡萄酒酿造过程中二氧化硫替代品的研究进展
近些年来人们健康意识逐渐提高,天然、绿色、无污染的特色产品受到追捧,因此,在葡萄酒酿造过程中减少或者不添加二氧化硫已经受到消费者和葡萄酒行业的关注,寻找可以在葡萄酒生产过程中替代二氧化硫添加的产品具有重要意义。
2.1 具有抑菌作用的二氧化硫替代品
2.1.1 溶菌酶
溶菌酶(lysozyme)是一种由129种氨基酸组成的天然多肽,又称胞壁质酶(muramidase)或N-乙酰胞壁质聚糖水解酶(N-acetylmuramylglycan hydrolase),可以从蛋清中提取出来,其通过水解细菌细胞壁中的粘多糖,使细菌破裂死亡,对革兰氏阳性细菌有较强抑制作用,对革兰氏阴性细菌抑制作用较弱[11]。目前,溶菌酶在乳制品和奶酪产业中被广泛使用,并且已经证明该物质对人体没有危害[12]。国标GB 2760—2024《食品安全国家标准食品添加剂使用标准》规定溶菌酶的使用限量为500 mg/kg[3]。 溶菌酶在葡萄酒的发酵和储存过程中能起到一定的抑菌作用,可以部分替代二氧化硫的添加。
在红葡萄酒酿造过程中,对于长时间浸渍的葡萄酒发酵工艺,特别是葡萄果实在发酵前没有完全破碎的情况下,葡萄皮上的细菌在微量残糖的环境下会增加苹果酸—乳酸发酵的几率[13],此时在发酵早期添加溶菌酶能有效预防这一情况的发生,然而溶菌酶是否会随着酚类化合物的沉降而失效,还有待研究,因此不能排除生产过程中再次被污染的可能[13]。 对于整串葡萄的发酵工艺,在酒精发酵结束前加入10 g/100 L的溶菌酶和5~7 g/100 L的亚硫酸盐一样有效,且25 g/100 L的溶菌酶能将细菌数量从数百万快速的减少到100 CFU/mL以下[13]。白葡萄酒中500 mg/L溶菌酶可以完全抑制苹果酸—乳酸发酵[14]。研究表明[15]在酵母菌活动受抑制酒精发酵停止时,含糖的环境有利于细菌的生长可能导致乳酸腐败;重新启动酒精发酵时加入250~350 mg/L的溶菌酶可以抑制乳酸菌的生长;当乳酸菌超过160 CFU/mL时,添加溶菌酶的量应为500 mg/L,且对葡萄酒的多酚含量、颜色及抗氧化能力没有影响。LASANTAC等[16]验证了在葡萄糖和酸高的葡萄酒中0.062 5 g/L的溶菌酶可以很好地控制甜型葡萄酒中乳酸菌的生长。
值得注意的是,溶菌酶不具有抗氧化性,因此不能完全代替二氧化硫的作用,两者可以搭配使用。另外,添加溶菌酶的葡萄酒可能会引发敏感人群的过敏反应,故酒标上面需注明有溶菌酶的添加。
2.1.2 壳聚糖
壳聚糖(chitosan)由甲壳素经脱乙酰作用而制得,又称为脱乙酰甲壳素,壳聚糖分子表面所带的正电荷可干扰细胞表面大分子带负电荷的残基,导致膜渗漏,因此具有较好的抗菌活性,能抑制一些霉菌、细菌和酵母菌[17]。研究表明[18],大多数壳聚糖及其衍生物对果酒致腐菌的抑制效果较好,如枯草杆菌、芽孢杆菌、金黄色葡萄球菌、布鲁氏酵母菌等。
VALERA M J等[19]选用两株适应高乙醇的醋酸杆菌,将人工污染的葡萄酒分别进行壳聚糖和二氧化硫处理,结果表明,两者均能降低这两株醋酸杆菌的代谢活性,且随着时间数量逐渐减少,其中壳聚糖的应用使醋酸杆菌的生存能力下降。 BA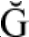 DER ELMACI S等[20]研究了壳聚糖与葡萄酒中的植物乳杆菌、酿酒酵母、酒酒球菌、希氏乳杆菌、布鲁塞尔酒香酵母、有孢汉逊酵母和拜氏接合酵母7种微生物的作用,结果显示,壳聚糖在实验室培养基中酿酒酵母的最小抑制浓度(minimal inhibitory concentration,MIC)>2 g/L,壳聚糖对植物乳杆菌最小抑制浓度(MIC)为2 g/L,对希氏乳杆菌和拜氏接合酵母的最小抑制浓度(MIC)均为0.4 g/L,且希氏乳杆菌、酒酒球菌和布鲁塞尔酒香酵母在壳聚糖质量浓度为0.2 g/L时完全失活。在酒精发酵期间,壳聚糖的抑菌效果有所下降,其对酿酒酵母的活力和发酵性能影响不大[20]。在苹果酸—乳酸发酵中,壳聚糖会抑制乳酸菌的生长从而影响苹果酸—乳酸发酵效果[21]。 添加适量的壳聚糖保持了葡萄酒的感官特性[22]。目前,英国欧盟标准BS EN ISO 25178-606:2015中允许葡萄酒中使用壳聚糖[23],但我国现行的GB 2760—2024《食品安全国家标准食品添加剂使用标准》中规定壳聚糖不能用于葡萄酒中[3]。
DER ELMACI S等[20]研究了壳聚糖与葡萄酒中的植物乳杆菌、酿酒酵母、酒酒球菌、希氏乳杆菌、布鲁塞尔酒香酵母、有孢汉逊酵母和拜氏接合酵母7种微生物的作用,结果显示,壳聚糖在实验室培养基中酿酒酵母的最小抑制浓度(minimal inhibitory concentration,MIC)>2 g/L,壳聚糖对植物乳杆菌最小抑制浓度(MIC)为2 g/L,对希氏乳杆菌和拜氏接合酵母的最小抑制浓度(MIC)均为0.4 g/L,且希氏乳杆菌、酒酒球菌和布鲁塞尔酒香酵母在壳聚糖质量浓度为0.2 g/L时完全失活。在酒精发酵期间,壳聚糖的抑菌效果有所下降,其对酿酒酵母的活力和发酵性能影响不大[20]。在苹果酸—乳酸发酵中,壳聚糖会抑制乳酸菌的生长从而影响苹果酸—乳酸发酵效果[21]。 添加适量的壳聚糖保持了葡萄酒的感官特性[22]。目前,英国欧盟标准BS EN ISO 25178-606:2015中允许葡萄酒中使用壳聚糖[23],但我国现行的GB 2760—2024《食品安全国家标准食品添加剂使用标准》中规定壳聚糖不能用于葡萄酒中[3]。
2.1.3 二甲基二碳酸盐
二甲基二碳酸盐(dimethyl dicarbonate,DMDC)又名维果灵,是一种食物防腐剂。在常温甚至低温的情况下,DMDC可以使有害菌菌体内的关键酶蛋白失活,因而具有较强的灭菌能力。DELFINI C等[24]将DMDC添加到葡萄汁和合成培养基中发现,在20 ℃时,250~400 mg/L的DMDC对酿酒酵母具有抑制作用,其对细菌的抑制作用相对于二氧化硫作用较小,抑制醋酸杆菌和乳杆菌DMDC的质量浓度为500~1 000 mg/L,因此,在实践应用中,通常使用DMDC控制酵母菌的污染,但DMDC作用时效不长,因此不建议在葡萄酒的储存阶段使用DMDC[8]。另外,DMDC也可用于发酵容器的清洁和消毒[13]。
2006年欧盟规定DMDC在葡萄酒中的质量浓度不超过200 mg/L。DMDC的主要分解产物是甲醇和二氧化碳。理论上,每1 mg/L DMDC分解产生0.48 mg/L的甲醇。 国际葡萄与葡萄酒组织(International Organisation of Vine and Wine,OIV)和国标GB/T 15037—2006《葡萄酒》规定红葡萄酒中甲醇的含量不高于400 mg/L,白葡萄酒中不高于250 mg/L。 因此,200 mg/L的DMDC添加量是安全的,在此浓度下,DMDC可以替代二氧化硫抑制葡萄酒中的酵母菌污染。 需要注意的是,该产品在使用中不小心吸入或者接触皮肤会对人体会造成危害,尤其在浓缩的状态,所以应当稀释后或者保证安全的情况下使用[13]。 虽然GB 2760—2024《食品安全国家标准 食品添加剂使用标准》中允许DMDC作为一种防腐剂在果汁饮料中使用[3],但目前在葡萄酒中使用该标准中还未涉及。
2.2 具有抗氧化作用的二氧化硫替代品
2.2.1 谷胱甘肽
谷胱甘肽(glutathione)是由谷氨酸、半胱氨酸、甘氨酸组成的三肽,因半胱氨酸残基(巯基部分)发生氧化还原反应且有亲核性,使谷胱甘肽具有抗氧化性[25],可预防葡萄酒的酶促褐变。 酶促褐变不利于优质葡萄酒的酿造[10],引起酶促褐变的主要因素是多酚氧化酶,如来自葡萄的酪氨酸酶和葡萄感染灰霉菌时所存在的漆酶,这两种酶会促进葡萄酒或者葡萄汁中二酚类物质(咖啡酸、儿茶素等)的氧化,进一步形成醌,醌及其衍生物发生聚合反应,形成棕色色素[26]。谷胱甘肽通过和醌反应形成葡萄反应产物,阻止棕色聚合物的合成[27]。
在模拟葡萄汁的条件下,研究谷胱甘肽对漆酶促褐变的抑制作用,研究表明,谷胱甘肽可以作为减少二氧化硫添加的替代品,特别是当葡萄感染灰腐菌时,抑制褐变的效果更为显著[28]。通过不同的谷胱甘肽和二氧化硫混合添加量分析,LYU X等[29]研究表明,可以推荐谷胱甘肽的添加量至100 mg/L,在葡萄采收时添加谷胱甘肽的措施与对照相比,可以防止葡萄汁被氧化,并增加成品葡萄酒中多功能硫醇的浓度,给白葡萄酒增加一些热带水果香气,且在压榨过程中添加谷胱甘肽还具有保护二氧化硫不被氧化的作用[29]。 DUBOURDIEU D L V[30]研究表明,6~10 mg/L还原型谷胱甘肽可以保护陈酿葡萄酒香气,还原型谷胱甘肽可以避免某些酯类、萜烯类和硫醇类等香气物质的损失。另外,成本较低且富含谷胱甘肽的非活性干酵母也能部分降低酶促褐变的强度[31]。
目前,国际葡萄与葡萄酒组织(OIV)已批准谷胱甘肽(最大剂量是20 mg/L)和富含谷胱甘肽的非活性干酵母可以用于葡萄酒酿造,但我国现行标准GB 2760—2024《食品安全国家标准食品添加剂使用标准》中尚未涉及。
2.2.2 单宁
单宁(tannin)是一种组成较为复杂的化合物,根据其单体分子以及分子间结构可分为两种:缩合单宁(condensed tannin)和水解单宁(hydrolyzed tannin),缩合单宁又称原花青素,主要存在于葡萄果皮和种子中,水解单宁又称为棓酸酯类单宁,主要来源于橡木桶。 单宁是葡萄酒的“骨架”,使酒体结构稳定、坚实丰满,同时是天然的抗氧化剂。由于缩合单宁A环具有亲核性,因此其可以与许多氧化产物(如醌和醛)发生反应[32-33],从根本上清除氧化产物避免其积累[34]。
VIGNAULT A L等[34]以健康的葡萄和霉变的葡萄为原料,分别进行了不同处理的酿造实验,结果表明,添加酿酒单宁含量20 g/100 L时,漆酶的剩余活性在(75.5±8.6)%~(81.5±7.5)%之间;添加量为40 g/100 L时,漆酶的剩余活性在(55.3±4.5)%~(68.8±5.4)%之间,除了葡萄皮单宁外,其他单宁抑制漆酶活性效果都比较显著,其中橡木单宁20 g/100 L和40 g/100 L的添加量,漆酶的剩余活性为(81.5±7.5)%~(58.5±3.1)%,此外,还表明单宁可以保护白葡萄酒颜色不褐变、红葡萄酒色泽不氧化雾化,尤其是葡萄籽单宁和没食子单宁。CHEN K等[36]对来自葡萄皮、葡萄籽和法国橡木的三种酿酒单宁进行了七个处理的实验,实验表明在发酵前添加酿酒单宁可以改善年轻葡萄酒的颜色、香气和感官特性,特别是低剂量葡萄籽单宁可以一定程度上提高葡萄酒的稳定性和香气复杂度。 目前, 欧盟已授权单宁作为加工助剂和添加剂;在美国,单宁仅被用于葡萄酒澄清及调节单宁含量;但国标GB 2760—2024中尚未涉及。
3 葡萄酒酿造过程中替代二氧化硫添加新型非热杀菌技术
除了在葡萄酒中添加二氧化硫及其替代品之外,许多物理手段也可以抑制葡萄酒腐败微生物的生长,新型非热杀菌技术如超声波、超高压、超高压均质及脉冲电场同样可以起到抑菌作用,且具有降低温度对葡萄酒的颜色、气味和质量影响的共同特点。虽然还没有工业化应用,但目前已有很多研究表明可以用于葡萄酒生产过程。
3.1 超声波技术
超声波指频率>20 kHz的声波,如图1所示,当超声波遇到液体介质会产生纵波,形成压缩和膨胀交替的压力变化区域,导致空化现象形成气泡,当所提供的超声波能量不足以保持膨胀气泡中的气相时,冷凝迅速发生,产生的冲击波引起的压力变化可使细菌活性丧失或死亡,具有杀菌作用。 因此在葡萄酒酿造中应用超声波杀菌有着良好的应用前景。
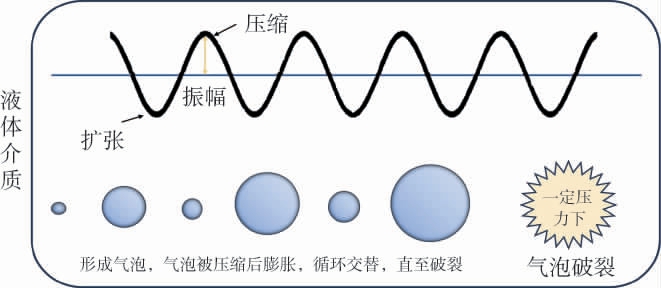
图1 超声波技术灭菌原理示意图
Fig.1 Schematic diagram of sterilization principle of ultrasonic technology
GRACIN L等[37]利用高功率超声(400 W,24 kHz,100 lm振幅)持续稳定的对葡萄酒样品进行处理,结果表明酒香酵母在1 min内减少了90%,乳酸菌减少到同样程度需要约1.5 min。此外,高功率超声对被污染的橡木桶的杀菌率高达99.9%~100%[38-39]。LUO H等[40]利用高功率超声在不同培养基下处理不同的酵母菌,结果表明活力均有所下降,其中酿酒酵母、粟酒裂殖酵母在葡萄汁中活力下降到75%;有孢汉逊酵母和勃氏布雷塔酵母在葡萄酒中的活力分别降低了48%和43%;相较之下,细菌对高功率超声处理敏感性相比酵母菌较弱。 当葡萄酒中高级醇的总质量浓度>400 mg/L时,会带来辛辣等不愉快的气味[41-42]。 ZHANG Q等[43]研究表明,在30 min、30 ℃、150 W的超声处理条件下,可最大程度降低模拟酒中的高级醇含量,降低率为40.44%,改善感官品质。MUÑOZ-GARCÍA R等[44]研究显示,与对照组相比,用超声处理过的葡萄所酿的红葡萄酒具有明显的红色水果香气和花香[45],且在陈酿过程使用超声波辅助会加速获得陈酿香气。
3.2 超高压和超高压均质技术
超高压(ultrahigh pressure)又称为高静压处理技术,如图2所示,高压会使细胞结构变形且会破坏酶的三级结构,导致酶蛋白失活[46],具有抑菌作用。MORATA A等[47]使用超高压(200 MPa、400 MPa、550 MPa,10 min,室温)分别处理丹魄葡萄,结果表明当压力>400 MPa时,野生酵母的数量从104 CFU/mL减少到<10 CFU/mL,而在550 MPa时仍有细菌残留;同时,超高压处理下与简单破碎的葡萄酒相比,总酚浓度有所提高,且增加了颜色强度,超高压技术能加快葡萄酒的陈酿。 FERRER-GALLEGO R等[48]评估超高压(400~600 MPa,1 min、3 min、5 min、10 min)的抑菌效果,结果表明该技术对酵母菌和乳酸菌的抑制较强但对醋酸菌的抑制效果较差,其中不同的压力对丹魄和阿尔巴利诺两种葡萄酒中酵母的生长都起到了抑制作用,而醋酸菌只有在丹魄葡萄酒中受到了抑制。
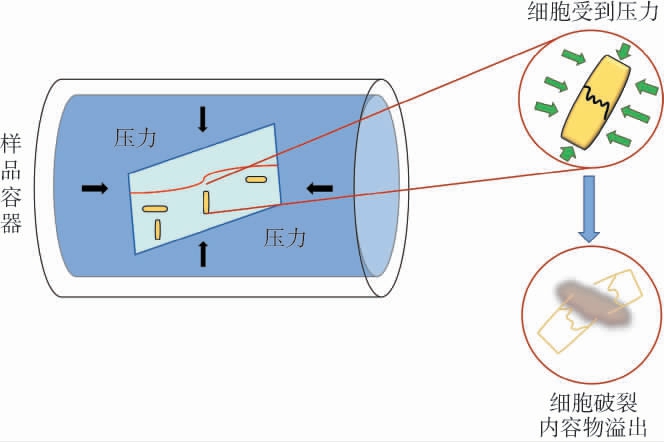
图2 超高压技术灭菌原理示意图
Fig.2 Schematic diagram of sterilization principle of ultra-high pressure technology
超高压均质(ultra high pressure homogenization,UHPH)是在低温甚至冷藏条件下对液态食品进行灭菌的一种连续技术,且温度增加≤5 ℃[49]。 可应用于酿酒阶段,以减少或避免使用亚硫酸盐处理[50]。在白葡萄酒发酵过程使用超高压均质处理,酵母菌和细菌可以被完全消灭,在无菌的条件下储存,白葡萄汁可以保持几个月甚至几年不发酵[49]。经过UHPH处理的葡萄酒香气更好(如果香)[51]。葡萄汁在UHPH(300MPa)处理下,酵母菌(减少7lg(CFU/mL))和细菌(醋酸菌减少4.6 lg(CFU/mL),乳酸菌减少4.3 lg(CFU/mL))完全灭活,此外,UHPH处理可使葡萄汁中多酚氧化酶失活,其作用与添加二氧化硫相似[50]。
3.3 脉冲电场技术
脉冲电场(pulsed electric fields,PEF)通过食品两端施加脉冲式高强度的电场作用力,使细胞膜的通透性增加发生破损,是在常温条件下对食品进行杀菌的一种手段(见图3)[52]。
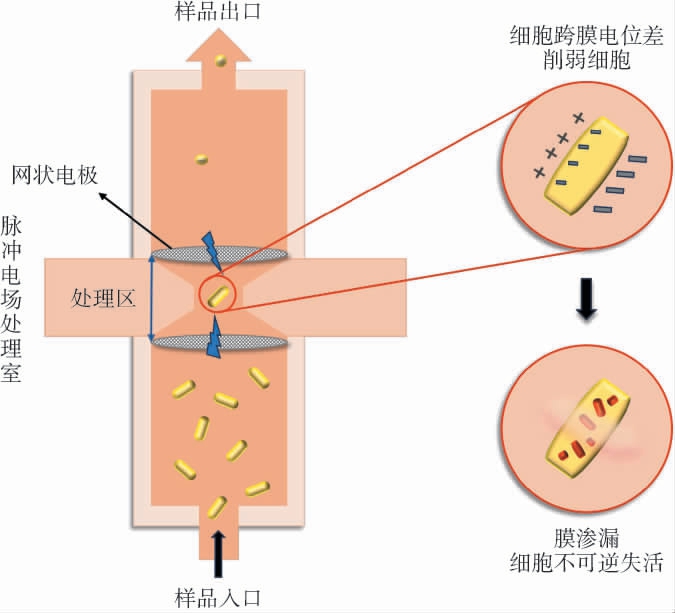
图3 脉冲电场技术灭菌原理示意图
Fig.3 Schematic diagram of sterilization principle of pulsed electric field technology
目前,PEF主要用于葡萄酒生产中的微生物控制以及预处理。 MARSELLÉS-FONTANET À R等[53]用不同的PEF参数(电场强度、脉冲频率、时间)处理葡萄汁和葡萄酒,发现经处理后的样品中酵母菌和细菌同原来的相比分别减少2.24~3.94 lg(CFU/mL),在35 kV/cm、303 Hz的条件下,1 ms是PEF使腐败微生物失活的最佳条件,且最大效率为1 500 MJ/L。 DELSART C等[54]研究表明,在10 ℃条件下,20 kV/cm的PEF处理在14 ms能够灭活葡萄酒中的所有微生物。 除此之外,也有人研究证明,PEF技术处理后的三种葡萄酒(麝香、黑皮诺、美乐)与对照组相比,生物活性化合物含量(总酚、类黄酮、单体花青素)增加,从而使抗氧化能力及感官质量也优于对照组[55]。 LÓPEZ N等[56]研究显示,PEF技术(5 kV/cm,2.1 kJ/kg)能够将赤霞珠葡萄酒的浸渍时间从268 h减少至72 h。葡萄酒发酵过程中需要严格控温,因此使用PEF技术需要控制电场强度、葡萄酒的初始温度等。 PEF技术商业化的主要问题之一成本比较高且要求严格,若投入大规模生产中处理大批葡萄酒没有合适的设备。
4 展望
目前为止,葡萄酒行业内添加二氧化硫的酿造工艺仍普遍存在。 众多科研工作者们在二氧化硫替代品和减少二氧化硫添加技术的研究方面取得了一定的进展,但是应用于葡萄酒实际生产效果的研究仍旧有限。某些产品或者技术不适用于大规模的使用或者因为条件受限不能大范围应用,有些需要和二氧化硫搭配使用,仍然没有可以高效、便捷发挥作用的二氧化硫替代品或者成熟的工艺运用于葡萄酒的酿造。 研制既能满足抗氧化、抑菌的需求,又可以不影响葡萄酒品质本身,甚至有利于葡萄酒品质形成的抗氧化—抑菌复合物或许可以成为科研者们研究的方向。酒庄可以根据自身条件,结合当地特色,选择目前合适、成熟的二氧化硫替代品或者技术,打造“绿色”、“自然”的葡萄酒生产模式,满足消费者需求。
[1]王琳,刘睿,孙德鹏,等.葡萄酒酿造过程中风险因素的分析研究[J].酿酒科技,2020(8):122-129.
[2]CASTRO MARÍN A,COLANGELO D,LAMBRI M,et al.Relevance and perspectives of the use of chitosan in winemaking:A review[J].Crit Rev Food Sci,2021,61(20):3450-3464.
[3]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 2760—2024 食品安全国家标准 食品添加剂使用标准[S].北京:中国标准出版社,2024.
[4]CARRASCÓN V,VALLVERDU′-QUERALT A,MEUDEC E,et al.The kinetics of oxygen and SO2 consumption by red wines.What do they tell about oxidation mechanisms and about changes in wine composition?[J].Food Chem,2018,241:206-214.
[5]LISANTI M T,BLAIOTTA G,NIOI C,et al.Alternative methods to SO2 for microbiological stabilization of wine[J].Compr Rev Food Sci Food Safety,2019,18(2):455-479.
[6]王震.食品中亚硫酸盐的使用及检测[J].现代食品,2016(24):75-78.
[7]SILVA F V M,VAN WYK S.Emerging non-thermal technologies as alternaive to SO2 for the production of wine[J].Foods,2021,10(9):2175.
[8]KALKANYIILDIRIMH,DARICIIB.Alternativmethods of sulfur dioxide used in wine production[J].J Microbiol Biot Food Sci,2020,9(4):675-687.
[9]GUERRERO R F,CANTOS-VILLAR E.Demonstrating the efficiency of sulphur dioxide replacements in wine: A parameter review[J].Trends Food Sci Technol,2015,42(1):27-43.
[10]LI H, GUO A, WANG H.Mechanisms of oxidative browning of wine[J].Food Chem,2008,108(1):1-13.
[11]王树庆,李保国,范维江,等.无二氧化硫添加葡萄酒酿造技术研究进展[J].酿酒,2020,47(3):4-7.
[12]KHORSHIDIAN N,KHANNIRI E,KOUSHKI M R,et al.An overview of antimicrobial activity of lysozyme and its functionality in cheese[J].Front Nutr,2022,(9):833618.
[13]RIBÉREAU-GAYON P, GLORIES Y, MAUJEAN A, et al.Handbook of Enology:The chemistry of wine stabilization and treatments[M].New Jersey:John Wiley&Sons Inc,2006:279-301.
[14]倪瑛,钟立人.溶菌酶在葡萄酒生产中的应用[J].中外葡萄与葡萄酒,2003(5):66-67.
[15]刘富兵,刘延琳.酶在葡萄酒生产中的应用[J].食品科学,2013,34(9):392-398.
[16]LASANTA C,ROLDÁN A,CARO I,et al.Use of lysozyme for the prevention and treatment of heterolactic fermentation in the biological aging of sherry wines[J].Food Control,2010,21(11):1442-1447.
[17]李晔,田研基.壳聚糖在食品领域的应用研究[J].现代食品,2020(12):55-58.
[18]GRAISUWAN W, WIARACHAI O, ANANTHANAWAT C, et al.Multilayer film assembled from charged derivatives of chitosan: Physical characteristics and biological responses[J].J Colloid Interf Sci,2012,376(1):177-188.
[19]VALERA M J,SAINZ F, MAS A, et al.Effect of chitosan and SO2 on viability of acetobacter strains in wine[J].Int J Food Microbiol,2017,246:1-4.
[20]BAGˇDER ELMACI S,GÜLGÖR G,TOKATLI M,et al.Effectiveness of chitosan against wine-related microorganisms[J].Anton Leeuw,2015,107(3):675-686.
[21]刁体伟,陈晓姣,赖晓琴,等.壳聚糖及其衍生物在果酒中应用的研究进展[J].食品工业科技,2022,43(6):467-473.
[22]The UK participation in its preparation was entrusted to Technical Committee TDW/4 BS EN ISO 25178-606:2015[S].London: The British Standards Institution,2015.
[23]RODRIGUES J A,NUNES C,COIMBRA M A,et al.Chitosan film as a replacement for conventional sulphur dioxide treatment of white wines:A 1H NMR metabolomic study[J].Foods,2022,11(21):3428.
[24]DELFINI C, GAIA P, SCHELLINO R, et al.Fermentability of grape must after inhibition with dimethyl dicarbonate(DMDC)[J].J Agr Food Chem,2002,50(20):5605-5611.
[25]苏静,龚荣.葡萄酒酿造过程中谷胱甘肽的研究进展[J].食品科学,2020,41(7):283-291.
[26]VIGNAULT A,GOMBAU J,JOURDES M,et al.Oenological tannins to prevent botrytis cinerea damage in grapes and musts:Kinetics and electrophoresis characterization of laccase[J].Food Chem,2020,316:126334.
[27]KRITZINGER E C,BAUER F F,DU TOIT W J.Role of glutathione in winemaking:A review[J].J Agr Food Chem,2013,61(2):269-277.
[28]GIMÉNEZ P,ANGUELA S,JUST-BORRAS A,et al.Development of a synthetic model to study browning caused by laccase activity from botrytis cinerea[J].LWT-Food Sci Technol,2022,154:112871.
[29]LYU X, DEL PRADO D R, ARAUJO L D, et al.Effect of glutathione addition at harvest on sauvignon blanc wines[J].Aust J Grape Wine Res,2021,27(4):431-441.
[30]DUBOURDIEU D L V.The role of glutathione on the aromatic evolution of dry white wines[J].Vinidea Net Wine Int Tech J,2004,2:1-9.
[31]GIMÉNEZ P,JUST-BORRAS A,PONS P,et al.Biotechnological tools for reducing the use of sulfur dioxide in white grape must and preventing enzymatic browning:glutathione;inactivated dry yeasts rich in glutathione; and bioprotection with Metschnikowia pulcherrima[J].Eur Food Res Technol,2023,249(6):1491-1501.
[32]ROY M K,KOIDE M,RAO T P,et al.ORAC and DPPH assay comparison to assess antioxidant capacity of tea infusions:Relationship between total polyphenol and individual catechin content[J].Int J Food Sci Nutr,2010,61(2):109-124.
[33]ROMANI A, CAMPO M, PINELLI P.HPLC/DAD/ESI-MS analyses and anti-radical activity of hydrolyzable tannins from different vegetal species[J].Food Chem,2012,130(1):214-221.
[34]WATERHOUSE A L,SACKS G L,JEFFERY D W.Understanding wine chemistry[M].New York:Wiley,2016:129-134.
[35]VIGNAULT A,PASCUAL O,JOURDES M,et al.Impact of enological tannins on laccase activity[J].OENO One,2019,1(53):2361.
[36]CHEN K, ESCOTT C, LOIRA I, et al.The effects of pre-fermentative addition of oenological tannins on wine components and sensorial qualities of red wine[J].Molecules,2016,21(11):1445.
[37]GRACIN L,JAMBRAK A R,JURETIC′ H,et al.Influence of high power ultrasound on Brettanomyces and lactic acid bacteria in wine in continuous flow treatment[J].Appl Acoust,2016,103:143-147.
[38]YAP A,BAGNALL W.High power ultrasonics:A new and powerful tool for removing tartrate deposits and killing viable brettanomyces cells in barrels[J].Aust New Zealand Wine Ind J,2009,29(8):29-39.
[39]STADLER E,FISCHER U.Sanitization of oak barrels for wine-a review[J].J Agr Food Chem,2020,68(19):5283-5295.
[40]LUO H,SCHMID F,GRBIN P R,et al.Viability of common wine spoilage organisms after exposure to high power ultrasonics[J].Ultrason Sonochem,2012,19(3):415-420.
[41]SÁENZ-NAVAJAS M, AVIZCURI J, BALLESTER J, et al.Sensoryactive compounds influencing wine experts' and consumers' perception of red wine intrinsic quality[J].LWT-Food Sci Technol,2015,60(1):400-411.
[42]CAMELEYRE M,LYTRA G,TEMPERE S,et al.Olfactory impact of higher alcohols on red wine fruity ester aroma expression in model solution[J].J Agr Food Chem,2015,63(44):9777-9788.
[43]ZHANG Q,XU B,CHEN B,et al.Ultrasound as an effective technique to reduce higher alcohols of wines and its influencing mechanism investigation by employing a model wine[J].Ultrason Sonochem,2020,61:104813.
[44]MUÑOZ-GARCÍA R,DÍAZ-MAROTO M C,ARÉVALO VILLENA M,et al.Ultrasound and microwave techniques as physical methods to accelerate oak wood aged aroma in red wines[J].LWT-Food Sci Technol,2023,179:114597.
[45]LABRADOR FERNÁNDEZ L, PÉREZ PORRAS P, DÍAZ MAROTO M C,et al.The technology of high-power ultrasound and its effect on the color and aroma of rosé wines[J].J Sci Food Agr,2023,103(13):6616-6624.
[46]彭子宁.超高压灭菌技术在食品加工中的应用[J].中国食品工业,2022(22):63-67.
[47]MORATA A,LOIRA I,VEJARANO R,et al.Grape processing by high hydrostatic pressure:Effect on microbial populations,phenol extraction and wine quality[J].Food Bioprocess Tech,2015,8(2):277-286.
[48]FERRER-GALLEGO R,PUXEU M,MARTÍN L,et al.Microbiological,physical, and chemical procedures to elaborate high-quality SO2-free wines.Grapes and wines-advances in production, processing, analysis and valorization[J].Analysis and Valorization,2018:171-193.
[49]MORATA A,LOIRA I,BAÑUELOS M A,et al.Use of ultra high pressure homogenization to sterilize grape must[C]//BIO Web of Conferences.EDP Sciences,2019,15:02035.
[50]PUIG-PUJOL A,ROCA-DOMÈNECH G,QUEVEDO J M,et al.Application of ultra-high pressure homogenization(UHPH)at different stages of wine production[C]//BIO Web of Conferences.EDP Sciences,2023,68:02025.
[51]LOIRA I,MORATA A,BAÑUELOS M A,et al.Use of Ultra-high pressure homogenization processing in winemaking: Control of microbial populations in grape musts and effects in sensory quality[J].Innovat Food Sci Emerging Technol,2018,50:50-56.
[52]SATO T,MURAKAMI Y,MURAMOTO Y.Estimation of liquid sterilization using critical voltage under high electric field pulses[J].IEEJ Transactions on Electrical and Electronic Engineering,2019,14(7):1002-1007.
[53]MARSELLÉS-FONTANET À R,PUIG A,OLMOS P,et al.Optimising the inactivation of grape juice spoilage organisms by pulse electric fields[J].Int J Food Microbiol,2009,130(3):159-165.
[54]DELSART C,GRIMI N,BOUSSETTA N,et al.Impact of pulsed-electric field and high-voltage electrical discharges on red wine microbial stabilization and quality characteristics[J].J Appl Microbiol,2016,120(1):152-164.
[55]VICAS,S I,BANDICI L,TEUS,DEA A C,et al.The bioactive compounds,antioxidant capacity,and color intensity in must and wines derived from grapes processed by pulsed electric field[J].CYTA: Journal of Food,2017,15(4):553-562.
[56]LÓPEZ N, PUÉRTOLAS E, HERNÁNDEZ-ORTE P, et al.Effect of a pulsed electric field treatment on the anthocyanins composition and other quality parameters of cabernet sauvignon freshly fermented model wines obtained after different maceration times[J].LWT-Food Sci Technol,2009,42(7):1225-1231.