慕萨莱思是一款独具西域民族特色的葡萄酒,其主要产地在阿瓦提县,有着独特的酿造工艺,距今已有三千多年的历史[1]。 慕萨莱思富含多种营养成分,其所具有的独特药用价值对于改善睡眠质量、清除瘀血、缓解失眠症状等症状具有一定的功效[2]。目前在新疆,慕萨莱思葡萄酒已成为人们佐餐聚会时非常受欢迎的健康饮品[3]。传统慕萨莱思的制作工艺比较简单,其区别于葡萄酒的最大特点就是经过了高温熬煮的工艺[4]。 在熬煮过程中可根据个人口味或需求加入一些鹿茸、枸杞、大芸、肉苁蓉等名贵中药材[5]。
由于原料产地、制作工艺不同,会导致发酵过程中微生物群系的差异,其主要由酿酒酵母(Saccharomyces cerevisiae)和非酿酒酵母组成[6]。酿酒酵母是葡萄酒工业中最主要的酵母菌,优质葡萄酒的生产需要能体现葡萄酒特色和风格的优势酵母菌种,以满足市场对个性多样化商品的要求[7-8]。文栩等[9]采用高通量测序研究葡萄酒自然发酵与接种发酵过程中真菌微生物多样性的变化及葡萄酒的风味特征,结果表明,自然发酵葡萄酒存在破败风险,会对香气造成不利影响,推荐使用接种发酵酿造葡萄酒;朱丽霞等[10]对新疆慕萨莱思自然发酵过程中酵母菌种群表型多样性与其优势菌进行研究与探讨,结果分离得到217株酵母菌,13种WL培养类型,8个表观群,表明慕萨莱思酵母菌具有丰富的多样性;冯姝[11]对新疆慕萨莱思酵母菌进行分离鉴定,并对其优势菌遗传多样性进行分析,结果表明,慕萨莱思酵母菌群具有丰富的表型、多样性以及存在丰富的遗传多样性;程功等[12]对阿瓦提红葡萄酒酵母进行分离鉴定并应用,结果发现筛选所得酿酒酵母J具有良好的慕萨莱思发酵潜力。
目前,对慕萨莱思的研究侧重于感官品质[13]、香气成分[14]、微生物等方面[15],而对于慕萨莱思在发酵过程中真菌菌群多样性的研究相对较少。随着微生物探究技术的发展,高通量测序技术(high-throughput sequencing,HTS)是目前应用最普遍的新一代测序技术[16],其在分析微生物群落结构时有着独特的优势,能够通过从环境样本中直接获取的总脱氧核糖核酸(deoxyribonucleic acid,DNA)进行文库构建并测序[17]。因此,本研究采用高通量测序技术,对慕萨莱思发酵前期、中期、后期的真菌菌落多样性进行分析。同时,采用传统培养分离法结合形态学观察对样品中的酵母菌进行分离筛选,进一步通过生理生化试验、产乙醇、产酯及酸耐受性分析筛选优良酿酒酵母,并通过分子生物学技术对其进行菌种鉴定,以期为慕萨莱思工业化生产提供理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
慕萨莱思:来自新疆维吾尔自治区和田地区和田县巴格其镇慕萨莱思传统自然发酵手工坊;商业酿酒酵母菌ATCC9763(SY):北京保藏生物科技有限公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基[18]:蛋白胨20 g/L,葡萄糖20 g/L,酵母浸出粉100 g/L,121 ℃高压蒸汽灭菌20 min。 YEPD固体培养基:YEPD培养基中添加琼脂粉200 g/L。
氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)上层培养基[18]:葡萄糖50 g/L,TTC 0.5 g/L,琼脂200 g/L,121 ℃高压蒸汽灭菌20 min。
TTC下层培养基[18]:蛋白胨200 g/L,葡萄糖100 g/L,酵母浸出粉15 g/L,MgSO40.4 g/L,KH2PO41.0 g/L,琼脂20 g/L,121 ℃高压蒸汽灭菌20 min。
产酯固体培养基[19]:蛋白胨200 g/L,葡萄糖200 g/L,酵母浸出粉100 g/L,三丁酸甘油酯15 mL/L,溴甲酚紫0.04 g/L,琼脂20 g/L。121 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
乙醇(分析纯):广东林氏化学试剂有限公司;琼脂粉、酵母浸粉、蛋白胨(均为生化试剂):北京奥博星生物技术有限公司;葡萄糖(生化试剂):天津永晟精细化工有限公司;三丁酸甘油酯(分析纯):上海麦克林生化科技股份有限公司;氯化三苯基四氮唑(分析纯):福州飞净生物科技有限公司;D5635-02 Soil DNA Kit试剂盒:广州飞扬生物工程有限公司;Q5R High-FidelityDNAPolymerase(2000U/mL):美国NEB公司;琼脂糖:美国Invitrogen公司;DNA Marker:日本Takara公司;其他试剂均为分析纯或生化试剂。
1.2 仪器与设备
LDZM-40KCS高压蒸汽灭菌锅:上海申安医疗器械厂;DM-500电子显微镜:福州泉通电子有限公司;bpH-9402恒温培养箱:上海一恒科学仪器有限公司;BBS-SDC超净工作台:博科控股集团有限公司;UV759紫外分光光度计:上海楚定分析仪器有限公司;Tissuelyser-48多样性组织研磨仪:上海净信实业发展有限公司;Nanodrop 2000c微量分光光度计:深圳德优平科技有限公司;2720聚合酶链式反应(polymerasechainreaction,PCR)扩增仪:美国ABI公司;DYY-6C电泳仪:北京六一生物科技有限公司;BG-gdsAUTO(130)凝胶成像系统:北京百晶生物技术有限公司;FLX800T酶标仪:美国BioTek公司。
1.3 方法
1.3.1 慕萨莱思发酵过程中样品的采集和预处理
慕萨莱思共发酵15 d,采集第1天的样品编号为ZW(发酵前期);发酵第10天的样品编号为WW(发酵中期);发酵第15天的样品编号为SW(发酵后期)。在无菌环境下,将采集的样品放入冻存管低温保存,冻存管于-80 ℃储藏。
1.3.2 真菌微生物基因组DNA提取及PCR扩增
将采集的样品从冰箱中取出,选取适量的样本(0.2~0.5 g之间),加入离心管中进行研磨(研磨频率60 Hz)。 采用D5635-02 Soil DNA Kit试剂盒提取基因组DNA,利用Nanodrop 2000c微量分光光度计对DNA进行定量[20],采用7%琼脂糖凝胶电泳检测提取效果。以其为模板,选用真菌ITS1 区 引 物ITS5(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS2(5'-GCTGCGTTCTTCATCGATGC-3'),参考邓旗等[21]的方法进行PCR扩增。
1.3.3 高通量测序及数据处理
基于上海派森诺生物科技股份有限公司的Illumina平台对PCR 扩增产物进行高通量测序。 使用Vsearch 的fastq_mergepairs模块拼接原始序列[22];使用uchime_denovo模块去除嵌合体,再过滤质控后序列集中的嵌合体,获得高质量序列;使用QIIME2.0软件中的cluster_size模块,将有效序列在97%相似度水平进行操作分类单元(operational taxonomic unit,OTU)聚类[23],并分别输出代表序列和OTU表。采用vegan包计算超1(Chao1)指数、Observed指数、香农(Shannon)指数、辛普森(Simpson)指数、Pielou's evenness指数和样品覆盖率,进行Alpha多样性分析。 最后,将代表序列通过Silva数据库(https://www.arb-silva.de/)进行物种注释。
1.3.4 酵母菌的分离纯化
将慕萨莱思样品ZW、WW、SW混匀后,取10 mL样品加入到90 mL的无菌生理盐水中进行混合,按10倍梯度将菌液稀释为10-2、10-3、10-4,取不同梯度的稀释液100 μL涂布于YEPD固体培养基中,28 ℃条件下恒温培养48 h。挑取具有典型酵母菌菌落特征且形态差异较为明显的单个菌落,再进行多次平板划线分离纯化得到单一菌落,观察菌落形态,并使用电子显微镜观察细胞形态。
1.3.5 优良酿酒酵母的筛选
生理生化实验:参照文献[24]对分离得到的酵母菌株进行糖发酵试验和碳氮源同化试验。
产乙醇性能的测定[25]:以商业酿酒酵母SY作为对照,将活化好的酵母菌株划线接种到TTC下层培养基上,在30 ℃条件下培养3 d后,将菌落置于避光环境中,并在其上方加覆一层TTC上层培养基。继续在30 ℃条件下避光培养3~4 h,通过观察菌落颜色来评估酵母产乙醇的能力。
产酯性能的测定[25]:以商业酿酒酵母SY作为对照,将产乙醇能力较强的酵母菌株接种到产酯固体培养基上,在30 ℃条件下培养3 d后,通过观察菌落的颜色来评估酵母产酯能力。
生长曲线的绘制[26]:以商业酿酒酵母SY作为对照,将筛选得到的酵母菌接种于YEPD液体培养基,于28 ℃条件下活化培养48 h,按3%(V/V)的接种量将活化的酵母菌培养液接种于YEPD液体培养基中,于28 ℃条件下静置培养60 h,每间隔4 h进行一次取样,使用紫外分光光度仪在波长600 nm处测定吸光度值,以培养时间为横坐标,OD600 nm值为纵坐标绘制生长曲线。
酸耐受性试验[27]:以商业酿酒酵母SY作为对照,将活化后的酵母菌培养液按5%(V/V)的接种量接种于不同pH(2.5、3.0、3.5、4.0和4.5)的YEPD液体培养基中,在30 ℃条件下培养48 h,测定OD600nm值。
1.3.6 优良酿酒酵母的分子生物学鉴定
采用D5635-02 Soil DNA Kit试剂盒提取优良酵母菌的基因组DNA,以其为模板,采用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和引物ITS4(5'-TCCTCCGCTTATTGATATGC-3')对其26S rDNA基因序列进行PCR扩增[28]。PCR扩增体系:Q5R High-Fidelity DNA Polymerase 0.25 μL、5×Reaction Buffer 5 μL,5×High GC Buffer 5 μL、脱氧核糖核 苷 三 磷 酸(deoxy-ribonucleoside triphosphates,dNTPs)(10 mmol/L)2 μL,模板DNA 2 μL,引物ITS1(10 μmol/L)1 μL,引物ITS1(10 μmol/L)1 μL,双蒸水(ddH2O)8.75 μL;PCR扩增程序:98 ℃预变性5 min;98 ℃变性30s,55 ℃退火45 s,72 ℃延伸45 s,共循环30次,72 ℃再延伸5 min。 PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,委托派森诺生物科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center for BiotechnologyInformation,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性对比,选取同源性较高的模式菌株中的26S rDNA基因序列,采用MEGA-11.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树[29]。
2 结果与分析
2.1 慕萨莱思发酵过程中真菌群落多样性分析
2.1.1 Alpha多样性分析
慕萨莱思发酵过程中真菌菌群的Alpha多样性分析结果见表1。由表1可知,所有样品的覆盖率均>99.99%,说明测序结果能覆盖样品中99.99%以上的真菌群落信息,测序结果合理,可用于Alpha多样性分析。Chao1指数随着发酵的进行呈先增加再减小的趋势,表明慕萨莱思发酵过程中真菌群落丰富度先递增达到一定峰值后逐渐递减,WW样品中真菌群落最为丰富,SW样品中真菌群落最为稀少。Observed指数随着发酵的进行呈先升高后下降的趋势,表明WW样品中真菌菌群丰富度最高。Pielou's evenness指数随着发酵的进行呈先升高后下降的趋势,表明WW样品中真菌菌群均匀度最高。 Shannon指数随着发酵的进行呈先升高后下降的趋势,表明WW样品中真菌群落多样性最高。综上,慕萨莱思发酵过程中真菌菌群丰富度、多样性及均匀度呈先升高后下降的趋势,且发酵中期时最高。
表1 慕萨莱思发酵过程中Alpha多样性分析结果
Table 1 Alpha diversity analysis results during the fermentation process of Musalesi
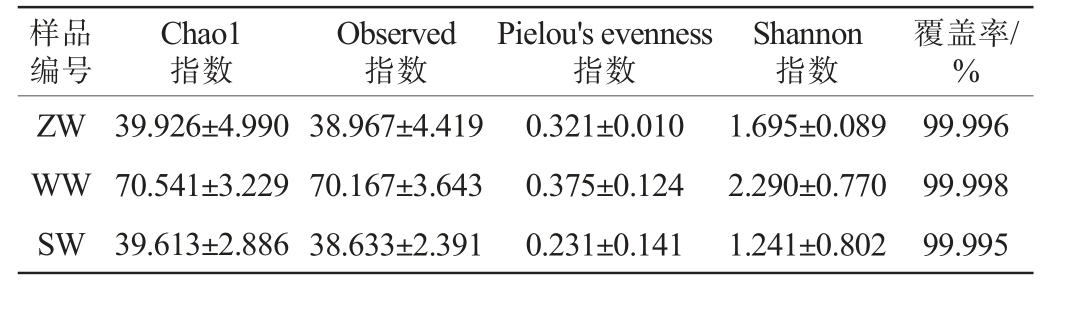
样品编号Chao1指数Observed指数Pielou's evenness指数Shannon指数覆盖率/%ZW WW SW 39.926±4.990 70.541±3.229 39.613±2.886 38.967±4.419 70.167±3.643 38.633±2.391 0.321±0.010 0.375±0.124 0.231±0.141 1.695±0.089 2.290±0.770 1.241±0.802 99.996 99.998 99.995
2.1.2 OTU分析
为进一步分析慕萨莱思发酵过程中真菌菌群的相似性及差异性,绘制真菌菌群OTUs韦恩图,结果见图1。由图1可知,WW样品的OTUs数(169个)明显高于SW(89个)和ZW样品(92个),说明发酵中期真菌数最多;ZW样品真菌数又高于SW样品,说明在发酵后期真菌数最少。WW样品特有的OTU数为129个,占其总数的76.33%;ZW样品特有的OTU数为66个,占其总数的71.74%;SW样品特有的OTU数为62个,占其总数的69.66%。其中共有的OTU数为11个,分别占WW、ZW、SW样品OTU数的6.50%、11.96%、12.36%。由此可见,慕萨莱思不同发酵阶段真菌群落组成差异性较大。
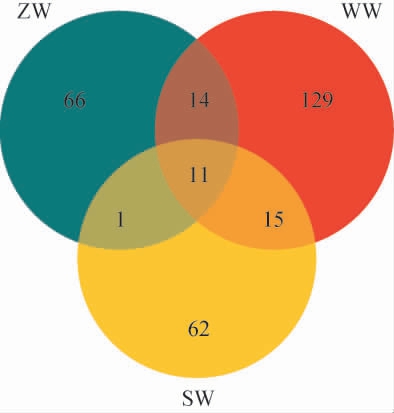
图1 慕萨莱思发酵过程中真菌菌群操作分类单元韦恩图
Fig.1 Venn diagram of operational taxonomic units of fungal flora of Musalesi during the fermentation process
2.1.3 真菌群落组成分析
从不同样品真菌菌群中共注释到4门、10纲、19目、22科、25属,在门和属水平上的真菌菌群结构见图2。
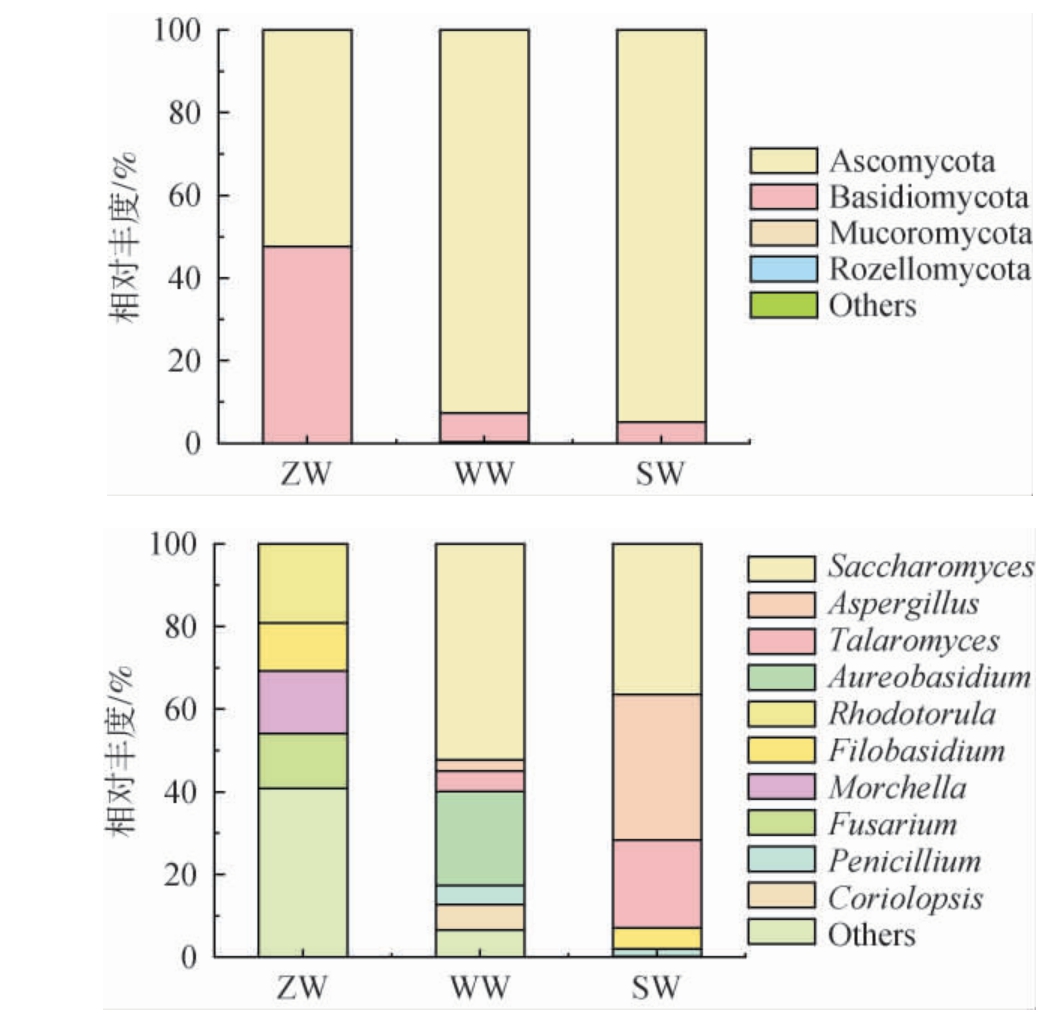
图2 基于门(a)和属(b)水平慕萨莱思发酵过程中真菌菌群结构分析结果
Fig.2 Results of fungal flora structure analysis of Musalesi during the fermentation process at phylum (a) and genus (b) levels
由图2a可知,在门水平上,慕萨莱思发酵过程中的主要真菌菌落有子囊菌门(Ascomycota)和担子菌门(Basidiomycota),其中,子囊菌门的相对丰度最高,在ZW、WW和SW样品中的相对丰度分别为52.40%、92.66%、94.85%。随着发酵的进行,子囊菌门相对丰度逐渐升高,担子菌门相对丰度逐渐减小。在门水平上,WW、SW样品的真菌群落组成相似,与ZW样品的真菌菌落组成相差较大,且差异主要体现在相对丰度上。
由图2b可知,在属水平上,慕萨莱思发酵过程中的主要真菌菌落有酵母属(Saccharomyces)、曲霉属(Aspergillus)、篮状菌属(Talaromyces)、短梗霉属(Aureobasidium)、红酵母属(Rhodotorula)、线黑粉菌属(Filobasidium)、羊肚菌属(Morchella)、镰刀菌属(Fusarium)等。ZW样品中的优势真菌属(相对丰度>1%)有红酵母属(19.10%)、羊肚菌属(15.16%)、镰刀菌属(13.30%)、线黑粉菌属(11.67%);WW样品中的优势真菌属有酵母属(52.30%)、短梗霉属(22.74%)、革孔菌属(Coriolopsis)(6.14%)、篮状菌属(5.03%)、青霉属(Penicillium)(4.50%)、曲霉属(2.64%);SW样品中优势真菌属有酵母属(36.44%)、曲霉属(35.25%)、篮状菌属(21.16%)、线黑粉菌属(5.10%)、青霉属(1.80%)。 结果表明,慕萨莱思发酵初期,真菌菌落组成较复杂,主要有红酵母属、羊肚菌属、镰刀菌属、线黑粉菌属,其中红酵母属相对丰度较高。 发酵中期,出现酵母属、短梗霉属、革孔菌属、篮状菌属、青霉属、曲霉属,但红酵母属、羊肚菌属、镰刀菌属、线黑粉菌属相对丰度较低,出现的酵母属占绝对优势。 发酵后期,又出现线黑粉菌属,酵母属相对丰度下降,曲霉属、篮状菌属相对丰度升高。酵母属贯穿于整个发酵过程,且发酵中、后期相对丰度较大,由此来看酵母属是在整个酿造过程中起到主要作用的真菌属。
FILIPPIS D F等[30]采用18S rRNA测序技术研究了意大利两种酿酒葡萄自然发酵过程中真菌群落的变化,结果发现,发酵初期菌群构成复杂,主要是由非酿酒酵母菌和几种霉菌构成。王汐月[31]采用宏基因组检测技术对两种发酵方式马瑟兰葡萄酒中的真菌微生物多样性进行探究,结果发现,在门水平上,注释到子囊菌门和担子菌门;在属水平上,优势真菌属为酵母属。 这些研究结果与本实验样品发酵过程中真菌菌落组成变化相似。
2.2 慕萨莱思发酵过程中优良酿酒酵母菌的分离及筛选
2.2.1 酵母菌的分离及形态学观察
通过菌落形态及细胞形态观察从ZW、WW、SW样品中共分离筛选出8株疑似酵母菌株,编号为J-1~J-8,部分菌株的菌落及细胞形态见图3,具体结果见表2。 由图3及表2可知,8株菌株的细胞形态均为椭圆型或圆形;菌落形态为圆形,呈乳白色、米白色或米黄色,除菌株J-6菌落表面粗糙外,其他菌株菌落表面光滑,边缘均整齐,除菌株J-2质地较干燥外,其他菌株的质地均黏稠,除菌株J-8不易挑起外,其他菌株均易挑起。
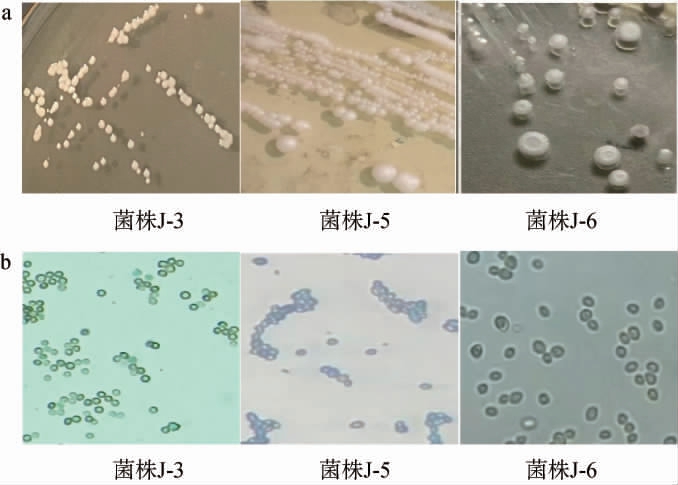
图3 部分疑似酵母菌菌株的菌落(a)及细胞(b)形态特征
Fig.3 Colony (a) and cell (b) morphology characteristics of some suspected yeast strains
表2 疑似酵母菌菌株的菌落及细胞形态特征
Table 2 Colony and cell morphological characteristics of suspected yeast strains
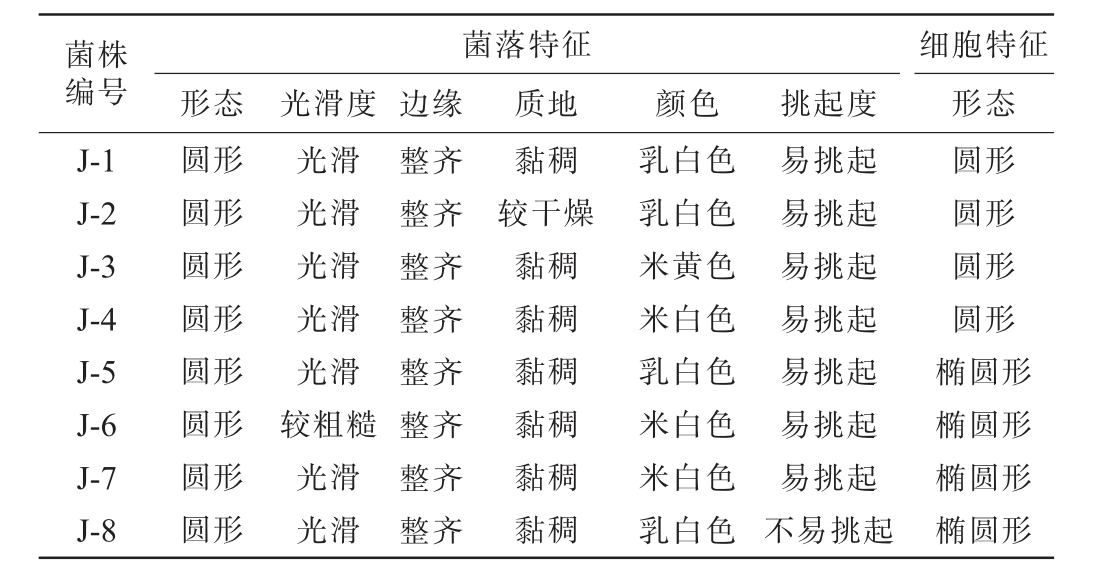
菌株编号J-1 J-2 J-3 J-4 J-5 J-6 J-7 J-8菌落特征形态 光滑度 边缘 质地 颜色挑起度细胞特征形态圆形圆形圆形圆形圆形圆形圆形圆形光滑光滑光滑光滑光滑较粗糙光滑光滑整齐整齐整齐整齐整齐整齐整齐整齐黏稠较干燥黏稠黏稠黏稠黏稠黏稠黏稠乳白色乳白色米黄色米白色乳白色米白色米白色乳白色易挑起易挑起易挑起易挑起易挑起易挑起易挑起不易挑起圆形圆形圆形圆形椭圆形椭圆形椭圆形椭圆形
2.2.2 酵母菌的生理生化试验
8株疑似酵母菌菌株的糖发酵试验结果见表3。 由表3可知,菌株J-1~J-7均可利用葡萄糖、蔗糖及可溶性淀粉进行生长繁殖,菌株J-8无法利用这3种糖类物质进行生长繁殖。 不同酵母菌种可以对不同糖类进行代谢利用[32],但菌株J-8无法利用各类糖类,故认为其不属于酵母菌。
表3 疑似酵母菌菌株的糖发酵试验结果
Table 3 Results of sugar fermentation test of suspected yeast strains

注:“+”表示菌株可以利用糖进行生长繁殖;“-”表示菌株不可以利用糖进行生长繁殖。
项目菌株编号J-1 J-2 J-3 J-4 J-5 J-6 J-7 J-8葡萄糖蔗糖可溶性淀粉+++++++++++++++++++++-- -
进一步对7株酵母菌菌株进行碳氮源同化试验,结果见表4。由表4可知,菌株J-1~J-7均可以利用葡萄糖、蔗糖、麦芽糖、蛋白胨、硫酸铵,菌株J-1、J-3、J-4、J-6无法利用乳糖,菌株J-2、J-5、J-7可以利用乳糖,菌株J-1、J-2、J-3、J-4、J-6、J-7均可以利用棉子糖,而菌株J-5无法利用棉子糖,根据《酵母菌的特征与鉴定手册》[33]和周英彪等[34]确定其不是酿酒酵母。
表4 酵母菌菌株的碳氮源同化试验结果
Table 4 Results of carbon and nitrogen assimilation experiment of yeast strains
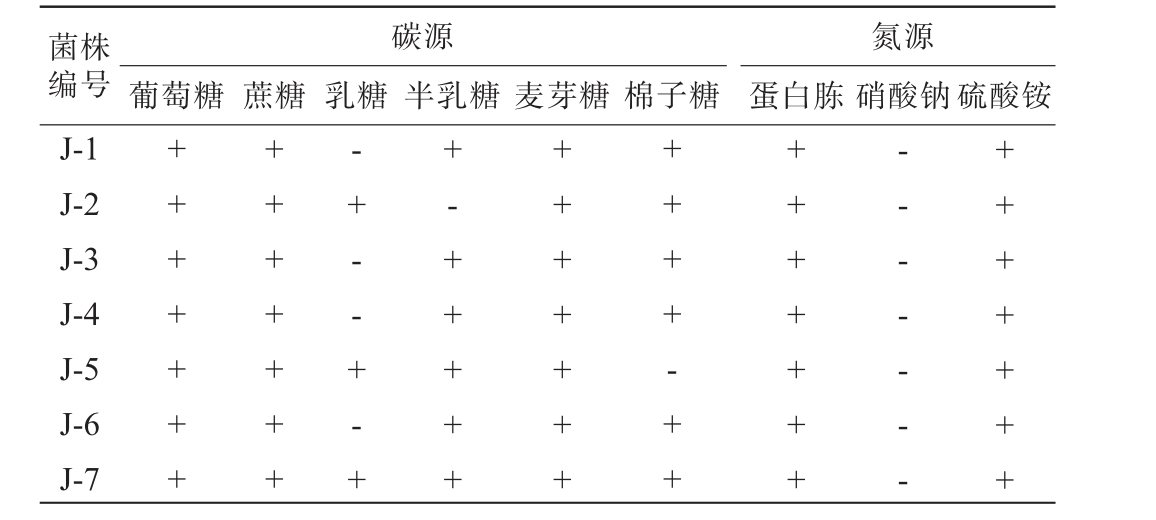
注:“+”表示结果呈阳性。“-”表示结果呈阴性。
菌株编号J-1 J-2 J-3 J-4 J-5 J-6 J-7碳源葡萄糖 蔗糖 乳糖 半乳糖 麦芽糖 蛋白胨棉子糖氮源硝酸钠硫酸铵++++++++++++++-+--+-++-++++++++++++++++-+++++++++-- - - - - -+++++++
2.2.3 产乙醇及产酯能力的测定
优良的酿酒酵母需要具有较好的产乙醇能力以及贡献香味的能力,因此需要对酵母菌菌株进行产乙醇及产酯能力的测定[35]。以商业酿酒酵母SY为对照,6株酵母菌菌株的产乙醇能力见表5。由表5可知,相比较商业酿酒酵母SY,酵母菌菌株J-6的产乙醇能力都强于商业酿酒酵母SY,菌株J-1和J-4的产乙醇能力与商业酿酒酵母SY相当,菌株J-2、J-3和J-7的产乙醇能力均弱于商业酿酒酵母SY。因此,进一步考察菌株J-1、J-4、J-6的产酯性能,结果见表6。由表6可知,相比与商业酿酒酵母SY,菌株J-4的产酯能力较弱,而菌株J-1和J-6的产酯能力都与商业酿酒酵母SY的产酯能力相当,因此,选择菌株J-1和J-6为优良酵母菌。
表5 酵母菌菌株的产乙醇能力测定结果
Table 5 Results of ethanol production capacity of yeast strains
注:“+”表示结果呈浅红色,“++”表示结果呈红色,“+++”表示结果呈深红色。
菌株编号 J-1 J-2 J-3 J-4 J-6 J-7 SY结果 ++ + + ++ +++ + ++
表6 酵母菌菌株的产酯能力测序结果
Table 6 Results of ester production capacity of yeast strains
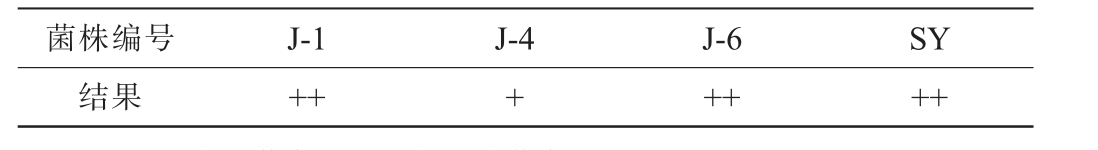
注:“+”表示黄色,“++”表示浅黄色。
菌株编号 J-1 J-4 J-6 SY结果 ++ + ++ ++
2.2.4 酵母菌的生长曲线
酵母菌菌株J-1和J-6的生长曲线见图4。由图4可知,3株菌株的生长趋势一致,均呈典型的“S”型曲线。在整个发酵过程中,菌株J-6的OD600 nm值高于菌株J-1和商业酿酒酵母SY,说明菌株J-6生长性能最好;在发酵0~24 h,商业酿酒酵母SY的OD600 nm值高于菌株J-1,在发酵24~60 h则相反,菌株J-4总体来说生长性能要优于高于商业酵母SY。

图4 酵母菌菌株的生长曲线
Fig.4 Growth curve of yeast strains
2.2.5 酵母菌的酸耐受性分析
酵母菌菌株J-1和J-6的耐酸性分析结果见图5。由图5可知,随着pH值的降低,3株酵母菌菌株的生长均逐渐受到抑制,当pH≤3.0时,3株酵母菌株均几乎不能生长,当pH在3.0~4.5时,酵母菌菌株J-1和J-6的OD600 nm值均高于商业酿酒酵母SY,且菌株J-1的OD600nm值最高,说明这两株优良酵母菌株的耐酸性能均优于商业酿酒酵母,且菌株J-1的耐酸性能最好,可耐受pH 3.5。
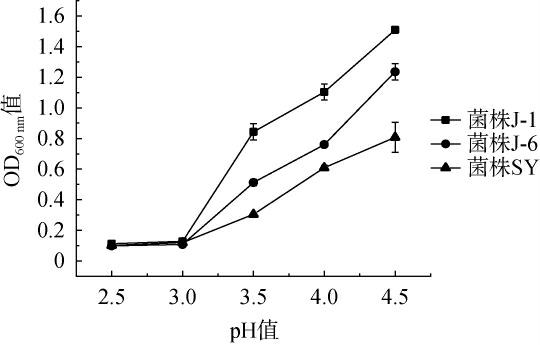
图5 酵母菌菌株的耐酸性分析结果
Fig.5 Results of acid tolerance analysis of yeast strains
2.3 优良酵母菌株的分子生物学鉴定
基于26S rDNA基因序列构建菌株J-和J-6的系统发育树,结果见图6。
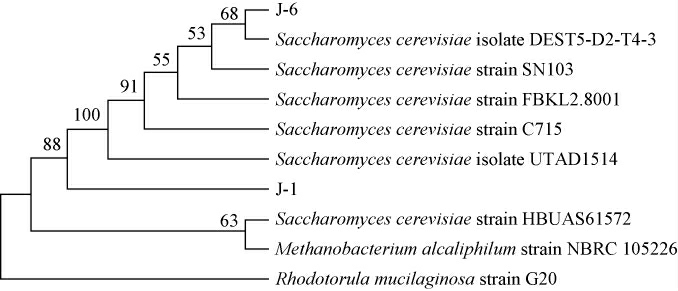
图6 基于26S rDNA基因序列优良酵母菌株J-1和J-6的系统发育树
Fig.6 Phylogenetic tree of superior yeast strains J-1 and J-6 based on the 26S rDNA gene sequence
由图6可知,菌株J-1和J-6均与酿酒酵母(Saccharomyces cerevisiae)聚于同一分支,亲缘关系最近,结合形态观察及生理生化试验,最终鉴定菌株J-1和J-6均为酿酒酵母(Saccharomyces cerevisiae)。
3 结论
慕萨莱思发酵过程中,真菌菌群的丰富度、均匀度及多样性呈先升高后下降的趋势,从中共注释到25个真菌属,主要真菌属为酵母属(Saccharomyces)、曲霉属(Aspergillus)、篮状菌属(Talaromyces)、短梗霉属(Aureobasidium)、红酵母属(Rhodotorula)、线黑粉菌属(Filobasidium)、羊肚菌属(Morchella)、镰刀菌属(Fusarium)等。 发酵初期优势真菌属(相对丰度>1%)为红酵母属(19.10%)、羊肚菌属(15.16%)、镰刀菌属(13.30%)、线黑粉菌属(11.67%);发酵中期为酵母属(52.30%)、短梗霉属(22.74%)、革孔菌属(Coriolopsis)(6.14%)、篮状菌属(5.03%)、青霉属(Penicillium)(4.50%)、曲霉属(2.64%);发酵后期为酵母属(36.44%)、曲霉属(35.25%)、篮状菌属(21.16%)、线黑粉菌属(5.10%)、青霉属(1.80%)。 丛慕萨莱思发酵过程中共分离筛选出2株优势酵母菌菌株,编号分别为J-1、J-6,经鉴定,均为酿酒酵母(Saccharomyces cerevisiae),其耐酸性及生长性能均优于商业酿酒酵母SY,在后续慕萨莱思的工业生产具有一定的应用潜能。
[1]乔通通.慕萨莱思产关键香优势菌株的筛选与工艺优化[D].阿拉尔:塔里木大学,2022.
[2]周环,王凯,陈盼盼,等.高效液相色谱法测定慕萨莱思中山梨酸钾的含量[J].农产品加工,2023(23):54-58,61.
[3]张璐,张昱,蒲云峰,等.慕萨莱思葡萄酒酿造过程中的氨基酸组成及含量分析[J].食品工业,2018,39(4):260-263.
[4]田木星,王伟华,苑贝贝,等.慕萨莱思酒发酵过程中主要成分变化规律研究[J].中国食品添加剂,2017(3):61-67.
[5]乔通通,朱丽霞.古老慕萨莱思发展现状[J].酿酒科技,2020(11):98-104,109.
[6]孙文静,陈建胜,束超,等.3株商业克鲁维酵母对贺兰山东麓赤霞珠干红葡萄酒增酸效果及酒品质的影响[J].食品科学技术学报,2024,42(4):61-74.
[7]杨创举,何新,朱丽霞.慕萨莱思降糖、降酸优势酵母菌的筛选[J].食品与发酵科技,2020,56(3):22-30.
[8]于其可,王赛,王盼,等.不同品种葡萄表皮真菌菌群的多样性分析[J].中国酿造,2022,41(7):122-127.
[9]文栩,王志磊,袁佳璐,等.自然发酵与接种发酵“户太8号”葡萄酒品质及真菌微生物多样性分析[J].食品科学,2023,44(14):181-189.
[10]朱丽霞,李红梅,郭东起,等.新疆慕萨莱思自然发酵过程中酵母菌表型多样性及优势菌分析[J].食品科学,2012,33(7):142-147.
[11]冯姝.新疆慕萨莱思酵母菌分离鉴定及优势菌遗传多样性分析[D].阿拉尔:塔里木大学,2013.
[12]程功,王丽玲,霍亚蒙,等.阿瓦提红葡萄中酵母菌的分离鉴定及应用[J].食品与发酵工业,2024,50(21):121-127.
[13] 李瞻君.慕萨莱思新产品研发及其品质研究[D].阿拉尔:塔里木大学,2024.
[14]乔通通,朱丽霞.慕萨莱思中呋喃酮、5-甲基糠醛和3-甲硫基丙醇的香气阈值及二元协同作用[J].食品科学,2023,44(8):176-183.
[15]侯晓杰,赵玉霞,龚虎成,等.双酵母混合发酵低度起泡慕萨莱思产品的研发[J].食品科技,2021,46(7):100-105.
[16]王旭辉,徐鑫,宝哲,等.高通量测序分析玉米秸秆与牛粪联合发酵阶段微生物多样性变化[J].食品与发酵工业,2019,45(3):47-55.
[17]秦楠,栗东芳,杨瑞馥.高通量测序技术及其在微生物学研究中的应用[J].微生物学报,2011,51(4):445-457.
[18]岑涛,岳田利,袁亚宏,等.云南芒果中酵母菌分离鉴定及在芒果酒发酵中的应用[J].食品科学,2015,36(11):119-124.
[19]赵雪平,温雅娇,李正英,等.内蒙古乌海地区果园及发酵醪液中酿酒酵母菌的筛选[J].食品与发酵工业,2020,46(11):178-183.
[20]李欢欢.基于肠道菌群—肠—脑轴探讨红景天苷联合Dorsomorphin对脑缺血再灌注损伤大鼠的影响[D].成都:西南交通大学,2022.
[21]邓旗,花梅芳,杨秀文,等.基于PCR和TOF-MS海洋源产脂肽芽孢杆菌筛选[J].广东海洋大学学报,2021,41(1):72-80.
[22]郭建华,李洋.糯玉米粉浸泡发酵改性过程中细菌菌群结构及多样性的变化分析[J].齐齐哈尔大学学报(自然科学版),2024,40(3):69-72.
[23]杨玲彭,佳伟,郭旭凯,等.基于高通量测序山西老陈醋和怀仁醋酒精发酵初期酒醅真菌菌群研究[J].中国酿造,2024,43(4):109-114.
[24]石明杨.沙果和桃子中酵母菌的分离鉴定及其生物学特性研究[D].呼和浩特:内蒙农业大学,2016.
[25]赵雪平,温雅娇,李正英,等.内蒙古乌海地区果园及发酵醪液中酿酒酵母菌的筛选[J].食品与发酵工业,2020,46(11):178-183.
[26]高娉娉,朱亚同,刘宇,等.高产酸性β-葡萄糖苷酶的优势本土酵母菌株筛选、鉴定及酶学性质分析[J].食品与发酵工业,2022:48(12):30-36.
[27]米尔班古丽·阿卜杜如苏力.新疆传统馕面团发酵酵母菌的多样性分析[D].乌鲁木齐:新疆大学,2015.
[28]麦桂婉,肖文超,李云锋,等.不同类型香蕉的细菌性鞘腐病病原分子鉴定及致病性分析[J].华南农业大学学报,2024,45(4):535-541.
[29]李默,曹凯欣,任广钰,等.自然发酵锦州小菜中优势酵母菌的筛选及鉴定[J].中国食品学报,2021:21(4):277-285.
[30]FILIPPIS D F,STORIA L A,BLAIOTTA G.Monitoring the mycobiota during Greco di Tufo and Aglianico wine fermentation by 18S rRNA gene sequencing[J].Food Microbiol,2017,63:117-122.
[31]王汐月.不同生长期葡萄根际微生物及葡萄酒发酵过程中真菌群落的研究[D].烟台:烟台大学,2022.
[32]魏学鼎,孙文超.酿酒酵母的筛选及其发酵性能应用研究[J].粮食与油脂,2024,37(3):117-121,153.
[33]巴尼特J A.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:144-171.
[34]周英彪,田朝玉,朱玥明,等.在酿酒酵母中重构棉子糖生物合成途径的基础研究[J].现代食品科技,2017,33(5):121-128,96.
[35]胡江南,高熳熳,马立娟,等.葡萄酒发酵优良酵母的筛选、鉴定及应用[J].中国酿造,2023:42(7):43-50.