高温大曲中高产四甲基吡嗪芽孢杆菌的筛选及其在酒醅堆积中的应用
史洪丽,余梦婷,王世昕,张 鹏,刘慧敏,李春茂,舒南鑫,孙朋朋,龙代洲,郭松波*
(贵州钓鱼台国宾酒业有限公司,贵州 遵义564501)
摘 要:该研究从高温大曲中筛选芽孢杆菌(Bacillus),通过耐高温试验、蛋白酶活力测定初筛,V-P试验及四甲基吡嗪含量分析复筛高产四甲基吡嗪芽孢杆菌,并经过形态学观察、生理生化试验及分子生物学技术鉴定筛选菌株,并采用气相色谱-质谱联用(GC-MS)仪分析筛选菌株发酵液中挥发性风味物质,并将其应用于酒醅堆积。结果表明,筛选出18株产蛋白酶菌株,高产四甲基吡嗪菌株D-13-11,其含量达339.99 mg/L,菌株D-13-11鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。GC-MS结果表明,共检出42种物质,其中,吡嗪类4种、酯类15种、醇类4种、醛酮类4种、酸类6种、酚类2种、烷烃类及硅氧烷类7种。吡嗪类化合物的相对含量最高,达40.14%,主要为四甲基吡嗪(24.84%)。将菌株D-13-11按接种量7%接种至堆积酒醅中,吡嗪类化合物的含量明显高于对照组,其中,四甲基吡嗪的含量达11.38 μg/g,是对照组的71.13倍。
关键词:高温大曲;四甲基吡嗪;芽孢杆菌;筛选;鉴定
中图分类号:TS262.3
文章编号:0254-5071(2025)03-0059-07
doi: 10.11882/j.issn.0254-5071.2025.03.010
引文格式:史洪丽,余梦婷,王世昕,等.高温大曲中高产四甲基吡嗪芽孢杆菌的筛选及其在酒醅堆积中的应用[J].中国酿造,2025,44(3):59-65.
收稿日期:2024-06-03 修回日期:2024-08-30
基金项目:贵州省科技支撑计划项目(黔科合成果[2023]一般151)
作者简介:史洪丽(1993-),女,硕士,主要从事酱香型白酒检测工作。
*通讯作者:郭松波(1987-),男,高级工程师,博士,主要从事酱香型白酒研究工作。
Screening of high yield tetramethylpyrazine Bacillus from high temperature Daqu and its application in the stacking of fermented grains
SHI Hongli,YU Mengting,WANG Shixin,ZHANG Peng,LIU Huimin,LI Chunmao,SHU Nanxin,SUN Pengpeng,LONG Daizhou,GUO Songbo*
(Kweichow Diaoyutai State Guest Distillery Co.,Ltd.,Zunyi 564501,China)
Abstract:In this study,Bacillus spp were screened from high temperature Daqu.The strains were preliminarily screened through high temperature resistance test and protease activity determination, rescreened by V-P test and tetramethylpyrazine content analysis.The screened strains identified through morphological observation,physiological and biochemical tests and molecular biology techniques.The volatile flavor substances in the fermentation liquid of the strains were analyzed by GC-MS,and the strains were applied to the stacking of fermented grains.The results showed that a total of 18 proteinase- producing strains and 1 high yield tetramethylpyrazine strain D-13-11 were screened, and the high yield tetramethylpyrazine strain D-13-11 was identified as Bacillus velezensis with its content as high as 339.99 mg/L.The GC-MS results showed that a total of 42 substances were detected,including pyrazines 4,esters 15,alcohols 4,aldehydes and ketones 4,acids 6,phenols 2,alkanes and siloxanes 7.The relative content of pyrazine compounds was the highest,reaching 40.14%,and the tetramethylpyrazine was the main compound(24.84%).The strain D-13-11 was inoculated into the stacking of fermented grains with inoculum 7%,and the relative content of pyrazine compounds was significantly higher than that of the control group.Among them,the content of tetramethylpyrazine was 11.38 μg/g,which was 71.13 times that of the control group.
Key words:high temperature Daqu;tetramethylpyrazine;Bacillus;screening;identification
四甲基吡嗪(tetramethylpyrazine,TTMP)称为川芎嗪,因其独特的香味而备受青睐,常在食品中被用作调味剂和增香剂[1-2]。能有效预防心脑血管疾病、糖尿病和癌症等疾病的发生[3-4]。此外,四甲基吡嗪是影响酒类口感的关键成分之一,在芝麻香型、酱香型白酒中,四甲基吡嗪的含量相对较高[5],但对于清香型白酒,其含量则显得非常稀少[6],这种差异与不同香型的白酒所采用的独特酿造技术密切相关[7]。四甲基吡嗪的生成得益于在高温条件下的制曲和堆积过程[8]。目前常用方法是通过微生物发酵酒曲和优化工艺条件增加白酒中的四甲基吡嗪含量[9-11]。
白酒生产过程中产四甲基吡嗪的微生物大多为芽孢杆菌[12],芽孢杆菌能代谢产生大量具有酱味的吡嗪类物质和酸味的物质[13],有助于提高白酒中四甲基吡嗪的含量,并对白酒品质有一定的提升作用[14]。王庆等[15]从高温大曲中分离出的产四甲基吡嗪菌株为副淀粉芽孢杆菌(Bacillus paramycoides)、贝莱斯芽孢杆菌(Bacillus velezensis),四甲基吡嗪产量为173.57~272.15 mg/L。钟桂芳等[16]在高温大曲中分离出高产四甲基吡嗪菌株为甲基营养型芽孢杆菌(Bacillus methylotrophicus)、蛋白水解芽孢杆菌(Bacillus proteolyticus),产量分别为350.98 mg/L、163.49 mg/L。王晓丹等[10]在窖池中加入产四甲基吡嗪菌株,其发酵后的酒醅中四甲基吡嗪含量为6.81 μg/g,为对照组的3.03倍。赵德义等[17]从中温大曲中分离筛选到一株产四甲基吡嗪的枯草芽孢杆菌,其四甲基吡嗪产量可达11.42 g/L。因此,筛选高产四甲基吡嗪菌株对提升白酒品质具有重要意义。
本研究从高温大曲中分离筛选出菌株,通过耐高温试验、高产蛋白酶菌株初筛,V-P试验及四甲基吡嗪含量分析复筛高产四甲基吡嗪芽孢杆菌,利用形态特征、生理生化试验及分子生物学技术,对高产四甲基吡嗪菌株进行鉴定,并采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术对筛选菌株的挥发性风味物质进行分析,并应用于酒醅中,以期增强酒醅中四甲基吡嗪的含量,为酱香型白酒中四甲基吡嗪菌株的使用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
高温大曲:贵州钓鱼台国宾酒业有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化有限公司;四甲基吡嗪标准品(纯度>98%)、甲醇、乙醇(均为色谱级):上海麦克林生化科技股份有限公司。
1.1.2 培养基
LB培养基:酵母浸粉0.5 g,NaCl 1 g,蛋白胨1 g,琼脂1.5 g,加水至100 mL,115 ℃高温灭菌20 min。
脱脂奶粉培养基(A液和B液单独灭菌)为A液:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 15 g/L,调节pH为7.0;B液:脱脂奶粉为1 g/10 mL。115 ℃高压灭菌25 min,A液和B液按9∶1比例均匀混合使用。
V-P培养基:蛋白胨0.5 g,葡萄糖0.5 g,氯化钠0.5 g,加水至100 mL,115 ℃高温灭菌25 min,pH值调至7.2。
发酵培养基:蛋白胨3 g,磷酸氢二铵3 g,酵母膏1 g,葡萄糖5 g,加水至100 mL,pH值调至7.3,115 ℃高温灭菌20 min。
固体培养基:将粉碎小麦与水按1∶0.4润麦过夜,在蒸锅里进行蒸煮40 min后取出,充分打散后,小麦与水按1.0∶0.2进行混匀,使其达到湿而不粘,将其分装到100 mL三角瓶中,每瓶50 g,121 ℃灭菌20 min。
1.2 仪器与设备
SW-CJ超净工作台:苏州市金净净化设备科技有限公司;LDZM-80L-I立式高压蒸汽灭菌器:上海申安医疗器械厂;BX-43生物显微镜:北京奥林巴斯销售服务有限公司;TS-2102双层恒温摇床:常州金坛良友仪器有限公司;InfinityⅡ1260高效液相色谱(high performance liquid chromatography,HPLC)仪、8860-5977B气相色谱-质谱联用仪:安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 大曲中细菌的分离、纯化
参照史洪丽等[18]的方法,将大曲10 g加入90 mL无菌水中,37 ℃、200 r/min振荡28 min,取上清液,分别稀释至10-3、10-4、10-5、10-6,进行平板涂布(重复3次),37 ℃培养24 h后,观察菌落形态,并选择不同菌落形态的单菌落,在LB培养基上进行培养,于37 ℃培养24 h,然后在-80 ℃的温度下进行保存以备后用。
1.3.2 菌株初筛
耐高温菌株筛选:将菌株D-13-11种子液按2%接种量接种至LB的培养基,在温度为30 ℃、37 ℃、45 ℃、50 ℃、55 ℃的摇床中,200 r/min分别振荡培养24 h,平行3次,用可见分光光度计进行计数,筛选出耐高温且生长较好的菌株[19]。
高产蛋白酶菌株的筛选:将已纯化好的菌株接种于脱脂奶粉培养基中,37 ℃培养24 h,观察菌株透明圈的大小[20]。根据脱脂牛奶培养基菌种透明圈直径D和菌落直径d比值的大小(D/d),初步判断产蛋白酶能力的高低。
V-P实验:V-P液体培养基中加入产蛋白酶能力强的菌株,37 ℃培养48 h。加入3 mL O'Meara(含0.3%肌酸与40%NaOH水溶液)试剂到培养液的试管中,振荡1~2 min,恒温培养箱静置15 min,当液体呈现伊红色,说明有双乙酰或乙偶姻产生[21]。
1.3.3 产四甲基吡嗪菌株的复筛
感官分析:将筛选菌株接种至LB培养基中进行培养,于37 ℃、200 r/min培养24 h,然后将其菌液以2%的接种量接种至小麦固态发酵培养基中进行固态模拟发酵实验,37℃培养48 h、40 ℃培养12 h、45 ℃培养24 h、50 ℃培养12 h、55 ℃培养12 h,设空白对照组(重复3次)。在培养完成之后,感官评价小组(由1位省级评审员和5位三级品酒师组成)从培养基的颜色、粘性和香气(酱味、甜香、焦香、麦香、酸味和异味等)方面进行感官评价[22]。
四甲基吡嗪的含量分析:将筛选菌株接入到LB液体培养基中,37 ℃、200 r/min培养24 h。然后将其按2%接种量接种至发酵培养基,37 ℃、200 r/min培养24 h,40 ℃培养12 h,随后升至45 ℃培养24 h,取5 mL培养液于10 000 r/min离心8 min之后,对上清液进行收集,并利用0.22 μm的有机滤膜直接进行样品进样,接着采用HPLC技术对发酵液中的四甲基吡嗪的含量进行测定[21,23]。
1.3.4 四甲基吡嗪含量检测
采用HPLC测定四甲基吡嗪含量。
色谱检测条件:流动相A为0.1甲酸∶超纯水溶液,流动相B为0.1甲酸∶乙腈溶液。柱体温度设定为40 ℃,设定流速为0.5 mL/min,采用梯度洗脱,Eclipse Plus C18色谱柱(3.5 μL,4.6 m×250 mm),进样量为20 μL,紫外检测器,波长为278 nm[24]。
定性定量分析:采用保留时间定性,外标法定量。以四甲基吡嗪含量(x)为横坐标,以峰面积(y)为纵坐标,绘制标准曲线,获得标准曲线回归方程为y=47.792 6x+105.545 8,相关系数R2=0.999 89。
1.3.5 产四甲基吡嗪菌株的鉴定
形态学观察:将产四甲基吡嗪菌株D-13-11接种于LB平板,37 ℃培养24 h,对其菌落的形态和大小进行观察,进行革兰氏染色处理[25]。
生理生化实验:参照文献[26]对菌株D-13-11进行生理生化特征分析。
分子生物学技术鉴定:参照文献[18]对菌株D-13-11的16S rDNA基因扩增及序列分析,引物为:27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACT T-3'),PCR扩增体系(25 μL):引物1492R和27F各1.0 μL,Mix 12.5 μL,DNA模板1.0 μL,双蒸水(ddH2O)9.5 μL;PCR扩增程序:94 ℃预变性10 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,31个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测后送生工生物工程(上海)股份有限公司进行测序,测序结果经美国国家生物技术信息中心(national center for biotechnology information,NCBI)进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,采用MEGA 7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.6 产四甲基吡嗪菌株的HS-SPME-GC-MS分析
上清液制备:将菌株D-13-11接种于发酵培养基进行模拟发酵实验,37 ℃、200 r/min培养48 h,40 ℃培养12 h,随后升至50 ℃培养24 h,发酵液以10 000 r/min离心10 min除去菌体,取7~8 mL上清液[16]。
HS-SPME条件:于上清液中加入2.5 g NaCl至20 mL顶空进样瓶中,再加入12 μL甲基异丁基甲醇[16],插入装有50/30 μm DVB/CAR/PDMS StableFlex(2 cm)纤维头的手动进样器,大约100 ℃进行顶空萃取30 min后快速取出萃取头,插入250 ℃气相色谱仪的进样口中热解吸5 min后,立即进行进样[27]。
GC条件:色谱柱为DB-WAX(30 m×0.25 mm×0.25 μm)弹性石英毛细管柱,程序升温条件:柱温50 ℃(保留2 min),温度从4 ℃/min升到30 ℃(保持2 min),柱前压为7.62 psi,载气为高纯氦气(He)(99.999%),载气流速为1.0 mL/min,汽化室温度为250 ℃,样品的进样不进行分流,溶剂需延迟5 min[27]。
MS条件:电离方式为电子电离(electronic ionization,EI)源,离子源温度230 ℃,四极杆温度150 ℃,接口温度280 ℃,质量扫描的范围是20~450 amu[27]。
定性定量方法:通过美国国家标准技术研究所(national institute of standards and technology,NIST)17.L数据库确定其挥发性化学成分,并采用峰面积归一化法来测定相对含量[28]。
1.3.7 产四甲基吡嗪菌株在酒醅堆积过程中的理化指标分析
将8%的大曲加入到装有90 g酒醅的三角瓶中搅拌混匀,将产四甲基吡嗪菌株D-13-11发酵液按0、3%、5%和7%接种量接种至酱香型堆积酒醅中发酵,5层纱布对三角瓶进行封口,37 ℃、40 ℃各培养24 h后,将纱布换成胶塞后继续在45 ℃、50 ℃各培养24 h,堆积结束后,测定酒醅中的残淀粉、酸度、残糖和吡嗪类化合物相对含量。
残淀粉、酸度、残糖的测定:分别参照T/CBJ004—2018《固态发酵酒醅通用分析方法》中的斐林试剂法、酸碱滴定法、斐林试剂法。
1.3.8 数据处理
利用SPSS 23.0对数据进行显著性分析,通过Origin 2020进行作图。
2 结果与分析
2.1 产四甲基吡嗪菌株的初筛
产四甲基吡嗪菌株的筛选结果见表1。由表1可知,从高温大曲中分离出18株细菌,均能观察到透明圈,透明圈直径为1.0~3.5,说明其均能产生蛋白酶,耐高温菌株11株,10株细菌V-P显色实验结果呈阳性(红色),说明其产乙偶姻(四甲基吡嗪的前体物质即乙偶姻[29]),10株菌株编号分别为D-3、D-13-11、D-102、D-110、D-117、D-119、D-162、D-167、D-48、D-187。因此,选择这10株菌进行后续实验。
表1 产四甲基吡嗪菌株的初筛
Table 1 Preliminary screening of tetramethylpyrazine-producing strains
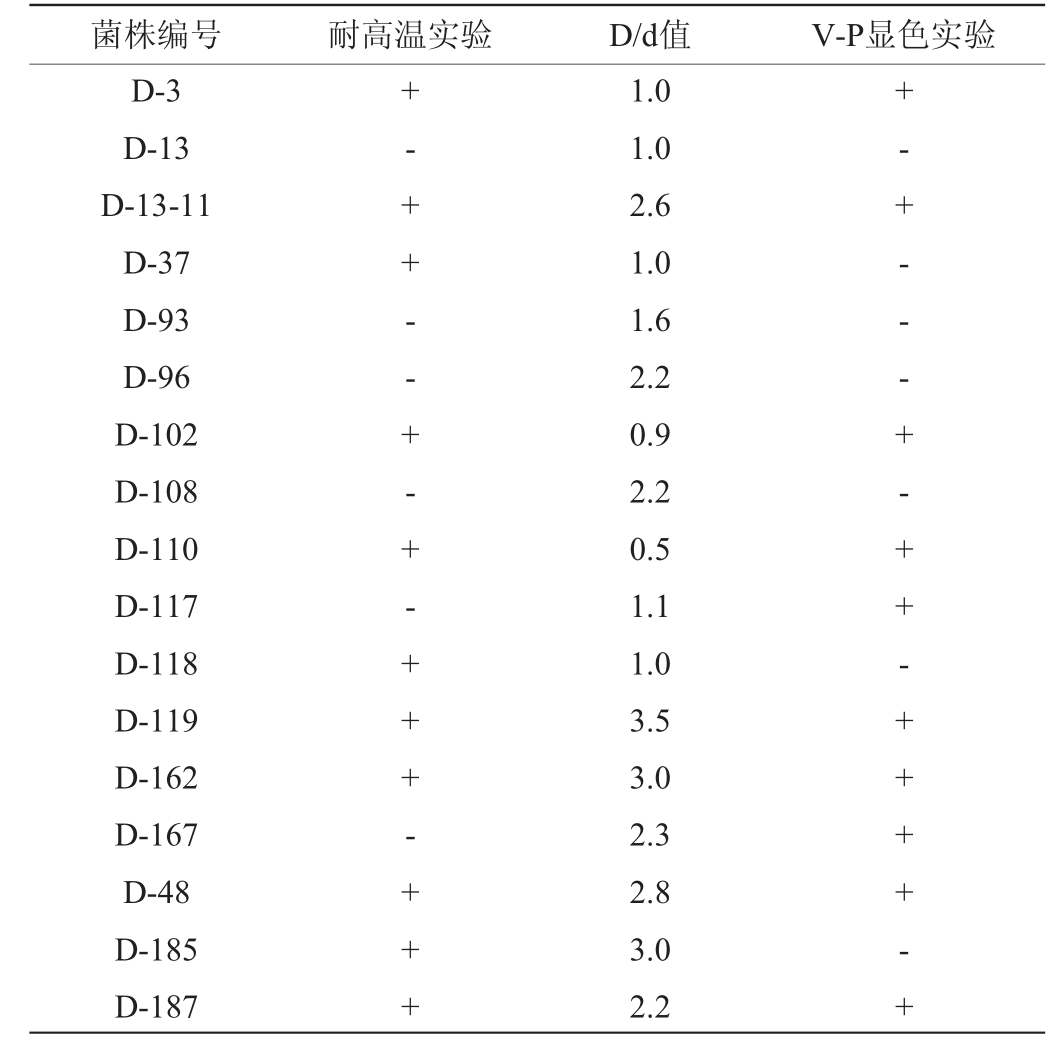
注:“+”表示反应为阳性,“-”表示反应为阴性。
菌株编号 耐高温实验 D/d值 V-P显色实验D-3 D-13 D-13-11 D-37 D-93 D-96 D-102 D-108 D-110 D-117 D-118 D-119 D-162 D-167 D-48 D-185 D-187+-+ +-- +-+-+++-+ ++1.0 1.0 2.6 1.0 1.6 2.2 0.9 2.2 0.5 1.1 1.0 3.5 3.0 2.3 2.8 3.0 2.2+- + - - - + - + + -+ + + + - +
2.2 产四甲基吡嗪菌株的复筛
2.2.1 筛选菌株模拟固态发酵感官评价
对经过初筛的10株菌株进行固态模拟发酵实验,并对发酵后的样品从培养基的颜色、粘性和香气进行了感官评价,结果见表2。由表2可知,菌株D-3、D-102、D-167、D-48为黄褐色,菌株D-162为黑褐色,菌株D-117深褐色,带有酸味,麦酸味、曲粉味等,粘性整体较强,综合评分均较低(1~4分);菌株D-13-11为黑褐色、菌株D-110为黄褐色、菌株D-119、D-187为深褐色,呈现出明显的酱香味、甜味、曲香味,粘性整体显著,综合评分较高(9~10分)。
表2 筛选菌株模拟固态发酵感官评价
Table 2 Sensory evaluation for simulated solid-state fermentation by
screened strains

注:“+”表示具有一定的粘性;“++”表示粘性较强;“+++”表示粘性显著。
菌株编号 颜色 香气 粘性 综合评分/分D-3 D-13-11 D-102 D-117 D-110 D-119 D-162 D-167 D-48 D-187黄褐色黑褐色黄褐色深褐色黄褐色深褐色黑褐色黄褐色黄褐色深褐色酸臭味酱香带一点甜香、有焦香酸味、麦酸味豆豉香、类似干稻草的气味酱香带豆豉香淡淡的酱香、麦香汗臭味、曲粉味麦皮味淡淡的糊味酱香、曲香++++++++++++++++++++++++3 10 241 091341 0
2.2.2 筛选菌株产四甲基吡嗪含量分析
初筛菌株发酵产四甲基吡嗪含量的测定结果见图1。由图1可知,菌株产四甲基吡嗪的含量范围为5.623~339.996 mg/L,其中,菌株D-13-11发酵产四甲基吡嗪含量最高,达339.996 mg/L。因此,对菌株D-13-11进行研究。
2.3 产四甲基吡嗪菌株的鉴定
2.3.1 形态学观察
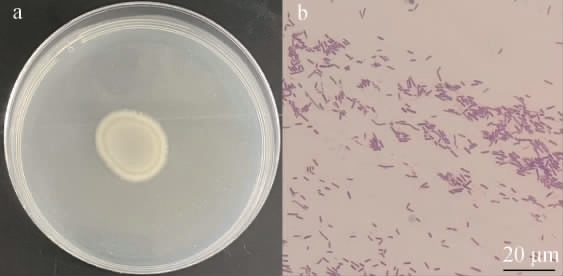
菌株D-13-11的菌落(a)及细胞(b)形态见图2。由图2a可知,菌株D-13-11在LB培养基上的菌落表面光滑、有光泽、乳白色、黏稠、边缘是锯齿状、呈圆形、椭圆形,由图2b可知,菌株为革兰氏阳性,菌体呈杆状。结合表2结果,推测菌株D-13-11为芽孢杆菌属。
2.3.2 生理生化试验
菌株D-13-11生理生化试验结果见表3。由表3可知,菌株D-3-11能够产蛋白酶和粉红色的化合物,可利用柠檬酸盐,且具有产酸能力,但不能产生黑色素和分解吲哚,耐受乙醇体积分数6%,由此表明,菌株D-13-11具有一定的生理活性,且符合芽孢杆菌生物学特性。
表3 菌株D-13-11生理生化试验结果
Table 3 Physiological and biochemical test results of strain D-13-11

注:“+”表示结果为阳性“-”表示结果为阴性。
项目 特征糖类分解试验黑色素产生试验产蛋白酶试验V-P显色试验柠檬酸盐试验吲哚试验耐酒精试验+-+++-耐受乙醇体积分数6%
2.3.3 分子生物学鉴定
基于16S rDNA基因序列菌株D-13-11的系统发育树见图3。
由图3可知,菌株D-13-11与Bacillusvelezensis MV577728.1聚于一支,亲缘关系最近,相似度达99.69%。结合形态特征与生理生化分析结果,将菌株D-13-11鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。
2.4 产四甲基吡嗪菌株发酵液的挥发性风味成分分析
菌株D-13-11发酵液中挥发性风味成分检测结果见表4。由表4可知,菌株D-13-11发酵液中共检出42种挥发性风味化合物。其中,吡嗪类物质4种、酯类15种、醇类4种、醛类与酮类物质4种、酸类6种,酚类2种、烷烃类及硅氧烷类7种。
表4 菌株D-13-11发酵液中挥发性风味成分检测结果
Table 4 Detection results of volatile flavor substances in fermentation broth of strain D-13-11
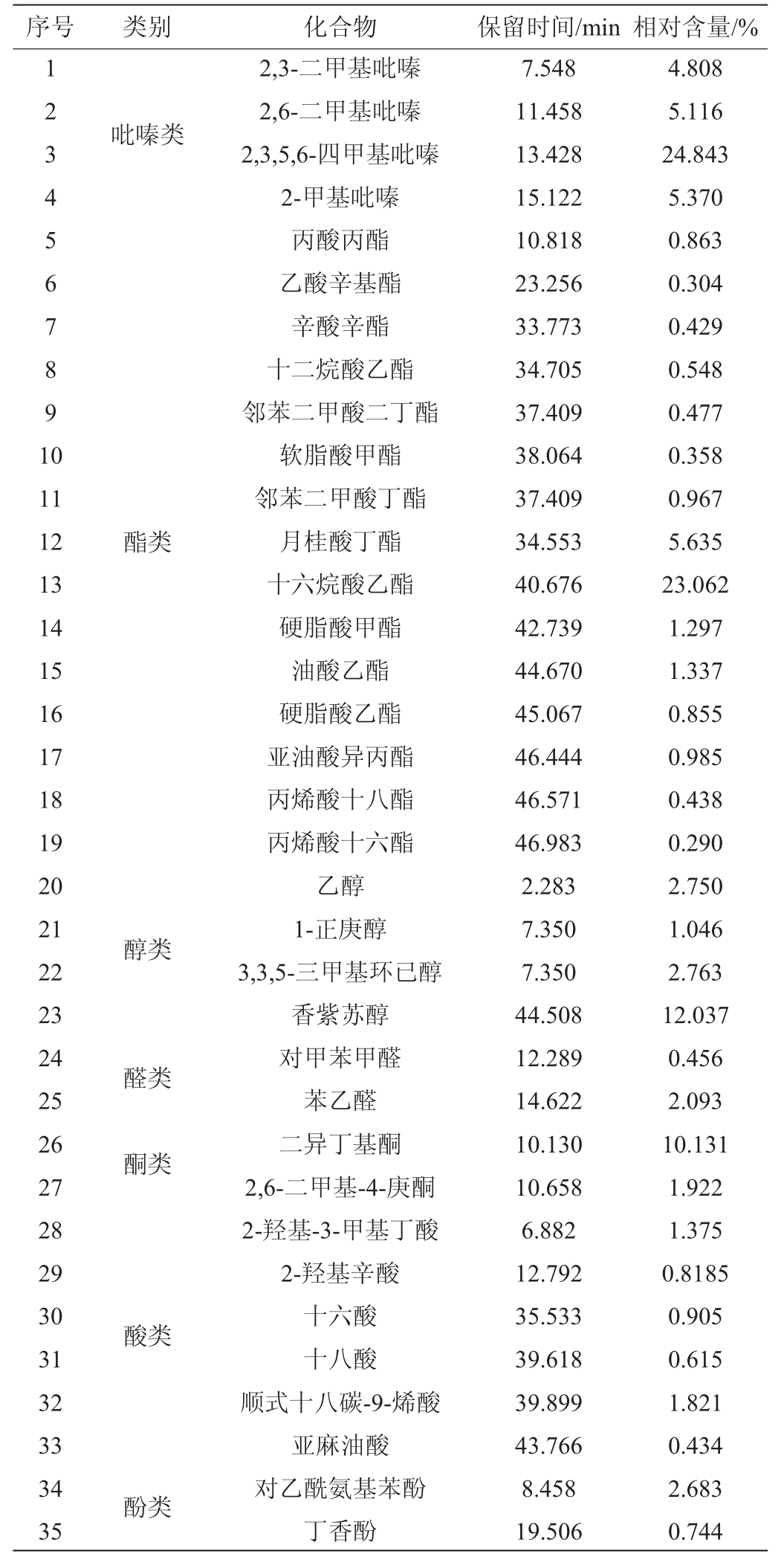
序号 类别 化合物 保留时间/min 相对含量/%1 2 3 45 6 7 8 9 1 0吡嗪类11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35酯类醇类醛类酮类酸类酚类2,3-二甲基吡嗪2,6-二甲基吡嗪2,3,5,6-四甲基吡嗪2-甲基吡嗪丙酸丙酯乙酸辛基酯辛酸辛酯十二烷酸乙酯邻苯二甲酸二丁酯软脂酸甲酯邻苯二甲酸丁酯月桂酸丁酯十六烷酸乙酯硬脂酸甲酯油酸乙酯硬脂酸乙酯亚油酸异丙酯丙烯酸十八酯丙烯酸十六酯乙醇1-正庚醇3,3,5-三甲基环已醇香紫苏醇对甲苯甲醛苯乙醛二异丁基酮2,6-二甲基-4-庚酮2-羟基-3-甲基丁酸2-羟基辛酸十六酸十八酸顺式十八碳-9-烯酸亚麻油酸对乙酰氨基苯酚丁香酚7.548 11.458 13.428 15.122 10.818 23.256 33.773 34.705 37.409 38.064 37.409 34.553 40.676 42.739 44.670 45.067 46.444 46.571 46.983 2.283 7.350 7.350 44.508 12.289 14.622 10.130 10.658 6.882 12.792 35.533 39.618 39.899 43.766 8.458 19.506 4.808 5.116 24.843 5.370 0.863 0.304 0.429 0.548 0.477 0.358 0.967 5.635 23.062 1.297 1.337 0.855 0.985 0.438 0.290 2.750 1.046 2.763 12.037 0.456 2.093 10.131 1.922 1.375 0.8185 0.905 0.615 1.821 0.434 2.683 0.744
续表
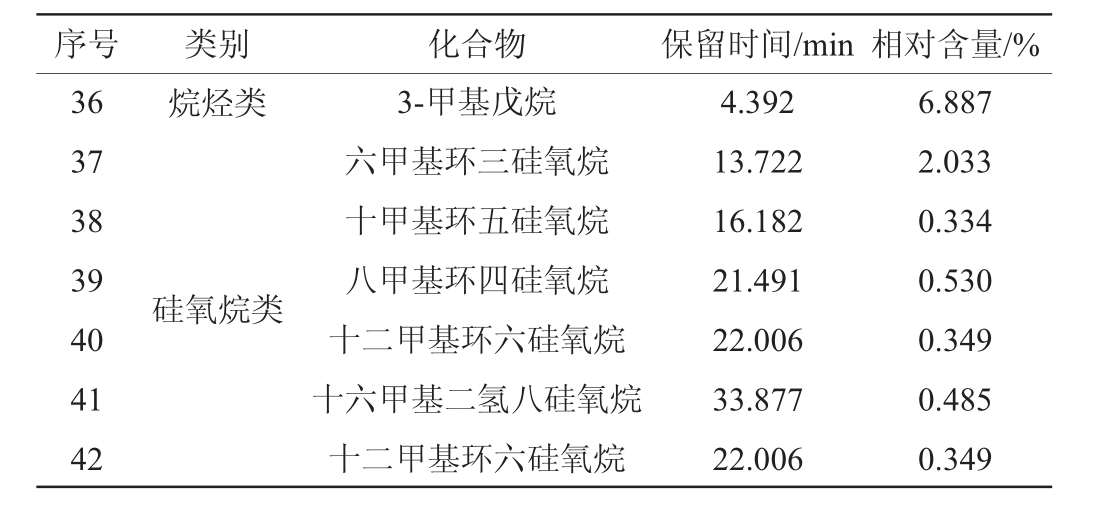
序号 类别 化合物 保留时间/min 相对含量/%36 37 38 39 40 41 42烷烃类硅氧烷类3-甲基戊烷六甲基环三硅氧烷十甲基环五硅氧烷八甲基环四硅氧烷十二甲基环六硅氧烷十六甲基二氢八硅氧烷十二甲基环六硅氧烷4.392 13.722 16.182 21.491 22.006 33.877 22.006 6.887 2.033 0.334 0.530 0.349 0.485 0.349
吡嗪类化合物具有明显的烤香味、坚果味,在白酒酿造过程中主要提供更多的风味和保健功能组分[30],贝莱斯芽孢杆菌合成2,3,5,6-四甲基吡嗪的能力较强,其中,2,3,5,6-四甲基吡嗪相对含量为24.843%、2-甲基吡嗪相对含量为5.370%、2,6-二甲基吡嗪相对含量为5.116%。酯类物质具有水果香和甜香,是构成酱香型典型性及综合性香气特征的关键物质[31],其中,十六烷酸乙酯相对含量为23.062%、油酸乙酯相对含量为1.337%,和亚油酸乙酯并称为白酒中的三大高级脂肪酸酯,其含量对白酒透明度有重要影响[32]。
醇类化合物的香气阈值都较高,赋予白酒秀雅的醇香,对白酒的丰满度和厚重感方面起着重要作用[32],其中,1-正庚醇相对含量为1.046%,香紫苏醇相对含量为12.037%,均为酱香型白酒中的重要香气贡献物质[33]。酸类化合物是酯类化合物的前体物质,在白酒中主要具有助香、缓冲平衡的作用[34],其中,十六酸相对含量为0.905%、亚麻油酸相对含量为0.434%,均在一定程度上改善白酒的余味并增加酒体醇和感。
醛类化合物是白酒酒体中重要的协调成分,有助于酒体风味的释放[35],其中,苯乙醛相对含量为2.093%、对甲苯甲醛相对含量为0.456%。酮类化合物对酒的香气风味影响较小,大多具有果香、花香等气味,其阈值较高[36],其中,二异丁基酮相对含量为10.131%、2,6-二甲基-4-庚酮相对含量为1.922%。酚类化合物是白酒香气的重要组成部分,某些酚类还具有独特的抗氧化生物活性[37],其中,丁香酚相对含量达0.744%,具有烟熏风味和酱油香味,是酱香风味的重要组成部分[38]。烷类化合物对白酒风味贡献较小,但作为次级代谢的产物,其对调节微生物种间关系有重要意义,其中3-甲基戊烷相对含量为6.887%。此外,菌株D-13-11还产生了六甲基环三硅氧烷、十甲基环五硅氧烷等化合物。
2.5 产四甲基吡嗪菌株D-13-11在酒醅堆积过程中的理化指标及吡嗪类物质测定结果
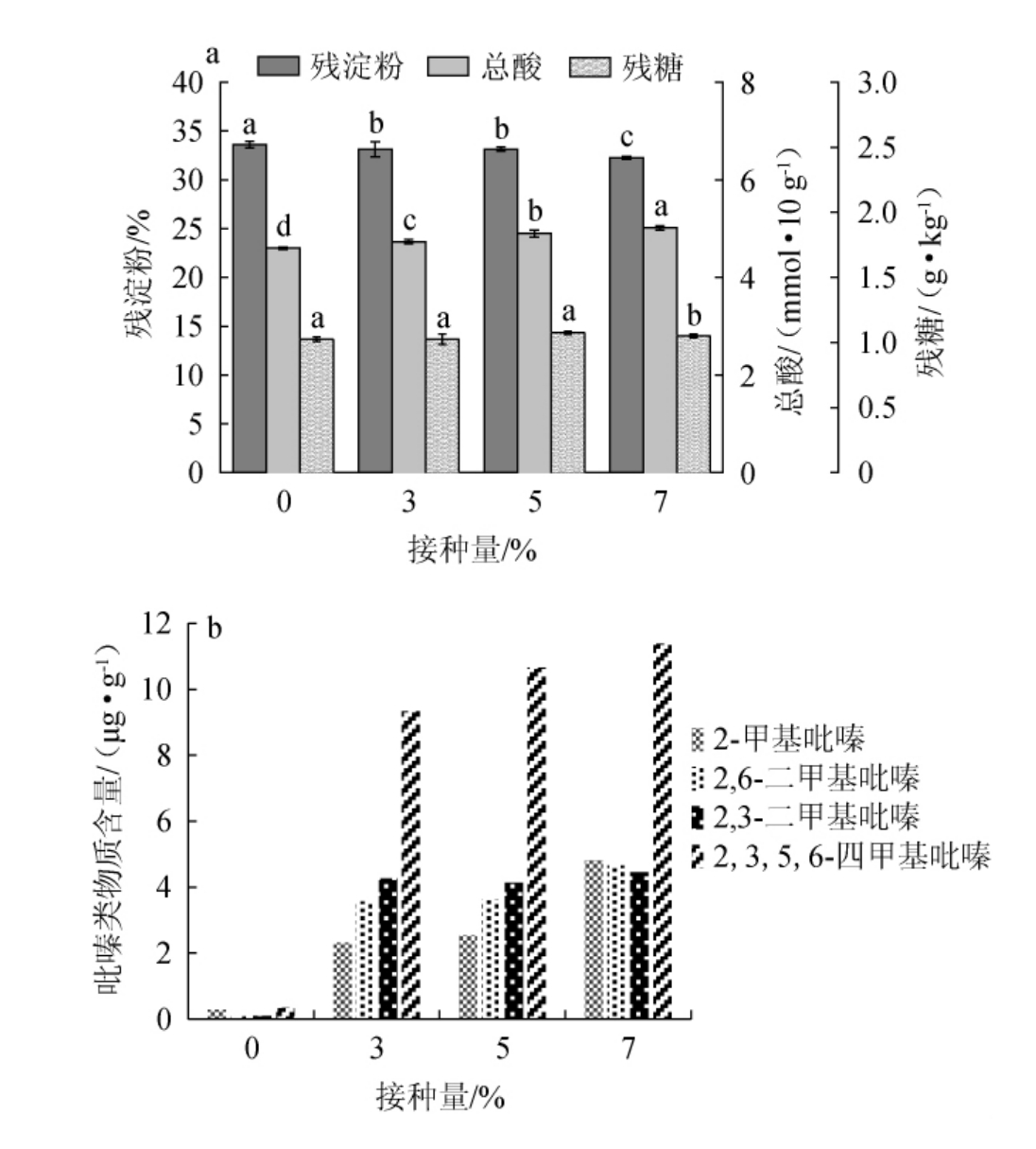
菌株D-13-11在酒醅堆积中理化指标及吡嗪类物质检测结果见图4。酸是形成白酒诸多风味物质的前体物[34],由图4a可知,与对照组相比,菌株接种量为0~7%时,总酸的含量有所上升(4.60~5.01 mmol/10 g),因此,菌株D-13-11对有机酸的生成有一定促进作用;残糖含量呈现下降趋势(1.025~1.05 g/kg),其原因可能是,还原糖作为整个发酵过程中的主要碳源,随着微生物的生长代谢,最终被完全消耗[39];残淀粉含量呈现下降趋势(33.6%~33.27%),淀粉是白酒发酵的基础,是酒醅中微生物生长代谢繁殖的重要营养物质[40]。淀粉含量逐渐下降的原因是,微生物利用淀粉作为主要前体物质之一,通过自身生长代谢活动,将其转化为各种次级代谢产物,如有机酸类、吡嗪类、酯类化合物等。
由图4b可知,随着菌株D-13-11接种量的增加,4种吡嗪类化合物(2-甲基吡嗪、2,6-二甲基吡嗪、2,3-二甲基吡嗪、2,3,5,6-四甲基吡嗪)含量明显增加;当添加量为7%时,其化合物含量分别为4.82 μg/g、4.65 μg/g、4.45 μg/g、11.38 μg/g,较对照组提高了46.35倍、66.43倍、49.44倍、71.13倍。结果表明,菌株D-13-11在酒醅堆积中不仅具有产吡嗪类物质的能力,且产四甲基吡嗪的能力较强。
3 结论
在酱香型高温大曲中通过分离筛选、利用HPLC结果得到一株高产四甲基吡嗪菌株,其发酵产四甲基吡嗪高达339.99 mg/L。通过形态特征、生理生化试验及分子生物学的鉴定,该菌株D-13-11鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。菌株D-13-11进行液态发酵培养,并利用GC-MS技术检测结果表明,发酵产物中共检出42种挥发性风味物质,其中,吡嗪类化合物的相对含量最高,达到40.137%,以四甲基吡嗪为主,其相对含量为24.843%。将该菌株D-13-11按7%接种量接种至堆积酒醅中,四甲基吡嗪的含量为11.38 μg/g,是对照组的71.13倍。本研究为酱香型大曲的生产提供了科学依据。
参考文献:
[1]马美荣,周林艳,王德斌,等.高产四甲基吡嗪芽孢杆菌的筛选及在清香型原酒生产中的应用研究[J].酿酒科技,2018,289(7):104-107.
[2]周榆林,吴钱弟,罗爱民.加热强化大曲对酱香型白酒酿造的影响研究[J].中国酿造,2020,39(2):67-72.
[3]CAO H, CHENG Y, ZHANG J, et al.The effect of umbilical cord mesenchymal stem cells combined with tetramethylpyrazine therapy on is chemic brain injury:A histological study[J].J Stroke Cerebrovasc Dis,2020,29(12):105298.
[4]LI J,LU J,MA Z L,et al.A green route for high-yield production of tetramethylpyrazine from non-food raw materials[J].Front Bioeng Biotechnol,2021,9:792023.
[5]FAN W L, XU Y, ZHANG Y H.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].J Agr Food Chem,2007,55(24):9956-9962.
[6]孙玉婷,郑晓卫,叶力,等.白酒中四甲基吡嗪形成机制及相关应用的研究进展[J].酿酒科技,2023(1):130-136.
[7]李晓霞.汾酒大曲中高产四甲基吡嗪菌株的筛选及其在酿酒中的应用研究[D].太原:山西师范大学,2016.
[8]李富强,曹振华,闫培勋,等.高产四甲基吡嗪细菌的筛选鉴定及应用研究[J].酿酒科技,2022(12):65-69.
[9]HAO F,WU Q,XU Y.Precursor supply strategy for tetramethylpyrazine production by Bacillus subtilis on solid-state fermentation of wheat bran[J].Appl Biochem Biotech,2013,169:1346-1352.
[10]王晓丹,雷安亮,王婧,等.产四甲基吡嗪地衣芽孢杆菌的应用[J].中国酿造,2017,36(2):35-38.
[11]张荣,徐岩,范文来,等.酱香大曲中地衣芽孢杆菌及其特征风味代谢产物的分析研究[J].工业微生物,2010,40(3):7-12.
[12]XIONG X M,HU Y L,YAN N F,et al.PCR-DGGE analysis of the microbial communities in three different Chinese"Baiyunbian"liquor fermentation starters[J].J Microbiol Biotechnol,2014,24(8):1088-1095.
[13]张小龙,邱树毅,王晓丹,等.酱香型大曲中挥发性成分与微生物代谢关系[J].中国酿造,2020,39(12):51-57.
[14]沈毅,陈波,张亚东,等.高产吡嗪类物质芽孢杆菌在高温大曲中的应用研究[J].酿酒科技,2019(10):101-105
[15]王庆,王超彦,徐海林,等.高温大曲中高产四甲基吡嗪芽孢杆菌的分离鉴定及发酵条件优化[J].中国酿造,2022,41(10):125-129.
[16]钟桂芳,张帆,郭辉祥,等.高温大曲中产四甲基吡嗪细菌的筛选及鉴定[J].中国酿造,2020,39(8):107-111.
[17]赵德义,汤丹丹,曹建全,等.产四甲基吡嗪微生物菌株的选育[J].中国酿造,2015,34(3):102-106.
[18]史洪丽,李腊,郭翠梅,等.番茄灰霉病生防菌株TL1的分离、鉴定及其生防能力分析[J].园艺学报,2023,50(1):79-90.
[19]余婷婷,赖世强,曹文涛,等.高温大曲中产酱香耐高温细菌的筛选及鉴定[J].贵州农业科学,2013,41(11):109-112.
[20]刘唤明,张芷欣,洪鹏志,等.耐高温蛋白酶产生菌的筛选及酶学特性的初步研究[J].食品工业科技,2017,38(3):133-136,142.
[21]陈梦圆,李志军,罗爱民.高温大曲中高产四甲基吡嗪菌株的筛选及鉴定[J].酿酒科技,2018(8):24-29.
[22]王晓丹,王婧,朱国军,等.酱香大曲中产四甲基吡嗪细菌的分离鉴定及其功能性研究[J].中国酿造,2017,36(1):55-60.
[23]黄丽,孟继坤,周嫄,等.高产右旋糖苷酶微生物的筛选及产酶条件的优化[J].轻工学报,2019,34(1):11-20.
[24]秦延平,黄丹丹,李纲,等.超高效液相色谱-串联质谱法快速检测自来水中18种抗生素[J].预防医学,2019,31(8):857-861.
[25]陈静,沈善瑞,赖晓芳,等.细菌芽孢染色方法的比较[J].科教文汇(中旬刊),2019,467(23):69-70,75.
[26]东秀珠,蔡妙英.常见细菌系统鉴定手册[J].北京:科学出版社,2001.
[27]赵泽伟,丁筑红,许培振,等.基于SPME-GC-MS和电子鼻分析方法分析薏仁饮料贮藏过程风味化合物变化[J].食品科学,2018,39(14):276-281.
[28]齐琦.黑糯米保健酒的工艺及品质研究[D].贵阳:贵州大学,2018.
[29]范恩帝,黄魏,谢丹,等.酱香大曲中高产四甲基吡嗪微生物的选育及应用研究[J].酿酒科技,2022(11):45-50,71.
[30]丁海龙,沈小娟,宋川,等.中国白酒健康功能成分吡嗪类化合物研究进展[J].中国酿造,2022,41(9):8-12.
[31]范文来,徐岩.酒类风味化学[M].北京:中国轻工业出版社,2019:224-236.
[32]刘奕霏,廉哲,梁鲁宁,等.GC-MS测定白酒中棕榈酸乙酯、油酸乙酯及亚油酸乙酯[J].刑事技术,2016,41(2):111-115.
[33]沈海月.酱香型白酒香气物质研究[D].无锡:江南大学,2010.
[34]蒙德俊,张娇娇,郭炳豪,等.酱香型白酒轮次基酒酸类风味物质与酒醅微生物的相关性分析[J].食品科技,2022,47(10):77-83.
[35]张萌,田真,魏建平,等.基于气相色谱-离子迁移谱法和固相微萃取-气相色谱-质谱法分析6种香型白酒挥发性风味物质[J].食品安全质量检测学报,2023,14(5):226-235.
[36]莫新良,杨亮,滕明德,等.一种典型酱香型白酒甜香风味酒挥发性香气成分分析[J].中国酿造,2022,41(8):235-240.
[37]耿平兰,黄卫红,程化鹏,等.白酒中酚类物质及检测方法的研究进展[J].酿酒科技,2020(8):83-88.
[38]孙啸涛,王宗元,刘淼,等.涡旋辅助液液微萃取结合GC-MS法检测67种白酒中四甲基吡嗪、4-甲基愈创木酚和4-乙基愈创木酚[J].食品科学,2017,38(18):73-79.
[39]石馨,惠明,田青,等.强化异常威客汉姆酵母对白酒酿造中微生物结构及酯类合成的影响[J].中国食品学报,2024,24(6):278-287.
[40]张霞,王中凯,郑佳,等.浓香型白酒发酵过程中酒醅理化指标变化规律研究[J].酿酒科技,2021(10):53-56.