葡萄酒中12种农药残留分析及膳食风险评估
汤丽华,朱燕燕*,郭 阳,吕 毅
(宁夏回族自治区食品检测研究院(国家市场监管重点实验室(枸杞及葡萄酒质量安全)),宁夏 银川750001)
摘 要:利用高效液相色谱-串联质谱法(HPLC-MS/MS)对葡萄酒中335种农药进行初筛,筛选出检出率较高的霜霉威等12种农药,采用QuEChERS-HPLC-MS/MS对其建立测定方法,并对其膳食风险进行评估。结果表明,采用乙腈提取,QuEChERS法净化,在电喷雾正离子(ESI+)模式下电离,使用多反应监测(MRM)模式对各农药进行测定,并用基质匹配标准溶液外标法进行定量分析。12种农药在1~200 ng/mL质量浓度范围内线性关系良好,相关系数R均>0.997,方法检出限(LOD)、定量限(LOQ)分别为0.000 5 mg/kg、0.001 mg/kg,平均加标回收率为82%~110%,精密度试验结果的相对标准偏差(RSD)为2.5%~9.2%。膳食风险评估结果表明,我国不同人群11种农药的慢性风险熵(RQc)范围为1.2×10-6~1.1×10-3,5种农药的急性风险熵(RQa)范围为9.2×10-6~2.5×10-3,表明葡萄酒中霜霉威、啶虫脒、多菌灵、甲基硫菌灵和烯酰吗啉等农药残留不会对消费者造成不可接受的风险。
关键词:高效液相色谱-串联质谱法;QuEChERS;葡萄酒;农药残留;膳食风险评估
中图分类号:TS262.6
文章编号:0254-5071(2025)03-0272-07
doi: 10.11882/j.issn.0254-5071.2025.03.041
引文格式:汤丽华,朱燕燕,郭阳,等.葡萄酒中12种农药残留分析及膳食风险评估[J].中国酿造,2025,44(3):272-278.
收稿日期:2024-06-05 修回日期:2024-08-30
基金项目:国家市场监管总局科技计划项目(2022MK129);宁夏回族自治区重点研发项目(2022BEG03170)
作者简介:汤丽华(1986-),女,高级工程师,硕士,研究方向为食品分析。
*通讯作者:朱燕燕(1988-),女,工程师,硕士,研究方向为食品检测与分析。
Analysis and dietary risk assessment of 12 pesticide residues in wine
TANG Lihua,ZHU Yanyan*,GUO Yang,LV Yi
(Key Laboratory of Quality and Safety of Wolfberry and Wine for State Administration for Market Regulation,Ningxia Food Testing and Research Institute,Yinchuan 750001,China)
Abstract:335 pesticides in wine were preliminarily screened by high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS),12 pesticides with high detection rate,such as propamocarb were selected and determined by QuEChERS-HPLC-MS/MS, and their dietary risk was evaluated.The results showed that each pesticide was extracted by acetonitrile, purified by QuEChERS method, ionized by electrospray ionization positive ions(ESI+)mode,determined by multiple reaction monitoring(MRM)mode,and quantitatively analyzed by matrix matching standard solution external standard method.The linear relationships of 12 pesticides were good in the mass concentration range of 1-200 ng/ml,and the correlation coefficients R were all greater than 0.997.The limits of detection(LOD)and limits of quantitation(LOQ)were 0.000 5 mg/kg and 0.001 mg/kg,respectively.The average standard recovery rates were 82%-110%.The relative standard deviation(RSD)of the precision tests was 2.5%-9.2%.The results of dietary risk assessment showed that the chronic risk entropy(RQc)of 11 pesticides were 1.2×10-6-1.1×10-3,and the acute risk entropy(RQa)of 5 pesticides were 9.2×10-6-2.5×10-3,indicating that the pesticide residues such as propamocarb,acetamiprid,carbendazim,thiophanate methyl and dimethomorph in wine did not pose an unacceptable risk to consumers.
Key words:HPLC-MS/MS;QuEChERS;wine;pesticide residues;dietary risk assessment
葡萄酒酿造历史悠久、口感醇厚丰富、香气浓郁,富含氨基酸、有机酸、酚类、单宁等多种营养成分,因其具有抗衰老、助消化、促进心血管健康和改善睡眠质量等功效而备受消费者青睐[1]。为减少酿酒葡萄在生长发育过程中易受到病虫草害及真菌的侵扰,会施用农药。因此,部分农药残留于葡萄表皮,并随着发酵过程转移到葡萄酒中,对人体健康造成一定威胁[2-4]。残留的农药还会通过与葡萄酒中的酚类物质作用,对其香气、色泽等造成一定影响,进而影响葡萄酒的品质[5]。
目前,农药残留前处理方法有固相萃取法、液液萃取法及Qu EchERS(quick,easy,cheap,effective,rugged,safe)法,其中,QuEChERS法精密度、回收率和准确度更好,操作更简单,有机溶剂用量更少,分析速度更快[6],检测方法有气相色谱法(gas chromatography,GC)[7-8]、气相色谱-串联质谱法(gas chromatography-tandem mass spectrometry,GC-MS/MS)[9-12]、高效液相色谱法(high performance liquid chromatography,HPLC)[13-14]、高效液相色谱-串联质谱法(high performance liquid chromatography-tandem mass spec trometry,HPLC-MS/MS)[15-17]和酶联免疫分析法(enzymelinked immunosorbent assay,ELISA)[18]等。GC、GC-MS/MS和HPLC法普遍存在检测耗时较长的缺点,且葡萄酒成分复杂,将待测物与干扰物进行有效分离仍比较困难,用GC和HPLC测定时易造成假阳性。ELISA属于特异性分析,仅适用于同类农药的测定,过程繁琐,成本高。而HPLC-MS/MS法因具有选择性好、分析速度快、灵敏度高的优点,在复杂样品基质痕量组分的确证研究方面具有显著优势,其与QuEChERS法相结合可以高效、便捷、快速地同时测定样品中的多组分,适用于批量样品的分析处理[19]。已有对葡萄酒中农药残留定性定量分析的相关研究[20-21],但涉及膳食风险评估的还比较少,且当前国家标准、欧盟及国际食品法典委员会(codex alimentarius commission,CAC)[22]均没有对葡萄酒中农残限量作出要求,因此亟需开展葡萄酒中农药残留分析及风险评估。
该研究以葡萄酒为研究对象,利用高效液相色谱-串联质谱法(HPLC-MS/MS)对葡萄酒中335种农药进行初筛,对检出率较高的啶虫脒等12种农药进行分析研究,建立了基于QuEChERS-HPLC-MS/MS技术的12种农药残留的测定方法,并基于测定结果对慢性和急性膳食风险进行评估。以期为啶虫脒等农药在葡萄酒中最大残留限量的制定提供基础数据,对于保障葡萄酒质量安全具有重要意义。
1 材料与方法
1.1 材料与试剂
红葡萄酒和白葡萄酒(共计390批次,其中赤霞珠218批次,霞多丽63批次,黑皮诺36批次,西拉25批次,白葡萄酒48批次):宁夏市售;乙腈、甲醇、甲酸(均为色谱纯):赛默飞世尔科技有限公司;无水硫酸镁、氯化钠、无水柠檬酸钠、柠檬酸二钠盐倍半水合物(均为色谱纯):国药集团化学试剂有限公司;ZORBAX Eclipse Plus C18色谱柱(2.1 mm×100 mm,3.5 μm)、N-丙基乙二胺(N-propyl ethylenediamine,PSA)固相吸附剂、无水硫酸镁(MgSO4)和石墨化碳黑(graphitized carbon black,GCB)吸附剂:美国安捷伦公司;霜霉威(propamocarb)、啶虫脒(acetamiprid)、多菌灵(carbendazim)、恶霜灵(oxadixyl)、甲基硫菌灵(thiophanatemethyl)、乙嘧酚(ethirimol)、甲霜灵(metalaxyl)、氟吗啉(flumorph)、嘧霉胺(pyrimethanil)、乙霉威(diethofencarb)、烯酰吗啉(dimethomorph)、异菌脲(iprodione)农药标准溶液(1 000 mg/L)(纯度均>98.2%):德国Dr.Ehrenstorfer公司;0.22 μm有机滤膜:上海安谱实验科技股份有限公司。
1.2 仪器与设备
Agilent HPLC-MS/MS高效液相色谱-串联质谱联用仪:美国安捷伦公司;Vortex Genie 2型涡旋混匀仪:美国Scientificln-dustries公司;BT25S型分析天平:北京赛多利斯科学仪器有限公司;Milli-Q超纯水处理系统:美国Millipore公司。
1.3 方法
1.3.1 标准溶液配制
标准储备液:分别准确吸取1 000.0 mg/L的12种农残标准溶液各100 μL,用乙腈溶解并定容至10.0 mL,配制成10.0 mg/L混标储备液,于-18 ℃避光保存,有效期6个月。
标准工作溶液:准确吸取不同体积的混合标准储备液,配制成质量浓度分别为1.0 ng/mL、2.0 ng/mL、5.0 ng/mL、10.0 ng/mL、20.0 ng/mL、50.0 ng/mL、100.0 ng/mL、200.0 ng/mL的系列标准工作液,临用现配。
1.3.2 样品前处理
将葡萄酒摇匀,准确称取10.0 g酒样于50.0 mL具塞离心管中,加入10 mL乙腈、1颗陶瓷均质子、4 g MgSO4、1 g氯化钠和0.5 g柠檬酸二钠盐倍半水合物,高速涡旋2 min,8 000 r/min离心3 min。移取上清液至装有900 mg无水MgSO4、150 mg PSA和15 mg GCB的高速离心管中,涡旋混合2 min,8 000 r/min离心3 min,吸取上清液过0.22 μm有机滤膜,将滤液进行HPLC-MS/MS分析。
1.3.3 色谱条件
Agilent ZORBAX Eclipse plus C18色谱柱(2.1 mm×100 mm,3.5 μm);柱温40 ℃;流速0.3 mL/min;进样体积2 μL;流动相A为2 mmol/L甲酸铵-水溶液(添加0.01%甲酸);流动相B为2 mmol/L甲酸铵-甲醇溶液(添加0.01%甲酸);梯度洗脱程序为0~1.0 min(97%A),1.0~1.5 min(97~85%A),1.5~2.5min(85~50%A),2.5~15.0min(50~30%A),15.0~15.1 min(30~97%A),15.1~18.0 min(97%A)。
1.3.4 质谱条件
电喷雾离子(electro-spray ionization,ESI)源;扫描模式:正离子模式扫描(ESI+);鞘气温度:350 ℃;鞘气流速:12.0 L/min;雾化器压力:45 psi;喷嘴电压:500 V(ESI+);毛细管电压:4.0 kV(ESI+);采用多反应监测(multiple reaction monitoring,MRM)模式。
选取[M+H]+为母离子,响应强度最高的为定量子离子,响应强度次之的为定性子离子,并以MRM模式优化碰撞能,保留时间辅助定性。12种农药化合物的质谱参数见表1。
表1 12种农药化合物的质谱参数
Table 1 Mass spectrum parameters of 12 pesticide compounds
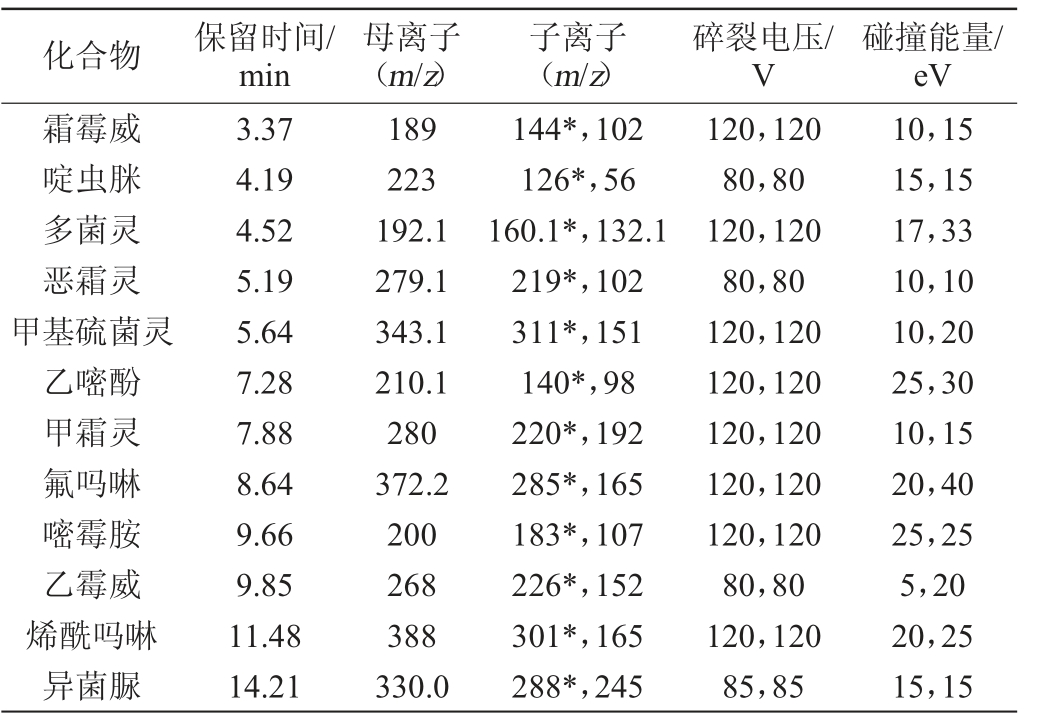
注:“*”为定量离子。
化合物 保留时间/min母离子(m/z)子离子(m/z)碎裂电压/V碰撞能量/eV霜霉威啶虫脒多菌灵恶霜灵甲基硫菌灵乙嘧酚甲霜灵氟吗啉嘧霉胺乙霉威烯酰吗啉异菌脲3.37 4.19 4.52 5.19 5.64 7.28 7.88 8.64 9.66 9.85 11.48 14.21 189 223 192.1 279.1 343.1 210.1 280 372.2 200 268 388 330.0 144*,102 126*,56 160.1*,132.1 219*,102 311*,151 140*,98 220*,192 285*,165 183*,107 226*,152 301*,165 288*,245 120,120 80,80 120,120 80,80 120,120 120,120 120,120 120,120 120,120 80,80 120,120 85,85 10,15 15,15 17,33 10,10 10,20 25,30 10,15 20,40 25,25 5,20 20,25 15,15
1.3.5 条件优化
在上述提取条件、色谱条件的基础上,分别考察提取溶剂:环己烷-乙酸乙酯(V/V=1∶1)、乙腈、甲醇;净化剂:A(900 mg无水MgSO4+150 mg PSA+15 mg C18)、B(900 mg无水MgSO4+150 mg PSA+15 mg GCB)、C(900 mg无水MgSO4+200 mg PSA)、D(900 mg无水MgSO4+50 mg C18);流动相体系:流动相A为0.01%甲酸-甲醇,流动相B为0.01%甲酸-水、流动相A为0.01%甲酸-乙腈,流动相B为0.01%甲酸-水、流动相A为0.1%甲酸-甲醇,流动相B为0.1%甲酸-水、流动相A为2 mmol/L甲酸铵-甲醇溶液(添加0.01%甲酸),流动相B为2 mmol/L甲酸铵水溶液(添加0.01%甲酸)对平均回收率的影响。
1.3.6 基质效应评价
采用HPLC-MS/MS法测定时,样品中的外源性或内源性物质会对目标物的离子化效率造成一定影响,使其响应降低或升高,即存在基质效应(matrix effect,ME)[23]。基质效应计算公式如下[24]:
当ME为正值时,表明存在基质增强效应,实际测量值偏高;当ME为负值时,为基质抑制效应,实际测量值偏低;|ME|<20%时为弱基质效应,可以忽略;20%<|ME|<50%时为中等基质效应;|ME|>50%时为强基质效应。当|ME|≥20%时,需使用基质匹配标准曲线校正[25]。
1.3.7 方法学考察
(1)线性范围、检出限和定量限
依照GB/T 27417—2017《合格评定化学分析方法确认和验证指南》[26],配制不同浓度标准品溶液,以12种农药定量离子峰面积(y)为纵坐标,以各农药的质量浓度(x)为横坐标,绘制标准曲线,得到标准曲线回归方程。分别以3倍信噪比(S/N)和10倍信噪比(signal to noise ratio,S/N)确定12种农药化合物的检出限(detection limit,LOD)和定量限(limit of quantitation,LOQ)[27]。
(2)加标回收率及精密度试验
该试验选择阴性基质样品,分别添加10.0 μg/kg、20.0 μg/kg、100.0 μg/kg 3个质量浓度水平的12种农药化合物,各水平重复测定6次,考察方法的准确度和精密度,计算平均回收率及精密度试验结果相对标准偏差(relative standard deviation,RSD)。
1.3.8 膳食暴露风险评估模型构建
(1)葡萄酒中12种农药残留毒理评估
葡萄酒中12种农药的慢性参考剂量(reference dose,RfD)和急性参考剂量(acute reference dose,ARfD)值综合参照了联合国粮农组织(food and agriculture organization,FAO)/世界卫生组织(world health organization,WHO)[28]和农药残留联席会议(Joint meeting on pesticide residues,JMPR)[29]的评估报告以及国家标准GB 2763—2021《食品中农药最大残留限量》[30]、GB 2763.1—2022《2,4-滴丁酸钠盐等112种农药最大残留限量》[31]中的安全参考剂量。
(2)慢性膳食暴露风险评估
采用估算每日摄入量(national estimated daily intake,NEDI)和慢性参考剂量(RfD)评估长期膳食摄入风险,结果以慢性风险熵(chronic risk quotient,RQc)表示[32-33]。RQc<1表明不会产生不可接受的摄入风险;RQc>1,表明会存在不可接受的风险,值越大,风险越高。NEDI和RQc计算公式如下:
式中:C为葡萄酒中农药残留量,mg/kg;Fi为葡萄酒摄入量,kg/d;EF为暴露频率,天/年;ED为暴露时间,年;bw为所评估人群的的平均体质量,kg;ED为中国人均寿命72年;AT为平均剂量的时间段,ED×365天。RfD为慢性参考剂量,mg/kg。
(3)急性膳食暴露风险评估
采用农药残留联席会议(Joint meeting on pesticide residues,JMPR)推荐的方法[29],计算国际短期膳食摄入量(international estimated short-term intake,IESTI)和急性风险熵(risk quotient,RQa),评估急性膳食暴露风险[20]。IESTI和RQa计算公式如下:
式中:LP为大份餐消费量(男性和女性分别为0.4和0.3),kg/d;HR为食物的P97.5残留值,mg/kg;;bw为消费人群平均体质量,kg;ARfD为急性参考剂量,mg/kg。
2 结果与分析
2.1 条件优化
2.1.1 提取溶剂的确定
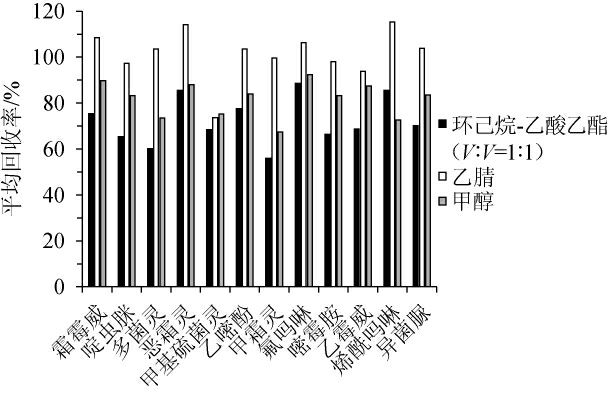
提取溶剂对12种农药平均回收率的影响见图1。由图1可知,以环己烷-乙酸乙酯和甲醇作为提取溶剂时,各农药的平均回收率范围分别为56%~86%和67%~93%,溶解出的杂质较多,提取液比较浑浊,不利于后续净化;乙腈作为提取溶剂时,各农药的平均回收率范围为74%~114%,因其具有极性适中,分层和萃取能力较优的特点,便于后续的分离和净化。因此,本研究采用乙腈作为提取溶剂。
2.1.2 净化剂的优化
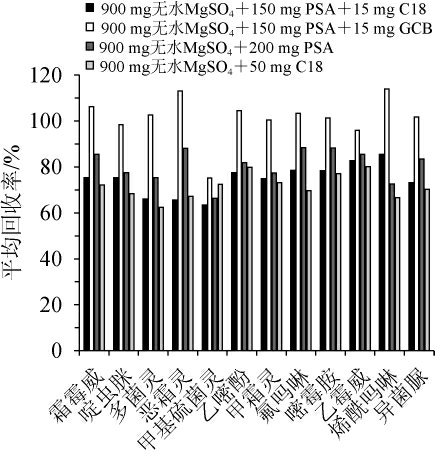
QuEChERS净化常用的吸附剂填料主要有PSA、MgSO4、GCB和C18,PSA和C18对基质中的糖类、脂肪和有机酸具有良好的净化效果[34],但PSA因含有2个胺基而呈碱性,对酸性农药的回收率会有影响,C18则会吸附一些农药如戊唑醇、噻嗪酮等含苯环的农药,使其回收率降低[35];GCB结构特殊,对色素及某些具有平面对称结构的物质具有良好的吸附作用[36],但会影响噻菌灵等农药的回收率[35]。由于葡萄酒含有丰富的色素、糖类、酯类及有机酸等,基质复杂,干扰较多,为平衡得到较佳的净化效果,本试验将吸附填料配合使用。净化剂对12种农药平均回收率的影响见图2。由图2可知,采用A(900 mg无水MgSO4+150 mg PSA+15 mg C18)和C(900 mg无水MgSO4+200 mg PSA)为净化剂时,各农药平均回收率范围为63%~86%和66%~85%,回收率相对较低,由于未添加GCB填料,导致对色素等杂质的去除效果较差;采用D(900 mg无水MgSO4+50 mg C18)为净化剂时,平均回收率范围为63%~80%,平均回收率较低可能与分析的12种农药均具有苯环结构,而该组合中的C18吸附剂对苯环类农药的吸附作用较强有关。以B(900 mg无水MgSO4+150 mg PSA+15 mg GCB)为净化吸附剂时,平均回收率为73%~109%,且啶虫脒、多菌灵、乙嘧酚、甲霜灵、氟吗啉、嘧霉胺、乙霉威和异菌脲的平均回收率为90%~100%,较其他3种净化方案更优,可满足净化要求。最终,在综合考虑净化效果和各农残的回收率的情况下,选择B(900 mg无水MgSO4+150 mgPSA+15 mg GCB)作为净化剂。
2.1.3 流动相的确定
分别考察了HPLC-MS/MS分析中常用的乙腈-水和甲醇-水流动相体系。结果表明,采用甲醇-水体系时,各农药的峰形、分离度和目标物的响应均较优。因此,将流动相A 0.01%甲酸-乙腈,B 0.01%甲酸-水排除。鉴于12种农药均在电喷雾正离子模式下扫描,在流动相中添加适量的甲酸可以提高目标物的离子化效率以增强响应[37],而添加少量的甲酸铵可有效改善目标物的峰形[38]。采用流动相A 2 mmol/L甲酸铵-甲醇溶液(添加0.01%甲酸),B 2 mmol/L甲酸铵水溶液(添加0.01%甲酸)时,其对12种农药平均回收率的影响见图3。由图3可知,各农药灵敏度较高、峰形流畅,各组分的分离效果良好且出峰时间适宜12种农药的保留时间为3.37~14.21 min。因此选择将其作为流动相。
2.2 基质效应
葡萄酒中12种农药的基质效应在11.3%~49.7%之间。其中多菌灵和异菌脲的|ME|<20%,为弱基质效应;霜霉威、啶虫脒、甲基硫菌灵、乙嘧酚、甲霜灵、氟吗啉、嘧霉胺、乙霉威和烯酰吗啉的20%<|ME|<50%,存在中等基质抑制效应。试验采用基质匹配标准曲线外标法进行定量,以消除基质效应的影响。
2.3 方法学验证
2.3.1 线性范围、检出限和定量限
12种农药的线性回归方程、线性范围、相关系数、检出限和定量限见表2。由表2可知,各农药在1.0~200.0 ng/mL质量浓度范围内呈现良好线性关系,相关系数R为0.997 9~0.999 9,检出限和定量限分别为0.000 5 mg/kg和0.001 mg/kg,方法的灵敏度较高。
表2 12种农药的线性回归方程、线性范围、相关系数、检出限和定量限
Table 2 Linear regression equations, linear range, correlation coefficients, limits of detection and limits of quantitation of 12 pesticides
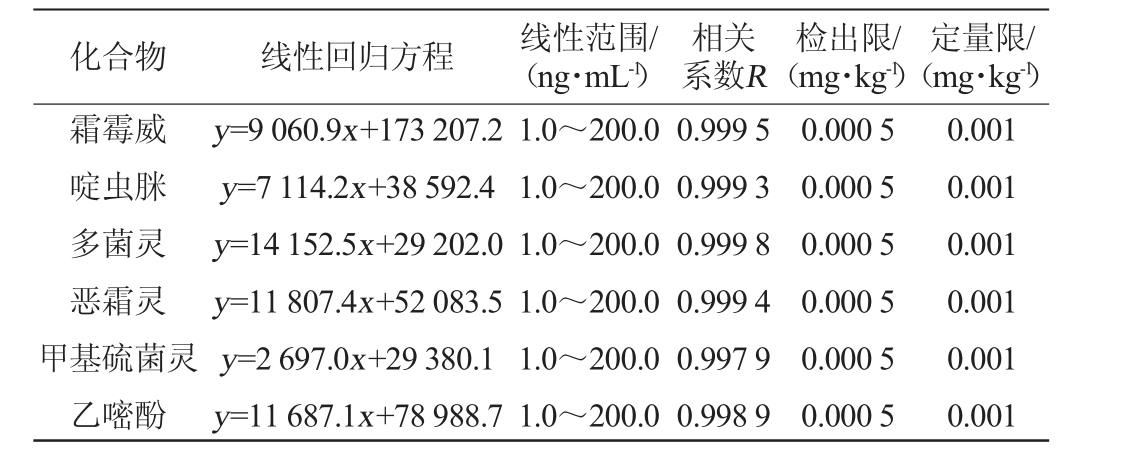
化合物 线性回归方程 线性范围/(ng·mL-1)相关系数R检出限/(mg·kg-1)定量限/(mg·kg-1)霜霉威啶虫脒多菌灵恶霜灵甲基硫菌灵乙嘧酚y=9 060.9x+173 207.2 y=7 114.2x+38 592.4 y=14 152.5x+29 202.0 y=11 807.4x+52 083.5 y=2 697.0x+29 380.1 y=11 687.1x+78 988.7 1.0~200.0 1.0~200.0 1.0~200.0 1.0~200.0 1.0~200.0 1.0~200.0 0.999 5 0.999 3 0.999 8 0.999 4 0.997 9 0.998 9 0.000 5 0.000 5 0.000 5 0.000 5 0.000 5 0.000 5 0.001 0.001 0.001 0.001 0.001 0.001
续表
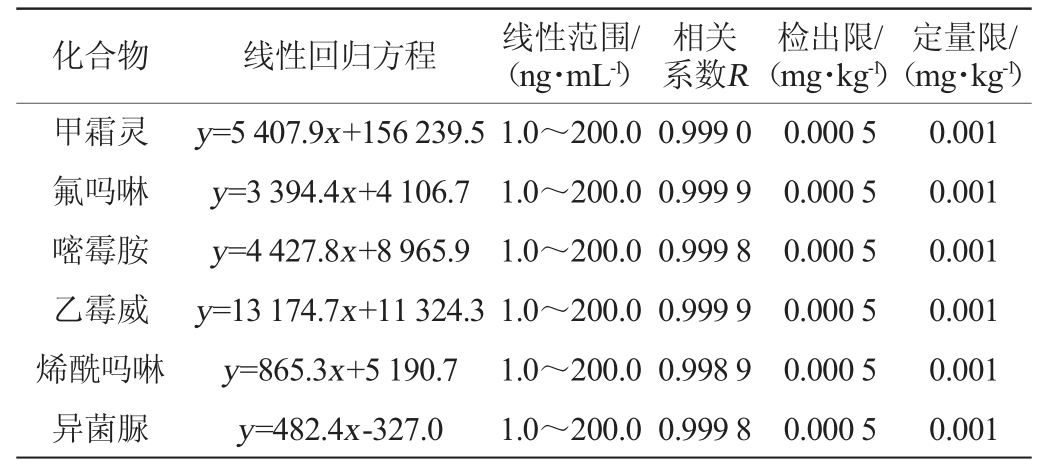
化合物 线性回归方程 线性范围/(ng·mL-1)相关系数R检出限/(mg·kg-1)定量限/(mg·kg-1)甲霜灵氟吗啉嘧霉胺乙霉威烯酰吗啉异菌脲y=5 407.9x+156 239.5 y=3 394.4x+4 106.7 y=4 427.8x+8 965.9 y=13 174.7x+11 324.3 y=865.3x+5 190.7 y=482.4x-327.0 1.0~200.0 1.0~200.0 1.0~200.0 1.0~200.0 1.0~200.0 1.0~200.0 0.999 0 0.999 9 0.999 8 0.999 9 0.998 9 0.999 8 0.000 5 0.000 5 0.000 5 0.000 5 0.000 5 0.000 5 0.001 0.001 0.001 0.001 0.001 0.001
2.3.2 加标回收率及精密度试验结果
12种农药在不同加标水平下的平均回收率及精密度试验结果见表3。由表3可知,各农药的平均回收率范围为82%~110%,精密度试验结果相对标准偏差(RSD)为2.5%~9.2%,满足GB/T 27404—2008《实验室质量控制规范食品理化检测》的要求[39],表明该方法的精密度和准确度良好。
表3 12种农药在不同加标水平下的平均回收率及精密度试验结果
Table 3 Average recovery rates and precision tests results of 12 pesticides at different spiking levels

化合物 添加量/(μg·kg-1)测得值/(μg·kg-1)平均回收率/%RSD/%霜霉威啶虫脒多菌灵恶霜灵甲基硫菌灵乙嘧酚甲霜灵氟吗啉嘧霉胺乙霉威烯酰吗啉异菌脲10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 10,20,50 9.1,19.2,44.0 8.5,17.8,42.0 9.3,19.4,47.5 8.5,20.6,43.5 8.2,16.8,42.5 101,17.2,46.0 87,18.8,48.0 8.6,18.0,46.5 94,17.8,47.5 91,16.8,44.0 106,22.0,51.5 102,19.0,44.5 91,96,88 85,89,84 93,97,95 85,103,87 82,84,85 101,86,92 87,94,96 86,90,93 94,89,95 91,84,88 106,110,103 102,95,89 6.5,4.8,5.2 8.4,4.5,7.5 5.8,3.9,4.0 6.9,6.2,5.8 6.1,5.7,6.4 9.2,6.2,6.0 4.8,4.3,3.6 3.5,3.8,5.6 5.2,3.2,2.5 5.7,5.5,6.7 7.0,6.3,5.9 6.3,4.6,5.3
2.4 葡萄酒样品测定
利用建立的方法对宁夏产区390批次葡萄酒进行测定,检测结果见表4。
表4 葡萄酒样品中12种农药残留检测
Table 4 Detection of 12 pesticide residues in wine samples
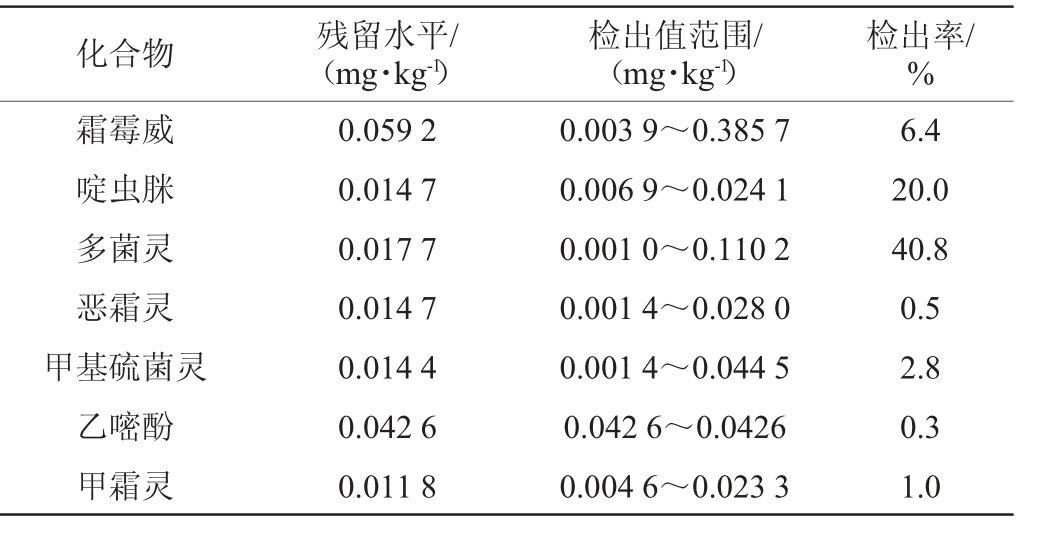
化合物 残留水平/(mg·kg-1)检出值范围/(mg·kg-1)检出率/%霜霉威啶虫脒多菌灵恶霜灵甲基硫菌灵乙嘧酚甲霜灵0.059 2 0.014 7 0.017 7 0.014 7 0.014 4 0.042 6 0.011 8 0.003 9~0.385 7 0.006 9~0.024 1 0.001 0~0.110 2 0.001 4~0.028 0 0.001 4~0.044 5 0.042 6~0.0426 0.004 6~0.023 3 6.4 20.0 40.8 0.5 2.8 0.3 1.0
续表
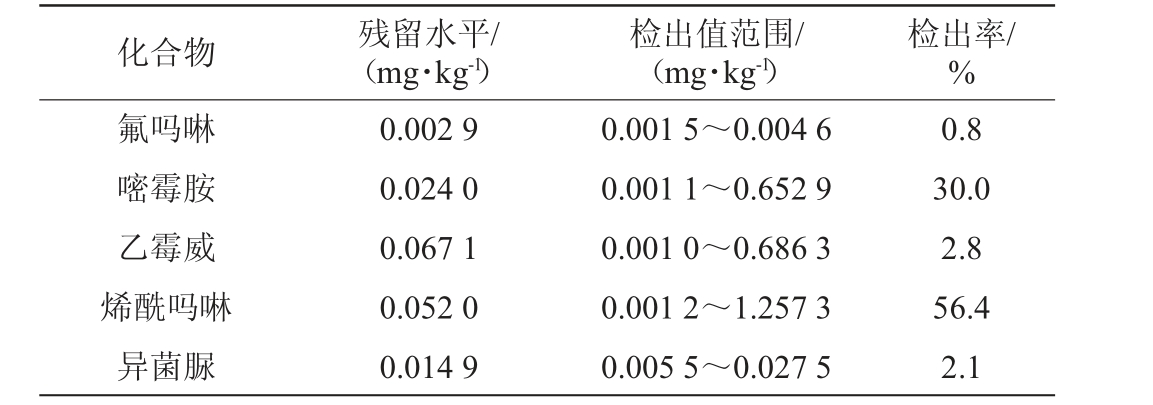
化合物 残留水平/(mg·kg-1)检出值范围/(mg·kg-1)检出率/%氟吗啉嘧霉胺乙霉威烯酰吗啉异菌脲0.002 9 0.024 0 0.067 1 0.052 0 0.014 9 0.001 5~0.004 6 0.001 1~0.652 9 0.001 0~0.686 3 0.001 2~1.257 3 0.005 5~0.027 5 0.8 30.0 2.8 56.4 2.1
由表4可知,啶虫脒、多菌灵、嘧霉胺、烯酰吗啉检出率较高,分别为20.0%、40.8%、30.0%和56.4%。其中只检出1种农药的样本占22.6%,同时检出2种、3种、4种和4种以上农药的样本占比分别为19.7%、16.7%、11.3%和4.9%,残留量均较低。鉴于当前各国家和组织尚未明确规定葡萄酒中农药的最高残留限量(maximum residue limit,MRL),建议根据农药的ADI值,原料的MRL值,制定葡萄酒的MRL的限定标准。
2.5 农药残留慢性和急性膳食风险评估
未查到恶霜灵的RfD数据,只对11种农药进行慢性膳食风险评估。葡萄酒中农药残留的慢性膳食风险和急性风险评估结果见表5。由表5可知,男性的11种农药的RQc范围为1.3×10-6~1.1×10-3,女性为1.2×10-6~1.0×10-3,不同人群通过葡萄酒摄入11种农药残留的慢性风险商(RQc)均远低于1,且女性比男性略低,表明葡萄酒中11种农药残留的慢性摄入风险较小。
表5 葡萄酒样品中农药残留的慢性膳食风险和急性风险评估结果
Table 5 Chronic dietary risk and acute risk assessment results of pesticide residues in wine samples

化合物霜霉威啶虫脒多菌灵恶霜灵甲基硫菌灵乙嘧酚甲霜灵氟吗啉嘧霉胺乙霉威烯酰吗啉异菌脲慢性风险商(RQc)男性女性急性风险商(RQa)男性 女性1.0×10-5 1.5×10-5 4.1×10-5/1.1×10-5 8.6×10-5 1.0×10-5 1.3×10-6 8.5×10-6 1.1×10-3 1.8×10-5 1.7×10-5 9.9×10-6 1.4×10-5 3.9×10-5/1.0×10-5 8.1×10-5 9.9×10-6 1.2×10-6 8.0×10-6 1.0×10-3 1.7×10-5 1.6×10-5 1.0×10-4 1.2×10-3 2.5×10-3/1.0×10-5 9.0×10-5 1.0×10-3 2.2×10-3/9.2×10-6// / / /// / / /1.7×10-3/1.5×10-3/
未查到恶霜灵、乙嘧酚、甲霜灵、氟吗啉、嘧霉胺、乙霉威和异菌脲7种农药的ARfD数据,只对5种农药进行急性膳食风险评估。结果表明,男性RQa范围为1.0×10-5~2.5×10-3,女性为9.2×10-6~2.2×10-3,同人群通过葡萄酒摄入5种农药残留的急性风险商(RQa)均远低于1,且与慢性膳食风险一样,女性略低,表明葡萄酒中5种农药残留的急性摄入风险较小。
3 结论
本研究对葡萄酒中检出率较高的霜霉威等12种农药建立了QuEChERS-HPLC-MS/MS检测法,并进行膳食风险评估。结果表明,采用乙腈提取,QuEChERS法净化,在电喷雾正离子(ESI+)模式下电离,使用多反应监测(MRM)对各农药进行测定,并用基质匹配标准溶液外标法进行定量分析。12种农药在1~200 ng/mL质量浓度范围内线性关系良好,相关系数R均>0.997,方法检出限(LOD)、定量限(LOQ)分别为0.000 5 mg/kg、0.001 mg/kg,平均加标回收率为82%~110%,精密度试验结果的相对标准偏差(RSD)为2.5%~9.2%。我国不同人群11种农药的慢性风险熵和5种农药的急性风险熵分别为1.2×10-6~1.1×10-3、9.2×10-6~2.5×10-3,表明霜霉威、啶虫脒、多菌灵、甲基硫菌灵和烯酰吗啉等农药在葡萄酒中的残留不会对人体造成不可接受的风险。本研究为葡萄酒中多农药残留检测提供了高效可靠的方法,并为葡萄酒质量控制及市场监管提供了技术和数据支撑。
参考文献:
[1]马燕玲,王一名,初坤,等.超高效液相色谱串联质谱法测定葡萄酒中酚酸和酚醛类化合物[J].化学试剂,2023,45(2):141-147.
[2]VIÑAS P, AGUINAGA N, CAMPILLO N, et al.Comparison of stir bar sorptive extraction and membrane-assisted solvent extraction for the ultraperformance liquid chromatographic determination of ox-azole fungicide residues in wines and juices[J].J Chromatogr A,2008,1194(2):178-183.
[3]QIN G F,CHEN Y,HE F R,et al.Risk assessment of fungicide pesticide residues in vegetables and fruits in the mid-western region of China[J].J Food Compos Anal,2021,95:103663.
[4]CˇEPO D V,PELAJIC′ M,VRCˇEK I V,et al.Differences in the levels of pesticides, metals, sulphites and ochratoxin A between organically and conventionally produced wines[J].Food Chem,2018,246:394-403.
[5]HAN F L,YANG P,WANG H,et al.Digestion and absorption of red grape and wine anthocyanins through the gastrointestinal tract[J].Trends Food Sci Tech,2019,83:211-224.
[6]刘晓斌.QuEChERS与SPE前处理方法结合GC-MS/MS同时测定8种果蔬中21种农药残留的对比研究[J].粮食与油脂,2024,37(7):128-132.
[7]AKHTAR S,BURAGOHAIN R,SAR T K,et al.Monitoring of pesticide and antibacterial drug residues in animal products from two states in India by modified multi-residue analytical methods using GC-ECD and HPLCDAD[J].J Consum Prot Food Saf,2021,16:171-181.
[8]OMEJE K O,EZEMA B O,OKONKWO F,et al.Quantification of heavy metals and pesticide residues in widely consumed nigerian food crops using atomic absorption spectroscopy(AAS)and gas chromatography(GC)[J].Toxins,2021,13(12):870.
[9]中华人民共和国国家卫生和计划生育委员会,中华人民共和国农业部,国家食品药品监督管理总局.GB 23200.7—2016 蜂蜜、果汁和果酒中497种农药及相关化学品残留量的测定气相色谱-质谱法[S].北京:中国标准出版社,2016.
[10]BRUGNEROTTO P,COSTA A C O,FUENTE-BALLESEROS A,et al.Determination of seven pesticide residues in Mimosa scabrella honeydew honey from Brazil by GC-MS[J].J Food Compos Anal,2023,122:105433.
[11]KHEZRI A,ANSARI M,AMIRAHMADI M,et al.Pesticide residues in dates using a modified QuEChERS method and GC-MS/MS[J].Food Addit Contam Part B,2022,15(3):168-176.
[12]JI C, XIAO L, WANG X Y, et al.Simultaneous determination of 147 pesticide residues in traditional Chinese medicines by GC-MS/MS[J].ACS Omega,2023,8(31):28663-28673.
[13]HUSSAIN M, AFTAB K, IQBAL M, et al.Determination of pesticide residue in brinjal sample using HPTLC and developing a cost-effective method alternative to HPLC[J].J Chem,2020,2020(1):8180320.
[14]ULUSOY H I, KÖSEOGLU K, KABIR A, et al.Fabric phase sorptive extraction followed by HPLC-PDA detection for the monitoring of pirimicarb and fenitrothion pesticide residues[J].Microchim Acta, 2020,187:1-11.
[15]ZHOU Y,YU Y H,HUANG Q,et al.Simultaneous determination of 26 pesticide residues in traditional Chinese medicinal leeches by modified QuEChERS coupled with HPLC-MS/MS[J].ACS Omega,2023,8(13):12404-12410.
[16]KOWALSKA G,PANKIEWICZ U,KOWALSKI R.Estimation of pesticide residues in selected products of plant origin from Poland with the use of the HPLC-MS/MS technique[J].Agriculture,2020,10(6):192.
[17]FAN X Y, TANG T, DU S, et al.Simultaneous determination of 108 pesticide residues in three traditional Chinese medicines using a modified QuEChERS mixed sample preparation method and HPLC-MS/MS[J].Molecules,2022,27(21):7636.
[18]吕丽兰,张娅,陆覃昱,等.DPPs类有机磷农药宽谱酶联免疫吸附分析方法的建立[J].西南农业学报,2022,35(11):2659-2666.
[19]薛荣旋,卢丽明,黄诚,等.QuEChERS-超高效液相色谱-串联质谱法测定水产品中6种氟喹诺酮类抗生素残留量[J].中国食品卫生杂志,2020,32(5):519-523.
[20]柳菡,张亚莲,丁涛,等.高效液相色谱-四极杆/静电场轨道阱高分辨质谱用于葡萄酒中111种农药残留的定性筛查与定量分析[J].分析测试学报,2014,33(5):489-498.
[21]吴帅,李湘南,王开宇,等.气相色谱-质谱法测定葡萄酒中33种农药残留[J].食品工业科技,2015,36(17):305-311.
[22]庄无忌.国际食品饲料中农药残留限量法规第一卷(CAC及亚洲地区卷)[M].北京:化学工业出版社,2010.
[23]朱燕燕,马桂娟,汤丽华,等.高效液相色谱-串联质谱法测定豆制品中11种喹诺酮类药物的残留量[J].理化检验-化学分册,2022,58(4):416-423.
[24]CHAMBERS E,WAGROWSKI-DIEHL D M,LU Z L,et al.Systematic and comprehensive strategy for reducing matrix effects in LC/MS/MS analyses[J].J Chromatogr B,2007,852(1-2):22-34.
[25]高娜,孙程鹏,许炳雯,等.液相色谱串联质谱法测定不同蔬菜中农药多残留的基质效应[J].食品科技,2021,46(4):310-317.
[26]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 27417—2017 合格评定化学分析方法确认和验证指南[S].北京:中国标准出版社,2017.
[27]李广,李琪,顾敏,等.高效液相色谱法同时检测葡萄酒中11种人工合成着色剂[J].中国酿造,2024,43(7):246-250.
[28]World Health Organization, Food and Agriculture Organization of the United Nations.Food safety collaborative platform[EB/OL].[2023-06-01].https://apps.who.int/foscollab/Download/DownloadConso.
[29]孙瑞卿,乔雄梧,秦曙.中国食品中农药MRL 标准对急性膳食暴露评估需求的研究[J].农药学学报,2015,17(5):544-554.
[30]中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 2763—2021 食品中农药最大残留限量[S].北京:中国标准出版社,2021.
[31]中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 2763.1—2022 食品中2,4-滴丁酸钠盐等112种农药最大残留限量[S].北京:中国标准出版社,2022.
[32]简秋,单炜力,段丽芳,等.我国农产品及食品中农药最大残留限量制定指导原则[J].农药科学与管理,2012,33(6):24-27.
[33]黄健祥,谢书越,唐雪妹,等.豇豆中灭蝇胺残留分析与膳食风险评估[J].现代食品科技,2023,39(11):263-269.
[34]陈勇,毛永琼,薛雨琴,等.农药残留QuEChERS前处理方法研究进展及应用探讨[J].食品安全质量检测学报,2024,15(9):111-121.
[35]黄松,刘佳,陈彦宏,等.改良QuEChERS法在农药多残留检测中的应用[J].食品安全质量检测学报,2019,10(12):3683-3688.
[36]宋晓娟,杨维英,李婷婷,等.QuEChERS-气相色谱-串联质谱法测定海洋沉积物中的多氯联苯[J].环境监控与预警,2024,16(3):16-22.
[37]王登远,倪永付,于洪建.QuEChERS结合超高效液相色谱-串联质谱法测定大蒜中15种农药残留[J].农药,2024,63(6):419-423.
[38]吴钟玲,何仲强,黄志宁,等.SPE-UPLC-MS/MS法同时测定花草茶中的7种吡咯里西啶类生物碱及其氮氧化物[J].中国酿造,2024,43(7):251-256.
[39]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 27404—2008 实验室质量控制规范食品理化检测[S].北京:中国标准出版社,2008.