表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation conditions optimization

水平 A 发酵时间/h B 发酵温度/℃ C 菌种添加量/% D 初始pH值-1 0 1 96 108 120 30 32 34 4 5 6 6.0 6.5 7.0
Optimization of fermentation conditions and effect evaluation of ester production by Saccharomyces cerevisiae in tobacco extract
烟草烟叶发酵历史可追溯至19世纪,KOLLER J B C最先尝试将微生物接种于烟叶上进行发酵,微生物和酶能够降解淀粉[1]、蛋白质[2]、纤维素[3]等生物大分子,从而改善烟叶质量,在提高香气成分的同时,缩短发酵周期[4-7]。烟草烟叶发酵的目的在于增香丰味、改善品质、降低青杂气味、刺激口感等[8],发酵原料为烟草烟叶原料、次级烟草烟叶提取液、成品烟等,发酵菌种以芽孢杆菌、酵母菌、霉菌等为主,这些菌种在发酵过程中与烟草中的化学物质发生反应,产生醇醛酸酯酮等各类化合物,可以提升烟草烟叶的口感和品质[9-11]。
以乙酸乙酯为代表的酯类物质是烟叶风味的重要贡献者,将高产酯类产香酵母应用到烟草烟叶发酵中,可明显改善烟叶质量、提高香气浓郁度[12]。闫洪洋等[13]研究发现,分离得到的产香酵母MG6可以提高烟草中酮类、酯类、醇类等主要特征成分。周瑢等[14]研究表明,与未发酵相比,烟梗提取液经生香酵母发酵后总香气成分增加了172.13%。杜飞等[15]研究表明,原料经产香酵母菌Z2、曲霉菌EC1发酵后能产生兼具茶香、酒香、蜜甜香及特殊香味的产物。目前,鲜有关于提高烟草烟叶中酯类化合物研究报道。
本研究以烟叶提取液为发酵基质,以酿酒酵母(Saccharomyces cerevisiae)SMR-SC-11为发酵菌种,以酯类化合物含量为评价指标,采用单因素及响应面试验优化其发酵条件,并对烟叶提取液发酵前后理化指标进行分析。以期为烟草烟叶微生物发酵提质增香技术提供实验依据,降低企业生产成本,提高企业生产效率。
1.1.1 原料与菌种
烟叶提取液:由云南中烟工业有限责任公司提供;酿酒酵母(Saccharomyces cerevisiae)SMR-SC-11:分离筛选自某清香型白酒大曲。
1.1.2 试剂
WL营养琼脂培养基、液体酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、固体YPD培养基(均为生化试剂):北京奥博星生物技术有限责任公司;二氯甲烷(色谱纯):福晨(天津)化学试剂有限公司;乙酸苯乙酯(分析纯);上海麦克林生化科技股份有限公司;苯酚(分析纯):广东光华化学厂有限公司;甲醇(色谱纯):美国赛默飞世尔科技公司;异丙醇(色谱纯):上海化成工业发展有限公司;氢氧化钠、乙酸乙酯(均为分析纯):天津市康科德科技有限公司。
ZXSD-B1270恒温培养箱、ZHJH-C1109B超净工作台:上海智城分析仪器制造有限公司;5480R低速离心机:德国Eppendorf公司;DZKW-C电热恒温水浴:河北黄骅市航空仪器厂;GB204电子分析天平:南京安铎贸易有限责任公司;iCAP Q电感耦合等离子体质谱仪:美国赛默飞世尔科技公司;EL-20K pH计:瑞士梅特勒托利多集团;ei-VAP Value/G3旋转蒸发仪;Infinite 200PRO酶标仪:奥地利TECAN公司。
1.3.1 烟叶提取液的发酵
酿酒酵母的活化培养:在无菌环境下取甘油冻存管保藏的酿酒酵母菌液100 μL接种于装有5 mL YPD液体培养基的试管中,活化培养后再于试管中取1 mL菌液于装液量为50 mL/250 mL YPD液体培养基中培养,培养条件均为30 ℃、180 r/min摇床培养24 h(1.5×108 CFU/mL)时,将其作为种子液接至烟叶提取液发酵培养基中。按烟叶提取液∶水1∶1.2比例加水,装液量为200 mL/500 mL,在菌种添加量3%,发酵温度32 ℃,初始pH值6.0的条件下,静置发酵4 d,即得烟叶提取液发酵液。
1.3.2 发酵条件优化
单因素试验:在上述工艺流程基础上,分别考察发酵时间(36 h、48 h、60 h、72 h、84 h、96 h、108 h、120 h、132 h、144 h)、发酵温度(24 ℃、26 ℃、28 ℃、30 ℃、32 ℃、34 ℃、36 ℃、38 ℃)、菌种添加量(1%、2%、3%、4%、5%、6%、7%、8%)、初始pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5)对发酵液中酯类化合物含量的影响。
响应面试验:选择发酵时间(A)、发酵温度(B)、菌种添加量(C)和初始pH值(D)为自变量,以酯类化合物含量(Y)为响应值,采用Box-Behnken试验设计优化发酵工艺条件[16],响应面试验因素与水平见表1。
表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation conditions optimization

水平 A 发酵时间/h B 发酵温度/℃ C 菌种添加量/% D 初始pH值-1 0 1 96 108 120 30 32 34 4 5 6 6.0 6.5 7.0
1.3.3 理化指标检测
蛋白质含量测定:采用二喹啉甲酸(bicinchoninic acid,BCA)试剂盒;还原糖含量测定:3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法[17];总糖含量测定:苯酚硫酸法[18];氨基酸态氮含量测定:参考GB 18186—2000《酿造酱油》中甲醛滴定法[19];钠钾离子含量测定:电感耦合等离子体质谱法[20];酯类化合物含量测定:皂化中和滴定法[21]。
2.1.1 发酵时间的确定
发酵时间对酿酒酵母SMR-SC-11发酵烟叶提取液中酯类化合物含量的影响见图1。由图1可知,随着发酵时间在36~108 h范围内的增加,烟叶提取液中酯类化合物的含量增加;当发酵时间为108 h时,酯类化合物含量可达1.67 g/L;当发酵时间>108 h时,酯类化合物含量变化趋于稳定。因此,最佳发酵时间为108 h。
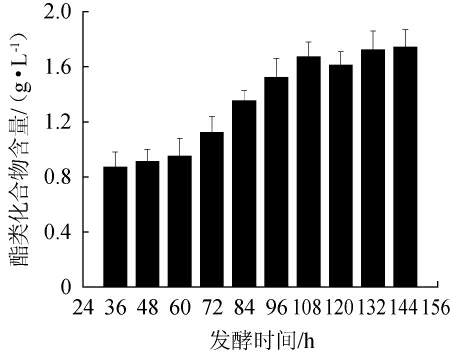
图1 发酵时间对酯类化合物含量的影响
Fig.1 Effect of fermentation time on ester substances contents
2.1.2 发酵温度的确定
发酵温度对酿酒酵母SMR-SC-11发酵烟叶提取液中酯类化合物含量的影响见图2。由图2可知,当发酵温度为24~32 ℃时,烟叶提取液中酯类化合物的含量增加;当发酵温度为32 ℃时,酯类化合物含量最高,为1.18 g/L;当发酵温度>32 ℃时,酯类化合物含量降低。因此,最佳发酵温度为32 ℃。
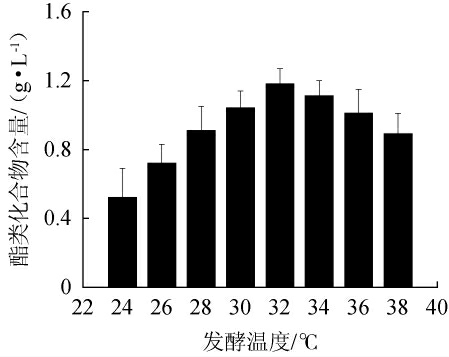
图2 发酵温度对酯类化合物含量的影响
Fig.2 Effect of fermentation temperature on ester substances contents
2.1.3 菌种添加量的确定
菌种添加量对酿酒酵母SMR-SC-11发酵烟叶提取液中酯类化合物含量的影响见图3。由图3可知,当菌种添加量在1%~5%的范围内增加,烟叶提取液中酯类化合物的含量增加;当菌种添加量为5%时,酯类化合物含量为1.57 g/L;当菌种添加量>5%时,酯类化合物的含量趋于平稳。因此,最佳菌种添加量为5%。
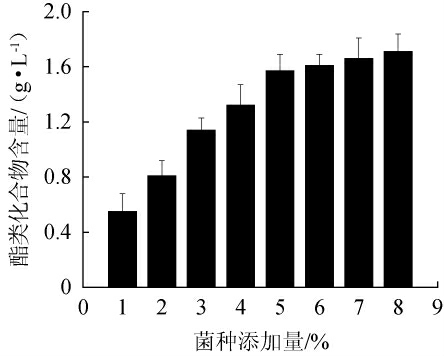
图3 菌种添加量对酯类化合物含量的影响
Fig.3 Effect of inoculum on ester substances contents
2.1.4 初始pH值的确定
初始pH值对酿酒酵母SMR-SC-11发酵烟叶提取液中酯类化合物含量的影响见图4。
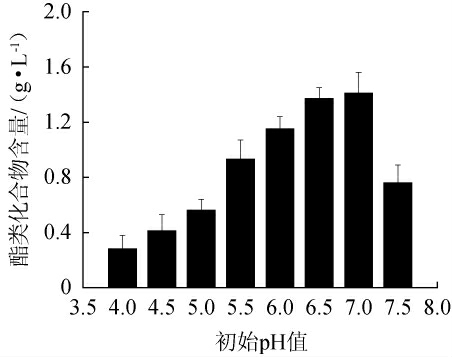
图4 初始pH值对酯类化合物含量的影响
Fig.4 Effect of initial pH on ester substances contents
由图4可知,当初始pH值在4.0~7.0范围内增加,烟叶提取液中酯类化合物的含量增加;当初始pH值为6.5和7.0时,酯类化合物含量相差不大,分别为1.37 g/L、1.41 g/L;当初始pH值>7.5时,酯类化合物含量下降。因此,最佳初始pH值为6.5。
根据单因素试验结果,选择发酵时间(A)、发酵温度(B)、菌种添加量(C)和初始pH值(D)为自变量,以酯类化合物含量(Y)为评价指标,进行Box-Behnken试验优化酿酒酵母发酵工艺条件,Box-Behnken试验设计及结果见表2,方差分析结果见表3。
表2 发酵条件优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken tests for fermentation conditions optimization
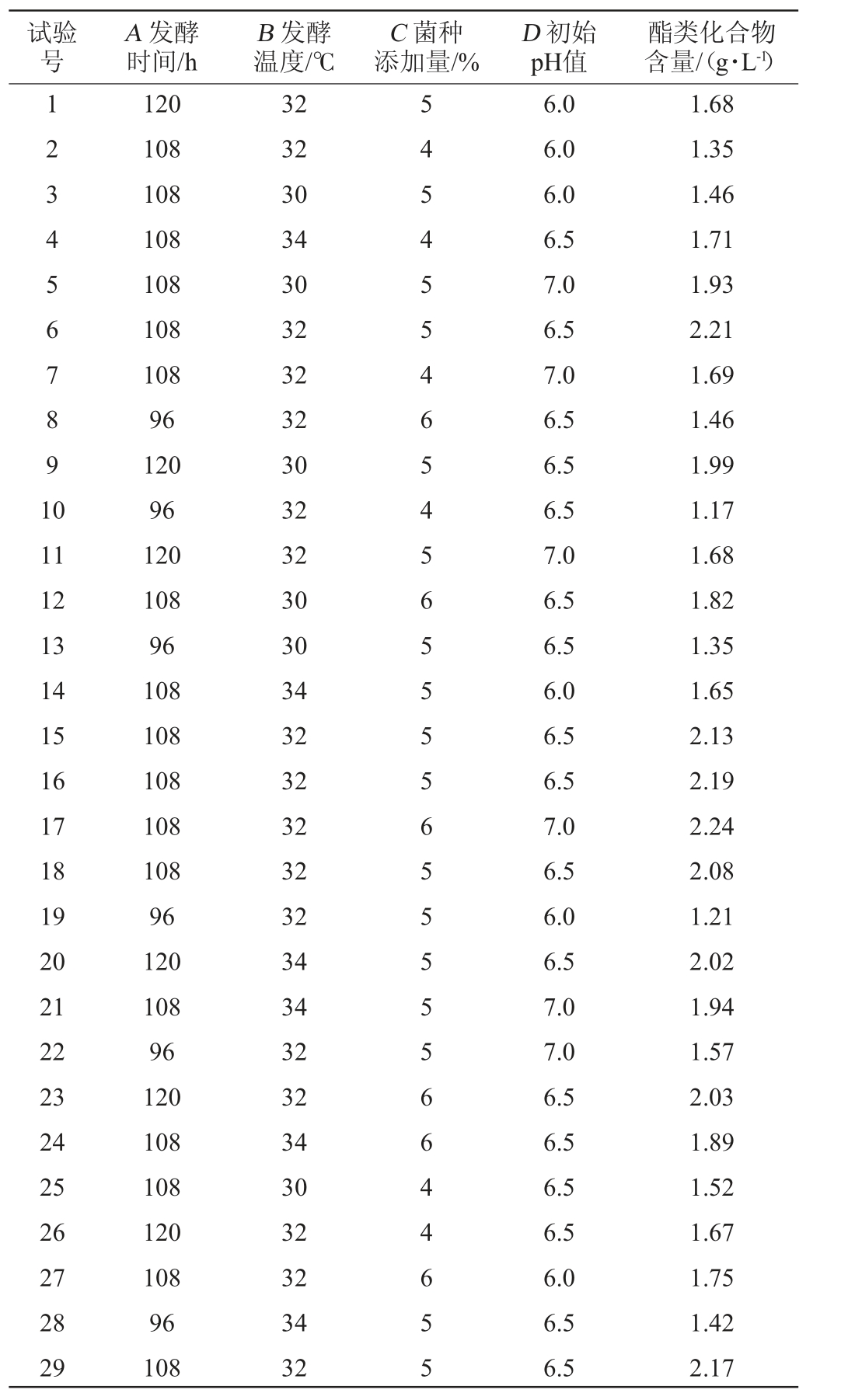
试验号A 发酵时间/h B 发酵温度/℃C 菌种添加量/%D 初始pH值酯类化合物含量/(g·L-1)1 2 3 4 5 6 78 9 1 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 120 108 108 108 108 108 108 96 120 96 120 108 96 108 108 108 108 108 96 120 108 96 120 108 108 120 108 96 108 32 32 30 34 30 32 32 32 30 32 32 30 30 34 32 32 32 32 32 34 34 32 32 34 30 32 32 34 32 5 4 5 4 5 5 46 5 4 5 6 5 5 5 5 65 5 5 5 5 6 6 4 4 6 55 6.0 6.0 6.0 6.5 7.0 6.5 7.0 6.5 6.5 6.5 7.0 6.5 6.5 6.0 6.5 6.5 7.0 6.5 6.0 6.5 7.0 7.0 6.5 6.5 6.5 6.5 6.0 6.5 6.5 1.68 1.35 1.46 1.71 1.93 2.21 1.69 1.46 1.99 1.17 1.68 1.82 1.35 1.65 2.13 2.19 2.24 2.08 1.21 2.02 1.94 1.57 2.03 1.89 1.52 1.67 1.75 1.42 2.17
表3 回归模型方差分析
Table 3 Variances analysis of regression model

注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B********AC AD BC BD CD A2 B2 C2 D2 15.172 4 58.002 4 2.177 8 30.045 3 26.407 0 0.033 3 0.102 1 2.700 1 0.300 1 0.675 0 0.468 8 64.994 1 14.806 0 25.103 6 29.662 0<0.000 1<0.000 1 0.162 1<0.000 1 0.000 2 0.857 7 0.754 1 0.122 6 0.592 5 0.425 1 0.504 7<0.000 1 0.001 8 0.000 2<0.000 1********残差失拟项纯误差总误差2.548 9 0.696 0 0.026 1 0.360 5 0.316 9 0.000 4 0.001 2 0.032 4 0.003 6 0.008 1 0.005 6 0.779 9 0.177 7 0.301 2 0.355 9 0.168 0 0.157 3 0.010 7 2.716 9 111111111111111 4 10 4 28 0.182 1 0.696 1 0.026 1 0.360 5 0.316 9 0.000 4 0.001 2 0.032 4 0.003 6 0.008 1 0.005 6 0.779 9 0.177 7 0.301 2 0.355 9 0.012 0 0.015 7 0.002 7 5.868 5 0.051 4
采用Design Expert 13.0软件对表2数据进行回归分析,获得发酵时间(A)、发酵温度(B)、菌种添加量(C)、初始pH值(D)对酯类化合物含量(Y)之间的二次回归方程如下:

由表3可知,回归分析模型显著性(P<0.000 1),失拟项不显著(P=0.051 4>0.05),说明该模型设计科学合理,同时回归模型决定系数R2=0.938 2,调整决定系数R2adj=0.938,证实该模型的回归方程与实际情况拟合度高,该模型可准确反映酿酒酵母产酯能力与发酵时间、发酵温度、菌种添加量、初始pH值之间的关系,应用该模型可以良好的预测酿酒酵母SMR-SC-11对烟叶提取液发酵产酯能力。由P值可知,该模型一次项A、C、D,二次项A2、B2、C2、D2对酯类化合物含量影响极显著(P<0.01),而其他项均不显著(P>0.05)。由F值可知,对酯类化合物含量影响顺序依次为发酵时间(A)>菌种添加量(C)>初始pH值(D)>发酵温度(B)。
进一步依据Design Expert 13.0软件对回归方程计算可知,酿酒酵母SMR-SC-11发酵烟叶提取液最佳条件为:发酵时间111.81 h,发酵温度32.08 ℃,接种量5.44%,初始pH值6.66。在此优化条件下,酯类化合物含量预测值为2.26 g/L。为方便实际操作,将最佳发酵条件修正为:发酵时间111 h,发酵温度32 ℃,接种量5%,初始pH值6.7。在此条件下进行3次验证试验,得到酯类化合物含量实际值为2.28 g/L,接近预测值,证实该模型可靠准确,较优化前酯类化合物产量提高714.28%(烟叶提取液中酯类化合物含量为0.28 g/L)。
进一步,对比发酵前后烟叶提取液中蛋白质、还原糖、总糖、氨基酸态氮、Na+、K+含量变化,结果见表4。由表4可知,不同物质呈现差异变化,蛋白质含量降低26.7%、还原糖含量降低33.0%、总糖含量降低23.6%、氨基酸态氮含量降低58.3%,其原因可能是由于微生物在发酵过程中会利用提取液中的碳氮源类物质作为生长代谢所必需的营养成分,将大分子物质降解为可供微生物直接利用小分子物质,并合成代谢乙酸乙酯、己酸乙酯、乳酸乙酯等具有典型风味特征的挥发性物质[22-24],即在降低燃烧易产生杂味的蛋白质、多糖等大分子物质含量的同时,增香丰味,提质增效效果显著。此外,发酵前后Na+和K+含量变化较小,说明其助燃特性无明显变化,表明微生物发酵对提取液中Na+、K+含量影响较小[25]。
表4 发酵前后样品理化指标检测结果
Table 4 Determination results of physiochemical indexes of samples before and after fermentation

?
以酯类化合物含量为评价指标,本研究通过单因素和响应面试验优化酿酒酵母SMR-SC-11发酵烟叶提取液条件。结果表明,最佳发酵条件为:发酵时间111 h,发酵温度32 ℃,接种量5%,初始pH值6.7。在此优化条件下,酯类化合物产量为2.28 g/L,与发酵前相比,发酵后烟叶提取液中酯类化合物含量提高714.28%。本研究可为微生物发酵烟叶提质增香技术提供参考和依据。
[1]孙光伟,孙敬国,陈振国,等.烟叶淀粉降解菌的筛选及其作用效果研究[J].中国烟草科学,2024,45(1):70-78.
[2]周艳霞,赵婉,杨勇,等.烟叶蛋白质降解菌的筛选及其作用效果[J].烟草科技,2024,57(6):43-54.
[3]郝捷,李选文,张宝,等.纤维素酶在烟草中的应用进展[J].生物技术进展,2023,13(2):166-173.
[4]郝捷,季嫱,李力群,等.生物酶和微生物技术改善烟叶香气的研究进展[J].生物技术进展,2022,12(6):817-824.
[5]云瑞刚,华群,张志钦,等.生物酶工业化发酵烟叶工艺研究[J].农产品加工,2023(17):47-49.
[6]吴鑫颖.烟叶醇化过程的动态解析及功能微生物研究[D].无锡:江南大学,2022.
[7]谭舒,曾旸,曾剑平,等.发酵对雪茄烟叶品质影响的研究进展[J].安徽农业科学,2023,51(18):16-19.
[8]何沛,苏代发,杨俊誉,等.微生物在烟草中的研究、开发与利用进展[J].湖北农业科学,2019,58(S2):42-57.
[9]刘方玉,高强,付沙,等.雪茄烟叶发酵工艺及其微生物技术研究进展[J].安徽农业科学,2023,51(14):18-21.
[10]宋丽丽,霍姗浩,孙永威,等.复合菌群协同发酵烟梗的降解特性及微生物多样性研究[J].轻工学报,2023,38(1):63-70.
[11]徐清泉,李石头,黄申,等.烟草源微生物及其应用研究进展[J].轻工学报,2021,36(5):42-50,58.
[12]孙福艳,杨雪鹏,杨成,等.烟草增香生物技术研究进展[J].云南化工,2023,50(2):9-14.
[13]闫洪洋,黄启蒙,蔡兴华,等.产香菌株的分离鉴定及其发酵产物在卷烟加香中的应用[J].轻工学报,2021,36(6):47-54.
[14]周瑢,孔浩辉,何艳明,等.生香酵母发酵改善烟梗提取液性质研究[J].食品工业科技,2012,33(23):73-75,80.
[15]杜飞,喻阑清,周家喜,等.两种产香微生物分离鉴定及其发酵液增香烟草研究[J].山地农业生物学报,2021,40(1):14-21.
[16]陈力,李珂,陈辉太,等.一株生香酵母的筛选鉴定及其产酯发酵条件优化[J].中国酿造,2024,43(12):96-102.
[17]刘彩华,曾嘉童,包竹君,等.3,5-二硝基水杨酸比色法测定芒果的可溶性糖含量[J].食品安全质量检测学报,2022,13(9):2892-2900.
[18]罗春萍,陆友利,王星星.苯酚-硫酸法快速测定多糖方法的优化[J].化工管理,2021(3):90-91,94.
[19]国家质量技术监督局.GB 18186—2000 中华人民共和国国家标准酿造酱油[S].北京:中国标准出版社,2000.
[20]念娟妮,周弛,薛婷,等.电感耦合等离子体质谱法测定水中钾、钠、钙、镁的研究[J].环境与发展,2019,31(8):115-116.
[21]龙亮.调味料酒中挥发酯检测方法的研究[J].食品安全导刊,2021(12):112-113.
[22]王金棒,邱纪青,汪志波,等.生物技术在烟草发酵领域的专利布局现状及热点分析[J].烟草科技,2021,54(10):96-112.
[23]ZOU X D,BK A,ABU-IZNEID T,et al.Current advances of functional phytochemicals in Nicotiana plant and related potential value of tobacco processing waste:A review[J].Biomed Pharmacother,2021,143:112191.
[24]KHAN M U,AHRING B K.Lignin degradation under anaerobic digestion:Influence of lignin modifications-A review[J].Biomass Bioenerg,2019,128:105325.
[25]刘雪松.含钾催化剂的制备及催化碳烟燃烧性能[D].济南:济南大学,2020.