Effect of heat treatment on functional properties of walnut protein and enzymatic hydrolysis products of walnut meal
核桃一直广受广大人民的喜爱,对人的身体有一定的保健效果[1]。其具有药食同源性,富含优质植物蛋白、矿物质、维生素及膳食纤维等营养成分[2-3],特别是高价值的不饱和脂肪酸,如油酸和亚油酸,极具开发利用价值[4-6]。在功能性食品领域核桃蛋白浓缩物和分离物有较好潜能[7]。目前我国核桃种植面积高居世界第一,伴随着核桃产量持续增长,为我国经济发展和未来核桃的出口带来巨大效益[8],核桃市场的发展相对广阔[9]。
目前对核桃蛋白的研究主要集中于核桃青皮的提取工艺优化、核桃酶解产物和核桃仁的功能性质。如卢俊[10]以核桃青皮为原料,通过单因素试验和正交试验,运用Box-Behnken响应面试验设计优化核桃青皮中总黄酮的提取工艺,证明核桃青皮总黄酮具有较强的抗氧化活性。核桃蛋白酶解产物可以提取功能肽,裴璞花等[11]证明了核桃蛋白酶解产物中含有降血压肽,以血管紧张素转换酶抑制率为考察因子,研究了影响血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制率的因素。ANJUM S等[12]研究不同溶剂浸泡核桃仁后抗氧化活性的影响,并使用色谱技术测定了生物活性化合物,发现其可以抑制细胞的增殖作用。
本研究以核桃粕为原料,通过酸沉碱提法和碱性蛋白酶分别制备分离蛋白和酶解产物,研究分离蛋白和酶解产物在不同条件热处理的乳化性、起泡性和抗氧化性。以期促进核桃粕的加工利用,促进核桃精深加工产品的开发。
核桃粕(食品级):山西省吕梁市;碱性蛋白酶(食品级):河南安锐生物科技有限公司;氢氧化钠、浓盐酸、硫酸亚铁、水杨酸、磷酸氢二钠、磷酸二氢钠、抗坏血酸、无水乙醇、三(羟甲基)氨基甲烷、铁氰化钾、三氯化铁、过氧化氢、三氯乙酸:天津福晨化学试剂厂;邻苯三酚:福州飞净生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、磷酸盐、Tris:天津光复科技发展有限公司。所用试剂均为分析纯。
JNB2003电子天平、MS5磁力搅拌机、MC-4K低速离心机:宁波鄞州群安实验仪器有限公司;PHBJ-260PH计:上海越平科学仪器股份有限公司;SC-04台式低速离心机:上海向帆仪器有限公司;SP21-318C酶标仪:美国伯腾仪器有限公司;DK-98-Ⅱ电热恒温水浴锅:天津泰斯特仪器有限公司;DSA100-GL2-4.1L超声波清洗器:福州德森精工有限公司;SCIENTZ-10YD/A冷冻干燥机:宁波新芝冻干设备有限公司。
1.3.1 核桃分离蛋白的制备
称取200g核桃粕置于烧杯中,加蒸馏水定容至2000mL,搅拌均匀,用1 mol/L NaOH调节pH值至9.0,50 ℃超声提取1 h,静置30 min,3 000 r/min离心20 min。用1 mol/L盐酸调节上清液pH值至4.5并静置30 min,继续3 000 r/min离心20 min。用纯水洗涤沉淀3~4次,调pH至中性,3000r/min离心20min,将沉淀物冷冻干燥得到分离蛋白[13-14]。
1.3.2 核桃粕酶解产物的制备
将10 g核桃粕与蒸馏水制成5 g/100 mL的核桃粕溶液,用1 mol/L NaOH调pH为9.5,加入3%的碱性蛋白酶,60 ℃水浴,用1 mol/L NaOH调节pH,使溶液在最适pH 9.5条件下酶解。冷却至室温,用1 mol/L盐酸调pH至中性,以3 000 r/min离心30 min,上层清液即酶解产物[15-17]。
1.3.3 核桃蛋白及其酶解产物样品处理共设置5组不同热处理方式对核桃蛋白样品溶液和酶解产物样品溶液进行处理,分别为未处理(对照)、65 ℃/30 min、72 ℃/10 s、85 ℃/10 min及95 ℃/10 min。
1.3.4 功能特性测定方法
起泡性:分别取10 mL不同热处理后的蛋白质样品和酶解产物溶液(10 mg/mL),12 000 r/min均质2 min,测定溶液起始体积和起泡体积[18-19],计算起泡性,计算公式如下:
乳化性:分别取10 mL不同热处理后的蛋白质样品和酶解产物溶液(10 mg/mL),各加入10 mL食用油。搅拌后1 200 r/min均质5 min,测量离心管中的液体总高度和乳化层高度[20-21]。计算公式如下:
总还原力的测定:分别取30支离心管各分为2组,各加入100 μL 10 mg/mL蛋白质样品溶液和酶解产物样品溶液,后加入100 μL 0.2 mol/L磷酸缓冲盐溶液(phosphate buffer saline,PBS)和1%的铁氰化钾溶液,先进行水浴加热(50 ℃加热20 min)后冷却至室温,加入10%的三氯乙酸100μL并4 000 r/min离心10 min,取上清液100 μL,加入同体积纯水,最后加入20μL0.1%三氯化铁,静置10min,取100 μL样液于96孔板,在波长700 nm处测得吸光度值A0[22-23],A0越大则样品的总还原力越大,抗氧化性就越好。
DPPH自由基清除率的测定:将不同热处理的蛋白质样品和酶解产物样品稀释为1 mg/mL。在96孔板中各加入50 μL已被稀释的样品溶液并分别加入0.1 mmol/L的DPPH溶液,室温避光静置30 min,测定其在波长517 nm处的吸光度值A1,用无水乙醇代替DPPH溶液重复实验得到A2,用无水乙醇代替样品溶液重复实验得到A3,重复3次[24-25]。DPPH自由基清除率计算公式如下:
超氧阴离子自由基清除率的测定:将不同热处理的蛋白质样品和酶解产物样品稀释为10 mg/mL,取3支1 mL的离心管,分别加入400 μL 50 mmol/L的Tris-HCl缓冲溶液,于水浴锅中进行25 ℃/20 min加热。各加入100 μL不同样品溶液和25 mmol/L的邻苯三酚溶液,混匀后在上述温度水浴锅中继续静置5 min,最后滴加10 μL 8%的盐酸终止反应。取100 μL溶液于96孔板中,测定其在波长325 nm处的吸光度值A1,用蒸馏水代替邻苯三酚溶液重复实验得到A2,用蒸馏水代替样品溶液重复实验得到A3,重复3次[26-27]。超氧阴离子自由基清除率计算公式如下:
羟基自由基清除率的测定:将不同热处理的蛋白质样品和酶解产物样品稀释为10 mg/mL。各取50 μL的9 mmol/L硫酸亚铁溶液、9 mmol/L水杨酸-乙醇溶液和10 mg/mL不同样品溶液于96孔板中,取50 μL 8.8 mmol/L的H2O2溶液启动反应,孔板在37 ℃恒温静置30 min,测定在波长510 nm处的吸光度值A1,用蒸馏水代替H2O2溶液重复实验得到A2,用蒸馏水代替样品溶液重复实验得到A3,重复3次[28-29]。羟基自由基清除率计算公式如下:
1.3.5 数据处理和统计学分析
数据采用Origin 2018软件进行计算绘图。采用IBM SPSS Statistics 25.0软件进行显著性分析,P<0.05为显著性差异。
不同热处理方式对核桃蛋白与酶解产物起泡性的影响见图1。
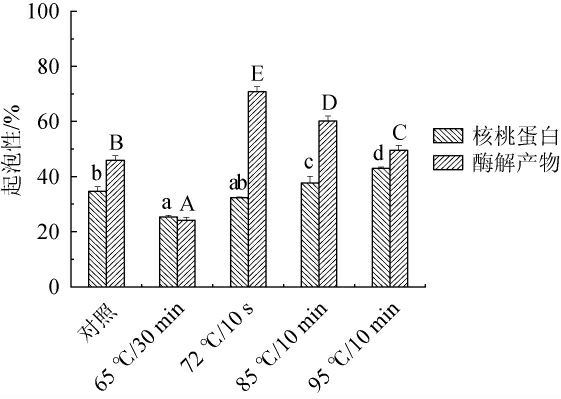
图1 不同热处理方式对核桃蛋白及核桃粕酶解产物起泡性的影响
Fig.1 Effect of different heat treatment methods on foaming properties of walnut protein and enzymatic hydrolysis products of walnut meal
不同大小写字母表示同一样品不同热处理方式差异显著(P<0.05)。
由图1可知,经不同热处理方式处理后,核桃蛋白起泡性分别为34.67%、25.33%、32.33%、37.67%、43%;酶解产物起泡性分别为45.92%、24.19%、70.80%、60.18%、49.56%。与未处理组相比,65 ℃/30 min和72 ℃/10 s时核桃蛋白起泡性略有下降,是蛋白受热变性的温度较高[30],在该温度条件下未发生蛋白解聚,升高温度可以让核桃蛋白起泡性变高,但蛋白活性受到抑制,由此起泡性降低;85 ℃/10 min和95 ℃/10 min能显著提高起泡性,是热处理导致蛋白质分子解聚,憎水性增强,蛋白质分子受热发生局部变性,蛋白质内部的多肽链展开,导致分子柔顺性变大,使起泡性增强。与未处理组相比,65 ℃/30 min时酶解产物起泡性降至最低,可能是因为温度使多肽表面的界面张力破坏,起泡性降低;72 ℃/10 s时酶解产物起泡性达到最大70.80%,可能是温度升高使蛋白质分子适度舒展,分子间的氢键和范德华力更易形成是因为原处于分子内部的疏水基团暴露,使得起泡性升高;72 ℃/10 s以后,起泡性逐渐下降至接近未处理组,是过高温度使蛋白质分子进一步舒展,极性基团过多暴露,蛋白质分子形成非共价聚集体,颗粒增大,不利于泡沫形成,导致起泡性下降。核桃蛋白的起泡性随热处理温度呈上升趋势,酶解产物则呈下降趋势,因为酶解产物的热稳定性高于核桃蛋白,所以酶解产物高于核桃蛋白的起泡性。综上,通过95 ℃/10 min处理核桃蛋白,72 ℃/10 s处理酶解产物的起泡性最佳。
不同热处理方式对核桃蛋白与酶解产物乳化性的影响见图2。
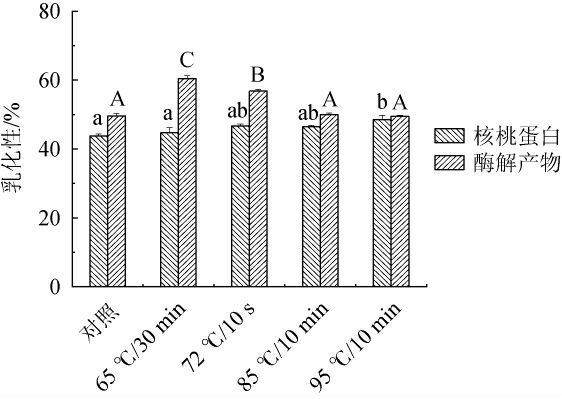
图2 不同热处理方式对核桃蛋白及核桃粕酶解产物乳化性的影响
Fig.2 Effect of different heat treatment methods on the emulsifying properties of walnut protein and enzymatic hydrolysis products of walnut meal
由图2可知,经不同热处理方式处理后,核桃蛋白乳化性分别为43.73%、44.71%、46.75%、46.47%、48.48%;酶解产物乳化性分别为49.59%、60.47%、56.81%、49.96%、49.49%。相对于未处理的核桃蛋白,经过热处理后的核桃蛋白乳化性均有一定程度的提高。核桃蛋白经过热处理后,核桃蛋白内部分子结构会发生变化,受热变性后其内部分子构象开始展开,柔顺性和憎水性相对增强,水相和油相分离情况更大,表面张力降低,蛋白分子在水油界面吸附更加容易,乳化性随之增大,从而提升了核桃蛋白的乳化性能。相同热处理条件下,酶解产物的乳化性均高于核桃蛋白。65 ℃/30 min处理时,酶解产物的乳化性达到最高,可能是由于65 ℃/30 min处理时热处理温度较低,使得多肽的结构展开,分子的表面积增加,与水油界面的接触面积增大,吸附力增强,乳化性增强;随热处理温度升高,乳化性逐渐下降,是温度增加使多肽的分子运动加剧,与水油界面的凝胶作用降低,同时由于高温也会导致肽链断裂产生沉淀,水油界面的分子减少,酶解产物的乳化性逐渐下降;85 ℃/10 min和95 ℃/10 min时,接近于未处理组。核桃蛋白的乳化性随热处理温度的增加总体呈上升趋势,酶解产物总体呈下降趋势。综上,通过95 ℃/10 min处理核桃蛋白,65 ℃/30 min处理酶解产物的乳化性最佳。
2.3.1 不同热处理方式对核桃蛋白与酶解产物总还原力的影响
不同热处理方式对核桃蛋白与酶解产物总还原力的影响见图3。
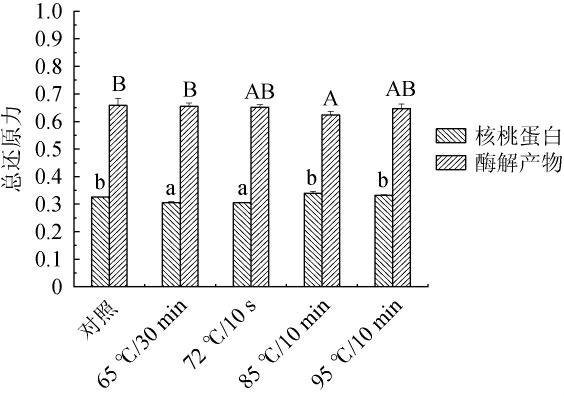
图3 不同热处理方式对核桃蛋白及核桃粕酶解产物总还原力的影响
Fig.3 Effect of different heat treatment methods on the total reducing power of walnut protein and enzymatic hydrolysis products of walnut meal
由图3可知,经不同热处理方式处理后,核桃蛋白总还原力分别为0.326、0.306、0.305、0.339、0.332,酶解产物总还原力分别为0.658、0.655、0.652、0.624、0.647。核桃蛋白在85 ℃/10 min时还原力最大,72 ℃/10 s时还原力最低,核桃蛋白的还原力随着热处理温度升高而增加,85 ℃/10 min时还原力最大,其原因是蛋白质分子解聚,构象展开,具有还原力的肽链释放,Fe3+大量还原为Fe2+,从而导致吸光度值变大,还原力提高,抗氧化性增强。其中65 ℃/30 min、72 ℃/10 s这两组核桃蛋白的还原力显著性低于其他三组(P<0.05),其他三组无显著差异(P>0.05)。对于酶解产物,当热处理温度提高到85 ℃时,达到酶解产物的热变性温度,活性丧失,导致其总还原力显著低于未处理组(P<0.05);72 ℃/10 s、85 ℃/10 min和95 ℃/10 min这三组结果没有显著性差异(P>0.05),均低于未处理组。且核桃蛋白的热稳定性和还原力均低于酶解产物。综上,通过85 ℃/10 min处理核桃蛋白,未处理组酶解产物的总还原力最佳。
2.3.2 不同热处理方式对核桃蛋白与酶解产物DPPH自由基清除率的影响
不同热处理方式对核桃蛋白与酶解产物DPPH自由基清除率的影响见图4。
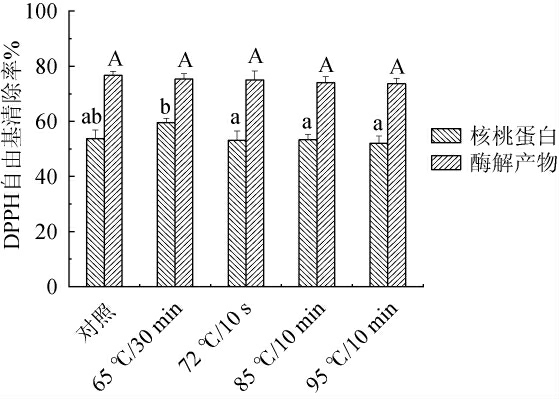
图4 不同热处理方式对核桃蛋白及核桃粕酶解产物DPPH自由基清除率的影响
Fig.4 Effect of different heat treatment methods on DPPH free radical scavenging rate of walnut protein and enzymatic hydrolysis products of walnut meal
由图4可知,经不同热处理方式处理后,核桃蛋白DPPH自由基清除率分别为53.71%、59.61%、53.07%、53.33%、52.05%,酶解产物分别为76.67%、75.33%、75.00%、74.00%、73.67%。相对于未处理的核桃蛋白,经过热处理后的核桃蛋白DPPH自由基清除率均无显著差异(P>0.05)。对于不同热处理方式的酶解产物,其DPPH自由基清除率均高于核桃蛋白,且酶解产物DPPH清除率在所有不同的热处理方式下均无显著差异(P>0.05)。DPPH与自由基相作用生成浅黄色或无色溶液,吸光度值减小,反映抗氧化较低。随着热处理温度的升高,导致蛋白质内部分子和酶解产物中具有抗氧化性的多肽链结构被破坏,大量自由基与DPPH结合,吸光度值降低,使抗氧化能力变弱,但各组之间的DPPH清除率变化趋势不大。综上,通过65 ℃/30 min处理核桃蛋白,未处理组酶解产物的热处理方式,其DPPH自由基清除率最高。
2.3.3 不同热处理方式对核桃蛋白与酶解产物超氧阴离子自由基清除率的影响
不同热处理方式对核桃蛋白与酶解产物超氧阴离子自由基清除率的影响见图5。
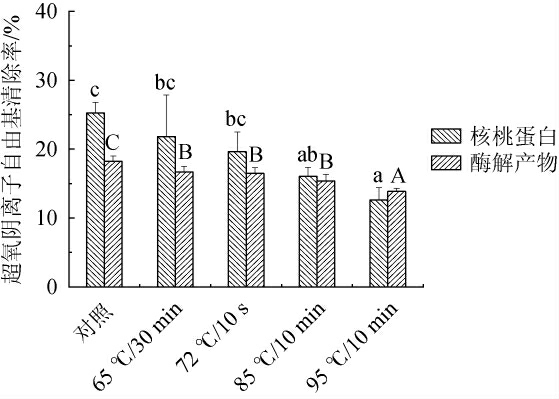
图5 不同热处理方式对核桃蛋白及核桃粕酶解产物超氧阴离子自由基清除率的影响
Fig.5 Effect of different heat treatment methods on superoxide anion radical scavenging rate of walnut protein and enzymatic hydrolysis products of walnut meal
由图5可知,经不同热处理方式处理后,核桃蛋白超氧阴离子自由基清除率分别为25.27%、21.83%、19.63%、16.04%、12.60%,酶解产物分别为18.24%、16.70%、16.48%、15.38%、13.85%。核桃蛋白及酶解产物随热处理温度的升高,具有清除超氧阴离子的物质结构受到破坏,超氧阴离子自由基清除率随之降低,酶解产物的超氧阴离子自由基清除率低于核桃蛋白。综上,在95 ℃/10 min时,核桃蛋白和酶解产物的超氧阴离子自由基清除率均下降到最低。未处理组核桃蛋白和酶解产物超氧阴离子自由基清除率最高。
2.3.4 不同热处理方式对核桃蛋白与酶解产物羟基自由基清除率的影响
不同热处理方式对核桃蛋白与酶解产物羟基自由基清除率的影响见图6。
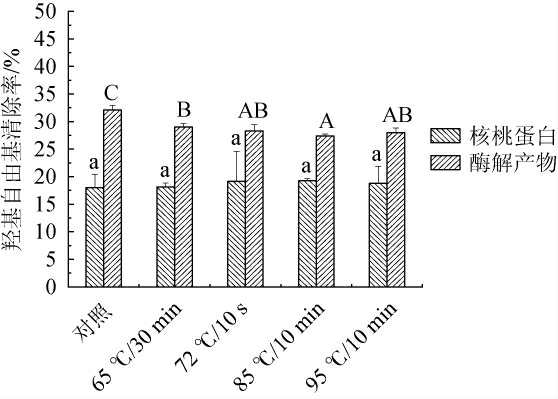
图6 不同热处理方式对核桃蛋白及核桃粕酶解产物羟基自由基清除率的影响
Fig.6 Effect of different heat treatment methods on hydroxyl radical scavenging rate of walnut protein and enzymatic hydrolysis products of walnut meal
由图6可知,经不同热处理方式处理后,核桃蛋白羟基自由基清除率分别为17.99%、18.13%、19.18%、19.29%、18.78%,酶解产物分别为32.10%、29%、28.30%、27.40%、28%。对于核桃蛋白,其羟基自由基清除率随热处理温度的增加呈现出先略微上升再下降趋势,在所有不同的热处理方式下均无显著差异(P>0.05)。在85 ℃/10 min时核桃蛋白的羟基自由基清除率能力最好,因为热处理温度升高,疏水基团暴露的蛋白质分子与羟基自由基结合,提高了羟基自由基清除率。由于热处理温度的升高,蛋白疏水性开始降低,疏水氨基酸遭到破坏,羟基自由基与疏水基团的结合能力减弱,导致酶解产物的抗氧化活性逐渐降低,其余四组均显著低于未处理组(P<0.05)。经不同热处理方式酶解产物的羟基自由基清除率均高于核桃蛋白。综上,通过72 ℃/10 s处理核桃蛋白,未处理组酶解产物羟基自由基清除率最高,抗氧化性最好。
本研究以核桃粕为原料,通过酸沉碱提法和碱性蛋白酶提取核桃蛋白和制备酶解产物,对其研究不同热处理条件对其起泡性、乳化性及抗氧化活性的影响。经研究发现,核桃蛋白的起泡性随热处理温度升高趋势是先降低后升高,在65 ℃/30 min时最低,在95 ℃/10 min时最高;酶解产物的起泡性在65 ℃/30 min时最低,72 ℃/10 s时达到最大。核桃蛋白乳化性与热处理温度成正比,在95 ℃/10 min时乳化性最好。酶解产物乳化性在65 ℃/30 min达到最高,之后与温度成反比,95 ℃/10 min时降至最低。随着热处理温度提高,核桃蛋白还原力先下降后提高,在85 ℃/10 min时还原力达到最大值;热处理对核桃蛋白DPPH自由基清除率和羟基自由基清除率均变化不大。随着热处理对酶解产物的温度提高,羟基自由基清除率为先降后升,整体上对总还原力与DPPH自由基清除率不显著。核桃蛋白与酶解产物超氧阴离子自由基清除率逐渐降低,最低点在95 ℃/10 min。综合考虑,85 ℃/10 min处理核桃蛋白,72 ℃/10 s处理酶解产物的热处理方式,其功能特性最佳。这是因为在此条件下,核桃蛋白和酶解产物的起泡性和乳化性均较高,且抗氧化性能相对稳定。同时,与核桃分离蛋白相比,酶解产物在多数性能指标上均有更优异的表现。
[1]YE R G, FAN Y H, MA C M, et al.Identification and enrichment of α-glucosidase-inhibiting dihydrostilbene and flavonoids from Glycyrrhiza uralensis leaves[J].J Agr Food Chem,2017,65(2):510-515.
[2]ALMEIDA I F,FRNANDES E,LIMA J L F C,et al Walnut(Juglans regia)leaf extracts are strong scavengers of pro-oxidant reactive species[J].Food Chem,2008,106(3):1014-1020.
[3]张亭,杜倩,李勇.核桃的营养成分及其保健功能的研究进展[J].中国食物与营养,2018,24(7):64-69.
[4]赵伟伟.高油核桃资源调查与油用核桃评价体系研究[D].郑州:河南农业大学,2019.
[5]张计育,王刚,王涛,等.薄壳山核桃果实性状和种仁脂肪酸含量多样性分析[J].植物资源与环境学报,2023,32(2):29-37.
[6]SOUSSI A, GARGOURI M, EL FEKI A.Potential immunomodulatory and antioxidant effects of walnut Juglans regia vegetable oil against leadmediated hepatic damage and their interaction with lipase activity in rats[J].Environ Toxicol,2018,33(12):1261-1271.
[7]MAO X Y,HUA Y F.Composition,structure and functional properties of protein concentrates and isolates produced from walnut(Juglans regia L.)[J].Int J Mol Sci,2012,13(2):1561-1581.
[8]王田利.我国核桃产业发展浅析[J].云南林业,2015,36(2):28-29.
[9]AMARAL J S,SEABRA R M,ANDRADE P B,et al.Phenolic profile in the quality control of walnut(Juglans regia L.)leaves[J].Food Chem,2004,88(3):373-379.
[10]卢俊.响应面优化核桃青皮总黄酮提取工艺及其抗氧化活性研究[J].饲料研究,2023,46(9):97-102.
[11]裴璞花,安传相,刘晓燕,等.酶解核桃蛋白制备降血压肽的工艺优化[J].食品研究与开发,2018,39(14):69-75.
[12]ANJUM S,GANI A,AHMAD M,et al.Antioxidant and antiproliferative activity of walnut extract (Juglans regia L.) processed by different methods and identification of compounds using GC/MS and LC/MS technique[J].J Food Process Preserv,2017,41(1):e12756.
[13]CHEN N,YANG H M,SUN Y,et al.Purification and identification of an-tioxidant peptides from walnut(Juglans regia L.)protein hydrolysates[J].Peptides,2012,38(2):344-349.
[14]高盼,李恒彬,陈哲,等.核桃分离蛋白的制备工艺优化及功能特性[J].中国油脂,2022,47(8):34-39.
[15]祁岩龙,孙文敏,孙俪娜.核桃粕中多肽的酶法制备工艺[J].食品工业,2019,40(5):46-50.
[16]温国琴.碱性蛋白酶水解苦荞的抗氧化活性研究[J].种子科技,2023,41(2):1-3,6.
[17]弘子姗,解静,张宝娟,等.核桃粕多肽的制备及其抗氧化活性研究[J].热带农业科学,2021,41(12):45-52.
[18]刘沛龙,刘昆仑.花生蛋白糖基化修饰及其应用的研究进展[J].河南工业大学学报(自然科学版),2023,44(5):1-9.
[19]程赞,赵晓燕,张晓伟,等.核桃分离蛋白酶解产物结构与功能的变化[J].中国油脂,2022,47(6):85-91.
[20]杨威,董志文,何东平,等.铁核桃蛋白和多肽功能特性的研究[J].粮食与油脂,2018,31(5):86-91.
[21]罗勤贵,李春娟,欧阳韶晖,等.核桃蛋白乳化性质及其影响因素效应的研究[J].安徽农业科学,2007,35(2):357-360.
[22]孔令明,李芳,宗玉霞,等.酶解条件对核桃多肽抗氧化活性的影响[J].食品研究与开发,2013,34(14):116-119.
[23]卢善善,黄挺章,李远辉,等.薏苡茎甲醇提取物的抗氧化性研究[J].中国野生植物资源,2015,34(1):12-14.
[24]赵鑫丹,郝苑汝,庞俊倩,等.核桃种仁、叶、花粉抗氧化活性及成分鉴定[J].食品工业科技,2019,40(20):54-60.
[25]罗燕,和兴萍,李雪,等.三种蛋白酶酶解核桃饼粕的抗氧化活性研究[J].中国酿造,2017,36(5):170-174.
[26]赵佳佳.3种大米蛋白肽的制备及其抗氧化活性比较[J].食品科技,2018,43(12):191-195.
[27]方川川,刘宗昭,王晓军,等.不同方法测定干红葡萄酒抗氧化性的比较分析[J].食品安全导刊,2023(12):95-98.
[28]陈留勇,孟宪军,贾薇,等.黄桃水溶性多糖的抗肿瘤作用及清除自由基、提高免疫活性研究[J].食品科学,2004,25(2):167-170.
[29]张浩华,黄梦筱,武张飞,等.香菇提取液在雪花膏工艺优化中抗氧化性的研究[J].当代化工研究,2023(8):143-145.
[30]刘玲,韩本勇,陈朝银.核桃蛋白研究进展[J].食品与发酵工业,2009,35(9):116-118.