Optimization of conditions for ethanol production from sugarcane molasses by fermentation with Saccharomyces cerevisiae cells immobilized on cotton gauze
糖蜜是一种混合物,成分复杂,含有12%果糖、葡萄糖,35%蔗糖,9.6%灰分,大量离子(约16 g/L K+、8 g/L Ca2+等)以及胶体、粗蛋白等,是我国的重要非粮食资源之一[1-2]。随着国家对非粮食资源开发利用以及绿色生物制造要求的不断提高,基于糖蜜类非粮食资源作为底物生产乙醇的生物合成技术得到了快速的发展[3]。然而,酿酒酵母(Saccharomyces cerevisiae)无法实现高含糖量甘蔗糖蜜高乙醇发酵,其根本原因有两种,一种是基于甘蔗糖蜜自身多重胁迫因素影响(外部因素);另外一种是自身代谢通路影响(内在因素)。根据ABBOTT D A等[4]提出的影响酵母细胞生长及发酵各因素的‘警戒水平’理论,在甘蔗糖蜜中生长受温度[5-7]、渗透压[8]、乙醇反馈抑制[9-10]、活性氧自由基[11-12]、高浓度离子[13-14]等诸多胁迫因素影响。本团队前期研究经过鲁棒型菌株选育以及组学验证,得出高浓度甘蔗糖蜜中同时存在的K+及Ca2+对酵母细胞的生长及活力影响是限制其高浓度甘蔗糖蜜发酵的主要胁迫因素[14]。
基于甘蔗糖蜜发酵多采用细胞固定化的方式,以提高细胞浓度、增加稳定性、提高耐受能力以及实现微生物菌体的重复利用。固定化微生物的方式主要有包埋法[15]、吸附法[16]、共价结合法以及交联法[20]等。共价结合需要严格的条件控制以及复杂的操作,交联法存在昂贵的交联试剂以及可能影响细胞活力等弊端[20],包埋法虽然目前应用比较成熟,但是前期准备复杂,步骤繁琐,耗时长。与包埋法相比,吸附法避免化学试剂处理,可以得到活力更高的菌。可用作吸附细胞进行固定化的材料还有甘蔗渣[17]、薄壳丝茧[18]、风化煤[19]以及纱布等。其中纱布的获取较为廉价和便捷。由于其具有多孔结构,有利于代谢产物和底物的扩散而被关注和利用。全向春等[20]采用纱布--聚乙烯醇(polyvinyl alcohol,PVA)复合载体对皮氏伯克霍尔德氏菌进行固定化以增强对有毒害作用的喹啉降解。刘姗姗等[21]利用纱布进行细胞固定化以提高微生物对苯酚的降解能力。目前关于纱布吸附技术用于酿酒酵母发酵高含糖量甘蔗糖蜜研究鲜见报道。
为了获得高效便捷的纱布固定酿酒酵母细胞技术以提高甘蔗糖蜜发酵生产乙醇效率,该研究采用纱布固定酿酒酵母(S.cerevisiae)GJ08细胞,将其种子液接种至甘蔗糖蜜中进行发酵生产乙醇,并考察接种量、培养时间、纱布大小及用量、通气量等影响因素对乙醇产量的影响。旨在提高纱布固定酿酒酵母细胞发酵甘蔗糖蜜生产乙醇产量,为高效利用甘蔗糖蜜提供科学依据。
1.1.1 原料与菌株
甘蔗糖蜜:广西糖业集团有限公司;酿酒酵母(Saccharomyces cerevisiae)GJ08(酿酒酵母S288C衍生菌):广西科技大学发酵工程研究所保藏。
1.1.2 培养基
种子培养基:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,琼脂粉20 g/L,pH自然;液体种子培养基中不添加琼脂。
甘蔗糖蜜发酵培养基:甘蔗糖蜜(糖蜜预处理流程按照文献[14],其可发酵总糖为250 g/L),尿素2.2 g/L,蛋白胨0.1%,pH 4.5~5.0。
以上培养基于105 ℃高压蒸汽灭菌15 min。
L2000高效液相色谱仪:日立科学仪器有限公司;456GC气相色谱仪:天美创科仪器有限公司;BX43F显微镜:奥林巴斯(中国)有限公司;LZB-3WB玻璃转子流量计(25~250 mL/min)、BIOSTATB25L全自动发酵罐:德国Sartorius公司;纱布(空隙30 mm×23 mm):华晨纺织品有限公司;FY-100L反压式高压灭菌锅:青岛聚创世纪环保科技有限公司。
1.3.1 甘蔗糖蜜发酵产乙醇基础条件
挑取酿酒酵母GJ08单菌落,接种至装液量为100 mL/250 mL液体种子培养基中,在摇床200 r/min、30 ℃条件下振荡培养12 h。4 000 r/min条件下离心10 min后加入原培养体积1/10的无菌水混匀后将菌液(约6×108 CFU/mL)以10%(V/V)接种量接种至装液量为100 mL/250 mL液体种子培养基,在摇床200 r/min、30 ℃条件下振荡培养12 h后以10%(V/V)接种量接种至装液量为100 mL/250 mL甘蔗糖蜜发酵培养基(放置纱布大小2 cm×2 cm,用量10 g/L),通过玻璃转子流量计控制通气量(80 mL/min),在200 r/min、30 ℃条件下连续发酵72 h测定乙醇含量。
1.3.2 甘蔗糖蜜发酵产乙醇条件优化
采用单因素轮换法分别考察种子液接种量(10.0%、12.5%、15.0%、17.5%、20.0%、22.5%)、培养时间(8 h、10 h、12 h、14 h)、纱布大小(1 cm×1 cm,2 cm×2 cm,3 cm×3 cm,4 cm×4 cm,5 cm×5 cm)及纱布用量(5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)及通气量(40 mL/min、60 mL/min、80 mL/min、100 mL/min、120 mL/min)对乙醇含量的影响。
1.3.3 生长曲线测定及显微镜观察
取酿酒酵母GJ08单菌落,接种至装液量为100mL/250mL液体种子培养基中,在摇床200 r/min、30 ℃条件下培养12 h后接种至装液量为100 mL/250 mL液体种子培养基,在摇床200 r/min、30 ℃条件下连续培养24 h,每隔2 h取样并于波长600 nm条件下测定吸光度值,绘制生长曲线。
活化后酿酒酵母GJ08于培养时间10 h、接种量17.5%,纱布大小1cm×1cm、纱布用量15g/L及装液量为100 mL/250 mL甘蔗糖蜜发酵培养基中连续发酵,分别取6 h、12 h以及36 h发酵罐内样品为处理组,以未添加纱布,于甘蔗糖蜜培养基中连续发酵36 h的菌株作为对照,采用纱布固定酿酒酵母GJ08细胞,并采用显微镜观察纱布固定酿酒酵母GJ08细胞前后的形态。
1.3.4 发酵罐发酵实验
活化后酿酒酵母GJ08于培养时间10 h、接种量17.5%,纱布大小1 cm×1 cm、纱布用量15 g/L及装液量3 L/5 L甘蔗糖蜜发酵培养基中,在150 r/min、30 ℃、通气量100 mL/min条件下发酵罐发酵72 h。每隔12 h取样一次测定酵母细胞数、残糖量、乙醇产量。
1.3.5 分析检测
乙醇含量的检测采用气相色谱法。吸取1 mL待测发酵液离心(12 000 r/min、5 min),取上清液1 μL注入气相色谱仪中,测定条件为:入口温度200 ℃、流速1 mL/min,烘箱温度40 ℃持续0 s、温度40~80 ℃持续5 min、温度80~150 ℃持续10 min,载气为高纯氮气(N2)。
总糖(葡萄糖、果糖、蔗糖)含量的检测采用液相色谱法。配制一定梯度浓度的葡萄糖、果糖、蔗糖标准品溶液,吸取1 mL待测发酵液,离心(12 000 r/min、5 min)后取上清液10 μL注入液相色谱仪中。液相色谱检测条件:Alltima Amino色谱柱(5 μm,250 mm×4.6 mm),柱温30 ℃,乙腈∶超纯水=75∶25(V/V)作为流动相;流速为1 mL/min。
残糖量、糖醇转化率计算公式如下:
式中:O为残糖量,g/L;X为葡萄糖含量,g/L;Y为果糖含量,g/L;Z为蔗糖含量,g/L。
式中:y为糖醇转化率,%;x为乙醇含量,g/L;TFS为可发酵总糖含量,g/L;RS为残糖含量,g/L。
酵母细胞数测定采用血球计数板计数,其计算公式如下:
式中:y为酵母细胞数,个/mL;z为5个小计数室细胞数,个/mL;A为稀释倍数。
1.3.6 数据分析
使用OriginPro(version 9.1)软件包绘图,采用单向方差分析和Tukey检验来确定显著差异。
2.1.1 接种量及种子培养时间的确定
接种量及种子培养时间对乙醇产量的影响见图1。由图1A可知,随着接种量在10.0%~17.5%范围内的增加,乙醇产量逐渐增加;当接种量为17.5%时,乙醇产量达到最高值,为79.65 g/L;当接种量>17.5%之后,乙醇产量逐渐下降。因此,确定最佳接种量为17.5%。由图1B可知,当种子培养时间在8~10 h范围内的增加,乙醇产量逐渐增加;当种子培养时间为10 h时,乙醇产量达到最高(80.34 g/L);当种子培养时间>10 h之后,乙醇产量逐渐下降。因此,确定最佳接种量及种子培养时间分别为17.5%、10 h。
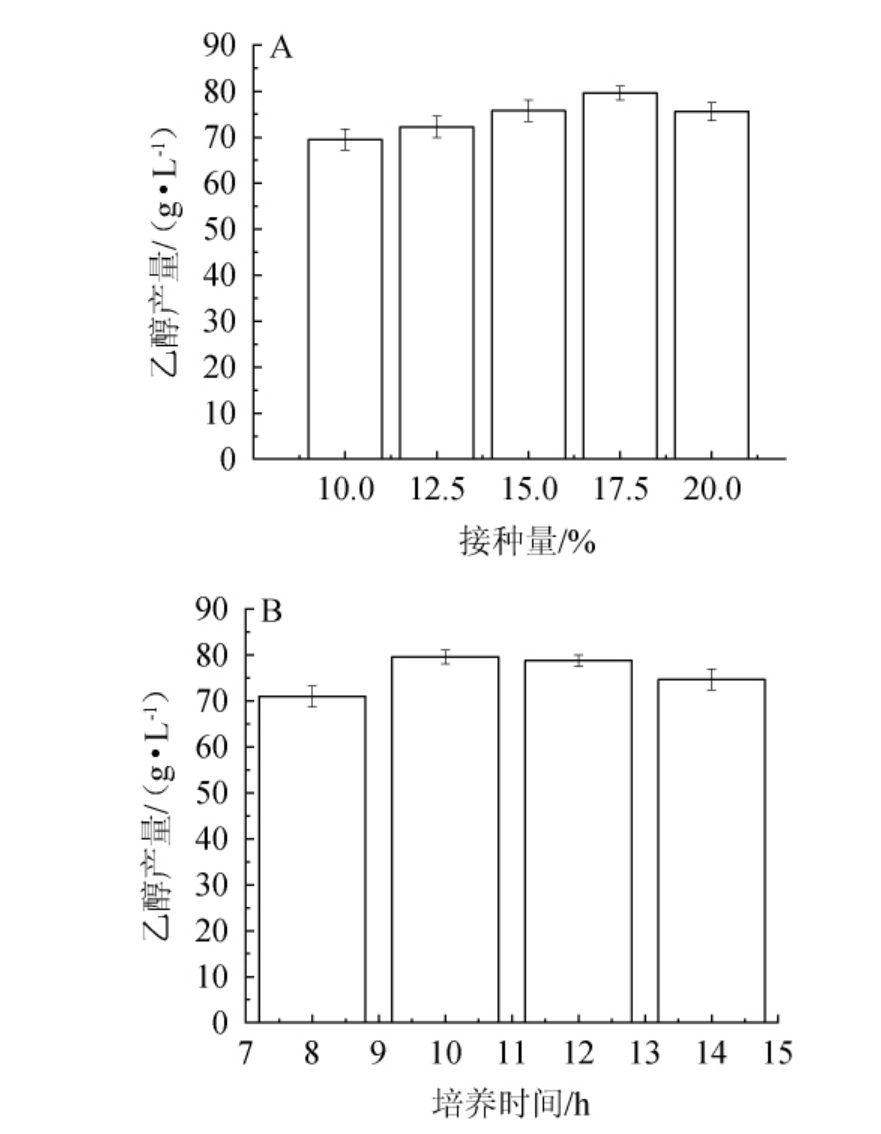
图1 接种量(A)及种子培养时间(B)对乙醇产量的影响
Fig.1 Effect of inoculum (A) and seed culture time (B) on ethanol yield
2.1.2 酿酒酵母GJ08生长曲线
酿酒酵母GJ08生长曲线见图2。由图2可知,酿酒酵母GJ08生长曲线呈现“S”型,经过4 h的停滞期后进入对数生长期(4~12 h),并于12 h后进入稳定期。因此,酿酒酵母GJ08种子液在高含糖量甘蔗糖蜜中培养12 h后适应性较好。
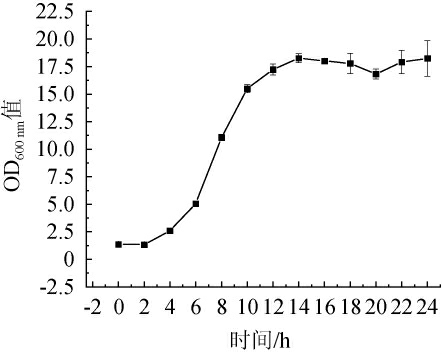
图2 酿酒酵母GJ08生长曲线
Fig.2 Growth curve of Saccharomyces cerevisiae GJ08
2.2.1 最适纱布大小及用量确定
纱布大小及用量对乙醇产量的影响见图3。由图3A可知,当纱布大小为1 cm×1 cm时,乙醇产量最高,达95.09 g/L,相比较未经纱布固定的细胞,乙醇产量提高了19.38%;继续增加纱布大小,乙醇产量降低;由图1B可知,随着纱布用量在0~15 g/L范围内的增加;乙醇产量逐渐增加;当纱布用量为15 g/L时,乙醇产量达最高值,为95.09 g/L;当纱布用量>15 g/L时,乙醇产量逐渐降低。因此,确定最佳纱布大小及用量分别为1 cm×1 cm、15 g/L。
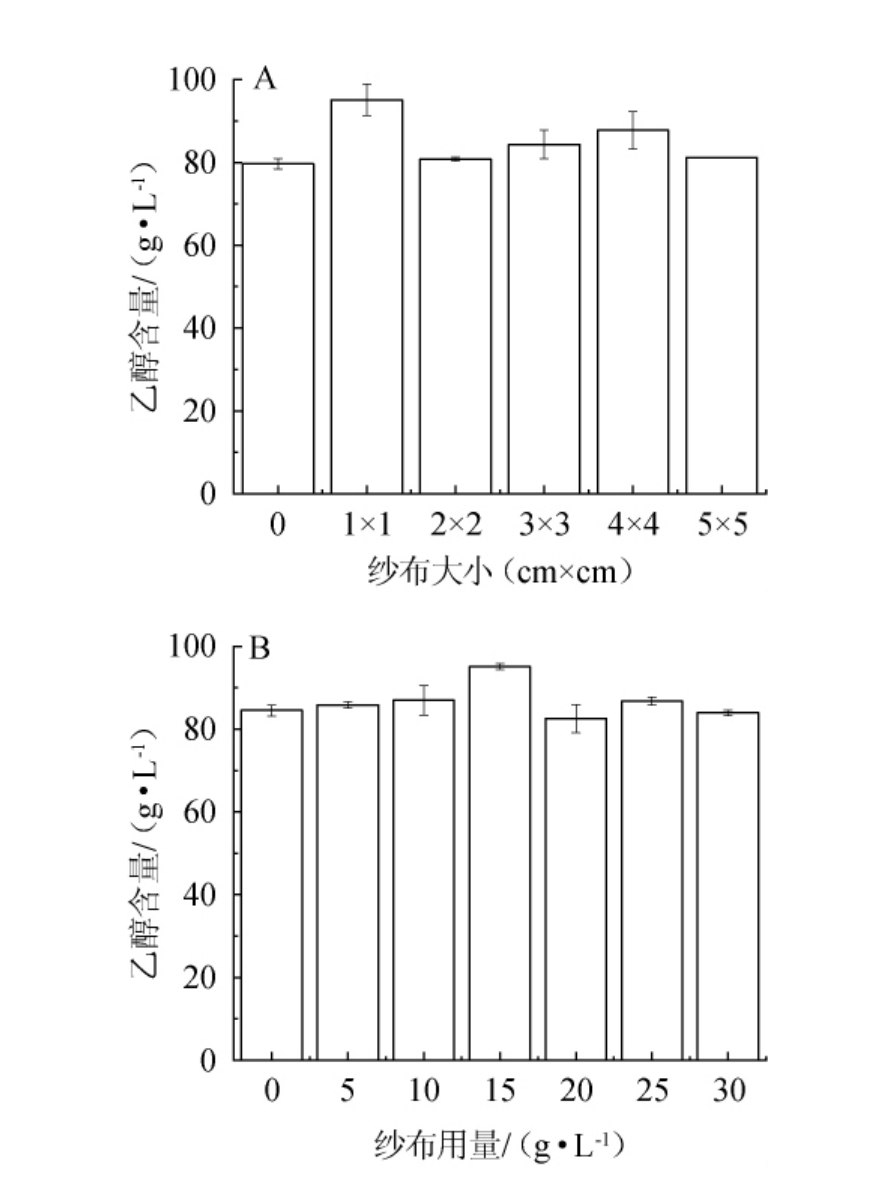
图3 纱布大小(A)及用量(B)对乙醇产量的影响
Fig.3 Effect of gauze size and amount on ethanol yield
2.2.2 显微镜观察纱布固定酿酒酵母GJ08
纱布固定酿酒酵母GJ08细胞前、后显微形态见图4。由图4A可知,未固定的酿酒酵母GJ08细胞在培养后期出现大量死亡现象。由图4B可知,经过纱布固定的酿酒酵母GJ08细胞,经过‘附着-聚集-增殖’过程,细胞形态偏大、较为饱满。
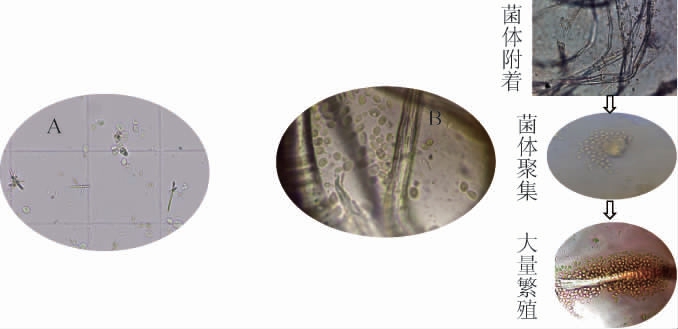
图4 纱布固定酿酒酵母GJ08细胞前(A)、后(B)显微形态
Fig.4 Micromorphology of Saccharomyces cerevisiae GJ08 cells before (A) and after (B) immobilization on cotton gauze
通气量对乙醇产量的影响见图5。
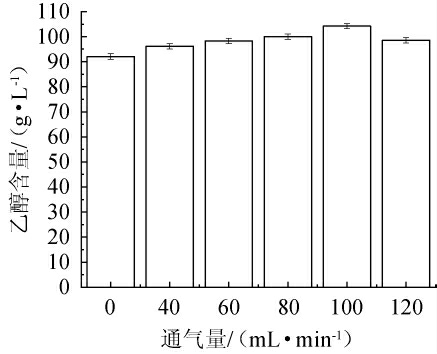
图5 通气量对乙醇产量的影响
Fig.5 Effect of ventilation volume on ethanol yield
由图5可知,随着通气量在0~100 mL/min范围内的增加,乙醇产量逐渐增加;当通气量为100 mL/min时,乙醇产量达到最高值,为104.22 g/L,相比较未通氧情况提高了13%,此时发酵罐内游离的细胞数达到了3.80×107个/mL,是未通氧情况下的3.23倍,残糖量也由未通氧情况下的18.60 g/L降至25.42 g/L。通气量降低或者升高,乙醇产量都呈现下降趋势,其原因可能是,有氧呼吸经由线粒体会产生大量的腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)对糖酵解途径以及限速酶产生影响,所以乙醇发酵常规是进行厌氧发酵。但是严格的厌氧环境下酿酒酵母细胞生长相对缓慢,并不利于细胞抵抗乙醇的反馈影响[22-24]。固定在纱布上的酵母细胞继续增殖达到纱布所承载的最大限度后,部分酵母细胞会同未固定化的酵母细胞一样游离于发酵罐内,游离的细胞数可以侧面的说明细胞生长情况,由此可知,微通氧情况下细胞的快速生长是提高乙醇产量的原因之一。在微通氧条件下,虽然乙醇产量得到了快速的提高,但是发酵罐内的糖醇转化率(90.8%)并没有高于未通氧条件(91.22%),其原因可能是部分糖分被微生物生长利用。此外,有氧条件下会促进酵母细胞不饱和脂肪酸及甾醇的合成,促进其对乙醇的外排,减少乙醇对细胞生长的抑制作用[24]。因此,确定最佳通气量为100 mL/min。
纱布固定酿酒酵母GJ08细胞发酵甘蔗糖蜜产乙醇过程中残糖量、乙醇浓度及细胞数的变化见图6。由图6可知,发酵罐中的残糖量呈现逐渐降低趋势;当发酵时间为0~36 h,乙醇含量迅速增高,当发酵时间>36 h,乙醇浓度缓慢增加,发酵时间为36 h时,乙醇质量浓度产量达104.22 g/L,提高了30.85%。当发酵时间为0~24 h,游离细胞数迅速增加,当发酵时间>24 h,游离细胞数下降。残糖量在发酵48 h内迅速下降至29.75 g/L。残糖量的递减以及乙醇含量的递增是由于发酵液中糖分消耗以及乙醇积累所致。游离细胞数先升高再降低是由于游离的细胞无法抵御高含糖量甘蔗糖蜜中诸多胁迫因素的影响,细胞大量死亡所致。非固定化情况下,乙醇的产量与细胞的生长是生长偶联型[25-26],而该研究中发酵罐内的游离细胞数不再与产量相偶联,在经过固定化及微通氧技术的加持下,纱布上的酵母细胞依然保持较高的活力以促进乙醇的合成,从而打破高含糖量甘蔗糖蜜的限制。
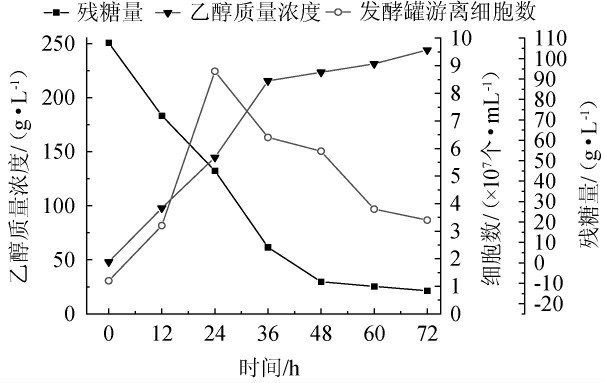
图6 纱布固定酿酒酵母GJ08细胞发酵甘蔗糖蜜产乙醇过程中残糖量、乙醇浓度及细胞数的变化
Fig.6 Changes of residual sugar contents, ethanol concentration and cell number of ethanol production from sugarcane molasses during fermentation process with Saccharomyces cerevisiae GJ08 immobilized on cotton gauze
本研究采用纱布固定酿酒酵母(S.cerevisiae)GJ08细胞,将其种子液接种至甘蔗糖蜜中进行发酵生产乙醇,并考察接种量、培养时间、纱布大小及用量、通气量等影响因素对乙醇产量的影响。结果表明,纱布固定酿酒酵母细胞发酵甘蔗糖蜜生产乙醇的最佳条件为:接种量17.5%、培养时间10 h、纱布大小1 cm×1 cm、纱布用量15 g/L、通气量100 mL/min。在此优化条件下,乙醇产量为104.22 g/L,比优化前提高了30.85%。本研究为以甘蔗糖蜜为底物发酵产乙醇奠定基础,为胁迫环境下固定化细胞新方法提供参考。
[1]ZHANG S H, WANG J J, JIANG H.Microbial production of valueadded bioproducts and enzymes from molasses,a by-product of sugar industry[J].Food Chem,2021,346:128860.
[2]李俊生,徐嘉伦,马娜,等.甘蔗糖蜜酒精废液的回收利用研究进展[J].现代化工,2022,42(7):79-83.
[3]WANG W Y,WU S H,XIE Y H,et al.A high-throughput screening procedure(Py-Fe3+) for enhancing ethanol production by Saccharomyces cerevisiae using ARTP random mutagenesis[J].Processes,2022,10(11):2186.
[4]ABBOTT D A, INGLEDEW W M.Buffering capacity of whole corn mash alters concentrations of organic acids required to inhibit growth of Saccharomyces cerevisiae and ethanol production[J].Biotechnol Lett,2004,26(16):1313-1316.
[5]DE ANDRADE R R, RIVERA E C, COSTA A C, et al.Estimation of temperature dependent parameters of a batch alcoholic fermentation process[J].Appl Biochem Biotechnol,2007:753-763.
[6]KHATUN M,YU X S,KONDO A,et al.Improved ethanol production at high temperature by consolidated bioprocessing using Saccharomyces cerevisiae strain engineered with artificial zinc finger protein[J].Bioresource Technol,2017,245:1447-1454.
[7]刘安,王丹阳,王振,等.高耐受性酿酒酵母的适应性驯化选育与发酵[J].微生物学通报,2024,51(3):1018-1032.
[8]王赟,袁嫒,李晨豪,等.酿酒酵母转录因子Ask10p的研究进展[J].齐鲁工业大学学报,2024,38(2):57-61.
[9]HOEK J B, RUBIN E.Alcohol and membrane-associated signal transduction alcohol[J].Alcohol Alcoholism,1990,25(2-3):143-156.
[10]李娜,李莹,孙悦.酿酒酵母乙醇代谢调控机制及低产乙醇菌株选育方法研究进展[J].食品与发酵工业,2024,50(15):315-323.
[11]QIN L, DONG S X, YU J, et al.Stress-driven dynamic regulation of multiple tolerance genes improves robustness and productive capacity of Saccharomyces cerevisiae in industrial lignocellulose fermentation[J].Metab Eng,2020,61:160-170.
[12]徐晓丹,潘宇,柯尊丽,等.高糖胁迫下槲皮素对酿酒酵母胞内损伤的保护作用与机制[J].食品科学,2017,38(12):63-68.
[13]CHOTINEERANAT S,WANSUKSRI R,PIYACHOMKWAN K,et al.Effect of calcium ions on ethanol production from molasses by Saccharomyces cerevisiae[J].Sugar Technol,2010,12:120-124.
[14]WANG W Y,WANG B P,SU H S,et al.Key role of K+and Ca2+in highyield ethanol production by S.cerevisiaefrom concentrated sugarcane molasses[J].Microb Cell Fact,2024,23:123.
[15]NAJAFPOUR G,YOUNESI H,ISMAIL K S K.Ethanol fermentation in an immobilized cell reactor using Saccharomyces cerevisiae[J].Bioresource Technol,2004,92(3):251-260.
[16]郑华楠.芦苇生物炭基质改善固定化微生物技术去除水体中氨氮的研究[D].上海:华东理工大学,2024.
[17]郑超群,何炯灵,谢广发,等.固定化醋酸菌发酵制备果香型米醋[J].中国食品学报,2023,23(5):184-192.
[18]CHEN Y,LIU Q G,ZHOU T,et al.Ethanol production by repeated batch and continuous fermentations by Saccharomyces cerevisiae immobilized in a fibrous bed bioreactor[J].World J Microbiol Biotechnol,2013,23(4):511-517.
[19]焦子乐,李建华,陈潇晶,等.风化煤固定化微生物材料对铅的吸附特性及机理[J].山西农业科学,2024,52(1):94-100.
[20]全向春,韩力平,王建龙,等.固定化皮氏伯克霍而德氏菌降解喹啉的研究[J].环境科学,2000,21(3):74-76.
[21]刘姗姗,刘永军,黎兵.固定化活细胞苯酚生物降解特性研究[J].水处理技术,2012,38(9):30-33,37.
[22]MARLÈNE C,MARIE-ODILE L,JEAN F,et al.Physiological behaviour of Saccharomyces cerevisiae in aerated fed-batch fermentation for high level production of bioethanol[J].FEMS Yeast Res,2007,7(1):22-32.
[23]ALFENORE S,CAMELEYRE X,BENBADIS L,et al.Aeration strategy:a need for very high ethanol performance in Saccharomyces cerevisiae fed-batch process[J].Appl Microbiol Biotechnol,2004,63:537-542.
[24]HOPPE G K,HANSFORD G S.The effect of micro-aerobic conditions on continuous ethanol production by Saccharomyces cerevisiae[J].Biotechnol Lett,1984,6:681-686.
[25]DOMBEK K M, INGRAM L O.Ethanol production during batch fermentation with Saccharomyces cerevisiae:changes in glycolytic enzymes and internal pH[J].Appl Environ Microbiol,1987,53(6):1286-1291.
[26]CASEY G P,INGLEDEW W M M.Ethanol tolerance in yeasts[J].Crit Rev Microbiol,1986,13(3):219-280.