表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation condition optimization
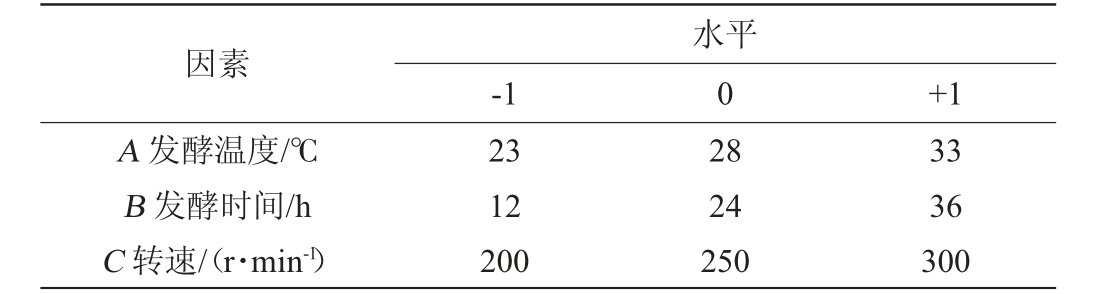
因素A 发酵温度/℃B 发酵时间/h C 转速/(r·min-1)-1水平0+1 23 12 200 28 24 250 33 36 300
Optimization of fermentation conditions for 2,3-butanediol production from Helianthus tuberosus hydrolysate by Raoultella ornithinolytica
2,3-丁二醇被被认为是潜在的C4平台化合物,能够应用于医药、食品、材料和化工能源等工业领域[1-3]。与化学法合成2,3-丁二醇相比,生物法符合物质循环利用与环境友好的发展理念[4-5]。因而,微生物发酵产2,3-丁二醇成为近年的研究热点。目前,已报道的2,3-丁二醇生产菌株主要有芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、弧菌属(Vibrio)、类芽孢杆菌属(Paenibacillus)和克雷伯菌属(Klebsiella)等[6-8]。已报道的菌株具有高效转化六碳糖和五碳糖生成2,3-丁二醇的能力,但以单糖为碳源生成2,3-丁二醇的成本较高,以木质纤维素为原料时,需要预处理水解大分子的纤维素和半纤维素为单糖和脱除水解液中抑制微生物生长的杂质[9-10]。因而,以易水解淀粉类的生物质资源受到青睐,NARISETTY V等[11]利用路氏肠杆菌(Enterobacter ludwigii)发酵面包废弃物的酸水解液和酶水解液,2,3-丁二醇产量分别可达135.4g/L、135.4g/L,最大产率分别为0.42g/g、0.48 g/g。以上结果可知,利用淀粉类资源进行2,3-丁二醇生成存在较大优势,但如果以粮食类为原料,会存在“与人类争粮”的问题。因此,寻找淀粉含量高的“非粮”资源成为当前急需解决问题之一。
菊芋(Helianthus tuberosus)又名洋姜、鬼子姜等,碳水化合物含量可达鲜质量的15%~20%,其水解产物主要单糖为果糖和葡萄糖[12],被认为是一种理想的生物基能源炼制原料。目前,已有较多以菊芋及水解液为碳源进行发酵产生物能源和有机酸等高附加值化学品的报道,如拜耳结合酵母(Zygosaccharomyces bailii)发酵产乙醇[13],梭菌(Clostridium sp.)strain NJ4发酵产丁醇[14]和肺炎克雷伯菌(Klebsiella pneumoniae)发酵产2,3-丁二醇和乙偶姻[15]。本课题组前期通过定向筛选得到一株能够利用多种单糖代谢合成主产物为2,3-丁二醇和副产物为乙偶姻、乳酸、乙醇和丁二酸的细菌—解鸟氨酸拉乌尔菌(Raoultella ornithinolytica)[16]。然而,目前尚未见到关于该菌利用菊芋水解液发酵产2,3-丁二醇的报道。
本研究以菊芋水解液为原料,以解鸟氨酸拉乌尔菌(Raoultella ornithinolytica)TH-21为菌种发酵制备2,3-丁二醇。以2,3-丁二醇产量为响应值,并利用单因素试验和响应面试验对其发酵条件进行优化。以期为菊芋水解液工业化发酵生产2,3-丁二醇提供理论依据,促进菊芋的能源化开发及高值化利用。
1.1.1 材料
解鸟氨酸拉乌尔菌(Raoultella ornithinolytica)TH-21(编号为MT299723.1):为本课题组分离保藏。新鲜菊芋:购买于贵州省黔南州都匀农贸市场。
1.1.2 化学试剂
2,3-丁二醇、乙偶姻(均为色谱纯):国药集团化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、酒石酸钾钠、苯酚、氢氧化钠(均为分析纯):上海麦克林生物科技有限公司。
1.1.3 培养基
LB液体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
发酵培养基:碳源50 g,酵母提取物9 g,KH2PO4 6 g,K2HPO4 14 g,柠檬酸钠4 g,乙酸钠4 g,MgSO4 0.4 g,CaCl2 0.05 g,FeSO4 0.001 g,CuSO4 0.001 g,ZnSO4 0.001 g,MnSO4 0.001,蒸馏水1 000 mL,初始pH 7.0,121 ℃高压蒸汽灭菌20 min。
TU-1901双光束紫外可见分光光度计:北京普析仪器有限公司;7890A安捷伦气相色谱仪:美国安捷伦科技有限公司;TS-200DC立式恒温振荡器:上海天呈实验仪器制造有限公司;LYO-15真空冷冻干燥机:北京博医康实验仪器有限公司。
1.3.1 菊芋水解液的制备
菊芋水解液的制备:将菊芋洗净泥土、切片后,置于冷冻干燥机中干燥至恒质量,干燥的菊芋片用小型粉碎机粉碎,过100目筛。将菊芋粉与蒸馏水按固液比为1∶10(g∶mL)加水混匀后,用0.1 mol/L H2SO4溶液将混合物pH调节为2.0,加热煮至沸腾,保持沸腾状态1 h,冷却后,真空抽滤得到菊芋水解液;用0.1 mol/L NaOH溶液调节水解液pH至7.0,然后在真空冷冻干燥机中浓缩菊芋水解液,得到浓缩液用蒸馏水稀释至还原糖质量浓度为50 g/L,储存至冰箱,备用。
1.3.2 菊芋水解液发酵
挑取活化的Raoultella ornithinolytica TH-21菌株接种于LB液体培养基中,置于温度30 ℃、转速200 r/min的条件下培养12 h;将培养后的菌液(OD600nm值=1.0)以2%的接种量接种至发酵培养基中,在温度30 ℃、转速200 r/min的条件下发酵48 h,产2,3-丁二醇。
1.3.3 发酵条件优化
(1)单因素试验
在菊芋水解液发酵基础条件下,分别考察发酵时间(12 h、24 h、36 h、48 h)、转速(150 r/min、200 r/min、250 r/min、300 r/min)、发酵温度(23 ℃、28 ℃、33 ℃、38 ℃)、酵母粉提取物质量浓度(9 g/L、12 g/L、15 g/L、18 g/L)对2,3-丁二醇产量的影响。
(2)响应面试验
以单因素试验结果为基础,从中筛选出对2,3-丁二醇产量影响较显著的因素,以发酵温度(A)、发酵时间(B)和转速(C)为自变量,2,3-丁二醇质量浓度(Y)为响应值,然后利用Design-Expert 13.0软件中Box-Behnken试验设计优化发酵条件,发酵条件优化响应面试验因素与水平见表1。
表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation condition optimization

因素A 发酵温度/℃B 发酵时间/h C 转速/(r·min-1)-1水平0+1 23 12 200 28 24 250 33 36 300
1.3.4 分析检测
还原糖质量浓度测定:依据参考文献中的DNS法测定还原糖质量浓度[17]。2,3-丁二醇和乙偶姻质量浓度测定:气相色谱法[16]。
1.3.5 发酵验证试验
将菌株Raoultella ornithinolytica TH-21活化液(OD600 nm值=1.0)以2%的接种量接种于酵母提取物质量浓度为12 g/L的发酵培养基中,在优化后的条件下发酵48 h,并分别在12 h、25 h、36 h、48 h进行取样,取2 mL不同发酵时间点的发酵液离心(4 ℃、10 000 r/min)5 min后取上清液,再经0.22 μm滤膜过滤后,收集滤液用于后续测定发酵液中的还原糖、2,3-丁二醇和乙偶姻质量浓度。
1.3.6 数据处理
本研究使用Origin 2021软件进行数据整理分析和作图,用Design-Expert 13.0软件进行响应面试验设计和方差分析,每个试验均重复3次并取平均值。
2.1.1 发酵温度的确定
发酵温度对2,3-丁二醇产量的影响见图1。由图1可知,当发酵温度在23~28 ℃范围内增加,2,3-丁二醇质量浓度呈增加趋势;当发酵温度为28 ℃时,2,3-丁二醇质量浓度达到最大值,为15.02 g/L,当发酵温度>28 ℃之后,2,3-丁二醇质量浓度下降。因此,确定最佳发酵温度为28 ℃。
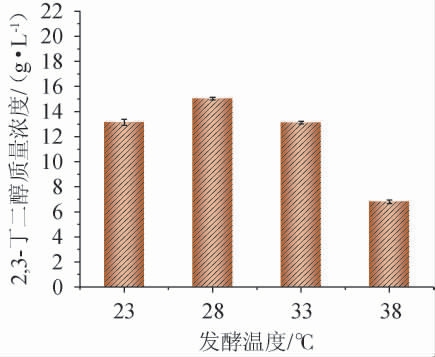
图1 发酵温度对2,3-丁二醇质量浓度的影响
Fig.1 Effect of fermentation temperature on 2,3-butanediol mass concentration
2.1.2 发酵时间的确定
发酵时间对2,3-丁二醇产量的影响见图2。由图2可知,当发酵时间为12~24 h时,2,3-丁二醇质量浓度呈增加趋势;当发酵时间为24 h时,2,3-丁二醇质量浓度达到最大值,为15.65 g/L;但当发酵时间>24 h之后,2,3-丁二醇质量浓度开始出现降低趋势。因此,确定最佳发酵时间为24 h。
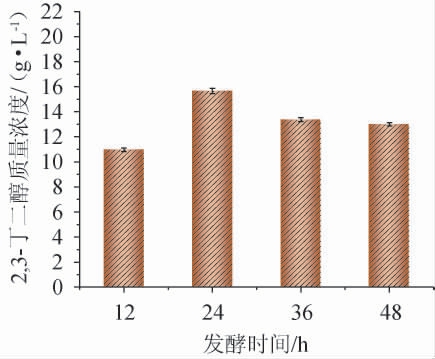
图2 发酵时间对2,3-丁二醇质量浓度的影响
Fig.2 Effect of fermentation time on 2,3-butanediol mass concentration
2.1.3 转速的确定
微生物合成2,3-丁二醇过程中培养液的溶氧量,对其产量影响显著[18]。转速对2,3-丁二醇产量的影响见图3。由图3可知,转速为150~250 r/min时,2,3-丁二醇产量逐渐增加;当转速为250 r/min时,2,3-丁二醇质量浓度为16.13 g/L;当转速>250 r/min之后,2,3-丁二醇产量开始下降。因此,确定最佳转速为250 r/min。
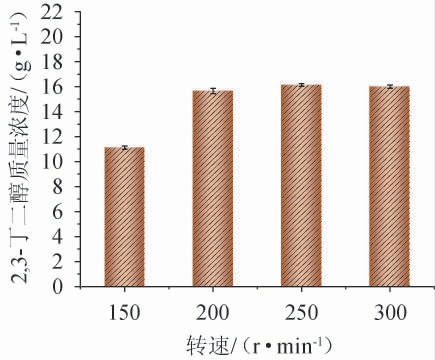
图3 转速对2,3-丁二醇质量浓度的影响
Fig.3 Effect of rotation rate on 2,3-butanediol mass concentrationn
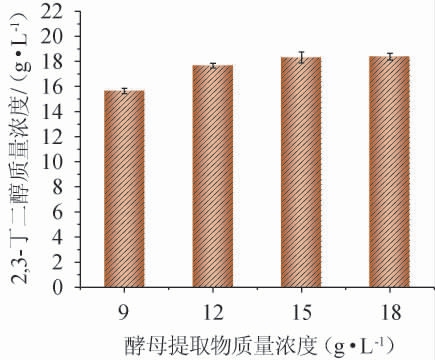
图4 酵母提取物质量浓度对2,3-丁二醇质量浓度的影响
Fig.4 Effect of yeast extract mass concentration on 2,3-butanediol mass concentration
2.1.4 酵母提取物质量浓度的确定
酵母提取物含有矿物质和信号肽,可为微生物提供较丰富的营养物质[19-20]。酵母提取物质量浓度对2,3-丁二醇产量的影响见图5。由图5可知,随着酵母提取物质量浓度在9~12 g/L范围内的增加,2,3-丁二醇呈现增加趋势;当酵母提取物质量浓度为12 g/L时,2,3-丁二醇产量为17.66 g/L;但当酵母提取物质量浓度>12 g/L之后,2,3-丁二醇产量变化趋于平稳。因此,确定酵母提取物质量浓度为12 g/L。
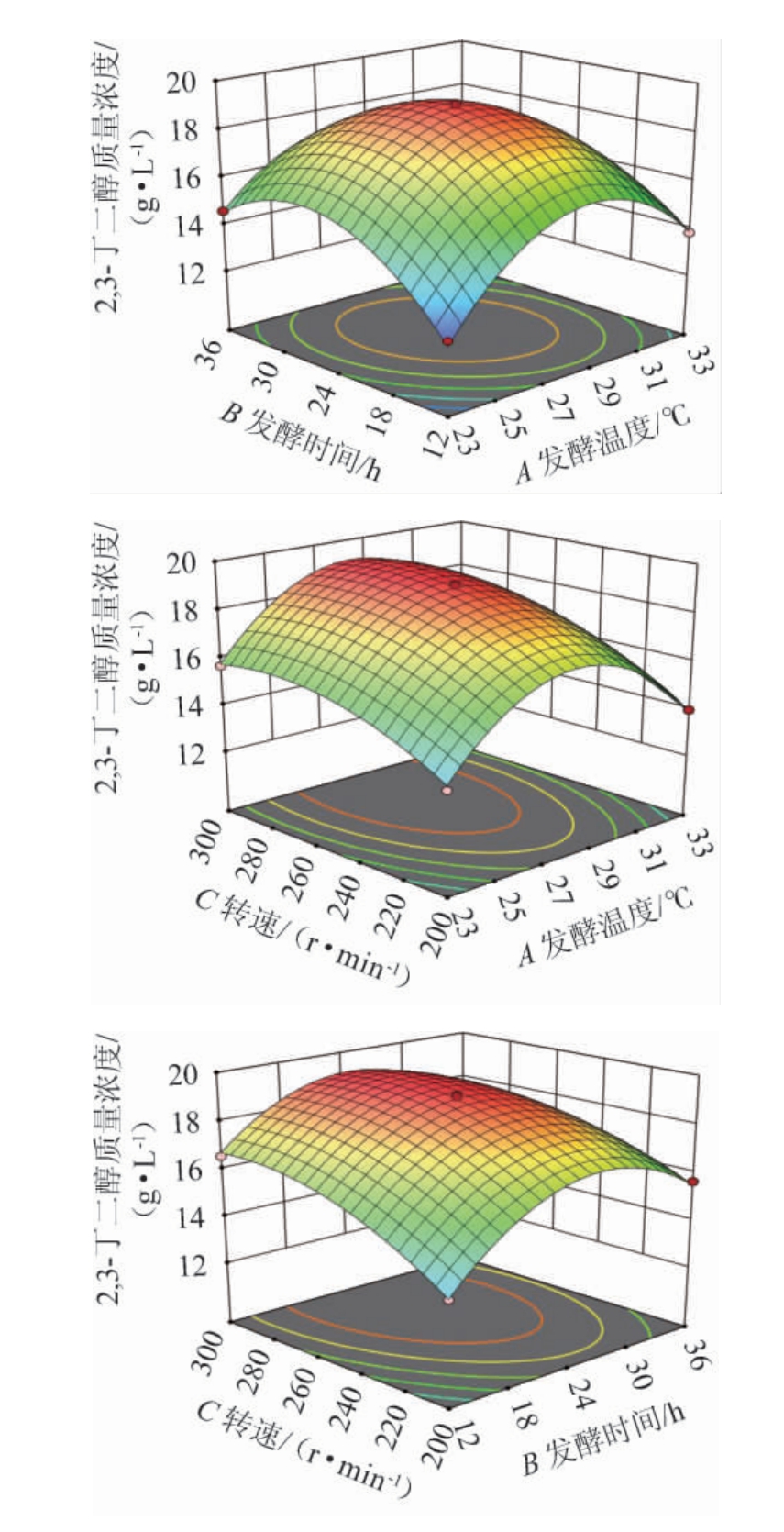
图5 发酵温度、发酵时间和转速间交互作用对2,3-丁二醇质量浓度影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effect of interaction between fermentation temperature,fermentation time and rotation rate on 2,3-butanediol mass concentration
以单因素试验结果为基础,从中筛选出对2,3-丁二醇产量影响较显著的因素,以发酵温度(A)、发酵时间(B)和转速(C)为自变量,2,3-丁二醇质量浓度(Y)为响应值,然后利用Design-Expert 13.0软件中Box-Behnken试验设计优化发酵条件,发酵条件优化响应面试验设计及结果见表2。方差分析见表3。
表2 发酵条件优化Box-Behnken响应面试验设计及结果
Table 2 Design and results of Box-Behnken response surface tests
for fermentation conditions optimization
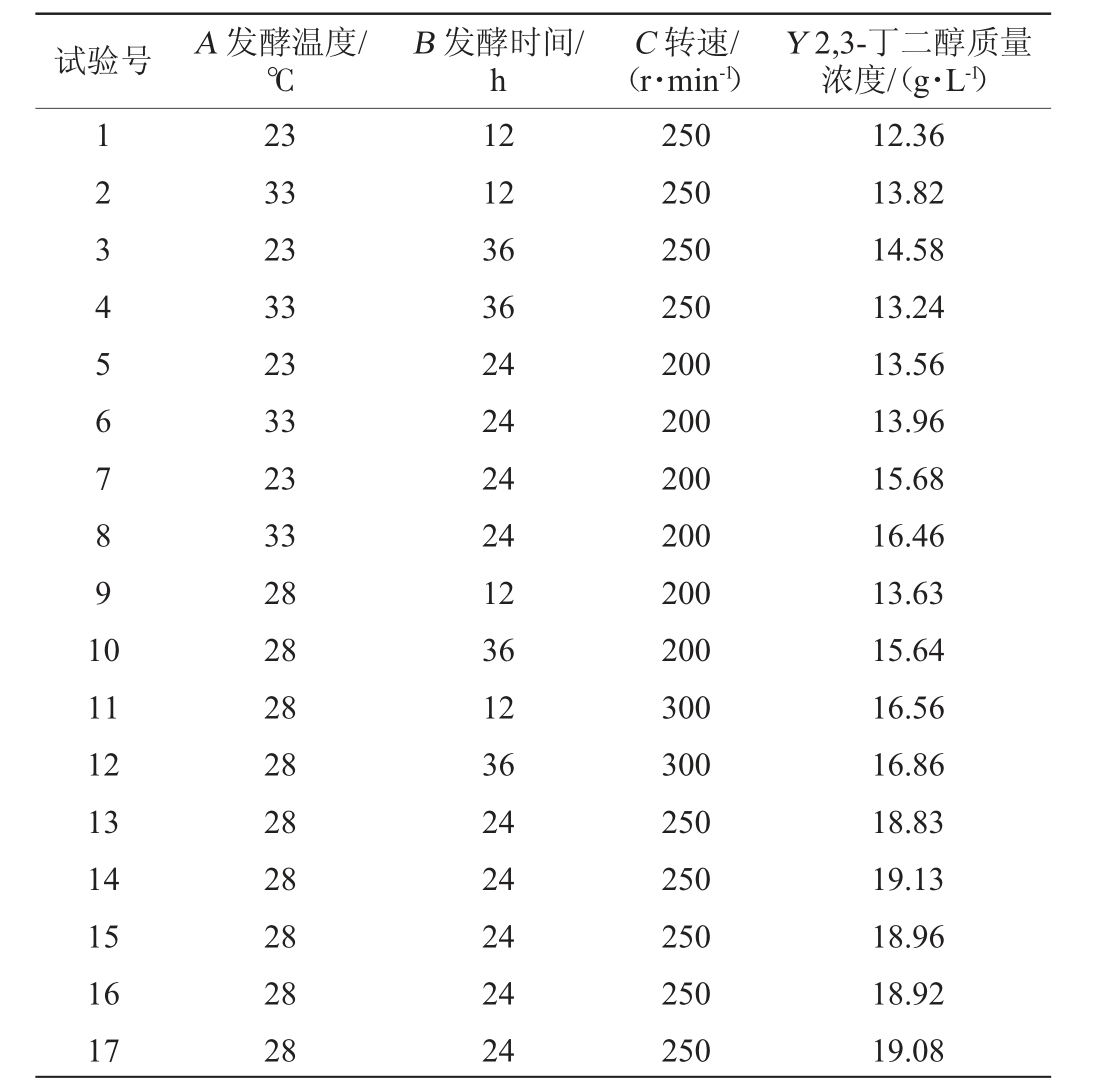
试验号 A 发酵温度/℃B 发酵时间/h C 转速/(r·min-1)Y 2,3-丁二醇质量浓度/(g·L-1)1234567891 0 11 12 13 14 15 16 17 23 33 23 33 23 33 23 33 28 28 28 28 28 28 28 28 28 12 12 36 36 24 24 24 24 12 36 12 36 24 24 24 24 24 250 250 250 250 200 200 200 200 200 200 300 300 250 250 250 250 250 12.36 13.82 14.58 13.24 13.56 13.96 15.68 16.46 13.63 15.64 16.56 16.86 18.83 19.13 18.96 18.92 19.08
表3 回归模型方差分析
Table 3 Variance analysis of regression model
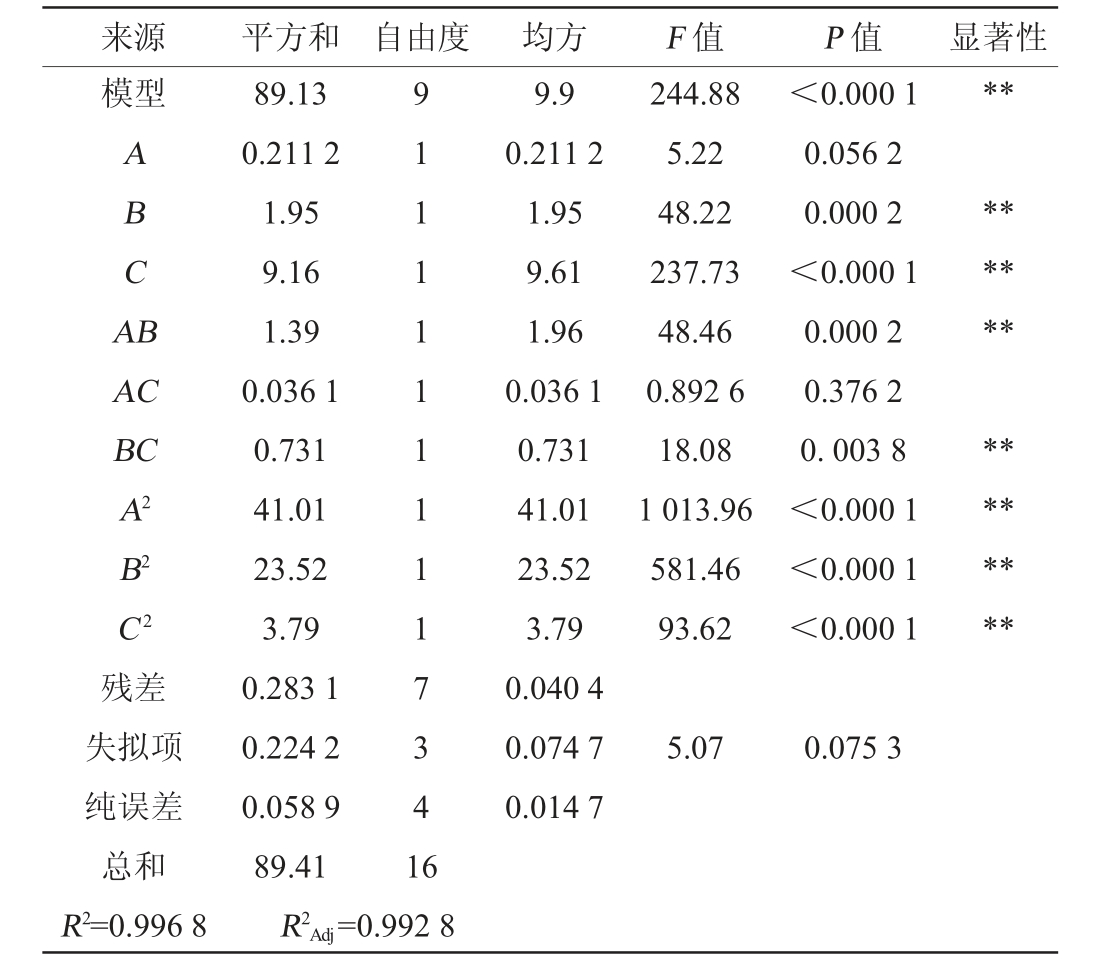
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
来源 平方和 自由度 均方 F 值 P 值 显著性模型**ABCA B******AC BC A2 B2 C2 244.88 5.22 48.22 237.73 48.46 0.892 6 18.08 1 013.96 581.46 93.62<0.000 1 0.056 2 0.000 2<0.000 1 0.000 2 0.376 2 0.003 8<0.000 1<0.000 1<0.000 1********残差失拟项纯误差总和R2=0.996 8 89.13 0.211 2 1.95 9.16 1.39 0.036 1 0.731 41.01 23.52 3.79 0.283 1 0.224 2 0.058 9 89.41 R2Adj=9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 9.9 0.211 2 1.95 9.61 1.96 0.036 1 0.731 41.01 23.52 3.79 0.040 4 0.074 7 0.014 7 5.07 0.075 3 0.992 8
通过Design-Expert 13.0软件对实验结果进行多元回归拟合,得到回归方程:Y=18.98+0.162 5A+0.493 8B+1.1C-0.7AB+0.095AC-0.427 5BC-3.12A2-2.36B2-0.948 2C2。
由表3可知,回归模型极显著(P<0.000 1),失拟项不显著(P=0.075 3>0.05),说明该模型拟合程度良好,模型决定系数R2=0.996 8,调整决定系数R2Adj=0.992 8,表明该模型的拟合度和可信度较高[21-22]。此外,能够准确预测响应值2,3-丁二醇质量浓度与各单因素之间的关系。由P值可知,回归方程的一次项B、C,交互项AB、BC,二次项A2、B2、C2对2,3-丁二醇质量浓度影响均极显著(P<0.01),其他项均不显著(P>0.05)。由F值可知,对2,3-丁二醇质量浓度的影响由大到小依次为转速(C)>发酵时间(B)>发酵温度(A)。
响应面曲面坡度越陡峭,等高线呈椭圆形,则表明二者交互作用显著[23]。发酵温度、发酵时间和转速间交互作用对2,3-丁二醇产量影响的响应面及等高线见图5。由图5可知,发酵温度(A)与发酵时间(B)、发酵时间(B)与转速(C)的交互作用响应曲面较陡峭,等高线呈椭圆形,因此交互作用极显著。而发酵温度(A)与转速(C)响应曲面较为平缓,等高线趋于圆形,表明发酵温度与转速的交互作用对2,3-丁二醇产量无显著影响。这与方差分析结果一致。
通过Desing-Expert 13.0软件分析预测最佳发酵条件:发酵温度为28.37 ℃、发酵时间为24.98 h、转速为272 r/min。在此优化条件下,2,3-丁二醇质量浓度预测值为19.29 g/L。考虑实际可操作性,将发酵条件修正为:酵母提取物质量浓度为12 g/L、发酵温度为28 ℃、发酵时间为25 h、转速为270 r/min。在此条件下进行3次平行验证试验,2,3-丁二醇质量浓度实际值为19.2 g/L,与模型预测值较为接近,说明此模型预测数据较可靠。与初始条件获得2,3-丁二醇质量浓度相比(15.65 g/L),发酵条件优化后的2,3-丁二醇质量浓度提高了22.68%。
菊芋水解液发酵过程中还原糖及代谢产物质量浓度的变化见图6。由图6可知,发酵时间为0~25 h时,还原糖质量浓度快速下降,2,3-丁二醇质量浓度呈现增加趋势;当发酵时间为25 h时,还原糖质量浓度为3.75 g/L,2,3丁二醇质量浓度达到最大值19.2 g/L,由此表明Raoultella ornithinolytica TH-21对糖类物质的代谢主要发生在前25 h,且发酵主产物为2,3丁二醇;发酵时间为25~48 h时,2,3-丁二醇质量浓度出现降低趋势;在发酵结束(48 h)时,2,3-丁二醇质量浓度降低为14.71 g/L,而副产物乙偶姻质量浓度出现增长趋势。其可能原因是,发酵培养基中还原糖被完全消耗后,2,3-丁二醇向乙偶姻开始转化。与已经报道的其他微生物利用不同类型的廉价原料(甘蔗糖蜜、玉米秸秆、胡萝卜加工废弃物、油棕等)发酵生产2,3-丁二醇相比[24-28],Raoultella ornithinolytica TH-21利用菊芋水解液为碳源发酵时,可在发酵25 h时生成较高含量的2,3-丁二醇。
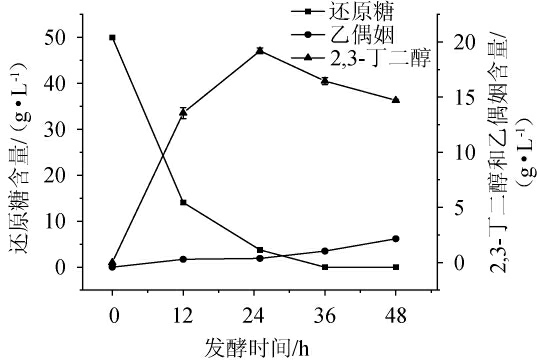
图6 菊芋水解液发酵过程中还原糖和代谢产物质量浓度的变化
Fig.6 Changes of reducing sugar and metabolites mass concentration
during Helianthus tuberosus hydrolysate fermentation process
本研究以菊芋水解液为碳源,采用单因素试验结合响应面法对Raoultella ornithinolytica TH-21产2,3-丁二醇的发酵条件进行优化。优化后的最佳发酵条件为:发酵温度28 ℃、发酵时间25 h、转速270 r/min、酵母提取物质量浓度12 g/L。在此优化条件下,2,3-丁二醇质量浓度可达19.2 g/L,较优化前提高了22.68%。当发酵时间为25 h时,还原糖质量浓度为3.75 g/L,2,3-丁二醇质量浓度达到最大值(19.2 g/L),表明Raoultella ornithinolytica TH-21在前25 h内可完成糖类物质代谢。本研究结果证明了Raoultella ornithinolytica TH-21利用廉价碳源菊芋合成生物基化学品的可行性,为菊芋高值化开发利用提供参考。
[1]TINOCO D,BORSCHIVER S,COUTINHO P L,et al.Technological development of the bio-based 2,3-butanediol process[J].Biofuels Bioprod Bior,2021,15(2):357-376.
[2]GAWAL P M,SUBUDHI S.Advances and challenges in bio-based 2,3-BD downstream purification:A comprehensive review[J].Bioresource Technol Rep,2023,24:101638.
[3]EBRAHIMIAN F,MOHAMMADI A.Assessing the environmental footprints and material flow of 2,3-butanediol production in a wood-based biorefinery[J].Bioresource Technol,2023,387:129642.
[4]TINOCO D, FREIRE D M G.Scale-up of 2,3-butanediol production by Paenibacillus peoriae NRRL BD-62 using constant oxygen transfer rate-based strategy[J].Fuel,2023,340:127603.
[5]TANWEE T N N,LIPSCOMB G L,VAILIONIS J L,et al.Metabolic engineering of Caldicellulosiruptor bescii for 2,3-butanediol production from unpretreated lignocellulosic biomass and metabolic strategies for improving yields and titers[J].Appl Environ Microbiol,2024,90(1):e01951-23.
[6]GADKARI S,NARISETTY V,MAITY S K,et al.Techno-economic analysis of 2,3-butanediol production from sugarcane bagasse[J].ACS Sust Chem Eng,2023,11(22):8337-8349.
[7]MAINA S,PRABHU A A,VIVEK N,et al.Prospects on bio-based 2,3-butanediol and acetoin production: Recent progress and advances[J].Biotechnol Adv,2022,54:107783.
[8]VARMA A R,SHRIAME B S,GADKARI S,et al.Techno-economic viability of bio-based methyl ethyl ketone from sugarcane using integrated fermentative and chemo-catalytic approach:Process integration using pinch technology[J].Chem Eng J,2024,489:151297.
[9]ZHANG J,ZHAO J,FU Q,et al.Metabolic engineering of Paenibacillus polymyxa for effective production of 2,3-butanediol from poplar hydrolysate[J].Bioresource Technol,2024,392:130002.
[10]AMRAOUI Y,NARISETTY V,COULON F,et al.Integrated fermentative production and downstream processing of 2,3-butanediol from sugarcane bagasse-derived xylose by mutant strain of Enterobacter ludwigii[J].ACS Sust Chem Eng,2021,9(30):10381-10391.
[11]NARISETTY V,ZHANG L, ZHANG J, et al.Fermentative production of 2,3-butanediol using bread waste-A green approach for sustainable management of food waste[J].Bioresource Technol,2022,358:127381.
[12]GUO Z W,NI Z F,ZONG M H,et al.Modular metabolic engineering of Bacillus licheniformis for efficient 2,3-butanediol production by consolidated bioprocessing of Jerusalem artichoke tubers[J].ACS Sust Chem Eng,2022,10(29):9624-9634.
[13]PAIXAO S M,SLVES L,PACHECO R,et al.Evaluation of Jerusalem artichoke as a sustainable energy crop to bioethanol:Energy and CO2eq emissions modeling for an industrial scenario[J].Energy, 2018, 150:468-481.
[14]JIANG Y,LV Y,MICHENFELDER R,CHEN T,et al.Clostridium sp.strain NJ4: A promising solventogenic strain for butanol production from Jerusalem artichoke through consolidated bioprocessing[J].Energy Fuels,2020,34(3):3406-3411.
[15]DAI J Y,GUAN W T,XIU Z L.Bioconversion of inulin to 2,3-butanediol by a newly isolated Klebsiella pneumoniae producing inulinase[J].Process Biochem,2020,98:247-253.
[16]LI F,PAN S,YANG L,et al.Efficient production 2,3-butanediol from biomass-derived sugars by Raoultella ornithinolytica TH-21,a newly isolated lignocellulose-degrading bacterium[J].Ind Crop Prod,2024,217:118841.
[17]PENNACCHIO A,VENTORINO V,CIMINI D,et al.Isolation of new cellulase and xylanase producing strains and application to lignocellulosic biomasses hydrolysis and succinic acid production[J].Bioresource Technol,2018,259:325-333.
[18]TINOCO D,SELDIN L,DE ANDRADE COUTINHO P L,et al.Optimization of fermentation conditions as a metabolic strategy for the high-yield and high-selectivity bio-based 2,3-butanediol production[J].J Ind Eng Chem,2023,125:345-359.
[19]PRAMANIK S K, MAHMUD S, PAUL G K, et al.Fermentation optimization of cellulase production from sugarcane bagasse by Bacillus pseudomycoides and molecular modeling study of cellulase[J].Curr Res Microb Sci,2021,2:100013.
[20]PROUST L,SOURABIE A,PEDERSEN M,et al.Insights into the complexity of yeast extract peptides and their utilization by Streptococcus thermophilus[J].Front Microbiol,2019,10:906.
[21]RAISZADEH-JAHROMI Y, REZAZADEH-BARI M, ALMASI H, et al.Optimization of bacterial cellulose production by Komagataeibacter xylinus PTCC 1734 in a low-cost medium using optimal combined design[J].J Food Sci Technol,2020,57:2524-2533.
[22]VERMA M, EKKA A, MOHAPATRA T, et al.Optimization of kraft lignin decolorization and degradation by bacterial strain Bacillus velezensis using response surface methodology[J].J Environ Chem Eng,2020,8(5):104270.
[23]潘冬梅,杨传伦,张心青,等.响应面法优化酿酒酵母培养基[J].中国酿造,2024,43(6):206-212.
[24]PSAKI O,MAINA S,VLYSIDIS A,et al.Optimisation of 2,3-butanediol production by Enterobacter ludwigii using sugarcane molasses[J].Biochem Eng J,2019,152:107370.
[25]MA K,HE M,YOU H,et al.Improvement of(R,R)-2,3-butanediol production from corn stover hydrolysate by cell recycling continuous fermentation[J].Chem Eng J,2018,332:361-369.
[26]LOPEZ-LINARES J C,MATEO MARTINEZ A,COCA M,et al.Carrot discard as a promising feedstock to produce 2,3-butanediol by fermentation with P.polymyxa DSM 365[J].Bioengineering,2023,10:937.
[27]MAINA S,STYLIANOU E,VOGIATZI E,et al.Improvement on bioprocess economics for 2,3-butanediol production from very high polarity canesugarviaoptimisationofbioreactoroperation[J].Bioresource Technol,2019,274:343-352.
[28]HAZEENA S H,SALINI C N,SINDHU R,et al.Simultaneous saccharification and fermentation of oil palm front for the production of 2,3-butanediol[J].Bioresource Technol,2019,278:145-149.