表1 发酵培养基优化Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman test design for fermentation medium optimization
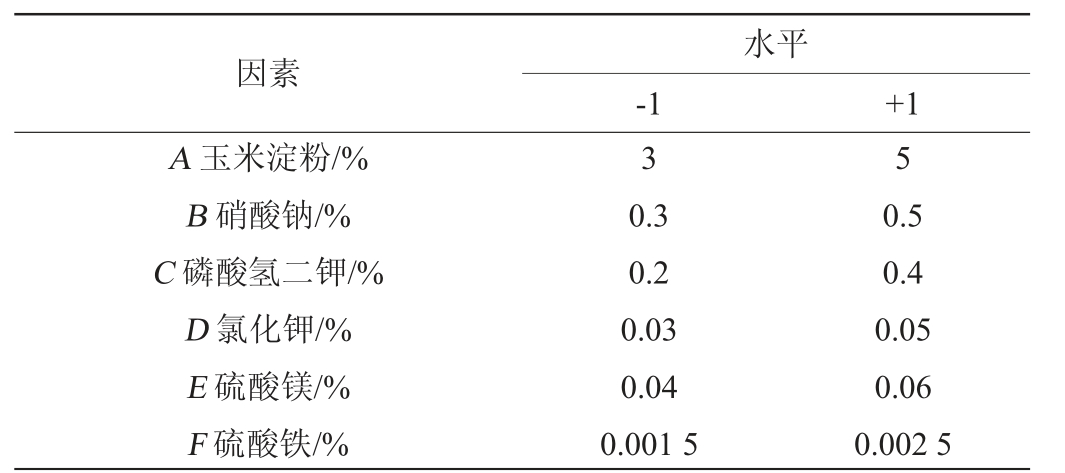
因素A 玉米淀粉/%B 硝酸钠/%C 磷酸氢二钾/%D 氯化钾/%E 硫酸镁/%F 硫酸铁/%水平-1 +1 3 5 0.3 0.2 0.03 0.04 0.001 5 0.5 0.4 0.05 0.06 0.002 5
Optimization of fermentation medium of Cytophaga sp.CX08 producing marine low-temperature raw starch glucoamylase
海洋占地球表面积的71%[1],海洋独特的自然条件[2],使得海洋微生物拥有独特而丰富的代谢途径和基因库[3-5],海洋环境中微生物种类繁多[6],但只有0.01%的海洋细菌被表征[7]。生淀粉糖化酶(raw starch glucoamylase,RSGA)属于淀粉酶[8-10],是指可直接消化未经糊化的生淀粉颗粒的一类酶[10],即可在低温下,直接分解未糊化的生淀粉晶体颗粒,将传统工艺的淀粉蒸煮、糊化、糖化多步合并为一步直接糖化的酶。目前,已有研究发现了许多生淀粉酶,但只有大约10%的淀粉酶能有效地将生淀粉直接降解成葡萄糖。巴黎链球菌(Streptococcus)来源的淀粉酶对生淀粉的降解能力仅为2.71 U/mL[11];草酸青霉菌(Penicillium oxalicum)来源的淀粉酶对生淀粉的降解能力为191.0 U/mL[12];根霉菌(Rhizopus)和镰孢菌(Fusarium)来源的淀粉酶对生淀粉的降解能力分别为322.68 U/g和302.12 U/g[13]。目前已知淀粉酶的来源包括:喜热噬油芽胞杆菌(Geobacillus thermo-leovorans)[14]、马来西亚吉奥塔利巴希菌(Jeotgalibacillus malaysiensis)[15]、杜邦嗜热菌(Thermomyces dupontii)[16]、米曲霉(Aspergillus oryzae)[17]和蜡样芽孢杆菌(Bacillus cereus)[18]等。
目前已有学者对生淀粉酶菌株的培养条件及培养基进行发酵优化,田瑞杰[19]对从中温大曲中分离出的淀粉酶进行发酵条件优化,其最高酶活力为8 158.23 U/mL,是优化前的14.75倍;LI H等[20]对降解生淀粉的枯草芽孢杆菌的发酵条件进行优化,最高酶活力为3 915.2 U/mL;YAO D B等[21]对产生淀粉酶的中温菌株进行发酵培养基优化,摇瓶培养最高酶活力为5 733.5 U/mL;孙志康等[22]对从土壤分离出的解淀粉芽孢杆菌进行发酵条件优化,优化后生淀粉酶活力为(224.63±7.34)U/mL,较优化前提高34.21%。生淀粉糖化酶因具有广泛的应用范围,在食品和化工产业均发挥重要作用,但对海洋低温环境来源耗能低的生淀粉酶研究报道较少。
该研究以噬纤维菌(Cytophaga sp.)CX08为菌种进行液态发酵,以生淀粉糖化酶酶活力为响应值,通过单因素试验、Plackett-Burman(PB)试验、最陡爬坡试验及Box-Behnken(BB)试验对发酵培养基组成进行优化。旨在提高生淀粉糖化酶的酶活力,为生淀粉糖化酶进一步研究奠定基础。
1.1.1 菌株
Cytophaga sp.CX08:分离自辽河口海泥,保藏于大连大学海洋微生物工程技术研究中心。
1.1.2 试剂
可溶性淀粉:国药集团化学试剂有限公司;硝酸钠:天津大茂化学试剂有限公司;磷酸氢二钾、氯化钾、硫酸镁、硫酸铁:天津科密欧试剂有限公司;蛋白胨、葡萄糖、酵母膏:北京奥博星生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):上海麦克林生化科技有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 培养基
种子培养基:蛋白胨10 g,K2HPO4 3 g,葡萄糖1 g,酵母膏5 g,蒸馏水1 000 mL,pH 6.0,121 ℃高压蒸汽灭菌30 min。
发酵培养基:可溶性淀粉20 g,硝酸钠3 g,磷酸氢二钾4 g,氯化钾0.5 g,硫酸镁0.5 g,硫酸铁0.01 g,蒸馏水1 000 mL,pH 6.0,121 ℃高压蒸汽灭菌30 min,其中可溶性淀粉在140 ℃下干热灭菌2 h。
LTI-700低温恒温培养箱:上海艾蓝工业设备有限公司;CRY-2112恒温摇床:上海荣能实验室设备有限公司;Multiskan GO酶标仪、Biofuge fresco微量高速冷冻离心机:美国Thermo Fisher Scientific公司;DHG-9240A电热恒温鼓风干燥箱:上海百信生物科技有限公司;CR21N高速冷冻离心机:日本Hitachi公司;PHS-3E型pH计:上海仪电科学仪器有限公司。
1.3.1 噬纤维菌CX08的种子液及发酵液的制备
菌株活化:将菌种CX08接种至固体种子培养基于25 ℃培养24 h,获得单菌落。
种子培养:接种单菌落于装液量为50 mL/250 mL液体种子培养基中,在温度25 ℃、转速160 r/min条件下,培养24 h,获得一级种子液。接种一级种子液1%于装液量为100 mL/250 mL二级液体种子培养基中,在温度25 ℃、转速160 r/min条件下振荡培养24 h[23],获得二级种子液。
发酵培养:接种二级种子液5%于装液量为100mL/250mL发酵培养基中,在温度25 ℃、转速160 r/min条件下振荡培养48 h,获得发酵液。
1.3.2 培养基组成优化单因素试验
碳源种类及添加量的确定:在初始发酵培养基中,分别以20 g/L的可溶性淀粉、玉米淀粉、马铃薯淀粉、葡萄糖、麦芽糖和蔗糖作为单一碳源,确定最佳碳源;在最优碳源条件下,设置其添加量分别为1%、2%、3%、4%、5%、6%,确定最佳碳源添加量。
氮源种类及添加量的确定:分别以3 g/L的硝酸钠、硝酸铵、尿素、酵母膏、牛肉膏和蛋白胨作为单一氮源,确定最佳氮源;在最优氮源条件下,设置其添加量分别为0.1%、0.2%、0.3%、0.4%、0.5%、0.6%,确定最佳氮源添加量。
无机盐添加量的确定:设置磷酸氢二钾添加量分别为0.1%、0.2%、0.3%、0.4%、0.5%、0.6%;氯化钾、硫酸镁添加量分别为0.02%、0.03%、0.04%、0.05%、0.06%、0.07%;硫酸铁添加量分别为0.000 5%、0.001 0%、0.001 5%、0.002 0%、0.002 5%、0.003 0%,确定最佳无机盐添加量。
1.3.3 产生淀粉糖化酶发酵培养基优化响应面试验
(1)Plackett-Burman(PB)试验设计
在单因素试验结果的基础上,以玉米淀粉(A)、硝酸钠(B)、磷酸氢二钾(C)、氯化钾(D)、硫酸镁(E)、硫酸铁(F)为自变量,以生淀粉糖化酶酶活力(Y)为评价指标,每个因素选取2个水平,进行n=12的PB试验,PB试验因素和水平见表1。
表1 发酵培养基优化Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman test design for fermentation medium optimization

因素A 玉米淀粉/%B 硝酸钠/%C 磷酸氢二钾/%D 氯化钾/%E 硫酸镁/%F 硫酸铁/%水平-1 +1 3 5 0.3 0.2 0.03 0.04 0.001 5 0.5 0.4 0.05 0.06 0.002 5
(2)最陡爬坡试验
根据上述PB试验设计筛选出对噬纤维菌CX08产生淀粉糖化酶影响显著的因素,确定爬坡方向,进一步进行最陡爬坡试验,分析具有显著影响的因素对生淀粉糖化酶酶活力的影响。
(3)Box-Behnken试验
将最陡爬坡试验得出的最优结果作为试验中心点,以生淀粉糖化酶酶活力(Y)为响应值,自变量为玉米淀粉(A)、硝酸钠(B)和磷酸氢二钾(C)添加量,采用Box-Behnken(BB)试验设计对发酵培养基进行3因素3水平试验,Box-Behnken试验设计因素和水平见表2。
表2 发酵培养基优化Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken tests design for fermentation medium optimization

因素A 玉米淀粉/%B 硝酸钠/%C 磷酸氢二钾/%-1水平0 1 3 4 5 0.3 0.2 0.4 0.3 0.5 0.4
1.3.4 生淀粉糖化酶酶活力测定
取2%的可溶性淀粉悬浮液2 mL加入到25 mL具塞比色管,添加pH 5.5柠檬酸-柠檬酸钠缓冲液2 mL[24],30 ℃预热10 min,加入1.0 mL酶液[25],于30 ℃恒温振荡(160 r/min)反应10 min,加入0.5 mL 4%的NaOH溶液终止反应;反应液3 000 r/min离心5 min,取上清液用DNS法[26-27]测定还原糖量。置沸水浴中煮沸5 min。取出后流水冷却,加蒸馏水定容至20 mL,在540 nm波长下比色测定吸光度值[28]。以先加0.5 mL 4%的NaOH溶液[29],再加入酶液,作空白对照,用以消除酶液和可溶性淀粉中游离糖的影响。生淀粉糖化酶酶活力计算公式如下:
式中:C为葡萄糖含量,μg;t为反应时间,min;Ew为酶量,mL。
生淀粉糖化酶酶活力定义:在温度30 ℃、转速160 r/min的条件下,1 min释放1 μg的还原糖(以葡萄糖计算)所需的酶量定义为1个酶活力单位(U)[30]。
1.3.5 计算公式
相对酶活计算公式如下:
生淀粉糖化酶对生淀粉的降解能力(raw starch digesting ability,RSDA),反映生淀粉糖化酶酶活力在糖化酶酶活力中的比例,计算公式如下:
式中:A为生淀粉糖化酶活力,U/mL;B为糊化淀粉糖化酶(gelatinized starch glucoamylase,GSGA)酶活力,U/mL。
生淀粉糖化酶在生淀粉颗粒上的吸附率(adsorption rate,AR),反映生淀粉糖化酶对生淀粉的亲和性,计算公式如下:
式中:M为吸附前RSGA酶活力,U/mL;N为吸附后RSGA酶活力,U/mL。
1.3.6 数据分析
采用SPSS 25.0软件对试验结果进行单因素显著性分析[31],GraphPad Prism 9.0软件作图,使用Design-Expert 12.0.3软件进行响应面试验设计及分析[32]。
2.1.1 碳源对产酶的影响
由图1(A)可知,当玉米淀粉为碳源时,相对酶活、RSDA及AR均为最高值,分别为100%、27.23%、30.57%,表明玉米淀粉为碳源时,菌株所产生淀粉糖化酶对生淀粉具有较高降解能力及吸附率。因此,确定玉米淀粉为最佳碳源。由图1(B)可知,玉米淀粉添加量为1%~4%时,相对酶活、RSDA及AR均逐渐增大;当其添加量为4%时,相对酶活、RSDA及AR均达到最高值,分别为100%、35.66%及42.69%;之后随着其添加量逐渐增大,相对酶活、RSDA及AR均逐渐减小,可能是因为碳源添加量过高影响菌体生长,从而降低酶的合成。因此,确定玉米淀粉的最佳添加量为4%。
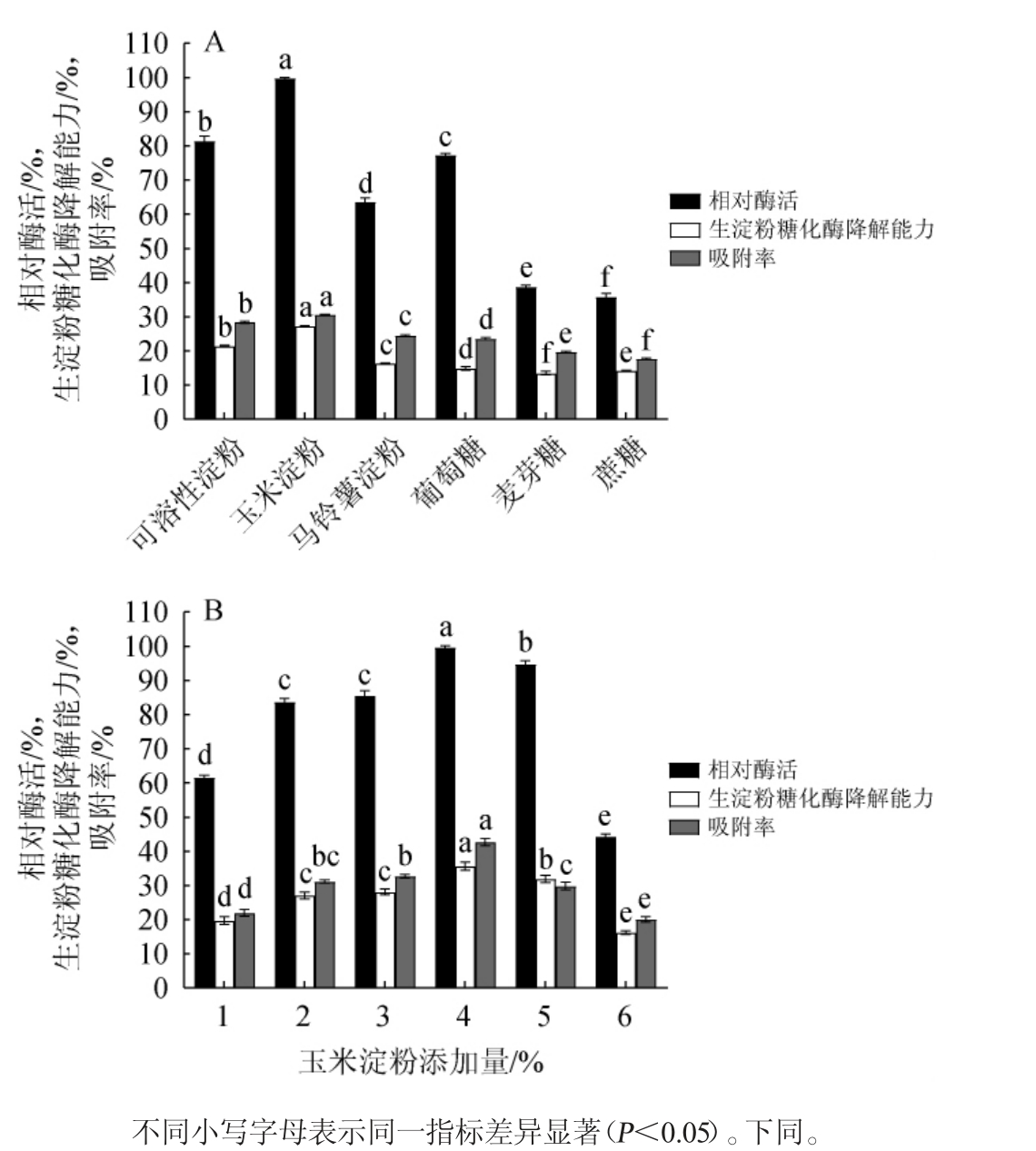
图1 碳源种类(A)及玉米淀粉添加量(B)对产淀粉糖化酶的影响
Fig.1 Effect of carbon source types (A) and corn starch addition (B)on raw starch glucoamylase production
2.1.2 氮源对产酶的影响
由图2(A)可知,当硝酸钠为氮源时,相对酶活、RSDA及AR均为最高值,分别为100%、28.18%、30.80%,表明硝酸钠为氮源时,菌株所产生淀粉糖化酶对生淀粉具有较高降解能力及吸附率。因此,确定硝酸钠为最佳氮源。由图2(B)可知,硝酸钠添加量为0.1%~0.4%时,相对酶活、RSDA及AR均逐渐增大;当其添加量为0.4%时,相对酶活、RSDA及AR均达到最高值,分别为100%、32.57%及39.53%;之后随着其添加量逐渐增大,相对酶活、RSDA及AR均逐渐减小,可能是因为氮源添加量过高不利于菌体生长,抑制酶的合成。因此,确定硝酸钠的最佳添加量为0.4%。
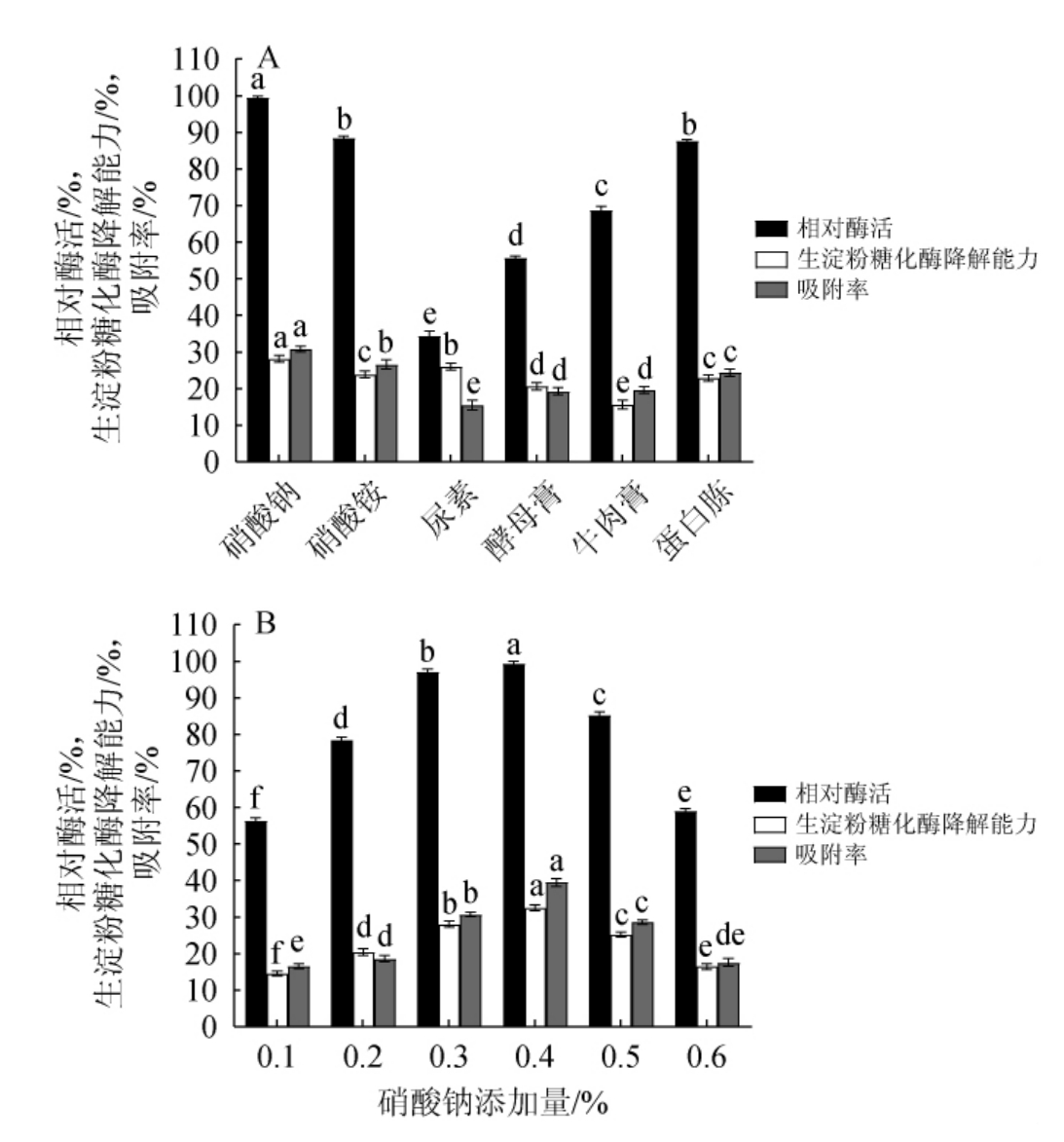
图2 氮源种类(A)及硝酸钠添加量(B)对产淀粉糖化酶的影响
Fig.2 Effect of nitrogen source types (A) and NaNO3 addition (B) on raw starch glucoamylase production
2.1.3 无机盐对产酶的影响
由图3(A~D)可知,随着磷酸氢二钾、氯化钾、硫酸镁、硫酸铁添加量的增加,相对酶活、RSDA及AR均逐渐增大,相对酶活、RSDA及AR均呈逐渐增加后减少的趋势;添加量分别为0.3%、0.04%、0.05%、0.002 0%时,相对酶活、RSDA及AR均达到最高值,分别为100%、34.30%、40.62%;100%、35.19%、41.85%;100%、35.42%、41.91%;100%、38.70%、43.76%。因此,确定磷酸氢二钾、氯化钾、硫酸镁和硫酸铁的最佳添加量分别为0.3%、0.04%、0.05%和0.002 0%。
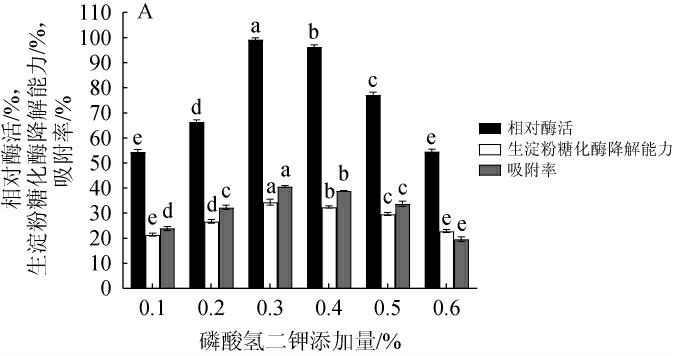
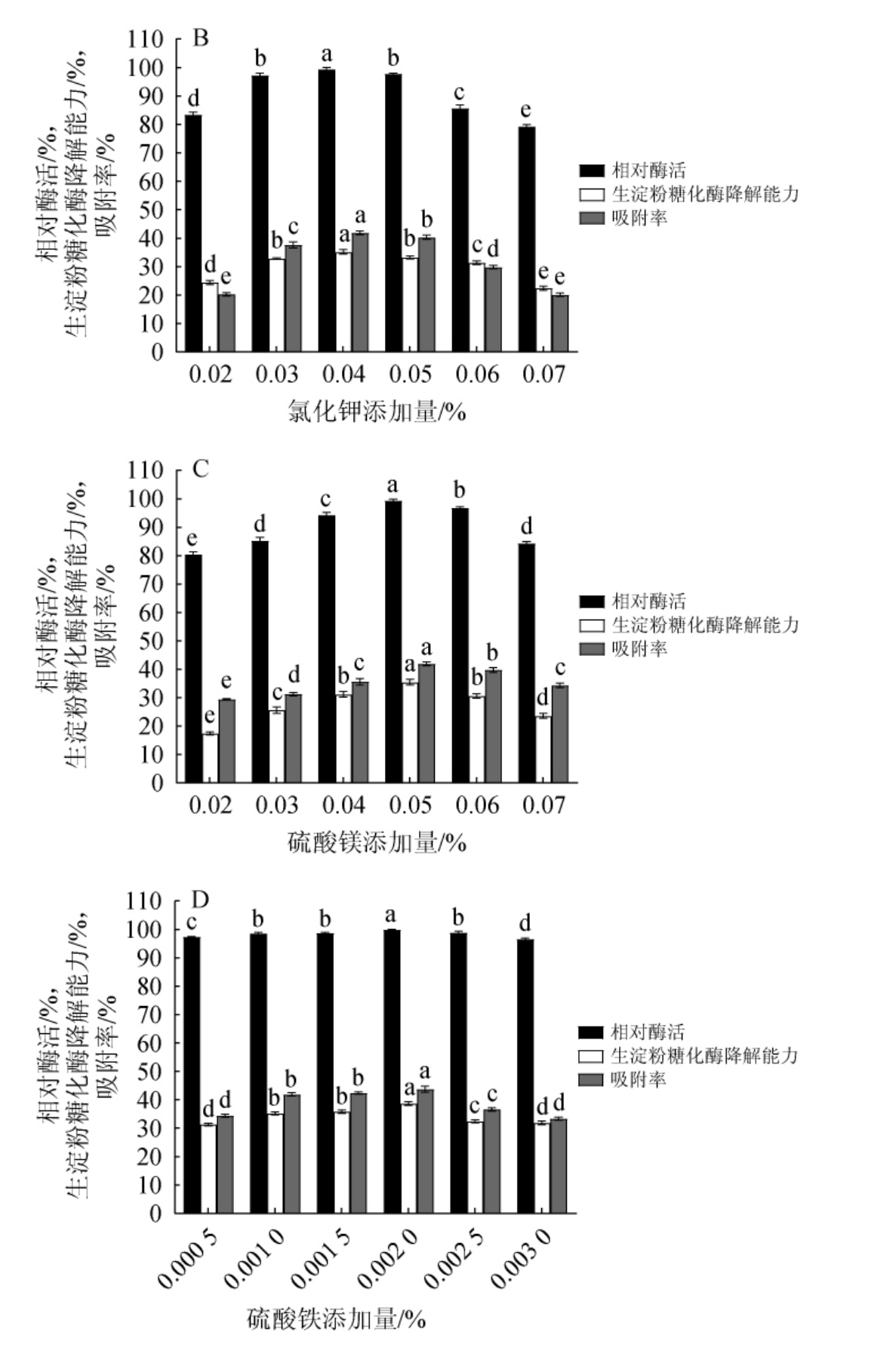
图3 磷酸氢二钾(A)、氯化钾(B)、硫酸镁(C)、硫酸铁(D)添加量对产淀粉糖化酶的影响
Fig.3 Effect of K2HPO4(A), KCl (B), MgSO4·7H2O (C) and FeSO4·7H2O (D) addition on raw starch glucoamylase production
在单因素试验结果的基础上,设计产酶培养基的6个变量分别为玉米淀粉(A)、硝酸钠(B)、磷酸氢二钾(C)、氯化钾(D)、硫酸镁(E)、硫酸铁(F),以生淀粉糖化酶酶活力(Y)为评价指标,使用Design-Expert 12.0.3软件进行PB试验设计,PB试验设计及结果见表3,PB试验设计的各因素主效应分析见表4。
表3 发酵培养基优化Plackett-Burman试验设计和结果
Table 3 Design and results of Plackett-Burman tests for fermentation medium optimization
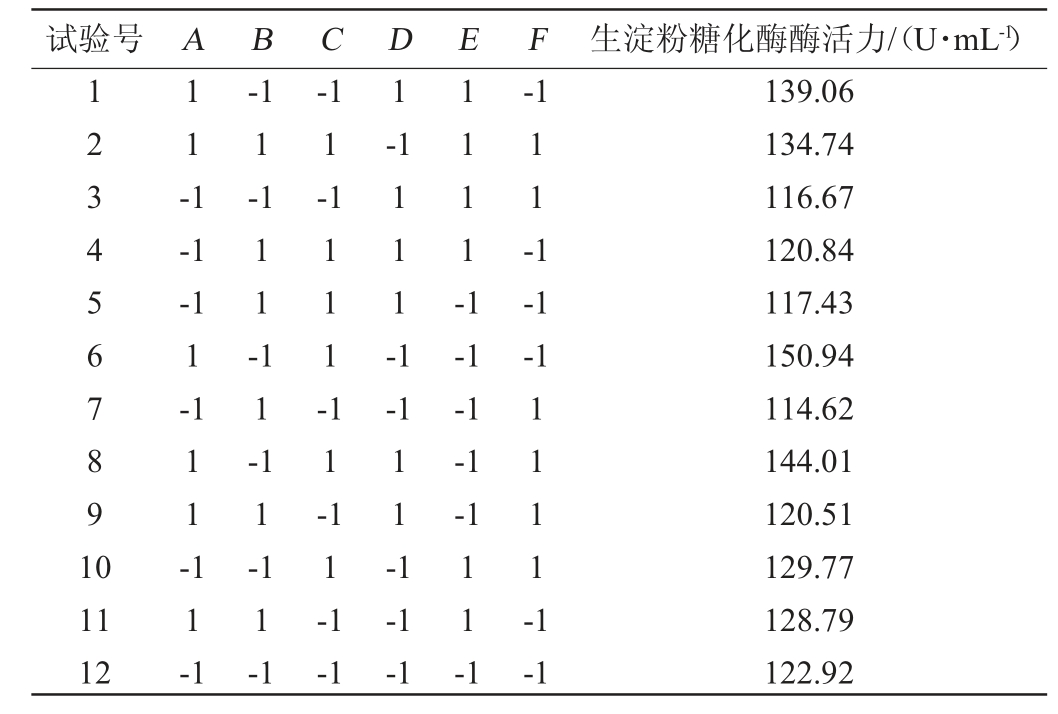
试验号 A B C D E F 生淀粉糖化酶酶活力/(U·mL-1)1234567891 0 11-1-1 1-1-1 1-1 1-1-1-1-1 1-1 11-111-111-1 1111-1 11-1-1-1 11-11--1 11-11-11-1-1-1-1-1 11 12 11-1 11-1 11-1 1111-1-1-1-1 11-1-1 139.06 134.74 116.67 120.84 117.43 150.94 114.62 144.01 120.51 129.77 128.79 122.92
表4 Plackett-Burman试验设计的各因素主效应分析
Table 4 Principal effect analysis of various factors in Plackett-Burman test design
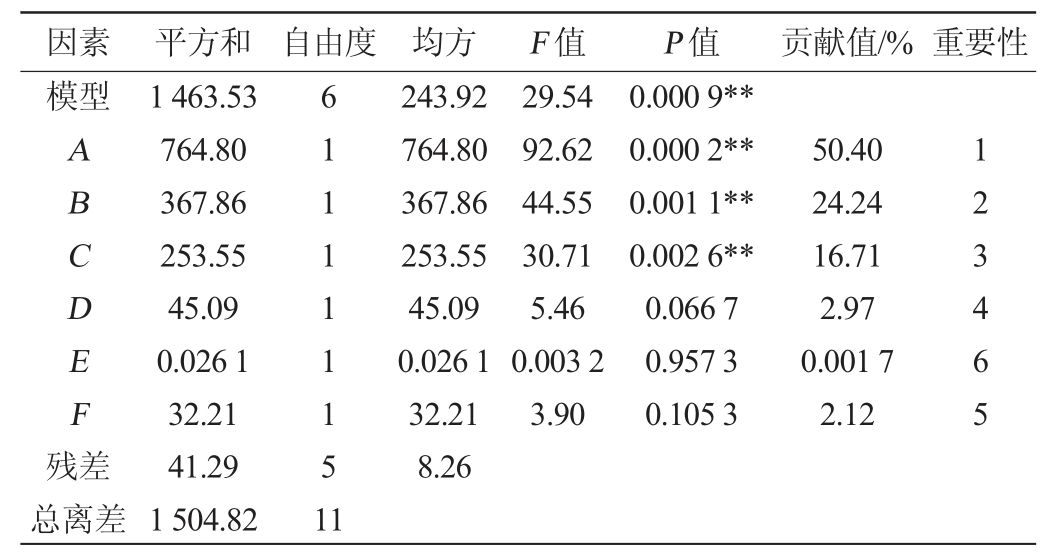
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
因素 平方和 自由度 均方 F 值 P 值模型贡献值/% 重要性ABCDEF残差243.92 764.80 367.86 253.55 45.09 0.026 1 32.21 8.26 29.54 92.62 44.55 30.71 5.46 0.003 2 3.90 0.000 9**0.000 2**0.001 1**0.002 6**0.066 7 0.957 3 0.105 3 50.40 24.24 16.71 2.97 0.001 7 2.12 123465总离差1 463.53 764.80 367.86 253.55 45.09 0.026 1 32.21 41.29 1 504.82 611111151 1
使用Design-Expert 12.0.3软件对表3结果进行多元一次回归拟合,得到一次回归方程:
Y=128.36+7.98A-5.54B+4.60C-1.94D-0.05E-1.64F
由表4可知,玉米淀粉、硝酸钠和磷酸氢二钾均对生淀粉糖化酶影响极显著(P<0.01),最显著的因素为玉米淀粉,因此以玉米淀粉为爬坡单位进行最陡爬坡试验[33],其中玉米淀粉和磷酸氢二钾为正效应,而硝酸钠为负效应,故对玉米淀粉(A)、硝酸钠(B)和磷酸氢二钾(C)三个因素进行最陡爬坡试验时,玉米淀粉和磷酸氢二钾应按照步长依次增大,硝酸钠应按照步长依次减小。该回归方程的决定系数R2为97.26%,校正决定系数R2Adj为93.96%,表明该模型设计可靠,拟和程度良好,可作为下一步响应面设计的显著影响因素。
经计算知玉米淀粉步长为1%,硝酸钠步长为0.07%,磷酸氢二钾步长为0.06%,为方便试验称量,玉米淀粉、硝酸钠和磷酸氢二钾的步长分别取1%、0.1%、0.1%。最陡爬坡试验设计和结果见表5。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the steepest climbing tests
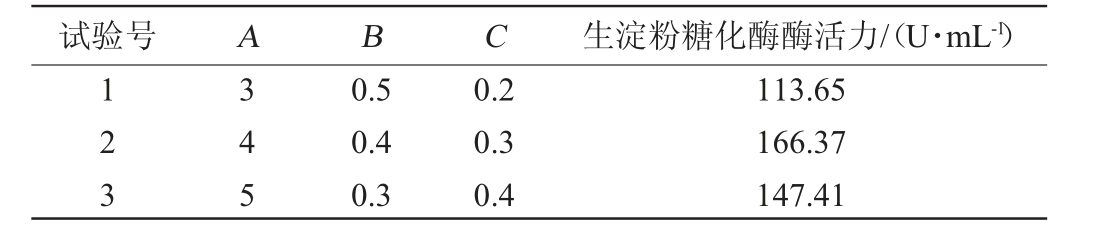
试验号 A B C 生淀粉糖化酶酶活力/(U·mL-1)123 345 0.5 0.4 0.3 0.2 0.3 0.4 113.65 166.37 147.41
由表5可知,在第2组试验中,玉米淀粉、硝酸钠以及磷酸氢二钾添加量分别为4%、0.4%和0.3%,酶活力达到最大值(166.37 U/mL)。
2.4.1 响应面试验结果与分析
在上述试验结果的基础上,以玉米淀粉(A)、硝酸钠(B)和磷酸氢二钾(C)为考察因素,以生淀粉糖化酶酶活力(Y)为响应值,进行Box-Behnken试验。Box-Behnken验设计及结果见表6,方差分析见表7。
表6 发酵培养基优化Box-Behnken试验设计及结果
Table 6 Design and results of Box-Behnken tests for fermentation medium optimization
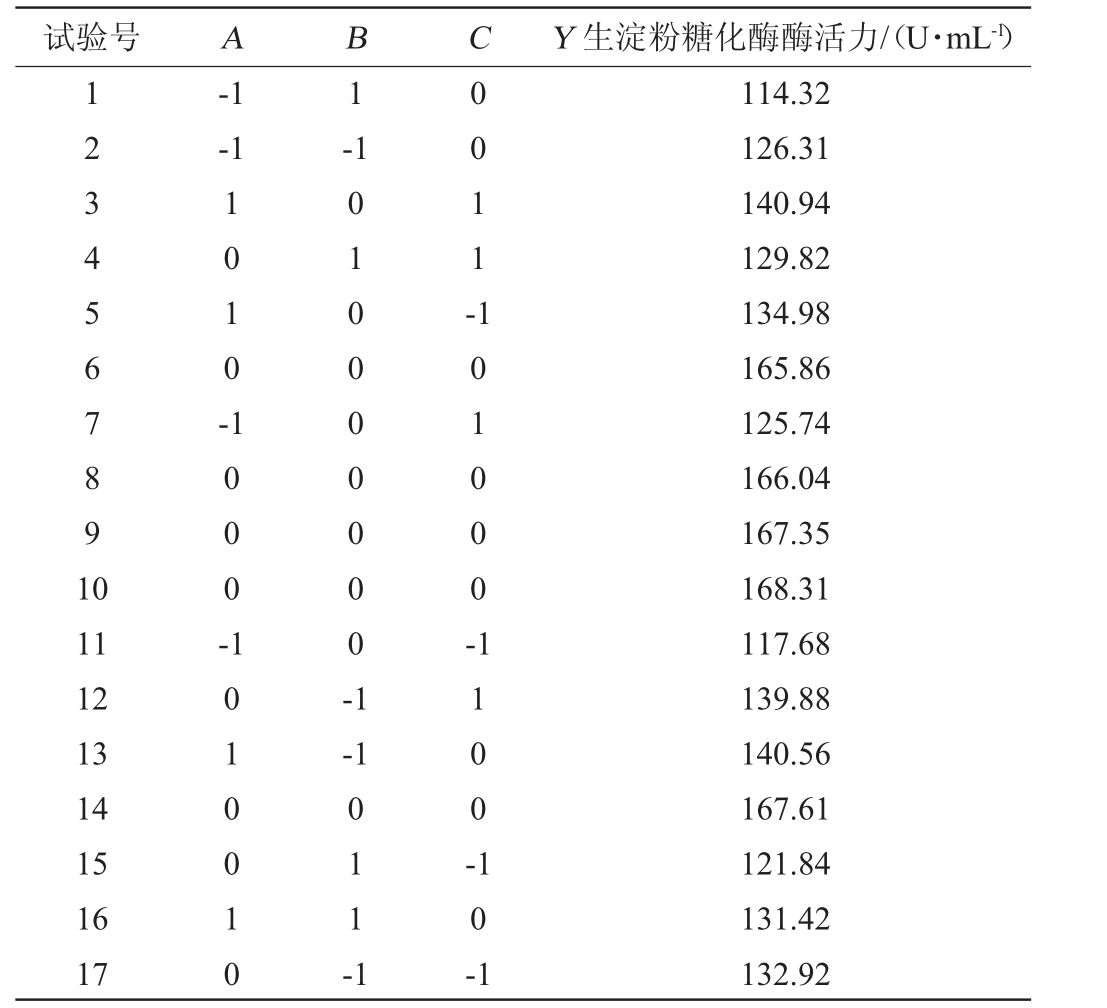
试验号 A B C Y 生淀粉糖化酶酶活力/(U·mL-1)1234567891 0-1-1 1-1 1010-0011-11 12 13 14 15 16 17 1000-1010010 010000000-1 101000--1 011-1 1100-10-1 114.32 126.31 140.94 129.82 134.98 165.86 125.74 166.04 167.35 168.31 117.68 139.88 140.56 167.61 121.84 131.42 132.92
表7 回归模型方差分析
Table 7 Variance analysis of regression model

因素 平方和 自由度 均方差 F 值 P 值 显著性模型ABCA B********AC BC A2 B2 C2残差失拟项纯误差总离差5 778.01 509.60 223.34 104.84 2.03 1.10 0.260 1 1 697.84 1 488.29 1 233.83 4.70 0.271 1 4.43 5 782.71 91111111117341 6 642.00 509.60 223.34 104.84 2.03 1.10 0.260 1 1 697.84 1 488.29 1 233.83 0.671 0 0.090 4 1.11 956.73 759.43 332.84 156.23 3.03 1.64 0.387 6 2 530.18 2 217.90 1 838.70<0.000 1<0.000 1<0.000 1<0.000 1 0.125 5 0.240 7 0.553 3<0.000 1<0.000 1<0.000 1******0.081 7 0.966 5
运用Design-Expert 12.0.3软件表6试验结果进行多元二次回归拟合分析,得到二次多项式回归方程:
由表7可知,该回归模型极显著(P<0.01),失拟项不显著(P=0.966 5>0.05),该模型回归方程的决定系数R2为99.92%,校正决定系数R2Adj为99.81%,说明99.81%的响应变异性可以被模型解释,表明该模型可靠,拟和程度良好。由P值可知,一次项A、B、C,二次项A2、B2、C2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。该模型可用于产生淀粉糖化酶发酵培养基优化。由F值可知,对生淀粉糖化酶活力影响的顺序为玉米淀粉添加量(A)>硝酸钠添加量(B)>磷酸氢二钾添加量(C)。
2.4.2 响应面分析
在响应面图中,圆形等高线表示参数之间交互作用不显著,椭圆型或马鞍型等高线表示参数之间交互作用显著;并且各因素响应曲面坡度的陡峭程度反映该因素对生淀粉糖化酶酶活力的影响程度,响应面越陡峭,等高线越趋于椭圆形,说明交互因素对结果影响越大[34]。玉米淀粉、硝酸钠与磷酸氢二钾间交互作用对生淀粉糖化酶酶活力影响的响应曲面及等高线图4。由图4可知,玉米淀粉与硝酸钠、玉米淀粉与磷酸氢二钾、硝酸钠与磷酸氢二钾之间有一定交互作用,但均不显著。

图4 玉米淀粉、硝酸钠与磷酸氢二钾添加量间交互作用对生淀粉糖化酶酶活力影响的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effect of interaction between corn starch, NaNO3 and K2HPO4 addition on raw starch glucoamylase activities
2.4.3 模型验证
通过Design-Expert 12.0.3软件得出最佳发酵培养基组成为:玉米淀粉4.209%、硝酸钠0.386%、磷酸氢二钾0.308%。在此条件下,生淀粉糖化酶酶活力预测值为168.34 U/mL。为方便实际操作,将最佳发酵培养基组成修正为玉米淀粉4.2%、硝酸钠0.4%、磷酸氢二钾0.3%,在此最优条件下,重复3次验证试验,生淀粉糖化酶酶活力实际值为168.31 U/mL,与预测值接近,表明采用响应面法优化得到的最佳条件准确可靠。
为提高噬纤维菌(Cytophaga sp.)CX08发酵产生淀粉糖化酶的能力,通过Plackett-Burman(PB)试验、最陡爬坡试验及Box-Behnken(BB)试验对发酵培养基组成进行优化。结果表明,最佳产生淀粉糖化酶培养基组成为:玉米淀粉42 g/L,NaNO3 4 g/L,K2HPO4 3 g/L,KCl 0.4 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.02 g/L。在此优化条件下,生淀粉糖化酶酶活力最高,为168.31 U/mL,是优化前的1.61倍。本研究结果为其后期发酵条件的进一步优化奠定了基础,为扩大生淀粉糖化酶的发酵规模提供了依据。
[1]BRIAN R C K,RANDI D R.Mind the gap:Comparing exploration effort with global biodiversity patterns and climate projections to determine ocean areas with greatest exploration needs[J].Front Mar Sci,2023,10:1219799.
[2]BARZKAR N,SUKHIKH S,BABICH O.Study of marine microorganism metabolites:New resources for bioactive natural products[J].Front Microbiol,2024,14:1285902.
[3]吴晓惠,陈彬彬,黄迎,等.海洋真菌来源杂萜类化合物的研究进展[J].化学与生物工程,2024,41(7):1-7,17.
[4]YAO H L,LIU S P,LIU T T,et al.Screening of marine sediment-derived microorganisms and their bioactive metabolites: A review[J].World J Microb Biot,2023,39(7):172.
[5]岳保静,陈斌.海洋中的资源[J].科学大观园,2024(16):64-69.
[6]陈世喜,陈梅,李娜,等.中国南海海域海洋深层水细菌多样性[J].生态学报,2024,44(14):6373-6382.
[7]RUGINESCU R M,ENACHE M,POPESCU O,et al.Characterization of some salt-tolerant bacterial hydrolases with potential utility in cultural heritage bio-cleaning[J].Microorganisms,2022,10(3):2076-2607.
[8]DA COSTA LUCHIARI I, CEDENO F R P, DE MACÊDO FARIAS T A,et al.Glucoamylase immobilization in corncob powder:Assessment of enzymatic hydrolysis of starch in the production of glucose[J].Waste Biomass Valor,2021,12(10):5491-5504.
[9]BANITA G,DIBYAJIT L,MOUPRIYA N,et al.Bio characterization of purified isoamylase from Rhizopus oryzae[J].Prep Biochem Biotechnol,2020,50(5):453-459.
[10]ZHAO S, TAN M Z, WANG R X, et al.Combination of genetic engineering and random mutagenesis for improving production of raw-starchdegrading enzymes in Penicillium oxalicum[J].Microb Cell Fact,2022,21(1):272.
[11]PARAMESWARAN R,SOUMYA M P,NAMPOOTHIRI M K.Direct utilization and conversion of raw starch to exopolysaccharides by a newly isolated amylolytic Streptococcus sp.[J].J Biotechnol, 2023, 371-372(7):22-32.
[12]GU L S,TAN M Z,LI S H,et al.ARTP/EMS-combined multiple mutagenesis efficiently improved production of raw starch-degrading enzymes in Penicillium oxalicum and characterization of the enzyme-hyperproducing mutant[J].Biotechnol Biofuels,2020,13(1):187.
[13]JESUBUNMI C O, OGBONNA J O.Production of cellulase and amylase enzymes in both solid and liquid states by two species of fungi[J].Asian J Biotechnol Biores Technol,2022:1-11.
[14]SHUKLA J R,SINGH P S.Purification and characterization of an amylase from a newly isolated Geobacillus thermoleovorans TTIO4 from the hot spring of Tuwa-Timba[J].Starch-Starke,2023,75(9-10):1-10.
[15]NURFATINI R,SHUKURI M A M,MAU K G,et al.Exploring a novel GH13_5 α-amylase from Jeotgalibacillus malaysiensis D5T for raw starch hydrolysis[J].Amb Express,2024,14(1):71-71.
[16]靳燕,李延啸,马俊文,等.嗜热杜邦菌α-淀粉酶的定向进化及高效表达[J].食品工业科技,2022,43(13):139-147.
[17]FADEL M,HALIM A S,SHARADA H,et al.Production of glucoamylase,α-amylase and cellulase by Aspergillus oryzae F-923 cultivated on wheat bran under solid state fermentation[J].J Adv Biol Biotechnol,2020:8-22.
[18]AMAL M A,IBRAHIM S A,FATEN A M,et al.A promising microbial α-amylase production,and purification from Bacillus cereus and its assessment as antibiofilm agent against Pseudomonas aeruginosa pathogen[J].Microb Cell Fact,2023,22(1):141.
[19]田瑞杰.中温大曲原核微生物群落解析及高产淀粉酶菌株的筛选与应用探究[D].郑州:郑州轻工业大学,2022.
[20]LI H, YAO D B, PAN Y, et al.Enhanced extracellular raw starch-degrading α-amylase production in Bacillus subtilis through signal peptide and translation efficiency optimization[J].Microb Cell Fact,2022,21(1):127.
[21]YAO D B,HAN X D,GAO H H,et al.Enhanced extracellular production of raw starch-degrading α-amylase in Bacillus subtilis through expression regulatory element modification and fermentation optimization[J].Microb Cell Fact,2023,22(1):118.
[22]孙志康,李选文,季嫱,等.烟草源高产淀粉酶菌株的分离鉴定、发酵条件优化及固体淀粉酶制剂的制备[J].中国酿造,2024,43(8):190-196.
[23]郭世杰,白红燕,张东风,等.防治棉花黄萎病的枯草芽孢杆菌EBS03发酵条件优化[J].中国棉花,2024,51(4):35-40.
[24]董先有.一种麦芽糖淀粉酶的发酵、提纯和应用研究[D].武汉:武汉轻工大学,2023.
[25]张小荣,黄钰芳,何海,等.差示苯酚-硫酸法结合DNS法测定红芪多糖(HPS)含量[J].安徽农业科学,2022,50(4):186-189,253.
[26]刘彩华,曾嘉童,包竹君,等.3,5-二硝基水杨酸比色法测定芒果的可溶性糖含量[J].食品安全质量检测学报,2022,13(9):2892-2900.
[27]高贯威,匡立学,李银萍,等.基于3,5-二硝基水杨酸比色法探究苹果中可溶性糖测定方法及其含量[J].中国果树,2021(7):74-77.
[28]邴孝凤,何玉,张学成,等.生淀粉水解α-淀粉酶AmyZ1热稳定性提升的分子改造[J].生物学杂志,2023,40(3):35-40.
[29]郑东影,梅婕,陈玮,等.DNS法与菲林试剂法测定酿酒大曲糖化酶活力的比较分析[J].酿酒,2023,50(5):134-138.
[30]张璋,赵腾飞,李红霞,等.产淀粉酶芽孢杆菌的筛选、耐酸性驯化及淀粉酶酶学性质分析[J].中国酿造,2024,43(8):74-79.
[31]胡晓,于娇,陈胜军,等.末水坛紫菜蛋白源抗氧化肽的制备、分离纯化与体外抗氧化活性[J].食品科学,2020,41(16):37-44.
[32]孙金梦,涂宗财,王辉,等.鱼蛋白胶芒果糕的制备工艺优化及品质分析[J].食品工业科技,2022,43(20):189-195.
[33]葛松涛,寿泉洪,韩文凤,等.响应面法优化酸溶蛋白发酵工艺[J].饲料工业,2023,44(13):14-20.
[34]陈勇权,唐雄民,李仲涛.基于响应曲面中心组合设计的介质阻挡负载特征参数分析与优化[J].电气技术,2024,25(1):17-22,33.