Establishment of fermentation kinetic model and antioxidant activity of kiwifruit wine fermented by black tea fungus liquid
猕猴桃(Actinidia chinensis Planch.)富含大量糖分、有机酸、矿物质和多种维生素,对人体有良好的保健作用,享有“世界珍果”之美称[1]。国内对猕猴桃的研究多集中于酿酒、果脯制作和有效成分提取等,所用原料均为去皮果肉,初加工较多[2]。有研究表明,猕猴桃果皮中的总酚和总黄酮含量远高于其果肉和种子,且含有丰富的香气成分[3-4],但是利用微生物发酵技术对带皮猕猴桃进行高值化开发研究较少,钟武等[5]研究发现,猕猴桃带皮发酵更有利于果皮中多酚类物质转移到酒体中,降低猕猴桃酒酸度的同时丰富酒体结构,但是口感单一,糖酸比较高。红茶菌是以红茶和白砂糖为原料经过熬制而成的发酵液,富含多种活性物质和抗氧化性物质,具有促进新陈代谢、改善睡眠、增强机体免疫力等功能[6]。目前,国内关于红茶菌发酵液的研究报道较多,王利平[7]对红茶菌发酵液生产工艺及保健功效进行了系统性研究,结果发现红茶菌发酵液内乙醇及有机酸含量是决定其整体风味的关键因素,但红茶菌发酵后酒精生成量较低且在发酵过程中由于其他菌种发酵产生大量有机酸,风味不佳。因此,用红茶菌液作为发酵原料来改善果酒的品质成了研究者的关注热点[8]。目前,关于红茶菌液与带皮猕猴桃的发酵动力学的研究鲜有报道。
发酵动力学可对实验过程进行定量分析,对发酵过程放大的实验指标进行较为准确的预测,目前对于红茶菌液猕猴桃果酒的发酵动力学及发酵过程中抗氧化活性变化规律的研究鲜见报道。因此,本研究采用经典模型中的Logistic模型、Boltzmann模型、SGompertz模型和DoseResp模型[9]对红茶菌液猕猴桃果酒发酵过程中,菌体生长、基质(还原糖)消耗、产物(乙醇)生成等实验数据进行非线性拟合,建立发酵动力学模型,通过发酵动力学分析,为红茶菌液猕猴桃果酒的发酵生产控制提供理论支持。此外,跟踪监测红茶菌液猕猴桃果酒发酵过程中体外抗氧化活性的变化,为红茶菌液猕猴桃果酒的工业化生产提供基础数据。
猕猴桃:采摘于信阳市商城县野生猕猴桃基地;红茶菌菌膜:济宁市兖州区创客电子商务有限公司;安琪高活性果酒干酵母SY:湖北省宜昌市安琪酵母股份有限公司;毛尖:信阳市云尖茶叶有限公司;果胶酶(1×106 U/g):河南万邦实业有限公司。其他试剂均为国产分析纯。
A390紫外分光光度计:翱艺仪器(上海)有限公司;DZKW-D-2电热恒温水浴锅:北京市永光明医疗仪器有限公司;SPX-250BⅢ电热恒温生化培养箱:北京科伟永兴仪器制造有限公司;UB100i生物双目显微镜:北京荣兴光恒技术有限公司。
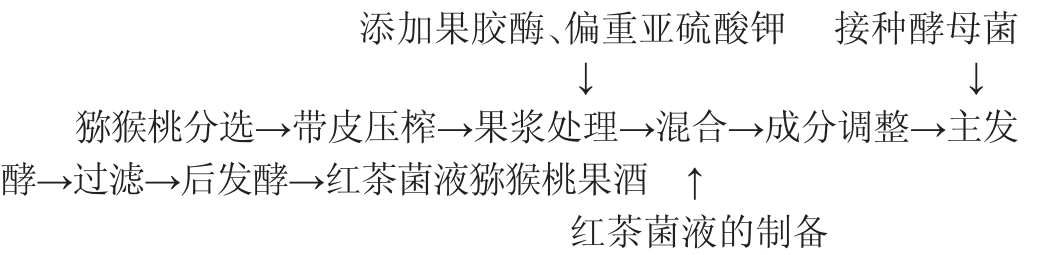
1.3.1 红茶菌液猕猴桃果酒发酵工艺流程及操作要点

操作要点:
原料预处理:选择成熟、香气浓郁、品质优良的猕猴桃,清洗外表皮后,放入破壁机中进行破碎打浆,直至无块状物存在且浆液细腻绵密停止破碎,放置备用。
果浆的处理:在带皮猕猴桃汁中添加50 mg/L果胶酶于60 ℃的恒温水浴锅中酶解24 h,果胶酶有助于野生猕猴桃中果胶的分解,提高出汁率。添加60 mg/L偏重亚硫酸钾产生SO2,起到保鲜、杀菌的作用。
红茶菌液的制备:将实验室保存的的红茶菌菌膜(20 g)倒入已灭菌的500 mL玻璃发酵罐中,加入200 mL煮沸后冷却的含糖茶水(500 mL开水中加入2.5 g毛尖和50 g白糖),28 ℃条件下静置发酵,当液面上长出新的菌膜且厚度大约为3 mm后停止发酵[10],即可获得红茶菌菌液,同时将红茶菌液进行煮沸灭菌。
果浆与红茶菌液混合:将果浆与红茶菌液按照体积比1∶2进行混合。
成分调整:通过添加白砂糖和柠檬酸,调整混合液的糖度为21°Bx,pH值为3.4,以平衡口感并促进发酵。
酵母活化:取适量安琪酵母,按料液比1∶9(g∶mL)加入无菌水,30 ℃水浴活化30 min。
主发酵:将混合液装入发酵罐中,体积不超过发酵罐的2/3,接种0.05%的活化安琪酵母,28 ℃培养。为了确保料液与酵母能够完全接触并进行发酵,需要在发酵过程中每天搅拌一次,整个发酵周期大约为8 d,当酒精度和残糖的含量在3 d内保持不变时,结束发酵。
过滤:使用8层干纱布对发酵液进行多次过滤以获得酒液,去除多余酵母粒及发酵物残渣,以使最终的酒液更加透亮和有光泽。
后发酵:将过滤后的酒液置于15 ℃低温发酵1个月,即得红茶菌液猕猴桃果酒成品。
1.3.2 酵母活菌数及理化指标的测定
酵母菌活菌数的测定:采用血球计数板[11];还原糖含量的测定:根据GB/T 15038—2006《葡萄酒、果酒通用分析方法》采用费林试剂滴定法;乙醇生成量的测定:根据GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》采用酒精计法。
1.3.3 发酵动力学模型的建立及验证
红茶菌液猕猴桃果酒发酵过程中,每隔48 h取样,测定酵母菌活菌数、还原糖含量及乙醇含量,采用Logistic、SGompertz、DoseResp 和Boltzmann模型进行非线性拟合,利用模型公式对微生物生长、基质消耗及产物生成的规律进行直观表示[12],预测其发酵过程变化。选取最佳的动力学模型对发酵过程中微生物代谢活动进行定量分析描述,通过测定红茶菌液猕猴桃果酒发酵过程中酵母菌活菌数、还原糖含量及乙醇含量,将模型预测值与实际测定值进行比较。
1.3.4 活性成分及体外抗氧化活性测定
总酚含量的测定:参考汪娣等[13]的Folin-Ciocalteu法;总黄酮含量的测定:参考黄艳丽等[14]的NaNO2-Al(NO3)3显色分光光度法;OH自由基清除率的测定:参考宫祥博等[15]的水杨酸比色法;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基清除率的测定:参考谭敏华等[16]的方法;2,2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基清除率的测定:参考宋艺君等[17]的方法。
1.3.5 数据处理
所有试验均重复3次,应用Origin 2021软件对试验数据进行非线性拟合,建立发酵动力学模型。
2.1.1 红茶菌液猕猴桃果酒发酵过程中动力学参数的测定
红茶菌液猕猴桃果酒发酵过程中酵母菌活菌数、还原糖含量及乙醇生成量的变化规律见图1。由图1可知,酵母菌活菌数变化曲线符合“S”型生长曲线,在发酵48~120 h时迅速上升,在发酵120 h达到最高,对应酵母菌活菌数为12.29×107 CFU/mL。乙醇生成量变化趋势与酵母菌活菌数变化趋势相一致,在发酵24~144 h间,乙醇生成量增幅较快,并在发酵144 h达到峰值,对应乙醇生成量为9.54%vol。还原糖含量在发酵48~120h时急剧下降,在发酵时间>120h之后趋于平缓,发酵结束时还原糖含量为21.11 g/L。此结论与张琪等[18]的沙棘果酒发酵过程中的还原糖含量变化趋势一致。
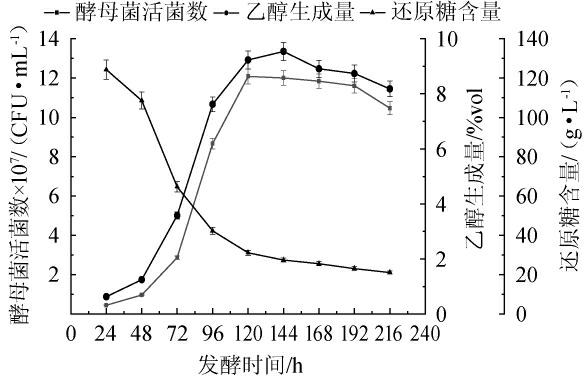
图1 红茶菌液猕猴桃果酒发酵过程中酵母菌活菌数、还原糖含量及乙醇生成量的变化规律
Fig.1 Changes of viable yeast counts, reduced sugar contents and ethanol production during the fermentation of black tea fungus liquid kiwifruit wine
2.1.2 酵母菌生长动力学模型的建立
采用Logistic模型、SGompertz模型和Boltzmann模型对红茶菌液猕猴桃果酒发酵过程中酵母菌活菌数的变化进行非线性拟合,拟合曲线见图2,拟合方程和相关系数见表1。由图2及表1可知,3种模型的相关系数R2分别为0.985 1、0.979 1和0.987 3。其中,Boltzman模型的相关系数R2最高,说明该模型对酵母菌生长量的拟合性最好,这与李敏杰等[19]的研究结果一致。
表1 酵母菌生长量发酵动力学模型的拟合方程及相关系数
Table 1 Fitting equation and correlation coefficient of yeast growth fermentation kinetics model

模型 拟合方程 相关系数R2 Logistic SGompertz Boltzmann y=11.67+ 0.63-11.67 1+ex-85.63 9.43 y=11.68×e-e[-0.07(x-77.01)]y=11.67+ 0.63-11.67 1+ex-85.63 0.985 1 0.979 1 0.987 3 9.43
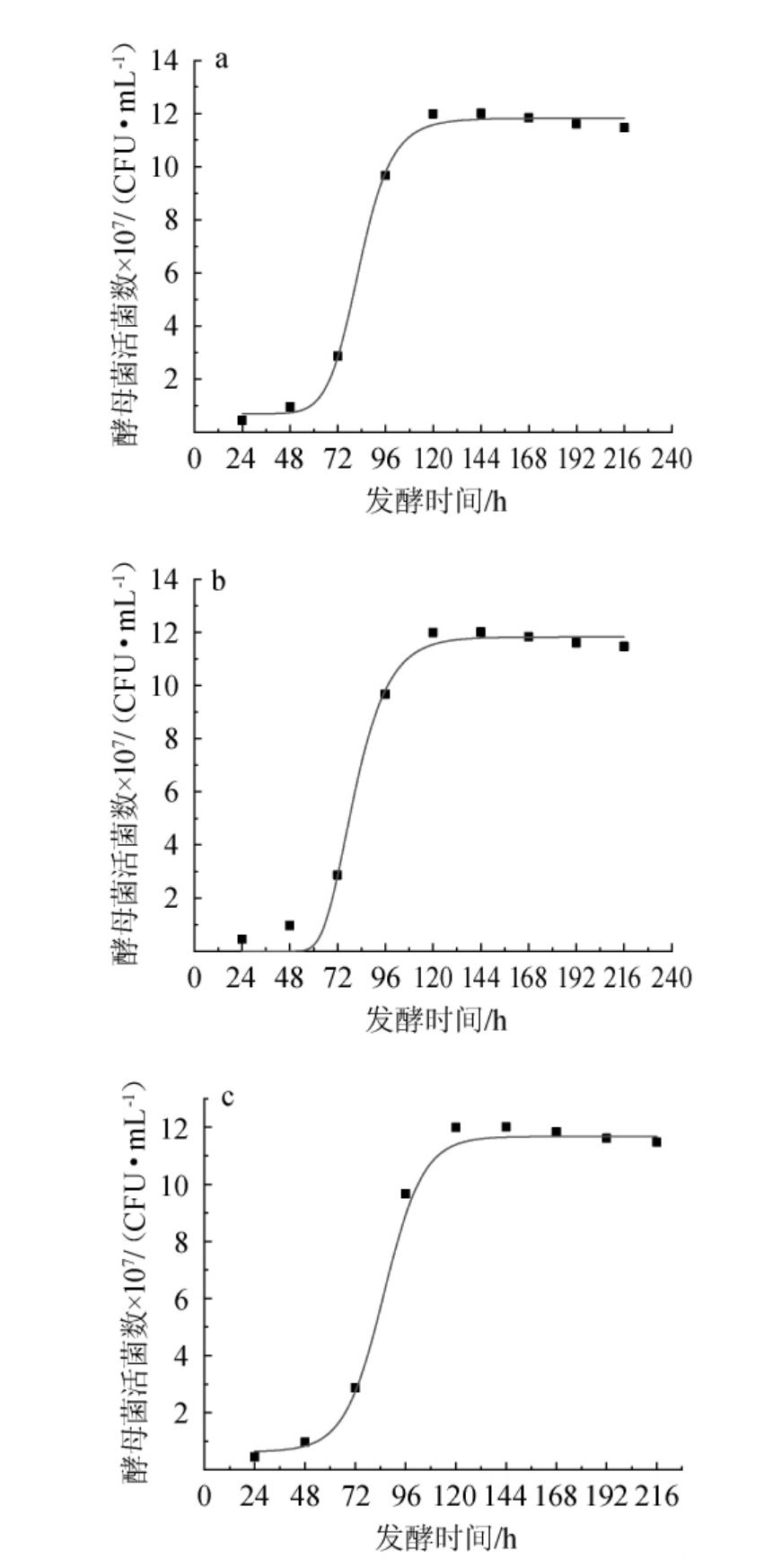
图2 红茶菌液猕猴桃果酒发酵过程中酵母菌生长量Logistic模型(a)、SGompertz模型(b)及Boltzmann模型(c)拟合曲线图
Fig.2 Fitting curves of the Logistic model (a), SGompertz model (b)and Boltzmann model (c) of yeast growth during the fermentation of black tea fungus liquid kiwifruit wine
2.1.3 乙醇生成动力学模型的建立
采用Logistic模型、SGompertz模型和Boltzmann模型对红茶菌液猕猴桃果酒发酵过程中乙醇生成量的变化进行非线性拟合,拟合曲线见图3,拟合方程和相关系数见表2。由图3及表2可知,3种模型的相关系数分别为0.986 2、0.970 1、0.988 1,其中Boltzmann模型的相关性系数最高,说明该模型对乙醇生成量的拟合度更高,这与刘玉成等[20]的研究结果一致。
表2 乙醇生成量发酵动力学模型的拟合方程及相关系数
Table 2 Fitting equation and correlation coefficient of fermentation kinetics model of ethanol production

模型 拟合方程 相关系数R2 Logistic SGompertz Boltzmann y=8.94+ (0.88-8.94)1+ x 78.00( )8.67 e-e[-0.06×(x-67.79)](0.71-8.93)y=9.03×y=8.93+1+e(x-78.29)0.986 2 0.970 1 0.988 1 10.16
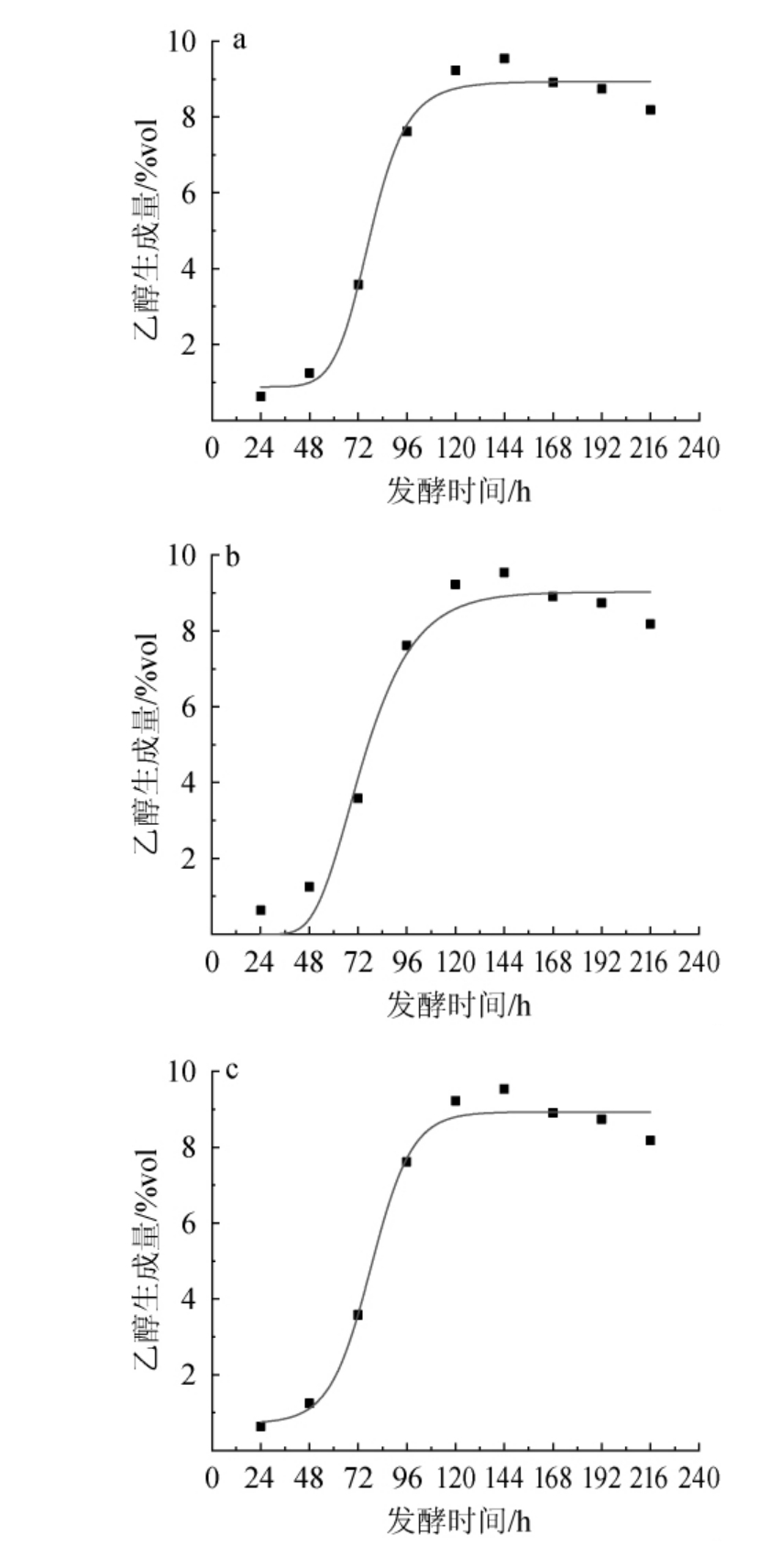
图3 红茶菌液猕猴桃果酒发酵过程中乙醇生成量Logistic模型(a)、SGompertz模型(b)及Boltzmann模型(c)拟合曲线图
Fig.3 Fitting curves of the Logistic model (a), SGompertz model (b)and Boltzmann model (c) of ethanol yield during the fermentation of black tea fungus liquid kiwifruit wine
2.1.4 还原糖消耗动力学模型的建立
在果酒发酵过程中还原糖的消耗模型包括底物消耗以维持细胞呼吸新陈代谢作用、供给菌体生长、形成产物三部分[21]。采用Logistic模型、Dose Resp模型和Boltzmann模型对红茶菌液猕猴桃果酒发酵过程中还原糖含量的变化进行非线性拟合,拟合曲线见图4,拟合方程和相关系数见表3。
表3 还原糖含量发酵动力学模型的拟合方程及相关系数
Table 3 Fitting equation and correlation coefficient of fermentation kinetics model of reducing sugar contents

模型 拟合方程 相关系数R2 Logistic y=22.64+ 126.32-22.34 1+ x 67.28( )4.32 135.60-24.50 0.998 5 Dose Resp y=24.50+1+10(64.78-x)×(-0.02)0.995 3 Boltzmann y=24.50+ 135.60-24.501+e(x+64.78)17.39 0.995 3
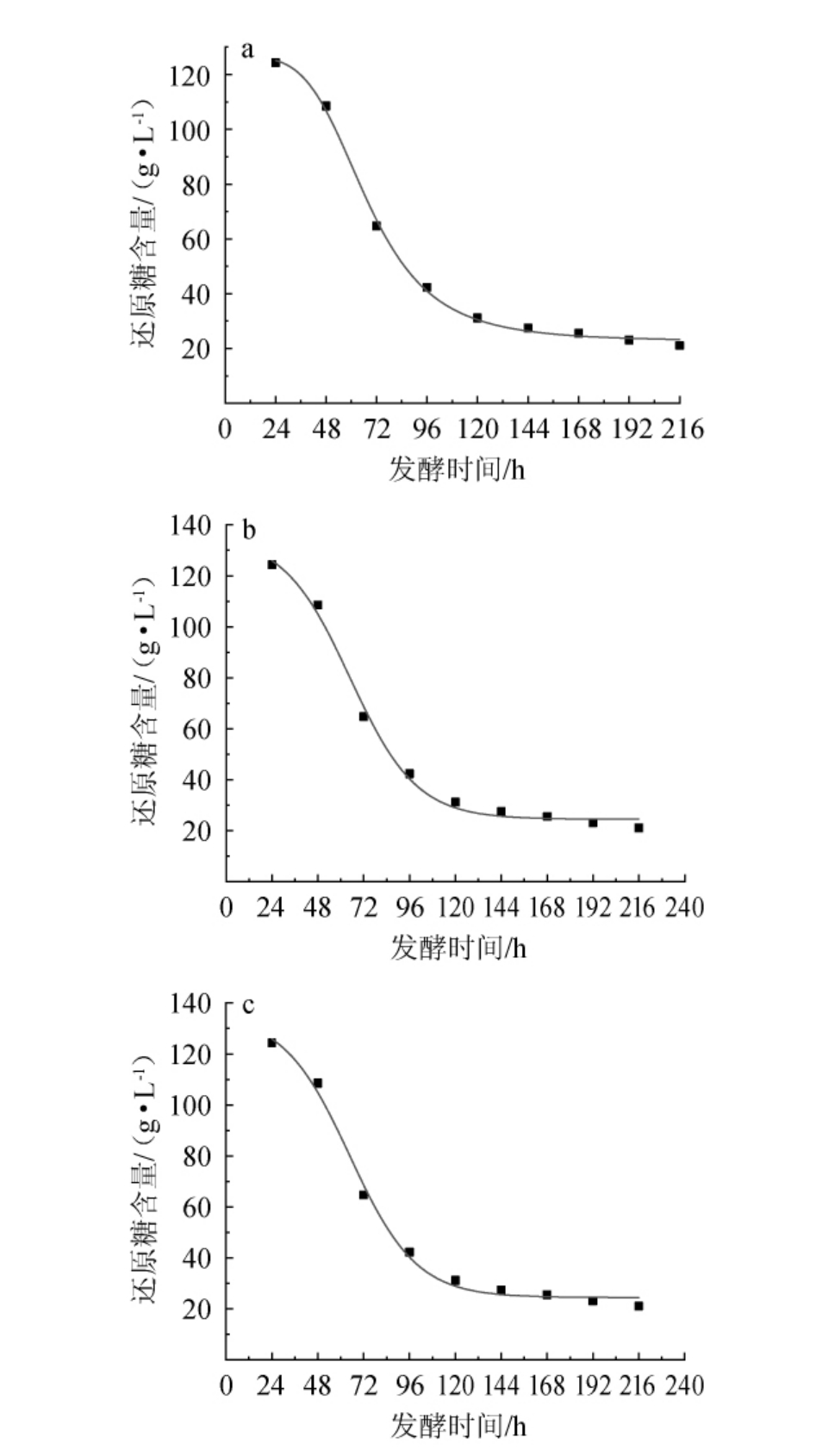
图4 红茶菌液猕猴桃果酒发酵过程中还原糖含量Logistic模型(a)、Dose Resp模型(b)及Boltzmann模型(c)拟合曲线图
Fig.4 Fitting curves of Logistic model (a), Dose Resp model (b) and Boltzmann model (c) of reducing sugar contents during the fermentation of black tea fungus liquid kiwifruit wine
由图4和表3可知,3种模型的相关系数R2分别为0.998 5、0.995 3、0.995 3,其中Logistic模型的相关性系数R2最高,说明该模型对还原糖含量的拟合度最高,能够较好的描述红茶菌液液猕猴桃果酒发酵过程中还原糖消耗的动态过程。这与张阳阳等[22]在蓝莓猕猴酒发酵动力学研究中对还原糖消耗动力学方程所建模型一致。
2.1.5 发酵动力学模型验证
为确定试验拟合模型的可靠性,对模型的预测值和试验值进行比对,结果见表4。由表4可知,模型的预测值与试验值相对误差均<15%,说明预测值与试验值相近,模型可靠,能够较好的描述红茶菌液液猕猴桃果酒发酵过程中酵母菌生长、乙醇生成及还原糖消耗的动态过程。
表4 红茶菌液猕猴桃果酒发酵动力学模型预测值与试验值比较结果
Table 4 Comparison results between the predicted value of the model and experimental value of black tea fungus liquid kiwifruit wine fermentation kinetics
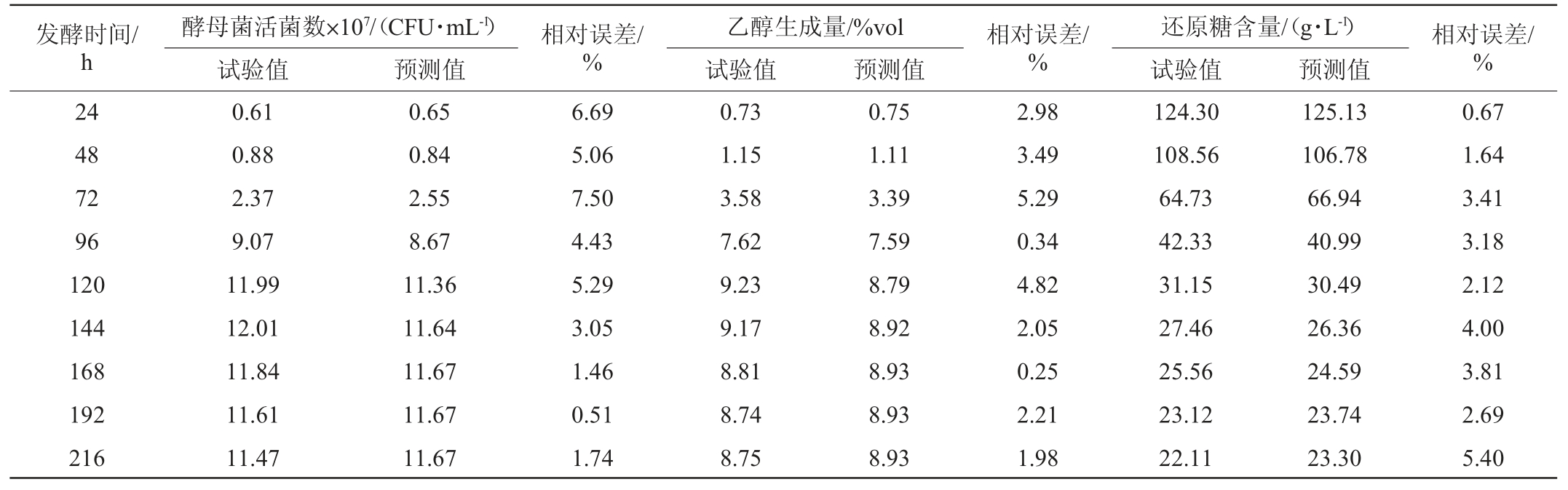
发酵时间/h 24 48 72 96 120 144 168 192 216酵母菌活菌数×107/(CFU·mL-1) 相对误差/%乙醇生成量/%vol 相对误差/%还原糖含量/(g·L-1) 相对误差/%试验值 预测值 试验值 预测值 试验值 预测值0.61 0.88 2.37 9.07 11.99 12.01 11.84 11.61 11.47 0.65 0.84 2.55 8.67 11.36 11.64 11.67 11.67 11.67 6.69 5.06 7.50 4.43 5.29 3.05 1.46 0.51 1.74 0.73 1.15 3.58 7.62 9.23 9.17 8.81 8.74 8.75 0.75 1.11 3.39 7.59 8.79 8.92 8.93 8.93 8.93 2.98 3.49 5.29 0.34 4.82 2.05 0.25 2.21 1.98 124.30 108.56 64.73 42.33 31.15 27.46 25.56 23.12 22.11 125.13 106.78 66.94 40.99 30.49 26.36 24.59 23.74 23.30 0.67 1.64 3.41 3.18 2.12 4.00 3.81 2.69 5.40
2.2.1 红茶菌液猕猴桃果酒中总酚和总黄酮含量的测定
猕猴桃中含有丰富的酚类物质,不仅影响猕猴桃的品质和猕猴桃果酒的感官特性、营养性质,而且是发挥抗氧化的主要成分[23]。红茶菌液猕猴桃果酒发酵过程中总酚及总黄酮含量的变化见图5。由图5可知,红茶菌液猕猴桃果酒中的总酚与总黄酮含量均呈现先升高后下降的趋势,当发酵192h时,均达到最高值,分别为1101.69mg/mL、735.35mg/mL。分析原因可能是,随着发酵时间延长,酵母菌发酵代谢过程中产生的酶酵素多酚等大分子物质分解所致[24-25]。
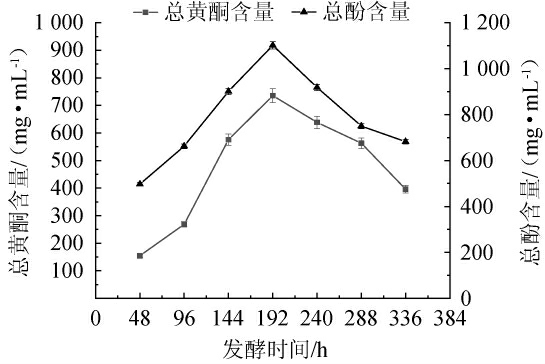
图5 红茶菌液猕猴桃果酒发酵过程中总酚和总黄酮含量的变化
Fig.5 Changes of total phenols and total flavonoids contents during the fermentation of black tea fungus liquid kiwifruit wine
2.2.2 红茶菌液猕猴桃果酒发酵过程中抗氧化能力的变化
红茶菌液猕猴桃果酒发酵过程中抗氧化能力的变化见图6。由图6可知,随着发酵时间的延长,红茶菌液猕猴桃果酒对DPPH自由基与ABTS自由基的清除率均呈先升高后降低的趋势,对OH自由基的清除率呈上升趋势。当发酵192 h时,DPPH自由基和ABTS自由基的清除率达到了93.6%和91.50%;当发酵336 h时,OH自由基清除率达到为54.48%。分析原因可能是,由于发酵过程中乙醇含量升高,导致原料中的多酚和黄酮不断溶出至使发酵的抗氧化活性提升,但随着发酵时间的延长,糖含量减少,酵母的代谢产物与酚类、黄酮类发生反应,造成抗氧化活性物质减少,进而导致抗氧化活性降低[26]。
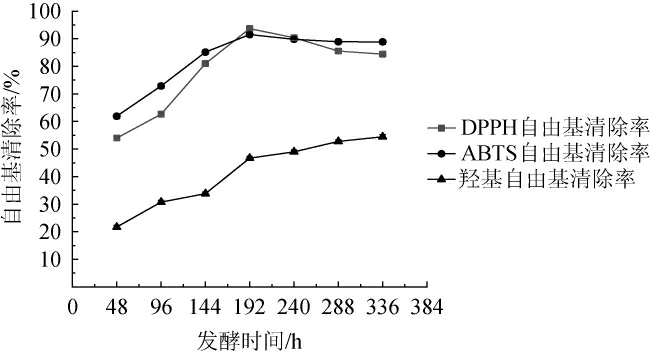
图6 红茶菌液猕猴桃果酒发酵过程中DPPH、ABTS及·OH自由基清除率的变化
Fig.6 Changes of DPPH, ABTS and·OH free radical scavenging rate during the fermentation of black tea fungus liquid kiwifruit wine
本研究采用以带皮猕猴桃、红茶菌液为原料发酵制备红茶菌液猕猴桃果酒,反映酵母菌生长及乙醇生成变化的Boltzmann模型、还原糖消耗的Logistic模型的相关系数R2均>0.98,可有效反映红茶菌液猕猴桃果酒发酵过程中的动力学特征。随着发酵时间的延长,红茶菌液猕猴桃果酒中总酚及总黄酮含量均呈先升高后下降的趋势,发酵192 h时均达到最高,分别为1 101.69 mg/mL和735.35 mg/mL;DPPH和ABTS自由基清除率均呈先升高后下降的趋势,发酵192 h时均达到最高,分别为93.6%、91.5%;OH自由基清除率呈升高趋势,发酵336 h时达到最高,为54.48%。本研究结果揭示了红茶菌液猕猴桃果酒发酵过程中代谢产物及抗氧化活性的变化规律,为红茶菌液猕猴桃果酒的工业化生产提供理论依据。
[1]孙锐劼,李刚,刘瑶,等.猕猴桃果酒酿造工艺优化研究[J].现代食品,2021(18):109-112,124.
[2]周艳,李华佳,李可,等.猕猴桃发酵果酒生产工艺研究进展[J].中国酿造,2023,42(3):23-27.
[3]张娅妮.猕猴桃果皮多酚类物质的提取、分离及对B16细胞黑色素抑制作用的研究[D].西安:陕西师范大学,2023.
[4]杨智博,张子涵,何依璇,等.基于GC-IMS和HS-SPME-GC-MS技术探究带皮发酵对猕猴桃果酒挥发性物质的影响[J].食品科学,2024,45(2):203-212.
[5]钟武,王腾腾,张娜威,等.带皮发酵对‘金艳’猕猴桃果醋品质的影响[J].食品科学,2020,41(22):74-81.
[6]万旺,王娟,夏思营.红茶菌液饮料发酵工艺及保健功效研究进展[J].热带农业科技,2021,44(1):41-46.
[7]王利平.红茶菌液酒生产工艺及保健功效的研究进展[J].食品安全导刊,2021(19):141-142.
[8]熊亚,李敏杰.红茶菌液酒发酵动力学模型的建立及抗氧化性研究[J].食品科技,2020,45(11):90-95.
[9]毛亚玲,李俊娥,于静,等.酒酒球菌和酿酒酵母共接种发酵动力学模型建立[J].食品科学,2023,44(2):156-164.
[10]李敏杰,熊亚.红茶菌液芒果复合酒的发酵动力学模型及其抗氧化活性[J].现代食品科技,2020,36(12):220-226,266.
[11]李秀萍,陆兵,郑平,等.甘蔗果酒补料分批发酵工艺优化及成分分析[J].中国食品添加剂,2023,34(3):180-187.
[12]RIVAS-ASTROZA M,PAREDES I,GUERRERO KARLO.Kinetic model of Clostridium beijerinckii's acetone-butanol-ethanol fermentation considering metabolically diverse cell types[J].J Biotechnol,2021,342(6):1-12.
[13]汪娣,曾雪莹,胡玉清,等.野樱莓果酒酿造工艺优化及抗氧化活性分析[J].食品工业,2023,44(6):26-30.
[14]黄艳丽,尹锦荣,赵秀,等.多依果红心火龙果复合果酒发酵工艺优化及抗氧化活性分析[J].食品安全质量检测学报,2022,13(8):2672-2679.
[15]宫祥博,延海莹,田迎樱,等.红树莓发酵果酒及其抗氧化活性[J].食品工业,2020,41(12):236-240.
[16]谭敏华,张巧苑,于立梅,等.柚子全果果酒发酵工艺优化及其抗氧化活性、挥发性成分分析[J].食品工业科技,2021,42(13):149-155.
[17]宋艺君,郭涛,刘世军,等.响应面法优化黄精-大枣果酒发酵工艺及其抗氧化活性[J].食品工业科技,2021,42(1):156-161.
[18]张琪,朱丹,牛广财,等.沙棘果酒发酵动力学及其抗氧化活性[J].食品与发酵工业,2019,45(15):53-58.
[19]李敏杰,熊亚.嘉宝果果酒发酵动力学模型的建立[J].食品科技,2022,47(9):83-87.
[20]刘玉成,张俊琴.沙棘果酒低温发酵还原糖指标的动力学研究[J].酿酒科技,2022(6):26-29.
[21]熊亚,李敏杰,刘姗.桑葚-草莓复合果酒发酵动力学模型建立[J].食品研究与开发,2021,42(5):77-81.
[22]张阳阳,靳羽慧,王荣荣,等.蓝莓猕猴桃酒发酵动力学模型的研究[J].食品科技,2023,48(7):79-84.
[23]WANG W,GAO Y T,WEI J W,et al.Optimization of uitrasonic cellulaseassisted extraction and antioxidant activity of natural polyphenols from passion fruit[J].Molecules,2021,26(9):2494-2496.
[24]孙时光,左勇,张诗琪,等.基于发酵动力学模型的桑椹果酒发酵过程中抗氧化活性[J].食品工业,2019,40(8):146-151.
[25]周佳悦,夏晓雨,候艳丽,等.不同发酵方式蓝莓果酒发酵过程中理化指标和抗氧化能力的动态变化[J].中国酿造,2023,42(5):132-138.
[26]陈林,苏珊,吴应梅,等.红阳猕猴桃酵素发酵工艺优化及其体外抗氧化活性[J].现代食品科技,2021,37(4):224-233.