酿酒酵母YY-02产胞外多糖发酵条件优化及其功能特性分析
王长丽1,张 称2,宾晓芸1,赵云慧3,张云野4,叶广彬5*
(1.右江民族医学院 基础医学院,广西 百色533000;2.右江民族医学院 医学检验学院,广西 百色533000;3.右江民族医学院 医学影像学院,广西 百色533000;4.右江民族医学院 全科医学院,广西 百色533000;5.右江民族医学院 生命科学研究院,广西 百色533000)
摘 要:该研究以酿酒酵母(Saccharomyces cerevisiae)YY-02为供试菌株,以初始发酵培养基为培养基质发酵产胞外多糖(EPS),采用单因素试验及响应面法优化其发酵条件,并对其EPS的功能特性(持水性、水溶性、乳化性及抗氧化特性)进行研究。结果表明,菌株YY-02产胞外多糖最佳培养基配方为:蔗糖73 g/L、酵母提取物21 g/L、NH4Cl 2.0 g/L,KH2PO4 2.0 g/L、CaCl2 0.3 g/L;最佳培养条件为装液量141 mL/250 mL、接种量2%、初始pH 7.0、发酵时间144 h及发酵温度30 ℃。在此优化条件下,EPS产量达到4.52 g/L,是优化前的2.50倍。菌株YY-02所产EPS的总糖、糖醛酸、蛋白质、硫酸盐含量分别为83.65%、15.27%、0.78%和0.30%,其持水性(WHC)和水溶性指数(WSI)分别为229.67%、75.23%;当EPS质量浓度为1 g/L时,对有机相汽油、大豆油、苯甲醛、石油醚的乳化性均>25%;当EPS质量浓度为3 mg/mL,对2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS+)、O2-自由基及H2O2的清除率最高,分别为24.8%、43.79%和11.40%。因此,酿酒酵母YY-02具有一定的抗氧化活性。
关键词:酿酒酵母;胞外多糖;功能特性;发酵条件优化;响应面法
中图分类号:TS201.3
文章编号:0254-5071(2025)03-0214-09
doi: 10.11882/j.issn.0254-5071.2025.03.032
引文格式:王长丽,张称,宾晓芸,等.酿酒酵母YY-02产胞外多糖发酵条件优化及其功能特性分析[J].中国酿造,2025,44(3):214-222.
收稿日期:2024-05-29 修回日期:2024-09-30
基金项目:广西高校中青年教师基础能力提升项目(2022KY0547);国家级大学生创新创业训练计划项目(202210599020);自治区教育厅创新创业训练计划项目(S202210599042,S202210599065,S202210599091);2021年右江民族医学院“新启航”青年骨干项目(DC2200001896)
作者简介:王长丽(1992-),女,讲师,硕士,研究方向为微生物资源挖掘与利用。
*通讯作者:叶广彬(1989-),男,实验师,博士,研究方向为微生物资源挖掘与利用。
Optimization of fermentation conditions of exopolysaccharide production from Saccharomyces cerevisiae YY-02 and its functional properties analysis
WANG Changli1,ZHANG Cheng2,BIN Xiaoyun1,ZHAO Yunhui3,ZHANG Yunye4,YE Guangbin5*
(1.School of Basic Medical Sciences,Youjiang Medical University for Nationalities,Baise 533000,China;2.School of Laboratory Medicine,Youjiang Medical University for Nationalities,Baise 533000,China;3.School of Medical Imaging,Youjiang Medical University for Nationalities,Baise 533000,China;4.School of General Medicine,Youjiang Medical University for Nationalities,Baise 533000,China;5.Institute of Life Sciences,Youjiang Medical University for Nationalities,Baise 533000,China)
Abstract:Exopolysaccharide(EPS)was produced by fermentation using Saccharomyces cerevisiae YY-02 as the test strain and initial fermentation medium as the culture medium.The fermentation conditions were optimized by single factor tests and response surface tests,and the functional properties(water retention,water solubility,emulsification and antioxidant properties)of EPS were studied.The results showed that the optimal medium formula for polysaccharide production by strain YY-02 was as follows:sucrose 73 g/L,yeast extract 21 g/L,NH4Cl 2.0 g/L,KH2PO4 2.0 g/L,CaCl2 0.3 g/L.The optimal culture conditions were obtained as follows:loading liquid volume 141 ml/250 ml,inoculum 2%,initial pH 7.0,fermentation time 144 h,and temperature 30 ℃.Under this optimization conditions,EPS yield reached 4.52 g/L,which was 2.50 times more than before optimization.The contents of total sugar,uronic acid,protein and sulfate of EPS produced by strain YY-02 were 83.65%,15.27%,0.78%and 0.30%,respectively.The water retention(WHC)and water solubility index(WSI)were 229.67%and 75.23%,respectively.When the mass concentration of EPS was 1 g/L,the emulsification of organic phase gasoline,soybean oil,benzaldehyde and petroleum ether was more than 25%.When the mass concentration of EPS was 3 g/L,the scavenging rates of 2,2'-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid)(ABTS+),O2-free radical and H2O2 were the highest,which were 24.8%,43.79%and 11.40%,respectively.Therefore,S.cerevisiae YY-02 had certain antioxidant activity.
Key words:Saccharomyces cerevisiae;exopolysaccharide;functional property;fermentation condition optimization;response surface method
微生物胞外多糖(exopolysaccharide,EPS)是由微生物生长代谢过程中产生和分泌到细胞外环境中的一种高分子聚合物,具有抗氧化、抗肿瘤、抗病毒、增强机体免疫力、降低胆固醇等多种生物活性功能,广泛应用于食品与医药等领域[1-2]。目前,多以微生物发酵法制备,常见菌种为细菌、霉菌、放线菌和酵母菌,酵母菌中的酿酒酵母(Saccharomyces cerevisiae)是国际公认安全(generally recognized as safe,GRAS)微生物,其优势在于成本低、安全无毒且环保[3],且发酵培养易提取、黏度低、稳定性高[4],但酵母菌合成EPS的产量较低,不利于大规模工业化生产。因此,提高酵母菌EPS产量是目前研究人员关注的热点。
酵母菌EPS的产生与次生代谢有关,生物合成取决于许多因素,包括培养基的组成和发酵条件,如碳源、氮源、初始pH、发酵温度和接种量等[5]。GIENTKA I等[6]对假丝酵母(Candida)产EPS的碳源进行优化后,EPS产量从4.43 g/L增加到7.80 g/L。包怡红等[7]从自然界中分离出一株东方伊萨酵母(Issatchenkia orientalis),经单因素和响应面试验优化后,EPS产量提高了79.9%。杨迎凤等[8]通过对酵母菌YF01-g产EPS的基础培养基成分进行响应面试验优化后,EPS产量最高值为4.67 g/L。此外,也有关于其抗氧化特性的研究报道,孙晓萌等[9]研究发现,获得季也蒙假丝酵母(Candida guilliermondii)EPS2-1对超氧阴离子和羟基自由基的清除率可达53.22%和100%。赵英杰等[10]通过响应面试验优化碳源后,金黄蝶形担孢酵母(Papiliotrema aurea)DF-12 EPS产量可达3.51 g/L,其抗氧化活性比优化前均有所提高。此外,由于酵母菌培养基成分比较复杂,有必要对其培养条件进行优化。
本研究以产EPS的酿酒酵母YY-02为研究对象,以基础发酵培养基为培养基质,通过单因素试验、Plackett-Burman(PB)试验、最陡爬坡试验及响应面试验对其产EPS培养条件进行优化,并对所制备EPS的功能特性(持水性、水溶性、乳化性及抗氧化特性)及抗氧化特性进行研究,因此,旨在提高酿酒酵母YY-02胞外多糖(EPS)产量,为功能性食品研发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母(Saccharomyces cerevisiae)YY-02:右江民族医学院生命科学研究院分离鉴定并保藏。
1.1.2 试剂
氯化铵(NH4Cl)、氯化钙(CaCl2)、磷酸二氢钾(KH2PO4)、三氯乙酸(trichloroacetic acid,TCA)、苯酚、浓硫酸(H2SO4)、硫酸镁(MgSO4)、氯化铵(NH4Cl)、硫酸铵((NH4)2SO4)、无水乙醇:北京市奥博星生物技术有限公司。本研究所用试剂均为分析纯化或生化试剂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)琼脂培养基:葡萄糖20 g/L、蛋白胨20 g/L、琼脂粉20 g/L、酵母提取液10 g/L,初始pH值自然。
YPD液体种子培养基:葡萄糖20 g/L、蛋白胨20 g/L、酵母提取液10 g/L,初始pH值自然。
初始发酵培养基:参考ZHAO D等[11]的方法并稍作修改,蔗糖80 g/L,酵母提取物20 g/L,NH4Cl 1.5 g/L,KH2PO4 1.5 g/L,CaCl2 0.3 g/L,初始pH 6.0。
以上培养基均于121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
DHP-420电热恒温培养箱:上海一恒科学仪器有限公司;PL1501电子分析天平、FE20pHMeterpH计:梅特勒-托利多(上海)有限公司;X-15R高速冷冻离心机:美国Beckman Coulter有限公司;UVmini-1240紫外可见分光光度计:岛津国际贸易上海有限公司。
1.3 方法
1.3.1 酿酒酵母YY-02发酵产EPS培养条件
斜面培养:将-20 ℃保藏的酿酒酵母YY-02菌株接种于YPD斜面培养基中,30 ℃恒温培养5 d,活化备用。
液体种子培养:将活化后的菌株接种于YPD液体种子培养基中,30 ℃,140 r/min条件下,培养48 h,备用。
发酵培养:按照5%(V/V)的接种量将培养好的液体种子接种于初始发酵培养基(装液量100 mL/250 mL),在发酵温度30 ℃、摇瓶转速140 r/min条件下培养36 h。
1.3.2 产EPS培养基组成及发酵条件优化
采用单因素轮换法,在初始发酵培养基组成及初始发酵条件的基础上,依次考察碳源种类(葡萄糖、果糖、乳糖、半乳糖、蔗糖、麦芽糖、甘露糖)(碳源添加量为80 g/L)、碳源添加量(20 g/L、30 g/L、40 g/L、50 g/L、60 g/L、70 g/L、80 g/L、90 g/L),有机氮源种类(酵母提取物、胰蛋白胨、牛肉膏和蛋白胨)(有机氮源添加量为20 g/L)、有机氮源添加量(0 g/L、5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L),无机氮源种类((NH4)2SO4、NH4Cl)(无机氮源添加量为1.0 g/L)、无机氮源添加量(0 g/L、0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L),无机盐种类(KH2PO4、MgSO4、CaCl2、NaCl)(KH2PO4添加量为1.5 g/L,其他无机盐添加量为0.3 g/L)、CaCl2添加量(0.1 g/L、0.2g/L、0.3g/L、0.4g/L、0.5g/L、0.6g/L),KH2PO4添加量(0.5g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L)及装液量(60 mL/250 mL、80 mL/250 mL、100 mL/250 mL、120 mL/250 mL、140 mL/250 mL、160 mL/250 mL)、接种量(1%、2%、3%、4%、5%)、发酵温度(22 ℃、24 ℃、26 ℃、28 ℃、30 ℃、32 ℃)、初始pH(4、5、6、7、8、9)、发酵时间(24 h、48 h、72 h、96 h、120 h、144 h、168 h)对酿酒酵母YY-02 EPS产量的影响。
1.3.3 产EPS培养基组成和培养条件优化响应面试验
(1)Plackett-Burman(PB)试验设计
在单因素试验结果基础上,以EPS产量(Y)为响应值,选取对EPS产量影响较大的7个因素蔗糖添加量(X1)、酵母提取物添加量(X2)、NH4Cl添加量(X3)、KH2PO4添加量(X4)、CaCl2添加量(X5)、装液量(X6)、初始pH(X7)设计高低水平,利用软件Design-Expert 8.0.6进行PB试验,试验因素与水平见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experiment design
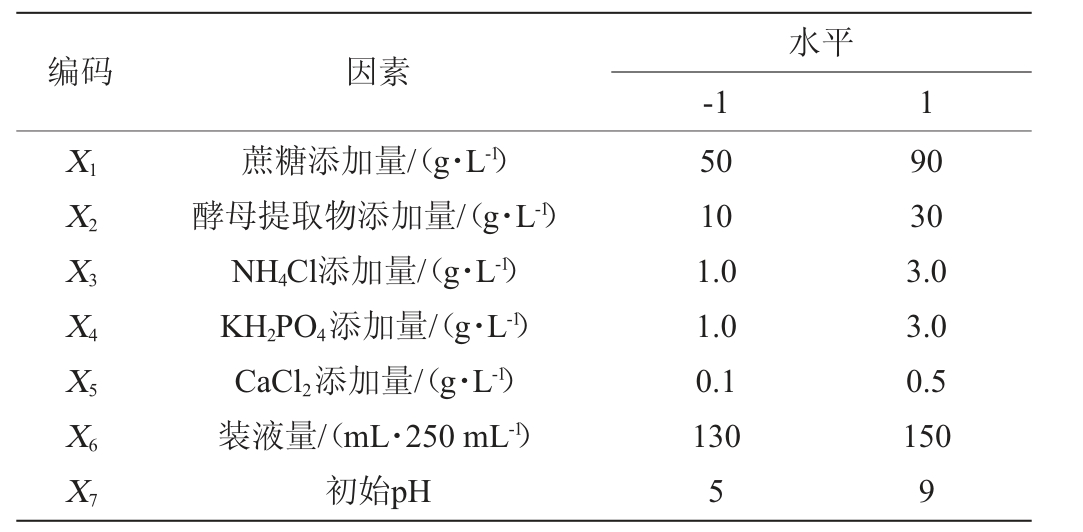
编码 因素水平-1 1 X1X2X3X4X5X6X7蔗糖添加量/(g·L-1)酵母提取物添加量/(g·L-1)NH4Cl添加量/(g·L-1)KH2PO4添加量/(g·L-1)CaCl2添加量/(g·L-1)装液量/(mL·250 mL-1)初始pH 50 10 1.0 1.0 0.1 130 5 90 30 3.0 3.0 0.5 150 9
(2)最陡爬坡试验
根据上述PB试验设计筛选出对EPS产量影响显著的因素,使用最陡爬坡试验根据响应值的变化梯度,确定最陡爬坡方向,进一步分析具有显著影响的因素对EPS产量的影响。
(3)中心组合试验
根据最陡爬坡试验初步得到蔗糖(X1)、酵母提取物(X2)和装液量(X6)合适范围,然后利用中心组合试验设计(central composite design,CCD)原理,设计3因素5水平试验优化培养基组成和培养条件,得到最优方案,CCD试验设计因素与水平见表2。
表2 中心组合试验设计因素与水平
Table 2 Factors and levels of central combination experiment design
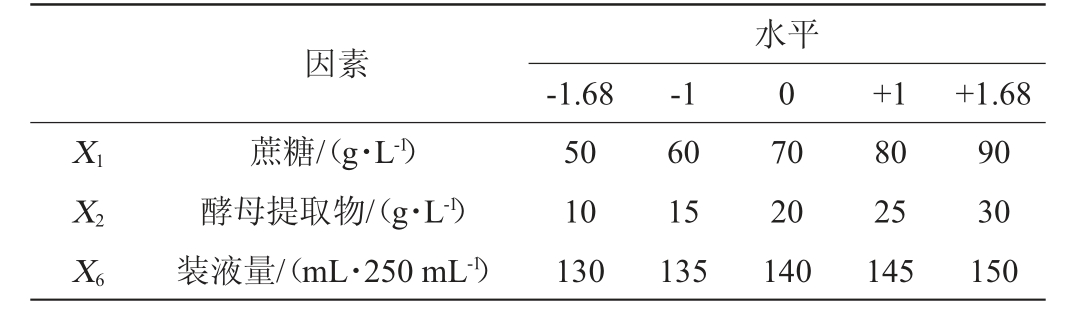
因素水平-1.68 -1 0 +1 +1.68 X1X2X6蔗糖/(g·L-1)酵母提取物/(g·L-1)装液量/(mL·250 mL-1)50 10 130 60 15 135 70 20 140 80 25 145 90 30 150
1.3.4 胞外多糖的提取
将酿酒酵母YY-02种子液以2%(V/V)接种量加入基础发酵培养基中,在140 r/min、30 ℃条件下培养36 h后离心(4 ℃、8 000×g)45 min后去除沉淀,取上清液加入3倍体积预冷的体积分数95%乙醇,4 ℃沉淀过夜后离心(4 ℃,8 000×g)45min,收集沉淀物并将其完全溶解于去离子水中,加入等体积的10%TCA,4 ℃搅拌孵育3 h。离心45 min(4 ℃,8 000×g)去除蛋白质,上清液装入透析袋,4 ℃透析2 d(每隔8 h换一次水),透析后冻干获得胞外多糖。
1.3.5 持水性、水溶性指数和乳化性测定
持水性(Waterholdingcapacity,WHC)的测定参照WANG Z M等[12]的研究方法。将纯化的EPS样品置于95 ℃烘箱中烘干4 h,取45 mg溶于0.5 mL超纯水中,漩涡振荡器振荡以充分溶解EPS,12 000 r/min离心40 min得到沉淀,收集未溶解部分用滤纸小心擦掉表面水分称质量,记为W1,将沉淀冷冻干燥后称质量,记为W2。WHC计算公式如下:
水溶性指数(water solubility index,WSI)的测定参照ZHAO D等[11]的研究方法,并在此基础上略有修改。将45 mg纯化的EPS样品溶于0.5 mL超纯水中,质量为M1,漩涡振荡器振荡以充分溶解EPS,12 000 r/min离心40 min得到沉淀进行冻干,冻干样品称其质量M2,WSI计算公式如下:
根据KANAMARLAPUDI S L R K等[13]的方法分析EPS的乳化性(emulsifying ability,EA)。将2.5 mL不同质量浓度的酿酒酵母YY-02 EPS(0.2 mg/mL、0.5 mg/mL、1.0 mg/mL)溶液与油类或烃类化合物2.5 mL(汽油、柴油、煤油、大豆油、苯甲醛、二甲苯、乙烷、石油醚)混合,测量液体总高度(H0),使用游标卡尺测量1 h、12 h、24 h和48 h乳化层高度(H1)。EA的计算公式如下:
1.3.6 抗氧化特性测定
(1)ABTS+自由基的清除活性的测定
参考孙晓萌等[9]研究方法。将0.2 mL不同质量浓度的EPS溶液(0 mg/mL、0.1 mg/mL、0.2 mg/mL、0.5 mg/mL、1.0 mg/mL、2.0 mg/mL、3.0 mg/mL)与4.0 mL 2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS)工作溶液混合测定反应后的样液吸光度值(A1),测定不同EPS样液在波长734 nm处的吸光度值(A2),室温孵育6 min,以抗坏血酸(vitamin C,VC)作为阳性对照,测定对照组的吸光度值(A0),计算清除活性,公式如下:
(2)H2O2的清除活性
EPS清除H2O2的试验参照张玉龙等[14]研究方法,并在此基础上略有修改。取1mL不同质量浓度(0mg/mL、0.1mg/mL、0.2 mg/mL、0.5 mg/mL、1.0 mg/mL、2.0 mg/mL、3.0 mg/mL)的EPS溶液,分别加入0.6 mL 40 mmol/L的H2O2溶液和2.4 mL 0.1 mmol/L的磷酸盐缓冲液(pH 7.4),室温孵育10 min,测定波长230 nm处的吸光度值,其中,对照的吸光度值为A0,与H2O2溶液反应后样品溶液的吸光度值为A1,EPS样品溶液的吸光度值为A2。计算清除率,公式如下:
(3)超氧阴离子自由基(O2-)的清除活性
O2-自由基清除试验参考龙丹丹等[15]研究方法。将1 mL不同质量浓度(0 mg/mL、0.1 mg/mL、0.2 mg/mL、0.5 mg/mL、1.0mg/mL、2.0mg/mL、3.0mg/mL)的EPS分别与3mL50mmol/L Tris-HCl缓冲溶液(pH=8.2)混合,25 ℃孵育20 min后,加入0.3 mL 30 mmo1/L邻苯三酚溶液,摇匀,25 ℃孵育5 min后加入1.0 mL HCl。以VC为阳性对照,测定波长325 nm处的吸光度值,其中,空白的吸光度值为A0,反应混合物值为A1和背景的吸光度值为A2,计算清除率,公式如下:
胞外多糖组分的测定:苯酚-硫酸法测定样品中总糖含量[16],Bradford法测定蛋白质含量,氯化钡-明胶比色法测定硫酸根离子含量[17]。
1.3.7 数据分析
所有试验均独立进行3次重复试验。采用Origin 2022软件绘图,采用SPSS.29.0.2.0软件处理数据,以“平均值±标准差”表示。
2 结果与分析
2.1 产EPS培养基组成和培养条件优化单因素试验
2.1.1 碳源对酿酒酵母YY-02产胞外多糖的影响
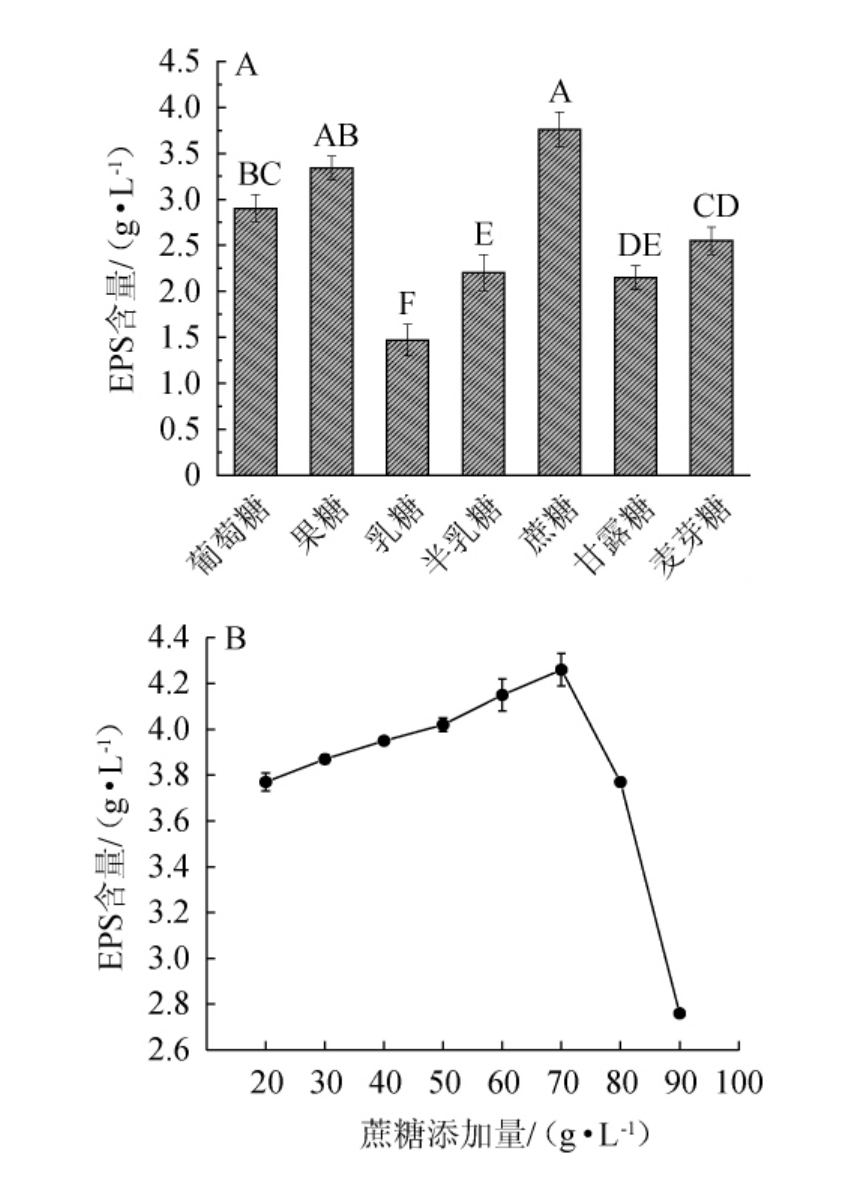
由图1A可知,7种碳源均可以被酿酒酵母YY-02利用代谢产EPS,其中以蔗糖为碳源时EPS产量最高,为(3.76±0.19)g/L。由图1B可知,当蔗糖添加量为20~70 g/L时,EPS的产量随之上升;蔗糖添加量为70 g/L时,EPS产量最高,为(4.26±0.07)g/L;当蔗糖添加量>70 g/L之后,EPS呈现下降趋势。因此,最适蔗糖添加量为70 g/L。
2.1.2 氮源对酿酒酵母YY-02产胞外多糖的影响
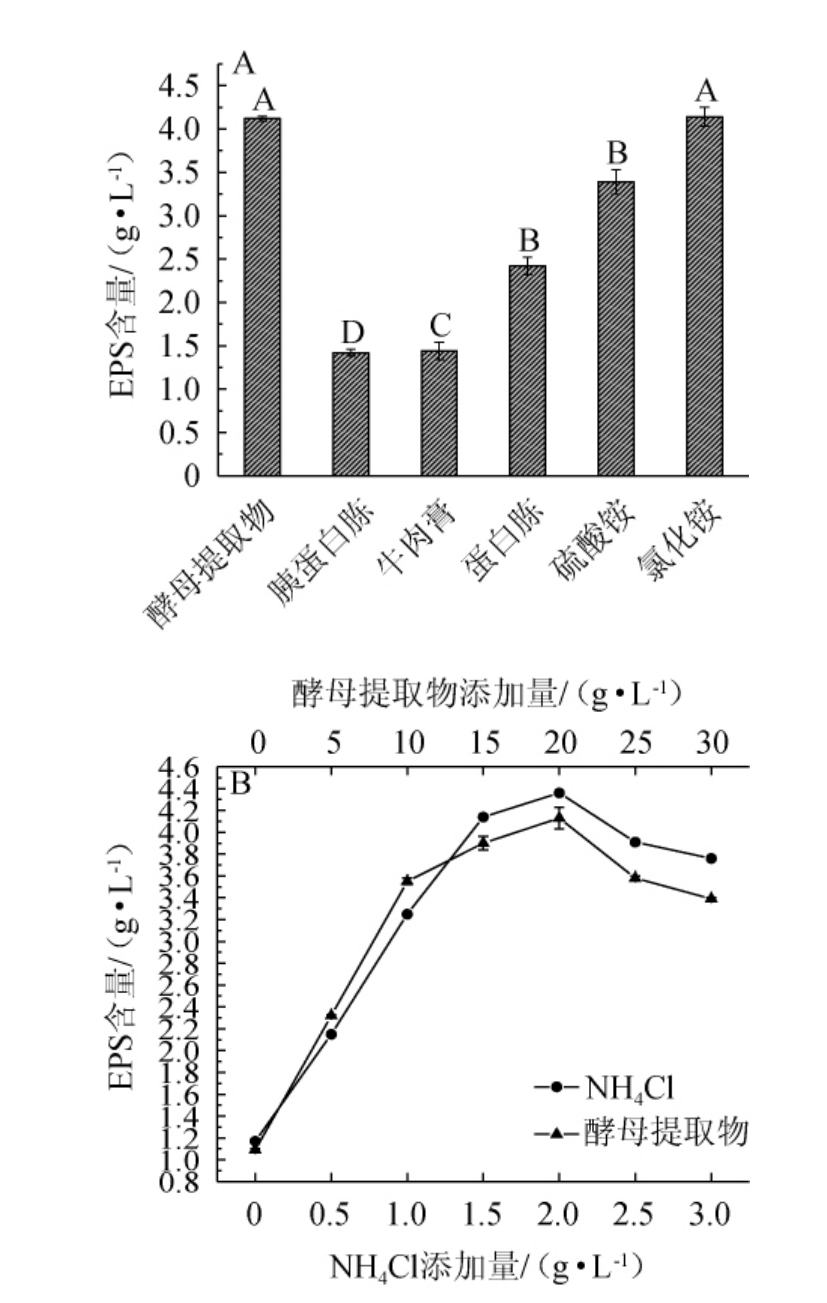
由图2A可知,4种有机氮源和2种无机氮源可以被酿酒酵母YY-02利用代谢产EPS,其中,以酵母提取物为有机氮源、NH4Cl为无机氮源时,EPS产量最高,分别为(4.12±0.03)g/L和(4.14±0.11)g/L。由此可见,酵母提取物和NH4Cl是酿酒酵母YY-02生产EPS的最适氮源。
由图2B可知,当酵母提取物、NH4Cl添加量分别为0~20 g/L、0~2.0 g/L时,EPS的产量随之上升;酵母提取物、NH4Cl添加量分别为20 g/L、2.0 g/L时;EPS产量最高,分别为(4.13±0.10)g/L、(4.36±0.06)g/L;当酵母提取物添加量>20 g/L、NH4Cl添加量>2.0 g/L时,EPS呈现出下降趋势。这可能是合成微生物重要的物质所必需的氮源,造成基本的生长繁殖受限,进而对EPS的合成造成影响。因此,最适酵母提取物、NH4Cl添加量分别为20 g/L、2.0 g/L。
2.1.3 无机盐对酿酒酵母YY-02产胞外多糖的影响
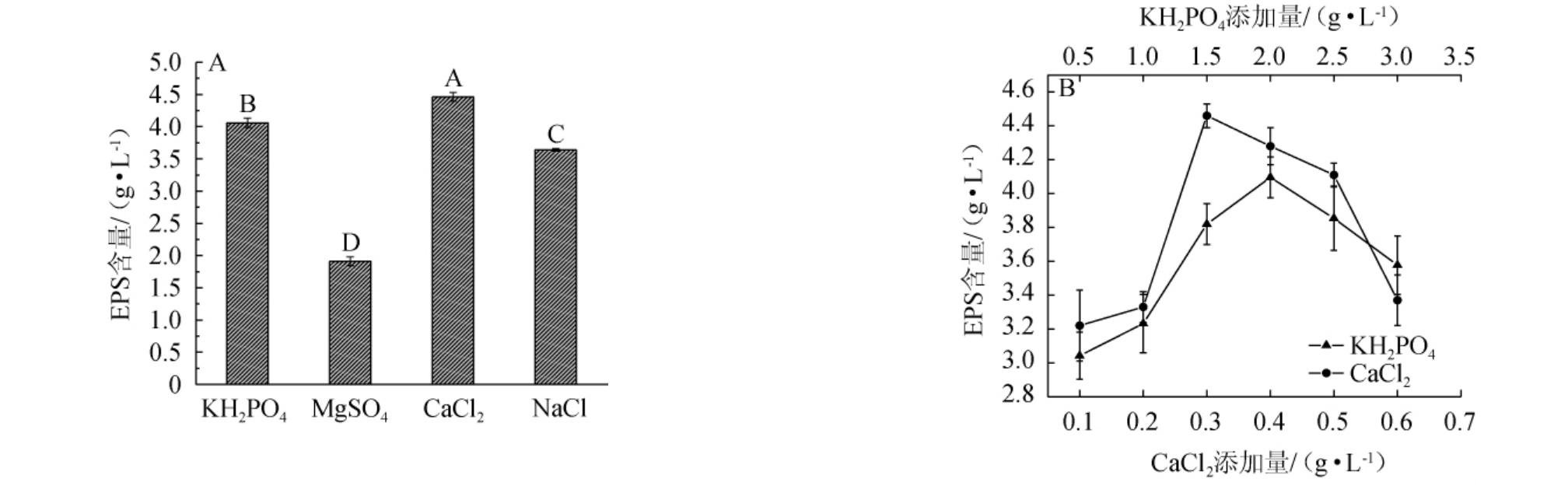
由图3A可知,4种无机盐可以被酿酒酵母YY-02利用代谢合成EPS,产量差异显著(P<0.05),当以Ca2+为无机盐时,EPS产量最高。由图3B可知,当CaCl2添加量为0~0.3 g/L时,EPS产量逐渐增加;当CaCl2添加量为0.3 g/L时,EPS产量最高,为(4.46±0.07)g/L;当CaCl2添加量>0.3 g/L之后,EPS产量有所下降;当KH2PO4添加量为0~2.0 g/L时,EPS的产量随之上升;KH2PO4添加量为2.0 g/L时;EPS产量最高,为(4.06±0.07)g/L;当KH2PO4添加量>2.0 g/L时,EPS呈现出下降趋势。这可能是合成微生物合成中所必需无机盐缺乏,造成基本的生长繁殖受限,进而对EPS的合成造成影响。因此,最适CaCl2、KH2PO4添加量分别为0.3 g/L、2.0 g/L。
2.1.4 培养条件对酿酒酵母YY-02产胞外多糖的影响
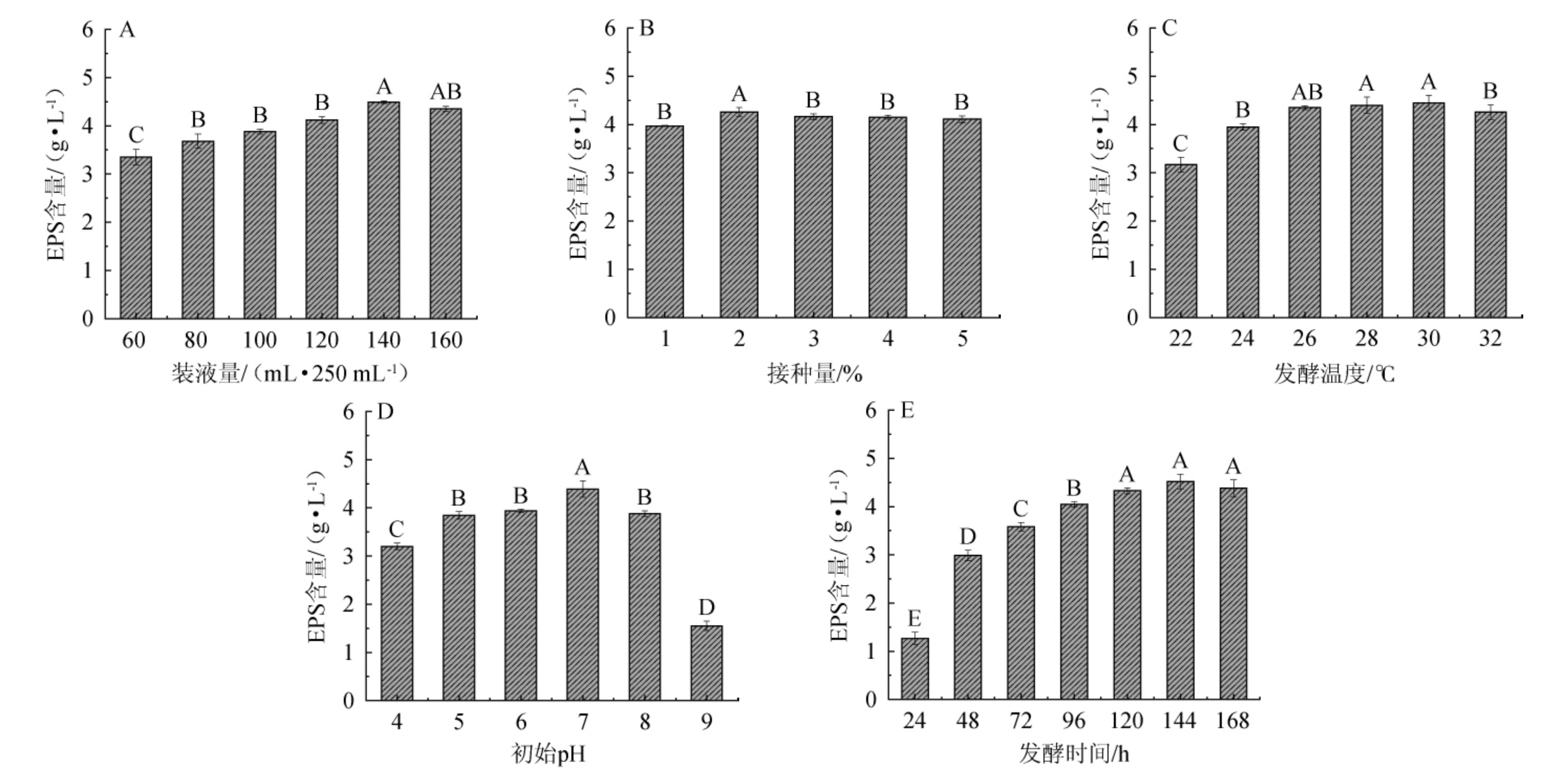
EPS产量不仅受自身遗传因素的影响,培养条件也对其EPS产量造成很大影响[8]。由图4A可知,随着装液量在60~140 mL/250 mL范围内的升高,EPS产量逐渐上升;当装液量为140 mL/250 mL时,EPS产量最高,为(4.49±0.13)g/L;装液量>140 mL/250 mL时,EPS产量开始下降。因此,确定最佳装液量为140 mL/250 mL。由图4B可知,接种量为0~2%时,EPS产量逐渐上升;当接种量为2%(V/V)时,EPS产量最高,为(4.26±0.09)g/L;当接种量>2%,EPS产量下降。这说明过高的接种量加速培养基养分的消耗[18],也使得EPS产量出现了较大的幅度下滑。因此,确定最佳接种量为2%(V/V)。由图4C可知,随着发酵温度在22~30 ℃范围内的升高,EPS产量逐渐增加;当发酵温度为30 ℃时,EPS产量最高,为(4.45±0.16)g/L;当发酵温度>30 ℃之后,EPS产量开始缓慢下降。因此,确定最佳发酵温度为30 ℃。由图4D可知,随着初始pH在4~7范围内的升高,EPS产量逐渐增加;初始pH为7时,EPS产量最高,为(4.39±0.17)g/L;初始pH>7之后,EPS产量有所下降。因此,确定最佳初始pH为7。由图4E可知,随着发酵时间在0~144 h范围内增加,EPS产量逐渐上升;当发酵时间为144 h,EPS产量最高,为(4.51±0.15)g/L;当发酵时间>144 h,EPS产量有所下降。因此,确定最佳发酵时间为144 h。
2.2 产EPS培养基组成和培养条件优化响应面试验
2.2.1 Plackett-Burman(PB)试验结果
在单因素试验结果的基础上,固定接种量为2%、发酵温度为30 ℃、发酵时间为144 h,以EPS产量(Y)为响应值,选取对EPS产量影响较大的蔗糖(X1)、酵母提取物(X2)、NH4Cl(X3)、KH2PO4(X4)、CaCl2(X5)、装液量(X6)、初始pH(X7)为考察因素,Plackett-Burman试验设计及结果见表3,方差分析结果见表4。
表3 Plackett-Burman试验设计及结果
Table 3 Design and results of Plackett-Burman experiments
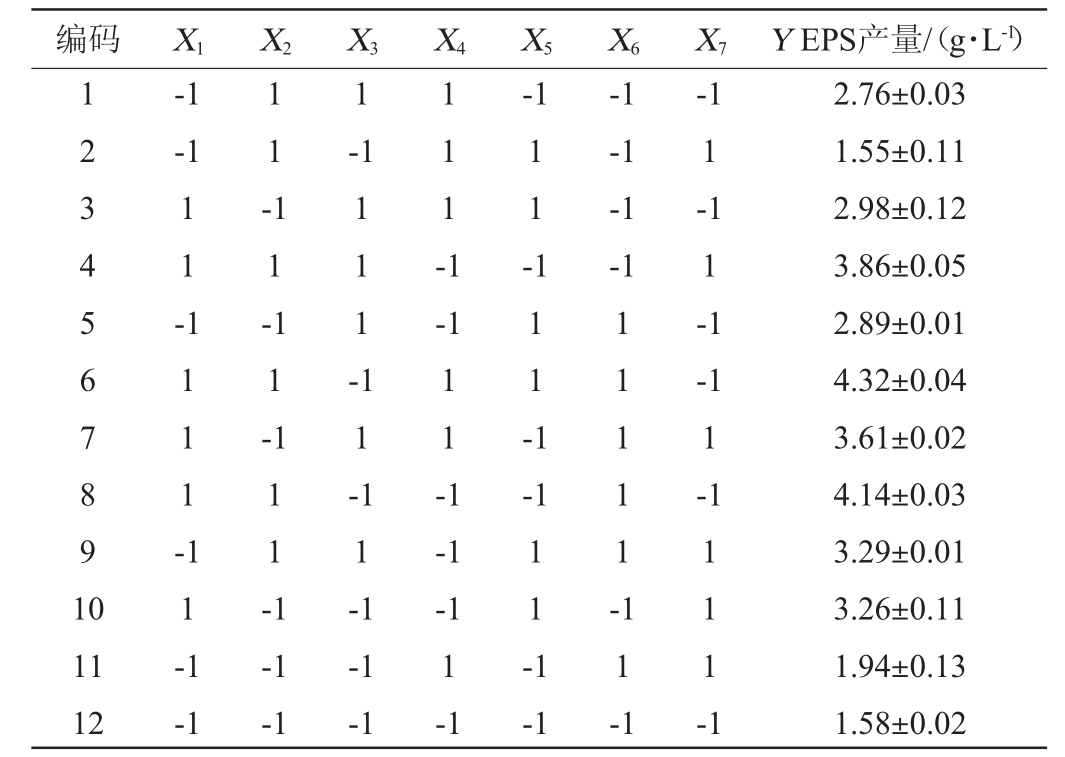
编码 X1 X2 X3 X4 X5 X6 X7 Y EPS产量/(g·L-1)1234567891 0-1-1 1-1 1 1 --1 1 1 -1 1 1 -1 1 1 --1-1-1-1 1 1 11 -1 1 -1 1 -1 1 1 --1 11 1 -1 1 1 -1 1 1 -1 1 1-1-1 1 1 -1 11111--1 1-1 1-1-1 1-1 11 12 1 1 -1 1 1 -1-1-1-1-1-1-1-1 1-1-1 1 1 -1 1 1 1 -1 2.76±0.03 1.55±0.11 2.98±0.12 3.86±0.05 2.89±0.01 4.32±0.04 3.61±0.02 4.14±0.03 3.29±0.01 3.26±0.11 1.94±0.13 1.58±0.02
表4 Plackett-Burman试验结果方差分析
Table 4 Variance analysis of Plackett-Burman experiments results
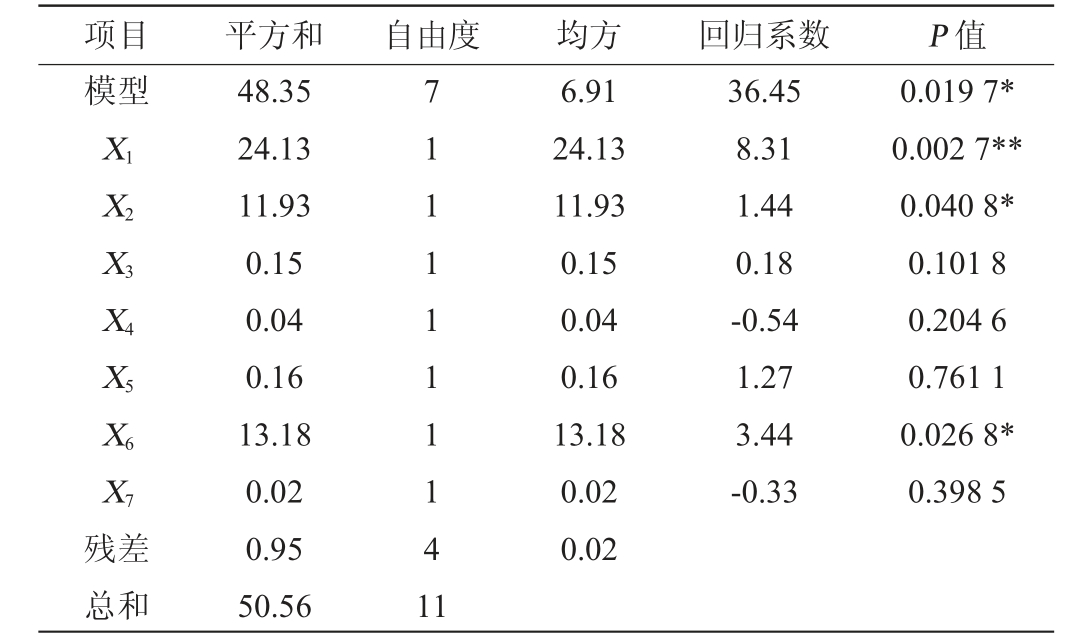
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。下同。
项目 平方和 自由度 均方 回归系数 P 值模型X1 X2 X3 X4 X5 X6 X7残差总和48.35 24.13 11.93 0.15 0.04 0.16 13.18 0.02 0.95 50.56 7 111111141 1 6.91 24.13 11.93 0.15 0.04 0.16 13.18 0.02 0.02 36.45 8.31 1.44 0.18-0.54 1.27 3.44-0.33 0.019 7*0.002 7**0.040 8*0.101 8 0.204 6 0.761 1 0.026 8*0.398 5
对表3试验结果进行多元二次回归拟合分析,得到各变量之间与酿酒酵母YY-02 EPS产量之间的模型拟合方程为:
由表4可知,模型极显著(P=0.019 7<0.05),决定系数R2为0.947 7,说明该模型可以解释响应94.77%的变化。蔗糖(X1)对EPS产量影响极显著(P<0.01),酵母提取物(X2)、装液量(X6)对EPS产量影响显著(P<0.05),具有正效应,回归方程拟合度高。根据F值的大小可知,3个因素对酿酒酵母YY-02 EPS合成的影响顺序为X1>X6>X2。
2.2.2 最陡爬坡试验结果
根据Plackett-Burman试验筛选的3个影响显著的因素,梯度增加蔗糖(X1)、酵母提取物(X2)和装液量(X6),采用最陡爬坡试验确定3个因素的最佳水平,最陡爬坡试验设计及结果见表5。由表5可知,EPS产量呈先上升后下降的趋势,第2组EPS产量最高,即蔗糖添加量为70 g/L,酵母提取物添加量为20 g/L,装液量为140 mL/250 mL。在此优化条件下,EPS产量最高(4.49±0.13)g/L。因此,选择第2组试验设计值为中心点进行中心组合试验。
表5 最陡爬坡试验设计与结果
Table 5 Design and results of the steepest ascent experiments
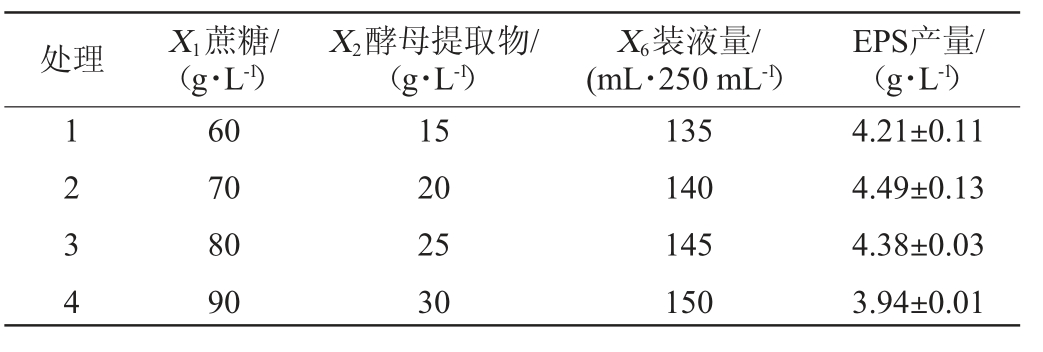
处理 X1蔗糖/(g·L-1)X2酵母提取物/(g·L-1)X6装液量/(mL·250 mL-1)EPS产量/(g·L-1)1234 60 70 80 90 15 20 25 30 135 140 145 150 4.21±0.11 4.49±0.13 4.38±0.03 3.94±0.01
2.2.3 响应面试验结果
以EPS产量(Y)为响应值,蔗糖(X1)、酵母提取物(X2)、装液量(X6)为自变量,进行CCD试验,CCD试验设计及结果见表6,方差分析结果见表7。
表6 中心组合试验设计与结果
Table 6 Design and results of central combination experiments
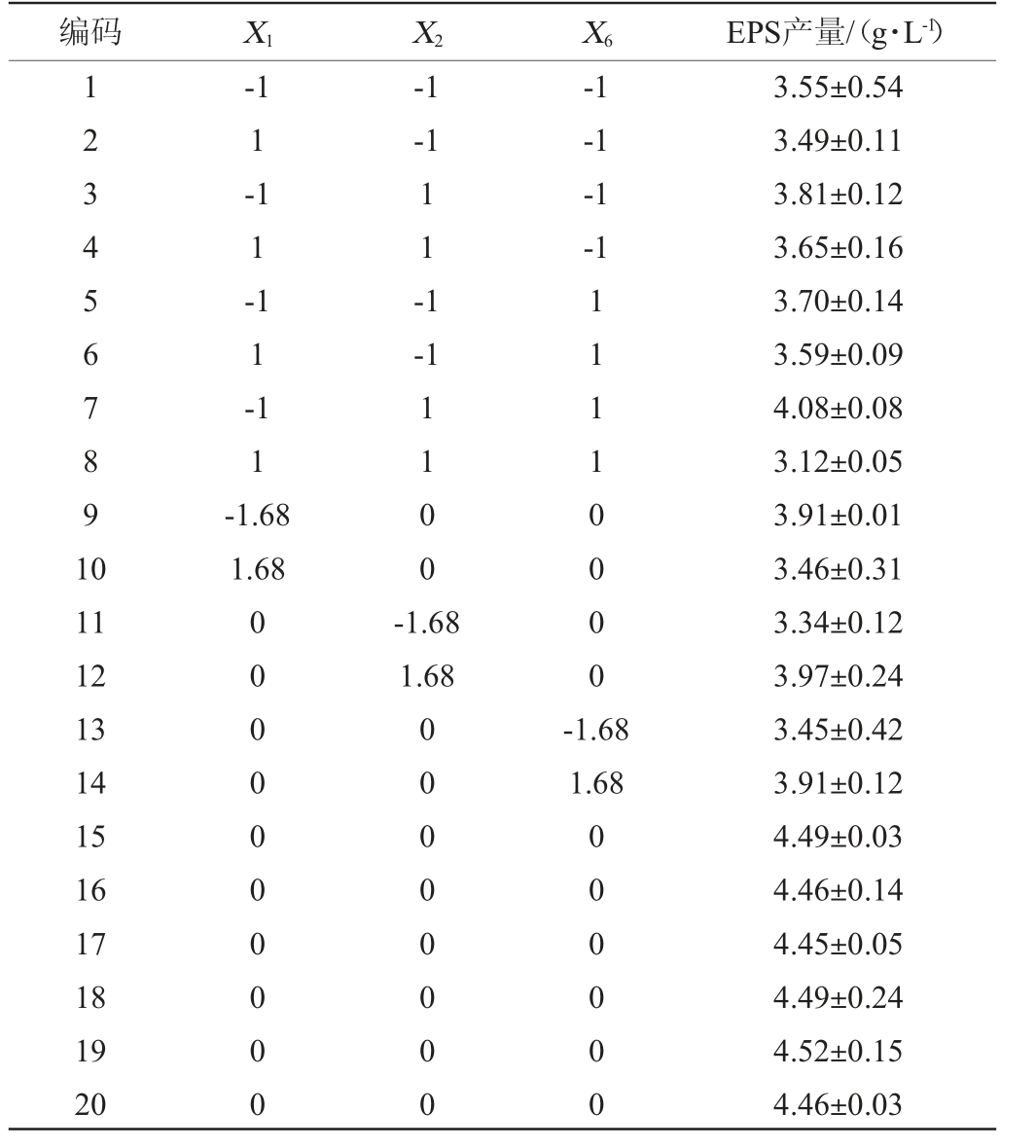
编码 X1 X2 X6 EPS产量/(g·L-1)1234567891 0-1 1-1 1-1 1-1 1-1.68 1.68-1-1 11-1-1-1-1-1-1 1100 11 12 13 14 15 16 17 18 19 20 0000000000-1.68 1.68 11110000 00000000-1.68 1.68 000000 3.55±0.54 3.49±0.11 3.81±0.12 3.65±0.16 3.70±0.14 3.59±0.09 4.08±0.08 3.12±0.05 3.91±0.01 3.46±0.31 3.34±0.12 3.97±0.24 3.45±0.42 3.91±0.12 4.49±0.03 4.46±0.14 4.45±0.05 4.49±0.24 4.52±0.15 4.46±0.03
表7 中心组合试验结果的方差分析
Table 7 Variance analysis of central combination experiments results
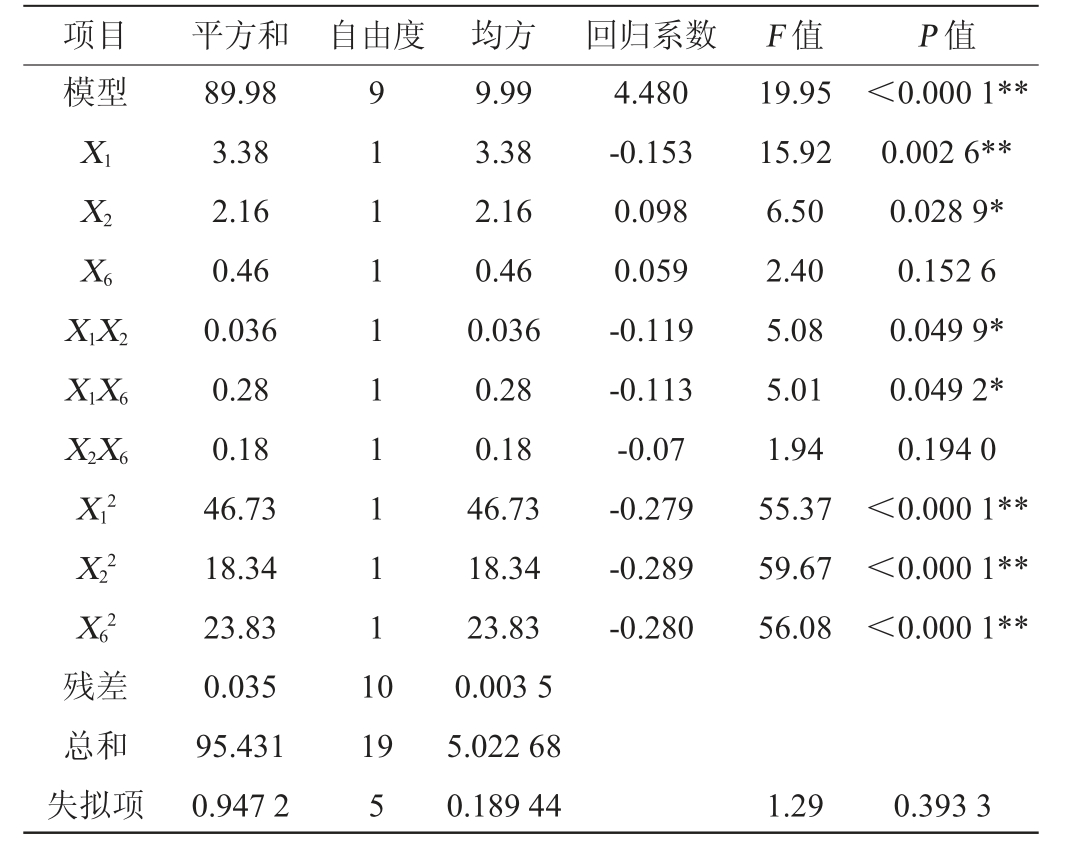
项目 平方和 自由度 均方 回归系数 F 值 P 值模型X1X2X6 X1X2 X1X6 X2X6 X12 X22 X62 4.480-0.153 0.098 0.059-0.119-0.113-0.07-0.279-0.289-0.280 19.95 15.92 6.50 2.40 5.08 5.01 1.94 55.37 59.67 56.08<0.000 1**0.002 6**0.028 9*0.152 6 0.049 9*0.049 2*0.194 0<0.000 1**<0.000 1**<0.000 1**残差总和失拟项89.98 3.38 2.16 0.46 0.036 0.28 0.18 46.73 18.34 23.83 0.035 95.431 0.947 2 9 1 1 1 1 1 1 1 1 1 1 0 19 5 9.99 3.38 2.16 0.46 0.036 0.28 0.18 46.73 18.34 23.83 0.003 5 5.022 68 0.189 44 1.29 0.393 3
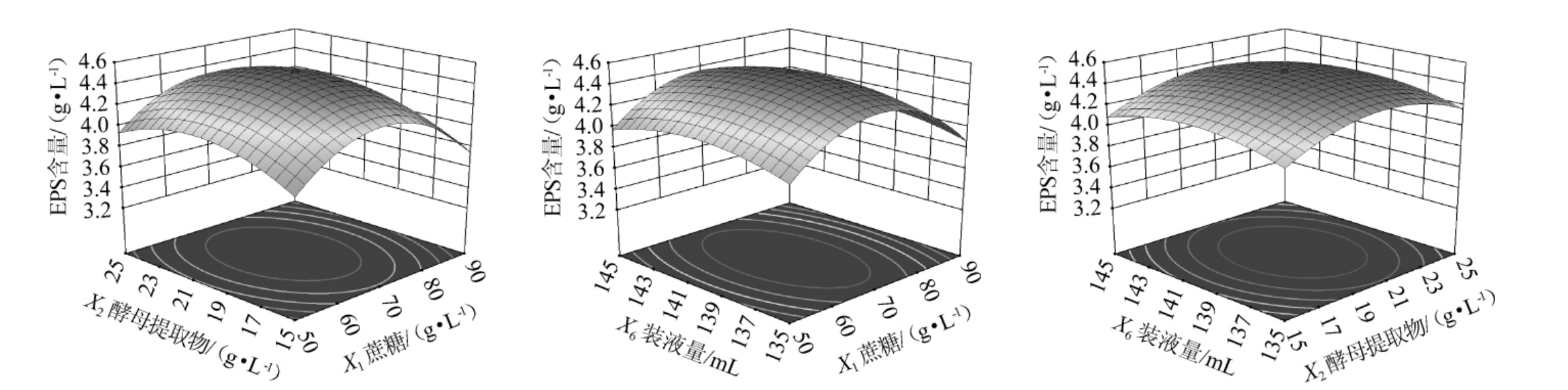
对试验结果进行响应面分析,得到EPS含量(Y)对蔗糖(X1)、酵母提取物(X2)和装液量(X6)的多元二次回归方程为:
由表7可知,模型显著(P<0.000 1),失拟项不显著(P=0.393 3<0.05),决定系数R2=0.947 2,调整决定系数R2=0.899 8,说明EPS产量的变异中94.72%是由独立变量决定的,变异系数值(coefficient of variance,CV)=2.63%,表明试验结果精确性和可靠性较高[19]。由P值可知,一次项X1、二次项X12、X22、X62对EPS产量影响极显著(P<0.01),一次项X2、交互项X1X2、X1X6对EPS产量影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。由F值可知,各因素对EPS产量影响的顺序为蔗糖(X1)>酵母提取物(X2)>装液量(X6)。
各因素间交互作用对菌株YY-02产EPS影响的响应曲面及等高线见图5。由图5可知,模型拟合方程中二次项系数均为负值,可知该方程有一个极大值,拟合的曲面开口朝下。等高线的形状及响应曲面陡峭程度可以揭示因素间交互作用强弱程度。若等高线呈椭圆形,响应曲面陡峭则交互作用显著,若等高线呈圆形,响应曲面平缓则交互作用不显著[20]。随着各因素水平的增加,EPS产量的变化趋势也随之变化。EPS产量先上升后下降,拟合曲线均为凸形,有最大值。蔗糖和装液量(X1X6)、蔗糖和酵母提取物(X1X2)间交互作用等高线趋于椭圆形,响应曲面较陡峭,酵母提取物和装液量(X2X6)间交互作用对EPS产量影响最弱,与表7中的方差结果一致。
2.2.4 最佳工艺验证试验结果
利用Design-Expert 8.0.6软件对多元二次回归方程进行求解,得到菌株YY-02产EPS的最佳条件理论值为蔗糖添加量73.16 g/L、酵母提取物添加量21.83 g/L、装液量141.49mL/250mL,EPS产量预测值为(4.52±0.15)g/L。为方便实际操作,将最佳培养条件修正为:蔗糖添加量、酵母提取物添加量和装液量分别为73 g/L、21g/L、141 mL/250 mL。在此条件下,EPS产量实际值达(4.52±0.15)g/L,与预测值一致,是优化前EPS产量的2.50倍。高于WANG H等[21]从酿酒酵母中分离EPS产量(2.89 g/L)和乔少婷[22]从酿酒酵母中分离EPS产量(0.49 g/L)。
2.3 EPS的理化指标检测结果
酿酒酵母YY-02产EPS的总糖、糖醛酸、蛋白质、硫酸盐含量分别为(83.65±0.16)%、(15.27±0.26)%、(0.78±0.02)%和(0.30±0.12)%。此结果与AMER H M等[23]从酿酒酵母分离提取的EPS的总糖(61.79%)、糖醛酸(28%)和蛋白质(4.8%)研究结果相似。
2.4 EPS的持水性、水溶性指数和乳化性测定结果
胞外多糖(EPS)的水溶性指数(WSI)主要取决于EPS的分子结构(主链和支链的长度、糖苷键的排列和聚合度)分子质量和多孔性大小、物种来源。持水性(WHC)是碳水化合物聚合物的基本特性之一,EPS的结构组成和分子质量对WHC影响很大。酿酒酵母YY-02 EPS的WHC和WSI分别为(229.67±10.45)%、(75.23±5.83)%,此结果高于LIU L N等[24]研究的酿酒酵母Y3产EPS的WHC(117.0±7.5)%和WSI(14.2±0.2)%。
EPS对不同油类和烃类化合物的乳化能力见表8。由表8可知,相同质量浓度条件下,不同有机相乳化次序为:汽油>苯甲醛>大豆油>石油醚>煤油>二甲苯>柴油>己烷。随着EPS浓度和反应时间的增加,对汽油、柴油、煤油、大豆油、苯甲醛、二甲苯、乙烷、石油醚的乳化能力均逐渐增强。当EPS质量浓度为1.0 g/L时,对汽油、大豆油、苯甲醛、石油醚的乳化性均>25%,表明YY-02 EPS具有良好的乳化性能。
表8 胞外多糖对油类和烃类化合物的乳化能力
Table 8 Emulsifying activity of exopolysaccharide to oils and hydrocarbons
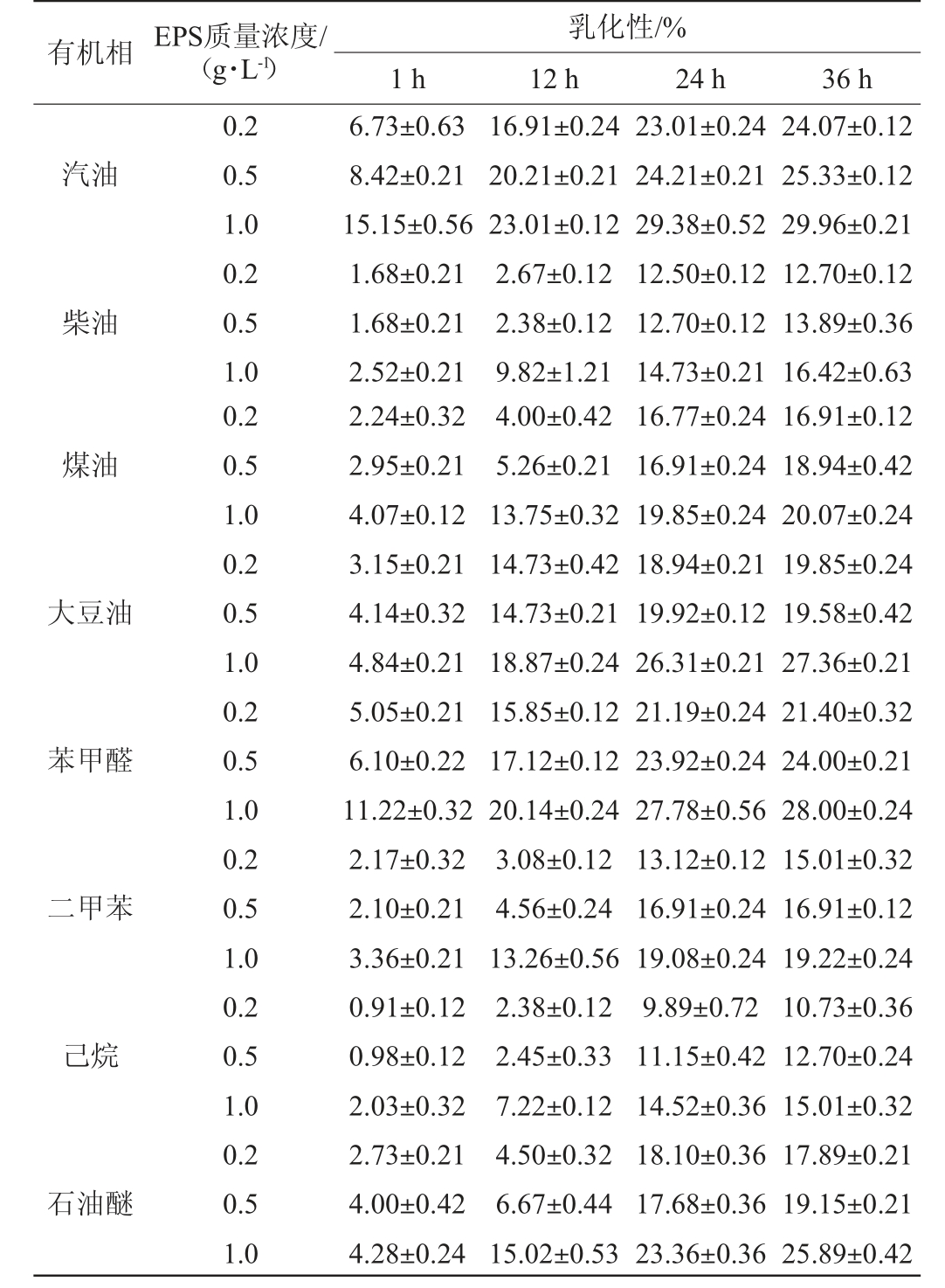
有机相 EPS质量浓度/(g·L-1)乳化性/%1 h 12 h 24 h 36 h汽油柴油0.2 0.5 1.0 0.2 0.5 1.0 6.73±0.63 8.42±0.21 15.15±0.56 1.68±0.21 1.68±0.21 2.52±0.21 16.91±0.24 20.21±0.21 23.01±0.12 2.67±0.12 2.38±0.12 9.82±1.21 23.01±0.24 24.21±0.21 29.38±0.52 12.50±0.12 12.70±0.12 14.73±0.21 24.07±0.12 25.33±0.12 29.96±0.21 12.70±0.12 13.89±0.36 16.42±0.63煤油大豆油苯甲醛二甲苯己烷石油醚0.2 0.5 1.0 0.2 0.5 1.0 0.2 0.5 1.0 0.2 0.5 1.0 0.2 0.5 1.0 0.2 0.5 1.0 2.24±0.32 2.95±0.21 4.07±0.12 3.15±0.21 4.14±0.32 4.84±0.21 5.05±0.21 6.10±0.22 11.22±0.32 2.17±0.32 2.10±0.21 3.36±0.21 0.91±0.12 0.98±0.12 2.03±0.32 2.73±0.21 4.00±0.42 4.28±0.24 4.00±0.42 5.26±0.21 13.75±0.32 14.73±0.42 14.73±0.21 18.87±0.24 15.85±0.12 17.12±0.12 20.14±0.24 3.08±0.12 4.56±0.24 13.26±0.56 2.38±0.12 2.45±0.33 7.22±0.12 4.50±0.32 6.67±0.44 15.02±0.53 16.77±0.24 16.91±0.24 19.85±0.24 18.94±0.21 19.92±0.12 26.31±0.21 21.19±0.24 23.92±0.24 27.78±0.56 13.12±0.12 16.91±0.24 19.08±0.24 9.89±0.72 11.15±0.42 14.52±0.36 18.10±0.36 17.68±0.36 23.36±0.36 16.91±0.12 18.94±0.42 20.07±0.24 19.85±0.24 19.58±0.42 27.36±0.21 21.40±0.32 24.00±0.21 28.00±0.24 15.01±0.32 16.91±0.12 19.22±0.24 10.73±0.36 12.70±0.24 15.01±0.32 17.89±0.21 19.15±0.21 25.89±0.42
2.5 EPS的抗氧化活性分析
EPS对ABTS+自由基、H2O2、O2-自由基的清除能力见图6。由图6可知,随着质量浓度增加,EPS及VC溶液对ABTS+自由基、H2O2、O2-自由基的清除率均呈现升高后保持平稳的趋势,且EPS溶液的清除率均低于对照组。当EPS浓度为3 mg/mL时,其对ABTS+自由基、H2O2、O2-自由基的清除率达最大值,分别为(24.8±1.34)%、(43.79±2.23)%和(11.40±2.74)%,此结果与MA W J等[25]从粘液红酵母中获得EPS抗氧化活性结果相似。说明酿酒酵母YY-02所产EPS有一定抗氧化活性。
3 结论
本研究以产EPS的酿酒酵母YY-02为研究对象,通过单因素试验、PB试验、最陡爬坡试验及响应面试验优化确定菌株YY-02产胞外多糖最佳培养基配方为:蔗糖73 g/L,酵母提取物21 g/L,NH4Cl 2.0 g/L,KH2PO4 2.0 g/L、CaCl2 0.3 g/L;最佳培养条件为装液量141 mL/250 mL、接种量2%、初始pH 7.0、发酵时间144 h及发酵温度30 ℃。在此优化条件下,EPS含量为(4.52±0.15)g/L,是优化前的2.50倍。菌株YY-02所产EPS的总糖、糖醛酸、蛋白质、硫酸盐含量分别为83.65%、15.27%、0.78%和0.30%,其持水性(WHC)和水溶性指数(WSI)分别为229.67%、75.23%,对汽油、大豆油、苯甲醛、石油醚的乳化性均>25%,对ABTS+自由基、H2O2、O2-自由基的清除率达最大值,分别为(24.8±1.34)%、(43.79±2.23)%和(11.40±2.74)%。因此,酿酒酵母YY-02所产EPS有一定抗氧化活性。本研究可为EPS的应用提供技术支持。
参考文献:
[1]韩勇.微生物胞外多糖提取纯化研究进展[J].黑龙江农业科学,2019(5):159-161.
[2]ROSCA I, PETROVICI A R, PEPTANARIU D, et al.Biosynthesis of dextran by Weissella confusa and its in vitro functional characteristics[J].Int J Biol Macromol,2018,107:1765-1772.
[3]HAO Y,HUANG Y,CHEN J,et al.Exopolysaccharide from Cryptococcus heimaeyensis S20 induces autophagic cell death in non-small cell lung cancer cells via ROS/p38 and ROS/ERK signalling[J].Cell Proliferation,2020,53(8):e12869.
[4]RAHBAR SAADAT Y,YARI KHOSROUSHAHI A, POURGHASSEM GARGARI B.Yeast exopolysaccharides and their physiological functions[J].Folia Microbiol,2021,66(2):171-182.
[5]BENAOUN F,DELATTRE C,BOUAL Z,et al.Structural characterization and rheological behavior of a heteroxylan extracted from Plantago notata Lagasca(Plantaginaceae)seeds[J].Carbohyd Polym,2017,175(56):96-104.
[6]GIENTKA I,BZDUCHA-WRÓBEL A,STASIAK-RÓZ˙AN′SKA L,et al.The exopolysaccharides biosynthesis by Candida yeast depends on carbon sources[J].Electron J Biotechn,2016,22(3):31-37.
[7]包怡红,梁雪,李锐达,等.产胞外多糖酵母菌株的筛选鉴定及发酵产糖[J].微生物学报,2010,50(2):278-283.
[8]杨迎凤,杨文娟,杨锟,等.响应面法优化酵母菌产胞外多糖培养基的研究[J].中国酿造,2014,33(9):115-119.
[9]孙晓萌,王上,丛丽娜,等.季也蒙假丝酵母胞外多糖的分离纯化及抗氧化活性研究[J].工业微生物,2016,46(2):24-29.
[10]赵英杰,张文平,吴剑梅,等.乳扇中高产胞外多糖酵母菌的筛选及其抗氧化活性[J].食品科学,2019,40(22):134-140.
[11]ZHAO D,JIANG J,DU R P,et al.Purification and characterization of an exopolysaccharide from Leuconostoc lactis L2[J].Int J Biol Macromol,2019,139:1224-1231.
[12]WANG Z M, CHEUNG Y C, LEUNG P H, et al.Ultrasonic treatment for improved solution properties of a high-molecular weight exopolysaccharide produced by a medicinal fungus[J].Bioresource Technol,2010,101(14):5517-5522.
[13]KANAMARLAPUDI S L R K, MUDDADA S.Characterization of exopolysaccharide produced by Streptococcus thermophilus CC30[J].Biomed Res Int,2017,2017:1-11.
[14]张玉龙,胡萍,王金龙,等.产胞外多糖乳酸菌的筛选及抗氧化特性研究[J].中国酿造,2015,34(10):37-42.
[15]龙丹丹,叶淑红,燕欣悦,等.黄褐假单胞菌Y11产胞外多糖发酵条件优化及其抗氧化活性研究[J].中国酿造,2024,43(4):115-122.
[16]孙国强,董金颖,董建生.苯酚-硫酸法测定灵芝菌丝多糖含量的研究[J].山西化工,2024,44(4):50-52.
[17]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[18]王琪,李根,刘鹏帆,等.短乳杆菌M-10产胞外多糖的发酵工艺优化[J].中国酿造,2024,43(6):162-167.
[19]司天昭,柳陈坚,秦晓萌,等.植物乳杆菌YM-2菌株胞外多糖生物合成工艺优化[J].食品科学,2017,38(10):24-30.
[20]郝俊光,莫维,侯慧,等.米香型毛葡萄配制酒的开发及品质分析[J].中国酿造,2024,43(6):218-224.
[21]WANG H, ZHANG X, DONG P, et al.Extraction of polysaccharides from Saccharomyces cerevisiae and its immune enhancement activity[J].Int J Pharm,2013,9(5):288-296.
[22]乔少婷.Streptococcus thermophilus IMAU20551胞外多糖的结构及其生物合成基因簇的研究[D].呼和浩特:内蒙古农业大学,2023.
[23]AMER H M.Purification and characterization of exopolysaccharides(EPS)extracted from Saccharomyces cerevisiae[J].Egypt J Exp Biol,2013,9(2):249-258.
[24]LIU L N, XU J J, DU R P, et al.The response surface optimization of exopolysaccharide produced by Saccharomyces cerevisiae Y3 and its partial characterization[J].Prep Biochem Biotech,2021;52(5):566-577.
[25]MA W J,CHEN X F,WANG B,et al.Characterization,anti-oxidativity,and anti-carcinoma activity of exopolysaccharide extract from Rhodotorula mucilaginosa CICC 33013[J].Carbohyd Polym,2018,181:768-777.