Advances in the synthesis and relationship with fermentation of Monacolin K genes in Hongqu
红曲是将红曲霉接种到大米中发酵得到的产物。它的使用历史悠久,可追溯至中国唐代,其发源地位于福建省古田镇[1]。红曲可用于食品工业中的增味[2]、染色[3]、防腐[4]、酿酒[5]。同时,红曲还具备显著调节心血管代谢的保健与医疗价值。根据不同的功能特性,红曲可分为三大类:色素型红曲、酿造型红曲、功能型红曲[6]。在红曲的生产过程中,普遍使用以下三种红曲霉:紫色红曲霉(Monascus purpureus)、红色红曲霉(Monascus rubber)、丛毛红曲霉(Monascus pilosus)[7]。
红曲的多种功能源于其含有多种对人体有益的代谢产物,如莫纳克林类、红曲色素类、γ-氨基丁酸、麦角固醇和不饱和脂肪酸等[8-10],其中以莫纳克林K(Monacolin K,MK)为代表性成分的莫纳克林类化合物具有调节血脂代谢的作用。然而,红曲在发酵过程中若控制不严,也会产生有害代谢产物,如桔青霉素[11],对人类肾脏和生殖器官具有显著毒性[12-13],因此,对红曲发酵过程的严格控制至关重要。
由红曲霉产生的MK的降脂作用可与合成他汀类化药相媲美,并且,其结构与化药洛伐他汀结构相同,从而引起世界关注。随着人们对MK的代谢调控及其基因簇的研究日益深入,红曲霉合成MK的基因序列已被发表,生物合成途径已基本被阐明。红曲霉有关合成MK的基因表达量与发酵参数的变化息息相关,菌株的选取也成为影响红曲MK含量的关键。为得到高产MK的红曲,发酵参数优化、诱变育种和基因工程成为红曲目前的研究热点之一。本文对红曲MK的理化性质和降脂机制进行介绍,并总结了红曲中莫纳克林K的合成途径和每个基因的作用。此外,本文对发酵参数与基因的关系进行概述,并综述了有关诱变育种和基因工程筛选出高产MK的红曲霉菌株的方法,以期为MK的代谢调控研究以及红曲在工业化生产中的质量控制提供参考。
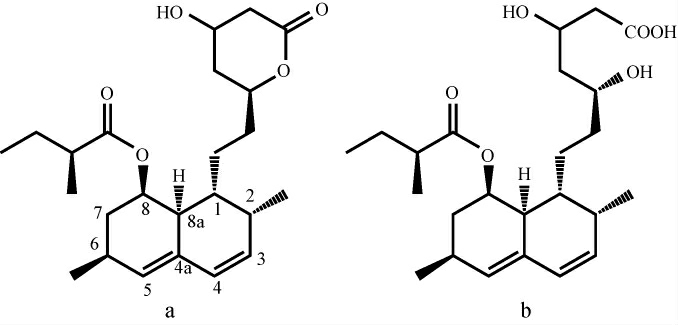
MK是红曲霉重要的次生代谢产物,首次由日本的ENDO A教授于1979年从红色红曲霉中提取分离[14]。在随后的研究中,发现紫色红曲霉、丛毛红曲霉等也能代谢产生MK。红曲中MK具有内酯(闭环)和羟基酸(开环)两种结构,分子式分别为:C24H36O5和C24H38O6,其中闭环结构与1980年在土曲霉(Aspergillus terreus)上发现的首个他汀类药物洛伐他汀的结构相同。现代药物代谢研究发现,闭环结构的MK在体内转化为开环结构,才能产生降脂作用。MK开环、闭环结构如下:

MK是一种白色结晶,熔点为157~159 ℃。在甲醇溶液中,紫外光谱在229 nm、237 nm、246 nm存在吸收峰;红外光谱吸收波长为3 550 cm-1、2 970 cm-1、1 696 cm-1、1 220 cm-1。MK易溶于甲醇、乙醇、丙酮、氯仿和苯,不溶于水、正己烷和石油醚。
MK的两种结构均具有光敏性和热敏性,在高温、高湿或光照条件下,其含量均会显著降低。在偏碱性的溶液中,闭环结构可转化为开环结构,在92.5%的相对湿度环境下,闭环结构也会转变为开环结构[15]。
MK具有显著的降脂效果[16],文献报道了由7 000名参与者进行的30项随机对照实验表明,使用红曲制剂可以降低总胆固醇(total cholesterol,TC)、甘油三酯和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C),其死亡率降低并与安慰剂相比,不良反应没有增加[17]。另一项在对111例中重度血脂异常患者的研究中发现,MK开环结构具有一定的降低LDL-C和TC的作用,且未有严重不良反应[18]。它能有效改善脂质积累和肝脏炎症[19],对动脉粥样硬化具有抑制作用。
MK降脂机制如图1所示[20],胆固醇的合成途径(甲羟戊酸途径)通过乙酰辅酶A为原料合成乙酰乙酰辅酶A,进而形成3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA),其在HMG-CoA还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGCR)的催化下形成胆固醇中间体甲羟戊酸,随后进一步转化为辅酶Q-10和胆固醇。HMGCR为甲羟戊酸途径的限速酶,也是治疗高血脂症的他汀类药物的酶位点。MK的开环结构与HMG-CoA相似,它通过与HMGCR竞争性结合,抑制该酶的活性,中断羟戊酸代谢途径,降低胆固醇在细胞内的合成,刺激细胞膜表面LDL受体的数量和活性,并去除血清胆固醇,以达到降脂的作用。MK的闭环结构在体内需通过羧化酶作用水解为开环结构,以产生药效。由于MK等成分具有降脂作用,红曲成为一种耐受性较高的天然降脂剂,对于无法耐受他汀类药物的人群是一个有效替代选择。红曲除了降脂的作用外,研究还发现其具有抗炎的作用,通过降低膜结合蛋白CD47的抑制吞噬作用的信号,从而减少凋亡细胞在血管中积聚,减少血管炎症的发生[21]。此外,通过体外实验和动物模型实验研究,发现其具有抗癌的作用[22]。
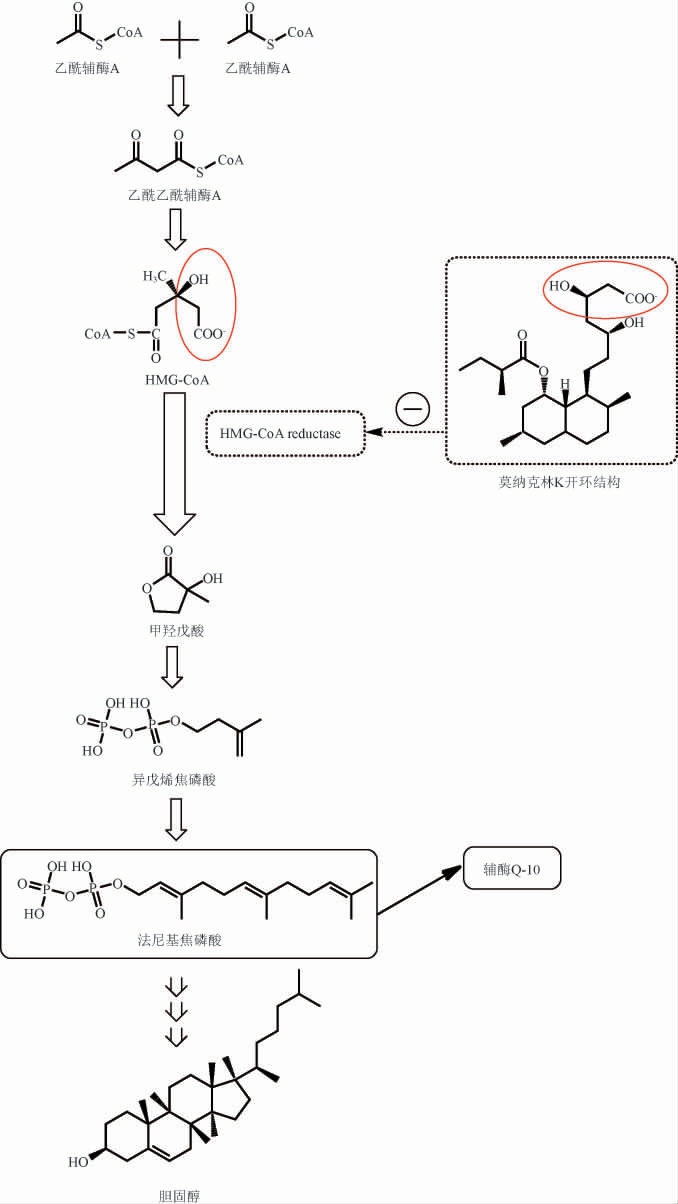
图1 红曲对胆固醇生物合成的影响
Fig.1 Effect of Hongqu on cholesterol biosynthesis
红曲霉产生的MK和土曲霉合成的洛伐他汀相似,均由I型聚酮合成酶(polyketide synthase,PKS)通过迭代还原过程产生[23]。土曲霉合成洛伐他汀的基因簇和合成路径在20世纪90年代已被阐明,土曲霉产生洛伐他汀的核心基因有9种(lovB、lovF、lovA、lovG、lovC、lovD、lvrA、lovE、lovI)。之后的研究者以土曲霉lovB基因的保守区作为探针[24],研究红曲霉产生MK的机制,结果在丛毛红曲霉中发现9种基因(mokA、mokB、mokC、mokD、mokE、mokF、mokG、mokH、mokI)与土曲霉产生洛伐他汀的主要9种基因高度同源[25],这两组基因所编码的蛋白功能相同,其结构相似率分别为76%、73%、85%、67%、81%、74%、69%、54%、81%(见表1),推测红曲霉生物合成MK的基因簇由这9个基因(mokAmokI)组成(见图2)。ZHANG C等[26]通过核糖核酸(ribonu cleic acid,RNA)测序和荧光定量聚合酶链式反应技术证实了上述基因与MK的生成密切相关,并深入探究了这些基因在细胞内的代谢路径和作用机制。
表1 丛毛红曲霉与土曲霉的莫纳克林K/洛伐他汀的生物合成基因簇
Table 1 Biosynthetic gene clusters of Monacolin K/lovastatin for Monascus pilosus and Aspergillus terreus
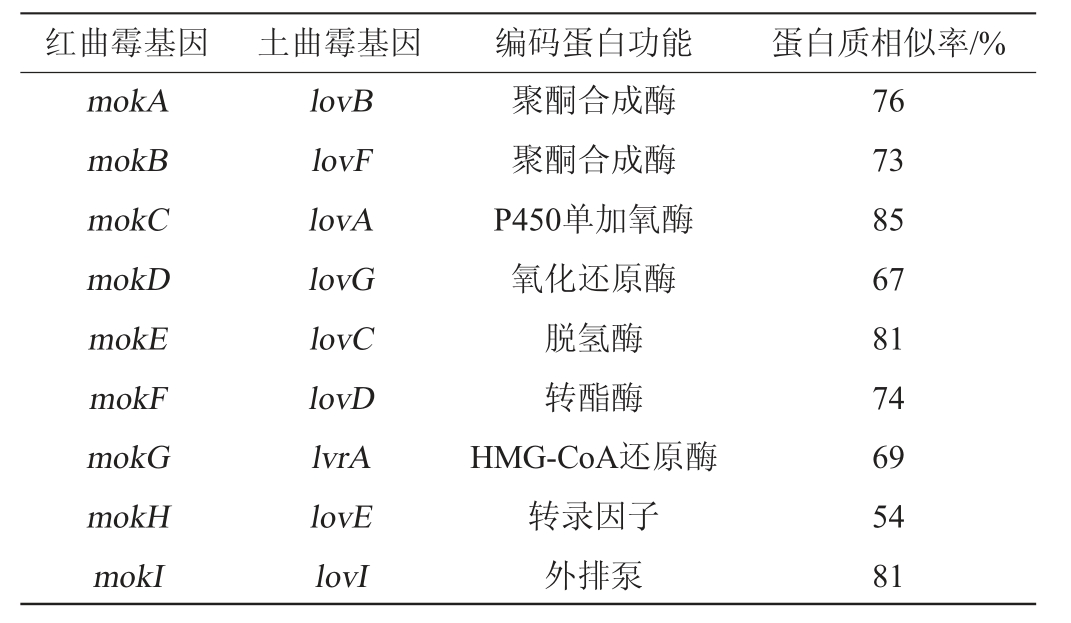
红曲霉基因 土曲霉基因 编码蛋白功能 蛋白质相似率/%mokA mokB mokC mokD mokE mokF mokG mokH mokI lovB lovF lovA lovG lovC lovD lvrA lovE lovI聚酮合成酶聚酮合成酶P450单加氧酶氧化还原酶脱氢酶转酯酶HMG-CoA还原酶转录因子外排泵76 73 85 67 81 74 69 54 81
图2 莫纳克林K生物合成基因簇
Fig.2 Biosynthetic gene clusters of Monacolin K
紫色红曲霉、红色红曲霉、丛毛红曲霉在合成MK时虽有轻微基因差异,但均含有相同的九种基因(mokA~mokI),这些基因在三种红曲霉中发挥相同的功能[27-28]。在MK的合成中,mokA和mokB基因尤为关键,负责编码PKS,分别合成MK的九酮主体(the nonaketide skeleton)和二酮侧链(the diketide skeleton)结构。其余7个基因(mokC~mokI)作为辅助酶基因,与mokA和mokB基因协同作用,共同调节MK的生成。
结合红曲霉MK合成途径及相关基因簇的研究以及参考土曲霉中洛伐他汀的合成途径,推测红曲霉中MK的分子生物合成途径,结果见图3。
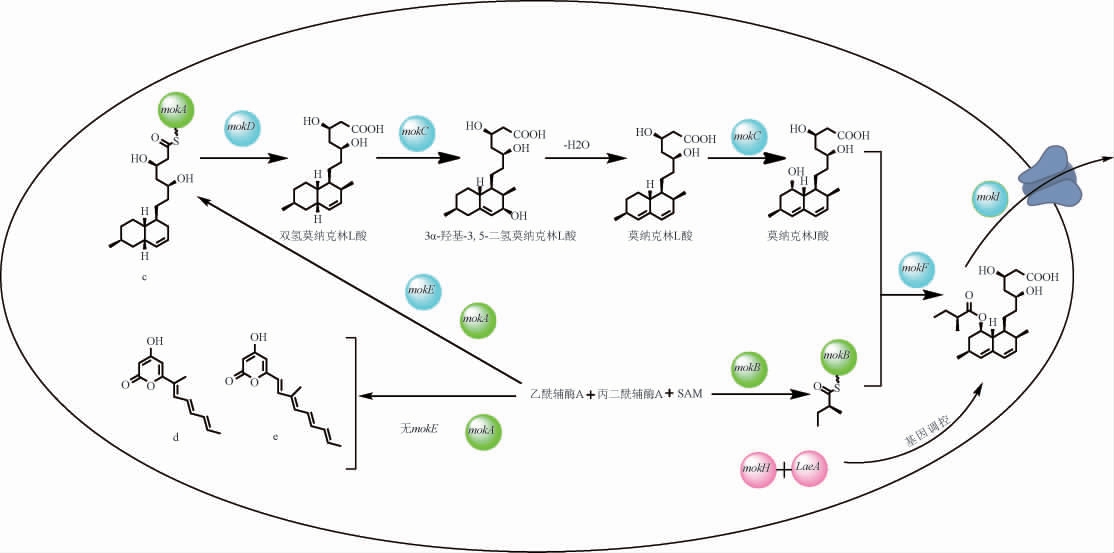
图3 红曲霉中莫纳克林K的生物合成途径
Fig.3 Biosynthetic pathway of Monacolin K in Monascus
九酮主体的合成:由mokA基因编码的聚酮合成酶以乙酰辅酶A、丙二酰辅酶A和S-腺苷蛋氨酸(s-adenosylmethionine,SAM)为底物,在mokE基因的辅助下确保聚酮链碳数量的准确性及正确的还原与环化模式[29],形成与mokA基因连接的双氢莫纳克林L。缺乏mokE基因时,产物的碳链可能缩短或还原程度较低,形成共轭吡咯酮d和e[30]。接着,mokD基因通过氧化还原反应生成双氢莫纳克林L酸式结构,随后在mokC基因编码的P450单氧酶作用下,通过羟基化反应,推测先形成不稳定的3α-羟基-3,5-二氢莫纳克林L酸式结构,经脱水反应转为莫纳克林L酸式结构,最后再次羟基化生成中间体莫纳克林J[31]。
二酮侧链:mokB基因以乙酰辅酶A、丙二酰辅酶A和SAM为底物,生成二甲基丁酸侧链。mokF基因将mokB基因生成的侧链转移至莫纳克林J的C-8位置上,生成MK。
mokI基因编码的外排泵将MK排出细胞外。此外,mokH基因与细胞内的全局调控基因LaeA基因共同调控mok基因表达量,控制莫纳克林K产量。
mokA基因主要负责合成MK的主体结构。研究发现,通过破坏丛毛红曲霉BCRC38072菌株中mokA基因序列,使该菌株丧失生成MK的能力,证明mokA基因在此生物合成中发挥至关重要的作用[32]。红曲霉中的mokA基因具有多个保守的PKS结构域,分别为酮基合成酶(keto-synthase,KS)、酰基转移酶(acyltransferase,AT)、脱水酶(dehydratase,DH)、甲基转移酶(methyltransferase,MeT)、酮还原酶(ketoreductase,KR)和酰基载体蛋白(acyl carrier protein,ACP),MK生物合成中PKS编码基因结构域的排列。AT负责将辅酶A标记并使其与ACP结合,通过DH与KR进行还原迭代反应,MeT将SAM甲基引入主体的C-6位上[33]。
mokB基因具备7个与lovF基因相似的催化结构域,分别为KS、AT、DH、MeT、KR、ACP与烯酰还原酶(enoylreductase,ER)。它们共同负责合成MK的二酮侧链。研究表明,当mokB基因被破坏后,菌株不能产生MK,并发现中间体莫纳克林J的累积,证明了mokB基因为负责编码合成侧链的PKS[34]。
mokC为P450单氧酶基因,与lovA基因的氨基酸序列相似,且在丛毛红曲霉和土曲霉中发现内含子位置相似,数量相同。在合成九酮主体的过程中,通过羟基化的形式,分别形成中间体莫纳克林L酸式结构与莫纳克林J酸式结构[28]。
mokD为氧化还原酶基因,与lovG基因编码的氧化还原酶的功能相似,都位于编码PKS和脱氢酶基因之间。通过逆转录多聚酶链式反应分析显示,mokD与对应簇中的其他生物合成基因存在一定程度的共转录。在MK的生物合成过程中,mokD可以释放与mokA基因结合的二氢莫纳克林L酸式结构,并清除mokA基因中的异常中间体[35]。
mokE基因在MK的生成中作为脱氢酶。当mokE基因过度表达时导致MK的产量增加,通过逆转录实时荧光定量聚合酶链式反应和电镜扫描证明,mokE基因的表达与MK的产生呈正相关[36-37]。在土曲霉中,lovC基因编码的中链脱氢酶/还原酶(medium-chain dehydrogenase/reductase,MDR)[38],主要负责还原生成二氢莫纳克林L所需的三个烯基。基于lovC基因的研究,推测mokE基因编码的蛋白作为伴侣蛋白[25]与mokA基因共同组装生成中间体二氢莫纳克林L,但不参与mokB基因主导的二酮侧链骨架的生成[39]。
mokF是转酯酶基因,负责将二酮侧链转移到中间体莫纳克林J的C-8位上。此外,mokF还能转移具有特定中链长度(C3~C6)的酰基,从而生成多种类型的莫纳克林,如转移乙酰乙酰辅酶A和β-羟基丁基辅酶A,分别生成降脂作用的莫纳克林X和莫纳克林M[40]。值得注意的是,过度表达mokF基因会正向调节mokB、mokC、mokD、mokH和mokI基因的表达,促使MK产量增加。mokG基因可以编码HMGCR蛋白,该蛋白对MK有较强的抑制作用,对MK有自我抗性。研究推测,LaeA基因可以通过下调mokG基因的表达,从而降低HHMGCR蛋白的含量,从而增加MK的产生[41]。
mokH基因编码的转录因子与土曲霉的lovE基因相似,富含半胱氨酸核苷酸结合域,属于Zn(II)2cys6双核DNA结合蛋白,能够正调控MK的产生[42]。CHEN Y P等[43]克隆了mokH基因,并在丛毛红曲霉BCRC38072中使用甘油醛-3-磷酸脱氢酶启动子过表达mokH基因。结果显示,与丛毛红曲霉的野生型菌株相比,过度表达mokH基因的菌丝更饱满,同时,mokH基因转录本和MK的生物合成相关基因表达显著增加。缺失mokH基因的红曲霉表现出明显的折叠和扩张,且MK的产量降低,这表明mokH基因上调了MK生物合成基因的转录,从而增加了MK的产量[44]。
mokI为编码外排泵基因,外排泵可以调节真菌在环境中的适应机制[45]。在MK的合成中主要负责将红曲霉细胞内生成的MK转运细胞外,促进MK的生成,避免在细胞内堆积造成反馈抑制[46]。
对MK合成相关基因的研究,为揭示MK生物合成调控机制奠定了坚实的基础,为研究高产MK的红曲提供了良好的理论依据。
红曲霉在子囊中通过复杂且精密的调控网络控制MK的合成[47]。菌株可以通过蛋白或信号分子感应外部环境的刺激与变化,从而做出相应的反应,调节MK基因簇的表达量。研究者期望通过改变红曲的发酵条件和方式,改变相关基因的表达量,从而获得高产MK的红曲。
目前,发酵方式主要有固态发酵与液态深层发酵两种。固态发酵相较于液态深层发酵有细胞生长速度更快,细胞膜的流动性和通透性较好的优势[48],而液态深层发酵则具有生产工艺参数的可控性较强,可以实现规模化及自动化生产,生产成本更低的优势[49]。虽然固态发酵与液态深层发酵对红曲霉中MK产量的影响不同,但影响因素值得相互借鉴。
3.1.1 固态发酵
近年来,研究者发现通过加入中药可以激发红曲霉的次生代谢产物表达。一项研究中,将柑橘、山楂和白茅根与糯米一起用于红色红曲霉M2-1菌株的发酵,通过基因表达量检测发现,mokA、mokB、mokF、mokH、mokI和mplaeA基因的表达均上调,MK产量增加了41.18%,达到了3.60 mg/g。然而,加入0.436 mg/g的茯苓显著降低了上述六个基因的转录水平[50]。另一项实验发现,在红色红曲霉BCRC31535菌株的培养基中分别加入当归、广藿香、芍药、千层莲和黄柏后,MK含量都得到提高,特别是加入乌拉尔甘草液培养60 d后,mokA-mokI基因的表达量是对照组(大米培养基)的41.9倍[51]。WU Z等[53]研究发现,将大米、葛根和山药的混合比例设置为8∶1∶1,与红色红曲霉发酵15 d后,MK含量约提高1.5倍[52]。当银杏种子与紫色红曲霉共同培养时,MK的最高产量比底物为大米的对照组高出2.25倍。在不少专利也提及中药与红曲霉菌株的发酵研究,如红曲霉菌株与何首乌[54]、山药[55]共同发酵培养,以实现MK的增产。
碳源与氮源是生物生长的物质基础。红曲霉在MK的合成中,碳源与氮源的类型和浓度选择会影响与MK生成相关的基因表达。研究表明,甘油是良好的碳源,其最佳添加量为8%。它可以刺激红曲霉CG-6菌株中mokA、mokD、mokE、mokG、mokH和mokI基因的表达量上调,从而使胞外MK的浓度大约是对照组(未添加甘油)的4倍[56]。
3.1.2 液态深层发酵
研究发现,通过在液态深层发酵中添加氨基酸或前体物质可以上调MK合成基因表达或下调其它物质的合成基因表达,从而达到增加MK产量的效果。有专利及其它研究指出,在紫色红曲霉M1菌株培养液中添加精氨酸可以作为红曲霉生产MK的氮源或者前体,其最佳添加量为0.6%,结果显示,生成MK的9个基因表达量均升高,MK的产量从94.6 mg/L增加到228.4 mg/L[57-58]。谷氨酸可以抑制柠檬酸循环。在红曲霉中添加谷氨酸使得参与柠檬酸循环的乙酰辅酶A更多地流向MK的生成途径。同时,谷氨酸还可以有效的上调除mokA基因以外的8个基因的表达,进一步促使MK的产量提高。在紫色红曲霉M1菌株中添加谷氨酸,MK的产量增加了3.5倍,为215.4 mg/L[59-60]。L-瓜氨酸为非必需氨基酸,其对红曲霉的MK合成途径有一定的促进作用。在紫色红曲霉M400-6菌株中添加4 g/L的L-瓜氨酸进行优化培养发现,产生红曲色素的基因表达量下降,合成MK的相关基因(mokA、mokB、mokC、mokD、mokF、mokH和mokI)表达量增加,在培养至20 d时,MK的产量达最高值,相较于未优化亲本株M1提高128.20%[61]。
此外,研究表明,添加维生素、脂肪酸等物质可以激发菌株的基因表达,增加MK产量。在紫色红曲霉M1菌株中添加0.5%烟酰胺,菌丝体通透性增加,促进MK分泌到细胞外,除mokI之外,mokA-mokH表达量均上调,MK的表达量相较于未添加烟酰胺的对照组,增加31.34%[62]。亚油酸在环磷酸腺苷-蛋白激酶A(cyclic adenosine monophosphateprotein kinase A,cAMP-PKA)信号通路中作为群体感应信号分子,促进MK生成。在红色红曲霉CICC5006菌株中添加512 μmol/L亚油酸时,AMP浓度升高,激活了PKA,进而增加了mokA和mokH基因的转录水平,MK的产量增加了1.35倍[63]。此外,研究发现,将紫色红曲霉M1与酿酒酵母(Saccharomyces cerevisiae)菌株共培养,产生的亚油酸促使红曲霉菌株mokA-mokI基因的转录水平的增加,其中mokE、mokF和mokG基因转录水平尤为明显,MK的产量比未共培养的对照组高出58.87%[64]。
此外,表面活性剂的加入也能提高红曲霉中MK产率。研究发现在紫色红曲霉TY02菌株的发酵初期添加聚乙二醇PEG-2000,可解除mok基因的负反馈调控,MK含量增加了943.21%,为845 mg/L[65]。在紫色红曲霉M1菌株中,添加非离子表面活性剂Brij35后发现,菌丝变得松弛,细胞膜的通透性增加,有利于MK排出到细胞外,并且除了mokE和mokG基因外,其余mok基因的表达量都有所上调,MK的产量为539.59 mg/L,相比对照组提高了386.16%[66]。
发酵温度的调控是提高红曲MK含量的重要的因素。有研究表明,在30 ℃恒温培养的烟色红曲霉(Monascus fuliginosus)CG-6菌株,其合成MK的相关基因簇(除mokB、mokC外)的表达量低于25 ℃培养温度。相较于30 ℃恒温培养,在变温(25~30 ℃)环境,mokI基因转录水平升高,MK的产量增加16倍[67]。有许多实验也证实,通过改变发酵温度,MK的产量会受到相应变化,如红曲霉U-2菌株在30 ℃培养2 d,在26 ℃环境下培养8 d,结果MK含量为236.8 mg/L,而30 ℃恒温组MK含量几乎为零[68]。
此外,在恒温条件下,光源也可影响增加MK产量。有研究通过利用不同光照射红色红曲霉MTCC1793菌株,发现黑暗环境下的MK含量最高可达786.9 mg/mL,而在蓝光下,含量只有133 mg/mL[69]。
通过对外部培养环境的调控可以影响真菌的次生代谢产物生成。研究表明,通过低频磁场(light or low frequency magnetic field,LF-MF)调节紫色红曲霉ACCC30140菌株的外部环境,会显著上调mokA和mokH基因的表达[70]。当LF-MF的磁场频率设置为1.6 mT时,可以抑制紫色红曲霉SKY219菌株中桔青霉素的合成,但促进色素与MK的基因表达,其中mokC、mokH基因在磁场的作用下表达量增加,MK的产量提高了29.3%[71]。
优良的红曲菌株是高产MK的关键与基础,对现有的红曲菌株进行修饰与改造已经成为MK高含量的红曲的趋势所在,许多研究通过诱变育种与基因工程的手段以获得稳定遗传且MK含量增高的红曲菌株。
诱变育种一般采取紫外线、离子束等物理诱变和添加诱变剂等化学诱变。近年来,常压室温等离子体诱变等物理新型技术也运用于红曲菌株的诱变中。在物理诱变方面,KETKAEO S等[72]对紫色红曲霉KUPM5菌株采用同步光辐照诱变的方法,使其mok基因位点发生核苷酸替换,并且LaeA基因也有突变位点,最终得到3株高产MK突变体(SC01、SC02和SC03),其中SC02的MK产量更高,为原菌株的3倍。紫外诱变也是对红曲霉菌株进行诱变的常用方法,吴玉峰[73]通过对紫色红曲霉H5-3进行紫外诱变,获得MK产量提高的正突变菌株Z-27,接着常温等压等离子体诱变,得到能稳定遗传且高产MK菌株W-4,较菌株H5-3约提高了81.39%。此外,紫外照射与添加化学试剂联合诱变红曲霉的研究也有进展。对紫色红曲霉M21菌株进行90 s的紫外线照射,30 min亚硝酸处理,0.08%氯化锂处理,得到高产MK突变菌株ULi17。复合诱变得到的菌株相较于菌株M21,MK产量增加75.2%[74]。通过诱变菌株以提高次生代谢产物含量已经成为当前的一个热门研究方向,为增加MK的产量提供了新的机会。
近年来,研究人员逐步将重点放在对红曲霉合成MK的相关基因的研究上,为红曲霉的基因重组提供了理论基础和技术手段,以培育可以高效合成MK的菌株,从而从根本上提高红曲中MK的含量。
研究表明,通过构建mok基因过表达的红曲霉,MK的含量可以得到提高。ZHANG C等[75]研究发现,紫色红曲霉M1菌株中mokC基因的过表达会导致mokA、mokH和mokI基因转录水平上调。此外,mokD、mokE和mokI基因的过表达还会改变菌丝的形态,并且MK含量得到显著的提高。也有研究通过分析转录组数据发现,紫色红曲霉ZZ-1菌株通过基因工程被改造为高产MK的紫色红曲霉XX-1菌株,其mokA基因在对数期(第8天)和平稳期(第12天)表现出高水平的表达。突变菌株在12 d后,其MK产量比原菌株高出20倍[76]。研究者还发现其它基因的过表达也对提高红曲霉菌株MK含量有帮助,研究通过重组丛毛红曲霉IFO4480菌株LaeA表达量,发现在非诱导条件下其次生代谢产物增加,MK的含量是其野生型的4倍[77]。不但如此,通过与其它菌株进行基因组合也成为其中一种可行研究趋势,一项实验将高产MK的红色红曲霉MRA7菌株与高产色素的紫色红曲霉MPA5菌株的基因进行组合,形成融合体进行发酵,融合体MK产量相较于亲本增加了250%,含量为2.22 mg/g[78]。此外,由于色素的生成也涉及聚酮反应,对MK的合成有一定的影响。研究者通过敲除丛毛红曲霉GN-01的生成色素基因pigR,抑制色素的合成,使MK含量升高为1 367.49 mg/L,提高了76.60%[79]。
近年来,因红曲具有天然降脂成分而被受关注,其中如何提高红曲内MK的含量成为当前研究热点。目前,在分子水平上对红曲霉合成MK的基因表达、调控蛋白以及生物合成途径深入研究日益加增,MK产量的影响因素的研究也刻不容缓。
本文结合大量研究阐述红曲霉合成MK的基因簇和生物合成途径。mok基因的转录水平是影响红曲MK含量的关键因素。研究发现,可以通过多种方式来增加红曲霉中MK含量,包括选择不同的发酵条件、温度、光源、培养基底物、营养物质、添加诱导剂,或者利用仪器改变培养环境,甚至通过诱变和基因改造等方法,来上调mok基因等关键基因的表达水平,或者下调其他可能干扰或竞争性基因的表达水平,从而增加MK的产量。这些研究将进一步揭示MK合成机制,为MK的工业化发展提供基础的框架与有效的参考依据。
目前,侧重在提高MK合成效率的研究中,包括上调相关基因、基因工程、诱变育种和改良发酵工艺,其研究的重点主要在MK的产量提高上,但在此过程当中,其它代谢产物尤其是影响安全的产物相对得到的研究较少,对此可能会导致安全性隐患的产生。因此在未来的研究当中,对安全性的关注和研究是未来的趋势。另鉴于MK的闭环结构需要肝脏代谢为具有活性的开环结构才能发挥降脂作用,因此闭环结构对肝脏造成负担,形成一定的安全性风险。因此在发酵工艺以及后期成品的相关储存和运输过程中,如何减少其开环结构向闭环结构的转化也将成为下一步的研究趋势之一。
[1]林风.福建古田为红曲发源地考证[J].中草药,2017,48(13):2793-2800.
[2]罗章,陈琴,刘振东,等.红曲色素改善藏香猪肉糜贮藏品质的机理研究[J].高原农业,2023,7(4):345-358.
[3]CHAUDHARY V,KATYAL P,PUNIYA A K,et al.Pilot-scale process to produce bio-pigment from Monascus purpureus using broken rice as substrate for solid-state fermentation[J].Eur Food Res Technol, 2023,249(7):1845-1855.
[4]HUSAKOVA M,PLECHATA M,BRANSKA B,et al.Effect of a Monascus sp.red yeast rice extract on germination of bacterial spores[J].Front Microbiol,2021,12:686100.
[5]CHANTAROT S, NOPHARATANA M, JIRASATID S.Influence of Saccharomyces cerevisiae strains on fermentation of Monascus vinegar from rice pasta by-product[J].Int Food Res J,2022,29(6):1390-1400.
[6]FENG Y L, YU X.Perspectives on functional red mold rice: functional ingredients, production, and application[J].Front Microbiol, 2020, 11:606959.
[7]PATEL S.Functional food red yeast rice(RYR)for metabolic syndrome amelioration:A review on pros and cons[J].World J Microb Biot,2016,32(5):87.
[8]刘润璞,孙晓东,李雨恒,等.紫红曲霉A13、Fen发酵红曲米中莫纳克林K的含量测定[J].中国调味品,2020,45(8):132-134.
[9]LIU L,WANG Z.Azaphilone alkaloids:Prospective source of natural food pigments[J].Appl Microbiol Biot,2022,106(2):469-484.
[10]CHEN W,FENG Y,MOLNÁR I,et al.Nature and nurture:Confluence of pathway determinism with metabolic and chemical serendipity diversifies Monascus azaphilone pigments[J].Nat Prod Rep, 2019, 36(4):561-572.
[11]ATAPATTU S N,POOLE C F.Recent advances in analytical methods for the determination of citrinin in food matrices[J].J Chromatogr A,2020,1627:461399.
[12]武东怡.基于内质网应激信号通路探讨桔青霉素致小鼠肝脏损伤的机制[D].长沙:湖南农业大学,2022.
[13]WU J,WU Y,FAN H,et al.Citrinin exposure induced testicular damage and spermatogenesis disorder by triggering endoplasmic reticulum stress[J].Foods,2023,12(8):1616.
[14]ENDO A.Monacolin K,a new hypocholesterolemic agent produced by a Monascus species[J].J Antibiot (Tokyo),1979,32(8):852-854.
[15]LI Y G,LIU H,WANG Z T.A validated stability-indicating HPLC with photodiode array detector(PDA)method for the stress tests of Monascus purpureus-fermented rice,red yeast rice[J].J Pharm Biomed Anal,2005,39(1-2):82-90.
[16]FAN X,HAN J,ZHANG F,et al.Red yeast rice:a functional food used to reduce hyperlipidemia[J].Food Rev Int,2022,39(9):1-27.
[17]YUAN R,YUAN Y,WANG L,et al.Red yeast rice preparations reduce mortality,major cardiovascular adverse events,and risk factors for metabolic syndrome:A systematic review and meta-analysis[J].Front Pharmacol,2022,13:744928.
[18]CHEN B J,HUANG X D,PENG H T,et al.Effectiveness and safety of red yeast rice predominated by monacolin K β-hydroxy acid form for hyperlipidemia treatment and management[J].J Tradit Chin Med,2022,42(2):264-271.
[19]ZOU J,YAN C,WAN J B.Red yeast rice ameliorates non-alcoholic fatty liver disease through inhibiting lipid synthesis and NF-κB/NLRP3 inflammasome-mediated hepatic inflammation in mice[J].Chin Med,2022,17(1):17.
[20]ANGELOPOULOS N,PAPARODIS R D,ANDROULAKIS I,et al.Low dose monacolin k combined with coenzyme Q10,grape seed,and olive leaf extracts lowers ldl cholesterol in patients with mild dyslipidemia:a multicenter, randomized controlled trial[J].Nutrients, 2023, 15(12):2682.
[21]EBERHARDT N,GIANNARELLI C.Statins boost the macrophage eatme signal to keep atherosclerosis at bay[J].Nat Cardiov Res,2022,1(3):196-197.
[22]CHEN C C,LIU T Y,HUANG S P,et al.Differentiation and apoptosis induction by lovastatin and γ-tocotrienol in HL-60 cells via Ras/ERK/NF-κB and Ras/Akt/NF-κB signaling dependent down-regulation of glyoxalase 1 and HMG-CoA reductase[J].Cell Signal,2015,27(11):2182-2190.
[23]HOPWOOD D A.Genetic contributions to understanding polyketide synthases[J].Chem Rev,1997,97(7):2465-2498.
[24]NICHOLSON T P,RUDD B A M,DAWSON M,et al.Design and utility of oligonucleotide gene probes for fungal polyketide synthases[J].Chem Biol,2001,8(2):157-178.
[25]CHEN Y P,TSENG C P,LIAW L L,et al.Cloning and characterization of monacolin K biosynthetic gene cluster from Monascus pilosus[J].J Agr Food Chem,2008,56(14):5639-5646.
[26]ZHANG C, LIANG J, YANG L, et al.De novo RNA sequencing and transcriptome analysis of Monascus purpureus and analysis of key genes involved in monacolin K biosynthesis[J].PLoS One, 2017, 12(1):e0170149.
[27]HIGA Y,KIM Y S,ALTAF-UL-AMIN M,et al.Divergence of metabolites in three phylogenetically close Monascus species(M.pilosus,M.ruber,and M.purpureus)based on secondary metabolite biosynthetic gene clusters[J].Bmc Genomics,2020,21(1):679.
[28]DAI W, SHAO Y, CHEN F.Production of monacolin K in Monascus pilosus: Comparison between industrial strains and analysis of its gene clusters[J].Microorganisms,2021,9(4):747.
[29]KENNEDY J,AUCLAIR K,KENDREW S G,et al.Modulation of polyketide synthase activity by accessory proteins during lovastatin biosynthesis[J].Science,1999,284(5418):1368-1372.
[30]BURR D A,CHEN X B,VEDERAS J C.Syntheses of conjugated pyrones for the enzymatic assay of lovastatin nonaketide synthase, an iterative polyketide synthase[J].Org Lett,2007,9(1):161-164.
[31]BARRIUSO J,NGUYEN D T,LI J W H,et al.Double oxidation of the cyclic nonaketide dihydromonacolin L to monacolin J by a single cytochrome P450 monooxygenase,LovA[J].J Am Chem Soc,2011,133(21):8078-8081.
[32]CHEN Y P,TSENG C P,LIAW L L,et al.Cloning and characterization of monacolin K biosynthetic gene cluster from Monascus pilosus[J].J Agr Food Chem,2008,56(14):5639-5646.
[33]ABE Y,SUZUKI T,ONO C,et al.Molecular cloning and characterization of an ML-236B(compactin)biosynthetic gene cluster in Penicillium citrinum[J].Mol Genet Genomics,2002,267(5):636-646.
[34]SAKAI K,KINOSHITA H,NIHIRA T.Identification of mokB involved in monacolin K biosynthesis in Monascus pilosus[J].Biotechnol Lett,2009,31(12):1911-1916.
[35]XU W,CHOOI Y H,CHOI J W,et al.LovG:the thioesterase required for dihydromonacolin L release and lovastatin nonaketide synthase turnover in lovastatin biosynthesis[J].Angew Chem Int Ed Engl,2013,52(25):6472-6475.
[36]林琳,王昌禄,李贞景,等.mokE基因过表达对红曲霉Monacolin K产量、菌丝及孢子形态的影响[J].食品科学,2018,39(8):45-49.
[37]LIN L,WU S,LI Z,et al.High expression level of mokE enhances the production of monacolin K in Monascus[J].Food Biotechnol,2018,32(1):35-46.
[38]AMES B D, NGUYEN C, BRUEGGER J, et al.Crystal structure and biochemical studies of the trans-acting polyketide enoyl reductase LovC from lovastatin biosynthesis[J].Proc Natl Acad Sci USA, 2012, 109(28):11144-11149.
[39]AUCLAIR K,KENNEDY J,HUTCHINSON C R, et al.Conversion of cyclic nonaketides to lovastatin and compactin by a lovC deficient mutant of Aspergillus terreus[J].Bioorg Med Chem Lett,2001,11(12):1527-1531.
[40]XIE X,WATANABE K,WOJCICKI W A,et al.Biosynthesis of lovastatin analogs with a broadly specific acyltransferase[J].Chem Biol,2006,13(11):1161-1169.
[41]ZHANG C,ZHANG H,ZHU Q,et al.Overexpression of global regulator LaeA increases secondary metabolite production in Monascus purpureus[J].Appl Microbiol Biot,2020,104(7):3049-3060.
[42]MIRANDA R U,GÓMEZ-QUIROZ L E,MENDOZA M,et al.Reactive oxygen species regulate lovastatin biosynthesis in Aspergillus terreus during submerged and solid-state fermentations[J].Fungal Biol, 2014,118(12):979-989.
[43]CHEN Y P,YUAN G F,HSIEH S Y, et al.Identification of the mokH gene encoding transcription factor for the upregulation of monacolin K biosynthesis in Monascus pilosus[J].J Agr Food Chem, 2010, 58(1):287-293.
[44]ZHANG C, ZHU Q, ZHANG H, et al.Effects on the sporulation and secondary metabolism yields of Monascus purpureus with mokH gene deletion and overexpression[J].Fungal Biol,2020,124(7):661-670.
[45]EL-GANINY A M, KAMEL H A, YOSSEF N E, et al.Repurposing pantoprazole and haloperidol as efflux pump inhibitors in azole resistant clinical Candida albicans and non-albicans isolates[J].Saudi Pharm J,2022,30(3):245-255.
[46]ZHANG Y,CHEN Z,WEN Q,et al.An overview on the biosynthesis and metabolic regulation of monacolin K/lovastatin[J].Food Funct, 2020,11(7):5738-5748.
[47]HIGA Y,MINAMI M,FUKUSAKI E,et al.Mass spectrometry imaging reveals localization of secondary metabolites in red yeast rice fermentation[J].ACS Food Sci Technol,2021,1(10):1814-1820.
[48]LIU X, SUN A, LI Q, et al.A systematic study of the production of Monacolin K by solid state fermentation of Monascus ruber[J].AMB Express,2022,12(1):29.
[49]胡文林,谢凤娇,谭兰英,等.红曲菌深层发酵工艺技术[J].肉类工业,2019(2):34-39.
[50]PENG L, AI-LATI A, LIU S, et al.Effects of Chinese medicines on monacolin K production and related genes transcription of Monascus ruber in red mold rice fermentation[J].Food Sci Nutr,2020,8(4):2134-2142.
[51]CHEN Y P,WU H T,HWANG I E,et al.Identification of the high-yield monacolin K strain from Monascus spp.and its submerged fermentation using different medicinal plants[J].Bot Stud,2022,63(1):20.
[52]WANG Y, GAO C, LONG P, et al.Dynamic changes of active substances of rice, Pueraria and yam fermentation by Monascus ruber[J].LWT-Food Sci Technol,2023,183:114925.
[53]WU Z, MIAO W, YANG Y, et al.Preparation of Monascus-fermented ginkgo seeds: Optimization of fermentation parameters and evaluation of bioactivity[J].Food Sci Biotechnol,2022,31(6):721-730.
[54]陈小林,严杰凯,赵敏,等.何首乌红曲的制造方法:CN104846017A[P].2015-8-19.
[55]潘子明,李俊霖.红曲山药的制作方法:CN101986869A[P].2011-3-23.
[56]薛意斌,任志远,樊筱园,等.甘油对红曲霉CG-6莫纳克林K合成及相关基因表达的影响[J].食品科学技术学报,2018,36(6):33-38.
[57]张婵,王成涛,孙宝国,等.精氨酸在提高紫色红曲霉产monacolin K上的应用:CN110592155A[P].2019-12-20.
[58]SHI R,LUO Q,LIU Y,et al.Effect of γ-heptalactone on the morphology and production of monascus pigments and Monacolin K in Monascus purpureus[J].J Fungi (Basel),2022,8(2):179.
[59]YANG X,XIANG L,ZHANG C,et al.Promotion of monacolin K production in Monascus extractive fermentation: the variation in fungal morphology and in the expression levels of biosynthetic gene clusters[J].J Sci Food Agr,2021,101(13):5652-5659.
[60]HUANG J,LIAO N Q,LI H M.Linoleic acid enhance the production of moncolin K and red pigments in Monascus ruber by activating mokH and mokA,and by accelerating cAMP-PkA pathway[J].Int J Biol Macromol,2018,109:950-954.
[61]SHI R, GONG P, LIU Y, et al.Linoleic acid functions as a quorumsensing molecule in Monascus purpureus-Saccharomyces cerevisiae coculture[J].Yeast,2023,40(1):42-52.
[62]ZHANG C,LIANG J,YANG L,et al.Glutamic acid promotes monacolin K production and monacolin K biosynthetic gene cluster expression in Monascus[J].Amb Express,2017,7(1):22.
[63]ZHANG C, ZHANG N, CHEN M, et al.Metabolomics analysis of the effect of glutamic acid on Monacolin K synthesis in Monascus purpureus[J].Front Microbiol,2020,11:610471.
[64]刘帅.X射线诱变选育红曲霉高产Monacolin K菌株及发酵工艺优化研究[D].长沙:中南林业科技大学,2023.
[65]张函,张楠,朱倩倩,等.烟酰胺对紫色红曲菌生长和次级代谢产物合成的影响[J].食品科学技术学报,2021,39(2):83-90.
[66]许世锦,胡文林,陈罗华周,等.聚乙二醇在液态发酵功能红曲莫纳克林K中的应用[J].食品与发酵工业,2022,48(21):42-47.
[67]LIN L, WANG C, LI Z, et al.Effect of temperature-shift and temperature-constant cultivation on the monacolin K biosynthetic gene cluster expression in Monascus sp.[J].Food Technol Biotech, 2017, 55(1):40-47.
[68]HUANG C F, SHEN S M, CHEN W T, et al.The effects of mutation and temperature variation on monacolin K production by Monascus sp.and relative statistical parameter analysis of monacolin K production[J].Phytochem Lett,2019,32:143-150.
[69]SUGANYA K,USHA RAJA NANTHINI A, NARENKUMAR J, et al.Impact of light and temperature on growth,intracellular and extracellular pigment, and lovastatin yield by Monascus ruber in synthetic medium[J].Adv Mater Sci Eng,2022,2022(5):2808733.
[70]XIONG X, LIU Y, ZHANG J, et al.Mutational analysis of MpPhy reveals magnetoreception and photosensitivity involvement in secondary metabolites biosynthesis in Monascus purpureus[J].J Photochem Photobiol B,2021,217:112164.
[71]ZHANG J, LIU Y, LI L, et al.iTRAQ-based quantitative proteomic analysis reveals changes in metabolite biosynthesis in Monascus purpureus in response to a low-frequency magnetic field[J].Toxins,2018,10(11):440.
[72]KETKAEO S,NAGANO Y,BABA S,et al.Development of Monascus purpureus monacolin K-hyperproducing mutant strains by synchrotron light irradiation and their comparative genome analysis[J].J Biosci Bioeng,2022,133(4):362-368.
[73]吴玉峰.高产洛伐他汀红曲菌的选育及其在黄酒中的应用研究[D].无锡:江南大学,2022.
[74]陈秉梅,孙丽娟,陈巧如.复合诱变选育高产洛伐他汀红曲菌[J].福建农业科技,2020(6):7-11.
[75]ZHANG C,LIANG J,ZHANG A,et al.Overexpression of monacolin K biosynthesis genes in the Monascus purpureus azaphilone polyketide pathway[J].J Agr Food Chem,2019,67(9):2563-2569.
[76]LIU Z,WANG B,ZHANG Y,et al.Investigation of biosynthetic mechanisms of Monacolin K and pigments in Monascus purpureus based on transcriptomic analysis[J].Int Symp Front Biotechnol Bioeng,2019,2110(1):20-21.
[77]LEE S S,LEE J H,LEE I.Strain improvement by overexpression of the laeA gene in Monascus pilosus for the production of monascus-fermented rice[J].J Microbiol Biotechn,2013,23(7):959-965.
[78]SINHA A, SARKAR K.Enhancement of Monacolin K production by intergeneric hybridization between Monascus purpureus (Arg-) and Monascus ruber (Thi-, Met-) auxotrophs[J].J Pure Appl Microbiol,2023,17(3):1458-1470.
[79]HONG X,GUO T,XU X,et al.Multiplex metabolic pathway engineering of Monascus pilosus enhances lovastatin production[J].Appl Microbiol Biot,2023,107(21):6541-6552.