Optimization of fermentation conditions for production of D-lactic acid with high optical purity by Lactobacillus delbrueckii HB49-2
D-乳酸(D-lactic acid,D-LA)作为自然界最小的手性分子,是多种手性物质的前体,广泛应用于医药、化工、农药和环保等领域[1-4]。以高光学纯度D-乳酸为原料合成的聚乳酸(polylactic acid,PLA)具有良好的生物相容性和可降解性,被认为是最具有前景的生物降解材料之一[5-6]。据统计,全球D-乳酸的需求量每年以6%~8%的速度增长,目前国内的产能已无法满足实际需求[7]。随着高光学纯度D-乳酸合成技术的不断突破,D-乳酸产业迅速发展,市场前景十分广阔[8-9]。
D-乳酸的主要生产方法有化学合成法和微生物发酵法,微生物发酵法与化学合成法相比,具有成本低、条件温和、环境友好和产品安全性高等优点[10-11],但生产过程中仍存在菌种产酸性能低、发酵副产物多等问题,导致D-乳酸的产量较低且光学纯度不高[12-14]。目前,在工业上利用较多的D-乳酸生产菌种主要是乳杆菌属(Lactobacillus sp.)和芽孢乳杆菌属(Sporolactobacillus sp.)[15],这两类菌属发酵方式均为同型乳酸发酵,即以葡萄糖为碳源通过糖酵解途径生成丙酮酸,然后在D-乳酸脱氢酶的作用下转化为D-乳酸。这类发酵方式所需的能耗少,产物浓度及纯度高,适合规模化工业生产[8]。德氏乳杆菌(Lactobacillus delbrueckii)是乳杆菌属的代表种之一,其可在35~43 ℃条件下利用葡萄糖等碳源发酵生产高光学纯度D-乳酸[16-17],逐渐成为国内外学者们研究的热点。TASHIRO Y等[18]利用德氏乳杆菌QU41以葡萄糖为底物发酵168 h后,D-乳酸产量为87.4 g/L,光学纯度达到99.9%。邵莲月[19]通过单因素和正交试验得到德氏乳杆菌保加利亚亚种CICC21101的最佳发酵条件,其在最佳条件下发酵72 h后,D-乳酸产量高达62.7 g/L。韩文静等[20]通过单因素试验优化德氏乳杆菌保加利亚亚种的发酵条件,其在最佳条件下发酵72 h后,D-乳酸产量为37.8 g/L。肖雨[21]采用等离子-紫外复合诱变技术得到德氏乳杆菌保加利亚亚种W209,其在42 ℃条件下发酵48 h后D-乳酸产量为54 g/L。宋婉莹[22]采用单因素及正交试验确定德氏乳杆菌保加利亚亚种S105的最佳发酵条件,其在最佳发酵条件下发酵72 h,D-乳酸产量达62.9 g/L。梁琼[23]在发酵培养基中添加0.015 μg/L的维生素B12后,德氏乳杆菌的D-乳酸产量提高至67.5 g/L。
随着研究人员对德氏乳杆菌发酵生产D-乳酸的关注度持续升高,发酵过程中D-乳酸产量和光学纯度低等瓶颈问题亟待突破。针对德氏乳杆菌发酵产酸存在的问题,本实验室前期从野外果园中筛选出一株产高光学纯度D-乳酸的德氏乳杆菌HB49-2,本研究以其为研究对象,采用单因素试验及Box-Behnken响应面试验对其产D-乳酸的发酵条件及培养基进行优化,进一步提高D-乳酸的产量,为德氏乳杆菌产D-乳酸发酵条件摸索以及生产应用提供参考。
1.1.1 菌株
德氏乳杆菌(Lactobacillus delbrueckii)HB49-2:从江西省九江市桃园土壤中分离获得,由本研究室保存。
1.1.2 试剂
轻质碳酸钙(99.2%):广西西陇化工有限公司;甲醇(99.9%):德国默克公司;DL-乳酸钠标准品(纯度为99.0%):美国SIGMA公司;葡萄糖、酵母浸粉、蛋白胨(均为生化试剂)、微量元素(99.0%)、维生素(99.0%):生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
MRS液体培养基[2]:葡萄糖20.0 g/L、蛋白胨10.0 g/L、酵母浸粉4.0 g/L、牛肉膏5.0 g/L、磷酸氢二钾2.0 g/L、柠檬酸三铵2.0 g/L、醋酸钠5.0 g/L、硫酸镁0.2 g/L、硫酸锰0.05 g/L、吐温80 1.0 mL/L、pH值6.2~6.4,121 ℃高压蒸汽灭菌20 min。MRS固体培养基:MRS液体培养基中添加琼脂15.0 g/L。
种子培养基[2]:在MRS液体培养基中加入CaCO3 5 g/L。
基础发酵培养基[2]:葡萄糖110 g/L、蛋白胨10 g/L、酵母浸粉10 g/L、磷酸氢二钾0.25 g/L、磷酸二氢钾0.25 g/L、乙酸钠0.05 g/L、硫酸镁0.5 g/L、碳酸钙50 g/L,pH值6.2~6.4,115 ℃高压蒸汽灭菌30 min。
15 cm×30 cm厌氧培养袋及2.5 L二氧化碳产气袋:日本三菱株式会社;D30分光光度计:德国艾本德股份公司;Waters 2695e高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Waters公司;H2100R高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;Starter 3100台式pH计:上海子期实验设备有限公司;SW-CJ-2FD超净工作台:苏州安泰空气技术有限公司;G154DS高压蒸汽灭菌锅:致微(厦门)仪器有限公司;SPX-250B-Z生化培养箱:上海博讯医疗生物仪器股份有限公司;Practum 224-ICN分析天平:德国赛多利斯公司;ZWY-2102C恒温培养振荡器:上海智城分析仪器制造有限公司。
1.3.1 德氏乳杆菌HB49-2生长曲线的测定
将甘油保存的供试菌株以10%(V/V)的接种量接种至装有5 mL MRS液体培养基的Hungate管中,37 ℃静置厌氧培养24 h,连续活化3代备用。将活化液按10%的接种量接种于种子培养基中,装液量为50 mL/250 mL,置于装有二氧化碳产气袋的培养袋中,密封,在37 ℃、150 r/min条件下厌氧培养17 h。将种子液按5%的接种量接种至MRS液体培养基中,置于装有二氧化碳产气袋的培养袋中,密封,于37 ℃、150 r/min条件下厌氧培养24 h,每隔2 h取样,以未接菌的培养基作为空白对照,在波长600 nm处测定OD600 nm值。以培养时间为横坐标,OD600nm值为纵坐标绘制生长曲线。
1.3.2 德氏乳杆菌HB49-2产D-乳酸发酵条件优化单因素试验
将种子液按10%的接种量接种至基础发酵培养基中,装液量为100 mL/250 mL,置于装有二氧化碳产气袋的培养袋中,密封,在37 ℃、180 r/min条件下培养72 h。在此基础上,依次考察接种量(5.0%、7.5%、10.0%、12.5%、15.0%、17.5%、20.0%)及发酵温度(33 ℃、35 ℃、37 ℃、39 ℃、41 ℃、43 ℃)对D-乳酸产量的影响。
在基础发酵培养基中分别加入MnSO4、FeSO4、ZnSO4和CuSO4,每种微量元素添加量分别为0、0.025 g/L、0.050 g/L、0.075 g/L、0.100 g/L;在基础发酵培养基中分别加入维生素B1(vitamin B1,VB1)、VB6、VB12、VC和VE,每种维生素添加量分别为0、20 mg/L、40 mg/L、60 mg/L、80 mg/L,将种子液按10%的接种量接种至不同发酵培养基中,装液量为100 mL/250 mL,置于装有二氧化碳产气袋的培养袋中,密封,在37 ℃、180 r/min条件下厌氧培养72 h,取样测定发酵液中的D-乳酸含量,考察不同微量元素、维生素的种类及添加量对D-乳酸产量的影响[17]。
1.3.3 德氏乳杆菌HB49-2产D-乳酸发酵条件优化Box-Behnken响应面试验
在单因素试验的基础上,选择影响较大的因素,以D-乳酸产量(Y)为响应值,运用Design-Expert 13.0.1软件设计3因素3水平的Box-Behnken响应面试验[24]。
1.3.4 测定方法
葡萄糖、乳酸含量的测定[25]:将发酵液在10 000 r/min条件下离心10 min,取上清液用0.22 μm滤膜过滤后采用HPLC检测葡萄糖、乳酸含量。
乳酸光学纯度的测定[25]:采用HPLC检测发酵液中的D-乳酸及L-乳酸含量,并计算D-乳酸光学纯度,其计算公式如下:
式中:SL为L-乳酸峰面积;SD为D-乳酸峰面积。
1.3.5 数据处理与统计分析
所有试验均设置3个平行,试验数据运用SPSS Statistics 22.0软件进行分析,结果以“平均值±标准差”表示;运用Excel 2021软件制作图表;运用Design-Expert 13.0.1软件设计响应面试验。
德氏乳杆菌HB49-2的生长曲线见图1。由图1可知,培养0~6 h时,菌株HB49-2生长缓慢,处于生长迟缓期;培养6~18 h时,菌株HB49-2快速生长,处于对数生长期;培养18 h之后,菌体浓度处于稳定期并开始略微下降,因此,选择培养时间17 h作为最适种龄。
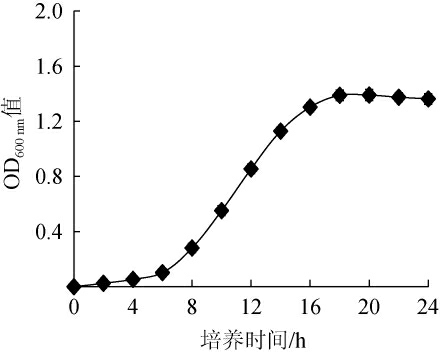
图1 德氏乳杆菌HB49-2的生长曲线
Fig.1 Growth curve of Lactobacillus delbrueckii HB49-2
2.2.1 接种量及发酵温度对菌株HB49-2产D-乳酸的影响
接种量及发酵温度对菌株HB49-2产D-乳酸的影响见图2。由图2A可知,随着接种量的增加,菌株HB49-2的D-乳酸产量呈先升高后下降的趋势,当接种量为15%时,D-乳酸产量最高,达到68.49 g/L,之后继续增加接种量D-乳酸产量反而降低,可能是因为接种量过大后培养基中营养成分主要用于菌株的生长,导致产酸量降低[20],因此,选择15%为最佳接种量。由图2B可知,随着发酵温度的升高,D-乳酸产量呈现先升高后降低的趋势,当发酵温度为39 ℃时,D-乳酸产量最高,达到70.21 g/L,分析原因可能是发酵温度继续升高后影响菌体细胞内代谢酶的活性,导致产酸量降低[20],因此,选择39 ℃为最佳培养温度。
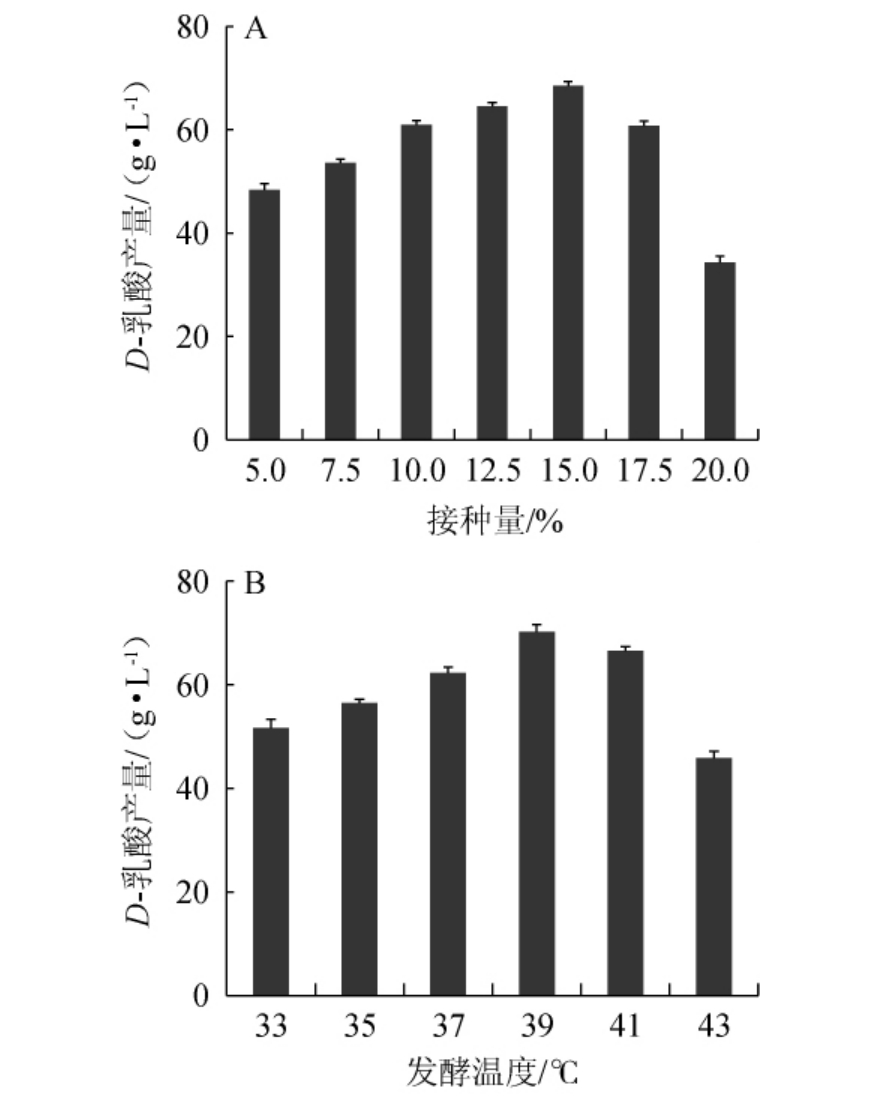
图2 接种量(A)和发酵温度(B)对德氏乳杆菌HB49-2产D-乳酸的影响
Fig.2 Effects of inoculum (A) and fermentation temperature (B) on D-lactic acid production by Lactobacillus delbrueckii HB49-2
2.2.2 微量元素与维生素对菌株HB49-2产D-乳酸的影响
微量元素、维生素种类及含量对菌株HB49-2产D-乳酸的影响见图3。由图3A可知,添加不同种类及质量浓度的微量元素对菌株HB49-2产D-乳酸的影响有所差别,添加Mn2+对菌株产D-乳酸有抑制作用,当添加量高于0.05 g/L时抑制作用较为明显;Fe2+对菌株HB49-2产D-乳酸有略微的促进作用;而添加Zn2+、Cu2+对菌株HB49-2产D-乳酸促进作用不明显。由图3B可知,维生素对菌株HB49-2的生长有一定的影响,添加VB1对菌株HB49-2的D-乳酸产量有轻微的促进作用,添加VB12的促进作用较为明显,且随着添加量的增加,D-乳酸产量均呈先升高后下降的趋势,当VB1、VB12的质量浓度达到40 mg/L时,D-乳酸产量均最高,分别为65.64 g/L、71.21 g/L;而添加VB6、VC、VE对菌株HB49-2产D-乳酸促进作用不明显。综上,在基础发酵培养基中添加VB12明显有利于德氏乳杆菌HB49-2产D-乳酸,且最佳添加量为40 mg/L,这与梁琼等[23,26]的研究结果一致。
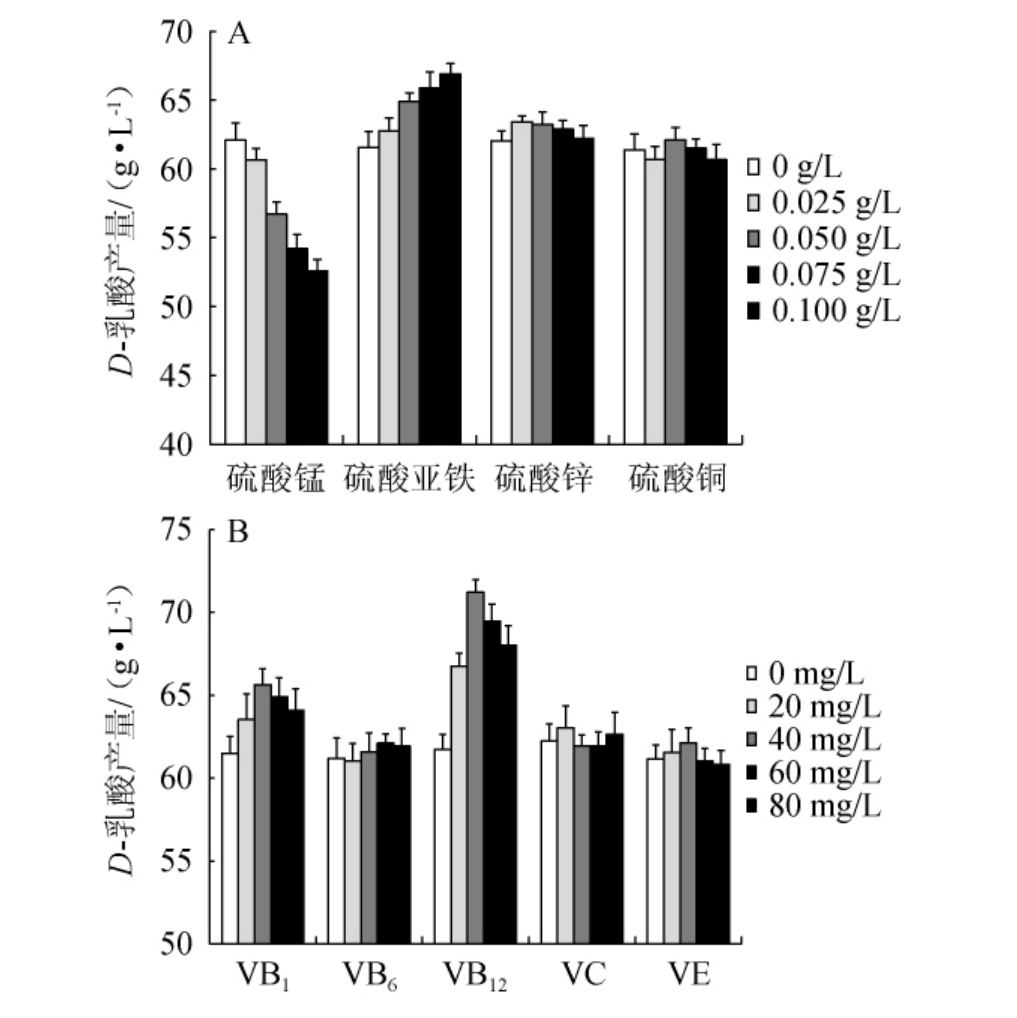
图3 不同微量元素(A)及维生素(B)添加量对德氏乳杆菌HB49-2产D-乳酸的影响
Fig.3 Effects of different trace elements (A) and vitamin (B) addition on D-lactic acid production by Lactobacillus delbrueckii HB49-2
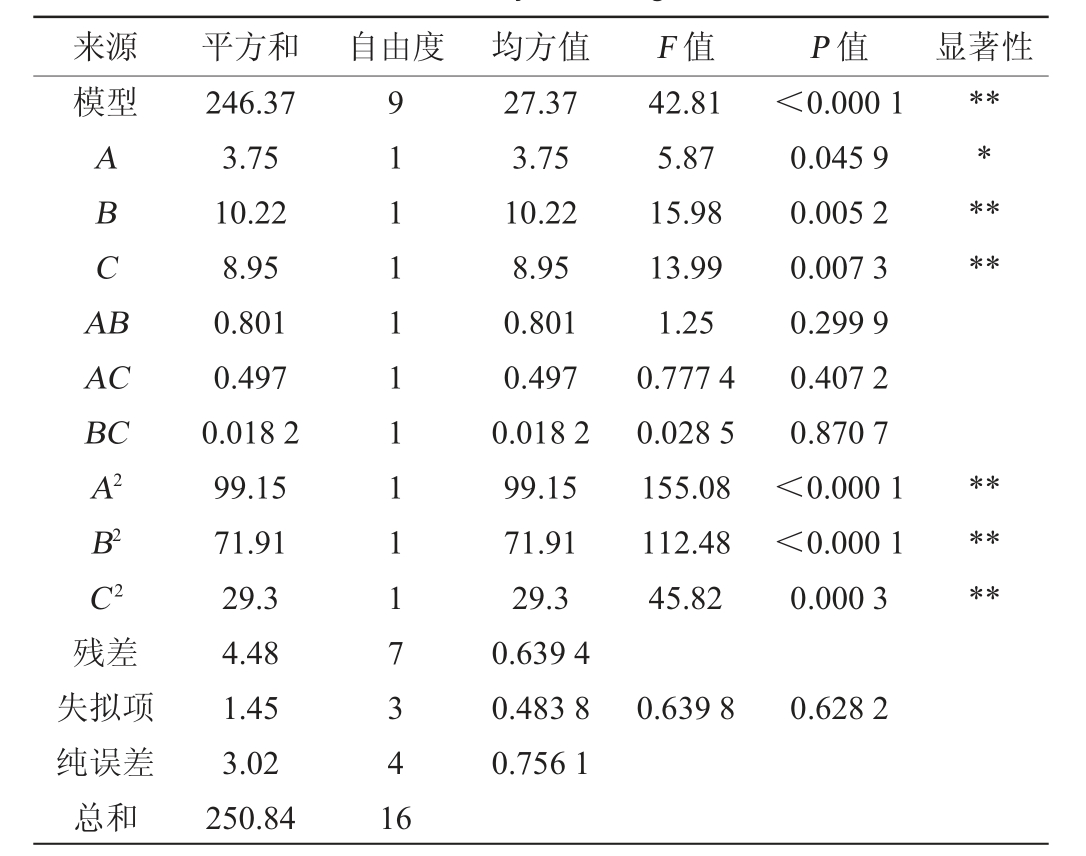
在单因素试验结果的基础上,选择对德氏乳杆菌HB49-2产D-乳酸影响较大的因素接种量(A)、发酵温度(B)、VB12添加量(C)为考察因素,以D-乳酸产量为响应值,运用Design-Expert 13.0.1软件设计3因素3水平Box-Behnken响应面试验,试验设计及结果见表1,回归模型方差分析见表2。
表1 德氏乳杆菌HB49-2产D-乳酸发酵条件优化Box-Behnken响应面试验设计及结果
Table 1 Design and results of Box-Behnken response surface experiments for fermentation conditions optimization of D-lactic acid production by Lactobacillus delbrueckii HB49-2
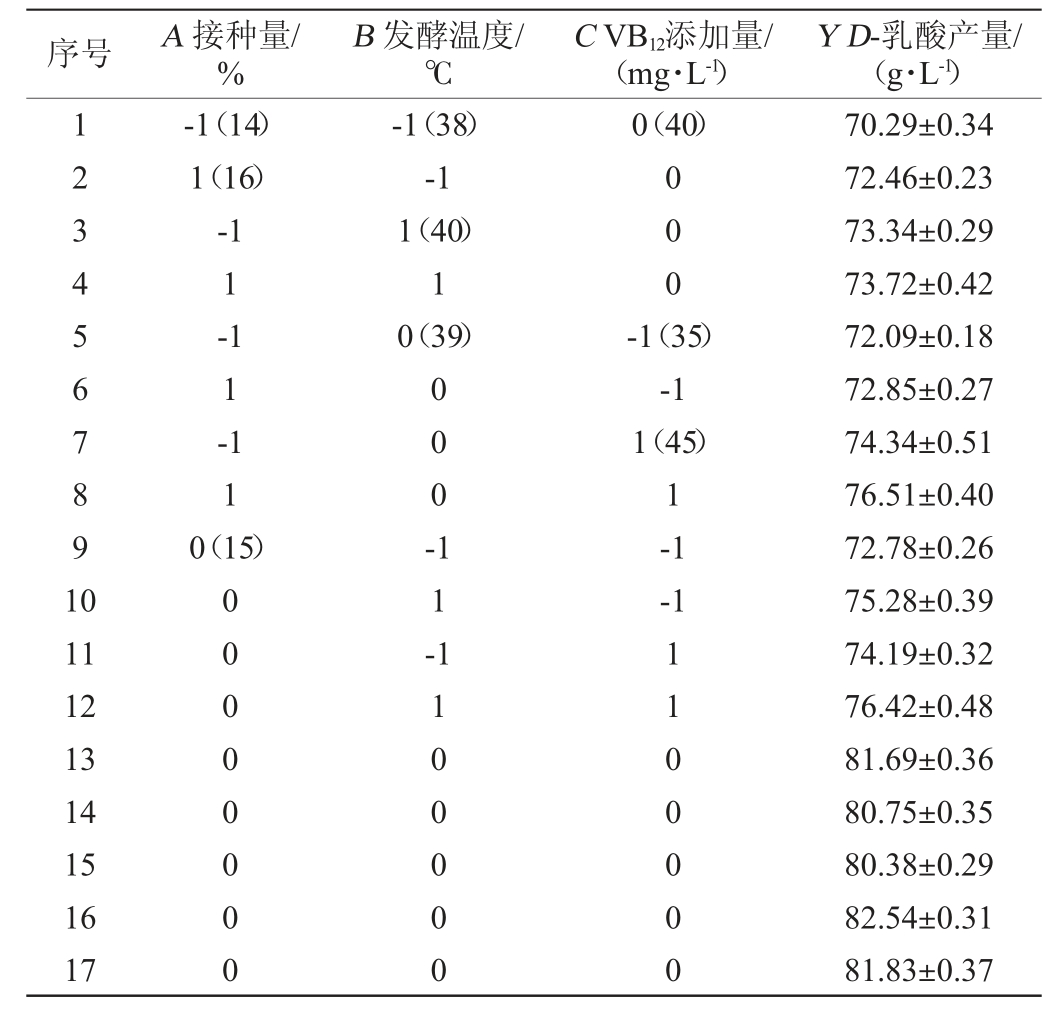
序号 A 接种量/%B 发酵温度/℃C VB12添加量/(mg·L-1)Y D-乳酸产量/(g·L-1)1234567891 0-1(14)1(16)-1 1-1 1-1 1 0(15)-1(38)-1 1(40)1 0(39)0(40)000 000--1(35)-1 1(45)1-1-1 11 12 13 14 15 16 17 00000000 11-1100000 1100000 70.29±0.34 72.46±0.23 73.34±0.29 73.72±0.42 72.09±0.18 72.85±0.27 74.34±0.51 76.51±0.40 72.78±0.26 75.28±0.39 74.19±0.32 76.42±0.48 81.69±0.36 80.75±0.35 80.38±0.29 82.54±0.31 81.83±0.37
表2 回归模型的方差分析
Table 2 Variance analysis of regression models
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著
(P<0.01)。
来源 平方和 自由度 均方值 F 值 P 值 显著性模型ABCA B*******AC BC A2 B2 C2残差失拟项纯误差总和246.37 3.75 10.22 8.95 0.801 0.497 0.018 2 99.15 71.91 29.3 4.48 1.45 3.02 250.84 91111111117341 6 27.37 3.75 10.22 8.95 0.801 0.497 0.018 2 99.15 71.91 29.3 0.639 4 0.483 8 0.756 1 42.81 5.87 15.98 13.99 1.25 0.777 4 0.028 5 155.08 112.48 45.82<0.000 1 0.045 9 0.005 2 0.007 3 0.299 9 0.407 2 0.870 7<0.000 1<0.000 1 0.000 3******0.639 8 0.628 2
采用Design-Expert13.0.1软件对表1中的试验数据进行二次多元回归拟合分析,得到以D-乳酸产量(Y)为响应值的二次多项式回归方程:Y=81.438+0.685A+1.13B+1.057 5C-0.447 5AB+0.352 5AC-0.067 5BC-4.852 75A2-4.132 75B2-2.637 75C2。
由表2可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明模型可靠。决定系数R2为0.982 1,调整决定系数R2Adj为0.959 2,变异系数(coefficient of variation,CV)为1.06%,说明模型的拟合度较好,数据之间误差较小,能够对D-乳酸产量进行分析和预测。由P值可知,一次项A对结果影响显著(P<0.05),一次项B、C及二次项A2、B2、C2对结果影响极显著(P<0.01),其他因素对结果影响不显著(P>0.05),说明接种量、发酵温度、维生素B12添加量对菌株HB49-2产D-乳酸影响显著。各因素间交互作用对结果影响的响应面及等高线见图4。

图4 各因素间交互作用对德氏乳杆菌HB49-2产D-乳酸的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effect of interaction between various factors on D-lactic acid production by Lactobacillus delbrueckii HB49-2
由图4可知,接种量、发酵温度、维生素B12添加量间交互作用对D-乳酸产量影响的3个响应曲面均呈抛物面状,说明存在极值点,等高线均趋于圆形,说明各因素间交互作用对德氏乳杆菌HB49-2产D-乳酸的影响较小,这与方差分析结果一致。对二次多项回归方程求解得到德氏乳杆菌HB49-2产D-乳酸的最佳发酵条件:接种量15.07%,发酵温度39.13 ℃,维生素B12添加量40.21 mg/L,D-乳酸产量的预测值为81.64 g/L。考虑试验的可操作性,修正最佳发酵条件为接种量15%,发酵温度39 ℃,维生素B12添加量40 mg/L,在此条件下进行3次平行验证试验,得到D-乳酸的平均产量为82.15 g/L,与预测值接近,比优化前产量(62.01 g/L)提高32.4%,高于邵莲月等[19-22]的试验结果。
将德氏乳杆菌HB49-2在最佳发酵条件下发酵培养72 h,采用HPLC测定D-乳酸和L-乳酸含量,HPLC色谱图见图5。在此条件下,D-乳酸的平均光学纯度为99.89%,这与TASHIRO Y等[18]的试验结果相近。
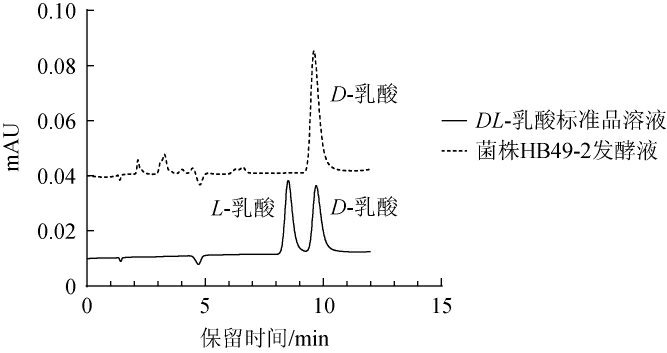
图5 德氏乳杆菌HB49-2发酵液与DL-乳酸标准品高效液相色谱对比图
Fig.5 Comparison of high performance liquid chromatography between Lactobacillus delbrueckii HB49-2 fermentation broth and DL-lactic acid standard
本研究采用单因素试验及响应面试验优化得到德氏乳杆菌HB49-2产D-乳酸的最优发酵条件为接种量15%、发酵温度39 ℃。最适发酵培养基成分为葡萄糖110 g/L、蛋白胨10 g/L、酵母粉10 g/L、磷酸氢二钾0.25 g/L、磷酸二氢钾0.25 g/L、乙酸钠0.05 g/L、硫酸镁0.5 g/L、维生素B12 40 mg/L、碳酸钙50 g/L。在此优化条件下,发酵培养72 h后,D-乳酸产量为82.15 g/L,比优化前产量(62.01 g/L)提高32.4%,D-乳酸的光学纯度为99.89%,研究结果对德氏乳杆菌工业化生产D-乳酸具有一定的指导意义。
[1]郭勇鑫,王刚,李柯欣,等.结冷胶固定化保加利亚乳杆菌及在玉米秸秆连续发酵D-乳酸中的应用[J].生物工程学报,2023,39(3):1083-1095.
[2]黄筱萍,王通,李鹏,等.高光纯D-乳酸生产菌株假肠膜明串珠菌HL64-1的分离鉴定及其发酵特性[J].食品工业科技,2024,45(11):133-141.
[3]JU S Y,KIM J H,LEE P C.Long-term adaptive evolution of Leuconostoc mesenteroides for enhancement of lactic acid tolerance and production[J].Biotechnol Biofuels,2016,9(1):240.
[4]GARBACZ K.Anticancer activity of lactic acid bacteria[J].Semin Cancer Biol,2022,356-366.
[5]郭勇鑫.保加利亚乳杆菌的固定化及未脱毒玉米秸秆发酵产D-乳酸工艺研究[D].长春:吉林农业大学,2023.
[6]LI G,ZHAO M,XU F,et al.Synthesis and biological application of polylactic acid[J].Mol Cells,2022,25(21):5023.
[7]刘娟,王刚,张明磊,等.D-乳酸产生菌的研究进展[J].微生物学杂志,2016,36(1):96-99.
[8]李晓姝,高大成,王领民,等.发酵法制备D-乳酸研究进展[J].当代化工,2017,46(8):1659-1662.
[9]刘金熙,李冠洋,金清.乳酸菌发酵生产D-/L-乳酸的研究进展[J].食品安全导刊,2021(33):146-148.
[10]周丽,田康明,陈献忠,等.微生物发酵产光学纯度D-乳酸研究进展[J].中国生物工程杂志,2010,30(10):114-124.
[11]刘娟.D-乳酸生产菌的诱变育种及发酵条件优化[D].长春:吉林农业大学,2016.
[12]ABDEL-RAHMAN M A, TASHIRO Y, SONOMOTO K.Recent advances in lactic acid production by microbial fermentation processes[J].Biotechnol Adv,2013,31(6):877-902.
[13]李中.基于甘油和乳酸的体外合成生物学研究[D].济南:山东大学,2018.
[14]姜珊.利用木质纤维素高温生产乳酸的研究[D].上海:上海交通大学,2019.
[15]李爽.D-乳酸产生菌株的基因敲除[D].天津:天津大学,2010.
[16]王希庆.产高光学纯度D-乳酸保加利亚乳杆菌工程菌的构建及在生物炼制中的应用[D].长春:吉林农业大学,2019.
[17]陈园园.德氏乳杆菌保加利亚亚种QH38-1高密度发酵工艺的优化[D].呼和浩特:内蒙古农业大学,2023.
[18]TASHIRO Y,KANEKO W,SUN Y,et al.Continuous d-lactic acid production by a novelthermotolerant Lactobacillus delbrueckii subsp.lactis QU 41[J].Appl Microbiol Biot,2011,89(6):1741-1750.
[19]邵莲月.玉米秸秆NaOH-Urea预处理及发酵生产D-乳酸初步研究[D].长春:吉林农业大学,2021.
[20]韩文静,梁颖超,陶进,等.产D-乳酸的德氏乳杆菌保加利亚亚种发酵工艺研究[J].安徽农业科学,2018,46(7):4-5,9.
[21]肖雨.保加利亚乳杆菌诱变育种及玉米秸秆同步糖化发酵产D-乳酸工艺研究[D].长春:吉林农业大学,2019.
[22]宋婉莹.常温等离子诱变选育耐酸保加利亚乳杆菌及玉米秸秆发酵产D-乳酸工艺研究[D].长春:吉林农业大学,2022.
[23]梁琼.德氏乳酸杆菌乳酸发酵条件研究及工艺优化[D].武汉:华中科技大学,2007.
[24]侯楠楠,王梅,王倩,等.乳酸菌固态发酵豆粕产酸性能分析[J].中国酿造,2022,41(9):124-129.
[25]张媛,王小艳,陈博,等.基因工程改造植物乳杆菌生产光学纯D-乳酸[J].当代化工,2019,48(4):674-678,682.
[26]龚晓咏,郭翠玲,陈楚莹.预包被微孔板式微生物法测定饮料中维生素B12的方法研究[J].现代食品,2023,29(23):133-136.