Research progress and prospect of quality control of strong-flavour Baijiu Daqu
浓香型白酒是我国传统酿造文化和工匠精神的杰出代表,主要代表包括五粮液和泸州老窖,其以柔和甘甜、香气和谐、回味悠长等特点而著称[1],占据了近70%的市场份额。大曲在中国白酒酿造中具有不可或缺的作用,古语云“粮是酒之肉,水是酒之血,曲是酒之魂(骨)”[2],体现出了大曲的质量直接关系到白酒的质量和产量[3]。
大曲是白酒酿造中使用的糖化发酵剂,是一种以生料小麦为主要原料,加入豆类等其他原料为辅料,通过自然网罗制曲环境中的微生物接种发酵,微生物在曲坯中此消彼长,自然积温转化并风干而成的一种多酶多菌的微生态制品[4-5]。根据发酵温度的不同分为:高温、中温和低温大曲[6];按照风味特征分为酱香型、浓香型以及清香型大曲[7];按照工艺的区别又可以将大曲分为传统、强化和纯种大曲[8]。由历史发展表明,在白酒生产中先有曲,后有大曲酒[5],高温曲酿造酱香型白酒、中温曲酿造浓香型白酒、低温曲酿造清香型白酒。由于自然环境条件、原料和工艺的不同,导致不同风味的白酒产生,也就是说,白酒的香型并非仅由原料和发酵工艺决定,与制曲温度和大曲品质也有一定关系。因此,传统固态白酒酿造要保持典型的风味与口感,与大曲的糖化、发酵及生香作用息息相关,并无可代替。
本文在简单介绍浓香型大曲生产工艺的基础上,探究大曲在挥发性风味物质检测(气相色谱法、高效液相色谱法)、大曲生化指标检测、大曲理化指标检测(近红外光谱、高光谱成像技术)以及微生物演替研究等方面的研究进展,以期给出大曲品质控制发展的可行思路,促进大曲和白酒酿造行业的进步。
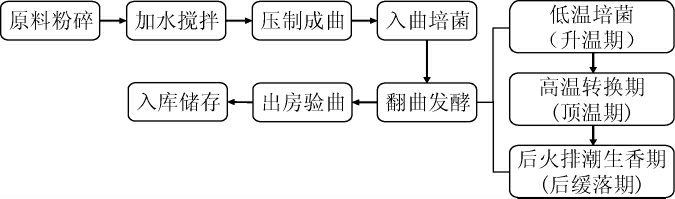
大曲每个生产工艺、操作流程及环境因素的质量水平直接关系到其品质的优劣。大曲的生产工艺包括润麦、粉粹、拌料、装箱上料、踩曲、晾干、入室安曲、培菌、保温控湿、翻曲、堆烧、收拢、出室、入库存储等工序,其制作工艺流程如下:

在大曲制作的各个阶段,需要严格控制温度和湿度。如在培菌过程中,根据曲坯的发酵情况,通过开关门窗来调节温湿度,并每3天检查曲房的发酵情况。在翻曲发酵环节中,首次翻曲应在40 ℃左右进行,并在翻曲后逐渐调节温度,通过调控温度、水分和曲块内氧气浓度等工艺参数,有助于促进不同风味大曲生产菌株的生长和代谢[9]。堆烧阶段需要控制曲坯的温度在60~62 ℃。收拢阶段前,曲坯的温度不得低于40 ℃,并在入库阶段确保曲块之间通风良好。发酵完成后的成品大曲通常需在库房贮存3~6个月,以达到使用标准。在这段时间内,细菌和真菌类群可能发生变化,同时大曲的菌系、酶系和理化指标逐渐趋于平衡。
因此,这一阶段不仅是贮存期,更是后熟过程,旨在减少产酸细菌的数量,确保大曲的品质和稳定性。在影响酒曲培养的因素中,最为重要的便是曲房环境的温湿度,这是决定酒曲发酵质量的重要参数指标之一。
大曲作为浓香型白酒酿造中的关键原料,其独特的制曲工艺为白酒的风味物质提供了丰富的来源。在大曲的制作过程中,经过微生物的作用,原料中的糖分、淀粉等物质转化为酒精和其他挥发性风味物质。这些风味物质包括酯类、醇类、酸类、醛类等多种化合物,在参与酒醅的发酵和蒸馏过程后,从而影响白酒的风味特征和质量稳定[10]。因此,通过检测分析大曲挥发性风味物质,有利于获得更为理想的香气和提高白酒的品质。在大曲挥发性风味物质的检测中,气相色谱法、高效液相色谱法两种方法结合质谱联用技术的应用最为广泛,两种技术对比见表1。
表1 不同色谱检测技术大曲挥发性风味物质对比
Table 1 Comparison of volatile flavor substances in Daqu by different chromatographic detection techniques

色谱检测技术 检测对象 主要分析法 优点气相色谱法高效液相色谱法酯、酸、醇、醛、酮、醚等微量风味化合物化学计量学方法、归一法、内标法聚类分析可用于对气体、易挥发的液体和固体进行色谱的分离和分析;可进行多组分同时分析、分析速度快、应用范围广适用于分析高沸点、大分子、强极性及热稳定性较差的化合物;具有高分离率、高速、高灵敏度、高自动化、高重复性等优点
气相色谱法(gas chromatography,GC)主要是以气体作为流动相,通过色层分离的方法对易挥发性化合物进行定性和定量分析,对于非挥发性液体或固体化合物,可以通过高温裂解和气化后进行整体分析[11]。气相色谱法通常利用化合物在色谱柱中的吸附和解吸附能力的差异来分离样品,然后通过检测器进行检测并绘制色谱图,从而确定各成分的组成和含量。气相色谱法可以在较短的时间内获得待测样品的色谱数据,从而对多组分混合物进行定性和定量分析,具有良好的灵敏度和稳定性,由于气相色谱法有高分辨率、快速分析、可靠性高等特点,在科学研究和工业生产中得到了广泛应用。黄姝[12]采用该方法测定甲醇和乙醇的最低检出限为3 mg/L,相关系数均高于0.999 5,相对标准偏差较小,验证了其可行性。
由于大曲中微量物质的含量极低,常规的气相色谱法难以达到所需的精确度水平。为了进一步分析大曲中的挥发性风味物质,通常需要对样品进行预处理,以提取微量的挥发性风味成分。目前,针对提取大曲香气成分,常用的预处理方法是顶空固相微萃取法(headspace solid phase microextraction,HS-SPME),HS-SPME是一种集采样和进样于一体的不需溶剂的样品微萃取新技术[13],其在研究复杂体系挥发性组分特征方面具有样品用量少、高效快速、灵敏度高、准确度高等优点,而且已经广泛应用于食品[14]、酒类[15]以及饮料[16]等风味成分的检测。
大曲挥发性风味物质的检测通常采用的是顶空固相微萃取结合气相色谱-质谱联用技术(headspace-solid phase micro extraction-gas chromatograph-mass spectrometer,HSSPME-GC-MS)。赵东等[17]采用顶空固相微萃取结合气相色谱-质谱法对大曲中的挥发性风味物质进行了初步的定性和定量分析,结果表明,大曲中的微量挥发性和半挥发性香味成分主要由杂环化合物组成;范文来等[18]先利用超声波加速萃取大曲样品,再应用HS-SPME方法进行快速检测,共检出112种微量挥发性风味化合物,其中含量最高的化合物是异戊酸和2-苯乙醇。陈勇等[19]利用HS-SPME-GC-MS联用技术探究不同类型萃取头,萃取操作条件对检测大曲主要挥发性成分的影响,确定了该大曲的最佳萃取条件,成功检测出了34种挥发性风味组分,确定了大曲的主要挥发性组分包括醛、吡嗪、芳香族和酯4大类。气相色谱法在大曲风味物质检测中发挥着重要作用,同时被广泛应用于白酒酒醅检测和基酒分类中。该技术能够对大曲样品中的挥发性风味物质进行半定量分析,但由于样品制备繁琐、操作要求高,且缺乏定性分析能力,因此难以确定其具体组分结构。
高效液相色谱法(high performance liquid chromatography,HPLC)是通过改进填料粒径及柱压,克服了传统液相柱色谱分离速度慢、柱效低等缺点,通过引入塔板理论体系,并运用了高压泵系统、高效能固定相和高灵敏响应检测器,从而实现高效、快速分离分析的色谱技术[20-21]。高效液相色谱由于具有高压强、高效率、高速度、高灵敏度等特点,已成为广受青睐的有效色谱技术之一,其主要用于医药[22]、食品[23]等领域,特别适用于不能用气相色谱分析检测的低挥发性或非挥发性有机化合物。周韩玲等[24]采用高效液相色谱检测方法对大曲中的L-谷氨酸和γ-氨基丁酸进行检测。先经过前处理对标样和样品进行定性检测,采用体积分数75%甲醇水溶液作为提取液,检测限为1 015 μg/L,线性相关系数分别为0.998 9、0.999 1。经过样品精密度试验和加标回收率试验,得到其相对标准偏差(relative standard deviation,RSD)为1.59%~1.72%,满足分析要求。因此,采用该方法能准确分析大曲样品中的L-谷氨酸和γ-氨基丁酸含量。林燕等[25]采用乙醇高效液相色谱法和CO2减重法两种方法进行对比实验,研究发现,两种测定结果差异不显著,验证了该方法的适用性并测定大曲的发酵力。
目前大曲的挥发性香气物质检测常采用高灵敏度的顶空固相微萃取(headspace solid phase microextraction,HS-SPME)-GC-MS方法,游离氨基酸和有机酸检测常采用HPLC法。气相色谱法通常检测分析时间较长,并且对于复杂体系的分析要求较高,为了充分发挥其优势,常需与其他质谱技术联用。高效液相色谱法可分析GC不能分离的低挥发性物质,弥补GC分离的不足,同时将HPLC与各种分析仪器联用,可以显著提升分析的准确度与灵敏度。
在评价大曲等级时,需要综合考虑其生化、理化和感官各项指标,以确定大曲的整体质量水平。在新的指标体系中,生化指标主要表现为酒化力、酯化力和生香力[26]。大曲酒化力是指大曲在酿酒过程中所表现出的糖化和发酵的能力[27],沈才洪等[28]经过试验设计对比分析发现,不同品质的大曲在酿造过程中会导致酒的含量存在一定的差异,但总体来说,酒的含量都维持在较高水平。杜礼泉等[29]采用检测大曲生成乙醇的能力来评估大曲的发酵力,经过对比分析,验证了优化后的酒化力检测方法能够准确评估大曲的酿酒潜力。袁志强等[30]通过实验发现,刚出房的成品曲酒化力较低,需要经过一段时间的贮存才能达到最高水平,并随着贮存时间的延长,酒化力指标会逐渐下降,一年后的降幅更为明显,两年后下降更加显著。王军凯等[31]通过选择4种方式对大曲产酒能力检测方法进行改进,研究表明,所选取的检测方法的相对平均偏差为0.92%,平均回收率为(95.97±2.27)%,说明其准确性较高。
大曲的酯化力是指大曲催化醇与有机酸反应合成酯的能力[32]。通常,大曲的酯化力是通过液态酯化过程来评估的,而无法精确地评价大曲在固态酿酒过程中的酯化能力。王明洪[33]考虑从酯化反应的温度、用曲量、底物浓度、酯化时间四个条件来对其进行研究,用己酸乙酯含量来衡量所测大曲酯化力的水平。王小琴等[34]通过在发酵过程中引入曲粉的操作,观察到酒糟中己酸乙酯含量的显著差异,验证了大曲酯化力在发酵过程中生成己酸乙酯的重要作用。在对大曲发酵过程中的生化特性进行深入分析的基础上,杨勇等[35]揭示了曲块不同区域间的特性差异及其演变规律。研究结果表明,尽管曲皮区域的微生物菌系多样性最高,但其酯化能力却相对较低;相反,曲心区域的细菌数量较少,糖化与发酵能力也相对较弱,但酯化能力却显著高于其他区域。
大曲的生香力表征了其生成复合曲香物质的潜力,可以通过淀粉的消耗量、蛋白质与脂肪的分解程度来衡量,由于目前缺乏对转化过程中脂肪酸的精确分析技术,其生香力的评估仍面临挑战。因此,大曲生香力的评价主要基于转化淀粉和蛋白质的变化情况[36]。大曲表现出来的生香功能参与了各种微生物区系和酶系,共同在大曲发酵体系内进行生化反应,随蒸馏过程进入酒体中,也在一定程度上增加了酒体的色泽和香味。在大曲的发酵过程中,各项生化指标之间存在着显著的相关性,并且在曲皮与曲心之间也呈现一定的差异性。通过对大曲生化指标(酒化力、酯化力、生香力)的综合分析,为评估大曲质量提供了科学的基准。
大曲理化指标包括传统指标中水分、酸度、淀粉等基本指标,还包括糖化力、液化力、发酵力等。传统的大曲理化指标测定方法参照QB/T 4257—2011《酿酒大曲通用分析方法》等[37-38]进行测定。目前,对大曲理化性质的检测方法主要以湿化学分析方法为主,所以存在检测周期长、操作复杂、易污染环境等问题,现通常采用光谱技术进行快速、无损检测分析,主要包括近红外光谱和高光谱成像技术,其检测对比分析见表2。
表2 不同光谱技术检测大曲理化指标特征对比
Table 2 Characteristics comparison of physiochemical indexes of Daqu detected by different spectral techniques

光谱技术 检测对象 优点 局限性近红外光谱高光谱成像技术糖化力、液化力、发酵力、水分、淀粉、酸度具备较好的穿透性,前处理简单、绿色环保;检测快速、无损、检测效率高能够快速、无损地对样本进行定量及定性分析,同时获取对象的光谱信息和空间信息易受水、油脂的干扰影响光谱质量;根据光谱信息无法获取图像信息,不能实现内部含量的可视化高光谱样本数据量大,原始光谱数据之间相关性很高,并具有一定代表性
表3 不同光谱技术对大曲理化指标的检测对比
Table 3 Detection comparison of physiochemical indexes of Daqu by different spectral techniques
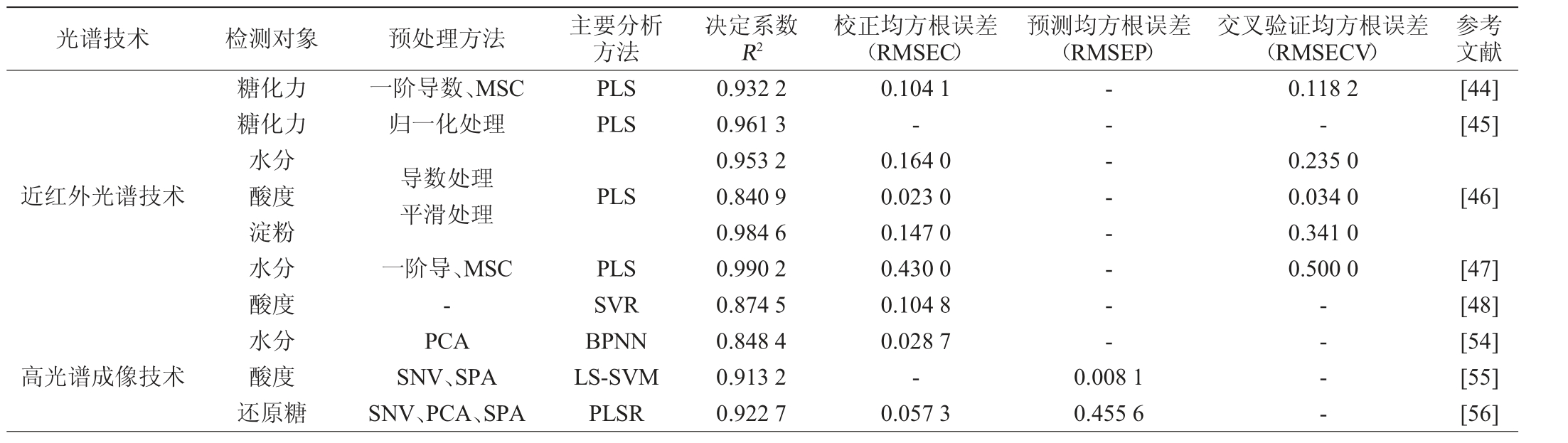
光谱技术 检测对象 预处理方法 主要分析方法参考文献糖化力糖化力决定系数R2校正均方根误差(RMSEC)预测均方根误差(RMSEP)交叉验证均方根误差(RMSECV)一阶导数、MSC归一化处理PLS PLS 0.932 2 0.961 3 0.104 1---0.118 2-[44][45]近红外光谱技术PLS-- - - - -0.235 0 0.034 0 0.341 0 0.500 0[46]高光谱成像技术水分酸度淀粉水分酸度水分酸度还原糖导数处理平滑处理一阶导、MSC-PCA SNV、SPA SNV、PCA、SPA PLS SVR BPNN LS-SVM PLSR 0.953 2 0.840 9 0.984 6 0.990 2 0.874 5 0.848 4 0.913 2 0.922 7 0.164 0 0.023 0 0.147 0 0.430 0 0.104 8 0.028 7-0.057 3 0.008 1 0.455 6-- - -[47][48][54][55][56]
近红外光谱技术(near infrared spectrometry,NIR)在20世纪以来得到迅速发展,已在国外酿酒行业过程与产品质量控制中得到广泛应用。而我国对NIR技术的研究和应用起步较晚(20世纪80年代初开始),但在农业[39]、食品[40]、林业[41]和药物[42]等领域获得了普遍应用。随着近红外光谱分析技术在国内的普及,该技术具有快速、便捷、非破坏性、强大的化学计量辅助手段,有效推动了在白酒行业的原材料检验、发酵过程控制、半成品及成品酒质量中的发展[43]。
近年来,近红外光谱已成为大曲理化指标检测的重要技术之一。刘国英[44]通过对样品进行多种光谱预处理和波段筛选,并结合偏最小二乘回归法(partial least squares,PLS)建立了糖化力的定标模型,进一步验证了该模型在近红外光谱中的预测能力,证明其可用于大曲糖化力的检测,给出了一种准确、及时、高效的大曲的质量监控和分析检测方法。王军凯等[45]利用NIR技术结合偏最小二乘法对大曲糖化力进行预测,结果显示,建模集的回归系数R为0.961 3,验证集R为0.952 8,表明该方法可用于大曲糖化力的预测。苏鹏飞等[46]为了快速检测大曲理化指标的含量指标,分别建立了西凤酒大曲水分、酸度以及淀粉的NIR技术模型,结果显示,NIR技术结合PLS处理后,各模型的校正均方根误差(root mean square error of calibration,RMSEC)和交叉验证均方根误差(rootmeansquareerrorofcrossvalidation,RMSECV)值均较小,表明分析结果准确可靠。胡心行等[47]采用相关的光谱预处理方法来减少干扰因素的影响,再进行波段选择分析,结合PLS建立和优化大曲样品的水分预测模型,模型的决定系数R2为99.02%,RMSECV为0.5%,发现模型预测精度较好,满足分析要求。王开铸等[48]先对原始数据进行异常样本剔除,分别使用PLSR、支持向量回归(support vector regression,SVR)、反向传播神经网络(back propagation neural network,BPNN)建立预测模型,从而实现对大曲酸度值的快速检测,准确分析了大曲内部温度、水分与酸度的相关性。
因此,通过现有的近红外光谱技术结合机器学习方法,可以有效地对大曲理化指标进行快速分析,且应用效果已经比较成熟。然而,在发酵阶段中采用不同生产工艺手段对大曲温度、水分等都会产生影响,从而降低建立的模型的泛化能力。因此,在挑选样本时应当充分考虑多种影响因素,以提升模型的稳定性和广泛适用性。
高光谱成像技术是将光谱技术和成像技术有机融合的新兴快速检测技术[49]。能够克服近红外和计算机视觉技术的缺点,不仅能提供样本表面特征信息,还能提供其内部化学成分的光谱信息[50]。高光谱成像技术可以快速、无损地对样本进行定量和定性分析,同时直观展示图像,且比近红外分析方法有较大的优越性。目前,已经广泛应用于农产品[51]、食品[52]及医学[53]等检测中,对于白酒酿造过程主要集中在对大曲理化指标进行检测。
适当的水分含量能够促进大曲中酶的活性,有利于淀粉的降解和酒精的生成,从而提高酒的产量和质量。叶建秋等[54]利用高光谱特征波段的纹理信息与水分含量指标的关联性进行建模研究,并运用主成分分析和特征波段对应的二维信息进行灰度共生纹理提取。依据提取的图像纹理特征,采用PLSR、BPNN、SVR等进行建模预测比较,以选择BPNN最佳预测模型。大曲的酸度主要来源于微生物代谢产生的有机酸以及原料的分解过程。孙婷等[55]利用高光谱成像技术的独特优势,采用标准正态变量变换(standard normal variate transformation,SNV)+连续投影算法(successive projection algorithm,SPA)+最小二乘支持向量机(least squares support vector machine,LS-SVM)的组合方法,建立了一种快速预测大曲酸度的模型,并生成了可视化云图,清晰地描绘了大曲酸度值随不同发酵时间的变化情况,为后期大曲酿造提供了一定的基础。大曲的还原糖含量的高低反应了大曲中微生物对酿酒原料的利用效果及其效率,淀粉含量的减少意味着原料得到了更高效的转化,从而证明大曲的发酵品质优良。刘亮等[56]利用高光谱成像技术获取了大曲样本数据,研究发现,在不同发酵阶段,曲样中的还原糖含量存在显著差异,其含量随着发酵时间的延长而逐渐减少,颜色也由红色逐渐转变为蓝色。
通过高光谱成像技术采集大曲的发酵信息,可以有效捕捉大曲在发酵过程中的水分、淀粉以及酸度值的分布情况,从而能准确评估大曲各项指标,为实现大曲的制作和发酵过程的自动化监控提供了技术保障。
在酿造白酒过程中大曲起着重要的作用,其中含有丰富的微生物和各种酶系,是整个酿酒过程中的驱动力。大曲微生物群落结构的研究方法不断发展,从最初的纯培养方法逐步演变为结合多种先进技术的综合应用。传统方法能够在一定程度上揭示大曲中的微生物组成,然而,为了深入探究大曲生产和酿酒过程中微生物群落的动态变化,亟需采用更为先进的分子生物学技术。王世宽等[57]以浓香型大曲微生物群落为研究对象,对聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)进行了优化,确定了最佳的变性剂梯度浓度以及电泳时间,从而分析出不同曲药中的微生物群落情况。ZHANG L Q等[58]研究了3种典型中国大曲酒以及不同种类的淡味大曲的微生物群落结构特征,发现乳酸菌占所有鉴定菌的30.95%,在所有大曲样品中占主导地位,验证了PCR-DGGE方法的适用性。周森等[59]应用高通量测序技术对浓香型白酒大曲中的微生物进行研究,从15种浓香型大曲样品中发现在真菌属组成中存在较大的差异。孙羊羊等[60]利用高通量测序技术对贵州和天津两地的大曲进行了微生物多样性分析,并系统地对比分析了大曲中微生物的进化关系和丰度差异,相对于其他研究较为全面,为了解大曲微生物多样性提供了重要参考。大曲微生物的演替手段经历了多个阶段,从传统分析培养法到PCR-DGGE技术优化,从采用高通量测序技术过渡到宏基因组测序技术,以系统地探究微生物的多样性以及功能。
通过对大曲生产工艺的演进、风味物质对白酒品质的影响、生理化指标的检测方法以及微生物和酶系的研究进展进行分析,得到了多方位的完整描述,对浓香型白酒大曲的品质控制的进一步发展总结及展望如下:
①目前,浓香型白酒曲房的信息化程度不高,较多仍沿用传统的自然发酵和人工操作方式来控制温湿度,难以确保生产标准化。传统大曲制曲过程中,受限于自然条件,微生物种类和活性可能无法充分发挥转化潜力,导致酒产量和质量波动。同时由于制曲周期长、发酵效率低,限制了生产效率和产能提升。通过引入智能化、数字化管理,能有效减少人工操作,缩短生产周期,提高产量和质量,降低生产成本,以增强生产效率,提高产品质量的稳定性。
②在浓香型大曲发酵过程中,其酯类、醇类和酸类物质是对大曲中的主要香味物质及其前体物质的体现。研究通常采用色谱法结合质谱联用技术检测其风味物质,但目前大部分研究仍然依赖于质谱谱库检索进行化合物的定性分析,以及利用内标法进行风味化合物的半定量评估。尚未完全了解分析物质对曲香的重要贡献,而现有的定性和定量方法尚未达到足够的准确性。
③随着各种检测技术不断发展成熟,利用常规的化学分析法已不足以满足大曲生产的在线、实时检测需求。光谱技术的优势使得在大曲生产过程中关键的理化指标能够在线监测,以确保及时获取必要信息,并且能有效管理大曲的品质与生产标准。
④在大曲的发酵过程中,微生物和酶的相互作用至关重要,决定了大曲的质量,也显著影响着最终产品的风味体验。因此,在大曲制作及其酿酒应用中,精准调控微生物群落和酶的活性是实现高效发酵和优质酒品产出的关键。现有的研究主要集中在对大曲微生物的多样性及其演替规律方面,部分研究开始寻找主要微生物群落与其理化指标、风味物质、功能酶系之间的相互关系与作用,这有助于深入揭示大曲的发酵机理,从而促进白酒工业生产的进步。
[1]张杰,程伟,潘天全,等.浓香型白酒风味成分研究现状及展望[J].酿酒,2019,46(1):29-32.
[2]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2007.
[3]ZHENG X,TABRIZI R M,NOUT R J M,et al.Daqu-A traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[4]唐玲,陶雪容.基于粗集理论的大曲理化指标重要性分析[J].黑龙江科技信息,2011(17):36-37.
[5]李大和.改革开放白酒四十年记(上)[J].酿酒,2018,45(4):5-12.
[6]敖宗华,陕小虎,沈才洪,等.国内主要大曲相关标准及研究进展[J].酿酒科技,2010(2):104-108.
[7]陈孝,温承坤,巩园园,等.酒曲的研究进展[J].中国酿造,2019,38(10):7-11.
[8]王忠彦,胡永松.大曲生产技术的研究和发展[J].四川食品工业科技,1994,13(4):1-7.
[9]韩培杰.中国白酒大曲微生物多样性研究[D].福州:福建农林大学,2023.
[10]郑佳,彭智辅,赵东.中国传统酿酒大曲的风味化学研究进展[J].酿酒科技,2017(3):89-94.
[11]赵蒙,孙安,谭功全.白酒酒醅检测技术的研究进展与展望[J].食品科技,2022,47(12):250-257.
[12]黄姝.大曲酒中甲醇和乙醇气相色谱分析[J].牡丹江师范学院学报(自然科学版),2020(2):53-55.
[13]胡航伟,张仁堂,张楠楠,等.基于HS-SPME-GC-MS和化学计量学对不同产地红枣香气成分的分析[J].食品工业科技,2024,45(6):265-271.
[14]张文娟,周考文.HS-SPME-GC-MS在食品挥发性物质分析中的应用[J].食品研究与开发,2021,42(17):218-224.
[15]WANG Z,WANG S,LIAO P F,et al.HS-SPME combined with GC-MS/O to analyze the flavor of strong aroma Baijiu Daqu[J].Foods,2022,11(1):116.
[16]WANG L,YANG X,LI Z T,et al.Sensory characteristics of two kinds of alcoholic beverages produced with spent coffee grounds extract based on electronic senses and HS-SPME-GC-MS analyses[J].Fermentation,2021,7(4):254.
[17]赵东,李扬华,向双全,等.顶空固相微萃取气相色谱质谱法测定曲药中的香味成分[J].酿酒科技,2006(5):92-94.
[18]范文来,张艳红,徐岩.应用HS-SPME和GC-MS分析白酒大曲中微量挥发性成分[J].酿酒科技,2007(12):74-78.
[19]陈勇,陈泽军,周瑞平,等.顶空固相微萃取-气相色谱-质谱法测定大曲中的挥发性组分[J].中国调味品,2013,38(2):70-75.
[20]安明哲,廖勤俭,李杨华,等.高效液相色谱法在白酒分析中的应用[J].酿酒科技,2019,(11):39-42.
[21]张咪咪.高效液相色谱法在中药复方制剂有效成分含量测定的应用研究[D].延安:延安大学,2015.
[22]ANNA M, RUBÉN L, SERGIO B, et al.Ultra high speed liquid chromatography combined with mass spectrometry detection analytical methods for the determination of nitrosamine drug substance related impurities[J].J Sep Sci,2023,46(13):e2300125.
[23]ZHAO Y N,XU W J,LIU R H,et al.Determination and analysis of patulin in apples, hawthorns, and their products by high-performance liquid chromatography[J].Mycotoxin Res,2024,40(2):235-244.
[24]周韩玲,廖勤俭,安明哲,等.大曲中L-谷氨酸和γ-氨基丁酸的高效液相色谱检测方法[J].酿酒科技,2018(4):118-120.
[25]林燕,吴登蓉,李冰川,等.两种测定大曲发酵力的方法研究[J].食品与发酵科技,2022,58(4):141-143,155.
[26]明红梅,周健,朱莉莉,等.大曲传统质量指标体系与新指标体系的对比研究[J].酿酒科技,2015(4):32-36.
[27]凌荔,牟飞燕,袁萌,等.清香型白酒大曲研究进展[J].酿酒,2022,49(6):17-22.
[28]沈才洪,许德富,沈才萍,等.大曲质量标准的研究第一报:大曲“酒化力”的探讨[J].酿酒,2004,31(2):29-30.
[29]杜礼泉,唐聪,蒲浩.大曲产酒能力检测方法的探讨[J].中国酿造,2006,25(8):63-64.
[30]袁志强,汤有宏,刘国英,等.大曲酒化力变化规律的研究[J].酿酒科技,2017(6):26-28.
[31]王军凯,王卫东,蒋明,等.洋河大曲产酒能力检测方法的研究[J].酿酒科技,2021(8):51-54.
[32]汤有宏,王志强,唐林,等.大曲酯化力测定参数的探讨与优化[J].酿酒,2015,42(5):54-57.
[33]王明洪.浓香型大曲酯化力的测定方法探讨[J].酿酒,2012,39(4):79-80.
[34]王小琴,练顺才,安明哲,等.大曲酯化力对固态酿酒的作用[J].酿酒科技,2016(1):63-64.
[35]杨勇,李燕荣,姜雷,等.中高温大曲曲块部位间生化指标的差异及变化规律[J].食品与发酵工业,2019,45(19):73-78.
[36]沈才洪,应鸿,许德富,等.大曲质量标准的研究(第三报):大曲生香力的特征指标探讨[J].酿酒科技,2005(8):20-22.
[37]中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[J].北京:中国轻工业出版社,2011.
[38]周斐成,吴生文,朱庆圣,等.特香型大曲发酵过程中曲块不同部位理化指标及主要酶系动态分析[J].中国酿造,2019,38(4):58-64.
[39]LI M, WIJEWARDANE K N, GE Y, et al.Visible/near infrared spectroscopy and machine learning for predicting polyhydroxybutyrate production cultured on alkaline pretreated liquor from corn stover[J].Biores Technol Rep,2020,9:100386.
[40]柴迎慧,俞玥,宋嘉慧,等.近红外光谱技术结合化学计量学用于畜禽肉制品品质分析的研究进展[J].食品安全质量检测学报,2022,13(10):3098-3105.
[41]王珏,李彦杰,陈益存,等.近红外光谱技术在林业领域的应用[J].南京林业大学学报(自然科学版),2023,47(3):237-246.
[42]SCAPPATICCI C, SPERA S, BIANCOLILLO A, et al.Detection and quantification of alprazolam added to long drinks by near infrared spectroscopy and chemometrics[J].Molecules,2022,27(19):6420.
[43]钟敏,张健,路虎.近红外光谱技术在白酒生产过程中的应用进展[J].酿酒科技,2022(4):106-110.
[44]刘国英.近红外光谱技术在大曲糖化力分析检测方面的应用[J].酿酒,2015,42(4):76-79.
[45]王军凯,王卫东,蒋明,等.近红外光谱技术结合偏最小二乘法检测大曲糖化力[J].酿酒科技,2018(3):116-118.
[46]苏鹏飞,刘丽丽,闫宗科,等.大曲水分、酸度和淀粉指标定量分析模型的建立研究[J].酿酒科技,2020(8):42-45.
[47]胡心行,沈小梅,马雷,等.快速测定大曲水份新方法的研究[J].酿酒,2017,44(5):97-102.
[48]王开铸,田建平,孙婷,等.大曲酸度值的快速预测模型及方法研究[J].中国酿造,2020,39(8):123-127.
[49]童庆禧,张兵,张立福.中国高光谱遥感的前沿进展[J].遥感学报,2016,20(5):689-707.
[50]PU Y Y,FENG Y Z,SUN D W.Recent progress of hyperspectral imaging on quality and safety inspection of fruits and vegetables: A review[J].Compr Rev Food Sci Food Safety,2015,14(2):176-188.
[51]孙传亮,马攀,刘泽厚,等.基于高光谱成像技术的不同类型小麦穗发芽籽粒识别[J].四川农业大学学报,2023,41(6):1071-1078.
[52]PU H B, YU J X, SUN D W.et al.Feature construction methods for processing and analysing spectral images and their applications in food quality inspection[J].Trends Food Sci Tech,2023,138:726-737.
[53]李伟,吕蒙,陈天虹,等.高光谱图像在生物医学中的应用[J].中国图象图形学报,2021,26(8):1764-1785.
[54]叶建秋,黄丹平,田建平,等.高光谱图像技术检测大曲发酵过程中的水分含量[J].食品与发酵工业,2020,46(9):250-254.
[55]孙婷,胡新军,田建平,等.基于高光谱成像技术的大曲酸度值预测及其可视化[J].食品与发酵工业,2020,46(17):226-231.
[56]刘亮,黄丹平,田建平,等.基于高光谱成像技术的大曲还原糖含量预测及其可视化[J].食品与发酵工业,2022,48(5):247-254.
[57]王世宽,侯华,袁城金,等.PCR-DGGE用于浓香型大曲微生物群落分析的条件优化[J].四川理工学院学报(自然科学版),2012,25(3):5-8.
[58]ZHANG L Q,WU C D,DING X F,et al.Characterisation of microbial communities in Chinese liquor fermentation starters Daqu using nested PCR-DGGE[J].World J Microb Biot,2014,30(12):3055-3063.
[59]周森,王成,朱绍宾,等.基于高通量测序技术分析浓香型白酒大曲真菌菌群多样性[J].中国酿造,2021,40(11):55-59.
[60]孙羊羊,尹亚格,吴雨甍,等.基于高通量测序技术分析天津高温大曲微生物菌群多样性[J].中国酿造,2023,42(5):28-34.