表1 制曲条件优化正交试验因素及水平
Table 1 Factors and levels of orthogonal tests for Qu-making conditions optimization

水平A 丢糟添加量/% B 水分添加量/% C 培养温度/℃D 大曲接种量/%1 2 3 10 15 20 50 55 60 25 30 35 5 7 9
Preparation and process optimization of Fuqu made by distiller's grains of strong-flavor Baijiu
麸曲作为白酒酿造的主要发酵剂之一[1],主要以麸皮为原料,经高温蒸煮、冷却,接种纯种微生物,人工控制培养,最后经低温烘干制作而成[2],具有糖化发酵力高,生产周期短,出酒率高等特点[3-4],广泛应用于白酒[5]、米酒[6]等生产中。传统麸曲的制作多以接种纯种霉菌、酵母菌为主[7-8],由于微生物种类少,酶系单一,且缺乏丰富的风味前体,因此酿造出来的酒酒体单薄、口感寡淡、香味短而淡[9],进而制约了麸曲白酒的发展。
丢糟,白酒生产残留的副产物之一,具有产量大、水分含量较高、酸度低、营养物质丰富、微生物种类多等特点[10]。丢糟中含有的蛋白质、脂质、氨基酸等[11-12]物质可为微生物的生长繁殖提供营养。此外,丢糟中还含有产朊假丝酵母(Candida utilis)、热带假丝酵母(Candida tropicalis)、乳酸菌(Lactobacillus)、枯草芽孢杆菌(Bacillus subtilis)等[13]利于发酵的功能微生物,这些微生物经环境的驯化,更能适应酸性环境。酒糟长期堆积易发霉变质污染环境,其中的葡萄糖和乳酸还会污染水源[14]。研究表明,丢糟在麸曲生产中的应用能够提高蛋白酶活力,增加产量并且有助于抑制产酸菌的繁殖,提高淀粉出酒率[15]。淀粉出酒率是乙醇质量(以95%vol计)与原料中淀粉含量的比值,它能反映原料中的淀粉转化为糖的效率,因此可作为评价指标评估酒曲质量[16-17]。
本研究以麦麸为原料,添加浓香型白酒丢糟制作麸曲,以淀粉出酒率、麸曲糖化酶活力及细菌、酵母菌数为评价指标,采用单因素试验确定丢糟添加量、水分添加量、培养温度、大曲接种量对评价指标的影响,并通过正交试验对其制曲工艺条件进行优化。以期提高麸曲品质,促进丢糟的资源化利用。
1.1.1 材料
麦麸、玉米粉:新乡市思丰粉业有限公司;浓香型白酒丢糟、中高温大曲:四川省宜宾市某酒厂。
1.1.2 化学试剂
硫酸铜:上海叶源生物科技有限公司;磷酸二氢钾、无水乙酸钠、亚铁氰化钾、酒石酸钾钠、硫酸镁、冰乙酸、孟加拉玫瑰红、浓硫酸、氢氧化钠、制霉菌素、氯霉素、甲基蓝:成都市科龙化工试剂厂;浓盐酸:重庆川东化工(集团)有限公司。所用试剂均为分析纯。
1.1.3 培养基
牛肉膏蛋白胨培养基:牛肉膏3 g/L、蛋白胨10 g/L、NaCl 5 g/L、琼脂20 g/L、制霉菌素0.05 g/L,115 ℃高压蒸汽灭菌20 min。
孟加拉红培养基:蛋白胨5 g/L、葡萄糖10 g/L、磷酸二氢钾1 g/L、硫酸镁0.1 g/L、孟加拉玫瑰红0.134 g/L、氯霉素0.1 g/L,115 ℃高压蒸汽灭菌20 min。
UV-1200高压蒸汽灭菌锅:翱艺仪器(上海)有限公司;Labserv-LS培养箱:吴江韵达烘箱设备有限公司;Labserv-LS-0610干燥箱:北京中兴伟业世纪仪器有限公司;DZKW电炉:北京市永光明医仪器有限公司。
1.3.1 麸曲制作工艺流程及操作要点
麦麸→加水→拌合→蒸料→摊凉→加曲、加糟→恒温培养→干燥→粉碎→麸曲
操作要点:
麦麸预处理:称取麦麸100 g,以麦麸与水的比例为2∶1添加水充分拌合均匀,121 ℃蒸料20 min。
摊凉、加曲加糟、恒温培养:取出麦麸,无菌摊凉冷却至30~40 ℃,添加10%浓香型大曲和10%丢糟,充分混匀,35 ℃培养36 h[18]。
干燥、粉碎:培养结束后,麸曲40 ℃通风干燥24 h,粉碎机粉碎过40目筛,4 ℃密封保存。
1.3.2 制曲条件优化
单因素试验:分别考察丢糟添加量(0、5%、10%、15%、20%、25%)、水分添加量(35%、40%、45%、50%、55%、60%)、培养温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)、大曲接种量(1%、3%、5%、7%、9%)对麸曲中细菌数、酵母菌数、糖化酶活力及其淀粉出酒率的影响,其中,淀粉出酒率为主要评价指标。
正交试验:基于单因素试验结果,以丢糟添加量(A)、水分添加量(B)、培养温度(C)、大曲接种量(D)为试验因素,以淀粉出酒率为评价指标,采用4因素3水平L9(34)正交试验进行制曲条件优化,正交试验因素与水平见表1。
表1 制曲条件优化正交试验因素及水平
Table 1 Factors and levels of orthogonal tests for Qu-making conditions optimization

水平A 丢糟添加量/% B 水分添加量/% C 培养温度/℃D 大曲接种量/%1 2 3 10 15 20 50 55 60 25 30 35 5 7 9
1.3.3 分析检测
麸曲中细菌及酵母菌的计数:参考国标GB/T 4789.2—2010《食品安全国家标准食品微生物学检验菌落总数》。
糖化酶活力的测定:糖化酶活力通过还原糖测定[19]。糖化酶活力定义:1 g麸曲(绝干计)在35 ℃、pH 4.6条件下,1 h分解可溶性淀粉生成1 mg葡萄糖,为1个酶活力单位(U/g)。
淀粉出酒率的测定:参考企业标准Q/YB 2022S—2020《复合酒曲》[20]。
1.3.4 数据处理
采用Excel 2019处理试验数据,SPSS 20.0进行差异显著性分析,Origin 2021作图,以P<0.05为差异显著。
2.1.1 丢糟添加量对麸曲品质的影响
丢糟中含有大量糠壳,起到疏通氧气的作用,并且丢糟中的粗蛋白、纤维素、淀粉、赖氨酸、蛋氨酸和色氨酸可为微生物提供碳源、氮源,促进其快速生长繁殖[1],同时丢糟中还含有许多酵母、细菌[14]。
丢糟添加量对麸曲品质的影响见图1。由图1可知,当丢糟添加量在0~25%范围内增加时,细菌数、酵母菌数及糖化酶活力均呈先上升后下降的趋势;当丢糟添加量分别为15%、15%、20%、15%时,麸曲细菌数、酵母菌数、糖化酶活力和淀粉出酒率均达最大值,分别为1.03×106 CFU/g、1.47×106 CFU/g、1 185 U/g、50%。其原因可能是,麸皮中含有丰富的碳源[21],加入含有丰富氮源的丢糟,可调节原料的碳氮比,利于微生物快速生长繁殖,其次,丢糟中的微生物经高酸环境驯化,具备良好的耐酸能力,故适量的丢糟有利于微生物的生长繁殖。丢糟中的残余淀粉和木质纤维生物质(如纤维素和半纤维组分)被降解为可发酵性糖,进一步提升了糖化酶活力和淀粉出酒率[22],当丢糟添加量过大,其中的有机酸累积使麸曲的酸含量增加,会对耐酸能力较差的微生物细胞产生毒害作用[23]和降低糖化酶活力[24],且较高浓度的酸会抑制细菌的生长[25],破坏麸曲中微生物的平衡,最终影响发酵效率和淀粉出酒率。综合考虑,选择最佳丢糟添加量为15%。
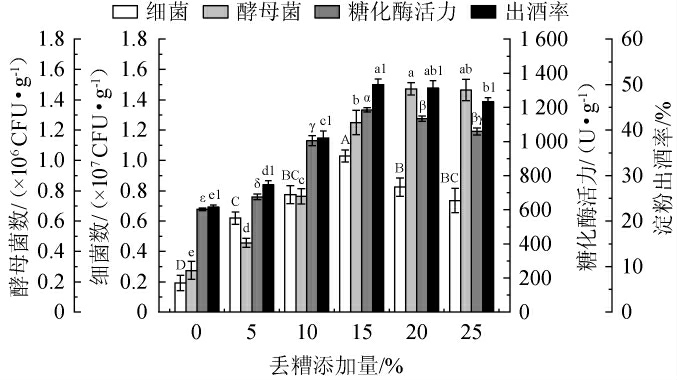
图1 丢糟添加量对麸曲品质的影响
Fig.1 Effect of distiller's grains addition on the quality of Fuqu
不同字母表示差异显著(P<0.05)。下同。
2.1.2 水分添加量对麸曲质量的影响
水是微生物生长繁殖的必要条件之一,也是糖化酶的有效溶剂[26]。麸曲中水分添加量对营养成分通过自由水扩散到基质表面有直接影响[23],不同微生物的水分活度(aw)不同,当aw<0.90时,细菌不能生长,当aw<0.87时,大部分酵母菌的生长繁殖被抑制[27]。
水分添加量对麸曲品质的影响见图2。由图2可知,当水分添加量在35%~60%范围内增加时,细菌数、酵母菌数、糖化酶活力和淀粉出酒率均呈先上升后下降的趋势;当水分添加量分别为50%、55%、50%、55%时,麸曲细菌数、酵母菌数、糖化酶活力和淀粉出酒率均达最大值,分别为0.69×108 CFU/g、0.97×107 CFU/g、1 311 U/g、49.8%。当水分添加量较低时,可能会降低糖化酶的溶解度,导致糖化酶活力下降,同时,可能会降低营养物质的流动性和微生物的附着性,从而减少微生物与营养物质的接触及吸收效率。此外,水分过低还可能导致微生物细胞内呼吸酶失活,从而影响细菌、酵母和产酶菌的生长、繁殖和产酶能力[28]。当水分添加量较高时,易造成麸曲黏稠结团,降低内外气体交换效率,形成缺氧环境,从而抑制好氧或兼性好氧微生物的生长和产酶能力,且在生产过程中可能会在干燥阶段增加翻拌次数,提高生产成本,增加杂菌污染的风险。因此,水分添加量可能通过影响酵母菌、细菌和糖化酶活力,从而影响淀粉的转化效率和出酒率。综合考虑,选择最佳水分添加量为55%。
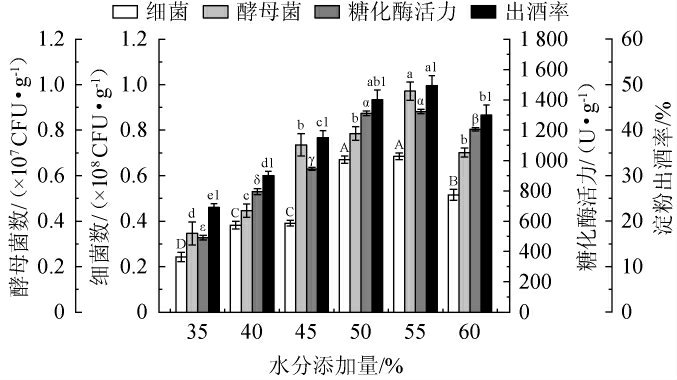
图2 水分添加量对麸曲品质的影响
Fig.2 Effect of water addition on the quality of Fuqu
2.1.3 培养温度对麸曲品质的影响
培养温度影响微生物的生长和产酶情况及糖化酶活性的稳定性。温度过低,微生物的呼吸代谢酶活受到抑制,导致其生长缓慢,影响糖化酶的生成,呈香呈味的前体物累积少;温度过高,微生物的呼吸代谢酶活和糖化酶活性的稳定性受到破坏[29-30]。
培养温度对麸曲品质的影响见图3。由图3可知,当培养温度在25~45 ℃范围内增加时,细菌数、酵母菌数、糖化酶活力和淀粉出酒率均呈先上升后下降的趋势;当培养温度分别为35 ℃、30 ℃、30 ℃、30 ℃时,麸曲细菌数、酵母菌数、糖化酶活力和淀粉出酒率均达最大值,分别为1.46×108CFU/g、1.94×107 CFU/g、1 419 U/g、50.8%,糖化酶活力和酵母菌数较高时对发酵过程起到积极作用。当培养温度偏低时,会抑制细菌、酵母菌以及产酶菌的生长,影响淀粉的转化效率,导致淀粉出酒率降低;当培养温度偏高时,酵母菌数和糖化酶活力开始减少。可能是麦麸持水性较差和丢糟中含有一部分糠壳,增大了麸曲的疏松度,从而加快了水分的蒸发速度,致使物料干燥和环境湿度低,进而抑制了细菌、酵母菌的生长[29],与此同时,由于产酶菌的死亡和糖化酶的热稳定性受到破坏[31],这些因素的共同作用导致糖化酶活力迅速下降,进而影响淀粉的糖化和出酒率。综合考虑,选择最佳培养温度为30 ℃。
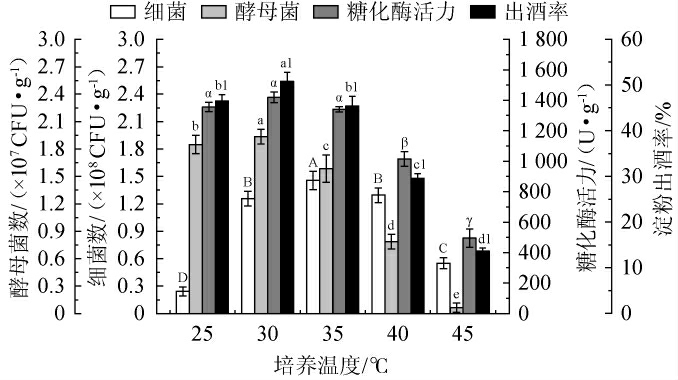
图3 培养温度对麸曲品质的影响
Fig.3 Effect of culture temperature on the quality of Fuqu
2.1.4 大曲接种量对麸曲品质的影响
大曲在制曲的过程中起提供菌源、糖化发酵的作用[32]。在发酵过程中,大曲的用量直接影响着发酵进程与产酒质量。添加适量的大曲有助于提高微生物生长量,缩短生产周期,降低非生产成本。
大曲接种量对麸曲品质的影响见图4。由图4可知,当大曲接种量在1%~9%范围内增加时,细菌数、酵母菌数呈先上升后下降的趋势。当大曲接种量分别为5%、7%、7%、7%时,麸曲细菌数、酵母菌数、糖化酶活力和淀粉出酒率均达最大值,分别为2.66×108 CFU/g、2.34×107 CFU/g、1 653 U/g、50.3%。当大曲接种量偏低时,细菌和酵母菌的生长量及糖化酶活力偏低,从而限制了发酵效率,影响了淀粉向酒精的有效转化,进而降低了淀粉出酒率。当大曲接种量偏高时,细菌、酵母菌的生长量和糖化酶活力有所下降,可能是因为发酵起始微生物的数量基值大,引起营养基质短缺,微生物间竞争加剧,促使其过早进入衰亡期,导致产酶减少,同时已产生的酶也可能因细胞的破裂而失活[33],最终对发酵过程和淀粉出酒率产生负面影响。综合考虑,选择最佳大曲接种量为7%。
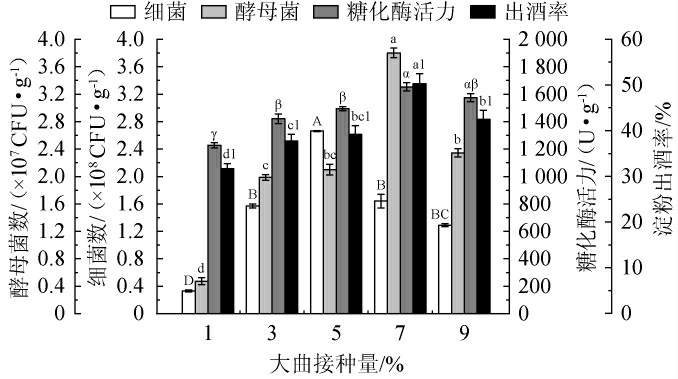
图4 大曲接种量对麸曲品质的影响
Fig.4 Effect of Daqu inoculum on the quality of Fuqu
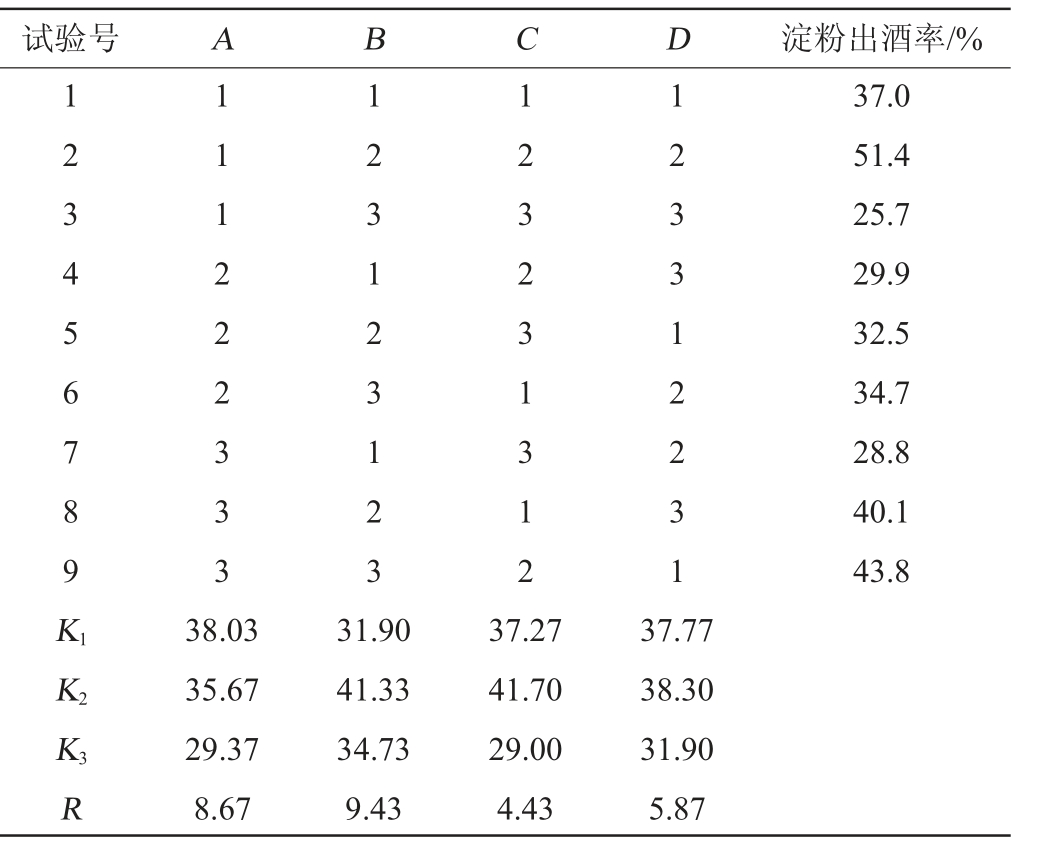
淀粉出酒率不仅与微生物的活性和酶活力有关,还受多种因素影响,如原料、工艺条件等,因此,淀粉出酒率更能全面地评价麸曲的质量。基于各因素对麸曲质量的影响,选取丢糟添加量(A)、水分添加量(B)、培养温度(C)、大曲接种量(D)为试验因素进行正交试验,以淀粉出酒率为评价指标,制曲条件优化正交试验设计与结果见表2。
表2 制曲条件优化正交试验设计与结果
Table 2 Design and results of orthogonal tests for Qu-making conditions optimization
试验号 A B C D 淀粉出酒率/%1 2 3 4 5 6 7 8 9 K1K2K3R 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 1 2 3 3 1 2 2 3 1 37.0 51.4 25.7 29.9 32.5 34.7 28.8 40.1 43.8 38.03 35.67 29.37 8.67 31.90 41.33 34.73 9.43 37.27 41.70 29.00 4.43 37.77 38.30 31.90 5.87
对正交试验结果进行分析(见表2),各因素对麸曲质量的影响为:B(水分添加量)>A(丢糟添加量)>D(大曲接种量)>C(培养温度),最佳制曲条件组合为A1B2C2D2,即丢糟添加量10%,水分添加量55%,培养温度30 ℃,大曲接种量7%。在此优化条件下,淀粉出酒率最高,达到51.4%,相较于优化前的淀粉出酒率(37%),提高了38.91%,此外,细菌数、酵母菌数、糖化酶活力也得到了增加,分别达到1.50×108 CFU/g、3.08×107 CFU/g、1 851 U/g。
经单因素试验、正交试验确定最佳制曲条件为:丢糟添加量10%,水分添加量55%,培养温度30 ℃,大曲接种量7%,在此优化条件下,麸曲淀粉出酒率高达51.4%,比优化前提高了38.91%。此外,细菌数、酵母菌数、糖化酶活力也得到了增加,分别达到1.50×108 CFU/g、3.08×107 CFU/g、1 851 U/g。细菌分泌的蛋白酶、液化酶、糖化酶及酯酶等多种酶,有利于酸、醇、醛、酯等风味物质及其前体物的增加,酵母菌可提高糖化力、发酵力,糖化酶活力有助于提升原料的利用率和出酒率。因此,本研究为麸曲白酒工艺的优化和产品品质提升提供了参考。
[1]周金虎.黄鹤楼酒生态洞酿产愈创木酚类功能菌的筛选与应用[D].武汉:湖北工业大学,2019.
[2]张杰,程伟,关玉权,等.高糖化力霉菌Mxzd-001麸曲的培养工艺优化及应用[J].酿酒科技,2021(1):17-23.
[3]张凯悦.酿醋用黑曲霉糖化力与产孢能力的相关性研究及麸曲淀粉酶组分分析[D].临汾:山西师范大学,2021.
[4]靳沛.大曲和麸曲相结合液态发酵白酒的酿造及理化性质的研究[D].沈阳:沈阳农业大学,2020.
[5]赵恒山.产糖化酶、液化酶菌株的筛选及麸曲的制备[D].晋中:山西农业大学,2017.
[6]KIM M, SEO J A.Fermentation profiling of rice wine produced by Aspergillus oryzae KSS2 and Rhizopus oryzae KJJ39 newly isolated from Korean fermentation starter[J].Appl Biol Chem,2021,64(1):25.
[7]ZHANG W X,WU Z Y,ZHANG Q S,et al.Combination of newly developed high quality Fuqu with traditional Daqu for Luzhou-flavor liquor brewing[J].World J Microb Biot,2009,25(10):1721-1726.
[8]李洪媛,马美荣,周林艳,等.根霉酵母混合麸曲在清香型白酒生产中的应用[J].酿酒科技,2021(9):123-130.
[9]高传强.芝麻香型白酒的典型工艺特征[J].酿酒,2022,49(2):3-15.
[10]CHETRARIU A, DABIJA A.Spent grain: A functional ingredient for food applications[J].Foods,2023,12(7):1533.
[11]张瑞景,汪江波,蔡凤娇,等.白酒糟生产丢糟酒的研究进展[J].中国酿造,2020,39(6):17-21.
[12]胡伟,陈豫.多粮型白酒酒糟成分分析研究[J].食品工业科技,2015,36(2):118-120,125.
[13]WEI D, FAN W L, XU Y.Identification of water-soluble peptides in distilled spent grain and its angiotensin converting enzyme(ACE)inhibitory activity based on UPLC-Q-TOF-MS and proteomics analysis[J].Food Chem,2021,353:129521.
[14]ZHANG J Q,WU D G,ZHAO Y K,et al.Engineering Shewanella oneidensis to efficiently harvest electricity power by co-utilizing glucose and lactate in thin stillage of liquor industry[J].Sci Total Environ,2023,855:158696.
[15]刘建波,赵德义,曹建全,等.丢糟在细菌麸曲中的应用研究[J].酿酒,2012,39(6):18-20.
[16]黄亮,任志强,邓杰,等.“麸曲+酒母”模式对丢糟发酵产酒的影响[J].现代食品科技,2022,38(11):73-79.
[17]周娜娜,李永恒,孙振江,等.超期储存小麦与水稻混合发酵生产燃料乙醇的研究[J].中国酿造,2021,40(8):169-173.
[18]张旭姣,闫裕峰,周景丽,等.强化多微麸曲制备工艺优化及其在陈醋酒精发酵阶段的应用[J].中国酿造,2020,39(2):129-134.
[19]王福荣.酿酒分析与检测[M].北京:化学工业出版社,2005:166-167.
[20]安琪酵母股份有限公司.Q/YB 2022S—2020 复合酒曲[S].湖北:湖北省食品安全企业标准网,2020.
[21]王玉珏,崔艺燕,马现永,等.白酒糟生物发酵饲料的生产工艺及其在猪和鸡生产中的应用[J].动物营养学报,2024,36(4):2188-2198.
[22]任海伟,徐娜,李金平,等.化学预处理提高酒糟生物质酶解糖化效果[J].农业工程学报,2014,30(16):239-246.
[23]程伟,卓毓崇,杨柳,等.不同工艺对麸曲中酸性蛋白酶活性的影响[J].酿酒科技,2016(12):40-42.
[24]姚亚林.酸度对白酒固态发酵产酒的影响[D].自贡:四川轻化工大学,2021.
[25]潘婉舒,彭杨,杜大钊,等.醋酸菌麸曲制备工艺的优化[J].食品与机械,2018,34(10):206-211.
[26]倪海斌,彭奎,王超凯,等.藏曲高产糖化酶霉菌的筛选及其产酶条件优化[J].食品与发酵科技,2022,58(2):31-37.
[27]周德庆.微生物学教程[M].北京:高等教育出版社,2011:98.
[28]ZHU Y Z,LI Y Y,HAN J G,et al.Effects of changes in water status on soil microbes and their response mechanism:a review[J].J Appl Ecol,2019,30(12):4323-4332.
[29]赵行星.糖化酶在“温度对酶活性的影响”试验中的应用效果[J].生物学通报,2022,57(8):54-56.
[30]ENGQVIST M K M.Correlating enzyme annotations with a large set of microbial growth temperatures reveals metabolic adaptations to growth at diverse temperatures[J].BMC Microbiol,2018,18:1-14.
[31]颜智叶.特香型大曲主要酶类的初步分析[D].南昌:江西农业大学,2016.
[32]肖冬光,赵树欣,陈叶福,等.白酒生产技术[M].北京:化学工业出版社,2011:257.
[33]龙晓晴.产氢优势菌的筛选及磁场强化芽孢杆菌BH01产氢的研究[D].湘潭:湘潭大学,2017.