Research progress on microbial communities and flavor substance characteristics in strong-flavor Baijiu during brewing
白酒是具有上千年历史的中国民族特色酒精饮料,被誉为中国“国酒”,也是世界六大蒸馏酒之一[1]。安徽、贵州、山东、山西、四川等地是国内白酒的主要酿造省份,其白酒生产量占我国白酒总产量的90%以上[2]。因为酿造地域的差异,导致了环境中微生物种类的差异,另外由于白酒生产企业的酿造原材料和酿造工艺不同,使白酒在发酵过程中产生的风味物质有所不同,同时这些风味物质作为白酒典型特征的基础,以一定的比例共存于酒体中相互作用,形成不同香型和不同特点的白酒。根据风味的不同,白酒主要可分为12种香型,包括浓香型、清香型、酱香型、米香型、凤香型、兼香型、董香型、豉香型、特香型、老白干香型、芝麻香型、馥郁香型,其中浓香型白酒占白酒总产量的70%[3]。
微生物在生产酒精、代谢风味物质、糖化原料和促进发酵等方面发挥着重要作用,对白酒的风味形成和品质有着重要的影响[4],大曲[5]、窖泥、酒醅、环境[6]中的微生物相互作用形成了白酒发酵过程中的生态系统。为了更好的调控白酒的风味、提升白酒的品质,对浓香型白酒发酵微生物的研究就显得尤为重要[7]。
为了更全面了解浓香型白酒,本文对近年来浓香型白酒的酿造、微生物组成、风味物质形成及风味物质的鉴定方法的研究现状进行总结分析,以期为今后浓香型白酒的规范化生产和管理、理论研究与技术开发提供参考。
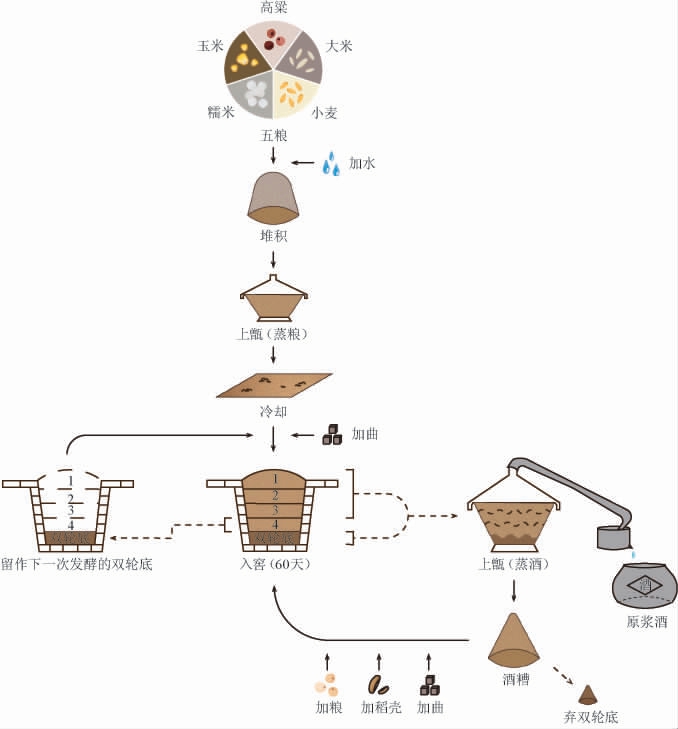
浓香型白酒以其浓郁的香味,入口绵柔等特点深受消费者喜爱。由于产区、原料等差异因素的存在,浓香型白酒的酿造工艺也有区别,河北地区浓香型白酒代表之一的泥坑白酒的酿造工艺如下:

白酒中风味化合物的代谢和积累是由微生物群演替及其相互关联的代谢过程驱动的[8]。微生物在白酒发酵过程中的作用不局限于影响白酒的风味,还关系到白酒的出酒率与品质等诸多方面。目前浓香型白酒酿造行业还存在着许多问题,如酿造产品质量难以保证,出酒率较低,对酒中风味化合物的形成了解不透彻,酿造工艺复杂,存在很多干扰等[9],因此了解白酒酿造过程中微生物组成并寻找优势菌群格外重要。浓香型白酒发酵大多采用的是传统泥窖来进行发酵,微生物来源有很多,包括大曲中的微生物,窖泥中的微生物,操作中环境中的微生物等,所有的微生物共同构成了白酒发酵的微生物群落结构。
2.1.1 大曲的制作工艺
大曲为白酒发酵过程中的糖化剂,也是发酵剂,为白酒发酵提供微生物和酶[10]。其中的微生物种类繁多。浓香型白酒发酵主要采用的大曲为中、高温大曲,制曲车间遵循发酵控温自然生态控温,一般需要在菌室里面放置20~25 d,之后转移到避光的库房内存储60 d后才能投入使用[11]。大曲的制作工艺流程如下:
2.1.2 大曲制作过程中微生物的变化
王志强等[12]研究大了曲制备过程中细菌群落的变化,通过高通量测序技术筛选中温大曲主要菌群包括乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)等;高温大曲中乳杆菌属、芽孢杆菌属(Bacillus)、克雷伯氏菌属(Klebsilla)等丰度较高。王国峥等[13]研究发现,克罗彭施泰特氏菌(Kroppenstedtia eburnea)和芽孢杆菌属为优势菌种,其中克罗彭施泰特氏菌的丰度最高。大曲进入菌室培养时间不同会导致微生物群落有差异。大曲进入菌室后的培养分为升温期、高温期、降温期和出室期。升温期温度逐渐升高,各种微生物生长迅速,随着温度逐渐升高,一些微生物也会失活,高温期温度上升到最高,部分不耐高温的菌株受温度影响活性降低直至失去活性,酵母菌全部失活,降温期温度降低,微生物再次活跃,酵母菌迅速生长。这与韩培杰[14]的研究一致,细菌、真菌开始增加在培养前期(9 d)出现峰值,之后温度升高,细菌不耐热菌株开始死亡,真菌相对丰度开始悬崖式下跌,12 d时降为最低,温度降低,细菌相对丰度出现回升,最终变化平稳,真菌的相对丰度变化较细菌稍有差异,15 d后真菌相对丰度有小幅度回升,随后趋于平稳。
2.1.3 大曲中微生物差异
由于自然环境的差异,不同地区所产大曲所含微生物存在差异,这种差异造成的结果表现在两个方面:一是微生物群落的差异导致风味形成的细微差异,而这种影响在一定意义上是正向的,造就了白酒不同的感官体验;二是微生物群落的差异导致大曲的理化性质(如酯化力和糖化力)存在缺陷,在一定程度上直接影响白酒的品质和出酒率[15]。MA S Y等[16]在大曲样品中发现41种挥发性代谢产物存在差异,差异代谢产物与差异微生物之间存在显著相关关系(P<0.05)。此外,基于功能预测和途径富集分析,不同产区大曲样品中微生物代谢功能预测存在显著差异。并且同一块大曲的不同位置所含微生物丰富度不同,曲块中心部分以及曲块与曲块相接触部分受高温影响,颜色呈深褐色。湖北省食品配料工程技术研究中心[17]通过研究发现,发酵温度效应没有显著改变微生物种类,但热不稳定性细菌种群和真菌种群减少。
由于培养室与陈化室环境差异较大,导致同一块大曲在陈化室与培养室展示出的微生物多样性和丰富度存在差异。其微生物种类以及丰富度见表1。
表1 大曲菌种组成
Table 1 Composition of Daqu strains

大曲来源 菌种组成(比例)大曲培养室(细菌)大曲培养室(真菌)大曲陈化室(细菌)大曲陈化室(真菌)Lactobacillus(24.9%)、Weissella(27.2%)、Leuconostoc(17.1%)、Staphylococcus(15.2%)、Lactococcus(4.1%)、Enterobacter(2.3%)、Pantoea(1.9%)、norank_f_norank_o_Chloroplast(1.4%)、others(4.5%)Aspergillus(1.1%)、Thermoascus(81.3%)、Rhizopus(13.2%)、Trichosporon(0.5%)、unclassified_f_Dipodascaceae(2.8%)、others(1.1%)Bacillus(93.9%)、Lactobacillus(2.1%)、Leuconostoc(0.7%)、Staphylococcus(1.7%)、Lactococcus(0.1%)、Pediococcus(<0.1%)、Weissella(<0.1%)、others(0.9%)Aspergillus(78.2%)、Thermoascus(0.3%)、Rhizopus(1.4%)、Trichosporon(7.6%)、Candida(6.0%)、Wickerhamomyces(0.5%)、Hyphopichia(1.1%)、unclassified_f_Dipodascaceae(2.4%)、others(2.3%)
在大曲培养室中细菌群落主要包括乳酸菌属(Lactobacillus)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、葡萄球菌属(Staphylococcus)等,真菌群落主要包括耐热囊菌属(Thermoascus)和根霉属(Rhizopus)。当大曲从培养室取出放入陈化室陈化至使用的过程中,细菌群落变为芽孢杆菌属为主要菌属,乳酸菌属和魏斯氏菌属减少;真菌群落中曲霉属和毛孢子菌属(Trichosporon)占比增加。
CHEN Y R等[18]采用传统培养技术和Illumina MiSeq测序方法分析特殊风味白酒大曲的微生物结构,其研究结果表明,主要的细菌群落包括芽孢杆菌属、乳杆菌属和红螺旋菌属(Rhodospirillum),而酵母菌属和散囊菌属(Eurotium)是主要的真菌群落。张永利等[19]研究发现,大曲中的优势真菌属有毕赤酵母属(Pichia)、热曲霉属(Aspergilus)和曲霉菌属,优势细菌是芽孢杆菌属、链霉菌属(Streptomyces)、糖多孢菌属(Saccharopolyspora)、乳酸杆菌属、伪诺卡菌科属(Pseudonocardiaceae)、魏斯氏菌属、葡萄球菌属和醋杆菌属(Acetobacter)。
窖泥是一种特定的发酵粘土,是发酵池中用于白酒生产的接种物和微生物栖息地[20]。窖泥覆盖在窖池的底部和内壁,为粮食发酵提供合适的微生物环境[21]。窖泥中的微生物种类、数量、微生物间的相互作用以及微生物的代谢产物对酒的发酵起到了至关重要的作用[22]。其微生物种类、数量和比例影响发酵过程的pH、产酸,产醇等能力,影响前体风味物质的形成,如丁酸、己酸、己酸乙酯等[23]。
张朝正等[24]研究发现,窖壁和窖底所处的环境氧气含量存在差异,底部氧气更加稀薄,并且其长期浸泡在黄水中,酸碱度和微量元素等指标水平比窖壁要高,因此导致接触窖底的酒醅发酵所产生的风味化合物含量要高于接触窖壁的酒醅。则造成窖池下层酿出来的酒质也比较好。使用传统窖泥微生物研究技术对窖泥微生物的研究存在缺陷,但厌氧培养、纯培养技术和传统的微生物鉴定技术为白酒生产起到了重要的推动作用[25]。PU S C等[26]通过研究发现,洛克菲特青霉属(Roqueforti)、库德里阿兹威毕赤酵母属(Pichia kudriavzevii)、罗氏青霉(Penicillium robsamsonii)、树格孢子菌(Alternaria arborescens)、木孢子菌(Trichosporon insectorum)、限制性马拉色菌(Malassezia restricta)在形成上部窖壁的窖泥样品中占主导地位,中窖壁以曲霉菌、环状镰刀菌(Fusarium)、根链格孢菌(Alternaria nees)为主。从窖池底部采集的窖泥样品中,鉴定出轴纹双极菌(Bipolaris axopiocola)、奥齐梅西菌(Ramgea ozimecii)、阿根廷青霉菌(Penicillium argentinense)、昆士兰绿脓杆菌(Calonectria queenslandica)、罗伯茨绿脓杆菌和罗克福蒂青霉菌(Penicillium roqueforti)。
本研究团队前期研究发现,属水平下窖泥细菌群落组成包括芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、氢孢菌属(Hydrogenispora)、氨基细菌属(Aminobacterium)、小毒蜥属(Petrimonas)、沉淀杆菌属(Sedimentibacter)、嗜蛋白属(Proteiniphilum)、互营单胞菌属(Syntrophomonas)、球菌属(Sporosarcina)、荸荠属(Caproiciproducens)、钙杆菌属(Caldicoprobacter)、碱性菌属(Alkalibaculum)、硫杆菌属(Solibacillus)等。真菌群落包括曲霉属(Aspergillus)、毛孢子菌属(Trichosporon)、危克汉姆酵母(Wickerhamomyces)、孢霉菌属(Mortierella)、球腔菌属(Phaeosphaeria)、古根霉菌属(Archaeorhizomyces)等。其中Hydrogenispora和unclassified_f_Dipodascaceae为优势细菌和优势真菌。随着发酵轮次的增加,乳杆菌属大量繁殖,其具有产乳酸酯的能力,在代谢过程中能将己糖转化为乳酸、酒精和CO2;梭菌属等产己酸的微生物数量下降,导致了窖泥pH升高,窖泥板结,对产出白酒的品质造成影响。但是窖泥的质量不是决定酒的品质的唯一因素,温度的把控、工人的操作、酒醅的质量等都决定着酒的品质[27]。
罗晶等[28]对窖泥中微生物丰富度进行研究发现窖泥中的微生物种类多以厌氧微生物为主,主要以甲烷菌、梭状芽孢杆菌、硝酸盐还原菌、乳酸菌、硫酸盐还原菌和厌氧异氧菌等。梁欢等[29]通过Illumina PE250测序法对新老窖泥进行研究,分析了其微生物群落结构和多样性,结果显示出不同窖龄、不同品质的窖泥微生物群落结构有很大差异,新窖泥微生物丰富度最高,优势真菌为单端孢菌属,优势细菌为乳酸菌属,老窖泥优势细菌也同样为乳酸菌属,优势真菌为青霉属,由于窖泥中微生物群落组成有差异,导致酿造出来的酒质也会有差异。肖琴等[30]采用高通量测序技术、线性判别分析(linear discriminant analysis effect size,LEfSe)和冗余分析(redundancy analysis,RDA)等方法对5年、10年和20年窖龄窖池中的微生物群落结构,差异微生物,微生物与理化因子间的关系进行了研究,研究发现窖龄5年的窖泥微生物多样性更高,这可能是由于真菌的生存方式导致,时间久了窖泥中的营养物质不能满足真菌的生长发育。李俊薇等[31]通过高通量测序技术对人工老窖泥进行研究,在酿造过程中窖泥理化指标的变化和微生物群落的改变,结果显示在0 d的时候,厚壁菌门(Firmicutes)为优势菌种,之后随着发酵的进行变形菌门(Proteobacteria)生长,随着二轮发酵进行,变形菌门、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)等微生物大量生长,另外窖泥中的己酸含量下降,基酒中的己酸和己酸乙酯的含量都有明显降低,反而乳酸增多,导致窖池老化。窖池老化对白酒的风味品质有很大影响,海超[32]对窖泥老化进行了分析,他认为不当的养护会造成窖池的老化,应该根据窖池的pH值定向的进行养护,养护所选菌种应从老窖中提取,力求贴近窖内微生物环境。研究表明总体上窖龄越长,窖泥质量越高,但是随着时间的增长窖泥的质量会出现退化,因此窖泥的日常养护必不可少。
由高粱、大米、小麦、糯米、玉米经粉碎、蒸粮、摊晾、降温、下曲、掺入稻壳、入窖发酵的粮醅称为酒醅。在大曲粉、窖泥、环境中存在大量的酵母菌,细菌等多种微生物共同作用下,粮食中的淀粉,蛋白质等大分子物质被降解为小分子物质,微生物分泌酶,酶作用于物质发生反应产生代谢物质,代谢物质进一步在酶的参与下转化成乙醇和呈味物质[33]。
在发酵过程中同一窖池不同层上的酒醅微生物群落不同。通过窖池中酒醅分布来看,在发酵中期由于中层微生物随着黄水渗入到底层所以导致窖池底部酒醅中微生物丰富度更高并以厌氧微生物为主[34],胡峰等[35]通过白酒风味导向对酱香型白酒发酵过程中不同层次酒醅微生物群落结构进行研究发现,上层的酒醅中霉菌、酵母菌、细菌含量都高于中下层。汪慧慧等[36]通过高通量测序技术对酒醅上中下层微生物群落进行研究发现,在发酵前期由于发酵产酸,产热,产醇,导致了不耐酸,不耐热,不耐醇的微生物生长受到抑制,并且大量好氧微生物在上层活动频繁,导致上层酒醅中真核微生物丰富度和数量要高于中下层,到了发酵中后期,下层酒醅中耐酸、耐醇、耐热微生物大量生长,所以下层微生物数量多于上层。在发酵过程中,酒醅微生物群落时刻都在改变,发酵前期微生物群落变化波动比较大,研究发现,在发酵(0~5 d)属水平下细菌群落主要包括Bacillus、Achromobacter、Lactobacillus、葡萄球菌属(Staphylococcus)、明串珠菌属(Leuconostoc)、糖多孢菌属(Saccharopolyspora)、链霉菌属(Streptomyces)、片球菌属(Pediococcus)、Acetobacter、norank_f_norank_o_Chloroplast、norank_f_Pseudonocardiaceae、Lactococcus、Weissella、短杆菌属(Brachybacterium)、代尔夫特菌属(Delftia)、考克氏菌属(Kocuria)等,其中Bacillus和Lactobacillus的数量呈下降趋势,Achromobacter的数量呈上升趋势。在属水平下真菌群落组成包括温子囊菌属(Thermoascus)、哈萨克斯坦菌属(Kazachstania)、嗜热真菌属(Thermomyces)、Aspergillus、Trichosporon、双足囊菌属(Dipodascus)等。随着发酵时间的增加Thermoascus的数量逐渐下降,Kazachstania的数量急剧增长。这与JIAO W J等[37]通过高通量测序发现普遍存在的微生物群、优势微生物群相一致,其确定了五个属为核心微生物群,包括乳杆菌属、热放线菌属、水杆菌属、曲霉菌属和哈萨克斯坦斯坦菌属。
白酒以其多菌种发酵方式,结合蒸馏出酒,勾调技术调香,后期陈酿等特点,使得其具有丰富的微量成分和风味物质[38]。经研究发现,白酒中的风味物质有2 400多种[39]。按照风味物质和加工工艺的差异可以将白酒分为12种香型,分类及主要香气物质见表2。浓香型白酒作为国内白酒销量第一大香型,不同于其他类型白酒的主要特征是窖香浓郁,入口绵甜爽净,香味浓郁且协调,回味丰厚且悠长。是以己酸乙酯为主体、纯正协调的复合型香气。
表2 白酒主要香型分类及主要香气物质
Table 2 Main flavor classification and main aroma substances of Baijiu

香型 主要香气物质 香味特点 代表品牌浓香型清香型酱香型米香型凤香型兼香型董香型豉香型特香型老白干香型芝麻香型馥郁香型己酸乙酯、乳酸乙酯、乙酸乙酯、丁酸乙酯乙酸乙酯、乳酸乙酯、丁二酸二乙酯乙酸、乳酸、正丙醇乙酸乙酯、β-苯乙醇乙酸乙酯、己酸乙酯己酸乙酯、己酸丁酸、丁酸乙酯乙酸乙酯、β-苯乙醇乙酸乙酯、己酸乙酯乳酸乙酯、乙酸乙酯乙酸乙酯己酸乙酯、乙酸乙酯口味绵甜,窖香浓郁入口微甜、香味悠长空杯留香、回味悠长入口醇甜、香味短暂醇香突出、落口干净酱浓协调、口味绵甜入口微酸、回味悠长落口微苦、后味清爽口味柔和持久醇香清雅、回味悠长焦香突出、爽口醇厚芳香秀雅、香味馥郁泸州老窖、五粮液宝丰酒、汾酒茅台酒、郎酒三花酒西凤酒白云边酒董酒玉冰烧四特酒衡水老白干景芝酒湘西酒鬼酒
近些年,仪器分析设备增多,对白酒风味物质的研究也越来越丰富精确。目前,白酒香气物质的分析方法主要包括三个步骤:第一步是香气物质的提取,第二步是香气物质的分离和鉴定,第三步是香气物质的定性定量分析,具体方法及其优缺点见表3。
表3 白酒香气物质检测方法及其优缺点
Table 3 Detection methods of aroma substances in Baijiu and their advantages and disadvantages
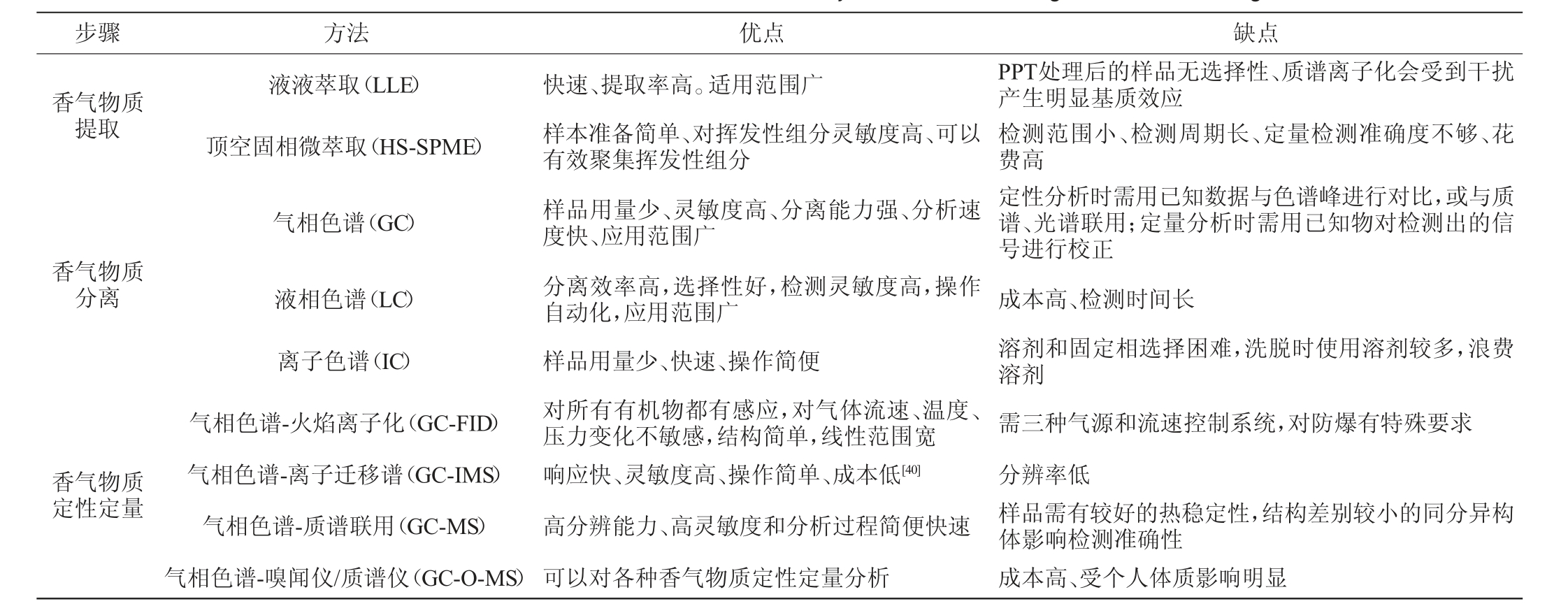
步骤 方法 优点 缺点香气物质提取液液萃取(LLE)顶空固相微萃取(HS-SPME)气相色谱(GC)香气物质分离香气物质定性定量液相色谱(LC)离子色谱(IC)气相色谱-火焰离子化(GC-FID)气相色谱-离子迁移谱(GC-IMS)气相色谱-质谱联用(GC-MS)气相色谱-嗅闻仪/质谱仪(GC-O-MS)快速、提取率高。适用范围广样本准备简单、对挥发性组分灵敏度高、可以有效聚集挥发性组分样品用量少、灵敏度高、分离能力强、分析速度快、应用范围广分离效率高,选择性好,检测灵敏度高,操作自动化,应用范围广样品用量少、快速、操作简便对所有有机物都有感应,对气体流速、温度、压力变化不敏感,结构简单,线性范围宽响应快、灵敏度高、操作简单、成本低[40]高分辨能力、高灵敏度和分析过程简便快速可以对各种香气物质定性定量分析PPT处理后的样品无选择性、质谱离子化会受到干扰产生明显基质效应检测范围小、检测周期长、定量检测准确度不够、花费高定性分析时需用已知数据与色谱峰进行对比,或与质谱、光谱联用;定量分析时需用已知物对检测出的信号进行校正成本高、检测时间长溶剂和固定相选择困难,洗脱时使用溶剂较多,浪费溶剂需三种气源和流速控制系统,对防爆有特殊要求分辨率低样品需有较好的热稳定性,结构差别较小的同分异构体影响检测准确性成本高、受个人体质影响明显
杜静怡等[41]通过液液萃取(liquid-liquid extraction,LLE)和顶空固相微萃取技术(headspace solid-phase microextraction,HS-SPME)结合气相色谱-嗅闻仪(gas chromatography/olfactometry,GC/O)分析清香型志都五谷酒香气活性成分,共检测出40种香气物质,其中定性出35种香气物质。张萌等[42]通过使用气相色谱-离子迁移谱(gas chromatography-ion mobility spectrometry,GC-IMS)和气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)两种方法检测了6种不同香型白酒中的挥发性风味物质,共检测出了56种和77种化合物,有13种为两种方法共同检出,主要包括酯类、醇类、酸类等。梁臣臣等[43]采用GC-MS法对两种由不同原料所酿出的白酒进行挥发性风味物质测定,结果两种白酒共同检出的挥发性风味物质有136种,香味骨架上无差异,微量成分上存在显著差异。其次,通过多元组学分析基础白酒中骨架风味物质的变化,发现醇类、酸类和酯类物质最为丰富,占总风味物质的88.16%~98.87%,并随着轮次的增加而减少[44]。占成等[45]利用GC-IMS对浓香型白酒等六种香型白酒中的挥发性成分进行了定性定量的分析,结果共检测出了70多种风味物质,包括酯类、醇类、醛类、酮类、萜稀类、硫化物、含氮化合物等。李欢欢等[46]也采用GC-IMS技术对挥发性成分进行定量定性分析,在石花白酒中共检测出18种挥发性风味物质,包括酯类5种,酮类3种,酸类1种,呋喃类1种,醛类6种和醇类2种。辛茜等[47]采用LLE和GC-MS技术对西凤酒中的酯类、醇类、醛类、酮类和其他类风味物质进行检测,确定了最佳的检测条件,并成功检测到西凤酒中有21种酯类,7种醇类,3种酸类和11种其他类物质。这些技术的广泛应用对白酒风味检测领域有重要意义。
为了探讨微生物群落变化对基础白酒中关键风味物质的影响,沈世明等[48]采用高通量测序技术分析了入窖前酒醅的微生物组,并通过气相色谱-火焰离子化(gas chromatography-flame ionization detector,GC-FID)测定了基础白酒的风味物质。结果表明,微生物群落在不同轮次之间存在动态变化,细菌和真菌表现出不同的演替模式,风味物质也存在差异。白酒中挥发性风味物质主要包括酯类、醇类、酸类、酮类等。酵母在白酒发酵过程中起关键作用[49],其中酿酒酵母主要代谢乙醇,毕赤酵母被认为是白酒中调节酸度的微生物。DU R B等[50]通过宏转录组学验证乳酸杆菌在白酒发酵中的作用,结果表明乳酸杆菌参与合成苯乙酸、辛酸、乙酸并催化酯类风味物质的形成。葡萄念珠菌被证明有利于脂肪酸的产生,乙酰乳杆菌有助于改善白酒的质量,与风味物质的形成成正相关[51]。酯类通常被认为是白酒中最重要的风味物质类型,产酯的细菌主要有拟杆菌、梭状芽胞杆菌、伯克霍尔德氏菌等,产酯霉菌主要有根霉、毛霉、黑曲霉等[52]。
从代谢的角度来看,酸性物质的浓度可以决定酯类的浓度。因此,酸酯的平衡将成为白酒质量非常重要的关键控制点[53]。白酒发酵过程中产乳酸较多,因此导致乳酸乙酯的含量较高,己酸乙酯的含量不足的情况,这种情况造成了白酒品质较低[54],因此如何控制乳酸乙酯的生成是研究白酒的重要环节。李慧星等[55]通过建立酒醅微生物与酯类成分关联性定量模型解释了出窖酒醅微生物与酯类之间的关联性。李书婷等[56]从代谢调控角度考虑,降低乳酸乙酯含量增加己酸乙酯含量的方法包括改变前体物质的含量,选育菌株提高己酸乙酯含量,添加乳酸菌及其代谢抑制剂降低乳酸乙酯含量。张志伟等[57]通过向酱香酒醅中添加芽孢杆菌、丝状真菌、酯化酵母,从而改变了蒸馏酒中乳酸乙酯、己酸乙酯、乙酸乙酯等风味物质的含量,提升白酒的品质。
白酒通常需要较长的储存时间进行陈酿,以减少新酒的刺激性和辛辣感。ZHANG W等[58]通过研究发现白酒样品的总酸和总酯分别随着陈化而减少和增加。分析了陈化处理后挥发性成分的组成变化,并分析了与白酒品质变化相关的挥发性风味成分。结合感官评价结果,电场陈化使白酒样品的陈酿和酒窖香气更加明显,经过电场陈化处理的白酒质量显著提高。结果表明,电场陈化是改善白酒风味的有效途径。
浓香型白酒发酵过程中,微生物扮演着重要的角色。理清微生物群落与风味物质的关系为之后研究浓香型白酒提供理论基础,有助于改善浓香型白酒的品质和风味,增强浓香型白酒的核心竞争力。
白酒固态发酵是多种微生物共同发酵的复杂过程。发酵过程中微生物组成和丰度的不稳定性导致产品质量波动,是浓香型白酒产业面临的瓶颈问题之一[59]。窖池中新旧窖泥的差异在不同程度上扩大了酒醅发酵的差异,最终影响了所生产的白酒的芳香品质[60],大曲储存时间的长短会造成其微生物群落不同,也会对白酒的发酵造成影响。随着科技进步,可以通过控制温度、pH值、氧气含量等理化性质从而控制微生物的生长,控制微生物的种类,定向调控白酒的发酵,提升白酒风味。
[1]JIA W,MA R T,HU L B,et al.Synergy of physicochemical reactions occurred during aging for harmonizing and improving flavor[J].Food Chem X,2023,17:100554.
[2]唐强.加快构建现代化产业体系推动白酒业高质量发展[N].证券时报,2023-03-09.
[3]ZHANG H M,MENG Y J, WANG Y L, et al.Prokaryotic communities in multidimensional bottom-pit-mud from old and young pits used for the production of Chinese strong-flavor Baijiu[J].Food Chem, 2020, 312:126084.
[4]DUAN J W,YANG S Q,LI H H,et al.Why the key aroma compound of soy sauce aroma type Baijiu has not been revealed yet?[J].LWT-Food Sci Technol,2022,154:112735.
[5]FU G M, DENG M F, CHEN K D, et al.Peak-temperature effects of starter culture (Daqu) on microbial community succession and volatile substances in solid-state fermentation (Jiupei) during traditional Chinese special-flavour Baijiu production[J].LWT-Food Sci Technol,2021,152:112132.
[6]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Tech,2017,63:18-28.
[7]LI Z J,FAN Y,HUANG X N,et al.Microbial diversity and metabolites dynamic of light-flavor Baijiu with stacking process[J].Fermentation,2022,8(2):67.
[8]HUANG X N,FAN Y,LU T,et al.Composition and metabolic functions of the microbiome in fermented grain during light-flavor Baijiu fermentation[J].Microorganisms,2020,8(9):1281.
[9]SHEN S M,LIU J L,LUO R Q,et al.Analysis of the influence of microbial community structure on flavor composition of Jiang-flavor liquor in different batches of pre-pit fermented grains[J].Fermentation, 2022, 8(12):671.
[10]ZHENG X W, TABRIZI M R, NOUT M J R, et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[11]MU Y, HUANG J, ZHOU R Q, et al.Comprehensive analysis for the bioturbation effect of space mutation and biofortification on strong-flavor Daqu by high-throughput sequencing,volatile analysis and metabolomics[J].Food Chem,2023,403:13440.
[12]王志强,蒋学剑,张亮,等.浓香型白酒大曲制备过程中细菌群落、环境因子和理化特性研究[J].酿酒科技,2023(16):35-41.
[13]王国峥,陈笔,卢建军,等.基于宏基因组学测序技术分析三个轮次高温大曲微生物群落[J].食品科学,2023,44(16):220-227.
[14]韩培杰.中国白酒大曲微生物多样性研究[D].福州:福建农林大学,2023.
[15]LI H D,LIU S Y,LIU Y B, et al.Functional microorganisms in Baijiu Daqu: Research progress and fortification strategy for application[J].Front Microbiol,2023,14:1119675.
[16]MA S Y,SHANG Z C,CHEN J,et al.Differences in structure,volatile metabolites,and functions of microbial communities in Nongxiangxing daqu from different production areas[J].LWT-Food Sci Technol,2022,166:113784.
[17]WANG Z, WANG S, LIAO P F, et al.HS-SPME Combined with GC-MS/O to analyze the flavor of strong aroma Baijiu Daqu[J].Foods,2022,11(1):116.
[18]CHEN Y R, LI K M, LIU T, et al.Analysis of difference in microbial community and physicochemical indices between surface and central parts of Chinese special-flavor Baijiu Daqu[J].Front Microbiol,2021,11:592421.
[19]ZHANG Y L,XU C,XING G,et al.Evaluation of microbial communities of Chinese Feng-flavor Daqu with effects of environmental factors using traceability analysis[J].Sci Rep,2023,13(1):7657.
[20]GAO J J,LIU G Y,LI A J,et al.Domination of pit mud microbes in the formation of diverse flavour compounds during Chinese strong aromatype Baijiu fermentation[J].LWT-Food Sci Technol,2020,137(1-2):110442.
[21]GAO Z Z,WU Z Y,ZHANG W X.Effect of pit mud on bacterial community and aroma components in yellow water and their changes during the fermentation of Chinese strong-flavor liquor[J].Foods, 2020, 9(3):372.
[22]梁欢,许长峰,唐伟斌,等.泥坑浓香型白酒窖泥中微生物群落结构与多样性分析[J].现代农业科技,2021(3):203-206.
[23]TAO Y,LI J B,RUI J P,et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Appl Environ Microbiol,2014,80(7):2254-2260.
[24]张朝正,张天爽,董思文,等.窖泥中挥发性物质和微生物群落的空间分布规律及其关系[J].食品工业科技,2022,43(5):147-157.
[25]江鹏,何朝玖,刘燕梅,等.浓香型大曲白酒窖泥微生物研究进展[J].中国酿造,2020,39(4):19-22.
[26]PU S C, YAN S B.Fungal diversity profiles in pit mud samples from Chinese strong-flavour liquor pit[J].Foods,2022,11(22):3544.
[27]ZONG X Y,WEN L,MOU T T,et al.Effects of multiple cycles of sorghum starch gelatinization and fermentation on production of Chinese strong flavor Baijiu[J].J Cereal Sci,2022,108:103561.
[28]罗晶,祝水兰,王丽,等.浓香型白酒酿造微生物与风味物质组成的研究进展[J].中国酿造,2020,39(4):1-6.
[29]梁欢,许长峰,朱立宁,等.浓香型白酒地域性及窖泥微生物研究进展[J].中国酿造,2020,39(11):5-8.
[30]肖琴,何平,周瑞平,等.不同窖龄及位置浓香型白酒窖泥微生物群落多样性与理化因子的比较分析[J].食品科学,2023,44(20):165-174.
[31]李俊薇,李斯琳,冯小进,等.浓香窖池生产过程中微生物菌群的变化研究[J].酿酒,2023,50(1):90-92.
[32]海超.窖泥老化原因浅析及预防措施探讨[J].食品与发酵科技,2022,58(1):136-139.
[33]杨牢记,徐敏锐,祝熙,等.浓香型酒醅发酵过程中主要酶系酶活变化规律研究[J].酿酒,2017,44(4):48-51.
[34]WANG X S,DU H,XU Y.Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J].Int J Food Microbiol,2017,224:27-35.
[35]胡峰,钟方达,胡建锋,等.酱香型白酒窖内不同层次酒醅微生物与酒体风格的研究[J].酿酒科技,2014(9):48-52.
[36]汪慧慧,高俊杰,李庆腾,等.浓香型酒醅发酵过程中真核微生物群落的研究[J].食品科技,2022,47(8):14-20.
[37]JIAO W J,XIE F,GAO L,et al.Identification of core microbiota in the fermented grains of a Chinese strong-flavor liquor from Sichuan[J].LWT-Food Sci Technol,2022,158:113140.
[38]方超,刘治国,乔潞,等.基于感官定量描述分析法和GC-MS对山庄老酒3种香型白酒挥发性特征风味的分析[J].食品科学,2023,44(10):291-299.
[39]张晓婕,邱树毅,王晓丹,等.白酒挥发性风味物质气相分析方法及研究进展[J].食品与发酵工业,2021,47(14):313-320.
[40]WANG S Q,CHEN H T,SUN B G.Recent progress in food flavor analysis using gas chromatography-ion mobility spectrometry(GC-IMS)[J].Food Chem,2020,315(C):126158.
[41]杜静怡,朱婷婷,黄明泉,等.清香型志都五谷酒关键香气成分分析[J].食品科学,2021,42(2):185-192.
[42]张萌,田真,魏建平,等.基于气相色谱-离子迁移谱法和固相微萃取-气相色谱-质谱法分析6种香型白酒挥发性风味物质[J].食品安全质量检测学报,2023,14(5):226-235.
[43]梁臣臣,沈小梅,张光耀,等.基于GC-MS的两种不同酿酒原料白酒挥发性成分差异分析[J].酿酒,2022,49(3):57-62.
[44]ZHOU Z H, LIU Z H, WEN S Y, et al.Rare short- and medium-chain fatty acid-producing anaerobes from raw soil play vital roles in formation of diverse flavour compounds of Jiangxiangxing Baijiu[J].Food Microbiol,2023,112:104247.
[45]占成,尹怀宁,徐洋辉,等.基于GC-IMS技术分析不同香型白酒挥发性成分差异[J].中国酿造,2023,42(3):241-245.
[46]李欢欢,余丽娜,雷婷,等.基于气相色谱-离子迁移谱分析石花白酒风味特征[J].中国酿造,2023,42(2):240-244.
[47]辛茜,朱瑞雪,韩海涛,等.LLME-GC-MS测定西凤酒中风味物质的方法研究[J].酿酒,2023,50(1):93-96.
[48]沈世明,梁明锋,张娇娇,等.酱香高温大曲风味轮的初步构建及其香气特征分析[J].食品与发酵工业,2023,49(1):73-78.
[49]杨建刚,苏畅,窦晓,等.泸型酒发酵过程中酵母菌演替规律及其对部分风味分子形成的影响[J].食品科学,2018,39(18):166-172.
[50]DU R B,WU Q,XU Y.Chinese liquor fermentation:Identification of key flavor-producing Lactobacillus spp.by quantitative profiling with indigenous internal standards[J].Appl Environ Microbiol,2020,86(12):e00456-20.
[51]WANG S L,WU Q,NIE Y,et al.Construction of synthetic microbiota for reproducible flavor compound metabolism in Chinese light-aromatype liquor produced by solid-state fermentation[J].Appl Environ Microbiol,2019,85(10):e03090-18.
[52]王晓程,徐友强,李秀婷,等.中国传统发酵食品来源典型小分子脂肪酸酯合成微生物及酶的研究进展[J].中国食品学报,2021,21(4):345-355.
[53]WU Y S,HOU Y X,CHEN H,et al."Key factor"for Baijiu quality:Research progress on acid substances in Baijiu[J].Foods, 2022, 11(19):2959.
[54]李俊辉,刘英杰,隋丽娜,等.浓香型白酒增加己酸乙酯降低乳酸乙酯的研究进展[J].中国酿造,2019,38(1):1-4.
[55]李慧星,姚涵译,许彬,等.浓香型白酒酒醅微生物与酯类成分关联性定量模型的建立[J].中国酿造,2022,41(7):51-57.
[56]李书婷,黄志久,吴正云,等.清香型白酒酿造中乳酸乙酯和乙酸乙酯合成代谢调控的研究进展[J].酿酒科技,2022(11):99-103.
[57]张志伟,聂士昊,汪俊卿,等.强化酒醅微生物对北方酱香型白酒风味影响的研究[J].酿酒科技,2022(8):24-29.
[58]ZHANG W,XIAO Y,DENG R J,et al.An electric-field instrument for accelerated aging to improve flavor of Chinese Baijiu[J].LWT-Food Sci Technol,2023,174:114446.
[59]XU Y Q, WU M Q, ZHAO D, et al.Simulated fermentation of strongflavor Baijiu through functional microbial combination to realize the stable synthesis of important flavor chemicals[J].Foods,2023,12(3):644.
[60]XU S S,ZHANG M Z,XU B Y,et al.Microbial communities and flavor formation in the fermentation of Chinese strong-flavor Baijiu produced from old and new Zaopei[J].Food Res Int,2022,156:111162.