作为白酒发酵过程中重要的发酵剂和糖化剂,大曲的制作过程在完全开放的环境中进行,经过生料制曲、自然接种、自然发酵而成[1],网罗空气、水、原料中的各种微生物。根据大曲品温不同,可分为高温、中温及低温大曲[2],分别用于酿造酱香、浓香、清香型白酒,其中中高温大曲又被称为浓香型大曲,是浓香型白酒中使用的发酵剂,其丰富的菌系、酶系和物系对白酒的风味和品质有着重要影响[3]。
大曲为白酒酿造提供了发酵所需的微生物,且这些微生物分泌的水解酶系[4],是白酒酿造过程中水解酶系的重要来源之一。其中,淀粉酶水解酶系可将原料中的淀粉转化为可发酵的糖类物质,为酵母菌的增殖和酒精发酵提供物质基础,影响着白酒出酒率及其品质[5]。大曲微生物中细菌最多,霉菌次之,酵母菌最少,同时,细菌所分泌的各种水解酶类组成的酶系也更加复杂多样,产生如多元醇、呋喃酮类、杂环化合物等丰富的代谢产物,这些产物作为白酒风味及其风味前体物质,对白酒风味的形成起着关键作用。
芽孢杆菌(Bacillus)不仅作为各类大曲中的优势细菌,更是生产淀粉酶的主要菌种之一[6],如贝莱斯芽孢杆菌(Bacillus velezensis)、地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)等。在以往研究中,芽孢杆菌(Bacillus)被证明具有强大的水解酶系统,尤其产α-淀粉酶能力突出[7],而这种能力使其在风味物质合成方面也具有较大潜力。白酒酿造中的高粱等原料含有丰富的淀粉和蛋白质类物质,淀粉经淀粉酶降解后的小分子糖类物质及蛋白质降解后的氨基酸类物质,可以为白酒中风味物质的合成提供前体物质[8]。在大曲发酵过程中,芽孢杆菌属(Bacillus)因其耐高温的特性,在发酵后期大量生长繁殖并得到富集,与风味物质的合成关系密切。陈蒙恩等[9]研究发现,在陶融型大曲中,芽孢杆菌属(Bacillus)与吡嗪类、芳香族类、酸类、酯类均呈现显著正相关性,是这些风味的主要产生菌。柳习月等[10]在高温大曲中研究表明,芽孢杆菌(Bacillus)与糖化酶、蛋白酶和四甲基吡嗪具有强的相关性,且这些酶可作为代谢途径的一部分,为微生物合成四甲基吡嗪提供驱动力,说明酶特性与风味物质的合成有密切关联,强化大曲实验的结果也证明了这一点。黄晓宁等[11]基于淀粉酶和蛋白酶活力筛选芽孢杆菌并用于强化大曲和白酒发酵,发现以醛酮酚为主的多种挥发性物质含量显著提高。因此,产淀粉酶芽孢杆菌对于大曲风味物质的贡献十分重要。
本研究从浓香型白酒大曲中分离筛选产α-淀粉酶菌株,对筛选菌株进行形态学观察及分子生物学鉴定,分析比较不同发酵温度及初始水分条件下筛选菌株的生长代谢特性,并进行风味物质差异和代谢通路富集分析,旨在揭示产α-淀粉酶芽孢杆菌对大曲风味的贡献以及受温度水分条件的影响情况,丰富产α-淀粉酶功能微生物资源库,为其在生产中的进一步利用提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
浓香型白酒大曲:四川某浓香型酒厂;小麦:市售。
1.1.2 化学试剂
蛋白胨、牛肉膏、琼脂粉、可溶性淀粉(均为生化试剂)、磷酸氢二钠、硫酸镁、氯化钠、无水碳酸钠、冰乙酸、酒石酸钾钠、亚甲蓝、氢氧化钠(均为分析纯):成都市科隆化学品有限公司;葡萄糖(分析纯):天津致远化学试剂有限公司;硫酸铜(分析纯):广东光华科技股份有限公司;乙酸戊酯(色谱纯):安捷伦科技(中国)有限公司。
1.1.3 培养基
富集培养基:可溶性淀粉10 g/L、硫酸铵2.5 g/L、硫酸镁0.2 g/L、KH2PO4 3 g/L、硫酸亚铁0.025 g/L、氯化钙0.25 g/L。
初筛培养基:蛋白胨10 g/L、牛肉膏5 g/L、可溶性淀粉10 g/L、NaCl 5 g/L、琼脂20 g/L。
复筛培养基:蛋白胨10 g/L、牛肉膏5 g/L、可溶性淀粉10 g/L、NaCl 5 g/L。
以上培养基均于121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
PR224ZH电子天平、ST2100pH计:奥豪斯仪器(常州)有限公司;DM500光学显微镜:德国徕卡公司;LYNX6000高速冷冻离心机:美国Thermo公司;ZWYR-D2403恒温培养振荡器:上海智城分析仪器制造有限公司;BSP-150生化培养箱:上海博讯医疗生物仪器股份有限公司;G154DS立式自动压力蒸汽灭菌锅:美国致徽公司;A390分光光度计:翱艺仪器(上海)有限公司;7890A/5975B气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS):美国Agilent公司;DVB/CAR/PDMS纤维萃取头:美国Supelco公司。
1.3 方法
1.3.1 产α-淀粉酶菌株筛选
富集培养:称取5 g浓香型白酒大曲粉于装液量为25 mL/250 mL富集培养基中,在37 ℃、150 r/min的条件下振荡培养48 h,得到富集液。
初筛:富集液在无菌条件下分别稀释为10-1~10-6的稀释梯度菌悬液,取不同梯度菌悬液100 μL涂布于初筛培养基上,置于37 ℃培养箱中静置培养48 h,选择长势良好且差异较大的菌株进行平板划线分离纯化,放置于37 ℃培养48 h。利用卢戈式碘液进行初筛,以细菌透明圈直径与菌落直径之比反映分解淀粉能力大小[12]。
复筛:选取细菌透明圈直径与菌落直径之比较大的菌落接种于复筛培养基斜面,37 ℃培养48 h,每管斜面加入10 mL灭菌生理盐水制成高浓度菌悬液。接种3 mL菌悬液至50 mL富集培养基中,37 ℃、150 r/min振荡培养72 h。培养结束后,将发酵液于5 000 r/min条件下离心5 min,取5 mL上清液作为粗酶液,测定α-淀粉酶活力[13]。
1.3.2 菌株鉴定
形态学观察:将菌株接种至固体培养基中,37 ℃培养24 h,观察其菌落形态,包括颜色、形状、透明度、表面状态、质地、边缘状况等[11]。革兰氏染色后,在显微镜下观察菌株细胞形态特征[14]。
分子生物学鉴定:使用TSINGKE植物脱氧核糖核苷酸(deoxyribonucleic acid,DNA)提取试剂盒(通用型)对目标菌株DNA进行提取,利用细菌通用引物27F(5'-GAGAGTTTGATCCTGGCTCAG-3')、1492R(5'-TACGGCTACCTTGTTACGAC-3')进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系为:45 μL 1×TSE101金牌mix、2 μL 27F(10 pmol/μL)、2 μL1492R(10 pmol/μL)、1 μL DNA模板。PCR扩增程序为:98 ℃预变性3 min,39次循环(98 ℃变性10 s、55 ℃退火15 s、72 ℃延伸15 s),72 ℃延伸5 min,4 ℃结束。PCR产物委托北京擎科生物科技股份有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对与分析,根据序列同源性,选取模式菌株的16S rRNA基因序列,采用MEGA 11.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.3 筛选菌株固态发酵实验
称取小麦500 g,加7%~8%的水润粮2 h左右,再粉碎至烂皮不烂心。装入浅瓷盘中,用8层纱布封盖,包裹牛皮纸进行灭菌(121 ℃高压蒸汽灭菌20 min)。将筛选菌株固体斜面每管加入9 mL灭菌生理盐水制备成菌悬液,以10%接种量进行小麦单菌固态发酵,作为实验组。固定初始水分含量为40%,分别设置不同发酵温度(40 ℃、45 ℃、50 ℃、55 ℃);固定发酵温度45 ℃,分别设置不同初始水分含量(30%、35%、40%、45%)发酵4 d[15],每隔24 h取样测定芽孢杆菌数量、α-淀粉酶活力及挥发性风味物质。空白组为不接种菌悬液的未发酵小麦。
1.3.4 分析检测
(1)芽孢杆菌数量测定参考张裕民[16]方法,利用比浊法测定芽孢杆菌数量。测定固态发酵过程中的菌液浓度时需用空白组发酵醅去除淀粉对吸光度值的影响,若菌液浓度过高,则需先稀释到线性范围内使用标曲计算生物量,再根据稀释倍数计算原始菌液浓度。
(2)α-淀粉酶活力测定
α-淀粉酶活参考XIAO Z Z等[17]方法测定。α-淀粉酶活力单位的定义:1 g样品(或1 mL酶液)在55 ℃,pH5.0,每分钟消耗1 mg可溶性淀粉所需酶量(U/g)。
(3)水分含量测定
水分含量测定参照轻工行业标准QB/T 4257—2011《酿酒大曲通用分析方法》。
(4)挥发性风味物质测定
采用顶空固相微萃取-气相色谱-质谱联用(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)法测定挥发性风味物质含量。
样品前处理:将4 g样品与10 mL生理盐水(1%氯化钙)混合,4 ℃浸泡过夜,130 W超声30 min后,4 ℃、10 000×g条件下离心20 min,过滤上清液。取5 mL上清液加入20 μL内标混合物(乙酸戊酯,最终质量浓度0.105 12 g/mL)及1.5 g氯化钠加入20 mL顶空玻璃瓶中。在50 ℃条件下平衡5 min,然后50 ℃吸附45 min。GC-MS进样口250 ℃条件下解吸附5 min,进行GC-MS分析鉴定。
GC条件:Agilent 122-7062 DB-WAX色谱柱(60 m×25 μm×0.25 μm),用高纯氦气(He)作为载气,恒流速为1.0 mL/min。升温程序为初始温度在45 ℃保持3 min,然后以4 ℃/min提高到150 ℃,保持2 min,以6 ℃/min提高到200 ℃,最后以10 ℃/min提高到230 ℃,保持10 min。采用不分流进样模式。
MS条件:电子电离(electronic ionization,EI)源,电子能量70 eV,离子源温度230 ℃,扫描范围35~400 amu[18]。
定性定量方法:使用GC-MS软件鉴定未知物质,结合美国国家标准与技术研究所(National Insititute of Standards and Technology,NIST)标准质谱库比对,筛选匹配因子>85的鉴定结果。采用内标法定量,挥发性风味物质含量计算公式如下:
1.3.5 数据处理
运用SPSS27.0中独立样本t检验进行显著性差异分析,结果用字母标注法表示,数据间凡有一个相同标记字母的即为差异不显著,具不同标记字母的即为差异显著。小写字母表示差异显著(P<0.05)。折线图和堆叠柱状图使用GraphPad Prism 9.5.0绘制。韦恩图和花瓣韦恩图在CNSknowall云平台上(https://cnsknowall.com/)绘制。挥发性风味物质聚类分析热图使用欧易云平台(https://cloud.oebiotech.com/)绘制。采用组间差异分析采用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)评估样品中风味成分的显著性差异[19],结果用线性判别分析效应大小表示(LDA>2,P<0.05)。使用Metaboanalyst6.0通过京都基因与基因组百科全书(Kyotoencyclopedia ofgenes and genomes,KEGG)对差异挥发性风味物质进行通路富集(https://www.metaboanalyst.ca/)。
2 结果与分析
2.1 浓香型白酒大曲中产α-淀粉酶细菌的分离鉴定
综合初筛复筛结果,从15株初筛菌株中筛选得到一株产α-淀粉酶活力最高的菌株L-3,其α-淀粉酶活力为80.16U/mL。对菌株L-3进行形态学观察,结果见图1。

图1 菌株L-3菌落(a)及细胞(b)形态特征
Fig.1 Morphological characteristics of colony (a) and cell (b) of strain L-3
由图1a可知,菌落呈乳白色,圆形,不透明,表面皱褶,有凸起,湿润,粘稠,易挑起,边缘粗糙且不规则。由图1b可知,菌株L-3细胞形态小(1.5~3.5 μm),呈杆状,革兰氏染色结果阳性。
基于16S rRNA基因序列构建菌株L-3系统发育进化树,结果见图2。由图2可知,菌株L-3与贝莱斯芽孢杆菌(Bacillus velezensis)同属一个分支,亲缘关系最近,结合形态学观察,菌株L-3被鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。

图2 基于16S rRNA基因序列菌株L-3的系统发育树
Fig.2 Phylogenetic tree of strain L-3 based on 16S rRNA gene sequences
2.2 发酵温度、初始水分含量对菌株L-3生长及产α-淀粉酶活性的影响
发酵温度、初始水分含量对菌株L-3生长及产α-淀粉酶活性的影响结果见图3。由图3a可知,在发酵温度为40 ℃时菌株L-3生长良好,菌数随发酵时间延长而增长,发酵4 d时菌数最多,达到1.078×1011 CFU/g。而在发酵温度为45 ℃和50 ℃时,菌数上升较缓且数量较少。在发酵温度55 ℃条件下菌数L-3几乎不增长,可能是温度过高抑制了菌体的生长,这与田瑞杰[13]研究结果相一致。由图3b可知,发酵0~1 d时,菌数随发酵时间延长而迅速增多,且初始水分含量越高菌数越多;发酵1~4 d时,初始水分含量45%时,菌数随发酵时间趋于平稳且略有下降,其他初始水分含量条件下菌数均随发酵时间而略有增长。初始水分含量40%条件下发酵4 d时菌数最多,达到4.340 1×1010 CFU/g。由图3c可知,除发酵温度55 ℃条件外,发酵0~1 d时,酶活随发酵时间而快速上升;发酵2~4 d时,发酵温度50 ℃条件下,酶活随发酵时间持续升高,发酵4 d时酶活最高,达到(128.636±1.187 1)U/g。发酵温度40 ℃和45 ℃条件下,酶活随发酵时间基本保持稳定且略有下降。发酵温度条件55 ℃下,α-淀粉酶活性一直较低,可能是温度过高导致菌数少且酶活受到抑制。由图3d可知,发酵0~1 d时,酶活随发酵时间而增加;发酵时间2~4 d时,初始水分含量40%和30%趋于平缓,且初始水分含量30%条件下酶活最低,而初始水分含量35%和45%条件下,酶活随发酵时间而上升,且初始水分含量35%条件下发酵4 d时酶活最高,可达(125.386 9±1.632 4)U/g。
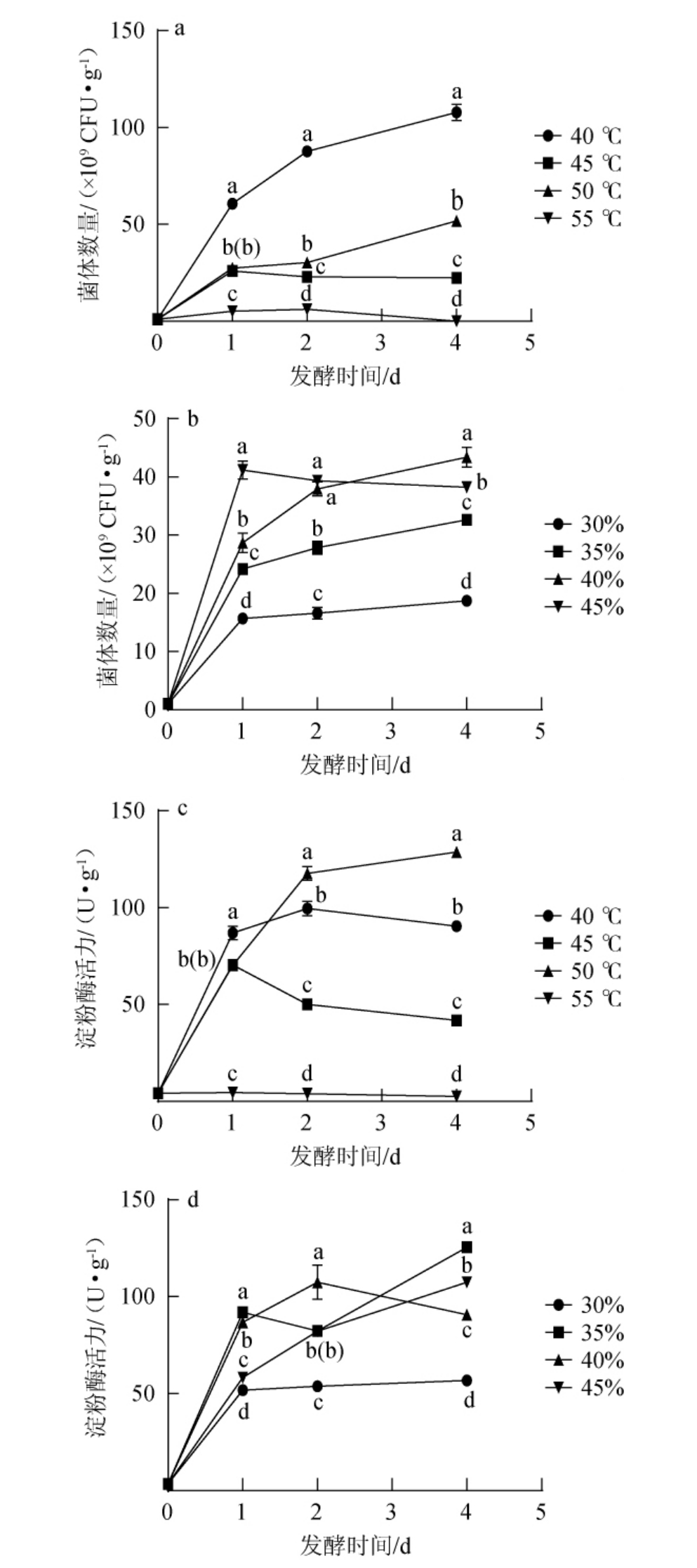
图3 不同发酵温度、初始水分含量对菌株L-3生长及α-淀粉酶活力的影响Fig.3 Effects of different fermentation temperature and initial moisture contents on growth and α-amylase activity of strain L-3
综上,在初始水分含量40%、发酵温度40 ℃条件下最适合菌株L-3生长,发酵4 d时菌数最多,达到1.078×1011CFU/g。初始水分含量40%、发酵温度50 ℃条件下淀粉酶活力最高,发酵4 d时可达(128.636±1.187 1)U/g。
2.3 菌株L-3对挥发性风味物质合成的影响
固定初始水分含量为40%,分别设置不同发酵温度(40 ℃、45 ℃、50 ℃、55 ℃);固定发酵温度45 ℃,分别设置不同初始水分含量(30%、35%、40%、45%)发酵4 d作为实验组。不接种菌悬液的未发酵小麦作为空白组。空白组与实验组中挥发性风味物质含量HS-SPME-GC-MS测定结果见图4。由图4a可知,两组共检测到61种挥发性风味物质,包括14种醇类、9种酯类、1种酸类、37种其他类。实验组中共检出60种挥发性风味物质,包括13种醇类、9种酯类、1种酸类、37种其他类;空白组中共检出19种挥发性风味物质,包括6种醇类、3种酯类、0种酸类、10种其他类。由图4b可知,空白组与实验组中共有挥发性风味物质18种,空白组中独有挥发性风味物质1种,实验组中独有挥发性风味物质42种。
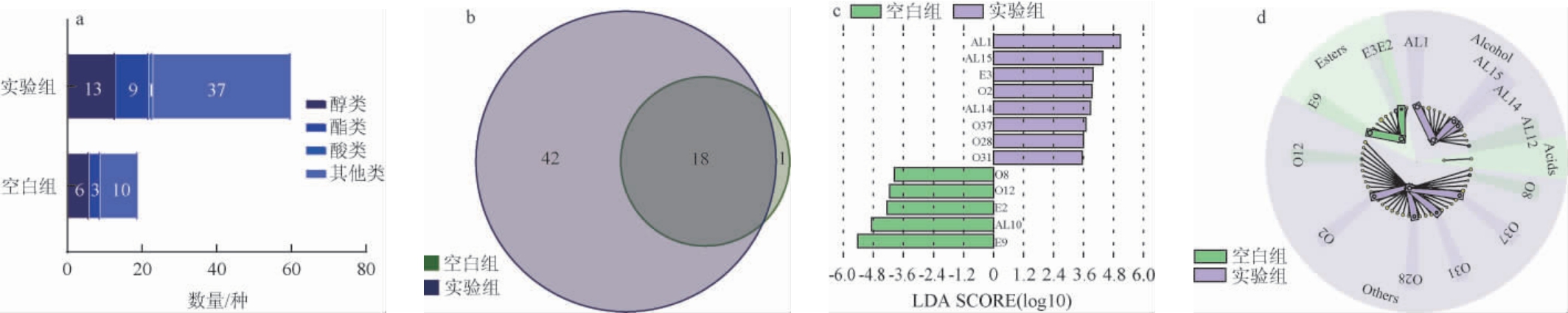
图4 空白组与实验组发酵过程中挥发性风味物质测定结果
Fig.4 Determination results of volatile flavor substances during fermentation in blank group and experimental group
AL1:乙醇;AL10:正己醇;AL14:苯乙醇;AL15:正戊醇;E2:硅酸四乙酯;E3:己酸乙酯;E9:乙酸庚酯;O2:愈创木酚;O8:正己醛;O12:糠醛;O28:苯酚;O31:2,6-二甲基吡嗪;O37:2,5-二甲基吡嗪。
采用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)评估样品中风味成分的显著性差异。由图4c可知,较未发酵小麦(空白组)而言,发酵过程中有显著差异的挥发性风味物质(LDA>2,P<0.05)有8种。由图4d可知,主要集中在醇类和其他类,其中包括乙醇、正戊醇、愈创木酚、苯乙醇、2,5-二甲基吡嗪、2,6-二甲基吡嗪、苯酚、己酸乙酯等。苯乙醇具有独特的芳香特征,可以赋予酒体玫瑰花香、茉莉花香[20];2,5-二甲基吡嗪、2,6-二甲基吡嗪具有浓厚的烘烤气味,增加白酒的香气深度和复杂度[21];己酸乙酯主要由己酸和乙醇通过酯化反应形成,有强烈的菠萝样果香,可平衡四大酯的关系[22]。说明贝莱斯芽孢杆菌进行固态发酵时主要合成醇类、芳香类化学物,在增加烘焙香、花果香等方面起到重要作用,与前人研究基本符合[23-25]。
2.4 发酵温度、初始水分含量对菌株L-3挥发性风味物质合成的影响
发酵温度、初始水分含量对菌株L-3挥发性风味物质合成的影响结果见图5。
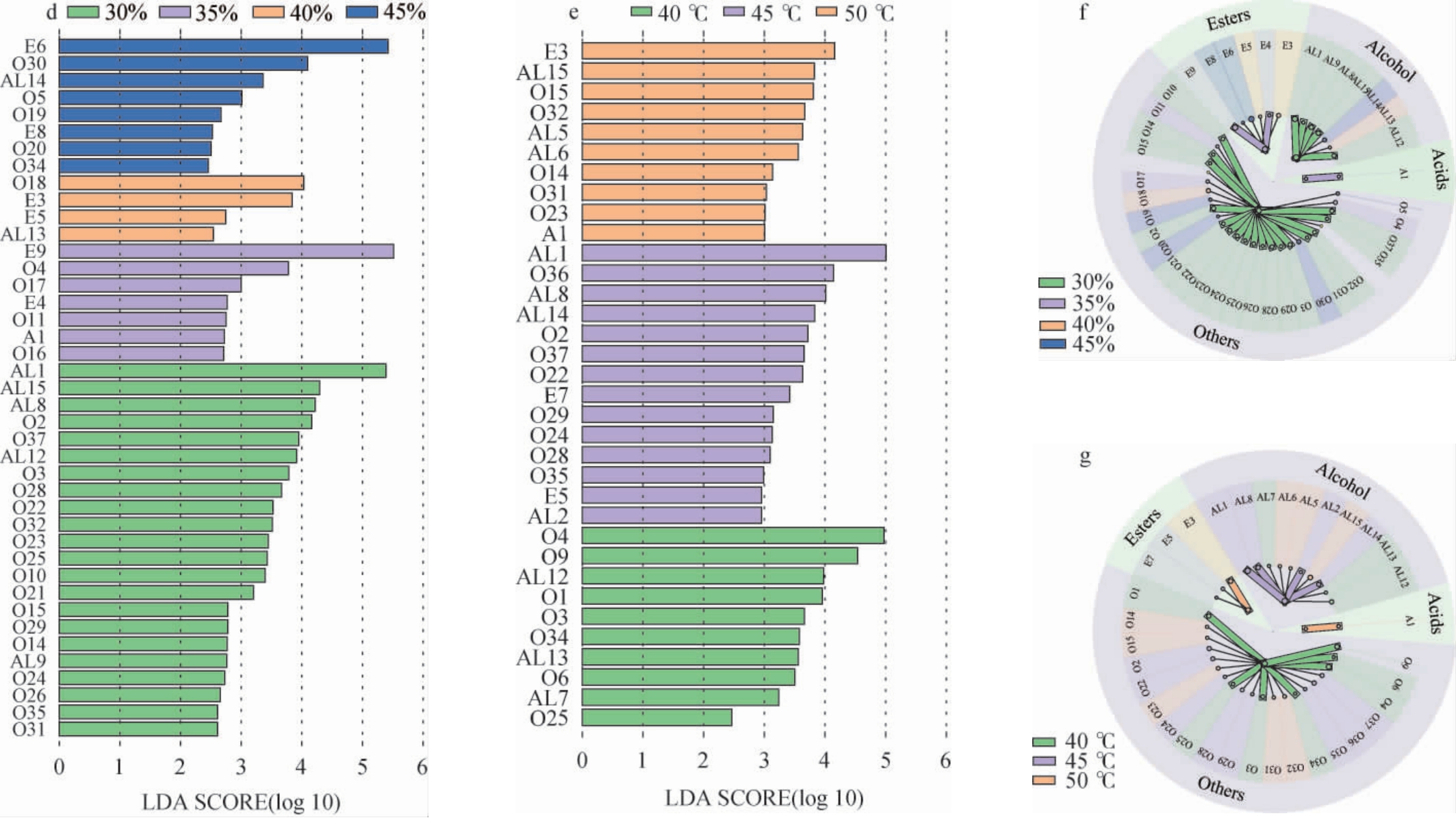
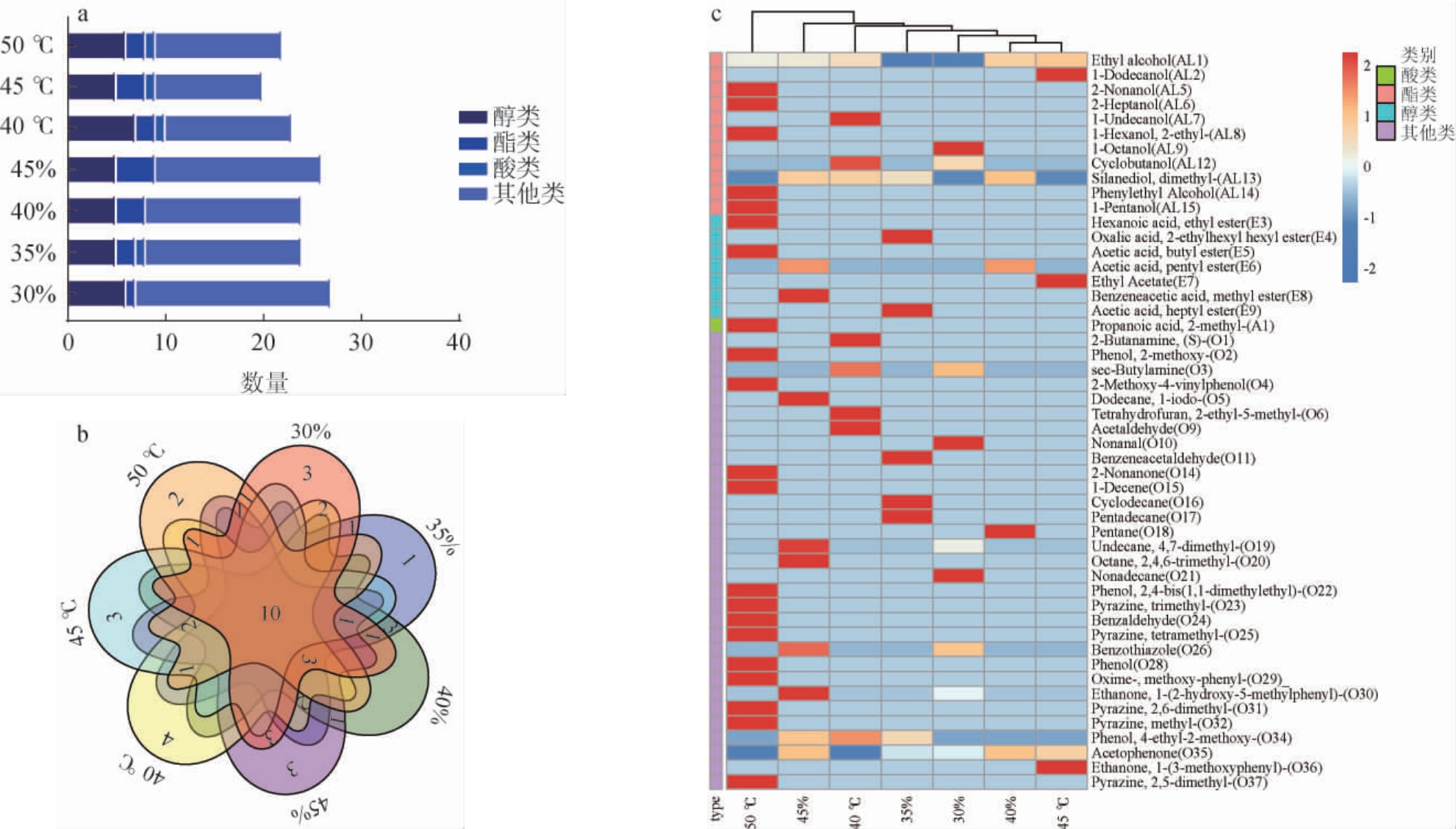
图5 不同发酵温度及初始水分含量对菌株L-3挥发性风味物质合成情况
Fig.5 Effects of different fermentation temperature and initial moisture contents on synthesis of volatile flavor substances of strain L-3
a:各类别挥发性风味物质数量;b:各类别挥发性风味物质韦恩图;c:挥发性风味物质聚类分析;d:不同初始水分含量条件挥发性风味物质差异分析;e:不同发酵温度条件挥发性风味物质差异分析;f:不同初始水分含量条件下挥发性风味物质差异分析分组情况;g:不同发酵温度条件下挥发性风味物质差异分析分组情况。
由图5a可知,不同发酵条件下检测到各类别挥发性风味物质数量差距不大,其中初始水分含量30%和45%、发酵温度40 ℃和50 ℃条件下各类别挥发性风味物质数量稍高。由图5b可知,10种挥发性风味物质是7个不同发酵条件组中共有,16种为不同发酵条件组中特有,主要为酯类、醇类以及其他,而初始水分含量45%条件下无特有挥发性风味物质。由图5c可知,图中从红到蓝色,颜色越深代表含量越高,颜色越浅代表含量越低。各类物质的合成主要集中在初始水分含量45%及发酵温度50 ℃条件下,特别是酸类物质只在50 ℃下显著增加,而较水分含量(30%、35%、40%)和较低温度(40 ℃、45 ℃)条件下只有少数醇类、酯类和其他类物质合成显著增多。由图5d可知,不同初始水分含量条件下有显著差异(LDA>2,P<0.05)的挥发性风味物质共有41种,分别在30%有22种,35%7种,40%4种,45%8种。由图5e可知,不同温度条件下有显著差异的挥发性风味物质(LDA>2,P<0.05)共有34种,分别在40 ℃有10种,45 ℃14种,50 ℃10种。由图5f可知,酸类物质只在初始水分含量35%条件下有显著差异,其他类物质在初始水分含量条件下均有显著差异,在初始水分含量30%下差异挥发性风味物质最多,而在初始水分含量40%下差异最少。由图5g可知,醇类物质和其他类物质在三个温度条件下均有显著差异,酸类物质只在50 ℃下有显著差异。
综上,不同发酵条件对菌株L-3合成挥发性风味物质的种类和含量发挥不同影响,初始水分含量40%和发酵温度50 ℃条件下,更有利于挥发性风味物质的合成,种类和含量较其他条件下均有所增加。其中,不同发酵温度条件对酸类和其他类物质的合成影响较大,不同初始水分含量条件对醇类、酸类和其他类物质的合成影响较大。
2.5 发酵温度、初始水分含量对Bacillusvelezensis L-3代谢功能的影响
发酵温度、初始水分含量对Bacillusvelezensis L-3代谢功能的影响结果见图6。
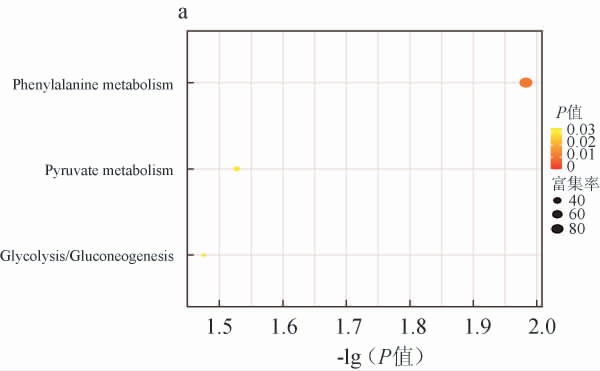
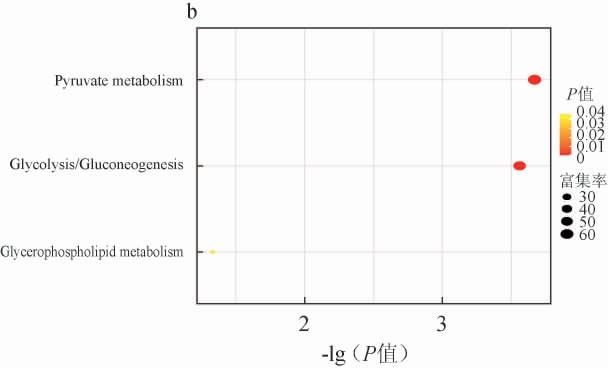
图6 不同发酵温度(a)及初始水分含量(b)条件下差异风味物质的京都基因与基因组百科全书富集分析结果
Fig.6 Kyoto Encyclopedia of Genes and Genomes enrichment analysis results of differential flavor substances under different fermentation temperature (a) and initial moisture contents (b) conditions
由图6a可知,不同初始水分含量条件下有3条代谢通路显著富集(P<0.05),包括苯丙氨酸代谢、丙酮酸代谢、糖酵解/糖异生过程。由图6b可知,不同发酵温度条件下有3条代谢通路显著富集(P<0.05),包括丙酮酸代谢、糖酵解/糖异生、甘油磷脂代谢过程。其中,最适合菌株L-3生长的初始水分含量40%、发酵温度40 ℃条件下显著富集的通路为甘油磷脂代谢,乙醛的合成与通向丙酮酸代谢和糖异生的转化在甘油磷脂代谢中进行,该通路的显著富集可能与乙醛在该温度下的大量合成有关。
3 结论
本研究从浓香型大曲中分离筛选得到一株产α-淀粉酶菌株L-3,经鉴定其为贝莱斯芽孢杆菌(Bacillus velezensis)。分别设置不同发酵温度和初始水分含量梯度,将该菌接种于小麦固体培养基进行单菌发酵4 d,动态追踪该菌株的生长和固态发酵特性。研究结果表明,初始水分含量40%、发酵温度40 ℃条件下最适合菌株L-3生长,发酵4 d时菌数最多,达到1.078×1011CFU/g;初始水分含量40%、发酵温度50 ℃条件下淀粉酶活力最高,发酵4 d时可达(128.636±1.187 1)U/g,更有利于挥发性风味物质的合成。基于差异风味物质通路富集结果,最适合菌株L-3生长的初始水分含量40%、发酵温度40 ℃条件下甘油磷脂代谢通路显著富集(P<0.05),乙醛的合成与通向丙酮酸代谢和糖异生的转化在此通路中进行,其显著富集可能与乙醛在该温度下的大量合成有关。
本研究主要探讨了更适宜Bacillus velezensis L-3生长代谢的初始水分含量及发酵温度,并进一步对差异风味物质进行KEGG富集分析,探究不同发酵条件对代谢通路的影响。该菌株来源于浓香型大曲,对白酒发酵环境适应较好,在小麦固态培养基中研究也更贴近实际应用环境,研究结果可为后续组装微生物群落并应用于生产提供实际价值。
[1]ZHENG X W,MINOO R T,M.J.R N,et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[2]周天慈,孙佳,朱雨婕,等.中高温大曲制作过程中火圈真菌菌群演替规律及其风味功能[J].微生物学通报,2021,48(11):4178-4189.
[3]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Tech,2017,63(2):18-28.
[4]LING Y X,LI W Y,TONG T,et al.Assessing the microbial communities in four different Daqus by using PCR-DGGE,PLFA and biolog analyses[J].Pol J Microbiol,2020,69(4):27-37.
[5]马晓梅.白酒窖泥中淀粉酶产生菌的筛选及产酶条件优化[D].哈尔滨:黑龙江大学,2015.
[6]陈绍依,郎莹,邱树毅,等.茅台镇不同区域酱香大曲微生物群落结构及生产性能对比[J].食品科学,2023,44(14):134-143.
[7]唐萍,代飞燕,吴毅歆,等.贝莱斯芽孢杆菌DJB5的生物安全性评价[J].南方农业学报,2019,50(12):2720-2727.
[8]高艳侠,张德锋,可小丽,等.罗非鱼源无乳链球菌肠道拮抗芽孢杆菌的筛选及其生物学特性[J].微生物学报,2019,59(5):926-938.
[9]陈蒙恩,侯建光,张振科,等.陶融型大曲微生物多样性与挥发性风味成分的相关性研究[J].中国酿造,2020,39(10):54-60.
[10]柳习月,朱琪,杨帆,等.多组学解析酱香型大曲风味物质的形成[J].食品与发酵工业,2021,47(22):35-41.
[11]黄晓宁,刘晶晶,韩北忠,等.基于酶学特性筛选大曲来源芽孢杆菌用于强化酿酒[J].食品科学,2021,42(10):218-224.
[12]胡晓龙,冯大鸿,田瑞杰,等.中温大曲产淀粉酶菌株的筛选鉴定及培养条件优化[J].中国酿造,2023,42(1):78-85.
[13]田瑞杰.中温大曲原核微生物群落解析及高产淀粉酶菌株的筛选与应用探究[D].郑州:郑州轻工业大学,2022.
[14]张志豪.枯草芽孢杆菌BY7在水体中的增殖规律及其与水质调控的关系研究[D].泰安:山东农业大学,2022.
[15]时伟,张熙琳,郑红梅,等.混菌固态发酵清香型白酒糟制备蛋白饲料的研究[J].饲料研究,2024,47(4):79-84.
[16]张裕民.可见分光光度法对3种细菌计数的研究[J].中国药事,2015(10):1066-1068.
[17]XIAO Z Z, REGINALD S, ADRIAN T.A quantitative starch-iodine method for measuring alpha-amylase and glucoamylase activities[J].Anal Biochem,2006,351(1):146-148.
[18]YANG L, FAN W L, XU Y.GC×GC-TOF/MS and UPLC-Q-TOF/MS based untargeted metabolomics coupled with physicochemical properties to reveal the characteristics of different type daqus for making soy sauce aroma and flavor type Baijiu[J].LWT-Food Sci Technol,2021,146(7):111416.
[19]GAO L, XIE F, REN X, et al.Correlation between microbial diversity and flavor metabolism in Huangshui:A by-product of solid-state fermentation Baijiu[J].LWT-Food Sci Technol,2023,181(4):114767.
[20]刘树文.合成香料技术手册[M].北京:中国轻工业出版社,2000:89-90.
[21]曹艳丽,张丽杰,徐岩.以L-苏氨酸为发酵底物的2,5-二甲基吡嗪高产菌株构建[J].食品与发酵工业,2020,46(1):1-10.
[22]WANG J B,LIU Z W,WANG X,et al.Optimizing Baijiu fermentation with high-yield ethyl caproate-producing Candida parapsilosis strain[J].LWT-Food Sci Technol,2024,203(6):116347.
[23]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities: A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121(3):422-432.
[24]ZHANG P P,LIU Y B, LI H D, et al.Bioturbation effect of high-yield pyrazine strain on the microbial community and flavour metabolites of fortified Daqu[J].LWT-Food Sci Technol,2024,208(9):116711.
[25]HE G Q,DONG Y,HUANG J,et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT-Food Sci Technol,2019,111(4):1-8.