浓香型白酒以泥窖为发酵容器[1],泥窖对浓香型白酒的产量、质量尤为重要,泥窖连续使用时间越长,其基酒产量、质量越好[2],在新建窖时会考虑窖形、窖容,根据生产需要和最大限度利用窖体表面积进行设计[3],彭盼等[4-5]研究认为,窖池比表面积越大,单位体积糟醅与窖泥接触更充分,利于窖泥微生物利用糟醅养分进行代谢,利于糟醅发酵产酯、提高酒质。酿酒微生物群落与基酒风味之间必定存在联系,微生物代谢是白酒中原料向风味物质转化的内在驱动力[6],白酒的风味与酿造过程中微生物代谢产生的风味物质密切相关[7]。目前研究较多的是糟醅微生物群落、大曲微生物群落、窖泥微生物群落同其代谢产物的相关性。张明珠[8]以不同年份窖泥及发酵过程糟醅为研究对象,揭示了白酒发酵过程中窖泥和糟醅特色风味物质形成与微生物之间的相互作用关系。XU Y Q等[9]系统分析了酱酒前三轮生产过程中微生物和风味物质的动态组成,并分析了它们之间的相关性,提出了具有代表性的关键风味物质的微生物代谢机制。焦文婧[10]从浓香型白酒发酵糟醅中的核心微生物入手,揭示发酵剂大曲以及发酵糟醅中与乙酸及乙酸乙酯形成相关的微生物菌群。宋建阳等[11]以浓香型白酒连续发酵的酒醅样品为研究对象,结果表明,与主要风味物质相关的8个菌属为嗜热霉菌属(Thermomyces)、卡斯泰利诺莫夫氏酵母(Nau-movozyma)、酵母属(Saccharomyces)、乳杆菌属(Lactobacillus)、醋酸杆菌(Acetobacte)、梭状芽孢杆菌属(Clostridium)、假丝酵母属(Candida)和曲霉属(Aspergillus)。陈让芳等[12]研究浓香型白酒窖泥中原核微生物群落对挥发性风味物质的影响,结果表明,14个细菌属与23种挥发性风味物质存在显著相关关系(P<0.05),2个古菌属与11种挥发性风味物质呈显著相关(P<0.05)。王清龙等[13]探究大曲、小曲、混合曲微生物与理化指标、挥发性风味物质之间的相关性,结果表明,理化指标、挥发性风味物质与部分微生物存在一定的相关性。少有将不同比表面积窖池糟醅微生物群落与对应窖池所酿造的基酒风味进行相关性分析的报道。
本研究以机械化生产模式下的浓香型白酒不同比表面积窖池作为研究对象,系统地研究不同比表面积窖池糟醅微生物群落与基酒风味之间的关系,通过高通量测序检测不同比表面积窖池糟醅微生物群落结构,顶空固相微萃取-气质联用(headspace solid phase microextraction-gas chromatography-mass spectrography,HS-SPME-GC-MS)技术检测不同比表面积窖池酿造的基酒挥发性风味物质,结合理化指标及感官品评,探讨不同比表面积窖池糟醅微生物群落、基酒理化特性、感官评分及风味差异,并对结果进行偏最小二乘-判别分析(partial least squares-discriminant analysis,PLS-DA)、聚类分析(clustering analysis,CA)及相关性分析。旨在探究不同比表面积窖池对发酵糟醅微生物群落结构及其基酒品质的影响,利用相关性分析解析它们之间的联系,以期为今后窖池科学合理地建造提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
研究所用糟醅、基酒样品均取自四川泸州某酒厂同一排生产发酵,选取同一个车间内使用年限相同且正常发酵的3种不同比表面积的窖池各2口,共6口。比表面积(即单位糟醅与窖泥的接触面)计算公式如下:
式中:A为单位糟醅比表面积,m2/m3;M为窖体总表面积,m2;V为窖体总容积,m3。
按比表面积大小将窖池分为A、B、C三类(且A>B>C),记为窖A1,A2,B1,B2,C1,C2。生产发酵前后,参考文献[14]设计取样点位,每口窖池除去窖面糟醅后,分为上、中、下三层取样,如图1,每层选取五个点位,并将三层糟醅混匀,再用四分法缩分得到综合样品,且每口窖池取三个平行糟样,记为ZPCA1_1,ZPCA1_2,ZPCA1_3,ZPCA2_1,…,ZPCC2_2,ZPCC2_3。在上甑、配料工艺参数一致的条件下,按上、中、下三层糟醅分层摘酒取样,每个糟层摘取一甑二、三段基酒混合酒样,再将三个糟层酒样混合作为研究酒样,且每口窖池取三个平行酒样,记为YJCA1_1,YJCA1_2,YJCA1_3,YJCA2_1,…,YJCC2_2,YJCC2_3。
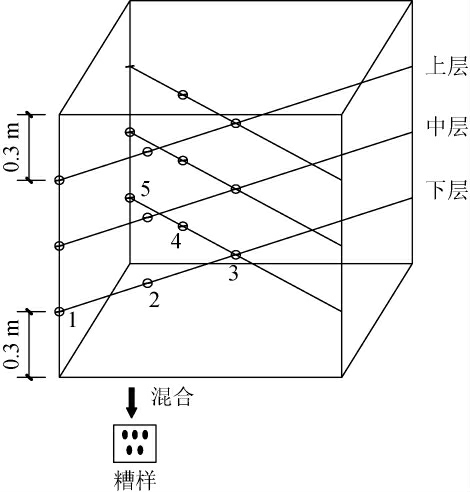
图1 糟醅取样示意图
Fig.1 Sampling diagram of fermented grains
1.1.2 化学试剂
氯化钠(NaCl),氢氧化钠(NaOH),盐酸(HCI),硫酸(H2SO4)(均为分析纯):国药集团化学试剂有限公司;2-辛醇(色谱纯):上海安谱璀世标准技术服务有限公司;E.Z.N.A.R Soil DNA Kit脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:美国Omega Bio-Tek公司;FastPfu聚合酶:北京全式金生物技术有限公司;NanoDrop2000超微量分光光度计:美国Thermo Scientific公司。
1.2 仪器与设备
GC-MS-QP2020气相色谱-质谱联用仪:日本岛津制作所;PAL RTC全自动前处理进样平台:广州智达实验室科技有限公司;DVB/Carbon WR/PDMS-120 μm萃取头:广州智达实验室科技有限公司;HP-INNOWAX毛细管色谱柱(60 m×0.25 mm×0.25 μm):美国安捷伦科技有限公司;T100 Thermal Cycler 聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;JY600C电泳仪:北京君意东方电泳设备有限公司;Illumina Nextseq2500高通量测序由上海美吉生物医药科技有限公司完成。
1.3 方法
1.3.1 糟醅、基酒理化检测
糟醅发酵过程温度变化用车间专用2.0 m测温仪测量;糟醅酸度、淀粉、水分与基酒总酸、总酯、酒精度检测均参考《泸型酒技艺大全》[15]中的方法。
1.3.2 感官品评
由专业品酒师通过白酒明酒明评法对酒样进行评定,总分100分,评分标准参考《泸型酒技艺大全》[15]。
1.3.3 HS-SPME-GC-MS检测基酒挥发性风味物质
基酒挥发性风味物质采用HS-SPME-GC-MS技术检测[16-19]。
样品预处理:称量2.0 g氯化钠加入20 mL顶空瓶中,再分别吸取4.0 mL超纯水和1.0 mL酒样,再加入内标2-辛醇(质量浓度为0.822 g/L)10 μL,加盖密封后进行顶空固相微萃取。采用自动进样,加热振荡器设置温度为60 ℃,振摇速度450 r/min,平衡时间5 min,萃取头顶空吸附45 min,萃取完成热解吸5 min,进行GC-MS检测分析。
GC条件:HP-INNOWAX毛细管色谱柱(60 m×0.25 mm×0.25 μm),载气采用高纯氦气(He)(纯度>99.999%),采用恒线速度模式和不分流进样模式,柱流量1.0 mL/min,进样口250 ℃,升温程序为40 ℃保持5 min,以4 ℃/min 升至100 ℃,再以6 ℃/min 升温至230 ℃,保持10 min。
MS条件:电子电离(electronic ionization,EI)源,离子源温度230 ℃,接口温度250 ℃,电子能量70 eV,质量扫描范围40.00~500.00 m/z。
定性定量分析:以保留时间及保留指数为定性依据,通过美国国家标准技术研究所(National Institute of Standards and Technology,NIST)20谱库检索选取匹配度>80%的化合物。采用内标进行半定量分析,利用各化合物峰面积与内标物质峰面积之比,计算出各挥发性风味物质的含量。
1.3.4 糟醅微生物群落结构多样性分析
(1)DNA提取及PCR扩增
用于微生物多样性检测的糟醅放-80 ℃保存[20],根据E.Z.N.A.R soil DNA kit说明书对糟醅总DNA抽提,使用1%的琼脂糖凝胶电泳检测抽提的基因组DNA的质量,并测定DNA浓度和纯度。分别以细菌引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA基因V3-V4可变区进行PCR扩增,真菌引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')对ITS1区进行PCR扩增[21-22]。PCR扩增程序:95 ℃预变性3 min,30个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),然后72 ℃稳定延伸10 min。PCR扩增体系(20 μL):10 μL 2×Pro Taq,0.8 μL Forward Primer(5 μmol/L),0.8 μL Reverse Primer(5 μmol/L),10 ng/μL DNA模板,补超纯H2O至20 μL。PCR产物用质量分数为2%琼脂糖凝胶电泳检测,将检测合格的PCR产物用于后续高通量测序分析。
(2)Illumina Miseq高通量测序及物种注释
Illumina Miseq测序由上海美吉生物医药科技有限公司完成,使用fastp(https://github.com/OpenGene/fastp,version 0.19.6)软件对双端原始测序序列进行质控,使用FLASH(http://www.cbcb.umd.edu/software/flash,version 1.2.11)软件进行拼接得到优化序列,使用序列降噪方法DADA2处理[23]优化序列,获得ASV(Amplicon Sequence Variant)代表序列及丰度表,基于物种注释数据库为silva138/16s_bacteria和unite9.0/its_fungi和物种注释方法为classify-sklearn(Naive Bayes)进行后续可视化分析。
1.3.5 相关性分析
基于美吉生信云平台,将筛选出的基酒19种重要差异风味物质的数据导入云平台环境因子板块,在云平台相关性分析板块设置参数,相关性系数选择Spearson,选择物种相对丰度前50的细菌属、真菌属进行相关性分析,结果由相关性Heatmap图展示。
1.3.6 数据处理
利用IBM SPSS Statistics 20对理化数据进行单因素方差分析(ANOVA)[24];采用SIMCA 14.1对基酒挥发性风味物质进行PLS-DA[25]分析,计算预测变量投影重要性(variable importance in projection,VIP)值,VIP值反映风味物质对模型分类的贡献程度,将VIP值>1作为筛选关键差异风味物质的标准;Origin 2021绘制柱状图、TBtools[26]绘制聚类热图。
2 结果与分析
2.1 不同比表面积窖池糟醅理化指标差异
不同比表面积窖池入、出窖糟醅理化指标测定结果见表1。由表1可知,糟醅入窖酸度在1.34~1.62 mmoL/10 g范围内;出窖酸度在2.00~2.54 mmoL/10 g范围内;生酸(出窖糟醅酸度与入窖糟醅酸度的差值)幅度在0.61~1.05 mmoL/10 g之间。糟醅入窖淀粉含量在18.58%~19.80%范围内,出窖淀粉含量在8.94%~9.95%范围内,淀粉消耗量在8.86%~10.85%范围内。糟醅入窖水分含量为55.54%~56.88%,糟醅出窖水分含量为61.29%~62.75%。结果表明,不同比表面积窖池糟醅理化指标均在正常范围内,不同比表面积窖池发酵情况正常但存在一定差异。
表1 不同比表面积窖池出、入窖糟醅理化指标测定结果
Table 1 Determination results of physicochemical indexes of loading and unloading fermented grains from different specific surface areas pits
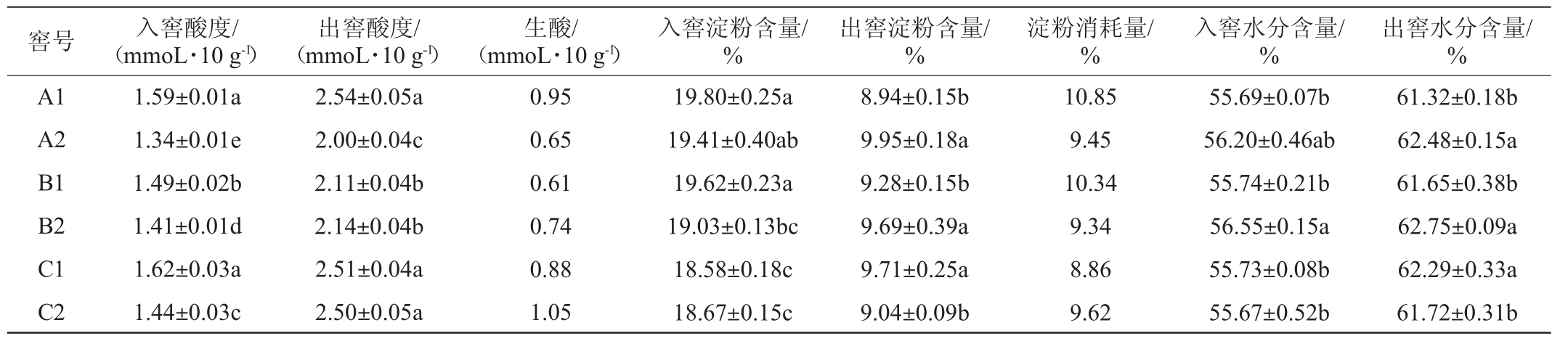
注:不同小写字母表示差异显著(P<0.05)。下同。
窖号 入窖酸度/(mmoL·10 g-1)出窖酸度/(mmoL·10 g-1)生酸/(mmoL·10 g-1)入窖淀粉含量/%出窖淀粉含量/%淀粉消耗量/%入窖水分含量/%出窖水分含量/%A1 A2 B1 B2 C1 C2 1.59±0.01a 1.34±0.01e 1.49±0.02b 1.41±0.01d 1.62±0.03a 1.44±0.03c 2.54±0.05a 2.00±0.04c 2.11±0.04b 2.14±0.04b 2.51±0.04a 2.50±0.05a 0.95 0.65 0.61 0.74 0.88 1.05 19.80±0.25a 19.41±0.40ab 19.62±0.23a 19.03±0.13bc 18.58±0.18c 18.67±0.15c 8.94±0.15b 9.95±0.18a 9.28±0.15b 9.69±0.39a 9.71±0.25a 9.04±0.09b 10.85 9.45 10.34 9.34 8.86 9.62 55.69±0.07b 56.20±0.46ab 55.74±0.21b 56.55±0.15a 55.73±0.08b 55.67±0.52b 61.32±0.18b 62.48±0.15a 61.65±0.38b 62.75±0.09a 62.29±0.33a 61.72±0.31b
2.2 不同比表面积窖池基酒理化指标分析
糟醅发酵过程温度变化曲线与对应窖池所产基酒总酸、总酯、酒精度等理化指标测定结果见图2。由图2A可知,6口窖池温度变化均符合传统浓香型白酒发酵过程“前缓,中挺,后缓落”的变化规律,但不同比表面积窖池温度变化也存在差异。由图2B可知,不同比表面积窖池基酒总酸在0.51~0.64 g/L范围内,由图2C可知,不同比表面积窖池基酒总酯含量为2.81~3.60 g/L,不同比表面积窖池总酸、总酯均在正常范围内,差异可能是不同比表面积窖池发酵情况不同造成的,由图2D可知,不同比表面积窖池基酒酒精度为65.2%vol~68.4%vol,酒精度差异可能与摘酒操作有一定关联。结果表明,不同比表面积窖池基酒总酸、总酯含量,酒精度均存在明显差异,且规律不明显,说明不同比表面积窖池发酵正常但存在一定差异。
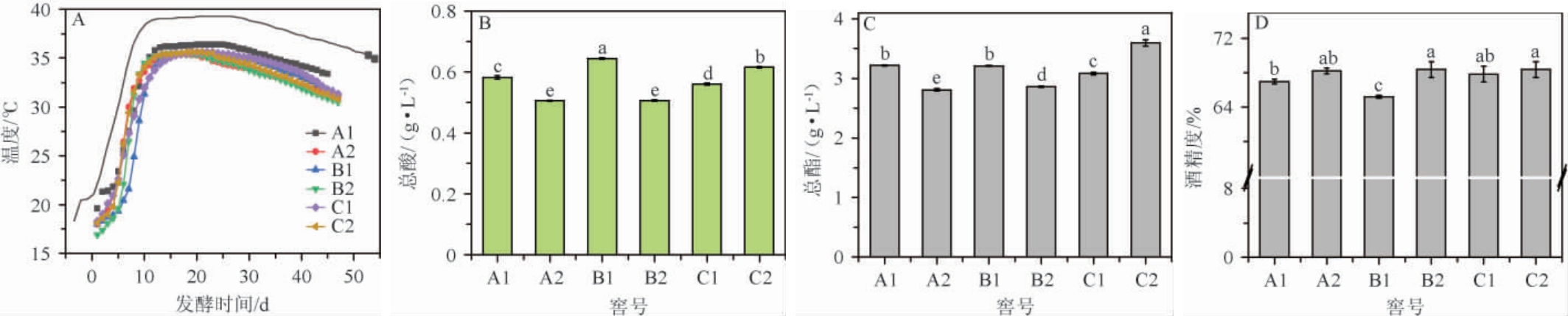
图2 不同比表面积窖池温度(A)、基酒总酸(B)、总酯(C)、酒精度(D)变化
Fig.2 Changes of temperature (A), total acid (B), total ester (C), alcohol content (D) of base liquor from different specific surface areas pits
小写字母表示差异显著(P<0.05)。
2.3 不同比表面积窖池基酒感官评价
对不同比表面积窖池所产基酒进行感官品评,结果见表2。由表2可知,不同窖池基酒感官评分存在显著差异(P<0.05),A类窖池基酒感官评分为85.50分、86.33分,B类窖池基酒感官评分为87.83分、88.67分,C类窖池基酒感官评分为83.47分、84.17分。结果表明,比表面积较大的A、B类窖池基酒口感稍好,感官评分略高,应建造比表面积较大的窖池用于生产发酵。
表2 不同比表面积窖池基酒感官评分
Table 2 Sensory score of base liquor from different specific surface areas pits
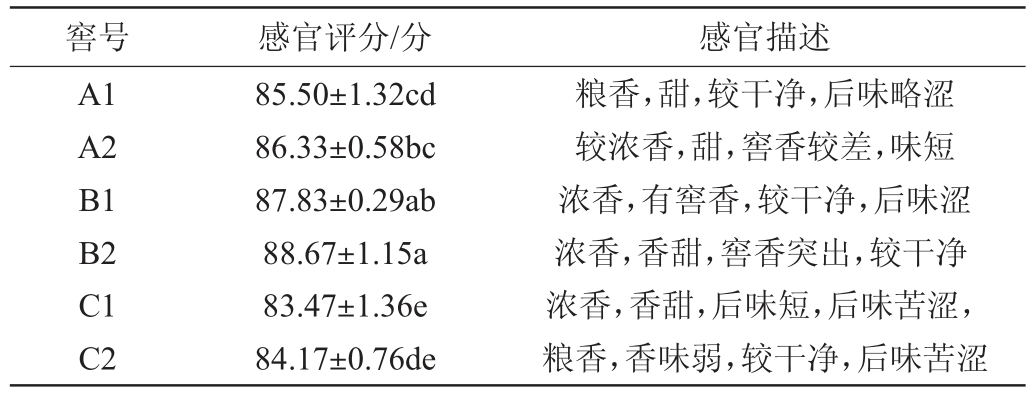
窖号 感官评分/分 感官描述A1 A2 B1 B2 C1 C2 85.50±1.32cd 86.33±0.58bc 87.83±0.29ab 88.67±1.15a 83.47±1.36e 84.17±0.76de粮香,甜,较干净,后味略涩较浓香,甜,窖香较差,味短浓香,有窖香,较干净,后味涩浓香,香甜,窖香突出,较干净浓香,香甜,后味短,后味苦涩,粮香,香味弱,较干净,后味苦涩
2.4 不同比表面积窖池基酒风味物质差异性分析
不同比表面积窖池的基酒中共检出了98种挥发性代谢物,包括酯类62种、醇类9种、酸类2种、醛类4种、酮类6种和其他类15种。为了进一步分析不同比表面积窖池基酒之间酒体风味结构的差异,使用偏最小二乘-判别分析(PLS-DA)建立模型基酒筛选不同比表面积窖池差异挥发性风味物质(VIP>1),并对其进行聚类分析,结果分别见图3和图4。由图3A可知,三类窖池基酒风味物质存在差异,能较好的区分开,B类窖池的基酒全都分布在t1轴左侧,A、C两类窖池基酒分别位于t1轴右侧第一象限与第四象限,风味特征相似的酒体散点相对聚集,反之则相对离散,A类窖池聚集性较好,C类次之,B类窖池较分散,表明B类两口窖池基酒酒体结构之间也存在一定的差异,可能是发酵情况不一样,其微生物群落结构也存在一定差异。通过200次置换检验评估判别模型是否拟合,由图3B可知,置换检验的变量解释能力R2<0.4,预测能力Q2<0,说明模型合理,不存在过拟合现象,模型预测能力良好,该模型可用于对不同比表面积窖池基酒酒样进行分析。一般认为VIP值>1是重要的差异风味物质,VIP值越大,表明该物质在组间的差异性越大。由图3C可知,共筛选出19种不同比表面积窖池基酒的差异挥发性风味物质(VIP>1),分别为己酸乙酯(VIP=4.62)、辛酸乙酯(VIP=3.53)、8-甲基壬酸乙酯(VIP=2.46)、乳酸乙酯(VIP=2.36)、L-乳酸乙酯(VIP=2.09)、丁酸乙酯(VIP=2.00)、棕榈酸乙酯(VIP=1.92)、庚酸乙酯(VIP=1.84)、己酸己酯(VIP=1.69)、戊酸乙酯(VIP=1.66)、乙酸乙酯(VIP=1.42)、辛酸异戊酯(VIP=1.305)、异戊醇(VIP=1.303)、己酸戊酯(VIP=1.29)、月桂酸乙酯(VIP=1.24)、9-十五碳烯酸乙酯(VIP=1.12)、2-甲基辛酸丁酯(VIP=1.08)、壬酸乙酯(VIP=1.06)、己酸异戊酯(VIP=1.05),其中差异性酯类18种,XU Y Q等[6]综述了浓香型白酒具有显著风味贡献的酯类物质以及其气味活性值(odor activity value,OAV)与香气稀释因子(flavor dilution factor,FD),对照知本次筛选出的己酸乙酯、辛酸乙酯、丁酸乙酯、戊酸乙酯等对浓香型白酒特征风味有显著贡献,醇类只有1种为异戊醇,异戊醇是酒中最重要的醇,其低浓度时有水果和花香[27]。说明不同比表面积窖池所产基酒差异主要集中在重要酯类的合成以及高级醇的产生。
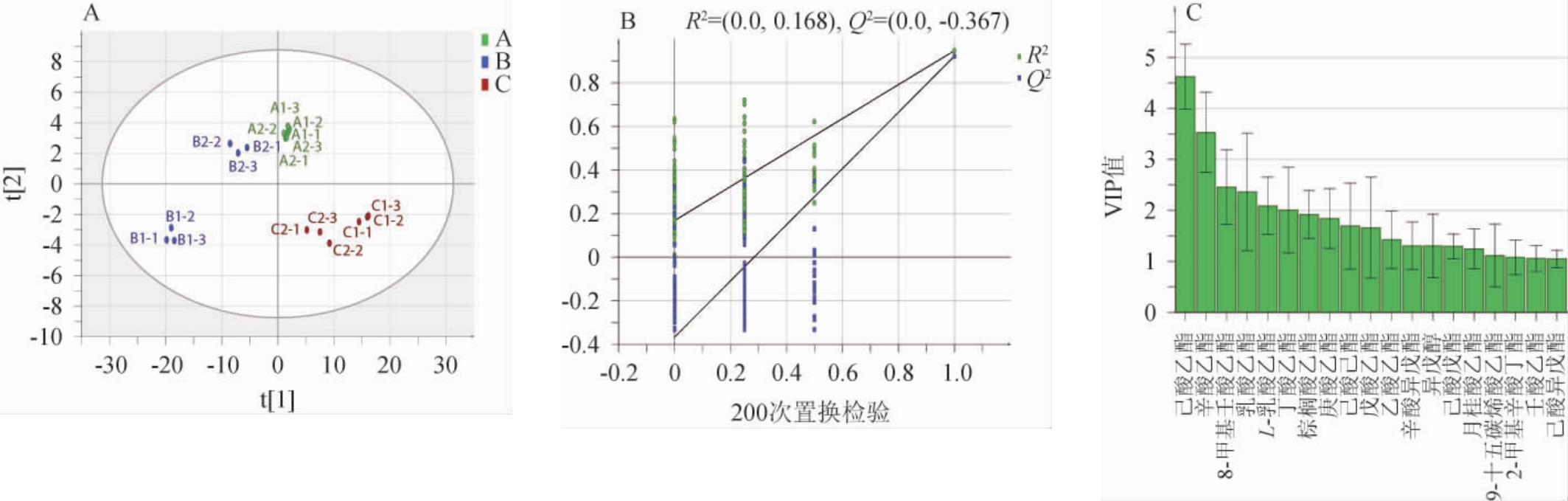
图3 不同比表面积窖池基酒偏最小二乘-判别分析(A)、置换检验结果(B)及差异挥发性风味物质变量投影重要性值(C)
Fig.3 Partial least squares-discriminant analysis (A), results of permutation test (B) and differential volatile flavor substances variable importance in projection value (C) of base liquor from different specific surface areas pits
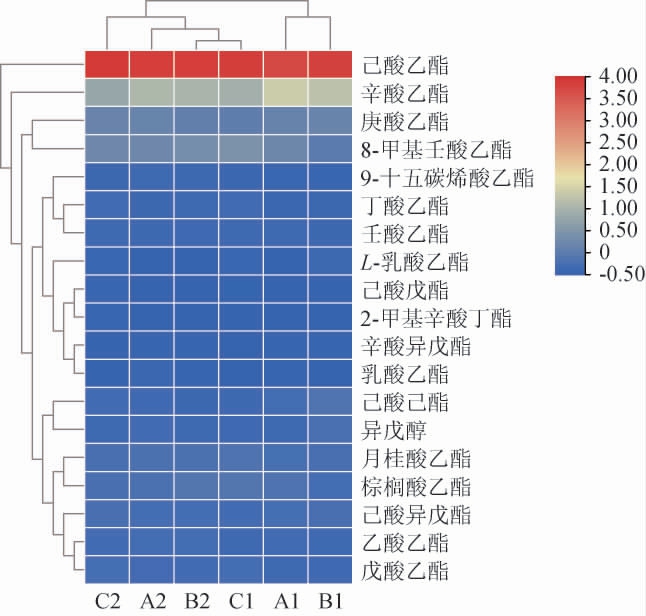
图4 不同比表面积窖池基酒中差异挥发性风味物质聚类分析结果
Fig.4 Clustering analysis results of differential volatile flavor substances in base liquor from different specific surface areas pits
将19种VIP值>1的差异挥发性风味物质含量导入TBtools标准化后绘制聚类分析热图,结果见图4。
由图4可知,六口窖池的基酒中均是浓香型主体酯类物质己酸乙酯含量最高,其中B1,B2窖池基酒己酸乙酯含量最高,A1,A2次之,C1,C2最少,且其他17种VIP值>1的酯类物质含量总和也符合这个规律,说明窖池比表面积越大,己酸乙酯以及其他VIP值>1的酯类总含量越高,可能是因为窖池比表面积大,更利于窖泥微生物与糟醅接触,微生物代谢活动更加旺盛,利于糟醅发酵产生重要的风味物质。该结论与表2基酒感官评分结果相一致,与文献[28]中越靠近窖泥点位的发酵糟醅产酯含量越高有相似之处。
2.5 不同比表面积窖池出窖糟醅微生物群落特征差异分析
2.5.1 群落多样性差异
通过高通量测序技术检测不同比表面积窖池出窖糟醅微生物群落结构,Alpha多样性指数见表3。由表3可知,发酵结束时,根据反映糟醅微生物群落的丰富度指数Chao1指数,B类窖池细菌丰富度均大于A类、C类窖池,A类、C类窖池真菌丰富度均大于B类窖池,根据多样性指数Shannon指数,B类、A类窖池细菌多样性也均大于C类窖池,C类窖池真菌多样性均大于B类、A类窖池。在比表面积大的A、B类窖池中,细菌丰富度大于真菌丰富度,细菌多样性小于真菌多样性,在比表面积小的C类窖池中,细菌丰富度小于真菌丰富度,细菌多样性小于真菌多样性。不同比表面积窖池出窖糟醅样品的群落覆盖度Coverage指数均为100%,说明测序结果能覆盖糟醅中的微生物群落,具有较好的代表性,能真实反映糟醅微生物的多样性与丰富度。根据群落均匀度Pielou_e指数,不同比表面积窖池出窖糟醅的细菌、真菌均匀度相差不大,但相同窖池真菌均匀度大于细菌均匀度。
表3 糟醅微生物群落Alpha多样性指数
Table 3 Alpha diversity indexes of microbial community in fermented grains

样品编号ZPCA_1 ZPCA_2 ZPCB_1 ZPCB_2 ZPCC_1 ZPCC_2 Chao1指数细菌Shannon指数细菌Coverage/%细菌真菌 真菌 真菌Pielou_e指数细菌 真菌227.91 196.49 277.12 304.71 84.89 80.84 108.01 124.50 99.00 100.91 237.38 116.70 1.62 1.75 2.01 2.00 1.44 1.44 2.27 2.67 2.24 2.40 3.41 2.68 100 100 100 100 100 100 100 100 10 100 100 100 0.32 0.37 0.38 0.37 0.35 0.37 0.48 0.55 0.49 0.52 0.62 0.56
2.5.2 微生物群落结构和组成差异
不同比表面积窖池出窖糟醅细菌、真菌属水平群落结构见图5。
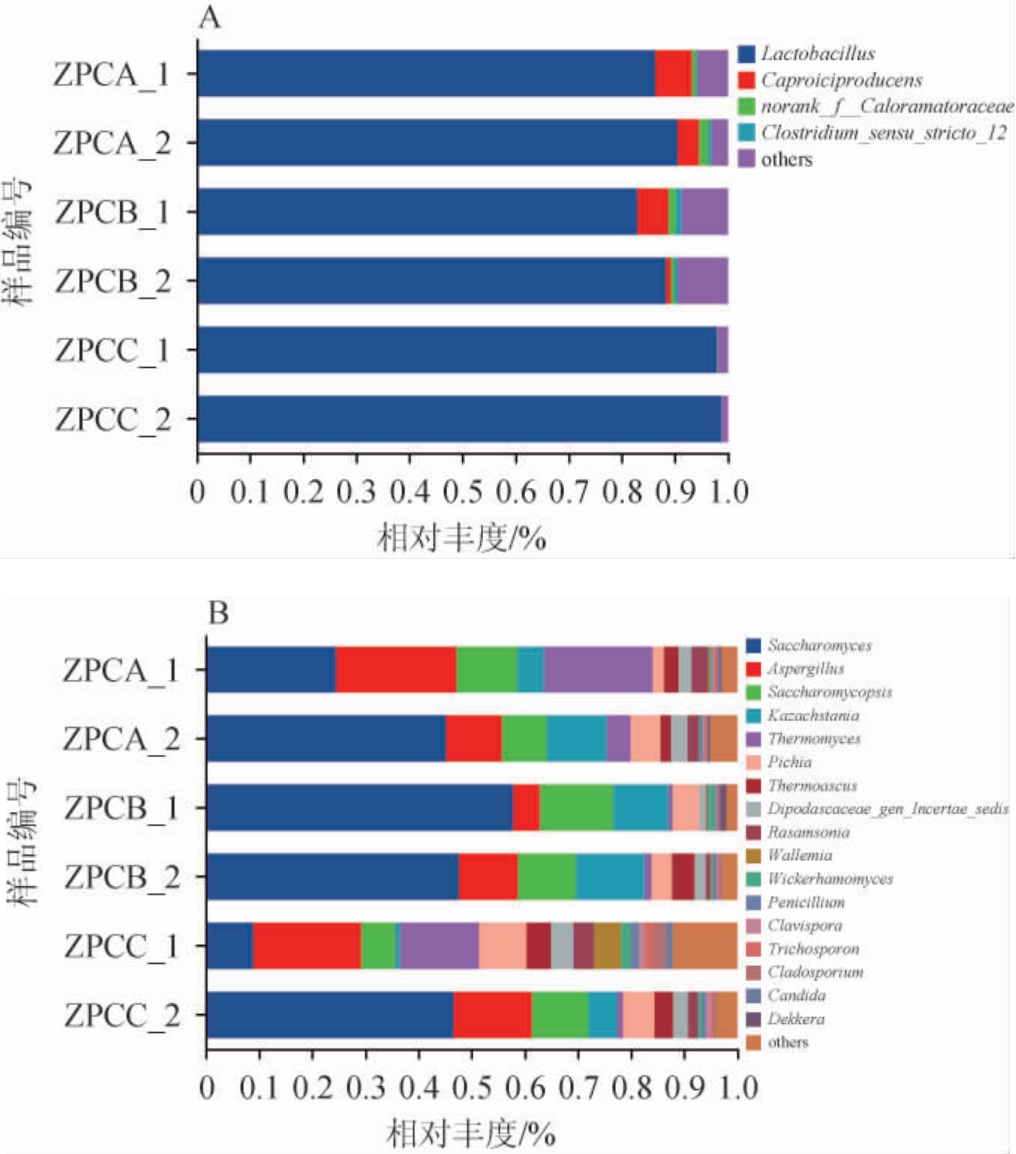
图5 不同比表面积窖池糟醅细菌(A)、真菌(B)属水平群落结构
Fig.5 Bacterial (A) and fungal (B) community structure at genus level of fermented grains from different specific surface areas pits
由图5A可知,糟醅中的优势细菌属(相对丰度≥1%)有4种,分别是乳杆菌属(Lactobacillus),己酸菌属(Caproiciproducens),norank_f__Caloramatoraceae,梭菌属(Clostridium_sensu_stricto_12),其中Lactobacillus占据主导地位(仅B1中相对丰度≥82.90%),norank_f__Caloramatoraceae是一种未分类的厌氧菌属,根据文献[29]报道,经溯源分析表明,发酵糟醅中92%的细菌、19%的真菌来自窖泥,相对丰度第2、第4的Caproiciproducens[30]、Clostridium_sensu_stricto_12[31]来自窖泥。结果表明,在比表面积大的窖池的出窖糟中丰度越高,表明窖池比表面积越大,越利于窖泥微生物与糟醅接触并进行物质能量交换,提高了功能细菌的丰度并降低了Lactobacillus的丰度,与毛凤娇等[32]报道一致。由图5B可知,糟醅中的优势真菌属(相对丰度≥1%)有17种,分别为酵母属(Saccharomyces)、曲霉属(Aspergillus)、复膜孢酵母属(Saccharomycopsis)、哈萨克斯坦酵母属(Kazachstania)、嗜热霉菌属(Thermomyces)、毕赤酵母属(Pichia)、热子囊菌属(Thermoascus)、Dipodascaceae_gen_Incertae_sedis、埃默森氏菌属(Rasamsonia)、节担菌属(Wallemia)、威克汉姆酵母属(Wickerhamomyces)、青霉属(Penicillium)、棒孢酵母属(Clavispora)、丝孢酵母属(Trichosporon)、枝孢霉属(Cladosporium)、假丝酵母属(Candida)、德克酵母属(Dekkera)。
为比较不同比表面积糟醅细菌差异,采用多组比较分析中的Kruskal-Wallis秩和检验及单因素方差分析,结果见图6。
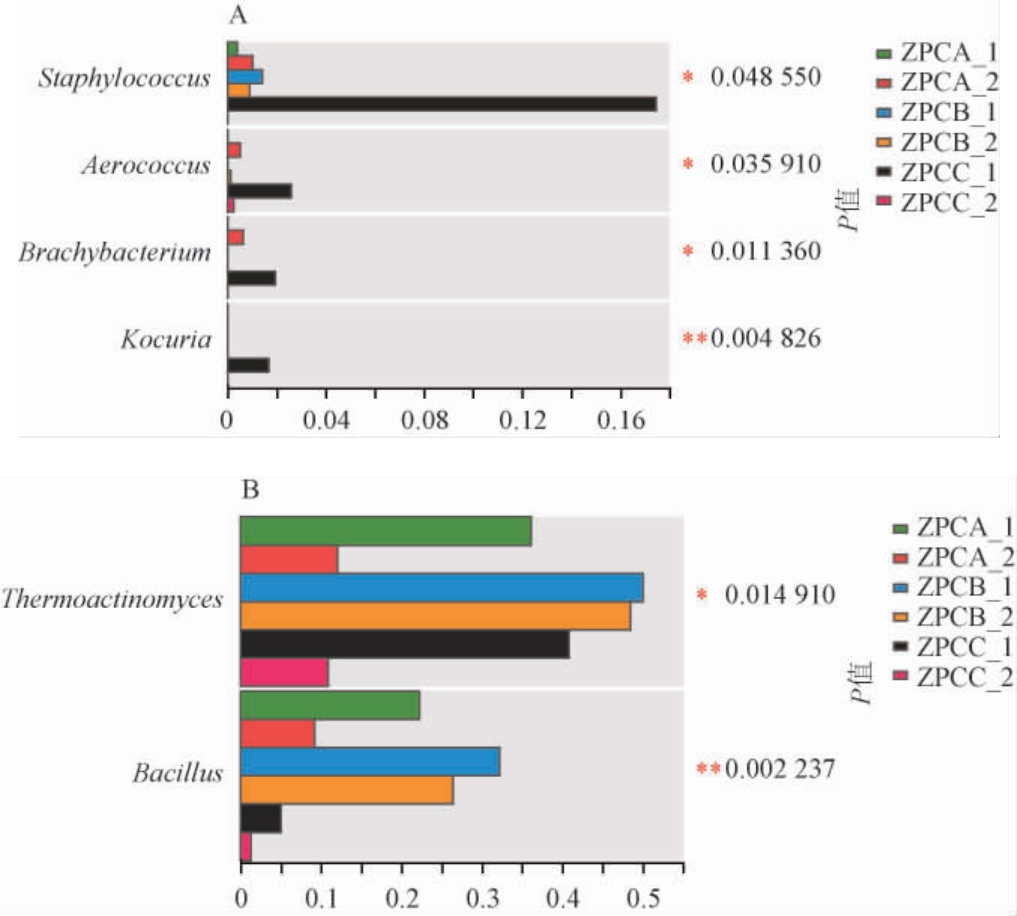
图6 不同比表面积窖池糟醅细菌属Kruskal-Wallis秩和检验(A)及单因素方差分析(B)
Fig.6 Kruskal-Wallis test (A) and one-way analysis of variance (B)for bacteria at genus level of fermented grains from different specific surface areas pits
由6A可知,采用Kruskal-Wallis秩和检验,只检验出4种显著差异菌属(P<0.05),分别为葡萄球菌属(Staphylococcus)、气球菌属(Aerococcus)、短状杆菌属(Brachybacterium)、考克氏菌属(Kocuria);由图6B可知,采用单因素方差分析,只有高温放线菌属(Thermoactinomyces)、芽孢杆菌属(Bacillus)2种显著差异菌属(P<0.05)。以上6种差异细菌属相对丰度均<1%,均不是优势细菌属。
为比较不同比表面积糟醅真菌差异,采用多组比较分析中的Kruskal-Wallis秩和检验及单因素方差分析,结果见图7。由图7A可知,通过Kruskal-Wallis秩和检验,选择具有显著差异且相对丰度前20的真菌属(P<0.05),其中前9种差异菌属为酵母属(Saccharomyces)、曲霉属(Aspergillus)、哈萨克斯坦酵母属(Kazachstania)、热子囊菌属(Thermoascus)、埃默森氏菌属(Rasamsonia)、节担菌属(Wallemia)、青霉属(Penicillium)、枝孢霉属(Cladosporium)、德克酵母属(Dekkera)为优势真菌属(相对丰度>1%),后11种差异菌属为镰刀菌属(Fusarium)、头束霉属(Cephalotrichum)、枝顶孢属(Acremonium)、接合酵母属(Zygosaccharomyces)、德巴利酵母属(Debaryomyces)、晋宁斯塔莫酵母(Starmerella)、Leiothecium、单端孢霉属(Trichothecium)、周刺座霉属(VoLutella)、Knufia、红酵母属(Rhodotorula)均不是优势菌属(相对丰度<1%);由图7B可知,通过单因素方差分析,得到具有显著差异的真菌属共14种(P<0.05),其中前10种差异菌属为酵母属(Saccharomyces)、曲霉属(Aspergillus)、哈萨克斯坦酵母属(Kazachstania)、热子囊菌属(Thermoascus)、埃默森氏菌属(Rasamsonia)、节担菌属(Wallemia)、威克汉姆酵母属(Wickerhamomyces)、青霉属(Penicillium)、枝孢霉属(Cladosporium)、假丝酵母属(Candida)为优势真菌属(相对丰度>1%),后4种头束霉属(Cephalotrichum)、交链孢属(Alternaria)、德巴利酵母属(Debaryomyces)、帚霉属(Scopulariopsis)不均是优势菌属(相对丰度<1%)。两种分析方法共得到具有显著差异的优势真菌11种(P<0.05)。
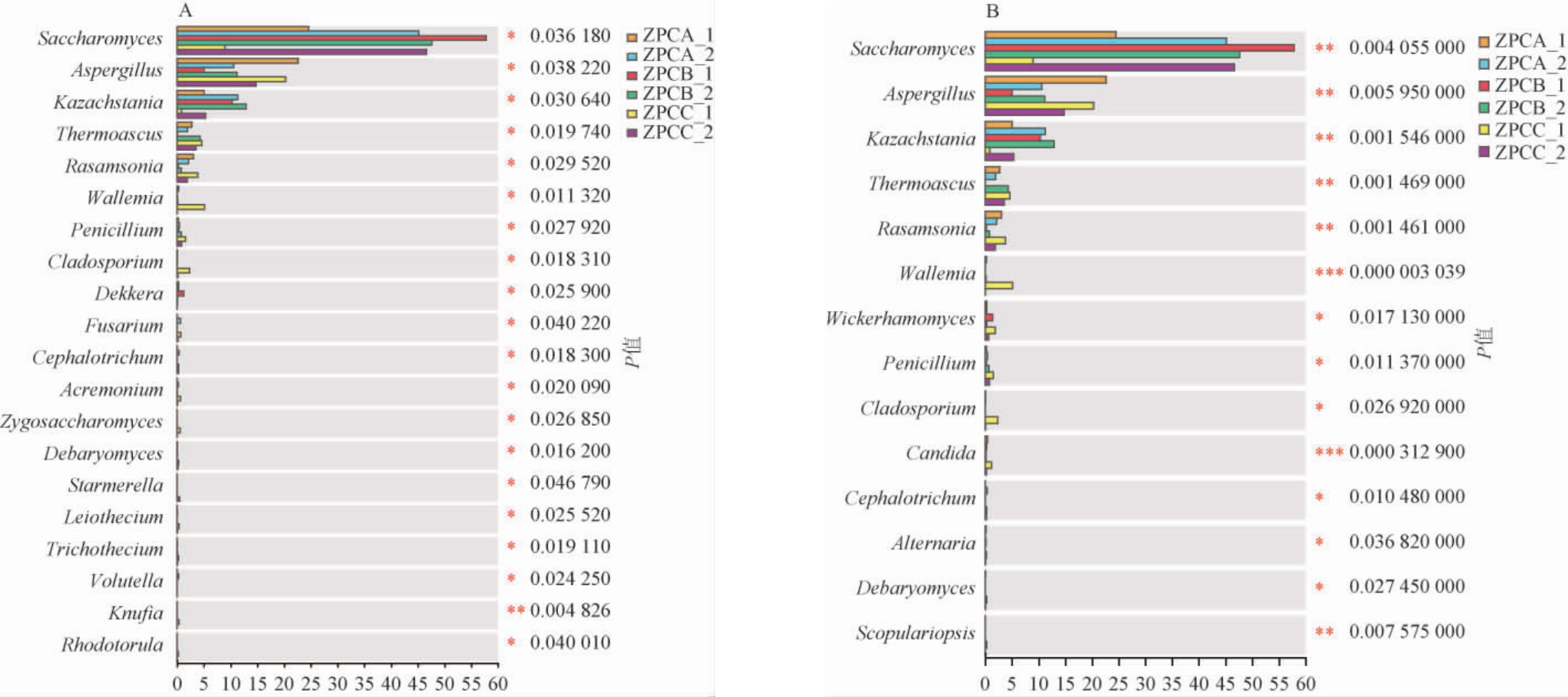
图7 不同比表面积窖池糟醅真菌属Kruskal-Wallis秩和检验(A)及单因素方差分析(B)
Fig.7 Kruskal-Wallis test (A) and one-way analysis of variance (B) for fungus at genus level of fermented grains from different specific surface areas pits
2.6 微生物群落与基酒风味相关性分析
利用美吉云平台工具,将基酒的19种重要差异风味物质与相对丰度前50的细菌属及真菌属进行相关性[33]分析,结果见图8。由图8A可知,大部分细菌与各风味物质成正相关关系,少部分细菌与各风味物质呈负相关,其中除细菌unclassified_c__Bacilli,其余大多细菌与L-乳酸乙酯、己酸戊酯、2-甲基辛酸丁酯呈负相关关系,乳杆菌属(Lactobacillus)与大多风味物质呈负相关;己酸菌属(Caproiciproducens)与9种酯和异戊醇呈显著正相关(P<0.05),其中棕榈酸乙酯、月桂酸乙酯、壬酸乙酯呈极显著正相关(P<0.01),norank_f__Caloramatoraceae与15种酯和异戊醇呈正相关,其中乙酸乙酯、月桂酸乙酯、9-十五碳烯酸乙酯呈显著正相关(P<0.05);梭菌属(Clostridium_sensu_stricto_12)与15种酯和异戊醇呈正相关关系,其中棕榈酸乙酯、9-十五碳烯酸乙酯呈显著正相关(P<0.05),芽孢杆菌属(Bacillus)与8种酯和异戊醇呈显著正相关(P<0.05),高温放线菌属(Thermoactinomyces)与棕榈酸乙酯呈显著正相关(P<0.05)。

图8 不同比表面积窖池基酒差异风味物质与糟醅主要细菌属(A)、真菌属(B)的相关性分析
Fig.8 Correlation analysis between differential flavor substances in base liquor and main genus of bacteria (A) and fungi (B) in fermented grains from different specific surface areas pits
“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01),“***”表示高度显著相关(P<0.001)。
由图8B可知,大部分真菌与各风味物质呈负相关,少部分与各风味物质呈正相关,其中酵母属(Saccharomyces)与10种酯类呈显著正相关(P<0.05);哈萨克斯坦酵母属(Kazachstania)与12种酯类呈显著正相关(P<0.05);曲霉属(Aspergillus)与9种酯类呈显著负相关(P<0.05);热子囊菌属(Thermoascus)、埃默森氏菌属(Rasamsonia)、威克汉姆酵母属(Wickerhamomyces)、青霉属(Penicillium)、枝孢霉属(Cladosporium)与大部分风味物质(除2-甲基辛酸丁酯)呈显著负相关(P<0.05),2-甲基辛酸丁酯与20种真菌呈显著正相关(P<0.05)。
3 结论
本研究对不同比表面积窖池糟醅理化、微生物及所酿造的基酒理化、风味、感官评分进行分析,结果表明,不同比表面积窖池糟醅温度变化,糟醅酸度、淀粉、水分,基酒总酸、总酯、酒精度存在差异,基酒VIP>1的酯类有己酸乙酯、乙酸乙酯等18种有机酸酯和1种异戊醇,窖池比表面积越大,基酒中己酸乙酯以及其他VIP>1的酯类总含量越高;高通量测序结果表明,比表面积大的窖池糟醅中源自窖泥的功能细菌多样性及丰度越大;相关性分析表明,大部分细菌与各风味物质成正相关,其中己酸菌属(Caproiciproducens)、梭菌属(Clostridium_sensu_stricto_12)与大部分酯类呈显著正相关(P<0.05);大部分真菌与各风味物质呈负相关,除Saccharomyces、Kazachstania与大部分酯类呈显著正相关(P<0.05),Aspergillus、Thermoascus、Rasamsonia、Wicker- hamomyces、Penicillium、Cladosporium与大部分酯类呈显著负相关(P<0.05)。本研究结果表明,窖池比表面积越大,基酒己酸乙酯及其他VIP>1的重要酯类总含量越高,比表面积大的窖池糟醅中源自窖泥的功能细菌多样性及丰度越大。该研究利用现代微生物测序手段结合风味相关性分析,科学解释了前人关于“窖池比表面积越大,基酒酒质越好”的酿造经验,研究结果为以后窖池科学合理地建造提供了理论依据。
[1]MEI J L, CHAI L J, ZHONG X Z, et al.Microbial biogeography of pit mud from an artificial brewing ecosystem on a large time scale:All roads lead to Rome[J].mSystems,2023,8(5):e00564-23.
[2]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:310-315.
[3]李国红,李国林.浅析窖形设计与窖池建造[J].酿酒科技,1996(2):40-42.
[4]彭盼.合理进行窖形设计提高酒质和酒率[J].酿酒科技,1996(5):42.
[5]王鑫.新型浓香型白酒窖池的搭建、养护与产业化研究[D].长沙:中南林业科技大学,2018.
[6]XU Y Q,ZHAO J,LIU X,et al.Flavor mystery of Chinese traditional fermented Baijiu:The great contribution of ester compounds[J].Food Chem,2022,369(8):130920.
[7]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of maotai flavor Baijiu[J].J Food Sci,2019,84(1):813-825.
[8]张明珠.文王贡酒微生物群落结构及其与主要风味代谢物的关联研究[D].合肥:合肥工业大学,2022.
[9]XU Y Q,WU M,NIU J,et al.Characteristics and correlation of the microbial communities and flavor compounds during the first three rounds of fermentation in Chinese sauce-flavor Baijiu[J].Foods,2023,12(1):207.
[10]焦文婧.浓香型白酒酿造微生物群落与乙酸及乙酸乙酯的相关性研究[D].绵阳:西南科技大学,2024.
[11]宋建阳,梁莉莹,岑定运,等.浓香型白酒发酵过程中酒醅微生物群落结构解析及其与风味物质的相关性[J].食品研究与开发,2023,44(14):86-92.
[12]陈让芳,高健,杨燕,等.浓香型白酒窖泥原核微生物群落与挥发性风味物质相关性分析[J].食品与发酵科技,2023,59(3):9-15.
[13]王清龙,朱甜甜,刘延波,等.白酒生产不同酒曲微生物群落结构、理化指标及挥发性风味物质研究[J].中国酿造,2023,42(7):93-102.
[14]XU S.Microbial communities and flavor formation in the fermentation of Chinese strong-flavor Baijiu produced from old and new Zaopei[J].Food Res Int,2022,156(7):111162.
[15]张宿义,许德富.泸型酒技艺大全[M].北京:中国轻工业出版社,2011,234-248,394-396.
[16]CHENG W,CHEN X,XUE X,et al.Comparison of the correlations of microbial community and volatile compounds between pit-mud and fermented grains of compound-flavor Baijiu[J].Foods,2024,13(2):203.
[17]刘平,张宿义,明红梅,等.不同发酵期对不同糟层浓香型基酒风味成分的影响[J].食品与发酵工业,2024,50(23):1-13.
[18]李孟涛,许德富,敖宗华,等.浓香型基酒中糊味特征物质解析[J].食品科学,2024,45(13):173-180.
[19]李培,倪斌,高洪霞,等.泸型酒中关键“窖香”风味物质确定及其馏出规律研究[J].食品与发酵工业,2024,50(16):181-195.
[20]柴丽娟,钱玮,钟小忠,等.浓香型白酒发酵过程中窖内古菌群落分布特征[J].生物工程学报(12):2635-2643.
[21]王双慧,马世源,李子健,等.酿酒酵母对浓香型白酒发酵过程中微生物群落演替的影响机制[J].食品科学,2024,45(7):103-110.
[22]彭远凤,杨阳,赵东,等.东方伊萨酵母对浓香型白酒酒醅微生物群落结构及挥发性风味物质合成的影响[J].食品科学,2024,45(16):97-104.
[23]邓杰,张曼,周杰,等.2种浓香型白酒大曲中微生物群落结构及功能研究[J].食品科学技术学报,2024,42(4):75-85.
[24]LIU X, MA D, YANG C, et al.Microbial community succession patterns and drivers of Luxiang-flavor Jiupei during long fermentation[J].Front Microbiol,2023,2(10):1109719.
[25]蒲领平,黄治国,饶家权,等.六粮浓香型白酒酒醅发酵理化指标时空差异性研究[J].中国酿造,2023(7):167-171.
[26]余小斌,黄张君,刘小刚,等.酱香型不同轮次及等级基酒的感官和风味成分特征分析[J].中国酿造,2024,43(8):61-73.
[27]范文来,徐岩.酒类风味化学[M].北京:中国轻工业出版社,2020,35-36.
[28]王乐,魏功,郭逸臻,等.北方浓香型白酒发酵过程中不同空间层次糟醅理化指标及风味物质的变化[J].中国酿造,2024(3):63-71.
[29]WANG S,LI Z,HUANG D,et al.Contribution of microorganisms from pit mud to volatile flavor compound synthesis in fermented grains for nongxiangxing Baijiu brewing[J].J Sci Food Agr,2023,10(28):12968.
[30]徐鹏翔.泸型酒窖泥中梭菌群落发酵演替及代谢特性分析[D].无锡:江南大学,2019.
[31]SUN H, CHAI L J, FANG G Y, et al.Metabolite-based mutualistic interaction between two novel clostridial species from pit mud enhances butyrate and caproate production[J].Appl Environ Microbiol, 2022,88(13):e00484-22.
[32]毛凤娇,黄均,周荣清,等.人工窖泥微生物群落对浓香型白酒发酵过程风味代谢物形成的影响[J].食品科学,2024,45(4):125-134.
[33]尹倩倩,刘双平,秦辉,等.浓香型白酒上下层原酒风味特征及影响因子分析[J].食品与发酵工业,2022,48(18):53-59.