白酒以粮食为原料,以大曲、小曲或麸曲等为糖化发酵剂,经过蒸煮、糖化、发酵、蒸馏而制,分为酱香型、浓香型、清香型和米香型等十二种香型[1-3]。酱香型白酒具有“酱香突出、幽雅细腻、酒体醇厚、回味悠久、空杯留香持久”等特点,可分为坤沙酒、翻沙酱酒等[4]。坤沙酒酱香突出、酒体醇厚、空杯留香,但出酒率低,生产周期长[5]。除坤沙工艺外,翻沙工艺也被广泛用于酱香型白酒的酿造中。翻沙工艺的操作流程为:在坤沙型白酒发酵八轮次后的酒醅中加入一些新的粉碎高粱和新曲药,再次堆积发酵、窖池发酵、蒸馏取酒[6]。翻沙工艺利用高温大曲作为发酵剂,能充分利用发酵后期酒醅中的残留淀粉和蛋白质等营养物质,从而提高粮食利用率,避免资源浪费。翻沙酱酒因其生产成本低、生产周期短、出酒率高,同时具备酱香纯正、酒体醇厚的特点而有较好的应用前景[7]。
酿酒原料的选择对酱香型白酒的特有风味的很大影响。“高粱产酒香”,高粱作为酿酒原料,具有淀粉含量高、单宁含量较高、蛋白质含量适中、脂肪含量低等突出优势[8]。在翻沙工艺中,高粱的加入不但能为微生物繁殖代谢提供物质基础,也能调节丢糟的初始酸度,避免入窖酒醅酸度过高抑制微生物繁殖,同时更能赋予酒体独特的粮香。适宜的高粱投入比例是生产优质酱香型白酒的重要前提条件。不同的高粱添加比例为微生物提供含量不等的营养物质,从而影响微生物的群落结构组成。不同的酿酒微生物通过不同的代谢途径生成不同的风味物质,风味物质的组合造就不同的酱酒风味。研究表明,在浓香型白酒夏季小转排和大转排生产中,不同投粮量对基础酒产质量有较大影响[9]。目前不同投粮量对翻沙工艺酱酒酒醅发酵及基酒品质影响的相关文献较少。
本研究设置了高粱的不同添加量,应用翻沙工艺对历经八轮次发酵的酱香型白酒酒醅进行再次发酵与取酒,分别采用顶空固相微萃取-气相色谱-质谱联用(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)和宏基因组技术对翻沙酱酒挥发性风味物质和出窖酒醅微生物群落结构进行解析。基于正交偏最小二乘判别分析(partial least orthogonal squaresdiscrimination analysis,OPLS-DA)、相关性分析等方法探究挥发性风味物质与微生物群落之间的潜在关系[10]。最后,采用香气、口味和口感三个维度评价不同投粮量翻沙酱酒的品质。通过研究不同投粮量对酱香型翻沙酱酒发酵过程及基酒品质的影响,以期为翻沙酱酒的生产提供理论指导。
1 材料与方法
1.1 材料与试剂
川南糯红高粱(每粒高粱破碎为4~6瓣)、翻沙工艺出窖酒醅:四川省泸州市某酒厂;脱氧核糖核酸(deoxyri bonucleic acid,DNA)提取试剂盒(货号175033914):德国QIAGEN公司;双链DNA荧光定量检测试剂盒(货号12640ES):翌圣生物科技(上海)股份有限公司;DNA标记物(货号G3363-01):武汉塞维尔生物科技有限公司。
1.2 仪器与设备
5403R冷冻离心机:德国Eppendorf公司;SI-0256(G560E)涡旋振荡仪:美国Scientific Industries公司;TUV-TOC/UF纯水仪:德国OmniaPure公司;SBL-10TD控温超声波清洗机:宁波新芝生物科技股份有限公司;HH-8数显恒温水浴锅:常州天瑞仪器有限公司;MS105DU电子天平:瑞士METTLER TOLEDO公司;PAL RTC-1600顶空固相微萃取多功能进样器:广州智达实验室科技有限公司;GCMS-QP2020气相色谱-质谱联用仪(GC-MS):日本Shimadzu Corporation公司;HP-INNOWAX色谱柱(60 m×0.25 mm×0.25 μm):美国Agilent公司;Invitrogen Qubit 4 荧光计:美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 实验方案
选取四川省泸州市某酒厂五口正常发酵的酱酒窖池作为实验对象。实验采用混蒸混烧的翻沙工艺生产酱香型白酒,具体方法如下:在坤沙工艺发酵八轮次后的出窖酒醅中加入粉碎高粱,随后进行上甑、摊晾、拌曲、入窖发酵等工序,发酵1个月后收集出窖酒醅和酱酒作为实验样品。实验设置了五个梯度的粉碎高粱添加比例,分别为25 kg/t、50 kg/t、75 kg/t、100 kg/t和125 kg/t,每个梯度对应的酒醅名称分别为HF25、HF50、HF75、HF100和HF125(基酒与酒醅命名方式相同)。酒醅和基酒的采样方法如下:每口窖池约24甑出窖酒醅,采用五点取样法在每甑酒醅混合均匀后采集样品,将24份酒醅等质量混合作为该窖池的出窖酒醅样品。在每甑酒醅蒸酒时收集综合酒样,将24份酒样等体积混合作为该窖池的基酒样品。
1.3.2 酒醅理化指标测定方法
酒醅的水分含量、酸度、淀粉含量、还原糖含量:参考DB34/T 2264—2014 固态发酵酒醅分析方法[11]进行检测。每组样品重复测定3次。
1.3.3 酒醅微生物群落结构分析
称取10 g出窖酒醅样品于50 mL无菌离心管中,加入20 mL 0.1 mol/L 磷酸盐缓冲(phosphate buffer saline,PBS)溶液与3~5颗玻璃珠。将离心管300 r/min涡旋5 min,在4 ℃、900 r/min条件下离心5 min,取上清液于新的50 mL无菌离心管。将上清液于在4 ℃条件下9 000 r/min离心3 min,丢弃上清,收集沉淀。利用试剂盒提取沉淀的DNA,通过荧光计和双链DNA荧光定量检测试剂盒检测DNA的浓度和纯度,利用1%琼脂糖凝胶电泳检测DNA完整性。
聚合酶链式反应(polymerase chain reaction,PCR)产物扩增和测序等后续步骤交由上海美吉生物公司进行。使用IlluminaNovaSeq/Hiseq Xten测序平台进行宏基因组测序,经过严格的数据质控、拼接组装、基因预测、非冗余基因集构建等步骤获得最终信息。进行物种注释时,由于每条序列可能会有多个比对结果,得到不同的分类级别,为了保证其生物学意义,采取最近公共祖先算法(lowest common ancestor,LCA),将出现第一个分枝前的分类级别作为该物种的注释信息。
1.3.4 基酒挥发性风味物质分析
采用HS-SPME-GC-MS方法测定基酒挥发性风味成分。
HS-SPME条件:取1 mL基酒,加入4 mL超纯水和2 g NaCl,置于15 mL固相微萃取仪采样瓶中,插入装50/30 μm DVB/CAR/PDMS Stableflex(2 cm)纤维头的手动进样器,60 ℃顶空萃取45 min,快速移出萃取头并立刻插入气相色谱仪进样口(温度250 ℃)中,热解吸3 min后进样。
GC条件:采用HP-INNOWAX色谱柱(60 m×0.25 mm×0.25 μm),气相色谱检测器和进样口温度为250 ℃,不分流进样,高纯氦气作为载气,流量1.5 mL/min,初始温度40 ℃保持2 min,以3 ℃/min升温到110 ℃,保持5 min;以4.5 ℃/min升温至200 ℃;以10 ℃/min升温至230 ℃,保持12 min。
MS条件:电子电离(electron ionization,EI)源;离子源温度230 ℃;电子能量70 eV;四级杆温度150 ℃;质量扫描范围25~550 m/z。
定性定量分析:将分析得到的离子图谱经美国国家标准技术研究所(national institute of standards and technology,NIST)谱库检索,保留匹配度>85%的物质定性;采用峰面积归一法计算各挥发性风味物质的相对含量。
1.3.5 基酒感官评价
参考GB/T 33404—2016《白酒感官品评导则》[12]。邀请6名品酒师(包括3名国家级白酒评委,3名一级品酒师资质),对酱香型白酒的感官特征描述包括香气(10个描述词)、口感(5个描述词)、口味(5个描述词)三个维度,采用感官标尺法(10分制)进行定量。
1.3.6 数据处理
采用DMSAS 1.0.2软件计算方差;采用SciDAVis.2.7软件绘制折线图、柱状图、聚类热图;采用R语言进行正交偏最小二乘判别分析;采用联川生物云平台计算Spearman相关性系数并绘制相关性热图。
2 结果与分析
2.1 酒醅理化指标分析
酒醅的水分是酱香型白酒生产的关键控制点之一。水分含量过低,会影响高粱的吸水糊化,也不能为微生物生长繁殖提供充足养分。水分含量过高,酒醅发粘导致透气性不佳,最终导致“水大酸大、酒醅酸败”[13-14]。酱酒出窖酒醅的水分随轮次发酵的进行呈上升趋势,发酵八轮次后能达到54%~56%[13]。由图1A可知,在不同投粮量出窖酒醅中,HF50的水分含量最高为54.34%,其次是HF75达到53.86%,HF25的水分含量最低为51.16%,较接近发酵八轮次的出窖酒醅水分范围。

图1 不同投粮量出窖酒醅的理化指标
Fig.1 Physicochemical indexes of pit-unloading Jiupei with different sorghum input
适宜的酒醅酸度是酿造优质白酒不可或缺的指标之一,不但能抑制杂菌的生长,为酿酒微生物正常生长提供良好的环境,还能为各种酯类物质的合成提供前体物质。由图1B可知,在不同投粮量出窖酒醅中,HF125的酸度最高为4.27 mmol/10 g,其次是HF100达到3.91 mmol/10 g,HF75的酸度最低为3.25 mmol/10 g。
还原糖是由淀粉等物质在淀粉酶的催化作用下水解而成,是微生物生长繁殖能直接利用的能源物质。由图1C可知,在不同投粮量出窖酒醅中,HF100的还原糖含量最高为5.99 g/100 g,其次是HF125为3.72 g/100 g,HF25的还原糖含量最低为2.65 g/100 g。随着投粮量的增加,还原糖含量出现增加的趋势,HF100的还原糖含量最高,可能此方案的微生物对淀粉的分解利用更频繁。
淀粉是微生物生长繁殖的主要营养源,同时也是微生物代谢酒精和各种风味物质的物质基础。由图1D可知,在不同投粮量出窖酒醅中,HF125的淀粉含量最高为39.67 g/100 g,其次是HF100达到35.23 g/100 g,HF50的淀粉含量最低为31.14 g/100 g。研究表明,发酵八轮次出窖酒醅的淀粉含量约为15 g/100 g[13],但本研究新投入的粉碎高粱使得酒醅中的残留淀粉含量变得更高。同时,随着投粮量的增加,淀粉含量也呈现增加趋势,但发酵过程中存在多种复杂的生物化学反应和微生物代谢活动,因此淀粉与还原糖的趋势并非线性相关。
2.2 酒醅微生物群落结构分析
2.2.1 测序结果统计
经过Illumina HiSeq 2500平台测序获得碱基信息。平均每个样品共获得85 973 502条有效序列,每个样品的原始数据序列平均碱基数为12 981 998 802 bp。经过质量控制和去宿主之后,平均每个样品获得78 325 767条有效序列,平均每个样品有效碱基为11 797 859 306 bp,占据原始读长的90.80%以上。结果表明酒醅样本的测序数据量合理,基因组的测序深度能够保证后续分析结果的准确性。
2.2.2 菌群多样性分析
不同投粮量出窖酒醅样本微生物群落的多样性指数见图2。采用Chao1指数和Shannon指数分析微生物菌群丰度和多样性[15]。在α多样性分析中,Chao1指数越大,说明物种总数越多。Shannon指数值越大,微生物群落物种多样性和丰富度越高。由图2可知,出窖酒醅真菌的物种丰度和多样性整体高于细菌。
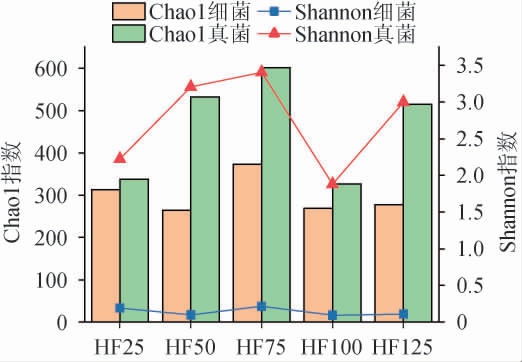
图2 不同投粮量出窖酒醅细菌与真菌的Chao1指数与Shannon指数
Fig.2 Chao1 and Shannon indexes of bacteria and fungi in pit-unloading Jiupei with different sorghum input
2.2.3 酒醅细菌与真菌群落结构分析
不同投粮量出窖酒醅中细菌和真菌群落在种水平的组成见图3。研究报道,细菌可以利用蛋白质和淀粉,对白酒的风味形成有重要贡献[16]。由图3A可知,在种水平上对相对丰度前15的优势细菌进行分析。整体而言,在出窖酒醅中,金山醋酸乳杆菌(Acetilactobacillus jinshanensis)占据绝对优势,其比例在96.59%至98.22%之间浮动,其次是乳杆菌属的耐酸乳杆菌(Lactobacillus acetotolerans),在HF25中达到1.01%,其余细菌的占比均低于1%。Acetilactobacillus jinshanensis属于醋酸乳杆菌属,是近年来被发现的乳杆菌科新种代表,是白酒发酵体系中优势微生物之一,发挥着重要的产酸功能。最新研究发现,Acetilactobacillus jinshanensis在白酒固态堆积发酵微生物群落结构中相对丰度>80%,它能提供代谢丙酮酸和降解多酚的参与基因,这些代谢途径可能有助于底物和氧气的利用,最终可增强微生物群落结构的稳定性[17]。在发酵过程中,一些非耐酸致病菌如肠球菌和克雷伯氏菌的丰度逐渐降低,而醋酸乳杆菌属和乳杆菌属等耐酸细菌因其高耐酸性成为优势菌属[18]。乳杆菌属也是酱酒后期发酵和出窖酒醅中的优势细菌属,因为发酵中后期的窖池处于长期厌氧状态更适合厌氧的乳杆菌属生长繁殖[18-19]。乳杆菌属能通过代谢碳水化合物生成乳酸,不但能抑制酿酒过程中病原菌的生长和微生物的腐败,而且乳酸经酯化作用后还生成乳酸乙酯等酯类物质,从而赋予白酒独特风格。
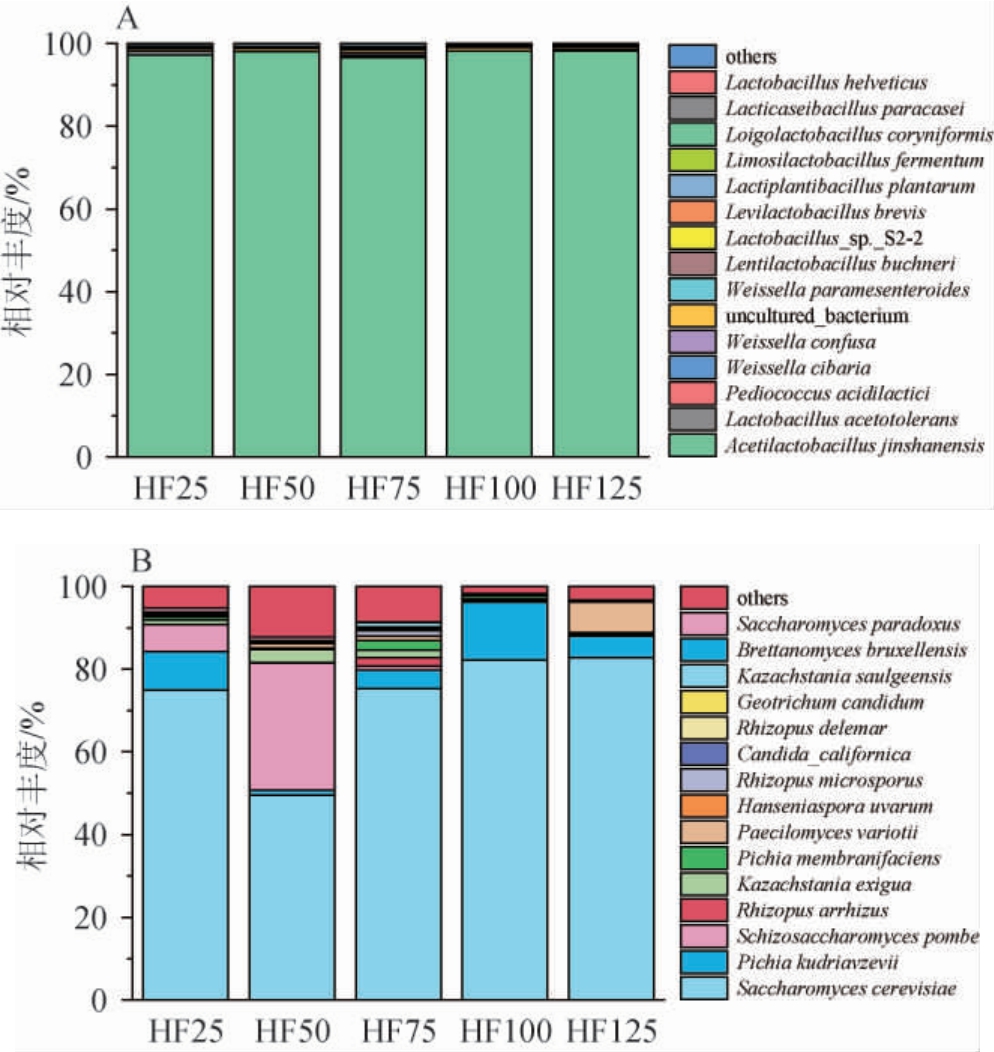
图3 基于种水平不同投粮量出窖酒醅细菌(A)及真菌(B)群落结构
Fig.3 Community structure of bacteria (A) and fungi (B) in pit-unloading Jiupei with different sorghum input based on species level
真菌在酱酒酯类物质合成中起重要作用,曲霉、根霉等真菌能产生醇、酸、酯等多种芳香初级代谢产物,有助于提高白酒的质量[20-21]。酵母菌主要产生各种风味化合物和乙醇,主要分为酿酒酵母与非酿酒酵母。霉菌可以分泌不同的酶来分解原料,并为其他细菌群的生长提供能量[22]。由图3B可知,在种水平上对相对丰度前15的优势真菌进行分析。在不同投粮量出窖酒醅中,存在多种占比高于1%的优势真菌。酿酒酵母(Saccharomyces cerevisiae)占比范围高达49.50%至82.82%,其次是粟酒裂殖酵母(Schizosaccharomyces pombe)占比范围为1.29%至13.98%,接着是库氏毕赤酵母(Pichia kudriavzevii),其占比范围分别在0.01%至30.69%之间波动。酿酒酵母(如Saccharomyces cerevisiae)能将糖类转化为乙醇和二氧化碳,而非酿酒酵母(如Pichia kudriavzevii、Schizosaccharomyces pombe)能利用糖类、氨基酸、蛋白质等物质产生大量风味物质从而增香,如醛类、酯类、酮类等[23]。Schizosaccharomyces pombe是乙醇、乙酸、辛酸和壬酸等酸类物质产生菌,还能贡献大量癸酸乙酯、乙酸乙酯及辛酸乙酯等酯类物质[24]。Pichia kudriavzevii在白酒酿造过程中能产生β-苯乙醇、乙酸苯乙酯等具有果香、蜜香、玫瑰香的风味物质[25-26]。在五组出窖酒醅的优势真菌中,Saccharomyces cerevisiae占据了绝对的主导地位,其在HF125中的占比最高(82.82%),其他优势真菌在五组不同投粮量中的丰度排序随着投粮量的增加在不断变化:Pichia kudriavzevii在HF100的占比最高,达到13.98%。Schizosaccharomyces pombe和Kazachstania exigua在HF50占比最高,分别达到30.8%和3.23%。值得注意的是:Saccharomyces cerevisiae和Pichia kudriavzevii在HF100方案中的累计占比高达96.23%,成为了该方案中的绝对优势真菌组合,此结果突显了HF100在促进这两种真菌生长方面的独特优势。
2.3 不同投粮量翻沙酱酒挥发性风味物质分析
2.3.1 挥发性物质及主成分分析
本研究基于HP-SPME-GC-MS对不同投粮量翻沙酱酒的挥发性风味物质进行检测,以探究不同投粮量对翻沙酱酒风味的影响。由表1可知,五个方案无论是风味物质种类还是含量均存在一定差异。在5种基酒中共检测到65种共有的风味物质,包括35种酯类,9种醇类,10种酮类,6种酸类,5种其余种类。酯类挥发性风味成分的种类及相对含量在各组中占比均最高,其次是醇类物质。酯类物质的增加趋势与风味物质总量保持一致,HF100的酯类物质占比最高(83.55%),HF125的占比最低(78.57%)。酯类化合物是白酒风味化合物中物质浓度最高、种类最丰富的一类,其种类和比例使得各香型白酒风味独特,为白酒赋予花香、果香、甜香等感官特性。五个方案中质量浓度排名前五的酯类物质分别是:己酸乙酯、辛酸乙酯、棕榈酸乙酯、庚酸乙酯、癸酸乙酯。己酸乙酯是白酒四大酯之一,具有果味、花香和甜味,同时为白酒赋予窖香[27]。辛酸乙酯具有梨香、白兰地酒香味。棕榈酸乙酯具有轻微的奶油香和不明显的脂肪香[20]。庚酸乙酯在坤沙酱酒中的含量并不高,可能是翻沙酱酒较特有的酯类物质。癸酸乙酯具有玫瑰、菠萝、葡萄酒的混合香气。醇类物质不但是酯类的前体物质,也是协调白酒秀雅香气和醇甜口感的必须物质[28]。酱酒中通常含有许多高级醇,如正丙醇、异丁醇、正丁醇、异戊醇、正戊醇等,适量的高级醇可以改善白酒的风味和口感[29]。在翻沙酱酒的醇类物质中,异戊醇和正己醇的含量靠前。异戊醇具有发酵香、果香、酒香,但也会带来杂醇油和指甲油等不愉悦味道[30]。正己醇主要突出果香、青草香、花香[30]。酸类对口感的贡献大于对风味的贡献,使酒体协调、余味悠长。挥发性酮类含量较低,阈值较高,对风味影响较小[31]。在五种方案中,2-十一酮和己酸的含量分别在酮类和酸类物质中最多,前者提供柑橘类、油脂香气,后者提供汗酸臭、动物臭、奶酪味[30]。
表1 翻沙酱酒的挥发性风味物质总含量
Table 1 Total contents of volatile flavor substances in "Fansha" sauce-flavor Baijiu
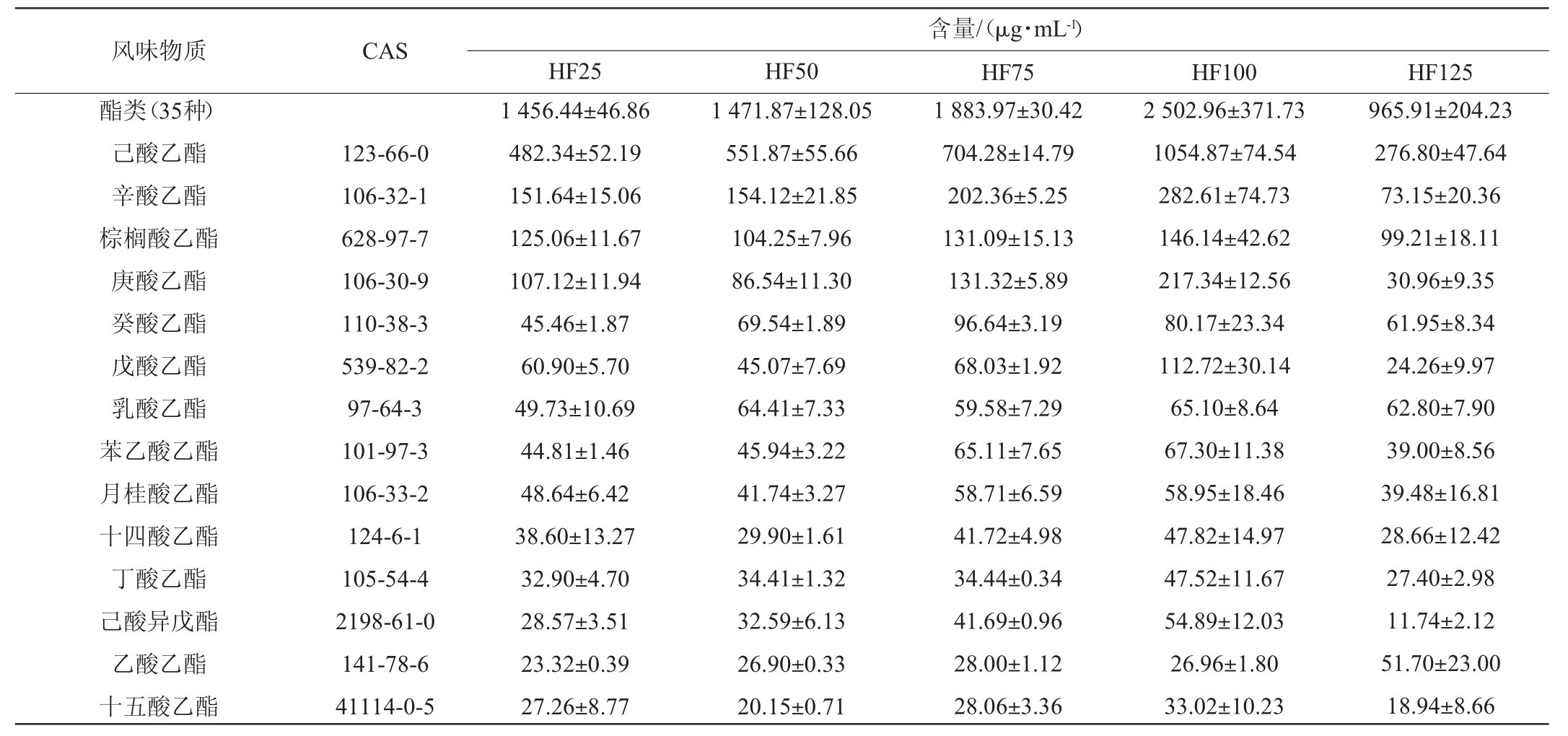
风味物质 CAS酯类(35种)己酸乙酯辛酸乙酯棕榈酸乙酯庚酸乙酯癸酸乙酯戊酸乙酯乳酸乙酯苯乙酸乙酯月桂酸乙酯十四酸乙酯丁酸乙酯己酸异戊酯乙酸乙酯十五酸乙酯123-66-0 106-32-1 628-97-7 106-30-9 110-38-3 539-82-2 97-64-3 101-97-3 106-33-2 124-6-1 105-54-4 2198-61-0 141-78-6 41114-0-5 HF25 HF50 1 456.44±46.86 482.34±52.19 151.64±15.06 125.06±11.67 107.12±11.94 45.46±1.87 60.90±5.70 49.73±10.69 44.81±1.46 48.64±6.42 38.60±13.27 32.90±4.70 28.57±3.51 23.32±0.39 27.26±8.77 1 471.87±128.05 551.87±55.66 154.12±21.85 104.25±7.96 86.54±11.30 69.54±1.89 45.07±7.69 64.41±7.33 45.94±3.22 41.74±3.27 29.90±1.61 34.41±1.32 32.59±6.13 26.90±0.33 20.15±0.71含量/(μg·mL-1)HF75 HF100 HF125 1 883.97±30.42 704.28±14.79 202.36±5.25 131.09±15.13 131.32±5.89 96.64±3.19 68.03±1.92 59.58±7.29 65.11±7.65 58.71±6.59 41.72±4.98 34.44±0.34 41.69±0.96 28.00±1.12 28.06±3.36 2 502.96±371.73 1054.87±74.54 282.61±74.73 146.14±42.62 217.34±12.56 80.17±23.34 112.72±30.14 65.10±8.64 67.30±11.38 58.95±18.46 47.82±14.97 47.52±11.67 54.89±12.03 26.96±1.80 33.02±10.23 965.91±204.23 276.80±47.64 73.15±20.36 99.21±18.11 30.96±9.35 61.95±8.34 24.26±9.97 62.80±7.90 39.00±8.56 39.48±16.81 28.66±12.42 27.40±2.98 11.74±2.12 51.70±23.00 18.94±8.66
续表
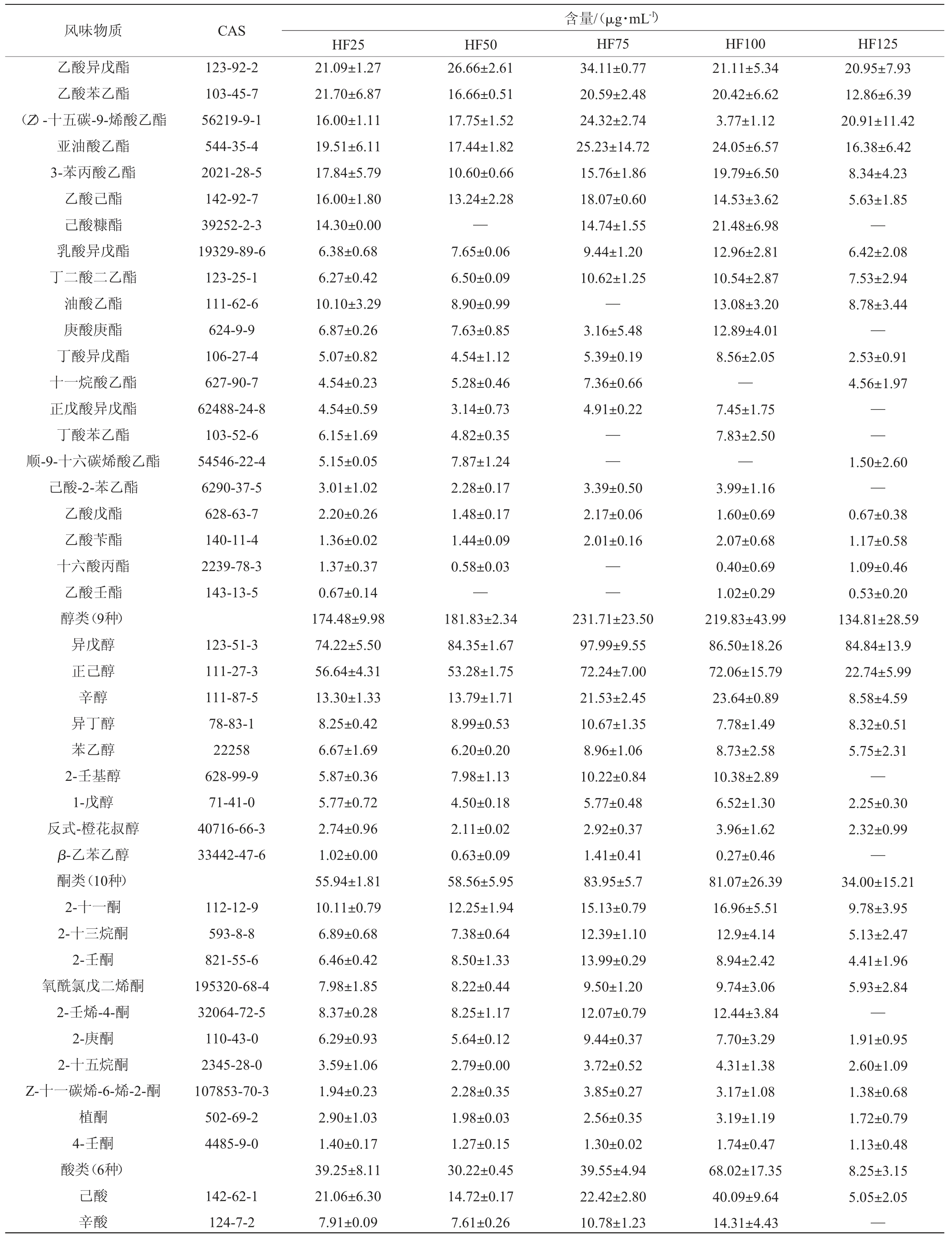
风味物质 CAS乙酸异戊酯乙酸苯乙酯(Z)-十五碳-9-烯酸乙酯亚油酸乙酯3-苯丙酸乙酯乙酸己酯己酸糠酯乳酸异戊酯丁二酸二乙酯油酸乙酯庚酸庚酯丁酸异戊酯十一烷酸乙酯正戊酸异戊酯丁酸苯乙酯顺-9-十六碳烯酸乙酯己酸-2-苯乙酯乙酸戊酯乙酸苄酯十六酸丙酯乙酸壬酯醇类(9种)异戊醇正己醇辛醇异丁醇苯乙醇2-壬基醇1-戊醇反式-橙花叔醇β-乙苯乙醇酮类(10种)2-十一酮2-十三烷酮2-壬酮氧酰氯戊二烯酮2-壬烯-4-酮2-庚酮2-十五烷酮Z-十一碳烯-6-烯-2-酮植酮4-壬酮酸类(6种)己酸辛酸123-92-2 103-45-7 56219-9-1 544-35-4 2021-28-5 142-92-7 39252-2-3 19329-89-6 123-25-1 111-62-6 624-9-9 106-27-4 627-90-7 62488-24-8 103-52-6 54546-22-4 6290-37-5 628-63-7 140-11-4 2239-78-3 143-13-5 123-51-3 111-27-3 111-87-5 78-83-1 22258 628-99-9 71-41-0 40716-66-3 33442-47-6 112-12-9 593-8-8 821-55-6 195320-68-4 32064-72-5 110-43-0 2345-28-0 107853-70-3 502-69-2 4485-9-0 142-62-1 124-7-2 HF25 HF50 21.09±1.27 21.70±6.87 16.00±1.11 19.51±6.11 17.84±5.79 16.00±1.80 14.30±0.00 6.38±0.68 6.27±0.42 10.10±3.29 6.87±0.26 5.07±0.82 4.54±0.23 4.54±0.59 6.15±1.69 5.15±0.05 3.01±1.02 2.20±0.26 1.36±0.02 1.37±0.37 0.67±0.14 174.48±9.98 74.22±5.50 56.64±4.31 13.30±1.33 8.25±0.42 6.67±1.69 5.87±0.36 5.77±0.72 2.74±0.96 1.02±0.00 55.94±1.81 10.11±0.79 6.89±0.68 6.46±0.42 7.98±1.85 8.37±0.28 6.29±0.93 3.59±1.06 1.94±0.23 2.90±1.03 1.40±0.17 39.25±8.11 21.06±6.30 7.91±0.09 26.66±2.61 16.66±0.51 17.75±1.52 17.44±1.82 10.60±0.66 13.24±2.28—7.65±0.06 6.50±0.09 8.90±0.99 7.63±0.85 4.54±1.12 5.28±0.46 3.14±0.73 4.82±0.35 7.87±1.24 2.28±0.17 1.48±0.17 1.44±0.09 0.58±0.03—181.83±2.34 84.35±1.67 53.28±1.75 13.79±1.71 8.99±0.53 6.20±0.20 7.98±1.13 4.50±0.18 2.11±0.02 0.63±0.09 58.56±5.95 12.25±1.94 7.38±0.64 8.50±1.33 8.22±0.44 8.25±1.17 5.64±0.12 2.79±0.00 2.28±0.35 1.98±0.03 1.27±0.15 30.22±0.45 14.72±0.17 7.61±0.26含量/(μg·mL-1)HF75 HF100 HF125 34.11±0.77 20.59±2.48 24.32±2.74 25.23±14.72 15.76±1.86 18.07±0.60 14.74±1.55 9.44±1.20 10.62±1.25—3.16±5.48 5.39±0.19 7.36±0.66 4.91±0.22 20.95±7.93 12.86±6.39 20.91±11.42 16.38±6.42 8.34±4.23 5.63±1.85—6.42±2.08 7.53±2.94 8.78±3.44—2.53±0.91 4.56±1.97————3.39±0.50 2.17±0.06 2.01±0.16——231.71±23.50 97.99±9.55 72.24±7.00 21.53±2.45 10.67±1.35 8.96±1.06 10.22±0.84 5.77±0.48 2.92±0.37 1.41±0.41 83.95±5.7 15.13±0.79 12.39±1.10 13.99±0.29 9.50±1.20 12.07±0.79 9.44±0.37 3.72±0.52 3.85±0.27 2.56±0.35 1.30±0.02 39.55±4.94 22.42±2.80 10.78±1.23 21.11±5.34 20.42±6.62 3.77±1.12 24.05±6.57 19.79±6.50 14.53±3.62 21.48±6.98 12.96±2.81 10.54±2.87 13.08±3.20 12.89±4.01 8.56±2.05—7.45±1.75 7.83±2.50—3.99±1.16 1.60±0.69 2.07±0.68 0.40±0.69 1.02±0.29 219.83±43.99 86.50±18.26 72.06±15.79 23.64±0.89 7.78±1.49 8.73±2.58 10.38±2.89 6.52±1.30 3.96±1.62 0.27±0.46 81.07±26.39 16.96±5.51 12.9±4.14 8.94±2.42 9.74±3.06 12.44±3.84 7.70±3.29 4.31±1.38 3.17±1.08 3.19±1.19 1.74±0.47 68.02±17.35 40.09±9.64 14.31±4.43 1.50±2.60—0.67±0.38 1.17±0.58 1.09±0.46 0.53±0.20 134.81±28.59 84.84±13.9 22.74±5.99 8.58±4.59 8.32±0.51 5.75±2.31—2.25±0.30 2.32±0.99—34.00±15.21 9.78±3.95 5.13±2.47 4.41±1.96 5.93±2.84—1.91±0.95 2.60±1.09 1.38±0.68 1.72±0.79 1.13±0.48 8.25±3.15 5.05±2.05—
续表
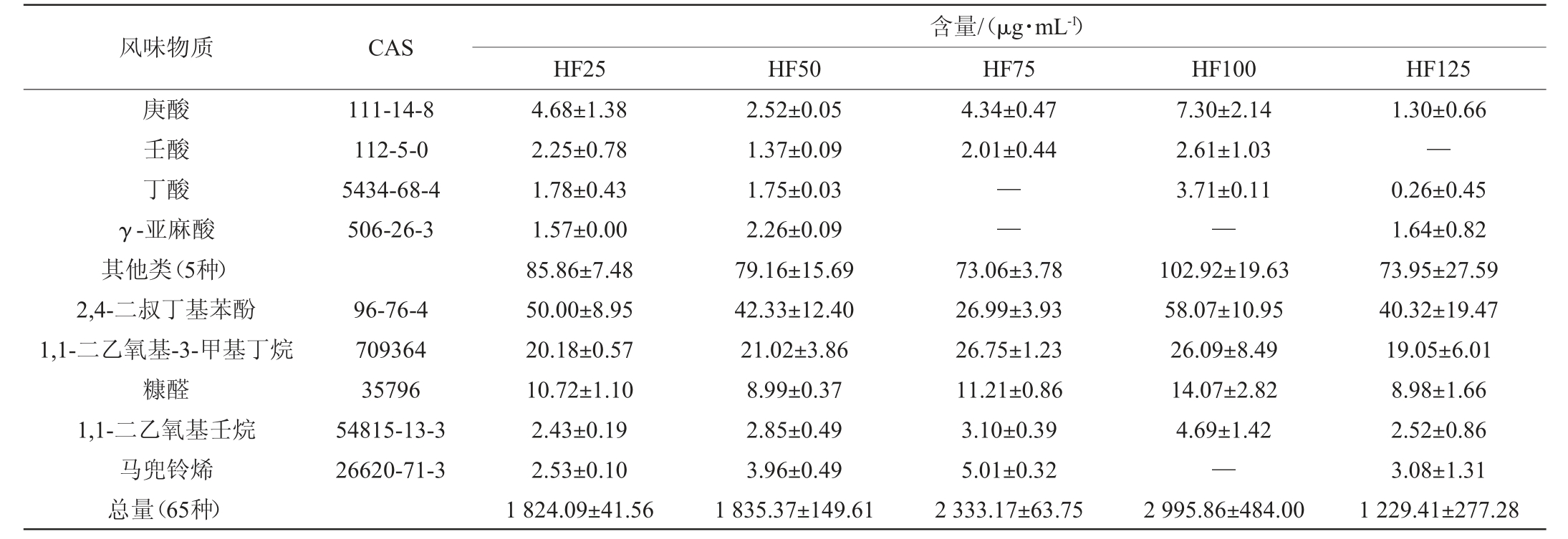
注:“—”代表未检出。
风味物质 CAS庚酸壬酸丁酸γ-亚麻酸其他类(5种)2,4-二叔丁基苯酚1,1-二乙氧基-3-甲基丁烷糠醛1,1-二乙氧基壬烷马兜铃烯总量(65种)111-14-8 112-5-0 5434-68-4 506-26-3 96-76-4 709364 35796 54815-13-3 26620-71-3 HF25 HF50 4.68±1.38 2.25±0.78 1.78±0.43 1.57±0.00 85.86±7.48 50.00±8.95 20.18±0.57 10.72±1.10 2.43±0.19 2.53±0.10 1 824.09±41.56 2.52±0.05 1.37±0.09 1.75±0.03 2.26±0.09 79.16±15.69 42.33±12.40 21.02±3.86 8.99±0.37 2.85±0.49 3.96±0.49 1 835.37±149.61含量/(μg·mL-1)HF75 HF100 HF125 4.34±0.47 2.01±0.44——73.06±3.78 26.99±3.93 26.75±1.23 11.21±0.86 3.10±0.39 5.01±0.32 2 333.17±63.75 7.30±2.14 2.61±1.03 3.71±0.11—102.92±19.63 58.07±10.95 26.09±8.49 14.07±2.82 4.69±1.42—2 995.86±484.00 1.30±0.66—0.26±0.45 1.64±0.82 73.95±27.59 40.32±19.47 19.05±6.01 8.98±1.66 2.52±0.86 3.08±1.31 1 229.41±277.28
随着投粮量的增加,基酒中挥发性化合物的总量呈现不同程度递增趋势,尤其是HF100的风味物质总量最高。研究表明,Lactobacillus和Acetilactobacillus等属于乳酸菌科,能产生乙酸、丙酸等短链脂肪酸,而Pichia也能产生乙酸等短链脂肪酸和辛酸等中链脂肪酸[32]。乙酸和乙醇通过微生物的条代谢途径可生成己酸乙酯:首先,乙酸与乙醇合成乙酸乙酯,其次,乙酸乙酯和乙醇合成丁酸乙酯,最后丁酸乙酯再合成己酸乙酯[33]。Acetilactobacillus和Saccharomyces的总含量在HF100中占比最高,这可能是HF100中酯类物质含量最高的原因,尤其是己酸乙酯和辛酸乙酯。
2.3.2 不同投粮量翻沙酱酒潜在香气标志物分析
对不同投粮量翻沙酱酒风味物质进行OPLS-DA及聚类分析,结果见图4。由图4A可知,该模型的自变量拟合指数(R2X)为0.803,模型预测指数(Q2)为0.999,两项数值均>0.5,表示模型拟合结果可接受。置换检验(n=200)结果显示,Q2回归线的截距为负值,表明该模型未过拟合。
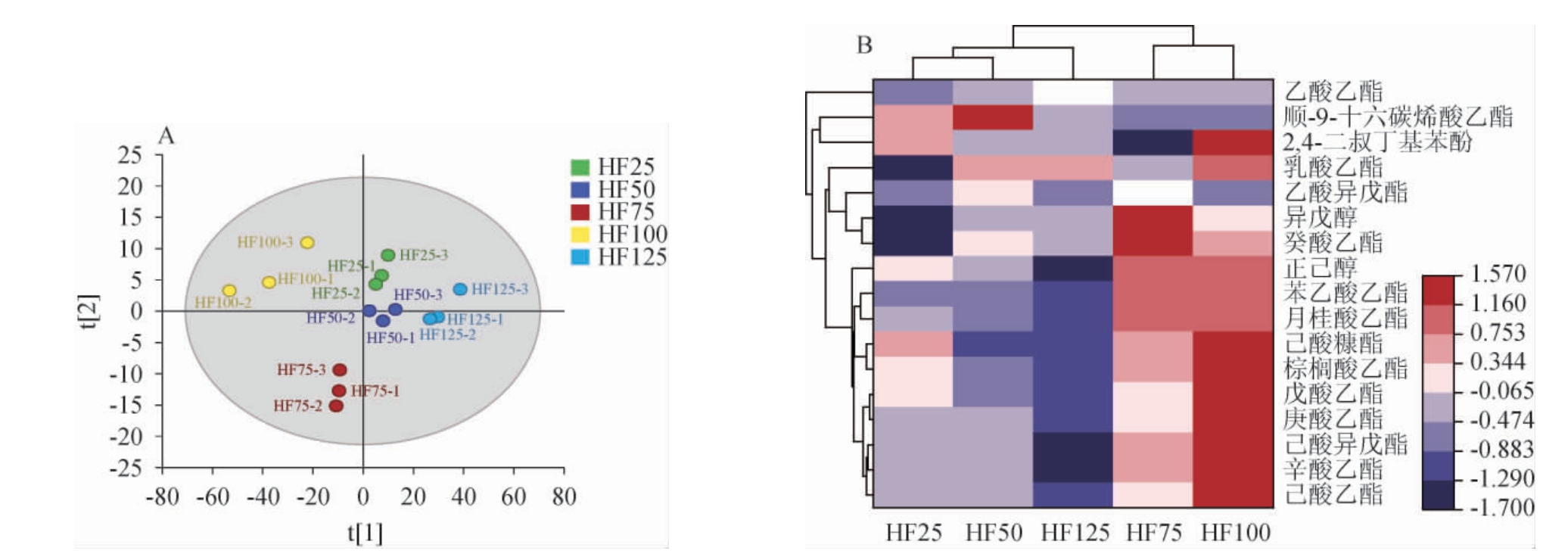
图4 翻沙酱酒的潜在香气标志物正交偏最小二乘-判别分析(A)和聚类分析热图(B)
Fig.4 Orthogonal partial least squares-discriminant analysis (A) and cluster analysis heat map (B) of potential aroma markers of "Fansha"sauce-flavor Baijiu
基于变量重要性投影值(variable importance projection,VIP)>1和P<0.05的条件筛选出17种潜在香气标志物。由图4B可知,17种潜在香气标志物,包括14种酯类,2种醇类和1种酚类。酯类化合物是白酒中花果香和甜香重要的呈香物质[34-35],有研究提到在酱酒酯类物质中,己酸乙酯和丁酸乙酯含量最高[36]。除了四大酯外,微量酯类物质是酱香型白酒呈现水果复合香气且优雅细腻的重要原因,包括辛酸乙酯、戊酸乙酯、棕榈酸乙酯、乙酸异戊酯、油酸乙酯等[37]。在本研究中,鉴定出的香气标志物主要有己酸乙酯、辛酸乙酯、己酸异戊酯、庚酸乙酯等酯类。其中HF100的酯类物质明显高于其他方案,这和风味物质整体浓度趋势一致。
2.3.3 酒醅优势菌群与基酒挥发性风味物质的相关性分析
对不同投粮量出窖酒醅中相对丰度排名前15的细菌种和真菌种,与翻沙酱酒所有挥发性风味物质进行了相关性分析,结果见图5。
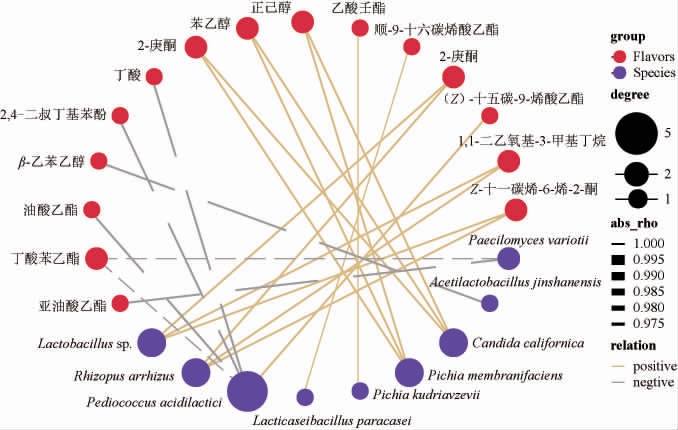
图5 微生物和挥发性风味化合物的相关性网络图
Fig.5 Correlation network diagram of microorganisms and volatile flavor compounds
蓝色代表风味物质,红色代表微生物。实线/虚线代表正/负相关,线粗细代表相关关系强弱,越粗越强。圆点大小浅代表相关对象个数多少,越大越多。
15种风味物质与4种细菌、5种真菌之间存在相关性。相关性分析显示,加州假丝酵母菌(Candida californica)和膜醭毕赤酵母(Pichia membranifaciens)与正己醇、苯乙醇和2-庚酮之间呈正相关。三种物质中,正己醇是已筛选出的潜在标记香气物质。在微生物群落结构中,HF75和HF100的Pichia membranifaciens和Candida californica的占比高于其他方案,而在挥发性风味物质含量中,HF75和HF100的正己醇含量高于其他方案。研究已经表明,Candida californica与乙醇的产生呈正相关,Pichia membranifaciens能产生β-木糖苷酶、β-葡萄糖苷酶和一些挥发性酚类物质[38-39]。但以上两种菌与正己醇、苯乙醇和2-庚酮的有关代谢通路未见报道。以往的研究显示,乳酸片球菌(Pediococcus acidilactici)是白酒酿造过程中常见的乳酸菌,与乳酸等代谢物呈正相关。本研究结果首次表明,Pediococcus acidilactici与(Z)-十五碳-9-烯酸乙酯呈正相关,与丁酸苯乙酯、2,4-二叔丁基苯酚、油酸乙酯和丁酸呈负相关,几者之间的相互作用还需进一步验证。
2.4 感官评价分析
采用感官定量描述分析法从香气、口味和口感3个维度对不同投粮量翻沙酱酒感官特征与差异进行解析,并基于数字化的感官评价结果绘制雷达图,结果见图6。
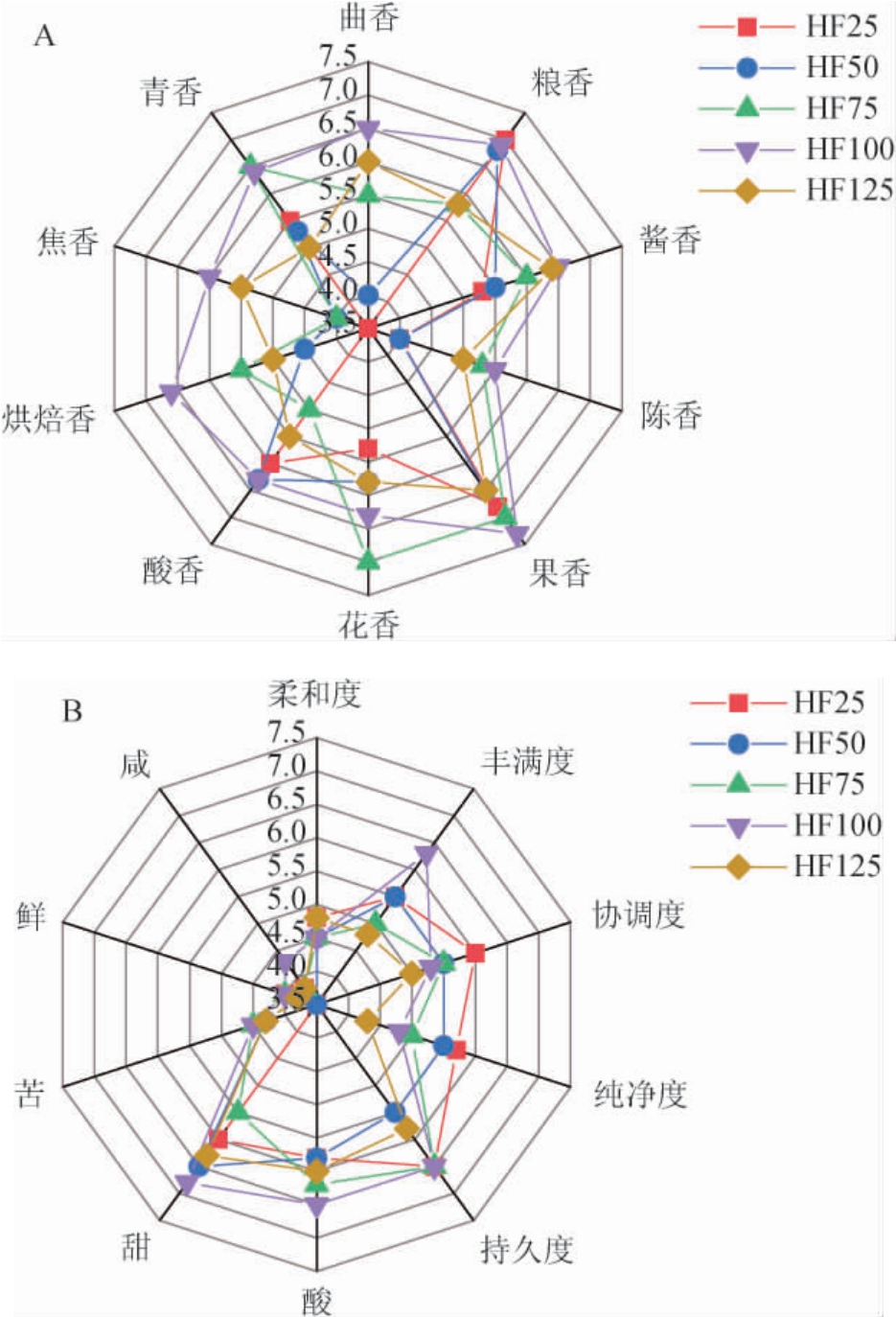
图6 不同投粮量翻沙酱酒的香气(A)、口味和口感(B)评分雷达图
Fig.6 Radar chart of aroma (A), taste and mouthfeel (B) score of"Fansha" sauce-flavor Baijiu with different sorghum input
由图6可知,在香气层面,不同方案翻沙酱酒的香气特征差异较大,整体的粮香和果香更突出,焦香、陈香较弱。HF25和HF50的香气特征较为接近,表现为粮香和果香突出,曲香、陈香、烘焙香、焦香不足;HF75的果香、花香、青香突出,但焦香不足;HF100协调平衡,每种香味都较突出;HF125的香气较均衡,突出香味不明显。在口味层面,翻沙酱酒整体的持久度较好,协调度、柔和度、丰满度、纯净度各有差异;在口感层面,翻沙酱酒的酸味、甜味明显,苦味、鲜味和咸味较弱;HF100整体表现最佳,甜味和酸味突出,苦味、鲜味和咸味协调。其次是HF75,甜味和酸味较突出,但咸味和鲜味稍显不足。
3 结论
酱香型白酒是中国白酒界的一大瑰宝,其风味形成的影响因素繁多。本研究深入分析了不同投粮量对翻沙酱酒的酒醅理化指标、微生物群落结构变化、基酒的挥发性风味物质以及感官评价的影响,并进一步探讨了出窖酒醅微生物群落与挥发性风味物质之间的相关性。发现在出窖酒醅的水分波动较大,酸度基本维持稳定,还原糖和淀粉含量随着高粱添加量的增加有所上升。酒醅的微生物群落结构解析结果显示,金山醋酸乳杆菌(Acetilactobacillus jinshanensis)是出窖酒醅绝对优势细菌,酿酒酵母(Saccharomyces cerevisiae)、粟酒裂殖酵母(Schizosaccharomyces pombe)、库氏毕赤酵母(Pichia kudriavzevii)是优势真菌。基酒的感官评价结果显示,随着粮食添加量增加,基酒的感官品质呈现提升后降低的趋势,HF100的感官品质最佳。综上,在翻沙工艺酱香型白酒的生产中,100 kg/t是高粱较适合的投入比例。本研究对翻沙工艺酱香型白酒生产中高粱的加入比例提供了一定的数据和理论支持,能够进一步指导翻沙酱酒基酒生产,提高丢糟的资源利用率。
[1]张治刚,张彪,赵书民,等.中国白酒香型演变及发展趋势[J].中国酿造,2018,37(2):15-18.
[2]WEI Y,ZOU W,SHEN C H,et al.Basic flavor types and component characteristics of Chinese traditional liquors:A review[J].J Food Sci,2020,85(12):4096-4107.
[3]王荣钰.酱香型不同轮次基酒理化特性及特征风味化合物研究[D].自贡:四川轻化工大学,2021.
[4]LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[5]胡鹏刚,邱树毅,李继杰.酱香大曲酒生产工艺关键环节与其风格质量的关系[J].酿酒科技,2010(8):36-39.
[6]张晓婕,邱树毅,曾庆军,等.不同工艺酱香型白酒挥发性物质差异分析[J].食品科学,2022,43(18):279-285.
[7]谭军辉,左垚.简述酱香型白酒新型生产工艺[J].酿酒,2020,47(4):32-35.
[8]李慧,范昭能,刘佩雄,等.优质酿酒高粱品种筛选比较试验初探[J].农业科技通讯,2021(12):117-120.
[9]杨甲平,王孝荣,蔡小波,等.夏季不同投粮量对酿酒生产的影响研究[J].酿酒科技,2021(8):76-80.
[10]王媚,李征,潘玲玲,等.不同前处理方法对酱香型白酒挥发性风味成分的影响[J].中国酿造,2023,42(12):143-152.
[11]安徽省质量技术监督局.DB34/T 2264—2014 固态发酵酒醅分析方法[S].合肥:安徽出版集团,2014.
[12]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 33404—2016 白酒感官品评导则[S].北京:中国标准出版社,2016.
[13]张翔,张福艳,周平,等.酱香轮次不同层次窖内发酵酒醅理化指标变化规律的分析研究[J].酿酒科技,2024(3):123-126.
[14]刘宏基,黄晓芬,余有贵,等.不同高度堆积发酵酱酒醅主要理化指标的比较研究[J].中国食品工业,2023(8):111-113.
[15]LI Z X,ZHOU J,LIANG H,et al.Differences in alpha diversity of gut microbiota in neurological diseases[J].Front Neurosci,2022,16:879318.
[16]TU W Y,CAO X N,CHENG J,et al.Chinese Baijiu:the perfect works of microorganisms[J].Front Microbiol,2022,13:919044.
[17]CHEN L Q,QIN X,WANG G Z,et al.Oxygen influences spatial heterogeneity and microbial succession dynamics during Baijiu stacking process[J].Bioresource Technol,2024,403:130854.
[18]REN T T,SU W,MU Y C,et al.Study on the correlation between microbial communities with physicochemical properties and flavor substances in the Xiasha round of cave-brewed sauce-flavor Baijiu[J].Front Microbiol,2023,14:1124817.
[19]黄慧芹,徐友强,李微微,等.北京地区酱香型白酒第四轮次入窖酒醅中微生物及风味物质的变化[J].食品工业科技,2024,45(1):97-107.
[20]袁宇轩,张紫瑗,李姝均,等.中国传统白酒风味酯合成研究进展[J].食品科技,2024,49(3):8-16.
[21]WANG W, XU Y, HUANG H, et al.Correlation between microbial communities and flavor compounds during the fifth and sixth rounds of sauce-flavor Baijiu fermentation[J].Food Res Int,2021,150:110741.
[22]HU Y L,WANG L Y,ZHANG Z J,et al.Microbial community changes during the mechanized production of light aroma Xiaoqu Baijiu[J].Biotechnol Biotec Eq,2021,35(1):487-495.
[23]陈丽花,任丽霞,李东娜,等.甜酒曲中优质酵母菌的分离鉴定及其产香特性分析[J].食品科学,2021,42(6):142-149.
[24]慕济锗.耐酸粟酒裂殖酵母在酱香型白酒酿造中的应用[D].天津:天津科技大学,2023.
[25]张学林,季斌,许玲,等.清香型大曲中产β-苯乙醇酵母的分离、鉴定及在白酒酿造中的应用[J].中国酿造,2022,41(1):123-127.
[26]倪冰倩,夏韩硕,闵伟红,等.Pichia kudriavzevii生物强化对酱香型白酒酒醅微生物群落结构及挥发性风味组分的影响[J].食品科学技术学报,2024,42(2):93-108.
[27]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of maotai flavor Baijiu[J].J Food Sci,2019,84(1):6-18.
[28]ZHANG M Z,WU X F,MU D D,et al.Profiling the influence of physicochemical parameters on the microbial community and flavor substances of Zaopei[J].J Sci Food Agr,2021,101(15):6300-6310.
[29]HAN Q A,SHI J L,ZHU J,et al.Enzymes extracted from apple peels have activity in reducing higher alcohols in Chinese liquors[J].J Agr Food Chem,2014,62(39):9529-9538.
[30]牛俊桀,史波林,汪厚银,等.酱香型白酒感官品质描述形成、发展与趋势[J].食品科学,2024,45(5):324-334.
[31]马宇,黄永光.清酱香型白酒挥发性风味组分及香气特征[J].食品科学,2019,40(20):241-248.
[32]张晶.酱香型白酒发酵过程脂肪酸合成核心微生物及其影响因素解析[D].无锡:江南大学,2023.
[33]梁龙元,王露,薛栋升.白酒酿造中酯酶及己酸乙酯的研究进展[J].酿酒,2018,45(1):17-23.
[34]GUAN Q J,MENG L J,MEI Z L,et al.Volatile compound abundance correlations provide a new insight into odor balances in sauce-aroma Baijiu[J].Foods,2022,11(23):3916.
[35]NIU Y W,YAO Z M,XIAO Q,et al.Characterization of the key aroma compounds in different light aroma type Chinese liquors by GC-olfactometry,GC-FPD,quantitative measurements,and aroma recombination[J].Food Chem,2017,233:204-215.
[36]GU X J, HAO D C, XIAO P G.Research progress of Chinese herbal medicine compounds and their bioactivities:Fruitful 2020[J].Chin Herb Med,2022,14(2):171-186.
[37]许忠平,梁明锋,张娇娇,等.不同地区酱香型白酒风格特征及风味物质构成差异相关性研究[J].中国酿造,2024,43(2):35-42.
[38]YAO L Y,ZHANG J,LU J,et al.Revealing the influence of microbiota on the flavor of kombucha during natural fermentation process by metagenomic and GC-MS analysis[J].Food Res Int,2023,169:112909.
[39]李群,林斌,柯锋,等.高产乙酸乙酯毕赤酵母筛选及其耐受性能研究