中国酒文化源远流长,从古至今,饮酒始终在人们的文化交流、社交活动中占有重要地位[1]。近几十年来,随着酒类品种的丰富和消费市场的扩大,白酒更是深入到大众日常生活及饮食当中,饮酒与健康之间的关系备受人们关注,亦是研究热点。现代医学研究表明,适量饮酒对促进机体健康有所裨益,如减轻抑郁、降低血压、减少心血管疾病和糖尿病发病率等[2-3]。然而,过量饮酒亦会对机体造成多方面的的损害,2023年,IM P K 等[4]调查发现,中国男性饮酒与61种疾病风险显著相关,包括肺癌、胃癌、白内障、六种消化系统疾病、精神疾病等。饮酒对脂质代谢,胆固醇的合成与分解亦是近年研究热点。已有研究指出,适量饮酒能够提升高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平,减轻高脂血症,有助于降低动脉粥样硬化的风险。过量饮酒,则被证实会导致高三酰甘油(triglyceride,TG)水平升高,增加动脉硬化、心血管疾病等的风险[5-6]。
随着“健康中国2030”规划纲要的提出,进一步强调合理饮酒,减少酒精对健康的负面影响,提高全民的健康水平。肝脏作为酒精代谢与脂质转运的主要器官,在饮酒过程中,两种功能可能同时受到影响,发生变化,还可能继发引起代谢疾病或心血管系统疾病[7]。目前,围绕合理饮酒推荐量,探究饮酒与机体肝脏功能、血脂水平、脂质代谢物变化关联及相关机制,尚鲜见报道。
本研究主要采用超高效液相色谱-四级杆静电场轨道阱高分辨率质谱(ultra high performance liquid chromatography-qua-drupole/electrostatic field orbitrap high resolutionmass spectrometry,UPLC-Q/Orbitrap-HRMS)非靶向代谢组学方法,选择SD大鼠为研究对象,分别给予低剂量(2.63mL/kg)和高剂量(5.25 mL/kg)的某品牌52°浓香型白酒及体积分数为52%乙醇(5.25 mL/kg),持续30 d,探究不同给酒剂量对SD大鼠脂质代谢物以及脂质代谢相关通路变化的影响,为探究饮酒与健康之间的关系提供了新的视角。同时助于提高公众对合理饮酒的认识,推动健康生活方式的普及。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物及酒样
无特定病原体(specific pathogen free,SPF)级SD大鼠(雌、雄各半,体质量200~210 g,6~8周龄):斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010。52°浓香型窖藏型白酒(许可证编号:SC11551050250069):泸州老窖股份有限公司。
1.1.2 化学试剂
谷丙转氨酶(alanine aminotransferase,ALT)试剂盒、谷草转氨酶(aspartate aminotransferase,AST)试剂盒:深圳迈瑞生物医疗电子股份有限公司;甘油三酯(triglyceride,TG)试剂盒、总胆固醇(total cholesterol,TC)试剂盒、高密度脂蛋白胆固醇(HDL-C)试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒:南京建成生物工程研究所;甲醇、乙腈、甲基叔丁基醚、甲酸铵、二氯甲烷、异丙醇(均为色谱纯):德国CNW Technologies GmbH公司。
1.2 仪器与设备
BS-240VET全自动生化分析仪:深圳迈瑞生物医疗电子股份有限公司;Vanquish超高液相色谱(UPLC)仪、Thermo Q Exactive Orbitrap高分辨质谱仪、Heraeus Fresco17离心机:美国Thermo Fisher Scientific公司;BSA124S-CW电子天平:赛多利斯(上海)贸易有限公司;JXFSTPRP-24研磨仪:上海净信科技有限公司;YM-080S超声仪:深圳市方奥微电子有限公司。
1.3 实验方法
1.3.1 动物分组和给酒方法
24只SPF级健康雌、雄SD大鼠,于(25±1)℃、相对湿度为(50±5)%的12 h光/暗循环环境中饲养一周后,按照体质量随机分为空白组、乙醇组、低剂量组、高剂量组,每组6只,雌雄各半。依据《中国居民膳食指南2016版》和美国疾病控制与预防中心推荐合理饮酒剂量设置低、高组给酒剂量[8-9]。上述指南推荐成人男性每日饮酒量不超过25 g 纯酒精,即成人男性52度白酒饮酒量不超过0.83 mL/(kg·d),换算为大鼠等效剂量5.25 mL/kg,设定为给酒高剂量,给酒低剂量为2.63 mL/kg,乙醇组按照5.25 mL/kg给予体积分数为52%乙醇,空白组给予等体积纯水,均采用灌胃给酒,1次/d。
各组大鼠连续灌胃至30 d,戊巴比妥钠40 mg/kg麻醉,腹主动脉取全血,离心,分离血清,-80℃冻存备用,剖取肝脏称质量,计算肝脏指数(肝脏指数=肝脏质量(g)/体质量(g))。
1.3.2 血清生化指标检测
各组大鼠血清样本,采用全自动生化仪检测大鼠血清肝功能指标ALT、AST和血脂指标TG、TC、HDL-C、LDL-C。使用TG、TC、HDL-C、LDL-C测试盒检测各组大鼠血脂生化指标含量,按照试剂盒要求进行操作,根据TG、TC、HDL-C、LDL-C测试盒说明书所提供的公式分别计算TG、TC、HDL-C、LDL-C 指标含量(mmol/L)。
1.3.3 脂质代谢组分的测定方法
脂质代谢组分采用UPLC-Q/Orbitrap-HRMS法测定。
样本处理:各组大鼠随机选用4个大鼠血清样本,移取100 μL样品,加入450 μL提取液(甲基叔丁基醚∶甲醇=5∶1,含内标L-α-溶血磷脂酰胆碱(L-alpha-lysophosphatidylcholine,LPC)、油酸-d7(oleoyl-d7)、1-戊十五酸酰基-2-油酸酰基-sn-甘油-3-磷酸乙醇胺-d7(1-pentadecanoyl-2-oleoylsn-glycero-3-phosphoethanolamine-d7),涡旋混合30 s,冰水浴超声10 min,-40 ℃冰箱静置1 h。将样品在4 ℃、3 000 r/min条件下离心15 min,取上清液,室温真空干燥1 h,加入100 μL的溶液(二氯甲烷∶甲醇=1∶1)进行复溶,涡旋30 s,冰水浴超声10 min,将样品4 ℃、12 000 r/min条件下离心15 min,取90 μL上清液用于UPLC-Q/Orbitrap-HRMS测定各组大鼠血清脂质代谢组分变化,所有样品另外取10 μL上清混合成质量控制(quality control,QC)样品上机检测,每4个检测样本中插入一个QC样品,以监测分析的重复性。
UPLC条件:Phenomen Kinetex C18色谱柱(2.1 mm×100 mm,1.7 m);柱温55 ℃,样品盘温度4 ℃;流动相速度0.3 mL/min,进样体积:正、负离子2 μL;流动相A为40%水和60%乙腈溶液,其中含10 mmol/L甲酸铵;B相为10%乙腈,90%异丙醇溶液,每1 000 mL中加入了50 mL的10 mmol/L甲酸铵水溶液;梯度洗脱:0~1.0 min,40%B;1.0~12.0 min,40%~100% B;12.0~13.5 min,100% B;13.5~13.7 min,100%~40%B;13.7~18.0 min,40%B。
质谱条件:质谱仪通过Xcalibur 4.0.27软件进行一级、二级质谱数据采集,采用电喷雾离子源正离子和负离子模式进行检测;鞘气流量:30 Arb,辅助气体流量:10 Arb,毛细管温度:320 ℃(正)或300 ℃(负),全毫秒分辨率:70 000,ms/ms分辨率:17 500,碰撞能量15 eV/30 eV/45 eV,喷雾电压:5 kV(正)或-4.5 kV(负)。
1.3.4 非靶向脂质代谢组学筛选差异代谢物及KEGG通路
富集分析
使用ProteoWizard3.0.24054软件将质谱原始转成mzXML格式。再使用XCMS矫正保留时间、识别峰、提取峰、对峰积分、对齐峰。基于XCMS软件(3.12.0)、R程序包及Lipidblast数据库进行脂质鉴定、数据质量评价和分析。使用SIMCA 16.0.2软件对数据和R数据包进行转换处理,进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)和模型检验以及作图。以变量投影重要性(variable importance in the projection,VIP)>1,P<0.05为条件筛选差异代谢物,再对大鼠血清差异代谢物进行KEGG通路富集分析,并以P<0.05为条件对富集的通路进行筛选。
1.3.5 数据处理
统计数据通过SPSS27.0软件进行数据整理分析,实验结果以“平均值±标准差”表示,各组数列均呈正态分布时采用单因素方差分析(analysis of variance,ANOVA),方差齐性用最小显著差异(least significant difference,LSD)法进行组间比较,方差非齐性用Dunnett's进行组间比较,1组及以上数列非正态分布时采用非参数检验,P<0.05 表示差异具有统计学意义,所有表格均使用Excel 2019绘制。
2 结果与分析
2.1 52°浓香型白酒连续给酒对大鼠体质量的影响
动物体质量是健康状况、营养状况以及肌肉、骨骼、脂肪和其他组织的质量的综合反映。
52°浓香型白酒连续给酒30 d对大鼠体质量的影响结果见表1。由表1可知,连续给酒过程中,每周测定各组大鼠体质量变化,各组大鼠体质量增长约为10~30 g,均呈正常增长状态。与空白组相比,乙醇组、低剂量给酒组、高剂量给酒组、大鼠连续给酒过程,体质量变化无显著差异(P>0.05);与乙醇组相比,高剂量给酒组、低剂量给酒组大鼠体质量变化在30 d连续给酒过程中无显著差异(P>0.05);与低剂量给酒组比较,高剂量给酒组鼠体质量变化无显著差异(P>0.05)。
表1 52°浓香型白酒连续给酒30 d对大鼠体质量的影响
Table 1 Effect of continuous administration of 52° strong-flavor Baijiu for 30 d on body mass of rats

组别 剂量/(mL·kg-1)空白组乙醇组低剂量组高剂量组——5.25 2.63 5.25第1天 第7天207.37±10.17 206.11±4.96 205.90±3.89 203.53±6.55 220.78±12.48 218.11±13.99 226.92±18.87 225.64±13.47小鼠体质量/g第14天 第21天 第28天225.85±20.12 232.24±7.29 241.95±28.84 232.41±15.97 244.53±11.82 243.76±18.41 269.55±38.11 248.84±24.56 255.75±30.82 248.74±11.36 283.52±42.64 258.77±30.15
2.2 52°浓香型白酒连续给酒对大鼠肝脏指数的影响
肝脏指数是指肝脏与体质量的比值,可以反映肝脏健康程度和机体的整体发育情况[10]。52°浓香型白酒连续给酒30 d对大鼠肝脏指数的影响结果见表2。
表2 52°浓香型白酒连续给酒30 d对大鼠肝脏指数的影响
Table 2 Effect of continuous administration of 52° strong-flavor Baijiu for 30 d on liver indexes of rats
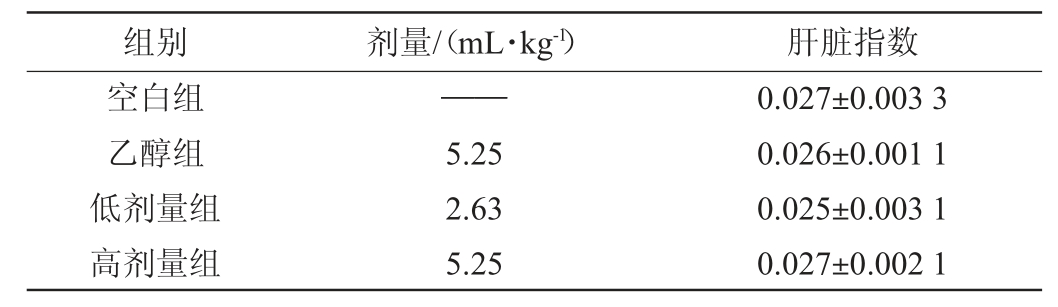
组别 剂量/(mL·kg-1) 肝脏指数空白组乙醇组低剂量组高剂量组——5.25 2.63 5.25 0.027±0.003 3 0.026±0.001 1 0.025±0.003 1 0.027±0.002 1
由表2可知,连续给酒30 d,与空白组相比,乙醇组、高剂量给酒组、低剂量给酒组大鼠的肝脏指数无显著差异(P>0.05);与乙醇组相比,高剂量组给酒组与低剂量给酒组大鼠肝脏指数无显著差异(P>0.05);与低剂量给酒组比较,高剂量给酒组大鼠肝脏指数亦无显著差异(P>0.05)。结果表明,52°浓香型白酒连续给酒30 d,未引起大鼠肝脏指数出现明显变化。
2.3 52°浓香型白酒连续给酒对大鼠肝功能指标的影响
在肝脏中,AST存在于肝细胞的线粒体内,ALT存在肝细胞的胞浆内,当肝脏开始出现损伤时,ALT升高,当肝细胞出现严重损伤时,会导致AST升高,因此ALT、AST常被用于检测肝功能损伤评价指标[11-12]。
52°浓香型白酒连续给酒30 d对大鼠肝功能指标的影响结果见表3。由表3可知,连续给酒30 d,与空白组相比,高剂量给酒组、低剂量给酒组大鼠血清ALT、AST指标无显著差异(P>0.05)。与乙醇组相比,高剂量组给酒组与低剂量给酒组大鼠血清ALT、AST指标无显著差异(P>0.05);与低剂量给酒组比较,高剂量给酒组大鼠血清ALT、AST指标亦无显著差异(P>0.05)。结果表明,52°浓香型白酒连续给酒30 d,未引起大鼠肝脏指标异常。
表3 52°浓香型白酒连续给酒30 d对大鼠肝功能指标的影响
Table 3 Effect of continuous administration of 52° strong-flavor Baijiu for 30 d on liver function indexes of rats
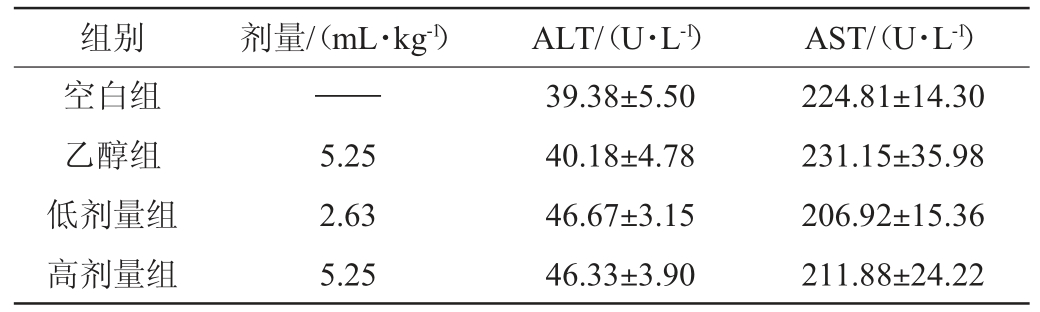
组别 剂量/(mL·kg-1) ALT/(U·L-1) AST/(U·L-1)空白组乙醇组低剂量组高剂量组——5.25 2.63 5.25 39.38±5.50 40.18±4.78 46.67±3.15 46.33±3.90 224.81±14.30 231.15±35.98 206.92±15.36 211.88±24.22
2.4 52°浓香型白酒连续给酒对大鼠血脂功能指标的影响
TC、TG、LDL-C、HDL-C是评价血脂水平常用指标,TC是血液中所有类型胆固醇的总和,包括LDL-C、HDL-C、极低密度脂蛋白胆固醇(VLDL-C)以及存在于血液中的其他形式的胆固醇。TG主要来源于食物中的脂肪,经过消化后被转运到体内各个组织,在体内作为能量储存。TG、TC、LDL-C含量异常升高时,易导致脂质堆积,使动脉硬化的风险升高[13];HDL-C有助于清除血管中的多余胆固醇,减少动脉粥样硬化的风险,但肝脏功能损伤时,HDL-C水平也可能降低[14]。
52°浓香型白酒连续给酒30 d对大鼠血脂功能的影响结果见表4。由表4可知,连续给酒30 d时,与空白组相比,低剂量组、高剂量组大鼠的TG、TC、LDL-C、HDL-C水平无显著差异(P>0.05),乙醇组大鼠TC水平显著升高(P<0.05);与乙醇组相比,高剂量组给酒组与低剂量给酒组大鼠TG、TC、LDL-C水平低于乙醇组,HDL-C指标水平高于乙醇组,但均无显著差异(P>0.05);与低剂量给酒组比较,高剂量给酒组大鼠TG、TC、LDL-C、HDL-C指标水平亦无显著差异(P>0.05)。
表4 52°浓香型白酒连续给酒30 d对大鼠血脂功能的影响
Table 4 Effect of continuous administration of 52° strong-flavor Baijiu for 30 d on blood lipid function of rats
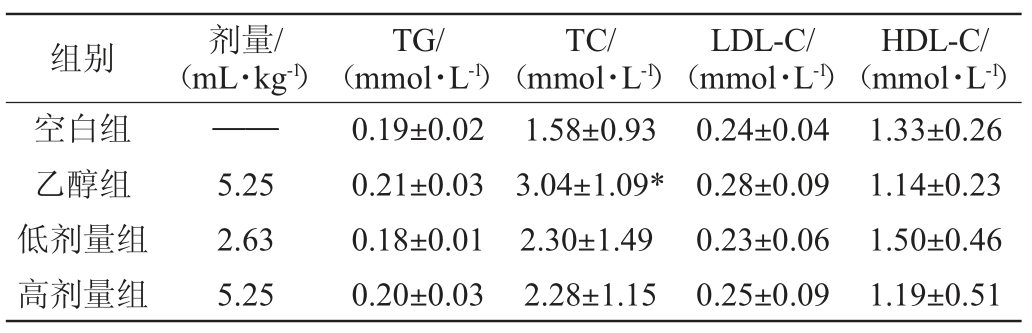
注:“*”表示与空白组比较,差异显著(P<0.05)。
组别 剂量/(mL·kg-1)TG/(mmol·L-1)TC/(mmol·L-1)LDL-C/(mmol·L-1)HDL-C/(mmol·L-1)空白组乙醇组低剂量组高剂量组——5.25 2.63 5.25 0.19±0.02 0.21±0.03 0.18±0.01 0.20±0.03 1.58±0.93 3.04±1.09*2.30±1.49 2.28±1.15 0.24±0.04 0.28±0.09 0.23±0.06 0.25±0.09 1.33±0.26 1.14±0.23 1.50±0.46 1.19±0.51
结果表明,按照25 g/d推荐剂量范围内饮酒,且控制饮酒时间,饮酒引起机体血脂紊乱、肝脏功能异常风险较小,且可能产生一定心血管保护作用。
2.5 52°浓香型白酒连续给酒对大鼠血清脂代谢组学分析
2.5.1 各给酒组大鼠血清脂代谢组分主成分分析
采用UHPLC-QE-MS测定空白组、乙醇组、低剂量组、高剂量组大鼠血清脂代谢组分,并对结果进行PCA,结果见图1。由图1可知,QC样品聚集性较好,说明仪器运行状态稳定,所得数据可靠;但空白组、乙醇组、各给酒组代谢物轮廓有一定差异,PCA未能完全有效区分所有样品。
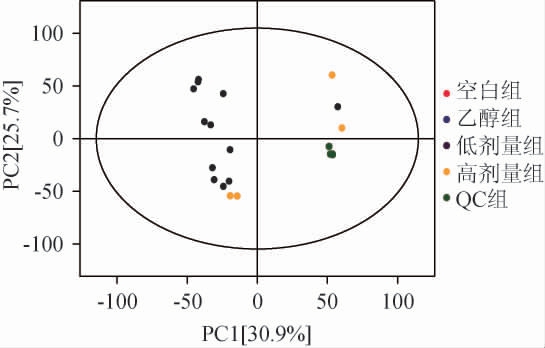
图1 52°浓香型白酒连续给酒30 d大鼠血清脂代谢组分主成分分析
Fig.1 Principal component analysis of blood lipid metabolites in rats continuously administrated with 52°strong-flavor Baijiu for 30 d
2.5.2 各给酒组大鼠血清脂代谢组分正交偏最小二乘-判别分析
为准确区分不同组样品的潜在特征物质,进一步对数据进行OPLS-DA,使各组样品间分离效果达到最高。OPLSDA模型得分图、置换检验结果见图2。由图2A~2E可知,连续给酒30 d,乙醇组与空白组、低剂量组与空白组、高剂量组与空白组样本、低剂量组与乙醇组、高剂量组与乙醇组能有效分开;结果表明,各组大鼠血清样本之间的OPLS-DA模型具有较好的可靠性和预测能力。

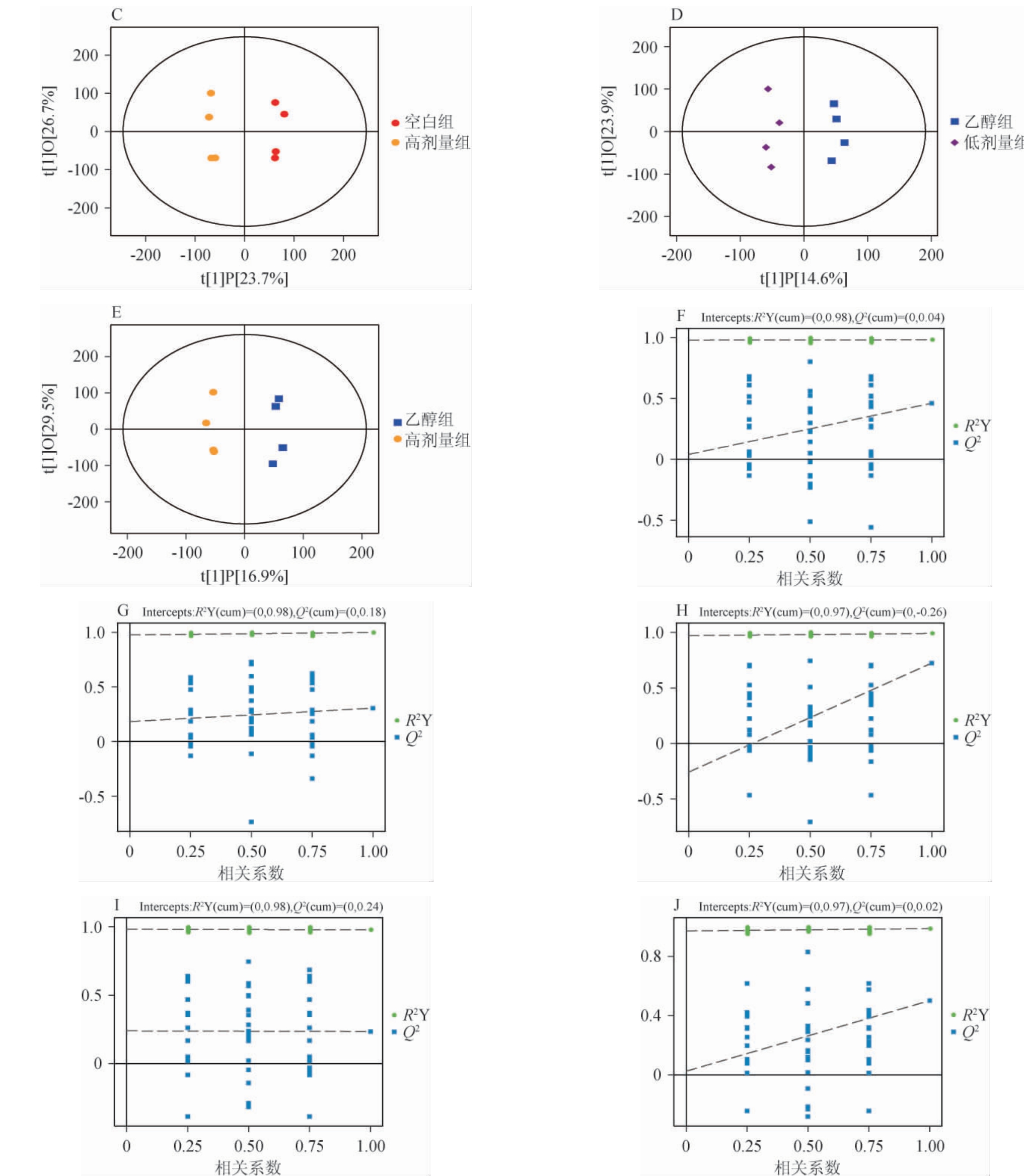
图2 52°浓香型白酒连续给酒30 d大鼠血清脂代谢组分正交偏最小二乘-判别分析模型得分图(A~E)及置换检验结果(F~J)
Fig.2 Orthogonal partial least squares-discriminant analysis model score plots (A-E) and permutation test results (F-J) of blood lipid metabolites in rats continuously administrated with 52° strong-flavor Baijiu for 30 d
由图2F~2J可知,模型200次置换检验结果表明,模型对Y轴方向模型的累积解释率(R2Y)>0.97,模型的预测能力(Q2)分别为0.04、0.18、-0.26、0.24、0.02,表明模型对数据未过拟合。
2.5.3 各给酒组大鼠血清差异脂质代谢物的筛选
在血清中总共检测和鉴定出814种脂质,其中包括甘油三酯类、磷脂酰胆碱类、酰基肉碱类、游离脂肪酸类物质,其中以甘油三酯类和磷脂酰胆碱类物质为主,分别有387种、166种,占比47.543%和20.393%。在正、负离子两种模式下,以VIP>1且P<0.05为筛选标准,筛选连续给酒30 d后各给酒组、乙醇组与空白组、给酒组与乙醇组之间的大鼠血清脂代谢差异脂质代谢物,结果见图3。由图3A可知,连续给予乙醇30 d,乙醇组与空白组共筛选出70种差异脂质代谢物,其中19种上调,排名前3的为TG(12:2/12:2/22:7)、ACar(14:0)、FA(16:1),51种下调,排名前三的为TG(18:2/22:6/22:6)、PC(18:2e/26:4)、PC(8:0/27:0)。
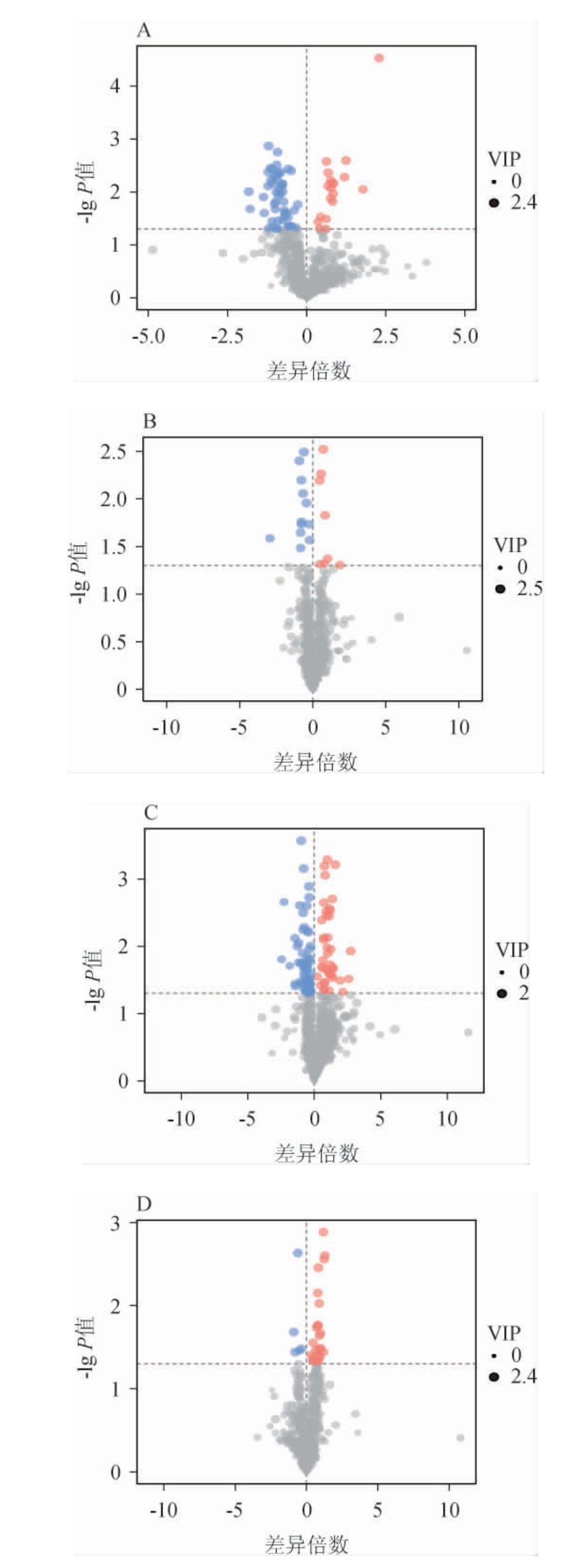
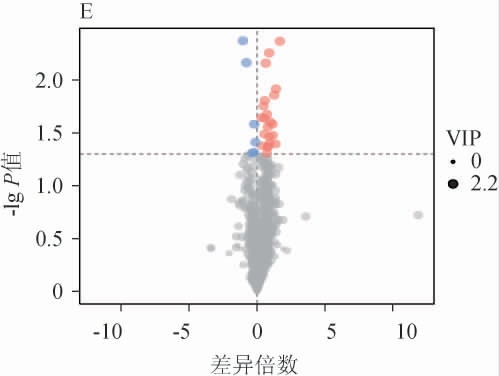
图3 各给酒组与空白组之间的差异脂质代谢物火山图
Fig.3 Volcano plots of differential lipid metabolites between each treatment group and control group
红色代表差异代谢物显著上调,蓝色表示差异代谢物显著下调,灰色为无显著差异代谢物。
由图3B可知,连续给酒30 d,低剂量组与空白组共筛选出20种差异脂质代谢物,其中8种上调,排名前3的为TG(12:2/12:2/22:7)、羟基脂肪酸的脂肪酸酯(fatty acid ester of hydroxyl fatty acid,FAHFA)(18:1/18:0)、TG(12:0/12:2/12:2),12种下调,排名前3的为TG(13:0/13:0/21:5)、TG(18:3/20:4/20:5)、鞘磷脂(sphingomyelin,SM)(d14:0/23:1)。由图3C可知,连续给酒30 d,高剂量组与空白组共筛选出99种差异脂质代谢物,其中40种上调,排名前3的为TG(12:2/12:2/22:7)、TG(16:0/17:0/20:1)、TG(12:0/18:2/18:2),59种下调,排名前3为磷脂酰胆碱(phosphatidylcholine,PC)(16:0e/21:2)、二酰基甘油三甲基高丝氨酸(diacylglyceryl trimethylhomo-serine,DGTS)(2:0/15:0)、PC(16:2e/23:0)。三组间显著上调的差异代谢物中有5种相同,为FA(16:2)、FAHFA(18:1/18:0)、PC(13:1/21:2)、TAG(12:2/12:2/22:7)、PC(16:0/18:1),但无相同下调的差异代谢物。
由图3D可知,连续给酒30 d,低剂量组与乙醇组共筛选出30种差异脂质代谢物,其中25种上调,排名前三的是PC(14:0e/24:4)、PC(16:2e/24:4)、PC(14:0e/20:2),5种下调,排名前三的是PC(14:1e/4:0)、LPC(20:5)、LPC(22:6)。由图3E可知,高剂量组与乙醇组共筛选出28种差异脂质代谢物,其中22种上调,排名前三的是TAG(18:2/18:3/18:3)、TAG(18:1/22:4/22:6)、PC(8:0/27:0),6种下调,排名前三的是Cer/BS(d21:1/15:0)、Cer/BS(d14:1/20:0)、FA(18:1)。与乙醇组相比,低剂量组和高剂量组相同上调的差异脂质代谢有8种,包括TAG(20:4/20:5/22:6)、PC(8:0/27:0)、TAG(20:4/20:4/22:4)、TAG(18:1/18:1/22:5)、TAG(13:0/22:2/22:2)、TAG(18:1/22:4/22:6)、TAG(18:1/22:5/22:6)、酰基葡萄糖醛酸糖脂(acylglucuronosyldiacylglycerol,AcylGlcADG)(16:0/16:0/20:2)。下调的相同差异代谢物为LPC(20:4)。
进一步通过脂质气泡图分析各给酒组与空白组、给酒组与乙醇组之间差异脂质代谢物相对含量变化,结果见图4。由图4A可知,连续给酒30 d,乙醇组与空白组相比,游离脂肪酸亚类、甘油三酯亚类物质、磷脂酰胆碱亚类物质变化显著。由图4B和4C可知,连续给酒30 d,低剂量组、高剂量组与空白组相比,TG亚类物质变化较显著;由图4D和4E可知,连续给酒30 d,低、高剂量组与乙醇组相比TG亚类物质变化较显著。此外乙醇组与空白组相比游离脂肪酸和酰基肉碱类脂质代谢物出现一定程度的变化。

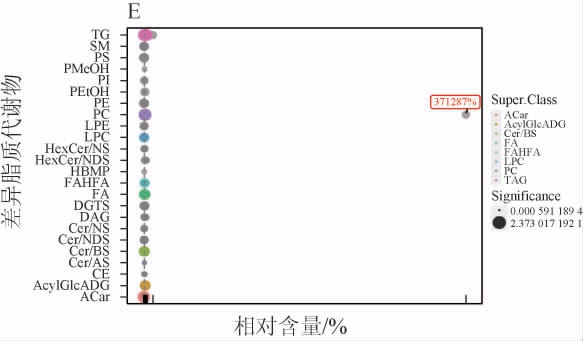
图4 各给酒组与空白组之间的差异脂质代谢物气泡图
Fig.4 Bubble plots of differential lipid metabolites between each treatment group and control group
彩色的点表示P<0.05,灰色的点表示P>0.05。
据已有研究报道,上述脂质类物质和脂质代谢调节关系密切。FA可以与甘油结合生成TG,FA异常升高,会导致脂质摄取和储存增加,进而引发代谢紊乱[15];TG与冠状动脉粥样硬化密切相关,TG含量升高,会介导高密度脂蛋白(high-density lipoprotein,HDL)中的胆固醇酯向极低密度脂蛋白(very low density lipoprotein,VLDL)和低密度脂蛋白(low-density lipoprotein,LDL)的转移,使HDL颗粒变小更易被代谢清除,从而导致血浆中HDL水平下降,而VLDL中的胆固醇酯含量升高后,可引起LDL-C含量升高,加重心血管疾病风险[16-17]。这或许是实验中观察到乙醇组出现TC含量显著升高的原因。PC对VLDL组装发挥重要作用,PC合成增加时会刺激VLDL颗粒分泌,VLDL颗粒可以将肝脏中的TG运输到组织中进行代谢和利用,当VLDL颗粒分泌增加时,会导致血浆中TG水平升高[18]。当PC含量异常下降时,ATP结合盒A1和肝脏清道夫受体B1表达升高,会造成肝脏中HDL合成会受到抑制,循环中HDL摄取会增加,导致血浆中HDL水平下降[19]。另有研究报道,在酒精性脂肪肝模型小鼠血浆中多种TG和PC相对含量变化显著,上述报道与此次脂质代谢组学结果相印证[20]。乙醇组的FA、TG、PC相对量与空白组相比变化显著,这可能是造成乙醇组大鼠血脂指标TG和LDL-C水平有升高趋势,TC水平显著升高的原因。
2.5.4 各给酒组大鼠血清差异代谢物通路富集分析
各给酒组大鼠血清差异代谢物通路富集分析结果见图5。由图5A可知,连续给酒30 d,与空白组比较,乙醇组脂质差异代谢物富集通路较为复杂,共有16条,包含其中与脂质代谢密切相关的通路包括甘油磷脂代谢通路、亚油酸代谢通路、甘油酯代谢通路、脂肪酸延长、降解通路、α-亚麻酸代谢通,此外还涉及脂质和动脉粥样硬化、胰岛素抵抗等通路。由图5B可知,低剂量给酒组大鼠差异脂质代谢物富集通路有7条,其中与脂质代谢密切相关的通路包括甘油磷脂代谢通路、亚油酸代谢通路、α-亚麻酸代谢通路、花生四烯酸代谢通路。由图5C可知,高剂量给酒组大鼠血清差异代谢物富集通路有10条,其中与脂质代谢密切相关通路为甘油磷脂代谢、亚油酸代谢、α-亚麻酸代谢、脂肪酸的延长、降解、以及不饱和脂肪酸的生物合成通路。
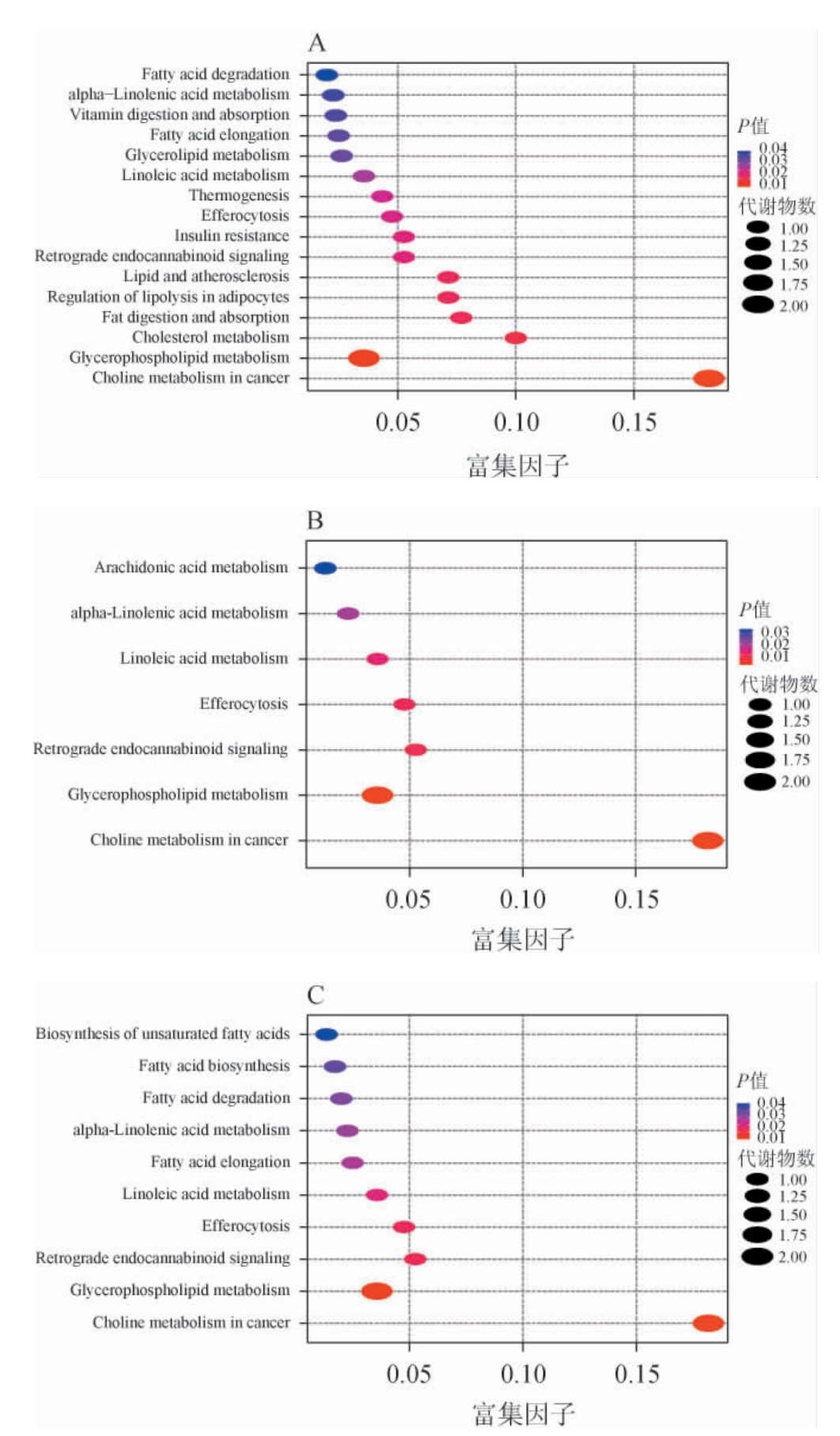
图5 各给酒组与空白组差异脂质代谢物KEGG富集分析气泡图
Fig.5 Bubble plots of KEGG enrichment analysis for differential lipid metabolites between each treatment group and control group
富集因子为KEGG通路中注释到的差异代谢物数量与该通路中所有代谢物数量的比值,其值越大富集程度越大。气泡颜色代表P值,一般认为P<0.05认为该功能为显著富集项;气泡越大代表富集到该通路的代谢物数目越多。
与空白组相比,各给酒组与乙醇组引起脂质代谢变化相关通路都包括甘油磷脂代谢、亚油酸和α-亚麻酸代谢通路。甘油磷脂是细胞膜重要组成部分、参与细胞信号转导,含量异常时可引起血脂、血糖异常,与二型糖尿病和心血管疾病密切相关[21]。PC是甘油磷脂的重要组成部分,PC代谢异常可引起内皮细胞凋亡和内膜功能障碍、引起血管平滑肌增殖和泡沫细胞的形成,导致动脉粥样硬化斑块的形成[22]。亚油酸和α-亚麻酸是两种重要多不饱和脂肪酸,与体内炎症反应和脂质水平相关。亚油酸可代谢为花生四烯酸(arachidonic acid,AA)参与促炎反应,α-亚麻酸可代谢生成二十碳五烯酸(eicosapentaenoic acid,EPA)及二十二碳六烯酸(docosahexaenoic acid,DHA),参与抗炎反应、降低血液中的LDL-C水平,两者代谢紊乱可导致炎症性疾病和脂质代谢紊乱风险增加[23-24]。乙醇组、高剂量组与脂质代谢相关的富集通路还涉及脂肪酸的延长与降解以及不饱和脂肪酸的合成,这与以往研究报道,连续对小鼠灌胃白酒后,发现脂肪酸合成途径变化一致[26]。脂肪酸作为甘油三酯合成的主要分子,其合成和降解对调控甘油三酯合成、调节肝脏脂质沉积和改善血脂异常至关重要,脂肪酸代谢异常与血脂紊乱、代谢疾病发生密切相关[25]。
与白酒组比较,乙醇组大鼠差异脂质代谢物富集通路还涉及胰岛素抵抗通路和脂质与动脉粥样硬化通路。胰岛素抵抗与甘油三脂和脂肪酸水平异常升高相关,这与代谢组学发现乙醇组TG和FA相对含量变化明显相一致,体内高水平甘油三酯,会引起多种脂质信号分子(如长链酰基肉碱、二酰基甘油和鞘氨醇等)异常升高,进而激活应激反应性丝氨酸激酶,使胰岛素细胞表面受体激活受阻,同时抑制胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)磷酸化,下游信号分子蛋白激酶B/Akt活性下降,降低胰岛素功能,引起糖尿病及其他代谢疾病[27]。而游离脂肪酸含量升高会降低胰岛素敏感性,加重胰岛素抵抗[28]。
3 结论
本次研究结果表明,依据国内外健康指南标准,25 g/d推荐剂量范围内,连续给予52°白酒及体积分数52%乙醇30 d,不会明显影响大鼠肝功能,但乙醇组大鼠TC水平显著升高,并且TG、LDL-C水平呈现升高的趋势,表明连续饮用白酒安全性高于等剂量乙醇。通过非靶向脂质代谢组学技术共鉴定出814种脂质代谢物,主要的脂质种类为甘油三酯类和磷脂酰胆碱类。与空白组相比,随着剂量的加大,给予白酒后变化的脂质数量越多。KEGG分析结果表明,给予乙醇和该浓香型白酒后,差异脂质代谢物富集与脂质代谢相关的通路为甘油磷脂、亚油酸、α-亚麻酸代谢通路。此次研究还发现给予乙醇后差异代谢物还会富集于脂质与动脉粥样硬化和胰岛素抵抗通路,使其引起代谢紊乱、心血管系统疾病风险加大。
本研究结果为探索合理饮酒与脂质代谢之间的关系提供了有效的实验依据,同时为推动公众合理饮酒理念的普及和提升全民健康水平具有积极促进作用。本次实验仅以正常大鼠为研究对象,未探讨饮酒对机体其他状态的影响。未来研究可考虑采用不同疾病模型,模拟多样化的生理或病理状态,以深入分析饮酒对脂质代谢的不同作用。此外,本次研究结果表明,饮酒过程涉及多个生物通路,未来可结合蛋白质组学等技术,进一步测定和验证相关通路,探索饮酒对脂质代谢的具体机制。
[1]TANG Y L,XIANG X J,WANG X Y,et al.Alcohol and alcohol-related harm in China:Policy changes needed[J].B World Health Organ,2013,91(4):270-276.
[2]孙亮亮,谢虹,张艳芳,等.饮酒与糖尿病及其心血管疾病关系的研究进展[J].牡丹江医学院学报,2019,40(2):123-126,130.
[3]GALL N.Is wine good for your heart?A critical review[J].Postgrad Med J,2001,77(905):172-176.
[4]IM P K,WRIGHT N,YANG L,et al.Alcohol consumption and risks of more than 200 diseases in Chinese men[J].Nat Med,2023,29(6):1476-1486.
[5]任金霞,骆雷鸣.饮酒对心血管系统影响的双向效应争论中的共识与分歧[J].中国全科医学,2022,25(30):3747-3754.
[6]李钰,张欢,饶家权,等.适量白酒对动脉粥样硬化大鼠血脂及炎性因子的影响[J].现代预防医学,2017,44(13):2347-2350.
[7]相芳萍.解酒保肝方治疗酒精性脂肪肝大鼠疗效及作用机制研究[D].沈阳:辽宁中医药大学,2016.
[8]刘银,周玲旭,杨官荣,等.白酒对大鼠血脂及脂代谢关键酶影响的研究[J].现代预防医学,2017,44(22):4151-4155.
[9]GOEL S,SHARMA A,GARG A.Effect of alcohol consumption on cardiovascular health[J].Curr Cardiol Rep,2018,20(4):19.
[10]王宇,王涵,肖乾等.蓝刺头黄酮对小鼠血液生理、生化指标和脏器指数、组织病理学的影响[J].黑龙江畜牧兽医,2023(21):107-110,116.
[11]杭环,袁俊,朱殊.肝功能及血清学指标联合诊断脂肪肝的临床意义[J].系统医学,2023,8(7):86-89.
[12]何秀义,安祯祥,何远利,等.安五脂素改善大鼠肝纤维化的效果及机制[J].中国药房,2023,34(20):2459-2464.
[13]袁蕾,苗芳元,张梦琳,等.血清PUFA水平与脑梗死患者总胆固醇、甘油三酯、LDL-C及HDL-C水平及预后的关系[J].临床和实验医学杂志,2023,22(7):685-689.
[14]杨景萍.血清甘油三酯及总胆固醇检测在诊断脂肪肝中的应用价值[J].当代医药论丛,2020,18(11):3-4.
[15]HENDERSON G C.Plasma free fatty acid concentration as a modifiable risk factor for metabolic disease[J].Nutrients,2021,13(8):2590.
[16]ITO F,ITO T.High-density lipoprotein(HDL)triglyceride and oxidized HDL:new lipid biomarkers of lipoprotein-related atherosclerotic cardiovascular disease[J].Antioxidants,2020,9(5):362.
[17]RIKHI R, SCHAICH C L, HAFZALLA G W, et al.Small dense lowdensity lipoprotein cholesterol and coronary artery calcification in the multi-ethnic study of atherosclerosis[J].Eur J Prev Cardiol,2024,31(8):1048-1054.
[18]VAN DER VEEN J N,KENNELLY J P,WAN S,et al.The critical role of phosphatidylcholine and phosphatidylethanolamine metabolism in health and disease[J].BBA-Gen Subjects,2017,1859(9):1558-1572.
[19]COLE L K,VANCE J E,VANCE D E.Phosphatidylcholine biosynthesis and lipoprotein metabolism[J].Biochim Biophys Acta,2012,1821(5):754-761.
[20]KOELMEL J P,TAN W Y,LI Y,et al.Lipidomics and redox lipidomics indicate early stage alcohol-induced liver damage[J].Hepatol Commun,2022,6(3):513-525.
[21]CHEN S,WU Q,ZHU L,et al.Plasma glycerophospholipid profile,erythrocyte n-3 PUFAs, and metabolic syndrome incidence: a prospective study in Chinese men and women[J].Am J Clin Nutr, 2021, 114(1):143-153.
[22]SU D, LIAO L, ZENG Q, et al.Study on the new anti-atherosclerosis activity of different Herba patriniae through down-regulating lysophosphatidylcholine of the glycerophospholipid metabolism pathway[J].Phytomedicine,2022,94:153833.
[23]MARANGONI F,AGOSTONI C,BORGHI C,et al.Dietary linoleic acid and human health:Focus on cardiovascular and cardiometabolic effects[J].Atherosclerosis,2020,292:90-98.
[24]WEN Y,SHANG Y,WANG Q,et al.Exploration of the mechanism of linoleic acid metabolism dysregulation in metabolic syndrome[J].Genet Res,2022,2022:e8.
[25]吕丹,金迪,隋国媛,等.基于AMPK调控ACC/CPT1信号通路介导脂肪酸代谢探究化瘀祛痰方含药血清对HepG2细胞脂质沉积的影响[J].中华中医药学刊,2024,42(3):194-197,286.
[26]JI M,FANG C,JIA W,et al.Regulatory effect of volatile compounds in fermented alcoholic beverages on gut microbiota and serum metabolism in a mouse model[J].Food Funct,2021,12(12):5576-5590.
[27]MUOIO D M.Intramuscular triacylglycerol and insulin resistance: guilty as charged or wrongly accused?[J].BBA-Mol Cell Biol Lipids,2010,1801(3):281-288.
[28]张文彤,姜丽,房文洁,等.葛根芩连汤对胰岛素抵抗大鼠肝脏能量代谢及游离脂肪酸的影响[J].中药新药与临床药理,2024,35(5):615-622.