喹诺酮类(quinolones)是一类含有4-喹诺酮母核的人工合成抗菌药物,具备广谱的抗菌效果,它们通过抑制细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)合成酶的活性,干扰细菌DNA复制和转录的进程,从而实现了对细菌生长和复制的有效抑制[1]。目前,喹诺酮类药物已经成为食品动物饲养中最重要的抗感染药物之一,但由于细菌对喹诺酮类药物耐药性的产生和某些喹诺酮类药物的潜在致癌作用[2],其残留问题已引起广泛关注。欧盟、美国、日本均制定了喹诺酮类兽药最大残留限量(maximum residue limits,MRLs),中华人民共和国农业部公告第2292号也规定自2016年12月31日起,停止经营、使用用于食品动物的洛美沙星、培氟沙星、氧氟沙星、诺氟沙星4种原料药的各种盐、酯及其各种制剂。
在奶牛饲养过程中,喹诺酮类常被用于防治疾病,若使用过量或休药期不足,会造成喹诺酮类残留在牛奶中,并由此进入食物链,进而对人类的健康造成危害。我国于2002年公布的《中华人民共和国农业部公告第235号》规定了部分喹诺酮类在奶类产品种的最大残留限量(MRLs),为做到食品安全预警,保证消费者健康,研究建立一种高效、准确的牛奶中喹诺酮类残留分析技术十分必要。
目前,喹诺酮类药物的检测方法在国内外均有报道,主要包括以下几种技术:微生物法简单且适用于大规模筛查,但灵敏度较低,检测范围有限,且存在误差较大的问题[3];电化学法具有较高的灵敏度和快速检测的优点,但对仪器设备和检测环境要求较高[4-5];免疫分析法灵敏度高、特异性强,适用于快速筛查,但开发和验证成本较高,且可能受到抗体的稳定性和特异性的限制[6];包括荧光光谱法[7]、化学发光法[8]和表面增强拉曼光谱法[9]等的光谱法,这类方法通常灵敏度高、特异性强,但样品前处理复杂,仪器要求高,应用范围受限。液相色谱[10-12]以及液相色谱串联质谱法[13-14]是目前应用最广泛的喹诺酮类药物检测技术,具有高分离能力和高灵敏度,尤其适合复杂基质样品的检测。液相色谱串联质谱法[15-18]因其高特异性和高灵敏度,成为检测喹诺酮类药物残留的主流方法。牛奶中的蛋白质、脂肪等干扰物质的去除是检测牛奶中兽药残留的关键步骤,现有的净化方法液液萃取[19]、常规固相萃取[20-21]、分散固相萃取[22-24]等往往步骤繁琐、耗时长,难以满足高通量检测的需求。
本研究创新性地引入了Ostro样品制备板,用于牛奶中喹诺酮类药物的高通量提取与净化。为评估Ostro样品板制备方法的有效性,本研究还与传统的QuEChERS法[25]和HLB净化法结果进行对比分析,再结合液相色谱串联质谱法对牛奶中喹诺酮类药物残留进行测定,旨在为牛奶中的喹诺酮类药物残留检测提供高效、可靠的技术方案。
1 材料与方法
1.1 材料与试剂
恩诺沙星(enrofloxacin,ENR)、环丙沙星(ciprofloxacin,CIP)、培氟沙星(pefloxacin,PEF)、氧氟沙星(ofloxacin,OFX)、诺氟沙星(norfloxacin,NOR)、洛美沙星(lomefloxacin,LOM)、恩诺沙星-D5同位素(Enrofloxacin-D5,ENR-D5)、环丙沙星-D8盐酸盐同位素(ciprofloxacin-D8 hydrochloride,CIP-D8)、诺氟沙星-D5同位素(norfloxacin-D5,NOR-D5):(均为100 μg/mL):坛墨质检标准物质中心。乙腈、甲醇、甲酸、正己烷(均为色谱纯):美国Fisher公司;Ostro样品制备板(96孔,25 mg)、HLB固相萃取柱:美国Waters公司;C18粉末、N-丙基乙二胺(primary secondary amine,PSA)粉末:美国安捷伦科技有限公司。
1.2 仪器与设备
QTRAP5500超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)仪(配有电喷雾离子源及Analyst数据处理系统):美国AB SCIEX公司;XS205分析天平:瑞士Mettler公司;TE212-L电子天平:德国Sartorius公司;多道可调量程移液器:德国VITLAB公司;Multifuge X3R高速台式冷冻离心机:美国Thermo Fisher公司;正压96孔提取装置:美国Waters公司。
1.3 实验方法
1.3.1 标准溶液配制
分别吸取恩诺沙星、环丙沙星、培氟沙星、氧氟沙星、诺氟沙星、洛美沙星标准溶液0.1 mL于10 mL容量瓶中,用甲醇定容,配制质量浓度为1 000 ng/mL混合外标工作液;分别吸取恩诺沙星-D5、环丙沙星-D8盐酸盐同位素、诺氟沙星-D5同位素0.01 mL于10 mL容量瓶中,用甲醇定容,配制质量浓度为100 ng/mL氘代混合内标工作溶液,-(18±2)℃冷冻避光保存。在空白基质中分别加入适量混合内、外标工作溶液,按样品前处理相同步骤制备为6个不同质量浓度标准溶液(5.00 ng/mL、10.0 ng/mL、20.0 ng/mL、50.0 ng/mL、100ng/mL、200ng/mL),内标法(内标质量浓度为10.0 ng/mL)绘制工作曲线。
1.3.2 样品净化条件
Ostro样品制备板法:取0.50 g牛奶试样至样品制备板的板孔中,加入50 μL混合内标溶液,加入450 μL含0.2%甲酸的乙腈溶液,用移液枪反复抽吸充分混合均匀,将样品板涡旋混合1 min,然后将样品板置于正压96孔提取装置上,收集提取液于圆孔收集板中,蒸干并用50 μL 5%甲醇复溶,经0.22 μm滤膜过滤后供液相色谱串联质谱仪测定。
QuEChERS法[25]:取2.0 mL牛奶样品,加入8.0 mL 0.2%甲酸-乙腈,涡旋混合1 min,振荡提取5 min,超声提取5 min,以8 000 r/min离心5 min,取上清液待净化转移到15 mL QuEChERS净化管,涡旋混合1 min,8 000 r/min离心5 min,取5.0 mL上清液于40 ℃氮吹至近干,用10%乙腈水溶液定容至1.00 mL,涡旋混匀,过0.22 μm微孔滤膜,供液相色谱串联质谱仪测定。
HLB净化法:参照GB 29692—2013《食品安全国家标准牛奶中喹诺酮类药物多残留的测定高效液相色谱法》中方法二进行前处理,采用液相色谱串联质谱法测定。
1.3.3 超高效液相色谱-串联质谱条件
液相色谱条件:CORTECS UPLCR CSHTM C18色谱柱(100 mm×2.1 mm,1.6 μm);流动相A为水(含0.1%甲酸,5 mmol/L甲酸铵),B相为乙腈溶液;梯度洗脱程序为0~1 min,5%B;1~3.5 min,5%~30%B;3.5~5 min,30%~30%B;5.0~7.0 min,30%~95% B;7.0~9.0 min,95% B;9.1~12 min,5%B;流速0.3 mL/min;进样量3 μL;柱温40 ℃。
质谱条件:电喷雾电离(electrospray ionization,ESI)源,正模式扫描;扫描模式为多反应监测(multiple reaction monitoring,MRM)模式;喷雾电压5 500 V;离子源温度550 ℃;气帘气206.9 kPa;碰撞气Medium;雾化气103.4 kPa;辅助雾化气103.4 kPa。定性、定量离子对、去簇电压、碰撞能量、保留时间等参数见表1。
表1 目标化合物及其内标的质谱参数
Table 1 Mass spectrum parameters of target compounds and their internal standards

待测物 MRM离子对(m/z) 去簇电压/V 碰撞能量/eV 保留时间/min ENR 80 4.6 CIP 360.1/361.1*360.1/245.1 332.1/288.1*332.1/245.1 80 28 36 25 33 4.4
续表
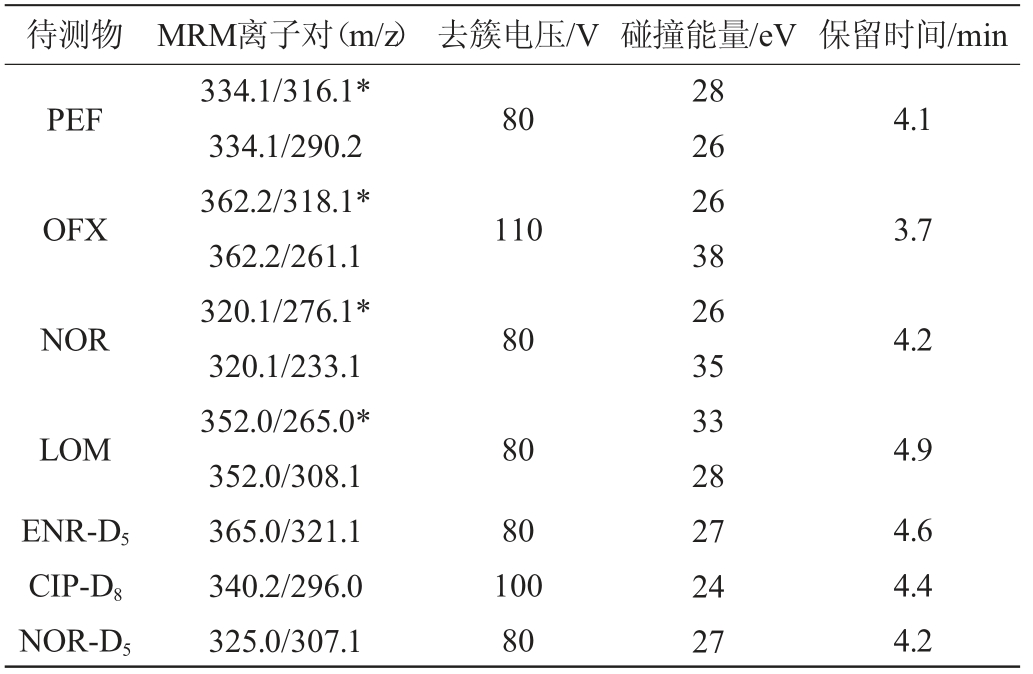
注:“*”表示定量离子。
待测物 MRM离子对(m/z) 去簇电压/V 碰撞能量/eV 保留时间/min PEF 80 4.1 OFX 110 3.7 NOR 80 4.2 LOM ENR-D5 CIP-D8 NOR-D5 334.1/316.1*334.1/290.2 362.2/318.1*362.2/261.1 320.1/276.1*320.1/233.1 352.0/265.0*352.0/308.1 365.0/321.1 340.2/296.0 325.0/307.1 80 80 100 80 28 26 26 38 26 35 33 28 27 24 27 4.9 4.6 4.4 4.2
定性定量方法:根据保留时间定性,标准曲线内标法定量。
1.3.4 数据分析
采用仪器配套MultiQuant 3.0.2和Office Excel 2021进行数据处理,利用Origin 2022 绘图。
2 结果与分析
2.1 提取溶剂优化
喹诺酮类药物常用的提取液一般为甲醇、乙腈、二氯甲烷等有机溶剂,或在有机溶剂添加一定比例的酸或碱。鉴于乙腈的沉淀蛋白能力和共萃取物少的特点,选择乙腈并添加一定酸体系作为提取溶剂,对不同甲酸加入量(0%、0.1%、0.2%、0.5%、1%)进行优化,考察不同提取溶剂对ENR、CIP、PEF、OFX、NOR、LOM回收率的影响,结果见图1。由图1可知,0.2%甲酸-乙腈对6种喹诺酮类药物的提取效果最好,6种喹诺酮类药物的回收率范围为86.7%~99.5%,平均回收率为93%,所以本研究选择0.2%甲酸-乙腈作为提取溶剂。
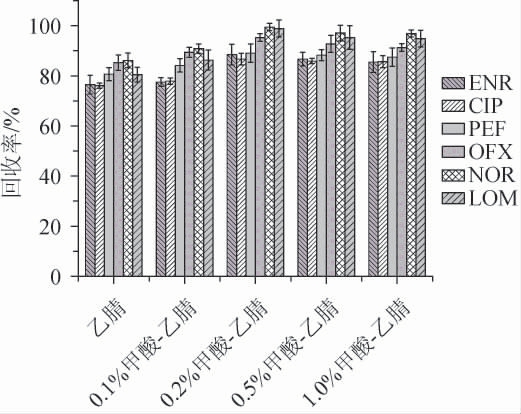
图1 不同提取溶剂对喹诺酮类物质回收率的影响
Fig.1 Effect of different extraction solvents on recovery rates of quinolones
2.2 净化条件优化
牛奶中含有丰富的蛋白质和磷脂,是质谱检测的干扰物质,在样品预处理过程中,蛋白通常通过沉淀和离心被去除。然而,大量脂肪和磷脂随着目标待测物一起被共提取出来,这些共提物的存在可能会干扰液相色谱-质谱联用仪分析、污染色谱柱和其他组件,并且还会污染质谱仪。目前,常采用正己烷液-液分配、固相萃取或QuEChERS法去除脂肪等杂质,但均对磷脂的去除能力较弱。Ostro样品制备板因其对磷脂具有很强的吸附能力,可以应用到牛奶样品的前处理。因此本研究在5.0 μg/kg的加标水平下考察QuEChERS法、HLB固相萃取、Ostro样品制备板三种净化方式的净化效果,结果见表2。
表2 不同净化方法喹诺酮类物质的平均回收率
Table 2 Average recovery rates of quinolones with different purification methods
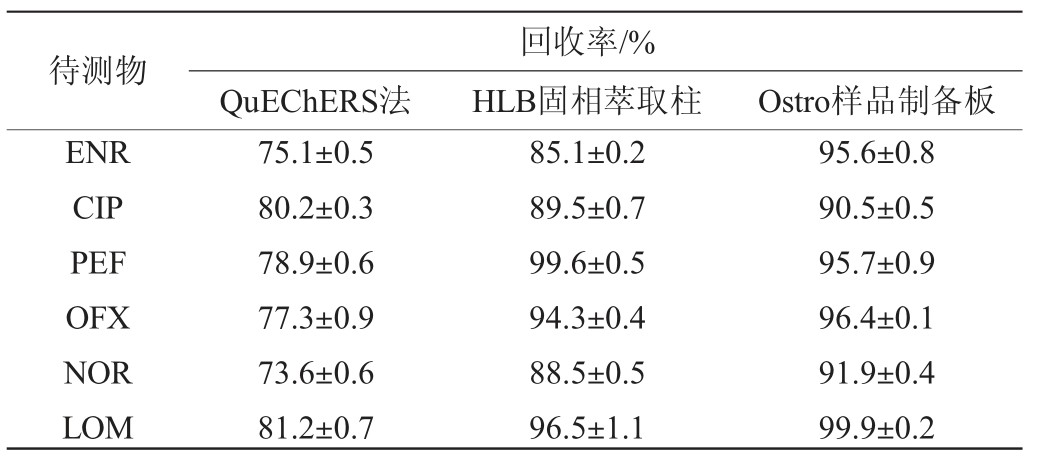
待测物ENR CIP PEF OFX NOR LOM QuEChERS法回收率/%HLB固相萃取柱 Ostro样品制备板75.1±0.5 80.2±0.3 78.9±0.6 77.3±0.9 73.6±0.6 81.2±0.7 85.1±0.2 89.5±0.7 99.6±0.5 94.3±0.4 88.5±0.5 96.5±1.1 95.6±0.8 90.5±0.5 95.7±0.9 96.4±0.1 91.9±0.4 99.9±0.2
由表2可知,采用QuEChERS法净化,6种喹诺酮类药物的回收率偏低,平均回收率80%左右,可能是基质抑制效应严重,也可能是吸附剂吸附了部分化合物,导致回收率偏低,除杂效果不理想。而使用HLB固相萃取柱和Ostro样品板,各种分析物的回收率均在80%~100%的范围内,净化效果相当。但是,Ostro样品板操作耗时更少,并且更适用于高通量分析,使用此方法,分析人员可在几分钟内制备几十个样品,与固相萃取净化相比,检测效率提高几十倍,所以,本研究选择Ostro样品板作为牛奶中喹诺酮类药物的提取净化材料。
2.3 流动相的选择
考察有机相为乙腈,水相分别为水、0.1%(V/V)甲酸、5 mmol/L甲酸铵(0.1%甲酸,V/V)溶液作为流动相的分离效果,结果见图2。
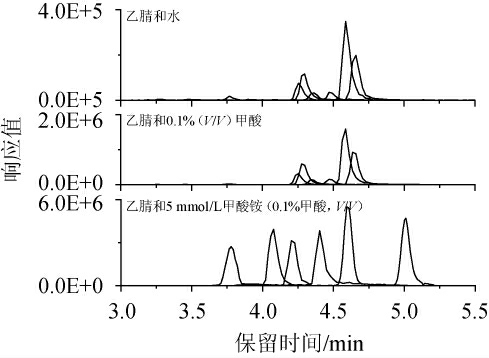
图2 不同流动相组成对试验结果的影响
Fig.2 Effect of different mobile phase composition on tests results
由图2可知,流动相中加入甲酸可增强化合物的保留性,且色谱峰分离程度有所提高,继续在水相中加入甲酸铵发现目标化合物响应值增强,甲酸铵浓度为5 mmol/L时待测物响应最强,故本试验选用乙腈和5 mmol/L甲酸铵(含0.1%甲酸)溶液作为流动相进行梯度洗脱。
2.4 质谱条件的优化
喹诺酮类药物分子中因含有羧基而显酸性,同时又含有碱性氮原子而显碱性,所以该类药物具有酸碱两性,在酸性溶液中呈阳离子状态,在ESI+模式下,易形成[M+H]+准分子离子。配制质量浓度为50 ng/mL的6种喹诺酮类药物及其内标标准溶液,分别单标进样,采用全扫描分析得到[M+H]+分子离子峰,然后子离子扫描确定子离子的质荷比,选取相对丰度强、干扰小的离子组成MRM离子对,优化6种药物去簇电压、碰撞能量等质谱条件。
2.5 基质效应考察
根据基质标准曲线与溶剂标准曲线的斜率比值来评价基质效应,若比值在80%~120%范围内,则表明基质效应不明显。牛奶中ENR、CIP、PEF、OFX、NOR、LOM的基质效应分别为90.6%、129.2%、73.4%、88.1%、134.1%、127.9%。结果显示,NOR、CIP、LOM 3种喹诺酮类药物存在基质增强效应,PEF存在基质抑制效应,ENR和OFX基质效应不明显。为降低基质效应影响,提高检测结果的准确性,本研究采用同位素内标及空白样品基质匹配标准溶液建立标准曲线减少相应影响。
2.6 方法学考察
2.6.1 线性范围、检出限和定量限
取空白牛奶样品,分别加入适量混合内、外标工作溶液,按“1.3.2 Ostro样品制备板法”样品前处理相同步骤制备成不同质量浓度标准溶液,以待测物定量离子峰面积和对应内标峰面积的比值(y)为纵坐标,标准溶液质量浓度(x)为横坐标,内标法绘制工作曲线,以各待测物信噪比为3(S/N=3)时对应的浓度作为检出限(limit of detection,LOD),以信噪比为10(S/N=10)时对应的浓度作为定量限(limit of quantitation,LOQ),其线性回归方程、LOD、LOQ见表3。
表3 6种喹诺酮类化合物线性回归方程及检出限、定量限
Table 3 Linear regression equations and detection limits and quantification limits of 6 quinolones
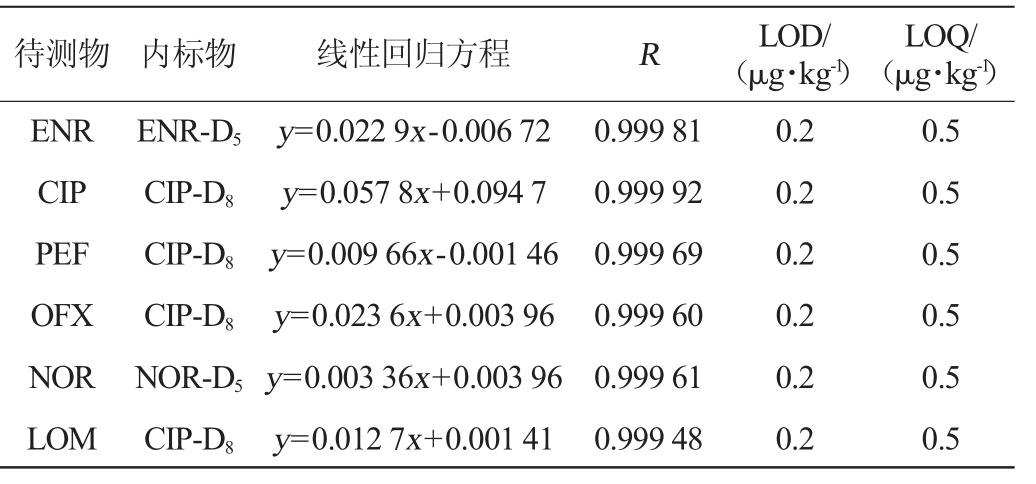
待测物 内标物 线性回归方程 R LOD/(μg·kg-1)LOQ/(μg·kg-1)ENR CIP PEF OFX NOR LOM ENR-D5 CIP-D8 CIP-D8 CIP-D8 NOR-D5 CIP-D8 y=0.022 9x-0.006 72 y=0.057 8x+0.094 7 y=0.009 66x-0.001 46 y=0.023 6x+0.003 96 y=0.003 36x+0.003 96 y=0.012 7x+0.001 41 0.999 81 0.999 92 0.999 69 0.999 60 0.999 61 0.999 48 0.2 0.2 0.2 0.2 0.2 0.2 0.5 0.5 0.5 0.5 0.5 0.5
由表3可知,方法检出限均为0.20 μg/kg,定量限均为0.5 μg/kg。6种喹诺酮类药物在5~200 ng/mL范围内呈现良好的线性关系,相关系数(R)均>0.999。方法检出限、定量限均低于现行标准。
2.6.2 加标回收及精密度实验
分别按照1、2、10倍定量限浓度(0.5 μg/kg、1.0 μg/kg、5.0 μg/kg)加入混合标准溶液,制成阳性加标样品,每个浓度各7份平行样品,按照“1.3.2 Ostro样品制备板法”前处理后测定,计算回收率及相对标准偏差(relative standard deviation,RSD),结果见表4。由表4可知,在3个加标水平下,6种目标化合物的的平均加标回收率为80.1%~98.9%,精密度实验结果的RSD为1.9%~9.2%。结果表明,该方法能满足牛奶中6种喹诺酮类药物残留的日常检测要求。
表4 6种喹诺酮类药物的平均回收率及相对标准偏差
Table 4 Average recovery rates and relative standard deviation of 6 quinolones
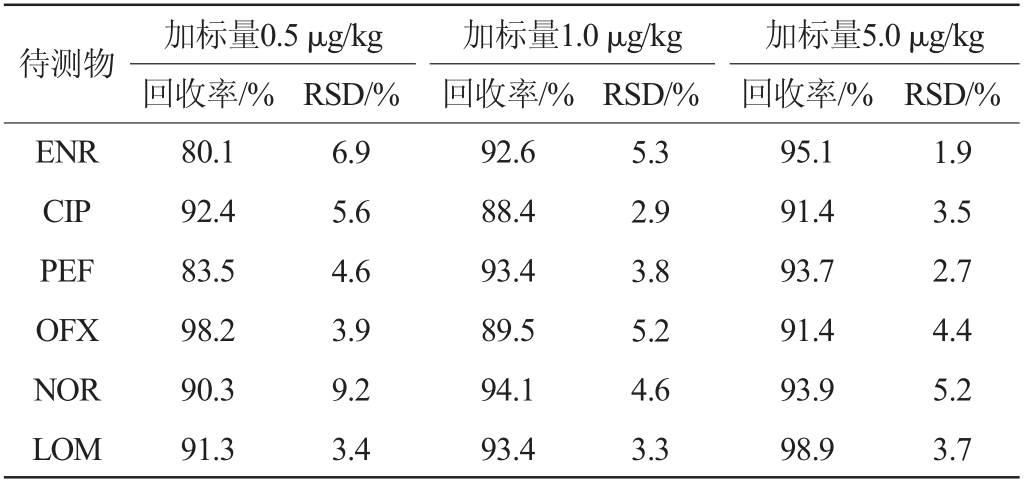
待测物ENR CIP PEF OFX NOR LOM加标量0.5 μg/kg回收率/%RSD/% RSD/%加标量1.0 μg/kg回收率/%加标量5.0 μg/kg回收率/% RSD/%80.1 92.4 83.5 98.2 90.3 91.3 6.9 5.6 4.6 3.9 9.2 3.4 92.6 88.4 93.4 89.5 94.1 93.4 5.3 2.9 3.8 5.2 4.6 3.3 95.1 91.4 93.7 91.4 93.9 98.9 1.9 3.5 2.7 4.4 5.2 3.7
2.6.3 方法稳定性实验
制备同一加标浓度水平(1.0 μg/kg)样品,分别间隔0 d、3 d、10 d测定,计算3次平均测定结果的RSD,结果见表5。由表5可知,6种待测物的方法稳定性实验结果的RSD范围为2.6%~10.8%,均<15%,结果表明方法可靠、稳定。
表5 方法稳定性实验结果
Table 5 Results of stability experiment of the method
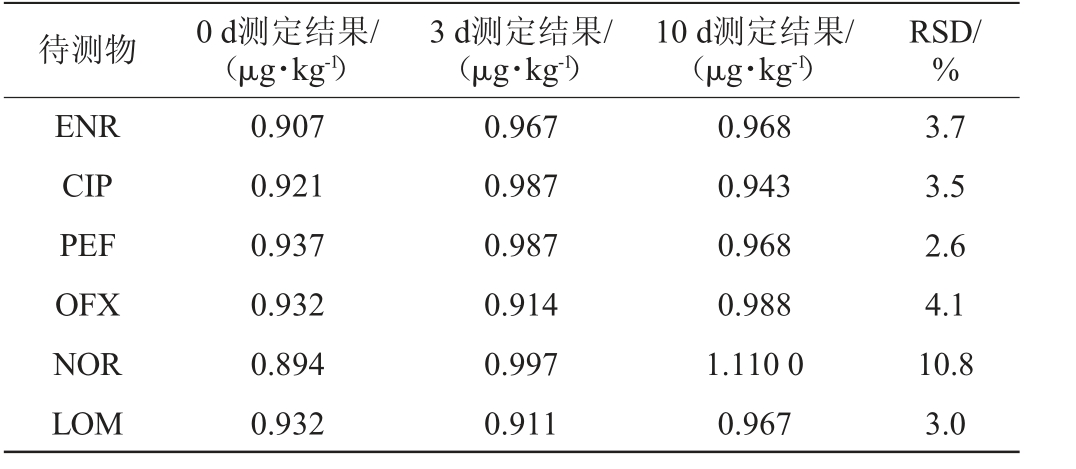
待测物 0 d测定结果/(μg·kg-1)3 d测定结果/(μg·kg-1)10 d测定结果/(μg·kg-1)RSD/%ENR CIP PEF OFX NOR LOM 0.907 0.921 0.937 0.932 0.894 0.932 0.967 0.987 0.987 0.914 0.997 0.911 0.968 0.943 0.968 0.988 1.110 0 0.967 3.7 3.5 2.6 4.1 10.8 3.0
2.7 实际样品分析
采用本研究建立的Ostro样品制备板结合UPLC-MS/MS测定牛奶中的6种喹诺酮类兽药残留量的方法,检测了在市场上采集的40份牛奶样品,结果在1份样品中检出恩诺沙星和环丙沙星,含量分别为10.3 μg/kg和9.1 μg/kg,其含量均未超出其最大残留限量(恩诺沙星和环丙沙星的总量100μg/kg)。为验证本方法的准确性和可行性,针对此份阳性牛奶样品,选择现行标准GB/T 21312—2007《动物源性食品中14种喹诺酮药物残留检测方法液相色谱-质谱/质谱法》测定,结果显示恩诺沙星和环丙沙星,含量分别为9.6 μg/kg和9.8 μg/kg,与本研究建立的方法得到的结果基本一致,进一步表明本方法准确可靠。
3 结论
本文建立了一种使用Ostro样品制备板提取净化,液相色谱串联质谱法测定牛奶中6种喹诺酮类药物的方法。结果表明,6种喹诺酮类药物在5~200 ng/mL质量浓度范围内线性关系均良好(R>0.999),检出限和定量限均分别为0.2 μg/kg和0.5 μg/kg,基质加标平均回收率在80.1%~98.9%之间,精密度实验结果的相对标准偏差(RSD)在1.9%~9.2%之间,方法稳定性实验结果的RSD在2.6%~10.8%之间。本方法的前处理步骤简单快捷,配合Ostro样品制备板提取净化技术检测通量高,可为牛奶中诺酮类药物的快速筛查和定量定性分析提供技术支撑。
[1]GUTIERREZ A, STOKES J M, MATIC I.Our evolving understanding of the mechanism of quinolones[J].Antibiotics,2018,7(2):32.
[2]TANG Y Z,SAHIN O,PAVLOVIC N,et al.Rising fluoroquinolone resistance in Campylobacter isolated from feedlot cattle in the United States[J].Sci Rep,2017,7(1):494.
[3]TUMINI M, NAGEL O, MOLINA P M, et al.Microbiological assay with Bacillus licheniformis for the easy detection of quinolones in milk[J].Int Dairy J,2017,64:9-13.
[4]KERARAVAT S V,GAGNETEN A M,HERNANDEZ S R.Development of an electrochemical method for the detection of quinolones:Application to cladoceran ecotoxicity studies[J].Microchem J,2018,141(9):279-286.
[5]PINACHO D G, SANCHEZ-BAEZA F, PIVIDORI M I, et al.Electrochemical detection of fluoroquinolone antibiotics in milk using a magneto immunosensor[J].Sensors,2014,14(9):15965-15980.
[6]ACAROZ U,DIETRCH R,KNAUER M,et al.Development of a generic enzyme-immunoassay for the detection of fluoro (quinolone)-residues in foodstuffs based on a highly sensitive monoclonal antibody[J].Food Anal Method,2020,13(3):780-792.
[7]YAO T,WANG H L,SI X J,et al.Determination of trace fluoroquinolones in water solutions and in medicinal preparations by conventional and synchronous fluorescence spectrometry[J].Open Chem,2018,16(1):1122-1128.
[8]HAN Z Y,SUN T Q,XU Z H,et al.Detection of four quinolone antibiotic by chemiluminescence based on a novel nor-biotin bifunctional ligand and SA-ALP technology[J].Biosci biotech Biochem,2021,85(7):1720-1728.
[9]MADALOSSI N V,MAZALI I O,CORBI F C A,et al.Development of silver nanoparticles-based sensor for detection of quinolones by surfaceenhanced raman spectroscopy: a case-study using using Levofloxacin[J].Chem Eng Transactions,2016,47:31-36.
[10]WU Y, ZHONG D D, QIU Q K, et al.Nanoporous polyimide microspheres solid phase extraction coupled to liquid chromatography with fluorescence detection to determine fluoroquinolones in water and food samples[J].Chromatographia,2022,85:939-948.
[11]LIU T, MA L, JIANG Y, et al.Simultaneous determination of four quinolones in honey by nickel/aluminum-layered double hydroxide-based air-assisted dispersive solid-phase extraction and high-performance liquid chromatography[J].J Food Meas Charact,2022,16:5023-5031.
[12]王晓茵,武云龙,孙晓亮,等.超高效液相色谱-荧光法同时测定鸡肉中14种喹诺酮类和16种磺胺类药物残留[J].中国兽医杂志,2023,59(10):46-53.
[13]严祖浩,李晓薇,夏曦.牛奶中69种兽药残留的超高效液相色谱-四极杆-飞行时间质谱快速筛查[J].分析测试学报,2023,42(10):1309-1318.
[14]张敏,徐宜宏,张彤,等.UPLC-MS/MS同时测定畜禽粪便中19种喹诺酮类抗生素残留量[J].饲料研究,2023,46(17):113-117.
[15]谢慧英,于晖,谭洪涛,等.碳纳米管分散固相萃取-超高效液相色谱-串联质谱法测定黄颡鱼中的氟喹诺酮类药物残留[J].实验与检验医学,2023,41(2):132-135.
[16]吴春霞,张秋萍,王春民,等.超高效液相色谱-串联三重四级质谱法测定动物源性食品中的喹诺酮类和四环素类残留[J].中国卫生检验杂志,2022,32(19):2310-2314.
[17]ZHU Y J, HE P F, HU H M, et al.Determination of quinolone antibiotics in environmental water using automatic solid-phase extraction and isotope dilution ultra-performance liquid chromatography tandem mass spectrometry[J].J Chromatogr B,2022,1208:123390.
[18]WANG H,ZHAO X Y,XU J W, et al.Determination of quinolones in environmental water and fish by magnetic metal organic frameworks based magnetic solid-phase extraction followed by high-performance liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2021,1651:462286.
[19]范广宇,乔柱,王毅谦,等.三重四极杆复合线性离子阱质谱法测定水产品中18种喹诺酮类药物残留[J].食品科技,2022,47(10):306-312.
[20]刘奕雄,张凯旋,朱雨田,等.自动固相萃取-超高效液相色谱-串联质谱法同时测定暂养水中45种抗生素药物的含量[J].理化检验-化学分册,2023,59(12):1365-1373.
[21]夏宝林,汪仕韬,殷晶晶,等.自动上样固相萃取-超高效液相色谱-串联质谱法同时测定水中9类43种抗菌药物残留[J].色谱,2023,41(7):591-601.
[22]张今君,夏慧丽,高海波.分散固相萃取-超高效液相色谱-串联质谱法测定豆芽中6种喹诺酮类药物[J].食品工业科技,2020,41(23):260-265,271.
[23]刘艳丽,吴昊,杜晓慧,等.磁分散固相萃取-高效液相色谱法测定牛奶中5种禁用喹诺酮类药物[J].分析科学学报,2018,34(2):196-200.
[24]刘冬虹,吴玉銮,王斌,等.分散固相萃取-超高效液相色谱-串联质谱测定肉制品中5类药物残留[J].现代食品科技,2016,32(10):290-296,258.
[25]李磊,周贻兵,张权,等.QuEChERS净化-高效液相色谱串联质谱法快速筛查乳制品中10种喹诺酮类抗生素[J].中国乳品工业,2021,49(9):57-61.