咖啡为茜草科咖啡属植物,咖啡果实成熟后其果皮会变成深红色或红紫色,富含纤维素、蛋白质、总糖、膳食纤维、氨基酸、花青素等营养物质[1],不仅提神醒脑,还可以预防糖尿病、肝硬化以及肝癌[2]。目前,咖啡果皮主要用于饮品制造、饲料、堆肥等方面,但利用率低,存在严重的资源浪费和环境污染问题[3]。若将咖啡果皮高效利用或形成产品,不仅有助于解决乡村环境治理问题,还能使咖啡果皮变废为宝,延长产业链,提高产值[4]。而存在于咖啡果皮中的花青素是一类黄酮化合物,具有减缓机体老化[5]、促进胃肠道蠕动、促进血液循环、降低胆固醇、缓解眼疲劳、保护肝脏、减少罹患癌症和预防心脑血管等疾病等功效[6-8],对维护人体正常的生命活动有积极作用[9]。
花青素常用的提取方法为有机溶剂提取[10]、超声波辅助提取[11]、微波辅助提取[12]、低共熔溶剂提取[13]等,目前,国内外使用最多的是有机溶剂法。但有机溶剂提取的花青素大多具有毒性残留且生产过程环境污染大,因此,需要寻找一种更为安全、环保的方法来提取花青素。其中,酶法提取反应温和[14],提取质量好、纯度高[15],对成分流失影响小,但提取率偏低。超声处理有利于花青素溶出,将两种方法结合,既能提高咖啡果皮花青素提取率,缩短提取时间,也能够很好保持花青素原有的理化性质,采用酶-超声辅助法提取植物中的花青素能够显著提高花青素提取率。洪豆等[16]采用酶法-超声联合提取紫色马铃薯花青素,得紫色马铃薯花青素含量达1.25 mg/g;张冬梅等[17]采用响应面法优化酶-超声提取黑枸杞花青素工艺条件,所得黑枸杞花青素含量为7.0 mg/g;马全民等[18]采用响应面法优化超声酶法提取蓝莓花青素工艺条件,得蓝莓花青素含量达0.606mg/g。但目前关于咖啡果皮花青素的提取工艺和抗氧化活性研究较少。
本研究以云南小粒咖啡果皮为原料,通过超声辅助酶法提取咖啡果皮中花青素,利用单因素试验及正交试验优化其提取工艺条件,并研究其体外抗氧化活性,旨在促进咖啡果皮的利用,为相关产品研发提供参考依据。
1 材料与方法
1.1 材料与试剂
小粒咖啡(卡蒂姆)(Coffea arabica L.):采自普洱市思茅区木乃河咖啡园,鲜果去籽,自然晒干,经过粉碎过60目筛后密封保存备用。
乙酸、无水乙醇、维生素C(vitamin C,VC)、双氧水、磷酸二氢钠、磷酸氢二钠、铁氰化钾、三氯乙酸、氯化铁(均为分析纯):天津市大茂化学试剂厂;水杨酸、乙酸钠、硫酸亚铁(均为分析纯):天津市风船化学试剂有限公司;纤维素酶(100 000 U/g)、果胶酶(100 000 U/g)、半纤维素酶(100 000 U/g)、木聚糖酶(100 000 U/g):山东隆科特酶制剂有限公司;花青素(矢车菊素-3-O-葡萄糖苷)、1,1-二苯基-2-三 硝 基 苯 肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度>98%):成都植标化纯生物技术有限公司。
1.2 仪器与设备
PR223ZH/E电子天平:奥豪斯仪器(常州)有限公司;UV-2600紫外-可见分光光度计:岛津国际贸易有限公司;HH-S28s恒温水浴锅:常州市金坛大地自动化仪器厂;BJ-800A多功能粉碎机:浙江杭州拜杰科技有限公司;YM-100S超声波清洗机:深圳市方奥微电子有限公司;SC-3616低速离心机:安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 咖啡果皮花青素提取工艺优化
单因素试验:以花青素得率为评价指标,分别考察酶种类(纤维素酶、半纤维素酶、果胶酶、木聚糖酶)、酶添加量(0、0.25%、0.50%、1.00%、1.50%、2.00%、2.50%)、乙醇体积分数(30%、40%、50%、60%、70%、80%)、提取温度(20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)、提取时间(10 min、20 min、30 min、40 min、50 min、60 min)和料液比(1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL))6个因素对咖啡果皮花青素得率的影响。
正交试验:基于单因素试验结果,以花青素得率为评价指标,以乙醇体积分数(A)、料液比(B)、提取时间(C)和提取温度(D)为考察因素,设计L9(34)正交试验优化咖啡果皮花青素提取工艺,正交试验因素与水平见表1。
表1 咖啡果皮花青素提取工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for extraction process optimization of coffee pericarp anthocyanins

水平 A 乙醇体积分数/%B 料液比(g∶mL)C 提取时间/min D 提取温度/℃1 2 3 60 70 80 1∶40 1∶50 1∶60 20 30 40 50 60 70
1.3.2 咖啡果皮花青素的检测
标准溶液的制备:准确配制质量浓度为0、2.50 μg/mL、5.00μg/mL、7.50μg/mL、10.00μg/mL、12.50μg/mL、15.00μg/mL花青素标准溶液,在波长536 nm下测定吸光度值,以质量浓度(X)为横坐标,吸光度值(Y)为纵坐标绘制花青素标准曲线,得到花青素的标准曲线回归方程为:Y=0.061 7X-0.011 6,相关系数R2=0.999 3。
精准称取0.1 g(精确至0.001 g)咖啡果皮粉样品,加入0.2 g果胶酶和5.00 mL体积分数60%乙醇,60 ℃超声提取40 min,将混合物以3 500 r/min离心5 min,上清液即为咖啡果皮花青素提取液。取上清液1.00 mL,用体积分数60%乙醇稀释至10 mL,在波长536 nm下测定吸光度值并计算咖啡果皮花青素得率,花青素得率计算公式如下:
式中:C为花青素质量浓度,μg/mL;F为稀释倍数;V为提取液体积,mL;m为咖啡果皮质量,μg。
1.3.3 咖啡果皮花青素体外抗氧化活性测定
DPPH自由基清除率的测定:参照李海飞等[19]的测定方法并稍作改动。将0.1 g咖啡果皮样品溶于100 mL提取液中进行提取,得到1 mg/mL咖啡果皮提取液,分别稀释为2.50μg/mL、5.00μg/mL、7.50μg/mL、10.00μg/mL、15.00 μg/mL、20.00 μg/mL、25.00 μg/mL、30.00 μg/mL的样品溶液,依次加入3.90 mL浓度为0.10 mmol/L的DPPH溶液,充分混匀,静置反应30 min,在波长517 nm条件下测定各样品的吸光度值。以相同浓度梯度下VC为阳性对照,DPPH自由基清除率计算公式如下:
式中:A1为混合样液的吸光度值;A2为含乙醇和样品的吸光度值;A0为含乙醇和DPPH的吸光度值。
OH自由基清除率的测定:参照周理红[20]的测定方法并稍作改动。将0.1 g咖啡果皮样品溶于100 mL提取液中进行提取,得到1 mg/mL咖啡果皮提取液,分别稀释为2.50μg/mL、5.00μg/mL、7.50μg/mL、10.00μg/mL、15.00μg/mL、20.00 μg/mL、25.00 μg/mL、30.00 μg/mL的样品溶液,依次加入1.00 mL浓度为9 mmol/L的FeSO4溶液和2.00 mL浓度为9 mmol/L水杨酸溶液,并充分摇匀,加入2.00 mL浓度为8.8 mmol/L H2O2溶液,37 ℃水浴加热0.5 h,在波长510 nm下测定各样品吸光度值,以相同浓度梯度下VC为阳性对照,OH自由基清除率计算公式如下:
式中:A1为样液加试剂后的吸光度值;A2为用蒸馏水替换H2O2后的吸光度值;A0为蒸馏水加试剂的吸光度值。
总还原能力的测定:参照李彩云等[21]的测定方法并稍作修改。将0.1 g咖啡果皮样品溶于100 mL提取液中进行提取,得到1 mg/mL咖啡果皮提取液,分别稀释为2.50 μg/mL、5.00μg/mL、7.50μg/mL、10.00μg/mL、15.00μg/mL、20.00μg/mL、25.00 μg/mL、30.00 μg/mL的样品溶液,依次加入2.00 mL pH 6.6磷酸盐缓冲液和2.00 mL 1%铁氰化钾溶液,50 ℃水浴反应30 min,快速冷却至常温,加入2.00 mL 10%三氯乙酸,摇匀,3 000 r/min离心10 min,取上清液2.00 mL,然后,向其加入2.00 mL蒸馏水和0.10 mL的0.1%FeCl3溶液,并使其反应10 min。以相同的浓度下VC溶液为阳性对照,在波长700 nm下测吸光度值,吸光度值越大,代表样品总还原能力越高。
1.3.4 数据处理
试验平行测定3次,采用Origin9.0软件处理数据并绘图。
2 结果与分析
2.1 咖啡果皮花青素提取工艺优化单因素试验结果
2.1.1 酶种类的确定
由图1可知,咖啡果皮中花青素得率由高到低的酶为果胶酶(0.16%)>纤维素酶(0.14%)>木聚糖酶(0.13%)>半纤维素酶(0.11%)。其原因可能是,果胶酶能够降解细胞间的果胶,松散解开各细胞之间的粘连,从而提高胞外化学物质的得率,纤维素酶、半纤维素酶和木聚糖酶均降解破坏植物组织的细胞壁,只能提取到细胞内花青素[22]。因此,确定果胶酶为最佳酶种类。
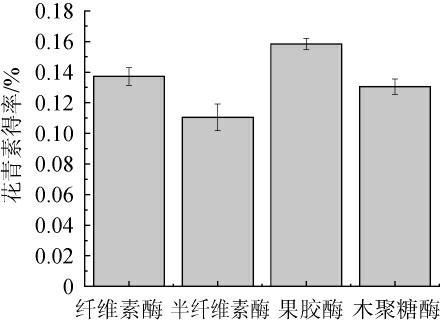
图1 不同酶种类对花青素得率的影响
Fig.1 Effect of different enzyme species on anthocyanin yield
2.1.2 果胶酶添加量的确定
由图2可知,当果胶酶添加量为0~2.0%时,花青素得率逐渐增加;当果胶酶添加量为2.0%时,花青素得率达最大值,为0.17%;当果胶酶添加量>2.0%时,花青素得率下降,可能是因为过量的果胶酶会将花青素水解为对应的糖苷配基[23]。因此,确定最佳果胶酶添加量为2.0%。
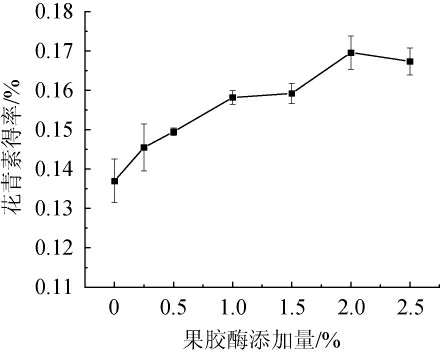
图2 果胶酶添加量对花青素得率的影响
Fig.2 Effect of pectinase addition on anthocyanin yield
2.1.3 乙醇体积分数的确定
由图3可知,当乙醇体积分数为30%~70%时,花青素得率随之增加;当乙醇体积分数为70%时,花青素得率达到最大值,为0.167%;当乙醇体积分数>70%时,花青素得率下降。分析原因可能是,乙醇能够穿透咖啡果皮内部,断裂其与花青素连接的氢键,加速花青素的溶解[24]。但是,过大的乙醇体积分数会导致极性偏离花青素的极性,并且溶出咖啡果皮中的醇溶物质,夺取有助于花青素溶解的乙醇-水分子结构[25]。因此,确定最佳乙醇体积分数为2.0%。
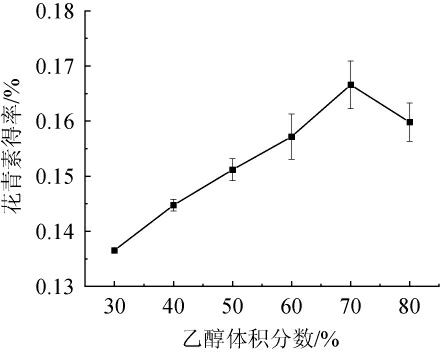
图3 乙醇体积分数对花青素得率的影响
Fig.3 Effect of ethanol volume fraction on anthocyanin yield
2.1.4 提取温度的确定
由图4可知,提取温度为20~60 ℃时,花青素得率随之增加;当提取温度为60 ℃时,花青素得率达到最大值,为0.254%;当提取温度>60 ℃时,花青素得率随之下降。其原因可能是,温度过低或过高都会导致酶活性减弱,从而导致花青素难以溶出,同时花青素耐热性较差,温度过高会使花青素降解,得率下降[26]。因此,确定最佳提取温度为60 ℃。
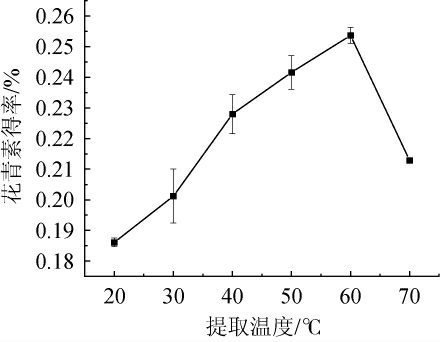
图4 提取温度对花青素得率的影响
Fig.4 Effect of extraction temperature on anthocyanin yield
2.1.5 提取时间的确定
由图5可知,当提取时间为10~30 min时,花青素得率随之增加;当提取时间为30 min时,花青素得率达到最大值,为0.263%;当提取时间>30 min时,花青素得率逐渐下降。其原因可能是由于超声波能量的作用,物料内部温度逐渐升高,从而加速了花青素的溶解过程。同时,超声波在溶液中传播时产生的空化效应有效地使细胞壁破裂,促进了花青素从咖啡果皮中释放。随着超声时间的进一步延长,大部分花青素已被提取出来,且过长的超声时间可能会破坏花青素的结构,导致得率下降[27]。因此,确定最佳提取时间为30 min。

图5 提取时间对花青素得率的影响
Fig.5 Effect of extraction time on anthocyanin yield
2.1.6 料液比的确定
由图6可知,当料液比为1∶10~1∶50(g∶mL),花青素得率随之增加;当料液比为1∶50(g∶mL),花青素得率达到最大值,为0.25%;继续增加液体比例,花青素得率逐渐下降。其原因可能是,适量的溶剂有助于活性物质的充分扩散,从而加速其扩散溶出[25],而过多的溶剂会导致杂质的溶出增加,从而使有效物质在溶液中的浓度降低[28]。因此,确定最佳料液比为1∶50(g∶mL)。
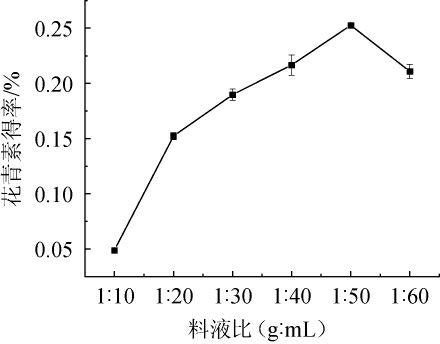
图6 料液比对花青素得率的影响
Fig.6 Effect of solid and liquid ratio on anthocyanin yield
2.2 咖啡果皮花青素提取工艺优化正交试验结果
以单因素试验结果为基础,确定最佳果胶酶添加量为2.0%,以花青素得率为评价指标,以乙醇体积分数(A)、料液比(B)、提取时间(C)和提取温度(D)为影响因素,进行L9(34)正交试验,正交试验结果与分析见表2。
表2 咖啡果皮花青素提取工艺优化正交试验结果
Table 2 Results of orthogonal tests for anthocyanin extraction process optimization of coffee pericarp anthocyanins
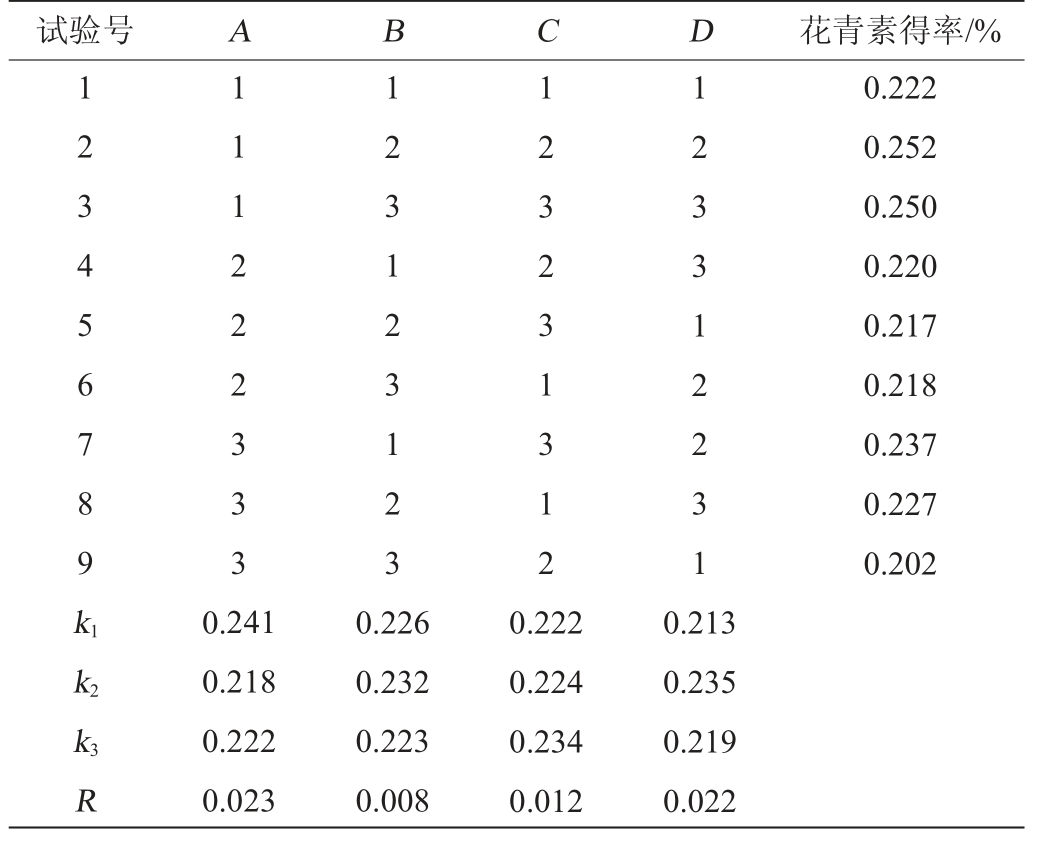
试验号 A B C D 花青素得率/%1 2 3 4 5 6 7 8 9 k1 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 1 2 3 3 1 2 2 3 1 0.222 0.252 0.250 0.220 0.217 0.218 0.237 0.227 0.202 k2 k3R 0.241 0.218 0.222 0.023 0.226 0.232 0.223 0.008 0.222 0.224 0.234 0.012 0.213 0.235 0.219 0.022
由表2可知,通过极差分析得到影响咖啡果皮花青素得率的因素从高到低依次为乙醇体积分数>提取温度>提取时间>料液比,最佳提取工艺条件组合为A1B2C3D2,即乙醇体积分数60%、料液比1∶50(g∶mL)、提取时间40 min,提取温度60 ℃。经过3次平行验证试验可知,咖啡果皮花青素得率为0.274%,高于2号试验组。因此,该方案可用于优化咖啡果皮花青素的提取工艺条件。
与极差分析结果一致,结果可信。
2.3 咖啡果皮花青素体外抗氧化活性研究结果
由图7A和7B可知,随着样品、VC溶液质量浓度在2.5~20 μg/mL的增加,对DPPH自由基、OH自由基的清除率逐渐增加;当样品质量浓度>20 μg/mL,增加趋势趋于平稳;当样品质量浓度为30 μg/mL时,DPPH自由基、OH自由基的清除率最高,分别为91.40%、67.28%,IC50分别为6.36 μg/mL、12.16 μg/mL。在不同质量浓度条件下,样品的自由基清除率均强于VC。由图7C可知,随样品、VC溶液质量浓度在1~5 μg/mL的增加,总还原能力逐渐增加;样品质量浓度>5μg/mL之后,增加趋势趋于平稳;当样品质量浓度为5μg/mL时,样品吸光度值为0.987,高于VC溶液吸光度值(0.129)。在相同质量浓度下,样品的总还原能力均强于VC。结果表明,咖啡果皮具有较强的抗氧化能力。
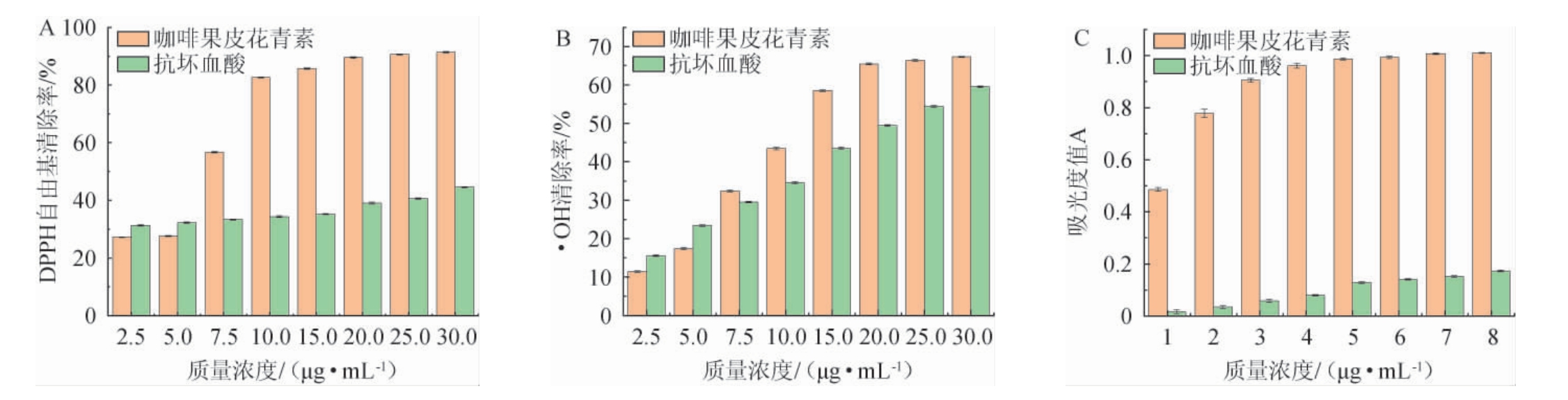
图7 样品质量浓度对DPPH自由基(A)、OH自由基(B)的清除能力和总还原能力(C)的影响
Fig.7 Effects of mass concentration of samples on scavenging abilities of DPPH radicals (A) and OH radicals (B) and total reduction capacities (C)
3 结论
本研究通过单因素试验和正交试验优化了咖啡果皮花青素的提取工艺,得咖啡果皮花青素的最佳提取工艺条件为:提取温度60 ℃、乙醇体积分数60%、果胶酶添加量2%、料液比1∶50(g∶mL)、提取时间40 min。并在此优化条件下,咖啡果皮花青素得率为0.274%。当样品质量浓度为30 μg/mL时,其对DPPH、OH自由基的清除率最佳,分别为91.40%、67.28%,半抑制浓度(IC50)分别为6.36 μg/mL、12.16 μg/mL;当样品质量浓度为5 μg/mL时,总还原能力较高(吸光度值为0.987)。本研究采用超声波辅助酶法提取花青素,操作简便、能耗低、安全性高,有助于咖啡果皮资源有效利用,对富含花青素保健产品的研发提供重要参考。
[1]JANISSEN B, HUYNH T.Chemical composition and value-adding applications of coffee industry by-products: A review[J].Resour Conserv Recy,2018,128:110-117.
[2]徐瑶.脂质对咖啡胶体颗粒理化性质和抗氧化能力的影响[D].杭州:浙江工商大学,2023.
[3]张佳欣,韩泽邦,吕玉兰,等.咖啡果皮综合利用浅析[J].热带农业科技,2023,46(2):56-60,82.
[4]孙岳,周地娇,何飞飞,等.咖啡果皮茶冲泡条件研究[J].食品研究与开发,2021,42(12):97-101.
[5]刘翠翠,郭钰洁,李正浩,等.基于正交分析的紫罗兰蜜薯中花青素的提取及功能分析[J].山东化工,2024,53(11):61-63,68.
[6]冯海博,石惠宇,罗财伟,等.花青素的提取分离纯化工艺、生理功能及在动物生产中应用的研究进展[J].饲料研究,2022,45(23):139-143.
[7]叶红玲,卢永梦,黄新雅,等.安庆地区5个高产蓝莓品种花青素稳定性研究[J].食品安全质量检测学报,2024,15(6):218-227.
[8]张祥涛,赵辰爽,谢聪颖,等.花青素对慢性炎性痛大鼠中枢TRPV1表达的影响[J].皖南医学院学报,2022,41(6):515-519.
[9]张潇,周海旭,高晗,等.紫甘蓝中花青素提取工艺及其抗氧化研究[J].河南科技学院学报(自然科学版),2024,52(3):62-68.
[10]张慧敏,何晓勇,刘平稳,等.紫葡萄皮中花青素提取工艺研究[J].粮食与食品工业,2023,30(6):6-10.
[11]李娟,彭健玮,孙雪梅.响应面试验优化超声法提取菊芋花青素工艺[J].中国调味品,2022,47(10):173-178.
[12]李艳秋,刘宇欣,李红利.微波辅助提取紫甘蓝中花青素工艺优化的研究[J].农产品加工,2024,29(2):56-63.
[13]徐唐芸,黄达敏,鲁东昊,等.基于低共熔溶剂提取紫薯中花青素研究[J].农产品加工,2021,37(10):25-33.
[14]WEI C, XIAO K, LI H L, et al.Optimization of ultrasound assisted aqueous enzymatic extraction of oil from Cinnamomum camphora seeds[J].LWT-Food Sci Technol,2022,164:113689.
[15]包洪亮,马永杰,蔡静静,等.牡丹籽油提取工艺及其在食品领域的研究进展[J].广州化工,2022,50(17):12-14.
[16]洪豆,阿丽雅,江宇峰,等.酶法-超声联合提取紫色马铃薯花青素的工艺研究[J].中国调味品,2020,45(8):154-158.
[17]张冬梅,王丽杰,潘悦.响应面法优化酶-超声提取黑枸杞花青素及抗氧化性研究[J].食品工业,2024,45(2):11-16.
[18]马全民,刘王梅,聂复礼,等.响应面法优化酶辅助超声提取蓝莓花青素工艺研究[J].浙江农业科学,2022,63(11):2606-2611.
[19]李海飞,杨毅,亓雨芮,等.超声波辅助酸性天然低共熔溶剂提取黑果腺肋花楸花青素及其稳定性和抗氧化活性分析[J].食品工业科技,2023,44(8):259-269.
[20]周理红.蓝莓花青素的抗氧化活性对比及其稳定性分析[J].现代食品科技,2020,36(3):65-71.
[21]李彩云,陈红,李松昂.发芽粟谷黄酮的提取、结构鉴定及体外抗氧化活性[J].吉林农业大学学报,2022,44(4):470-478.
[22]张莹丽,邓瑞瑞,李伟民.超声波辅助酶法提取紫薯花青素及抗氧化性研究[J].食品研究与开发,2021,42(15):92-96.
[23]KOPONEN J M,BUCHERT J,POUTANEN K S,et al.Effect of pectinolytic juice production on the extractability and fate of bilberry and black currant anthocyanins[J].Eur Food Res Technol,2008,227:485-494.
[24]CAI Z,QU Z Q,LAN Y,et al.Conventional,ultrasoundassisted,and accelerated solvent extractions of anthocyanins from purple sweet potatoes[J].Food Chem,2016,197:266-272.
[25]李佳桥,余修亮,曾林晖,等.响应面试验优化超声波辅助提取莲房原花青素工艺[J].食品科学,2016,37(12):45-45.
[26]邱菊,陈昌琳,陈冰艺,等.响应面法优化超声辅助乙醇提取桑葚花青素工艺及稳定性分析[J].中国调味品,2023,48(11):176-182.
[27]CHEN L Y, YANG M, MOU H, et al.Ultrasound-assisted extraction and characterization of anthocyanins from purple corn bran[J].J Food Process Preserv,2017,42(1):e13377.
[28]程海涛,申献双.响应面法优化机械砂磨辅助提取婆枣中原花青素工艺[J].食品工业科技,2019,40(11):218-222,228.