随着“酱酒热”的高速发展,酱香型白酒的产量在近几年也呈现超高速发展的态势,因此,酱香型白酒的副产物——丢糟,也呈现高速增长的态势[1]。酱香型白酒以赤水河水、红缨子糯高粱和小麦为原料,历经1年的时间,经过9次蒸煮,8次加曲发酵,7次蒸馏取酒,端午踩制、40 d高温制曲,储存6个月以上的高温大曲,每轮次窖内发酵不低于30 d,分下沙和造沙2次投粮,采用“三高、三低、三多和一少”十大酿造工艺从而生产出酱香型白酒的副产物——丢糟[2]。丢糟易产酸,腐败变质,从而对周边环境造成一定程度的生态污染[3-4]。经研究发现,经过“长时间、多种微生物和多种酶”共同发酵的酱香型白酒丢糟中含有大量的高附加值活性有机物,包括多糖类、蛋白类和总黄酮类等[5]。
总黄酮类化合物的基本结构是2-苯基色原酮,在此基础上又可分为八大类及其二氢衍生物[6-7],具有抗氧化[8]、抗菌[9]以及治疗心血管疾病[10]等功效。常见的提取总黄酮类物质的方法主要有超声波-微波协同提取法[11]、超声波辅助乙醇浸提法[12]、酶协同超声结合双水相萃取法[13]等。为了减少酱香型白酒丢糟对环境的污染和提高丢糟利用率,目前,众多学者采用多种方法从丢糟中提取高附加值活性物质并测定其生物活性,如李欣培等[14]采用超声辅助酶法从黄酒糟中提取蛋白质;张佳丽等[15]采用超临界二氧化碳萃取法从青稞酒糟中提取脂溶性成分;王兴东等[16]采用石油醚从酱香型酒糟和酒曲中提取脂溶性成分;姜福佳[17]利用醇碱法、碱法及酸法提取酒糟中蛋白质;张鹏杰等[18]通过超声法从苦荞酒糟中提取总黄酮,总黄酮得率为0.9%;杨杰[19]以口子窖酒糟为原料,利用超声波辅助法提取总黄酮,总黄酮含量为6.531 mg/g,其对1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除率为90.000%,对羟基自由基的清除率为55.031%。赵超等[20]采用超声辅助乙醇技术提取白酒酒糟总黄酮,在单因素试验基础上,选取超声温度、超声功率、液料比、乙醇体积分数为影响因素,以总黄酮得率为评价指标,利用Box-Behnken试验优化白酒酒糟总黄酮提取工艺条件,并评价白酒酒糟总黄酮体外抗氧化活性。结果表明,白酒酒糟总黄酮最佳提取工艺为超声温度65 ℃、超声功率320 W、液料比40∶1(mL∶g)、乙醇体积分数66%。在此优化条件下,白酒酒糟总黄酮得率为14.58 mg/g。常见谷物类总黄酮的提取方法有超声法、微波法和溶剂提取法,相比其他两种,溶剂提取法更方便、快捷。
本研究采用乙醇浸提法,提取酱香型白酒副产物丢糟中的总黄酮类化合物,以提取液中总黄酮的得率为响应值,通过单因素试验和Box-Behnken响应面试验对酱香型白酒副产物丢糟中总黄酮的提取条件进行优化,并对其抗氧化活性进行测定,以期提高丢糟的资源利用率。旨在解决酿酒行业对环境污染的问题,有利于酿酒行业朝着更健康、更绿色、更环保的方向发展。
1 材料与方法
1.1 材料与试剂
酱香型白酒丢糟:贵州某酱香型酒厂。
亚硝酸钠、硝酸铝、氢氧化钠、30%过氧化氢、水杨酸(均为分析纯):天津市科密欧化学试剂有限责任公司;芦丁标准品(纯度>98%):江西佰草源生物科技有限公司;DPPH、羟基自由基:福州飞净生物科技有限公司;硫酸亚铁(分析纯):成都金山化学试剂有限公司;无水乙醇(分析纯):上海国药集团有限责任公司。其他试剂均为国产分析纯。
1.2 仪器与设备
PWN224ZH电子分析天平:奥豪斯仪器有限公司;TDL-80-2B低速离心机:上海安亭科学仪器厂;HH-6数显恒温水浴锅:国华电器有限公司;SHZ-lll循环水真空泵:上海亚荣生化仪器厂;UV-5100紫外可见光分光光度计:上海元析仪器有限公司;DGG-9240A电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;SB-4200DTD超声波清洗机:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 酱香型白酒丢糟中总黄酮的提取[21]
将新鲜的酱香型白酒丢糟在40 ℃的烘箱中烘干至恒质量,经高速万能粉碎机粉碎后,过40目筛。准确称取(1.000 5±0.000 2)g酱香型白酒丢糟粉末,按照料液比1∶20(g∶mL)加入体积分数为75%的乙醇,于70 ℃水浴回流浸提25 min。
1.3.2 总黄酮含量的测定
将浸提液抽滤后以3 600 r/min离心10 min,取上清液稀释10倍,采用分光光度法测定总黄酮含量[22]。具体方法:采用高精密度的电子天平称取芦丁标准品0.019 6 g,用体积分数为80%的乙醇配制质量浓度为0.2 mg/mL的芦丁标准液。分别移取0、0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL的0.2 mg/mL的芦丁标准液于7支试管中,加体积分数为80%乙醇溶液定容至10 mL,分别移取质量浓度为0、0.01mg/mL、0.02mg/mL、0.03mg/mL、0.04mg/mL、0.05mg/mL、0.06 mg/mL的芦丁标准液1 mL于7支比色管中,先加0.4 mL的5%的NaNO2溶液,摇匀后静置6 min,再加0.4 mL 10%的Al(NO3)3,摇匀后静置6 min,最后加4 mL 4%NaOH后摇匀,用80%乙醇定容至10 mL,摇匀后静置20 min。测定7支比色管中溶液在波长510 nm处的吸光度值,以芦丁质量浓度(X)为横坐标,OD510 nm值(Y)为纵坐标,绘制芦丁的标准曲线,得到其线性回归方程为:Y=9.242 9X+0.000 6(相关系数R2=0.999 5)。根据芦丁的线性回归方程计算待测液中的总黄酮含量,并计算总黄酮得率,其计算公式如下:
式中:Y为总黄酮得率,%;C为待测液中总黄酮的质量浓度,mg/mL;M为酱香型白酒丢糟样品的质量,g;F为稀释倍数;V为待测液体积,mL。
1.3.3 酱香型白酒丢糟中总黄酮提取工艺优化
单因素试验:在1.3.1的基础上,分别探究乙醇体积分数(70%、75%、80%、85%、90%)、料液比(1∶15、1∶20、1∶25、1∶30、1∶35(g∶mL)、水浴温度(60 ℃、65 ℃、70 ℃、75 ℃、80 ℃)、提取时间(15 min、20 min、25 min、30 min、35 min)对总黄酮得率的影响。
响应面试验:在单因素试验结果基础上,以乙醇体积分数(A)、料液比(B)、浸提时间(C)、水浴温度(D)4个影响因素为考察因素,以总黄酮得率(Y)为响应值,采用Design Expert V10.0.7软件设计4因素3水平的Box-Behnken响应面试验,试验设计因素与水平见表1。
表1 总黄酮提取工艺条件优化Box-Behnken响应面试验因素与水平
Table 1 Factors and levels of Box-Behnken tests for extraction process conditions optimization of total flavonoids
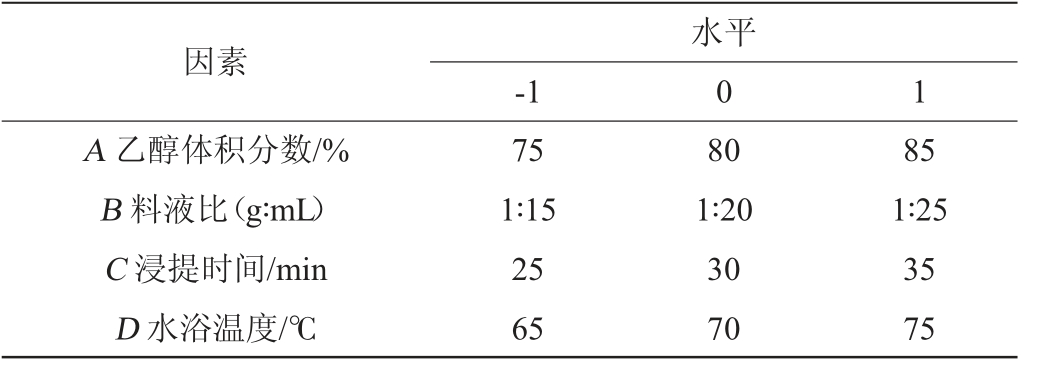
因素A 乙醇体积分数/%B 料液比(g∶mL)C 浸提时间/min D 水浴温度/℃-1水平0 1 75 1∶15 25 65 80 1∶20 30 70 85 1∶25 35 75
1.3.4 酱香型白酒丢糟中总黄酮提取液的抗氧化活性测定
(1)DPPH自由基清除率的测定
参考CHEN F等[23]的方法并略作修改。精密称取DPPH自由基0.019 7 g,用体积分数为80%的乙醇溶解摇匀,得到0.2 mmol/L的标准溶液;分别配制质量浓度为4 μg/mL、8 μg/mL、12 μg/mL、16 μg/mL、20 μg/mL、24 μg/mL的样品溶液。取1 mL样品溶液分装于6支具塞试管,先加1 mL的DPPH标准溶液,3 500 r/min离心10 min,取其上清液测定OD517 nm值记为A1,再加入体积分数为80%的乙醇溶液和DPPH标准溶液各1 mL,摇晃均匀,避光条件反应30 min,测定OD517 nm值,记为A0,取6个样品溶液与体积分数为80%的乙醇各1 mL混合均匀,静置反应30 min,测定OD517 nm值,记为A2,以蒸馏水作为对照,平行测定3次求平均值,计算总黄酮提取液DPPH自由基清除率,将上面样品液换成相同浓度的维生素C(vitamin C,VC)溶液,即可计算出VC对DPPH自由基的清除率。其计算公式如下:
(2)羟基自由基清除率的测定
参考章烨雯等[24]的方法并略作修改。样品溶液按1.3.4(1)制备。在6支25 mL的具塞比色管中依次加入2 mL不同质量浓度的样品溶液,并向6支试管中添加硫酸亚铁溶液、过氧化氢溶液、水杨酸溶液各1 mL,最后加蒸馏水定容至10 mL,摇匀在37 ℃水浴锅中加热30 min,并测定OD510 nm值,记为A1;用蒸馏水分别代替样品溶液、过氧化氢溶液进行上述操作后测定OD510nm值,分别记为A0、A2,平行测定3次求平均值,计算总黄酮提取液的羟基自由基清除率,将上面样品液换成相同质量浓度的VC溶液,即可计算出VC对羟基自由基的清除率。其计算公式如下:
1.3.5 数据处理与分析
每个试验都重复3次,采用SPSS 28.0.1.1处理数据并进行方差分析,结果用“平均值±标准差”表示,采用Origin 2018制图。
2 结果与分析
2.1 酱香型白酒丢糟中总黄酮提取工艺条件优化单因素试验结果
2.1.1 料液比对酱香型白酒丢糟中总黄酮得率的影响
料液比对酱香型白酒丢糟中总黄酮得率的影响见图1。

图1 液料比对总黄酮得率的影响
Fig.1 Effect of solid and liquid ratio on total flavonoids yield
由图1可知,随着料液比的变化,总黄酮得率呈先升高后下降的趋势,当料液比为1∶20(g∶mL)时,总黄酮得率达到最高,为3.57%。分析其原因可能是随着乙醇占比的增加,总黄酮物质扩散的范围变大,使有效成分的浓度降低,有利于总黄酮类物质随着乙醇浓度的增加而提高,从而增大其得率;当两者达到一定的比例后,其扩散作用达到稳定,再继续增加乙醇用量反而使总黄酮得率降低[25]。因此,确定最适料液比为1∶20(g∶mL)。
2.1.2 水浴温度对酱香型白酒丢糟中总黄酮得率的影响
水浴温度对酱香型白酒丢糟中总黄酮得率的影响见图2。
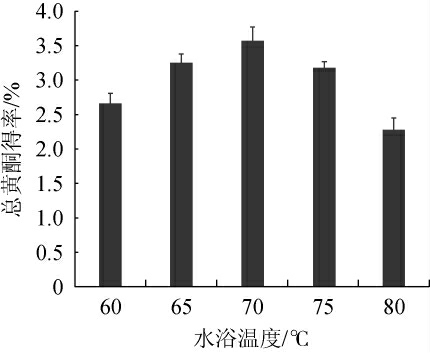
图2 水浴温度对总黄酮得率的影响
Fig.2 Effect of water bath temperature on total flavonoids yield
由图2可知,当水浴温度为60~70 ℃时,随着水浴温度的升高,总黄酮得率逐渐升高;当水浴温度为70 ℃时,总黄酮得率达到最高,为3.57%;当水浴温度为70~80 ℃时,随着水浴温度的升高,总黄酮得率逐渐下降。分析原因可能是随着水浴温度的升高,总黄酮变性,活性降低,不易从细胞溶出,从而得率降低[26]。因此,确定最适水浴温度为70 ℃。
2.1.3 浸提时间对酱香型白酒丢糟中总黄酮得率的影响
浸提时间对酱香型白酒丢糟中总黄酮得率的影响见图3。
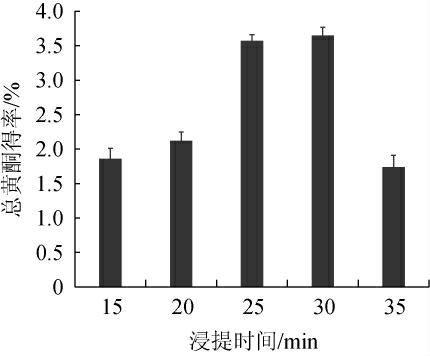
图3 浸提时间对总黄酮得率的影响
Fig.3 Effect of extraction time on total flavonoids yield
由图3可知,当浸提时间为15~30 min时,随着浸提时间的延长,总黄酮得率逐渐升高;当浸提时间为30 min时,总黄酮得率达到最高,为3.63%;当浸提时间为30~35 min时,随着浸提时间的延长,总黄酮得率逐渐下降。分析原因可能是由于丢糟中的成分较为复杂,提取时间过长使得丢糟中的一些杂质析出,从而使总黄酮的得率降低[27]。因此,确定最适浸提时间为30 min。
2.1.4 乙醇体积分数对酱香型白酒丢糟中总黄酮得率的影响
乙醇体积分数对酱香型白酒丢糟中总黄酮得率的影响见图4。由图4可知,当乙醇体积分数为70%~80%时,随着乙醇体积分数的升高,总黄酮得率逐渐升高;当乙醇体积分数为80%时,总黄酮得率达到最高,为3.95%;当乙醇体积分数为80%~90%时,随着乙醇体积分数的升高,总黄酮得率逐渐下降。根据总黄酮类化合物易溶于有机溶剂的性质,糖苷型和苷元型易溶于水和乙醇,当乙醇溶液中的水和乙醇达到合适配比时,得率更高[28-29]。因此,确定最适乙醇体积分数为80%。
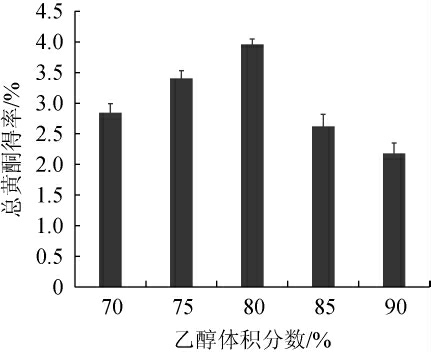
图4 乙醇体积分数对总黄酮得率的影响
Fig.4 Effect of ethanol volume fraction on total flavonoids yield
2.2 酱香型白酒丢糟中总黄酮提取工艺条件优化的响应面试验结果
2.2.1 Box-Behnken响应面试验结果
在单因素试验结果的基础上,以乙醇体积分数(A)、料液比(B)、浸提时间(C)、水浴温度(D)为自变量,以总黄酮得率(Y)为响应值,采用Design Expert V10.0.7软件设计4因素3水平的Box-Behnken响应面试验,试验设计及结果见表2,方差分析见表3。
表2 Box-Behnken响应面试验设计与结果
Table 2 Design and results of Box-Behnken response surface tests
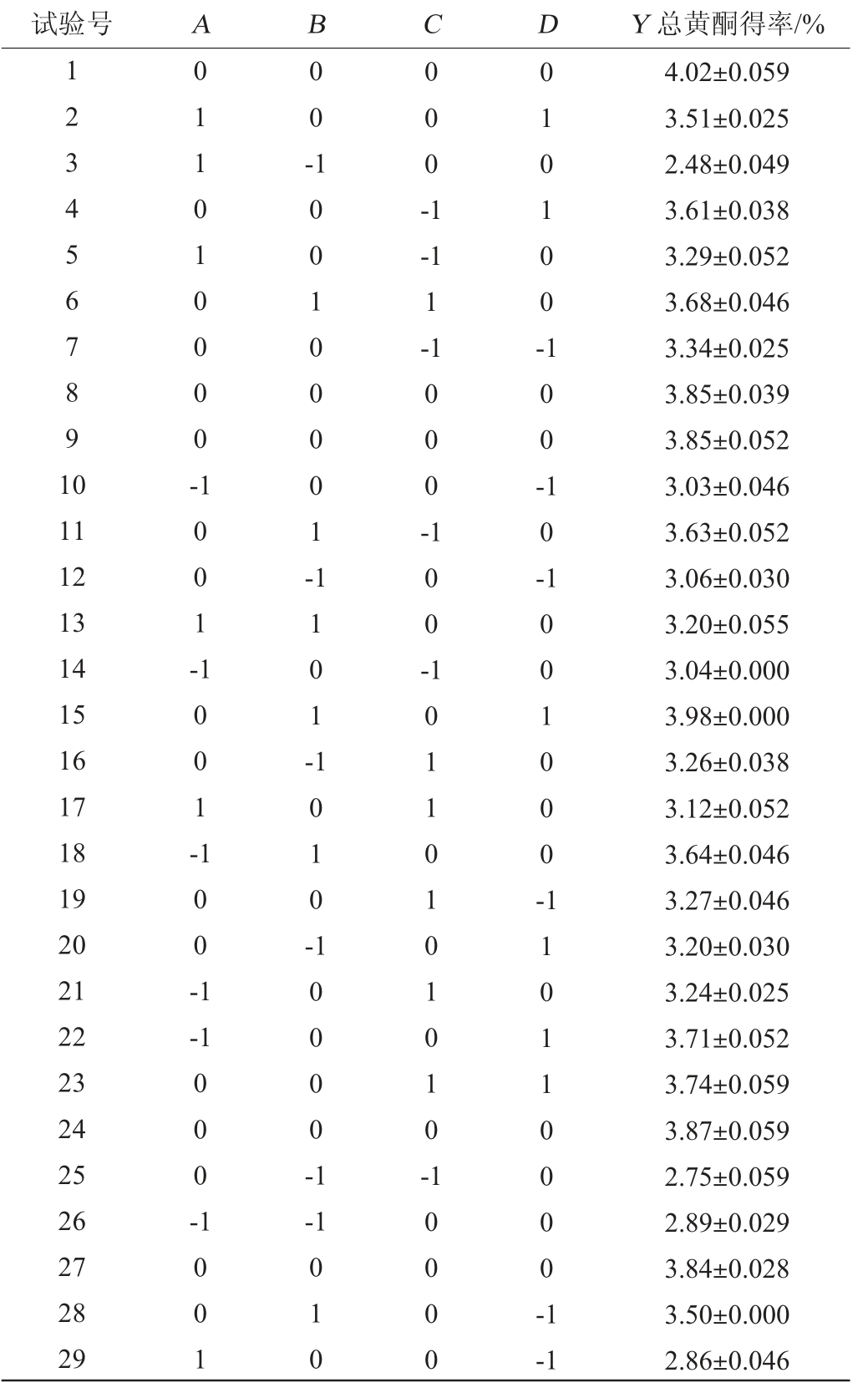
试验号 A B C D Y 总黄酮得率/%1234567891 0 011010000-0 0-000-1-1 1-1 010100-100-11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 1001-100100001-000-10-1001-1101-100-100-1 1010-1001000--1 000-10000-1 10110101010-1001-1 010 10000 110110000-1-1 4.02±0.059 3.51±0.025 2.48±0.049 3.61±0.038 3.29±0.052 3.68±0.046 3.34±0.025 3.85±0.039 3.85±0.052 3.03±0.046 3.63±0.052 3.06±0.030 3.20±0.055 3.04±0.000 3.98±0.000 3.26±0.038 3.12±0.052 3.64±0.046 3.27±0.046 3.20±0.030 3.24±0.025 3.71±0.052 3.74±0.059 3.87±0.059 2.75±0.059 2.89±0.029 3.84±0.028 3.50±0.000 2.86±0.046
表3 回归模型方差分析
Table 3 Variance analysis of regression model
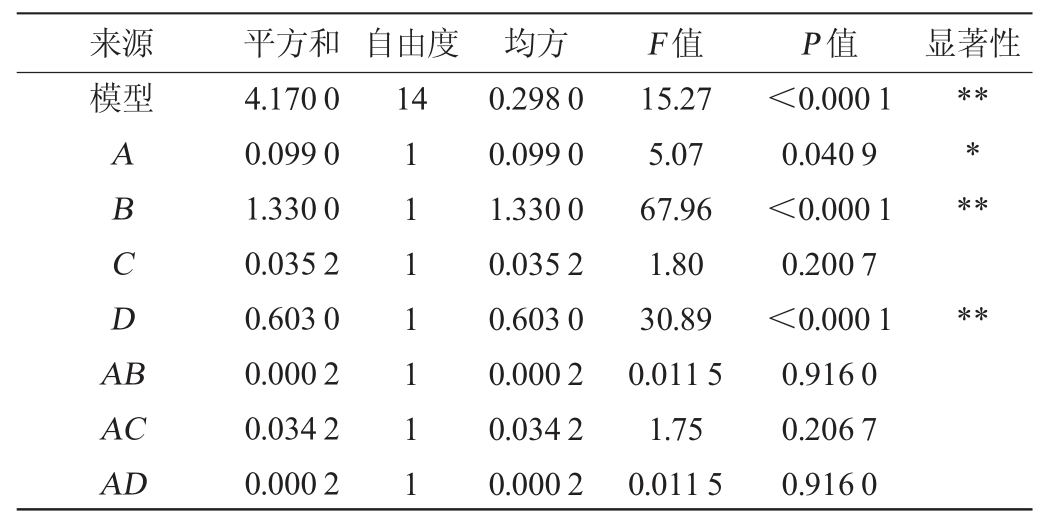
来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCDA B*****14**AC AD 4.170 0 0.099 0 1.330 0 0.035 2 0.603 0 0.000 2 0.034 2 0.000 2 1111111 0.298 0 0.099 0 1.330 0 0.035 2 0.603 0 0.000 2 0.034 2 0.000 2 15.27 5.07 67.96 1.80 30.89 0.011 5 1.75 0.011 5<0.000 1 0.040 9<0.000 1 0.200 7<0.000 1 0.916 0 0.206 7 0.916 0
续表
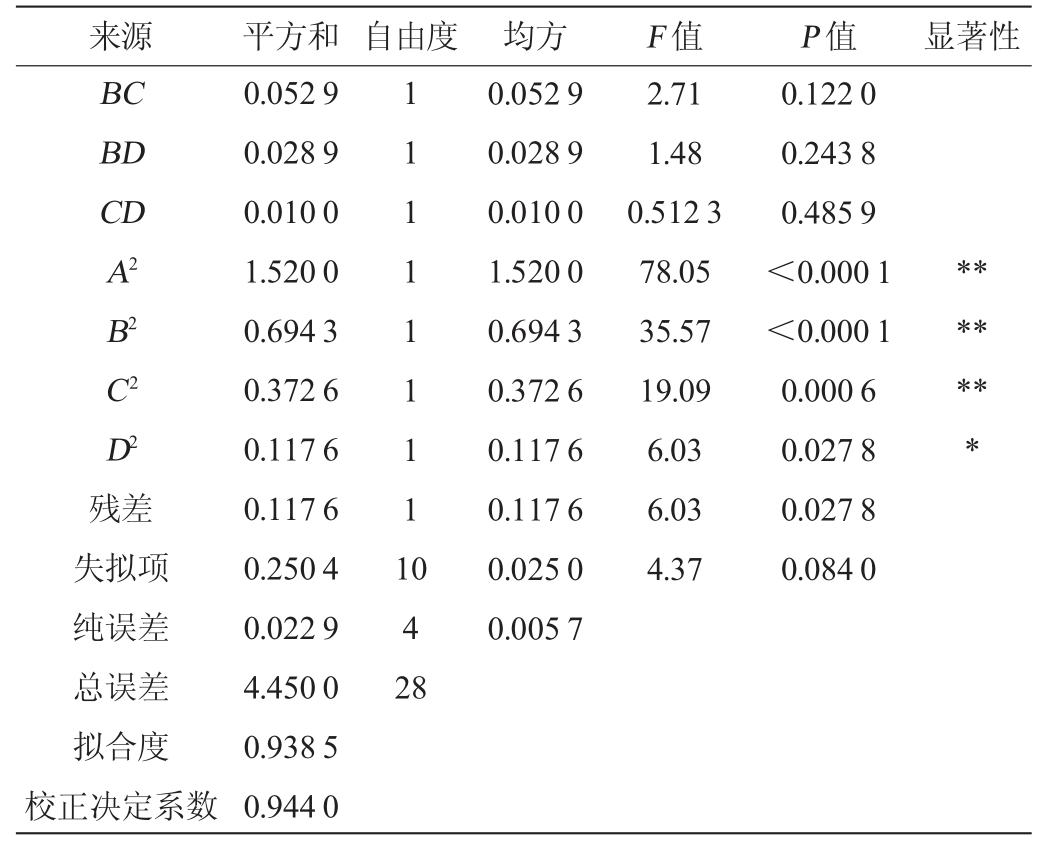
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
来源 平方和 自由度 均方 F 值 P 值 显著性BC BD CD A2 B2 C2 D2残差失拟项纯误差总误差拟合度校正决定系数0.052 9 0.028 9 0.010 0 1.520 0 0.694 3 0.372 6 0.117 6 0.117 6 0.250 4 0.022 9 4.450 0 0.938 5 0.944 0 1 1 1 1 1 1 1 1 1*******0 4 2 8 0.052 9 0.028 9 0.010 0 1.520 0 0.694 3 0.372 6 0.117 6 0.117 6 0.025 0 0.005 7 2.71 1.48 0.512 3 78.05 35.57 19.09 6.03 6.03 4.37 0.122 0 0.243 8 0.485 9<0.000 1<0.000 1 0.000 6 0.027 8 0.027 8 0.084 0
采用Design Expert V10.0.7软件对表2数据进行多元回归拟合得到二次多项回归方程为:Y=3.886 00-0.090 833A+0.332500B+0.054167C+0.224167D-0.007500AB-0.092500AC-0.007 500AD-0.115 000BC+0.085 000BD+0.050 000CD-0.484 667A2-0.327 167B2-0.239 667C2-0.134 667D2
由表3可知,回归模型极显著(P<0.01),失拟项不显著(P>0.05),故表明此模型数据可行,误差较小。决定系数R2为0.938 5,调整决定系数R2Adj为0.944 0,变异系数为4.12(<5),表明模型的拟合度较好。由P值可知,一次项B、D和二次项A2、B2、C2对结果影响极显著(P<0.01),一次项A及二次项D2对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。由F值可知,各因素对丢糟中总黄酮得率影响的主次顺序为:料液比(B)>水浴温度(D)>乙醇体积分数(A)>浸提时间(C)。
2.2.2 验证试验
通过Design Expert V10.0.7软件拟合得到酱香型白酒丢糟中总黄酮的最佳提取条件为:丢糟与乙醇的料液比1∶22.8(g∶mL),乙醇体积分数80.19%,浸提时间28.96 min,水浴温度72.38 ℃,在此条件下,预测的总黄酮得率为4.05%。为了便于实际操作,将最佳工艺条件修订为:丢糟与乙醇的料液比为1∶23(g∶mL),乙醇体积分数80%,浸提时间29 min,水浴温度72 ℃。在此条件下经过3次平行验证试验,得到总黄酮得率的实际值为4.02%,与预测值相差不大,说明模型可行性高。
2.3 酱香型白酒丢糟中总黄酮提取液抗氧化活性测定结果
以VC为对照,丢糟中总黄酮提取液对DPPH自由基和羟基自由基清除率见图5。
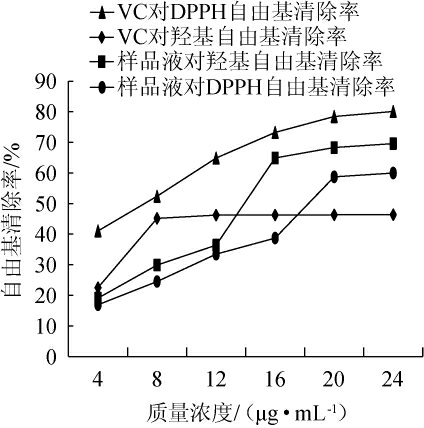
图5 维生素C及丢糟中总黄酮提取液对DPPH自由基和羟基自由基清除率的影响
Fig.5 Effect of vitamin C and total flavonoid extracting solution on scavenging rate of DPPH radicals and hydroxyl radicals
由图5可知,随着总黄酮提取液质量浓度在4~20μg/mL范围内的增加,其对DPPH自由基的清除率不断增加;当总黄酮提取液质量浓度>20 μg/mL之后,对DPPH自由基的清除率逐渐趋于平稳;当总黄酮提取液质量浓度为24 μg/mL时,DPPH自由基清除率达到59.98%,低于VC,半抑制浓度(half maximal inhibitory concentration,IC50)值为18.89 μg/mL。随着总黄酮提取液质量浓度在4~16 μg/mL范围内的增加,其对羟基自由基的清除率不断增加;当总黄酮提取液质量浓度>16 μg/mL之后,对羟基自由基的清除率逐渐趋于平稳;当总黄酮提取液质量浓度为24 μg/mL时,羟基自由基的清除率达69.6%,高于VC,IC50值为14.69 μg/mL。结果表明,酱香型丢糟黄酮对DPPH自由基和羟基自由基有一定的自由基清除能力。
3 结论
通过单因素及响应面试验得到乙醇浸提法提取酱香型白酒丢糟中总黄酮的最佳工艺条件为丢糟与乙醇的料液比1∶23(g∶mL),乙醇体积分数80%,浸提时间29 min,水浴温度72 ℃。在此优化条件下,总黄酮得率为4.02%,总黄酮提取液对DPPH自由基和羟基自由基清除的IC50值分别为18.89 μg/mL和14.69 μg/mL,说明丢糟总黄酮提取液具有一定的抗氧化活性。本研究结果在一定程度上解决了酿酒行业对环境污染的问题,有利于酿酒行业朝着更健康、更绿色、更环保的方向发展,并为富含黄酮配制酒的制备提供理论依据。
[1]李欣.酱香型白酒酒糟资源化利用分析研究[J].酿酒科技,2023(8):128-131.
[2]何菲,先春.影响不同酱香酒总多酚含量的因素探讨[J].中国酿造,2020,39(1):181-185.
[3]张丽华,王小媛,李昌文,等.丢糟再利用的研究进展[J].食品与发酵工业,2017,43(11):250-256.
[4]李芳香,郁建平.酒糟的保存和应用现状[J].山地农业生物学报,2016,35(4):66-71,82.
[5]李芳香,徐丽娜,宋露露,等.酱香型白酒丢糟中多酚提取工艺优化及抗氧化活性分析[J].中国酿造,2023,42(9):175-179.
[6]李晓雪.紫苏黄酮的提取工艺优化、含量分析及降糖活性研究[D].哈尔滨:东北林业大学,2020.
[7]李云龙,李红梅,胡俊君,等.响应面法优化苦荞酒糟黄酮提取工艺的研究[J].中国酿造,2013,32(7):38-42.
[8]HUANG Y S,HO S C.Polymethyl flavones are responsible for the antiinflammatory activity of citrus fruit peel[J].Food Chem,2010,119(3):868-873.
[9]KUROWSKA E M,MANTHEY J A.Hypolipidemic effects and absorption of citrus polyethoxylated flavones in hamsters with diet-induced hypercholesterolemia[J].J Agr Food Chem,2004,52(10):2879-2886.
[10]LE T,LE N L.Antioxidant capacities and betacyanin LC-MS profile of red-fleshed dragon fruit juice(Hylocereus polyrhizus)extracted by ultrasound-assisted enzymatic treatment and optimized by response surface methodology[J].J Food Process Preserv,2021,45(3):e15217.
[11]彭雪.长白山野生软枣猕猴桃总黄酮提取纯化及抗氧化性研究[D].长春:吉林农业大学,2019.
[12]SARFARAZI M, JAFARI S M, RAJABZADEH G, etc.Evaluation of microwave-assisted extraction technology for separation of bioactive components of saffron(Crocus sativus L.)[J].Ind Crop Prod,2020,145:11978.
[13]李申.无花果叶黄酮类成分提取及抗氧化活性研究[D].哈尔滨:东北林业大学,2021.
[14]李欣培,崔立娟,王焜佳,等.超声辅助酶法预处理对黄酒糟蛋白提取的工艺优化及成分分析[J].中国食物与营养,2024,7(4):1-9.
[15]张佳丽,罗毅皓,孙万成,等.青稞酒糟脂溶性成分超临CO2提取工艺优化及其组成分析[J].现代食品科技,2023,39(4):231-238.
[16]王兴东,牟明月,康文艺,等.茅台酱香型酒糟和酒曲脂溶性成分及抗菌活性研究[J].中国酿造,2016,35(12):44-47.
[17]姜福佳.酒糟中活性成分的提取及其活性的研究[D].长春:吉林大学,2009.
[18]张鹏杰.甘霖耀,孙金旭,等.苦荞酒糟黄酮富集生产苦荞蒸馏酒的研究[J].中国酿造,2024,43(2):181-187.
[19]杨杰.酒糟中黄酮类化合物的提取分离及其生物活性研究[D].合肥:安徽农业大学,2023.
[20]赵超,张鑫,高晓娟,等.响应面法优化白酒酒糟总黄酮提取工艺及抗氧化活性研究[J].中国酿造,2024,43(12):205-210.
[21]张喜梅,李琳,陈玲,等.葛根总黄酮提取工艺研究[J].现代食品科技,2008(1):42-45.
[22]ENUJIUGHA V N, TALABI J Y, MALOMO S A, et al.DPPH radical scavenging capacity of phenolic extracts from African yam bean[J].Food Nutr Sci,2012,3:7-13.
[23]CHEN F,HANG G L.Antioxidant activity of polysaccharide from different sources of ginseng[J].Int J Biol Macromol,2018,125:906-908.
[24]章烨雯,臧青民,陈荣,等.金橘叶中总黄酮的提取工艺优化及抗氧化活性研究[J].中国食品添加剂,2022,33(1):46-54.
[25]高欣.中华补血草总黄酮的提取分离及抗氧化活性研究[D].舟山:浙江海洋学院,2013.
[26]MALEŠ I,MARIC′ T,VLADIMIR-KNEŽEVIC′ S,et al.Determination of phenolic content and DPPH radical scavenging activity of functional fruit juices fortified with Thymus serpyllum L.and Salvia officinalis L.extracts[J].Croatica Chemica Acta,2023,96(1):51-57.
[27]杨晓梦,崔世华,徐世豪,等.柚皮总黄酮提取工艺优化及抑菌研究[J].现代园艺,2024,47(9):1-5.
[28]黄成,李筱燕,陈飞燕,等.响应面法优化东革阿里黄酮提取工艺及抗氧化活性分析[J].食品工业,2024,45(4):114-119.
[29]王兴东,牟明月,任雅奇,等.茅台酱香型酒糟中总黄酮及总多酚含量的测定[J].中国酿造,2015,34(10):86-90.