刺梨(Rosa roxburghii)为蔷薇科多年生灌木,在我国分布较广。研究发现,刺梨的花、叶、果实、籽、茎、根均有极高的食、药用价值和经济价值[1]。其中,刺梨果更是肉肥味美,富含超氧化物歧化酶(superoxide dismutase,SOD)、黄酮、多酚、多糖、氨基酸、维生素、微量元素等多种生物活性成分[2-3],具有抗菌、抗氧化[4]、抗肿瘤、免疫调节[5]、降血糖、辐射防护、抗凋亡[6]和预防动脉粥样硬化[7]等药理作用,可应用于食品饮料加工[8]、果酒食醋发酵[9-10]、医药研发、保健饮料[11]生产等诸多行业,刺梨果渣还可作为山羊饲料原料[12]、平菇栽培的培养基主料[13]、食品配料、降解农药的环保酵素制作原料[14]等,有非常广阔的应用前景。《酵素产品分类导则》把酵素定义为:以动物、植物、菌类等为原料,经微生物发酵制得的含有特定生物活性成分的产品。食用酵素最早源于日本,因富含多种生物活性成分,在食品、饲料、酿造及健康领域受到国内外越来越多的关注[15]。目前国内外对于刺梨酵素的研究较少,CHEN Z等[16]研究表明,刺梨酵活原液对小鼠急性肺损伤有明显修复效果,文永岚等[17]研究发现,刺梨酵素化果醋可显著改善酒精诱导小鼠的急性肝损伤。我国刺梨资源丰富,但由于对酵素的研究起步较晚,普遍存在产品单一、品质不稳定等问题[11],深入开展刺梨酵素研究,对推动我国刺梨产业和酵素行业的发展都具有重要意义。
产地不同,气候环境差异较大,所产刺梨果实含有的营养成分及其活性存在一定差异[18-19]。河南省开封市黄河故道境内是我国的刺梨干果主产区,刺梨相关产业已成为当地“乡村振兴”的重要支柱。但现有报道中,关于开封黄河故道产刺梨的研究很少。本研究以开封黄河故道产刺梨干果为原料,植物乳植杆菌(Lactiplantibacillus plantarum)和短乳杆菌(Lactobacillus brevis)为发酵菌种,制备刺梨酵素。以刺梨酵素的SOD酶活为评价指标,在单因素试验的基础上,利用响应面试验优化刺梨酵素的发酵工艺,并探讨分析其抗氧化活性,以期为开封产刺梨的深度加工与产业化开发提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
刺梨干果:河南省开封德圣缘刺梨有限公司;植物乳植杆菌(Lactiplantibacillus plantarum)、短乳杆菌(Lactobacillus brevis):河南工业大学漯河工学院微生物实验室保藏。
1.1.2 化学试剂
白砂糖:市售;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)(均为分析纯):上海麦克林生化试剂有限公司;维生素C(vitamin C,VC)(纯度≥99%):黑龙江新和成生物科技有限公司;SOD试剂盒:南京建成生物工程研究所;磷酸二氢钾、磷酸氢二钠、无水乙醇、甲醇、过硫酸钾(均为分析纯):郑州阿尔法化工有限公司。
1.1.3 培养基
MRS肉汤培养基:上海博微生物科技有限公司。
1.2 仪器与设备
JA5003N型电子精密天平:青岛聚创环保集团有限公司;SW-CJ-IFD型单人单面净化工作台:苏州净化科技有限公司;BTS-150型生化培养箱:英检达仪器(重庆)有限公司;UV-2600型紫外可见分光光度计:上海尤尼柯仪器有限公司;TG16B实验室台式高速离心机:河南信陵仪器设备有限公司;SYP恒温水浴锅:郑州卓成仪器科技有限公司。
1.3 方法
1.3.1 刺梨酵素的制备[20-21]
筛选无机械损伤、无腐烂变质的刺梨干果,去籽,清洗破碎,刺梨与蒸馏水按照料液比1∶3(g∶mL)充分混合打浆,随后在混合料液中添加6%的白砂糖,搅拌均匀。于70 ℃温度下巴氏灭菌15 min,待料液冷却后,接种3%(V/V)乳酸菌混合发酵剂(植物乳植杆菌、短乳杆菌以37 ℃温水活化,按照2∶1体积比混合),于34 ℃恒温密封发酵16 h,过滤即得刺梨酵素成品。
1.3.2 刺梨酵素发酵工艺优化
(1)单因素试验
采用单因素轮换法,以SOD酶活为评价指标,依次考察白砂糖添加量(2%、4%、6%、8%、10%)、乳酸菌发酵剂接种量(1%、2%、3%、4%、5%)、发酵温度(22 ℃、26 ℃、30 ℃、34 ℃、38 ℃)、发酵时间(8 h、12 h、16 h、20 h、24 h)对刺梨酵素品质的影响。
(2)Box-Behnken响应面试验
在单因素试验结果的基础上,选择白砂糖添加量(X1)、接种量(X2)、发酵温度(X3)和发酵时间(X4)为自变量,以SOD酶活(Y)为响应值,进行4因素3水平Box-Behnken响应面试验,优化刺梨酵素发酵工艺。Box-Behnken试验因素与水平见表1。
表1 刺梨酵素发酵工艺优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experimental design for fermentation process optimization of Rosa roxburghii Jiaosu

水平 X1白砂糖添加量/% X2接种量/% X3发酵温度/℃ X4发酵时间/h-1 0 1 4 6 8 2 3 4 30 34 38 12 16 20
1.3.3 刺梨酵素SOD酶活测定
取5 mL刺梨酵素发酵液,4 000 r/min离心15 min,取上清液按照SOD试剂盒标注方法进行测定。
1.3.4 刺梨酵素抗氧化活性测定
(1)DPPH自由基清除能力
参照文献[22]的方法,配制体积分数为0.25%、0.50%、0.75%、1.00%、1.25%的刺梨酵素溶液,各取2 mL依次加入2 mL浓度为0.1 mmol/L的DPPH溶液,充分混匀,室温条件下于黑暗处反应0.5 h,以超纯水作空白组,以VC为阳性对照,于波长517 nm处测定其吸光度值。DPPH自由基清除能力计算公式如下[23]:
式中:A为样品组吸光度值;B为对照组吸光度值;C为空白
组吸光度值。
(2)ABTS自由基清除能力
参照文献[24]的方法,以甲醇为溶剂,配制浓度为7 mmol/L的ABTS溶液,然后与浓度为2.45 mmol/L的过硫酸钾溶液1∶1等体积均匀混合,常温下暗处放置12~16 h后用甲醇稀释,使其在波长734 nm处吸光度值达到0.7±0.02左右,得到ABTS工作液。配制体积分数为0.25%、0.50%、0.75%、1.00%、1.25%的刺梨酵素溶液,各取0.5 mL,分别加入4 mL ABTS工作液,充分混匀,室温条件下于黑暗处反应0.5 h,以超纯水作空白组,以VC为阳性对照,于波长734 nm处测定其吸光度值。ABTS自由基清除能力计算公式如下[25]:
式中:A′为样品组吸光度值;B′为对照组吸光度值;C′为空白组吸光度值。
1.3.5 数据处理
利用SPSS 18.0软件统计处理数据,采用Excel 2010和Origin Pro2022作图,采用Design-Expert 12.0进行响应面试验分析,每组试验均重复3次,取平均值。
2 结果与分析
2.1 刺梨酵素发酵工艺优化单因素试验结果
2.1.1 白砂糖添加量对刺梨酵素品质的影响
白砂糖添加量对刺梨酵素品质的影响见图1。由图1可知,白砂糖添加量为2%~6%时,SOD酶活逐渐上升;当白砂糖添加量为6%时,SOD酶活达到最大,为6 865.28 U/mL;白砂糖添加量为6%~10%时,SOD酶活逐渐下降。这主要是由于当白砂糖添加量过低时,可利用碳水化合物不足,限制了微生物的生长;当白砂糖添加量过高时,高糖环境会导致菌体脱水失活,产物的合成减缓甚至停止[26]。因此,最佳白砂糖添加量为6%。
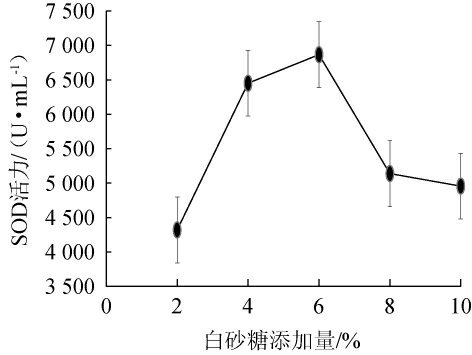
图1 不同白砂糖添加量对刺梨酵素超氧化物歧化酶酶活的影响
Fig.1 Effect of different sugar addition on superoxide dismutase activity of Rosa roxburghii Jiaosu
2.1.2 乳酸菌接种量对刺梨酵素的影响
乳酸菌接种量对刺梨酵素品质的影响见图2。由图2可知,接种量为1%~3%时,SOD酶活逐渐升高;当乳酸菌发酵剂接种量为3%时,SOD酶活达到最大,为7 013.97 U/mL;乳酸菌发酵剂接种量为3%~5%时,SOD酶活逐渐降低。其原因是接种量过低导致发酵速率降低,发酵环境也更容易被有害菌污染,延缓SOD的生成;而接种量过高,又会加快菌种生长代谢,使溶氧匮乏,限制了SOD的生成[27]。因此,选择最佳乳酸菌接种量为3%。
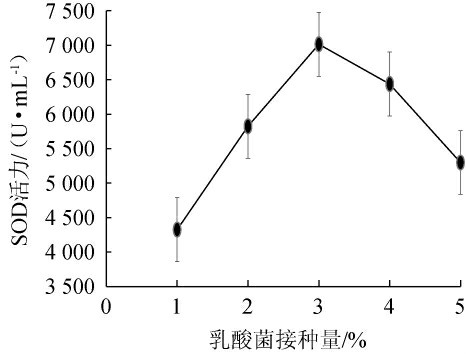
图2 不同接种量对刺梨酵素超氧化物歧化酶酶活的影响
Fig.2 Effect of different inoculum on superoxide dismutase activity of Rosa roxburghii Jiaosu
2.1.3 发酵温度对刺梨酵素的影响
发酵温度对刺梨酵素品质的影响见图3。由图3可知,发酵温度为22~34 ℃时,SOD酶活逐渐上升;当发酵温度为34 ℃时,SOD酶活最大,为6 764.58 U/mL;发酵温度高于34 ℃后,SOD酶活逐渐降低。这可能是由于在过低温度条件下,微生物代谢被限制,代谢速率减慢,从而导致发酵效率降低;而温度过高,菌种酶活性被抑制,从而导致微生物的生长代谢受限[28]。因此,选择最佳发酵温度为34 ℃。
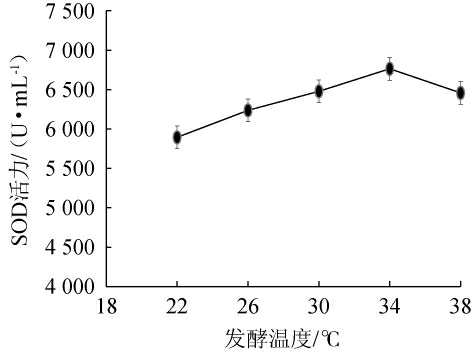
图3 不同发酵温度对刺梨酵素超氧化物歧化酶酶活的影响
Fig.3 Effect of different fermentation temperature on superoxide dismutase activity of Rosa roxburghii Jiaosu
2.1.4 发酵时间对刺梨酵素的影响
发酵时间对刺梨酵素品质的影响见图4。由图4可知,发酵时间为8~16 h时,SOD酶活逐渐升高;当发酵时间为16 h,SOD酶活最大,为6 798.92 U/mL;发酵时间为16~24 h时,SOD酶活逐渐降低。这是因为在一定范围内,发酵时间适当延长,可促进刺梨酵素发酵;但发酵时间过长,会造成可用碳源不足,乳酸菌营养物质匮乏,降低了刺梨酵素发酵效率[29]。因此,选择最佳发酵时间为16 h。
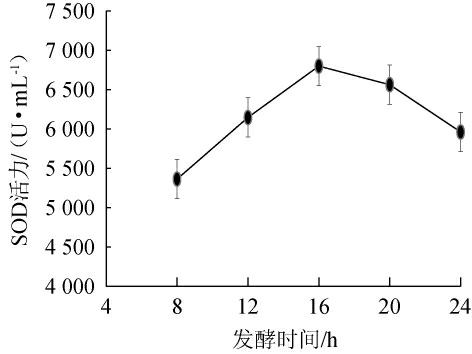
图4 不同发酵时间对刺梨酵素超氧化物歧化酶酶活的影响
Fig.4 Effect of different fermentation time on superoxide dismutase activities of Rosa roxburghii Jiaosu
2.2 刺梨酵素发酵工艺优化响应面试验结果
2.2.1 响应面试验结果及方差分析
在单因素试验基础上,以白砂糖添加量(X1)、接种量(X2)、发酵温度(X3)和发酵时间(X4)为自变量,SOD酶活(Y)为响应值,进行Box-Benhnken响应面试验,响应面试验设计及结果见表2,方差分析结果见表3。
表2 发酵工艺优化Box-Benhnken响应面试验设计及结果
Table 2 Design and results of Box-Benhnken response surface experiments for fermentation process optimization

试验号 X1 X2 X3 X4 Y SOD酶活/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0 1 0 -0 0 0 -0 0 0 0 0 -1 0 -1 0 1 -1 0 0 -11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 1 1 0 0 0 0 0 0 1 -1-1-1 1 0 0 0 0 0 -1 1 0 1 0 1 0 1 0 0 1 0 0 0 1 -1 1 0 0 0 0 0 1 0 0 1 1 -1 0 0 1 0 0 -1-1 1 0 0 0 0 1 -1 0 -1 0 -1 1 0 1 0 0 --1-1 1 0 1 -1 0 0 1 1 0 0 0 -1 0 1 0 0 0 0-1-1 1 1 0 0 0 1 0 6 885.43 7 011.52 6 887.12 6 206.58 6 389.31 7 096.56 6 432.62 7 012.41 6 397.28 7 032.17 6 309.73 6 869.63 6 877.95 6 287.39 6 917.19 7 023.97 7 058.59 6 414.18 6 319.35 7 049.57 6 049.36 7 013.25 6 312.54 6 364.56 6 303.37 6 917.45 6 889.19 7 043.97 6 908.16
表3 回归模型方差分析
Table 3 Variance analysis of regression model
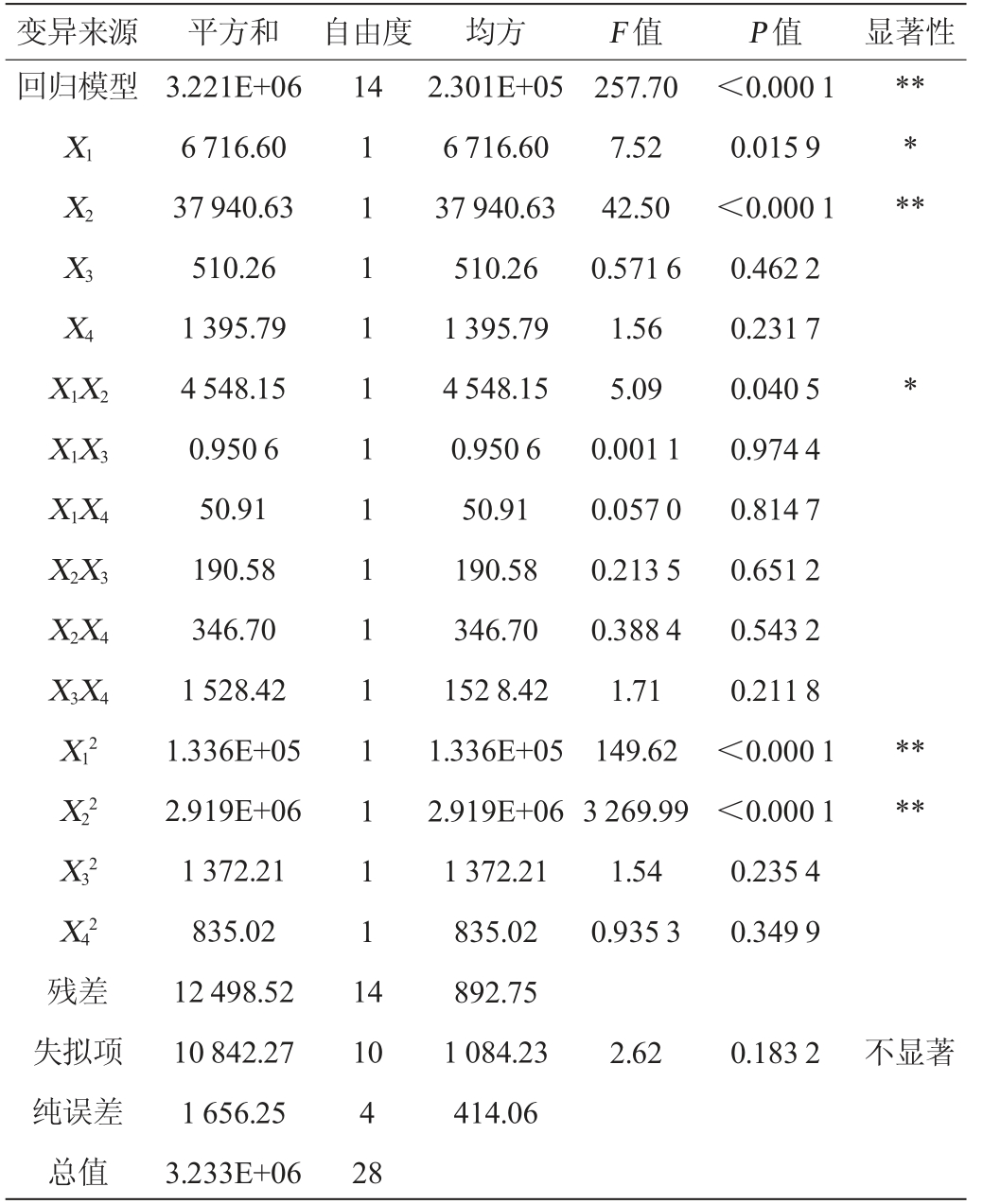
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
变异来源 平方和 自由度 均方 F 值 P 值 显著性回归模型14 X1 X2 X3 X4 X1X2 X1X3 X1X4 X2X3 X2X4 X3X4 X12 X22 X32 X42残差失拟项纯误差总值3.221E+06 6 716.60 37 940.63 510.26 1 395.79 4 548.15 0.950 6 50.91 190.58 346.70 1 528.42 1.336E+05 2.919E+06 1 372.21 835.02 12 498.52 10 842.27 1 656.25 3.233E+06 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 257.70 7.52 42.50 0.571 6 1.56 5.09 0.001 1 0.057 0 0.213 5 0.388 4 1.71 149.62 3 269.99 1.54 0.935 3<0.000 1 0.015 9<0.000 1 0.462 2 0.231 7 0.040 5 0.974 4 0.814 7 0.651 2 0.543 2 0.211 8<0.000 1<0.000 1 0.235 4 0.349 9**********10 4 28 2.301E+05 6 716.60 37 940.63 510.26 1 395.79 4 548.15 0.950 6 50.91 190.58 346.70 152 8.42 1.336E+05 2.919E+06 1 372.21 835.02 892.75 1 084.23 414.06 2.62 0.183 2不显著
通过Design-Expert 12.0软件对表2中数据进行多元回归拟合,得到白砂糖添加量(X1)、接种量(X2)、发酵温度(X3)和发酵时间(X4)对SOD酶活(Y)影响的回归模型为:
Y=7 025.59+23.66X1+56.23X2-6.52X3-10.78X4-33.72X1X2+0.487 5X1X3-3.57X1X4+6.90X2X3+9.31X2X4+19.55X3X4-143.50X12-670.86X22+14.54X32+11.35X42
由表3可知,该回归模型的P值<0.000 1,极显著,失拟项P值>0.05,不显著,表明该模型拟合度表现良好[30],结果可靠。模型的决定系数R2为0.996 1,说明该模型可用于刺梨酵素发酵工艺参数的预测和分析。由F值可知,各参数对SOD酶活的影响大小顺序依次为X2>X1>X4>X3,即接种量>白砂糖添加量>发酵时间>发酵温度。由P值可知,回归模型中一次项X2,二次项X12、X22对结果影响极显著(P<0.01),一次项X1、交互项X1X2对结果影响显著(P<0.05),其余项对结果影响不显著(P>0.05)。
2.2.2 各因素间交互作用对刺梨酵素发酵工艺的影响
各因素间相互作用对结果的影响可以通过响应面及等高线的形状反映,响应面曲线越陡峭,等高线呈椭圆形,表明交互作用对结果影响较大;响应面曲线越平缓,等高线呈圆形,表明交互作用对结果影响较小[31]。白砂糖添加量(X1)、接种量(X2)、发酵温度(X3)和发酵时间(X4)4个影响因素间交互作用对刺梨酵素SOD酶活影响的响应面和等高线见图5。由图5可知,白砂糖添加量(X1)和接种量(X2)的交互作用响应曲面较陡,等高线呈椭圆形,说明白砂糖添加量和接种量之间交互作用对刺梨酵素SOD酶活影响较大,而其他因素交互作用对刺梨酵素SOD酶活影响较小,这与方差分析的结果相一致。
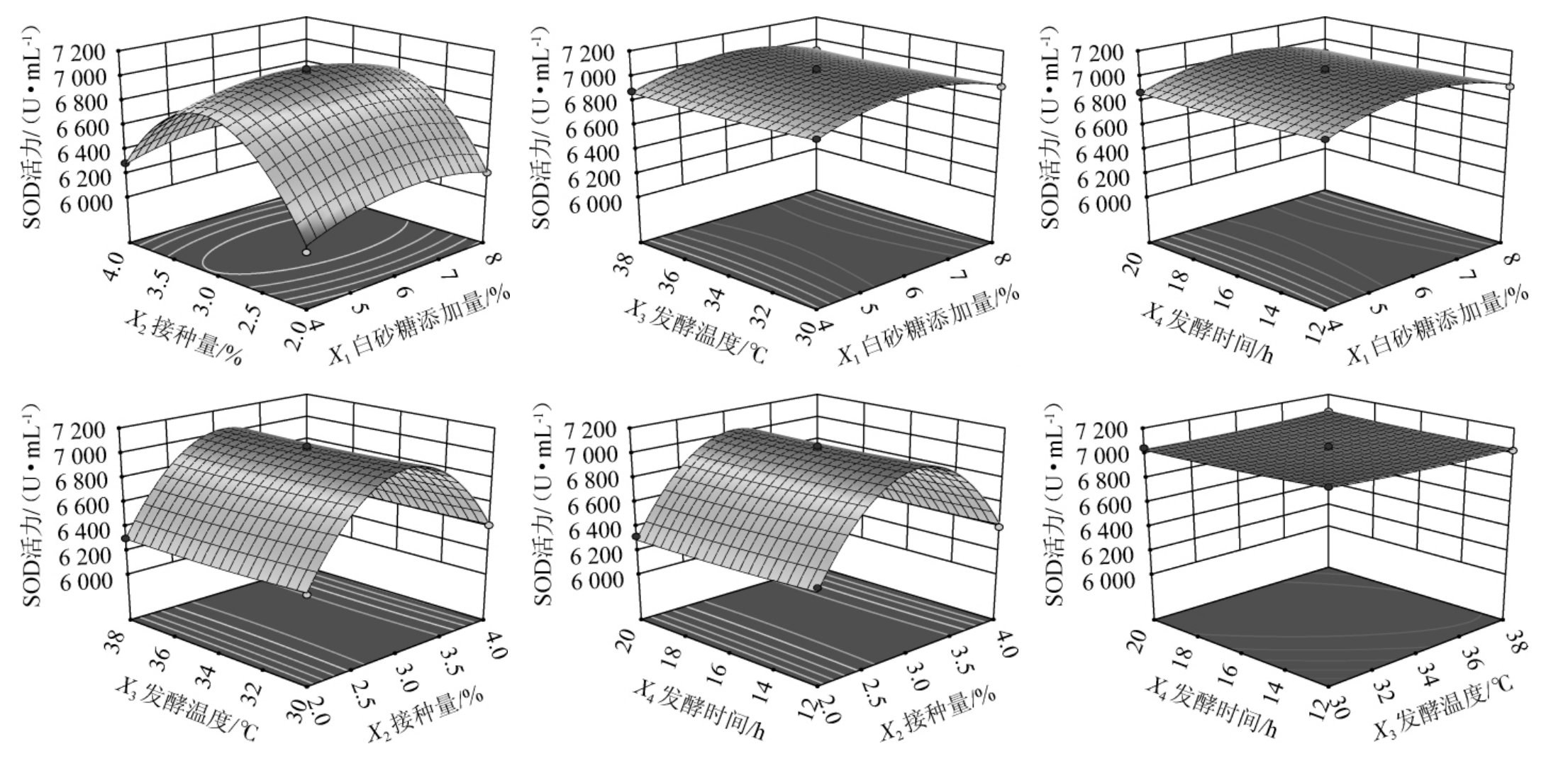
图5 各因素间交互作用对超氧化物歧化酶酶活影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effect of interaction between various factors on superoxide dismutase activities
2.2.3 刺梨酵素发酵最佳工艺参数的确定和验证试验
借助Design Expert 12.0软件对试验结果进行分析,得出刺梨酵素发酵最佳发酵工艺为:白砂糖添加量6.19%、接种量3.21%、发酵温度33.27 ℃和发酵时间17.18 h。在此条件下,SOD活性的预测值为7026.51U/mL。考虑实际可操作性,修正最佳发酵工艺为:白砂糖添加量6%、乳酸菌发酵剂接种量3%、发酵温度33℃和发酵时间为17h。在此优化条件下,进行3次平行验证试验,SOD酶活平均实际值为(7 021.22±3.32)U/mL,与预测值基本相符,表明优化后的参数可信,具有实际应用价值。
2.3 刺梨酵素抗氧化活性分析
刺梨酵素抗氧化活性测定结果见图6。
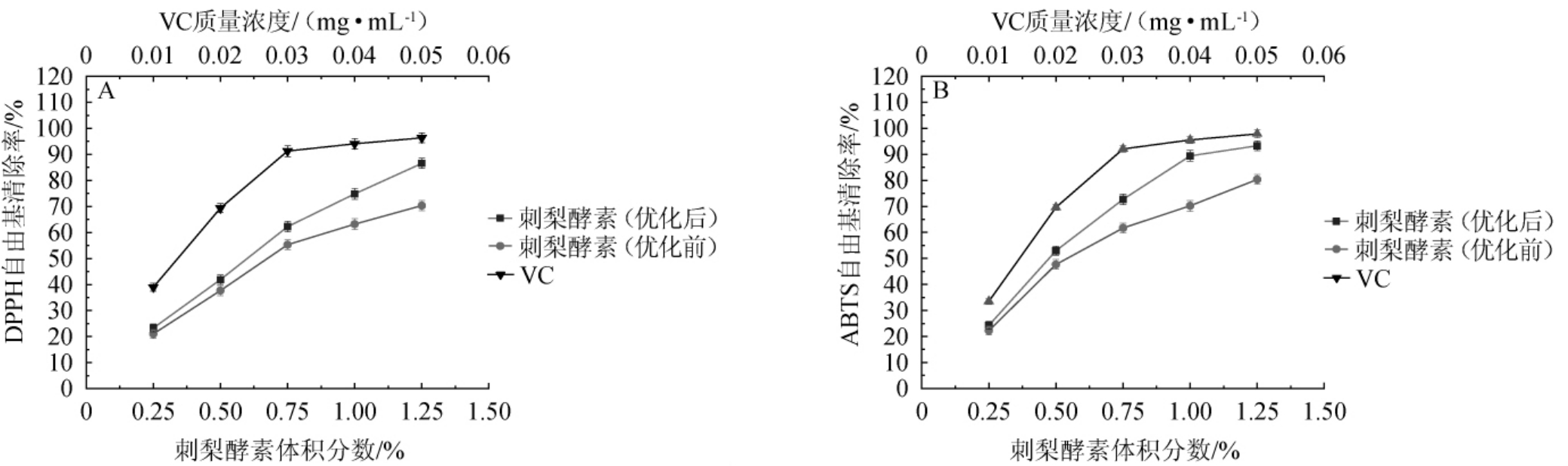
图6 刺梨酵素对DPPH(A)及ABTS(B)自由基清除能力
Fig.6 Scavenging ability of Rosa roxburghii Jiaosu on DPPH (A) and ABTS (B) free radicals
由图6可知,在试验测定浓度范围内,刺梨酵素对DPPH自由基、ABTS自由基的清除效率与刺梨酵素的浓度存在明显正相关,浓度越大,自由基清除效果越好。在刺梨酵素体积分数为1.25%时,DPPH、ABTS自由基清除率分别为86.56%和93.29%。比优化前分别提高了12.98%和15.24%,虽均略低于对照VC,但已表现出良好的对DPPH自由基、ABTS自由基的清除能力。计算得到刺梨酵素对DPPH、ABTS自由基的半抑制浓度(50%inhibiting concentration,IC50)值分别为0.012 mg VC当量/mL和0.013 mg VC当量/mL。
3 结论
本研究以河南开封黄河故道所产刺梨为原料,采用植物乳植杆菌(Lactiplantibacillus plantarum)和短乳杆菌(Lactobacillus brevis)(2∶1)为发酵菌种制备刺梨酵素。采用单因素、响应面试验优化刺梨酵素发酵工艺,并对其进行抗氧化活性测定。结果得到刺梨酵素的最佳发酵工艺为:白砂糖添加量为6%、接种量为3%、发酵温度33 ℃和发酵时间17h。在此最优条件下,SOD酶活为(7021.22±3.32)U/mL。在刺梨酵素体积分数达到1.25%时,DPPH、ABTS自由基清除率分别为86.56%和93.29%,相较于原始发酵组分别提高了12.98%和15.24%,刺梨酵素对DPPH、ABTS自由基的IC50值分别为0.012 mg VC当量/mL和0.013 mg VC当量/mL,说明所得刺梨酵素具有良好的抗氧化活性。本研究结果具有现实应用价值,对刺梨酵素资源的开发和利用提供参考。
[1]WU H Y, LI M M, YANG X R, et al.Extraction optimization, physicochemical properties and antioxidant and hypoglycemic activities of polysaccharides from roxburgh rose (Rosa roxburghii Tratt.) leaves[J].Int J Biol Macromol,2020,165(Part A):517-529.
[2]WANG H, LI Y, REN Z, et al.Optimization of the microwave-assisted enzymatic extraction of Rosa roxburghii Tratt polysaccharides using response surface methodology and its antioxidant and alpha-D-glucosidase inhibitory activity[J].Int J Biol Macromol,2018,112(6):473-482.
[3]王怡,李贵荣,朱毅.刺梨食品研究进展[J].食品研究与开发,2019,40(18):213-218.
[4]ZENG F F,GE Z W,LIMWACHIRANON J,et al.Antioxidant and tyrosinase inhibitory activity of Rosa roxburghii fruit and identification of main bioactive phytochemicals by UPLC-triple TOF/MS[J].Int J Food Sci Tech,2017,52(4):897-905.
[5]YUAN H F,WANG Y R,CHEN H,et al.Protective effect of flavonoids from Rosa roxburghii Tratt.on myocar-dial cells via autophagy[J].3 Biotech,2020,10:1-9.
[6]WANG L,TIAN Y P,ZHANG P,et al.Polysaccharide isolated from Rosa roxburghii Tratt.fruit as a stabilizing and reducing agent for the synthesis of silver nanoparticles:Antibacterial and preservative properties[J].J Food Meas Ch,2022,16(2):1241-1251.
[7]WU P H,HAN S C H,WU M H.Beneficial effects of hydroalcoholic extract from Rosa roxburghii Tratt fruit on hyperlipidemia in high-fat-fed rats[J].Acta Cardiol Sin,2020,36(2):148-159.
[8]陈萍,谭书明,黄颖,等.刺梨、山楂、绿豆饮料的降血脂作用研究[J].食品研究与开发,2019,40(14):57-61.
[9]王宏,李登,黄星源,等.响应面法优化刺梨果酒发酵工艺研究[J].中国酿造,2021,40(6):124-128.
[10]安玉红,陆敏涛,卢秀,等.刺梨果酒通过胰岛素介导的PI3K途径改善1-型糖尿病大鼠机体糖代谢紊乱[J].现代食品科技,2020,36(7):25-33.
[11]魏建敏.刺梨酵素的制备及功能性研究[D].贵阳:贵州大学,2022.
[12]郭子義,马政发,杨艺,等.刺梨果渣对山羊生长性能和血浆脂代谢的影响研究[J].饲料工业,2021,42(15):53-56.
[13]杨勇,杨礼寿,罗忠圣.刺梨果渣栽培平菇过程中蛋白质含量变化研究[J].安徽农业科学,2019,47(21):51-52.
[14]谢丹.刺梨果渣环保酵素发酵工艺的研究[D].贵阳:贵州大学,2020.
[15]杨成玮,袁斌,杨权,等.食用酵素的功能活性及应用研究进展[J].现代食品,2019(9):70-76.
[16]CHEN Z,ZHANG S,SUN X,et al.Analysis of the protective effects of Rosa roxburghii-fermented juice on lipopolysaccharide-induced acute lung injury in mice through network pharmacology and metabolomics[J].Nutrients,2024,16(9):1376.
[17]文永岚,王瑜,万科,等.刺梨酵素化果醋对小鼠急性酒精性肝损伤的改善作用[J].现代食品科技,2023,39(4):26-32.
[18]李跃红,冉茂乾,徐孟怀,等.不同产地刺梨果实品质分析与模糊综合评判[J].安徽农业科学,2020,48(17):202-205.
[19]吴红,罗忠圣,罗宗乾,等.贵州十七个产地刺梨抗氧化活性及抗氧化物质分析[J].北方园艺,2023(20):94-101.
[20]赵春妮,汤鑫鑫,刘可,等.响应面法优化金刺梨酵素发酵工艺[J].中国酿造,2023,42(3):151-156.
[21]王瑜,李立郎,杨娟,等.刺梨酵素发酵工艺优化及发酵前后风味与活性成分分析[J].食品科技,2019,44(10):74-81.
[22]PARHAT R,AYTURSUN A,PAIHEERDING M,et al.Sequential extraction, characterization and antioxidant activity of polysaccharides from Fritillaria pallidiflora Schrenk[J].Int J Biol Macromol,2019,131(6):97-106.
[23]潘雪梅.五倍子与刺梨天然提取物的复合抗氧化剂研究[D].贵阳:贵州大学,2021.
[24]刘毓锋.益生菌发酵水果饮料工艺及品质变化研究[D].广州:华南理工大学,2020.
[25]汪磊.刺梨多糖的分离纯化、降血糖作用及其对肠道微生态的影响[D].广州:华南理工大学,2019.
[26]王荣荣,刘晓媛,涂剑秋.猕猴桃酵素发酵工艺优化及体外抗氧化活性测定[J].中国酿造,2024,43(7):222-228.
[27]LI C,REN Y C,JIANG S H,et al.Effects of dietary supplementation of four strains of lactic acid bacteria on growth, immune-related response and genes expression of the juvenile sea cucumber Apostichopus japonicus Selenka[J].Fish Shellfish Immun,2018,74(3):69-75.
[28]袁晶,康三江,宋娟.响应面法优化乳酸菌发酵苹果浆工艺及其抗氧化活性分析[J].中国酿造,2020,39(12):86-90
[29]陈秋慧,魏建敏,穆先,等.刺梨果渣酵素复合发酵工艺优化[J].中国调味品,2023,48(9):122-130.
[30]GARG D,CHAKRABORTY S,GOKHALE J S.Optimizing the extraction of protein from Prosopis cineraria seeds using response surface methodology and characterization of seedprotein concentrate[J].Lebensm Wiss Technol,2020,117(1):108630.
[31]周书来,王琪,刘琨毅,等.Box-Behnken中心组合设计优化复合豆浆酒发酵工艺[J].中国酿造,2019,38(8):205-210.