酵素是以新鲜水果、蔬菜、食用菌、中草药等为主要原料,借助酵素食品发酵技术,利用乳酸菌、酵母菌、醋酸菌等多种有益菌进行发酵后所产生的具有生物活性的物质[1]。酵素富含丰富的维生素、酶、矿物质、活性物质,在亚洲国家深受青睐[2]。水果酵素是以水果为原料经有益微生物群长时间发酵得到的发酵产品,富含黄酮类、有机酸、酚类等生物活性物质[3-4],具有很强的抗氧化活性[5],主要表现在降血脂、促进肠胃蠕动、提高机体免疫等方面[6],受到消费者及学术界的广泛关注。酵素的发酵方式分为自然发酵和接种发酵,其中接种发酵是通过一种或几种菌种混合接种进行发酵,而自然发酵主要是依赖于水果本身优势菌群进行发酵[7],相对于接种发酵具有更丰富的微生物群落和次级代谢产物[8-9]。
目前对于枇杷酵素的研究主要集中在发酵工艺、抗氧化活性和代谢物质等方面[10-12],关于文旦柚酵素、桔柚酵素的报道较少,但有对其果皮抗氧化活性功能开展研究[13-14]。水果酵素的自然发酵是一个动态变化过程,每种水果的发酵过程中微生物的基质代谢与次级产物变化情况都不一样,导致最佳发酵条件也存在差异[15]。张海燕等[16]研究表明,酵素发酵时间长短会影响产物中活性物质的含量,从而最终影响酵素的理化特性和抗氧化活性。蔡丽琴[17]将5种乳酸菌和2种酵母菌接种到猕猴桃原浆中进行发酵,利用光谱学、色谱学技术对各组猕猴桃酵素发酵过程中的生物活性物质进行分析,为开发具有较高营养价值和美妙风味的益生菌发酵猕猴桃酵素提供了理论指导。余思洁[18]利用植物乳杆菌PMO08制备复合蔬菜酵素,结果显示,植物乳杆菌PMO08发酵显著提高了复合蔬菜酵素的总酚、总黄酮的含量,提高了超氧化物歧化酶(superoxide dismutase,SOD)酶活、蛋白酶酶活,使游离氨基酸含量显著减少。魏雪琴等[19]为了解陈酿玫瑰酵素理化特性和生物活性,对发酵2年的玫瑰酵素的理化成分、酶活力和抗氧化活性进行研究,并与陈酿的洛神花酵素、市售酵素进行比较分析。结果表明,玫瑰酵素的总酸、粗多糖、总蛋白、总酚、总黄酮含量以及α-淀粉酶活力、过氧化氢酶活力、总抗氧化能力均显著高于洛神花酵素和市售酵素(P<0.05)。
本研究以福建特有水果文旦柚、枇杷和桔柚为原材料,采用自然发酵的方式制备水果酵素,探讨发酵过程中发酵液中pH值、总酸、有效活菌数、多糖、总酚、β-葡聚糖酶酶活,羟自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基及2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基清除能力的变化规律,对比研究这3种水果酵素的发酵特性和抗氧化活性,旨在构建水果酵素的综合评价体系,推动水果的高附加值转化与精深加工进程,为地方特色水果加工产业及副产物产业链发展提供技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
文旦柚:福建省仙游县川阳农业科技有限公司;桔柚:福建省仙游县兴泰庄园农业开发有限公司;枇杷:仙游县清风生态农庄有限公司;红糖(食品级):广西马山南华糖业有限责任公司。
1.1.2 化学试剂
乳酸、乳酸钠、无水碳酸钠、酚酞、磷酸、柠檬酸钠、盐酸、硫酸、蒽酮、乙酸乙酯、氢氧化钠、乙酸、乙酸钠、三氯乙酸、无水乙醇、维生素C(vitamin C,VC)(均为分析纯):国药集团化学试剂有限公司;甲醇(色谱纯):德国默克密理博公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)、β-葡聚糖、福林酚溶液(均为分析纯)、没食子酸、葡萄糖标准品(纯度均>98%):上海源叶生物科技有限公司;DPPH、ABTS、羟自由基清除能力检测试剂盒:生工生物工程(上海)股份有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、MRS培养基:广东环凯微生物科技有限公司。
1.2 仪器与设备
Allegra X-15R型高速离心机:德国Beckman公司;LC-2030型高效液相色谱仪:日本岛津公司;SpectraMax M5型酶联免疫仪:美国Molecular Devices公司;KQ5200DE型超声波清洗器:昆山市超声仪器有限公司;DKZ-2B 型电热恒温水浴锅:上海一恒科学仪器有限公司;S20K酸度计:梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 水果酵素的制备
挑选新鲜、无腐烂的文旦柚、枇杷、桔柚,无菌水清洗2~3次后,自然晾干,切片、去除核,按果肉∶红糖∶无菌水质量比为1∶3∶10,28 ℃左右自然发酵,发酵时间90 d(pH值或总酸不再变化),即得水果酵素。发酵期间定期取样(0 d、15 d、30 d、45 d、60 d、75 d、90 d),将发酵液离心(4 000 r/min,4 ℃)后的上清液保存于冰箱中待测。
1.3.2 理化特性分析
pH值的测定:使用pH计;总酸含量:采用GB 12456—2021《食品中总酸的测定》中的酸碱指示剂滴定法测定[20];有效活菌数(酵母菌和细菌菌落数)的测定:采用GB4789.2—2022《食品微生物学检验菌落总数测定》中平板菌落计数法[21];多糖含量的测定:采用蒽酮硫酸法[22];总酚含量的测定:采用福林酚法[23];β-葡聚糖酶活力测定:采用NY/T 911—2020《饲料添加剂β-葡聚糖酶活力的测定-分光光度法》[24]。
1.3.3 抗氧化活性测定
(1)羟自由基清除能力
参照羟自由基清除能力试剂盒的操作说明,在试管中依次加入200 μL 6 mmol/L FeSO4、100 μL H2O、100 μL 6 mmol/L H2O2,立即摇匀,再加入100 μL样品和100 μL 6 mmol/L水杨酸,混匀后37 ℃孵育60 min,在波长536 nm处测定吸光度值A测。用2 μg/mL VC作阳性对照测吸光度值A对;用蒸馏水代替样品测得空白对照吸光度值A空。羟自由基清除能力D计算公式如下:
(2)DPPH清除能力
参照DPPH清除能力试剂盒的操作说明,在试管中加入380 μL 0.02 mg/mL DPPH-乙醇溶液和20 μL样品,充分混匀,室温避光反应20 min,在波长515 nm处测定吸光度值A测。用蒸馏水代替样品测得空白对照吸光度值A空。DPPH自由基清除率计算公式如下:
(3)ABTS自由基清除能力
参照ABTS自由基清除能力试剂盒的操作说明,在试管中加入190 μL ABTS工作液溶液和10 μL样品,充分混匀,静置20 min,在波长734 nm处测定吸光度值A测。用0.2 mol/L磷酸缓冲液(pH 7.4)代替样品测得空白对照吸光度值A空。ABTS自由基清除率计算公式如下:
2 结果与分析
2.1 发酵过程中酵素理化特性的变化
三种水果酵素发酵过程中的pH值、总酸变化,结果见图1。
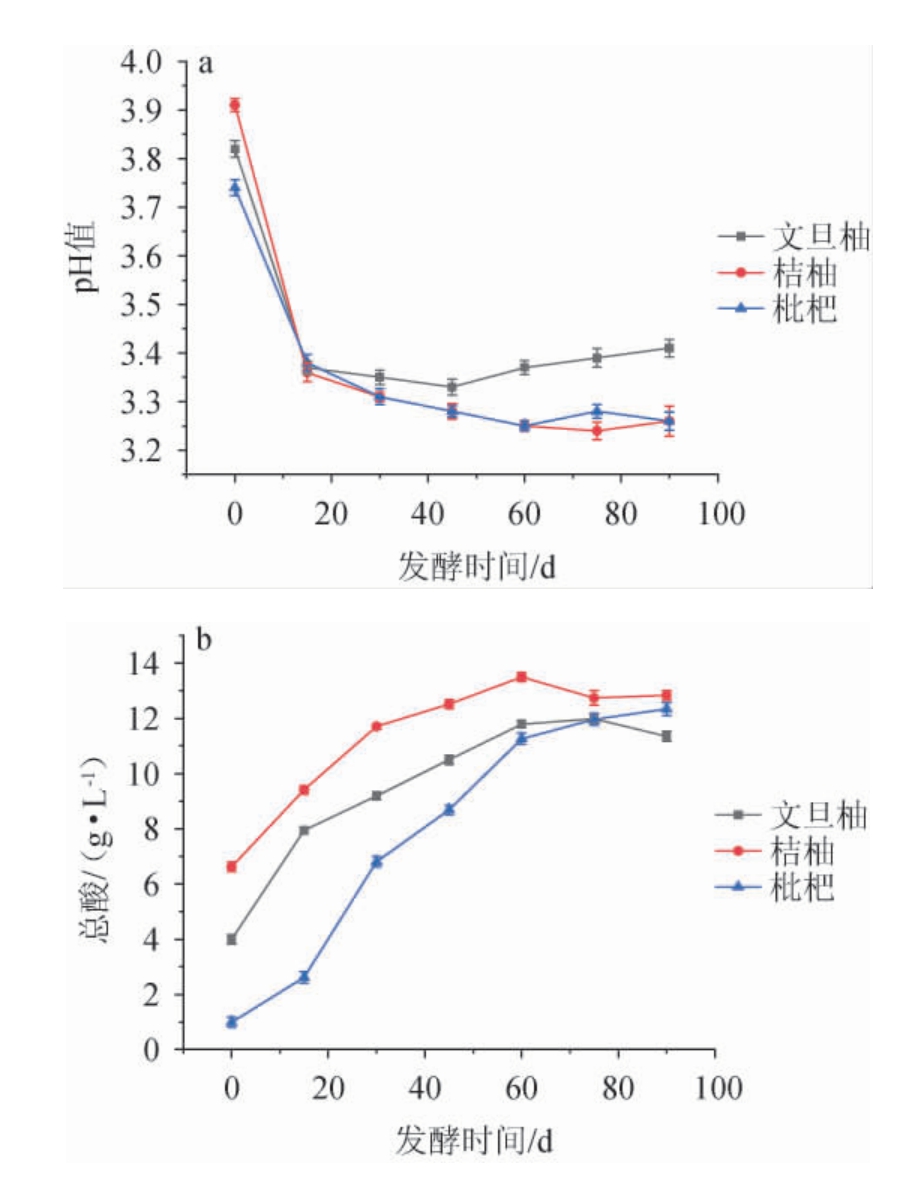
图1 不同水果酵素发酵过程中pH值(a)及总酸含量(b)的变化
Fig.1 Changes of pH value (a) and total acid contents (b) of different fruit Jiaosu during fermentation process
由图1可知,发酵结束时,文旦柚酵素的pH值最高,而其他2种酵素pH值相差不大。三种水果酵素随着发酵时间的延长pH值先降低后维持稳定,而总酸呈现先上升后趋于稳定的趋势。发酵前期可能是酵素中酵母菌大量繁殖,在发酵过程中利用添加的碳源自身代谢产生乙酸、乳酸等有机酸,导致pH呈现下降的趋势,总酸含量增加。发酵后期,一方面添加的碳源基本被利用,微生物代谢缓慢;另一方面,可能是发酵后期体系的低pH值会对乳酸菌的繁殖产生一定的抑制作用,从而导致乳酸菌自身代谢缓慢,因此总酸含量的增加较为缓慢,pH值和总酸含量趋于稳定[8]。
2.2 有效活菌数的变化
取发酵0、15 d、30 d、45 d、60 d、75 d、90 d的发酵上清液,分别在YPD和MRS培养基上进行选择培养,采用国标GB 4789.2—2022《食品微生物菌落总数的测定》中平板菌落计数法测定酵母菌和细菌菌落数,结果见表1。由表1可知,文旦柚、桔柚、枇杷酵素有效活菌数在发酵过程中呈现持续增长趋势,在发酵15 d时细菌菌数迅速上升达到109数量级,发酵90 d时细菌菌数依旧保持在108数量级;同时,在发酵15 d时酵母菌菌数迅速上升达到108数量级,发酵90 d时酵母菌菌数依旧保持在106数量级。说明文旦柚、桔柚、枇杷酵素在0 d时活菌均为水果内部或者表皮携带的自然菌群,随着发酵进行,部分细菌逐渐占据优势地位,可以维持菌群结构的稳定。在发酵初期,发酵环境中营养物质丰富,温度、pH 等条件适宜,微生物适应环境后开始大量繁殖,有效活菌数快速增加。随着发酵的进行,营养物质逐渐被消耗,同时微生物代谢产物开始积累,如有机酸、乙醇等,这些物质会对微生物的生长产生一定的抑制作用,有效活菌数达到一个相对稳定的水平,不再有明显增加,甚至可能会因为细胞衰老、死亡等原因而出现下降[25]。
表1 不同水果酵素发酵过程中有效活菌数的变化
Table 1 Changes of effective viable bacterial counts of different fruit Jiaosu during fermentation process
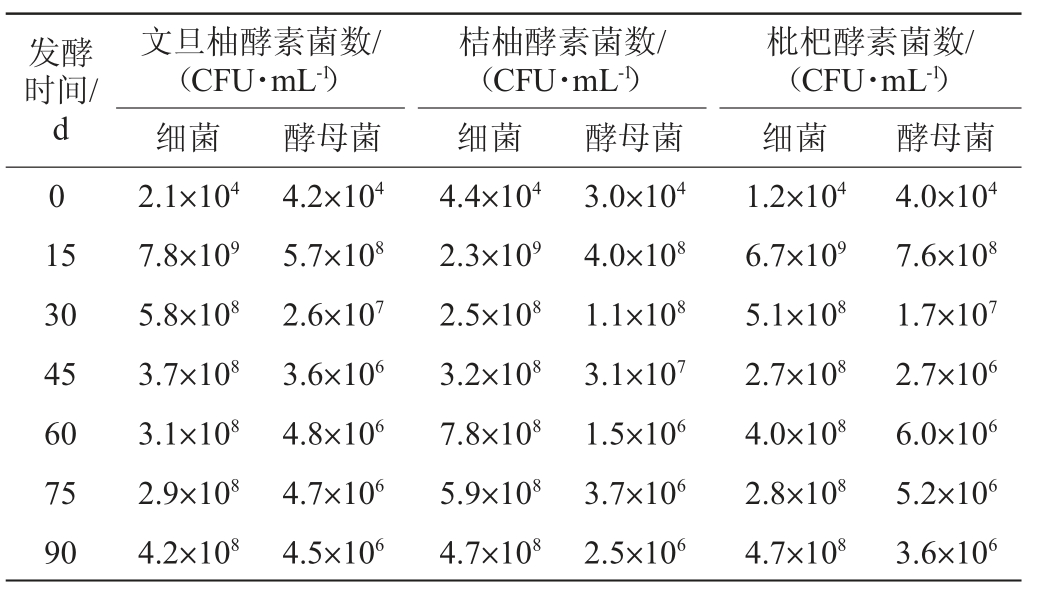
发酵时间/d 0 1 5文旦柚酵素菌数/(CFU·mL-1)细菌桔柚酵素菌数/(CFU·mL-1)细菌酵母菌 酵母菌枇杷酵素菌数/(CFU·mL-1)细菌 酵母菌30 45 60 75 90 2.1×104 7.8×109 5.8×108 3.7×108 3.1×108 2.9×108 4.2×108 4.2×104 5.7×108 2.6×107 3.6×106 4.8×106 4.7×106 4.5×106 4.4×104 2.3×109 2.5×108 3.2×108 7.8×108 5.9×108 4.7×108 3.0×104 4.0×108 1.1×108 3.1×107 1.5×106 3.7×106 2.5×106 1.2×104 6.7×109 5.1×108 2.7×108 4.0×108 2.8×108 4.7×108 4.0×104 7.6×108 1.7×107 2.7×106 6.0×106 5.2×106 3.6×106
2.3 多糖,总酚含量及β-葡聚糖酶活的变化
三种水果酵素发酵过程中多糖、总酚含量及β-葡聚糖酶活变化,结果见图2。
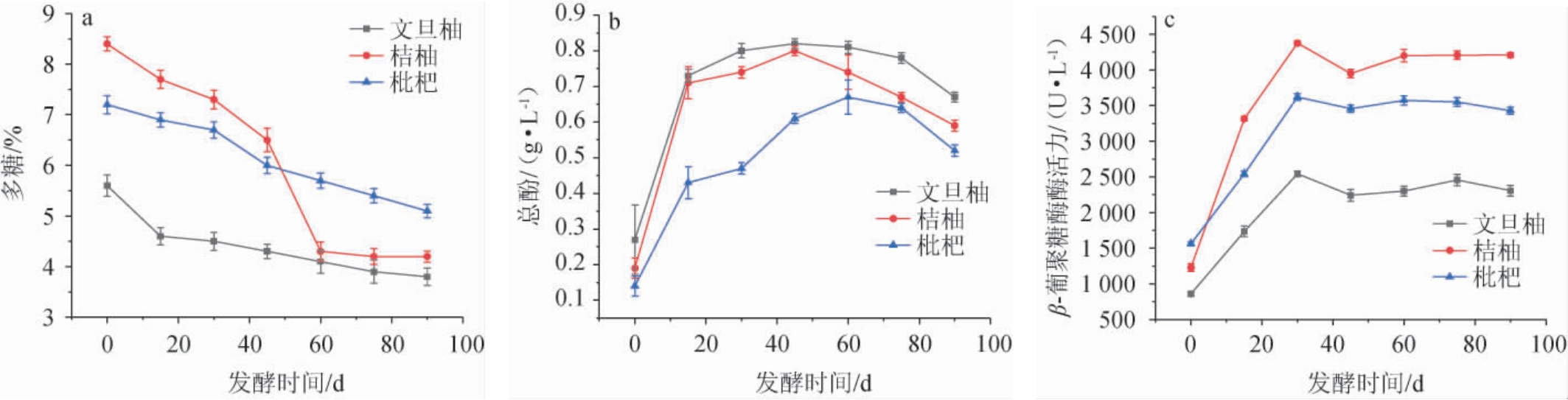
图2 不同水果酵素发酵过程中多糖(a),总酚(b)含量及β-葡聚糖酶酶活力(c)变化
Fig.2 Changes of polysaccharides (a), total phenol (b) content and β-glucanase activities (c) of different fruit Jiaosu during fermentation process
由图2a可知,多糖含量随着发酵时间的增加而减少,其中发酵前期多糖消耗量比较大,发酵后期趋于平稳。这是因为发酵前期添加了糖类作为碳源,前期微生物大量繁殖对于糖类的分解迅速,后期随着微生物自身代谢产生多糖等代谢产物,导致多糖含量趋于平稳。发酵30 d桔柚酵素有效活菌数处于较高水平,总酸含量较高、pH 较为适宜,微生物快速生长繁殖,对糖的消耗速度加快,导致多糖含量下降[26]。
由图2b可知,发酵45 d后文旦柚酵素的总酚含量最高,达到0.82 g/L,其次是桔柚酵素,枇杷酵素的总酚含量最低。发酵过程中三种水果酵素总酚含量均呈现先上升后下降趋势,一方面是随着发酵时间的增加,发酵液中有机酸的含量逐渐升高,酚类化合物会和有机酸发生化学反应,生成酚酸类化合物;另一方面是酚类化合物会和发酵液中的蛋白质结合沉淀,故样品中总酚含量降低[27]。
由图2c可知,三种水果酵素的β-葡聚糖酶活性在0~30 d呈上升趋势,在发酵30 d时达到最高,分别为文旦柚酵素2 541.79 U/L、桔柚酵素4 376.44 U/L、枇杷酵素3 621.32 U/L;在发酵30~90 d时,β-葡聚糖酶活性趋于稳定。其中桔柚酵素的β-葡聚糖酶活性在30 d达到最高,为4 376.44 U/L。发酵开始后,微生物在适应环境的过程中会逐渐启动相关基因的表达,开始合成β-葡聚糖酶。0~30 d,随着微生物数量的增加和代谢活动的增强,β-葡聚糖酶的合成速度也会加快,酶活性快速上升。30~90 d,微生物的生长和代谢处于旺盛阶段,β-葡聚糖酶的合成量与降解量达到相对平衡,但伴随着pH 值的改变、代谢产物积累等,影响了微生物的生长和代谢,导致β-葡聚糖酶的合成减少,同时酶的降解和失活速度可能会加快,使得酶活性逐渐下降[28]。
总体来看,三种水果酵素在发酵期间,多糖含量随着发酵时间的增加而减少、总酚含量呈现先上升后下降趋势、β-葡聚糖酶活性呈现先上升后平稳的趋势,变化背后均受微生物活动、发酵环境及物质间相互作用等因素影响。
2.4 发酵过程中抗氧化活性的变化
三种水果酵素发酵过程中羟自由基、DPPH自由基、ABTS自由基清除能力,结果见图3。
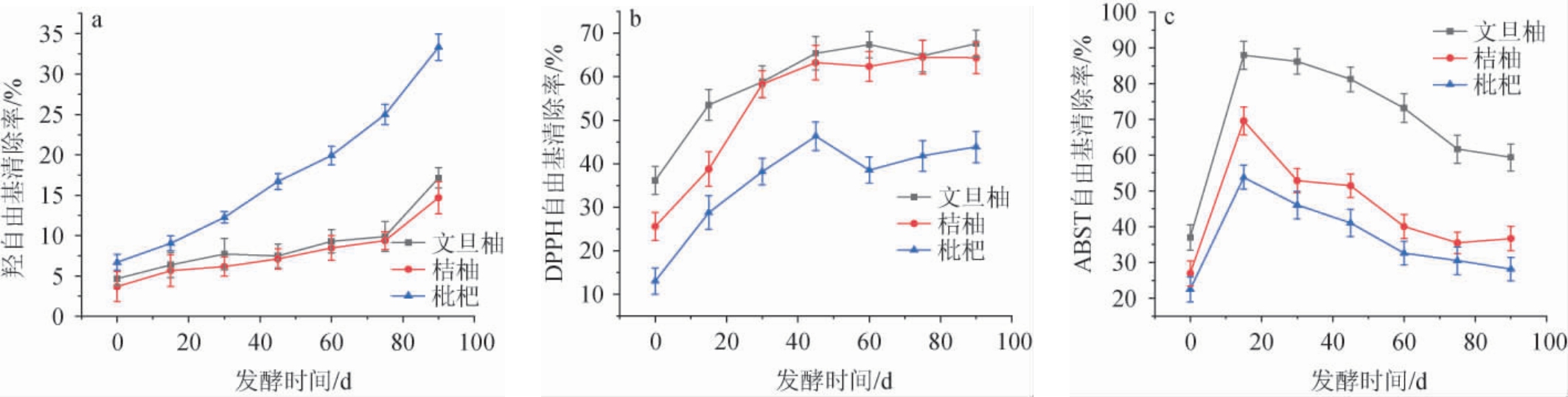
图3 不同水果酵素发酵过程中羟自由基(a),DPPH自由基(b)及ABTS自由基(c)清除率的变化
Fig.3 Changes of hydroxyl radical (a), DPPH radical (b) and ABTS radical (c) scavenging rates of different fruit Jiaosu during fermentation process
由图3a可知,三种水果酵素的羟自由基清除率随着发酵时间的增加而增加,其中,枇杷酵素的羟自由基清除率最高,90 d达到了33.32%,这可能与枇杷酵素的pH最低有关,低pH值有利于乳酸菌等有益微生物的生长和抗氧化物质的产生,进而提高羟自由基清除率[10]。结果表明,发酵对于三种水果的羟自由基清除率的提高显著,枇杷酵素从6.71%提高到33.32%,文旦柚酵素从4.69%提高到17.14%,桔柚酵素从3.69%提高到14.69%。
DPPH自由基是一种比较稳定的自由基,被广泛运用于短时间内评价样品的抗氧化活性[28]。由图3b可知,与发酵前的新鲜水果相比,三种水果酵素的DPPH自由基清除率都有所提升,发酵45 d,随着微生物逐渐适应环境开始大量繁殖,其代谢活动增强,产生一系列具有抗氧化活性的物质,如多酚类、黄酮类化合物以及一些酶类等。这些物质能够与DPPH自由基发生反应,使DPPH 清除率快速升高,这时三种水果酵素的DPPH自由基清除率都处于自身的较高水平,其中文旦柚酵素的DPPH自由基清除率最高达65.4%,同期文旦柚酵素的多酚含量在三种水果酵素中也是最高的达0.82 g/L,与PERTUZATTI P B等[29]研究结果一致。
由图3c可知,文旦柚酵素对ABTS自由基清除率最高,枇杷酵素最低。三种水果酵素的ABTS自由基清除率在发酵0~15d呈快速上升趋势,发酵15~90d呈缓慢降低趋势,在发酵15d对ABTS自由基清除率达到最大值,分别为文旦柚酵素87.96%、桔柚酵素69.6%、枇杷酵素53.8%。理论上,ABTS自由基清除率于酚类物质有显著的正相关性[30],同期文旦柚酵素的多酚含量在三种水果酵素中也是最高的,本研究中ABTS自由基清除率也与总酚含量也呈现正相关。
3 结论
本研究以福建特有水果文旦柚、枇杷和桔柚为原材料,采用自然发酵的方式制备水果酵素,探讨发酵过程中发酵液中pH值、总酸、有效活菌数、多糖、总酚、β-葡聚糖酶酶活、羟自由基、1,1-二苯基-2-三硝基苯肼(DPPH)自由基及2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)自由基清除能力的变化规律。结果表明,在酵素发酵过程中,3种水果酵素的pH值呈先下降后趋于稳定,总酸呈先上升后趋于稳定,有效活菌数呈持续增长趋势,多糖含量呈下降趋势。文旦柚和桔柚酵素在发酵45 d 时总酚含量最高,分别为0.82 g/L、0.80 g/L,枇杷酵素在发酵60 d时总酚含量最高(0.67 g/L);β-葡聚糖酶酶活性在30 d最高(2541.79~4376.44 U/L)。3种酵素中,枇杷酵素羟自由基清除率最高,可达33.32%;文旦柚酵素DPPH、ABTS自由基清除率最高,分别可达65.4%、87.96%。水果酵素有着丰富的代谢产物和较好的体外抗氧化能力,有望应用于健康食品的研发,在抗衰老,美容护肤等领域。
[1]李占东,王丁,李皓.酵素主要功能及其行业展望[J].食品工业,2019,40(1):301-303.
[2]FENG Y J,ZHANG M,MUJUMDAR S A,et al.Recent research process of fermented plant extract:A review[J].Trends Food Sci Tech,2017,65(7):40-48.
[3]YANG F J, HOU C, ZENG X, et al.The use of lactic acid bacteria as a probiotic in swine diets[J].Pathogens,2015,4(1):34-45.
[4]张梦梅,刘芳,胡凯弟,等.酵素食品微生物指标与主要功效酶及有机酸分析[J].食品与发酵工业,2017,43(9):195-200.
[5]金哲宁,方晟,沙如意,等.沙棘酵素功能成分及其体外抗氧化性能研究[J].食品研究与开发,2020,41(17):20-28.
[6]高庆超,常应九,马蓉,等.微生物酵素的研究进展[J].食品研究与开发,2020,41(2):190-195.
[7]王荣荣,刘晓媛,涂剑秋.猕猴桃酵素发酵工艺优化及体外抗氧化活性测定[J].中国酿造,2024,43(7):222-228.
[8]李希羽,高洁,李云姣,等.水果酵素自然发酵过程中优势菌群与有机酸变化规律分析[J].食品科学,2020,41(24):61-68.
[9]周清丽,周绍琴,周艳.自然发酵猕猴桃果酒中降苹果酸酵母的筛选与鉴定[J].中国酿造,2023,42(12):76-80.
[10]付龙威,汤晓娟,林祥娜,等.枇杷酵素自然发酵过程中有机酸及其抗氧化活性的研究[J].食品研究与开发,2021,42(4):42-47,54.
[11]陈洲琴,张祝兰,程贤,等.枇杷酵素发酵过程生物学特性和主要功效酶活性研究[J].福建农业科技,2023,54(10):23-28.
[12]姚晓云,刘金,岳希洁,等.枇杷酵素发酵工艺优化及其品质分析[J].食品工业,2024,45(7):12-15.
[13]卢锦澜.中国10产地文旦柚果皮化学成分及生物活性研究[D].北京:中央民族大学,2020.
[14]李鸾翔,唐小霄,张画喜,等.沃柑、红江橙和建阳桔柚果皮精油成分的比较分析[J].中国南方果树,2023,52(3):35-40.
[15]杨小幸,周家春,陈启明,等.苹果酵素天然发酵过程中代谢产物的变化规律[J].食品科学,2017,38(24):15-19.
[16]张海燕,康三江,袁晶,等.苹果酵素自然发酵过程中生物活性物质的变化[J].中国酿造,2021,40(3):111-114.
[17]蔡丽琴.猕猴桃酵素发酵过程中代谢产物变化规律研究[D].杭州:浙江工商大学,2022.
[18]余思洁.复合蔬菜酵素发酵、后熟过程中功能活性及体外消化特性的研究[D].重庆:西南大学,2021.
[19]魏雪琴,黄珍珍,刘芳,等.陈酿玫瑰酵素理化特性及抗氧化活性[J].食品工业,2021,42(11):227-232.
[20]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 12456—2021 食品中总酸的测定[S].北京:中国标准出版社,2021.
[21]国家卫生健康委员会,国家市场监督管理总局.GB 4789.2—2022 食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2022.
[22]张媛媛,张彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J].食品科学,2016,37(4):158-163.
[23]范昊安,薛淑龙,王高坚,等.紫苏叶酵素发酵过程中代谢产物与抗氧化活性研究[J].中国酿造,2019,38(9):148-154.
[24]中华人民共和国农业农村部.NY/T 911—2020 饲料添加剂β-葡聚糖酶活力的测定分光光度法[S].北京:中国标准出版社,2020.
[25]晏殊.水果酵素自然发酵中优势菌株的分离鉴定及其代谢产物功效特性的研究[D].长沙:中南林业科技大学,2019.
[26]张海燕,康三江,袁晶,等.不同菌种组合对沙棘酵素发酵过程中理化指标及活性物质变化的影响[J].食品安全质量检测学报,2023,14(16):268-276.
[27]周偏,蔡坤,梁丛颖,等.诺丽酵素在自然发酵过程中体外抗氧化活性变化及品质研究[J].中国酿造,2018,37(1):92-96.
[28]PANAT N A, MAURYA D K, GHASKADBI S S, et al.Troxerutin, a plant flavonoid,protects cells against oxidative stress-induced cell death through radical scavenging mechanism[J].Food Chem,2016,194:32-45.
[29]PERTUZATTI P B,BARCIA M T,JACQUES A C,et al.Quantification of several bioactive compounds and antioxidant activities of six cultivars of Brazilian blueberry[J].Nat Prod J,2012,2(3):188-195.
[30]XU B,CHANG S K C.Total phenolics,phenolic acids,isoflavones,and anthocyanins and antioxidant properties of yellow and black soybeans as affected by thermal processing[J].J Agr Food Chem,2008,56(16):7165-7175.