红曲菌(Monascus)作为一种分布广泛的真菌,已经在多个领域展现出其独特的应用价值。它们不仅在食品工业中扮演着关键角色[1],而且在医药、化工以及农业等诸多领域也有着不可忽视的地位[2]。特别值得一提的是,莫纳可林K(Monacolin K,MK)(又称为洛伐他汀)作为一种高效的降脂活性物质,因其能够有效地抑制胆固醇合成酶(cholesterol 7-alpha hydroxylase,CYP7A1)的活性[3]而受到了研究者们的高度关注和研究。
MonacolinK有两种结构,一种是内酯式,一种是酸式[4]。酸式Monacolin K化学结构复杂且精细,其合成途径是通过一系列特定的化学反应,将聚酮化合物的合成过程转化为他汀类物质[5]。酸式的Monacolin K与人类胆固醇生物合成通路中3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)结构类似,可竞争抑制胆固醇合成关键酶HMG-CoA,进而抑制胆固醇合成[6];而内酯式的Monacolin K只是一种前体药物,本身不具有活性,需经体内羧基酯酶将其转变为酸性结构,才能更好地发挥降血脂功效[7]。因此,酸式Monacolin K的含量是衡量红曲产品的降脂效果的一项重要指标。天然发酵制得的功能型红曲,其Monacolin K大多为酸式,能够直接起到降低脂肪的功效[8]。
目前,工业上生产Monacolin K的主要途径仍然依赖于红曲菌的发酵过程[9]。尽管这一工艺成熟且稳定,但在实际生产中却经常遇到产量偏低、成本高昂等问题[10]。XU B J等[11]研究发现,添加0.3%乙酸可增加Monacolin K产量,但乙酸挥发性对培养基的pH值有一定影响。因此,经常使用乙酸盐代替乙酸。KAMATH P V等[12]研究表明,添加乙酸钠可显著提高洛伐他汀产量。ZHANG Y R等[13]研究发现,补充精氨酸不仅可以提高莫纳可林K的产量,还可以改变菌丝体的凹陷和折叠程度,使其高于未添加精氨酸的原始菌株。刘帅[14]研究发现,相比对照组试验,利用精氨酸可以明显提高红曲产生Monacolin K的含量。另外,有研究表明[15],在红曲菌发酵过程中人工外源添加碳源或氮源,并且采用响应面优化法对红曲产Monacolin K的固态发酵条件进行优化,可以明显提高MK产量,得到MK实测值为0.258%。FENG Y L等[16]研究表明,用非糯米和大豆粉作为底物时,可以极大限度的提高MK的产量,最终验证的Monacolin K产率为18.733 mg/g,比预测的Monacolin K产率高106.06%。这些研究都为进一步分析莫纳可林K的生物合成奠定了基础。
为了解决这些问题并进一步提高Monacolin K的产量,本研究以紫色红曲霉(Monascus purpureus)作为发酵菌种,以大米为发酵基质,酸式Monacolin K产量作为目标产物,选取L-精氨酸作为代谢调控物质,乙酸钠作为前体物质,以大米为基本基质,辅以适当的营养物质作为养分,将L-精氨酸与乙酸钠在不同发酵时间段分别加入到功能化的固体发酵基质中。在单因素试验基础上,通过响应面法优化红曲霉固态发酵条件,旨在提高酸式Monacolin K的产率,为红曲菌生物发酵产业带来新的发展机遇,进而推动整个红曲菌产业的进步与发展。
1 材料与方法
1.1 材料与试剂
1.1.1 原料菌种
大米:中国黑龙江;产Monacolin K的紫色红曲霉(Monascus purpureus)(CGMCC No.18110):中国微生物菌种保藏管理委员会普通微生物中心和本实验室。
1.1.2 试剂
L-精氨酸(分析纯)、酸式Monacolin K标准品(纯度>98%)、玉米淀粉(生化试剂):上海阿拉丁生化科技股份有限公司;蛋白胨、麦芽浸粉、大豆粉、琼脂(均为生化试剂)、甘油、无水葡萄糖、乙腈、氢氧化钠、磷酸氢二钾、七水硫酸镁、硝酸钠(均为分析纯):国药集团化学试剂有限公司;无水乙酸钠(分析纯):西陇科学股份有限公司。
1.1.3 培养基
固体培养基(麦芽汁琼脂培养基):蛋白胨30 g/L,麦芽汁浸粉30 g/L,琼脂15 g/L,无菌水1 L,于121 ℃条件下灭菌20 min。
种子液培养基[17]:无水葡萄糖60 g/L,蛋白胨25 g/L,玉米淀粉10 g/L,硝酸钠2 g/L,磷酸氢二钾1 g/L,七水硫酸镁1 g/L,无菌水1 L,于121 ℃条件下灭菌20 min。
1.2 仪器与设备
YXQ-LS-50S-Ⅱ立式压力蒸汽灭菌器、SW-CJ-2FD无菌操作台:上海博迅实业有限公司医疗设备厂;ZQTY-70台式全温振荡培养:上海知楚仪器有限公司;1260 Infinity高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦公司;PYX-DHS-BS-Ⅱ隔水式电热恒温培养箱、GZX-9140MBE电热恒温鼓风干燥箱:上海恒跃医疗器械有限公司。
1.3 方法
1.3.1 菌株的活化
紫色红曲霉菌通过平板划线法和三点取样法,将其接种于固体培养基中,于30 ℃恒温培养7 d后,选择生长良好的菌株,在新的固体培养基上进行接种、培养,直到红曲菌平板上长满孢子,这样就获得了纯度较高、易于成活的紫色红曲霉菌。
1.3.2 种子培养液的制备
采用无菌水冲洗紫色红曲霉菌的孢子,然后将其打散、摇匀,制得孢子悬浮液,使其浓度为106个/mL,再与100 mL液体培养液混合,置于250 mL三角瓶中,于30 ℃、180 r/min振荡培养48 h,即得紫色红曲霉菌种子液。
1.3.3 固态发酵
将大米浸泡8 h,以无菌水冲净,滤干水分,蒸熟。称量50 g,放入250 mL三角瓶中,用塑料密封的薄膜密封,在121 ℃条件下灭菌20 min,冷却后在无菌条件下向每个三角瓶中固态发酵基质中接入15%的种子液,拌匀后封口。将其转移到培养室中进行固态发酵。先在30 ℃的条件下恒温静置培养3 d后,为进一步促进菌丝生长,将培养体系移至20 ℃低温条件下继续恒温静置培养21 d,即得红曲米成品。
1.3.4 发酵条件优化
(1)单因素试验
在固态发酵基础上,分别考察发酵时间(12d、15 d、18 d、21 d、24 d、27 d)、接种量(5%、10%、15%、20%、25%、30%)、装料量(30 g/250 mL、40 g/250 mL、50 g/250 mL、60 g/250 mL、70 g/250 mL、80 g/250 mL、90 g/250 mL)、大豆粉添加量(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、甘油添加量(0.5%、1.5%、2.5%、3.5%、4.5%、5.5%)、L-精氨酸添加量(0.2%、0.4%、0.6%、0.8%、1.0%、1.2%)和添加时间(低温发酵的0、24 h、48 h、72 h、96 h、120 h)、乙酸钠添加量(0.05%、0.10%、0.15%、0.20%、0.25%、0.30%)和添加时间(低温发酵的0、24 h、48 h、72 h、96 h、120 h)对酸式Monacolin K产量的影响。
(2)响应面试验
在单因素试验基础上,固定发酵时间为24 d,接种量为15%,装料量为50 g,L-精氨酸添加时间为低温培养72 h时,乙酸钠添加时间为低温培养96 h时,以酸式Monacolin K产量为响应值,以大豆粉添加量(A)、甘油添加量(B)、L-精氨酸添加量(C)及乙酸钠添加量(D)为响应值,采用4因素3水平响应面试验优化发酵条件,Box-Behnken试验因素与水平设见表1。
表1 发酵条件优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments for fermentation conditions optimization
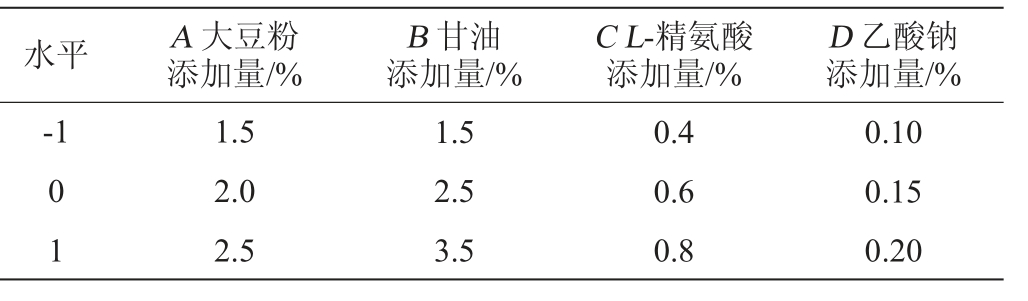
水平 A 大豆粉添加量/%D 乙酸钠添加量/%-1 B 甘油添加量/%C L-精氨酸添加量/%0 1 1.5 2.0 2.5 1.5 2.5 3.5 0.4 0.6 0.8 0.10 0.15 0.20
1.3.5 酸式Monacolin K含量的检测
酸式Monacolin K含量的检测采用HPLC法[17]。
样品处理:将红曲米样品于55 ℃温度下恒温烘干8~10 h,将干燥后的样品研磨成细粉状,通过40目的筛子,去除可能存在的杂质或不均匀的颗粒。准确称取0.06 g的红曲米粉末,并将其加入到容量为10 mL的比色管中。为了进一步增加样品与试剂的接触面积,并确保精确控制,使用体积分数70%的乙醇溶液定容至6 mL。在恒温55 ℃的条件下水浴静置1h。期间每隔20 min摇匀一次样品,以保证均匀混合。水浴完成后取出萃取液,并使用0.22 μm的滤膜进行过滤,得到样品溶液,备用。
高效液相色谱条件:检测波长238 nm,C18色谱柱(150 mm×4.6 mm×5 μm),柱温28 ℃,流动相为水溶液与乙腈(45∶55,V/V)H3PO4溶液作为缓冲液,pH值为2.5,进样量20 μL。流速1.0 mL/min。
酸式Monacolin K标准曲线的绘制:称取20.0 mg Monacolin K标准品,将其置于100mL容量瓶中。在55 ℃的温度下加入90 mL体积分数为70%的乙醇溶液,使用20%氢氧化钠溶液调节溶液的pH至7.7,用70%的乙醇溶液定容,得到质量浓度为200 mg/L的标准溶液。将200 mg/L标准液分别用70%乙醇稀释,得到0、50 mg/L、100 mg/L、150 mg/L和200 mg/L的标准工作溶液,过0.22 μm的滤膜,进行高效液相色谱仪测定。以酸式Monacolin K的质量浓度(X)为横坐标,峰面积(Y)为纵坐标绘制标准曲线,得到线性回归方程Y=57.803X-227.82,相关系数R2为0.999 2。按照标准曲线回归方程计算酸式Monacolin K含量,其计算公式如下:
式中:A0为酸式MK峰面积;4为样品体积,mL;C0为酸式MK标准品质量浓度,μg/mL;A为酸式标准品峰面积;0.04为红曲米质量,g。
1.3.6 数据处理与统计分析
所有实验均重复进行3次,数据以“平均值±标准差”表示。使用SPSS 27.0和Duncan方法,对数据进行方差分析和多重测试分析。在P<0.05时表示差异显著。采用Origin 9.0进行作图。采用Design-Expert 10.0.1软件对响应面试验结果进行统计和分析。
2 结果与分析
2.1 发酵条件优化单因素试验结果
2.1.1 发酵时间对Monacolin K产量的影响
由图1可知,酸式Monacolin K产量在发酵过程中呈现先上升后下降的变化趋势。发酵时间为12~24 d时,酸式MK产量随着发酵时间的延长随之升高;发酵时间为24 d时,酸式Monacolin K产量最高,为2.99 mg/g;发酵时间>24 d之后,酸式Monacolin K产量有所下降。这可能是由于微生物在代谢初期对营养物质需求较高,当发酵培养基的关键营养素被完全耗尽时,微生物的合成速度将开始慢于其消耗速度,导致Monacolin K产量出现下降。因此,最适发酵时间为24 d。
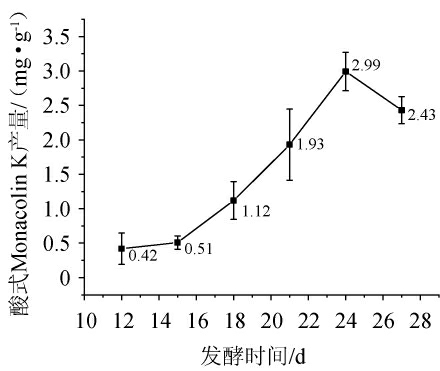
图1 发酵时间对酸式Monacolin K产量的影响
Fig.1 Effect of fermentation time on yield of acidic Monacolin K
2.1.2 接种量对酸式Monacolin K产量的影响
由图2可知,酸式Monacolin K产量随接种量呈现先上升后下降的趋势。接种量为5%~15%时,酸式Monacolin K产量随着接种量的增加而上升;接种量为15%时,酸式Monacolin K产量最高,为3.11 mg/g;接种量>15%之后,酸式MK产量有所下降。接种量增加,更多的微生物参与了发酵过程,从而促进了Monacolin K的积累。但当接种量超过某个临界点时,Monacolin K产生的速率不再随量的增大而线性增加,反而出现了下降的现象。因此,最适接种量为15%。
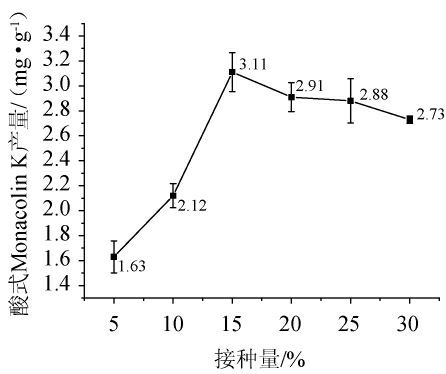
图2 接种量对酸式Monacolin K产量的影响
Fig.2 Effect of inoculum on yield of acidic Monacolin K
2.1.3 装料量对酸式Monacolin K产量的影响由图3可知,酸式Monacolin K产量随着装料量的增大呈现先增大后减小的趋势。装料量为30~50 g/250 mL时,酸式Monacolin K产量随着装料量的增大而上升;装料量为50 g/250 mL时,酸式Monacolin K产量最高,为3.03 mg/g;装料量>50 g/250 mL之后,酸式Monacolin K产量有所下降。因此,最适装料量为50 g/250 mL。
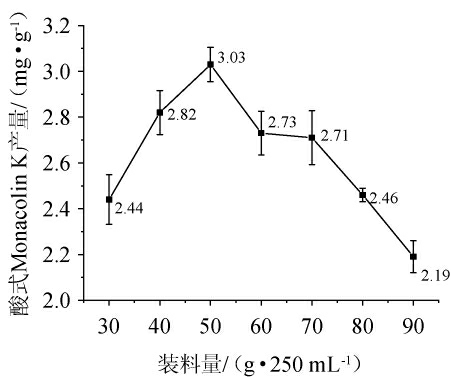
图3 装料量对酸式Monacolin K产量的影响
Fig.3 Effect of loading volume on yield of acidic Monacolin K
2.1.4 大豆粉添加量对酸式Monacolin K产量的影响
外源氮源对菌体生长具有重要作用,适当添加氮源对菌体生长及次生代谢产物积累有促进作用[18]。由图4可知,酸式Monacolin K产量随大豆粉添加量呈现先上升后下降的趋势。大豆粉添加量为0.5%~2.0%时,酸式Monacolin K产量随之增大;大豆粉添加量为2.0%时,酸式Monacolin K产量最高,为4.03 mg/g;大豆粉添加量添加量>2.0%之后,酸式Monacolin K产量降低。过量的氮源会引起细菌的快速生长和快速的营养物质的消耗,从而使二次代谢产物的合成减少。因此,最适大豆粉添加量为2.0%。

图4 大豆粉添加量对酸式Monacolin K产量的影响
Fig.4 Effect of soybean powder addition on yield of acidic Monacolin K
2.1.5 甘油添加量对酸式Monacolin K产量的影响
外源碳源对菌体生长具有重要作用,适当添加碳源对菌体生长及次生代谢产物积累有促进作用[19]。由图5可知,酸式Monacolin K产量随着甘油的添加呈现先上升后下降的趋势;甘油添加量为0.5%~2.5%时,酸式Monacolin K产量随着甘油添加量的增大而升高;甘油添加量为2.5%时,酸式Monacolin K产量最高,为3.92 mg/g;甘油添加量>2.5%之后,酸式Monacolin K产量有所下降。这一现象背后的原因可能与红曲菌的生长代谢有关。在加入甘油之后,虽然红曲菌的生长速率有所加快,但同时也伴随着其次级代谢产物含量的减少。这种平衡的打破可能是导致最终产物Monacolin K含量降低的主要因素之一。因此,甘油最适添加量为2.5%。
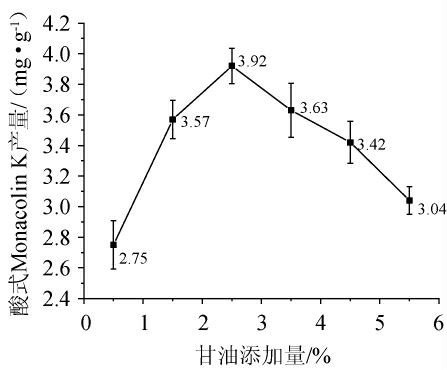
图5 甘油添加量对酸式Monacolin K产量的影响
Fig.5 Effect of glycerol addition on yield of acidic Monacolin K
2.1.6 L-精氨酸添加量及添加时间对酸式Monacolin K产量的影响
L-精氨酸,这种在许多生物体内发挥重要作用的氨基酸,已经被证明是促进酸式Monacolin K生物合成的关键因素。通过精确控制添加量,可以显著增加他汀类物质的产量[20]。
在固态发酵基础上,在紫色红曲霉低温培养时添加L-精氨酸,分别考察不同L-精氨酸添加量及添加时间对酸式Monacolin K产量的影响,结果见图6。
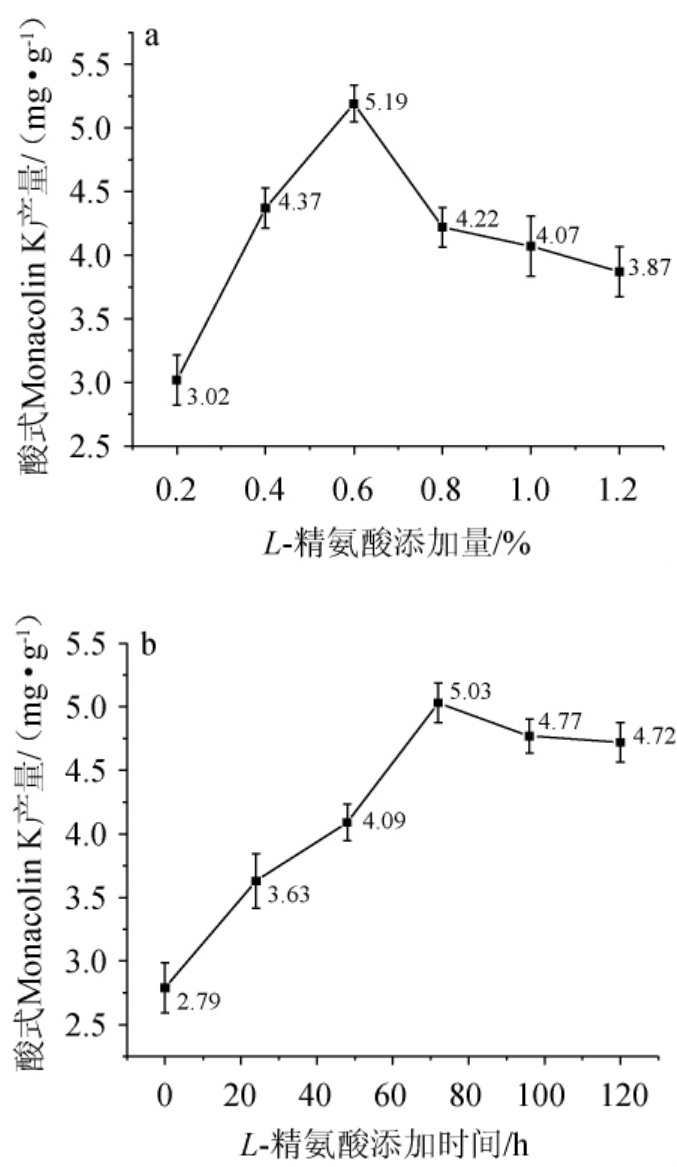
图6 L-精氨酸添加量(a)及添加时间(b)对酸式Monacolin K产量的影响
Fig.6 Effect of L-arginine addition (a) and addition time (b) on yield of acidic Monacolin K
由图6a可知,紫色红曲霉低温培养3 d时添加0.2%~1.2%L-精氨酸,酸式Monacolin K产量随L-精氨酸添加量的增大而呈现先上升后下降的趋势。L-精氨酸添加量为0.2%~0.60%时,酸式Monacolin K产量随之升高;L-精氨酸添加量为0.60%时,酸式Monacolin K产量最高,为5.19 mg/g;L-精氨酸添加量>0.60%之后,酸式Monacolin K产量有所下降。因此,最适L-精氨酸添加量为0.60%。
由图6b可知,L-精氨酸添加量为0.60%,酸式Monacolin K产量随L-精氨酸添加时间的增加而呈现先上升后下降的趋势。低温培养0~72 h时添加L-精氨酸,酸式Monacolin K产量随之升高;低温培养72 h时添加L-精氨酸,酸式Monacolin K产量最高,为5.03 mg/g;低温培养72~120 h时添加L-精氨酸,酸式Monacolin K产量有所下降。L-精氨酸投加过早,发酵过程中的二次代谢产物尚未大量生成,产量较低;若加入得太迟,则会错过Monacolin K的大量合成。因此,加入L-精氨酸的最佳时间为低温培养72 h时。
2.1.7 乙酸钠添加量及添加时间对酸式Monacolin K产量的影响
对比L-精氨酸添加后,酸式Monacolin K产量的增幅,添加乙酸钠后,酸式Monacolin K产量增加较少。但乙酸钠作为合成酸式Monacolin K的前体物质,其添加后酸式Monacolin K产量也明显高于未添加前体物质的MK产量[21-22]。在固态发酵基础上,在紫色红曲霉低温培养时添加乙酸钠,分别考察不同乙酸钠添加量及添加时间对酸式Monacolin K产量的影响,结果见图7。

图7 乙酸钠添加量(a)及添加时间(b)对酸式Monacolin K产量的影响
Fig.7 Effect of sodium acetate addition (a) and addition time (b) on yield of acidic Monacolin K
由图7a可知,紫色红曲霉低温培养4 d时添加0.05%~0.30%乙酸钠,酸式Monacolin K产量随乙酸钠添加量的增大而呈现先上升后下降的趋势。乙酸钠添加量为0.05%~0.30%时,酸式Monacolin K产量随乙酸钠添加量的增加而升高;乙酸钠添加量为0.15%时,酸式Monacolin K产量最高,为4.42 mg/g;乙酸钠添加量>0.15%之后,酸式Monacolin K产量有所下降。因此,最适乙酸钠添加量为0.15%。
由图7b可知,乙酸钠添加量为0.15%,酸式Monacolin K产量随乙酸钠添加时间的增加而呈现先上升后下降的趋势。低温培养0~96 h时添加乙酸钠,酸式Monacolin K产量随之升高;低温培养96 h时添加乙酸钠,酸式Monacolin K产量最高,为4.26 mg/g;低温培养96~120 h时添加L-精氨酸,酸式Monacolin K产量有所下降。因此,加入乙酸钠的最佳时间为低温培养96 h时。
2.2 发酵条件优化响应面试验
2.2.1 响应面设计试验结果及方差分析
在单因素试验基础上,固定发酵时间为24 d,接种量为15%,装料量为50 g/250 mL,L-精氨酸添加时间为低温培养72 h时,乙酸钠添加时间为低温培养96 h时,以酸式Monacolin K产量为响应值,以大豆粉添加量(A)、甘油添加量(B)、L-精氨酸添加量(C)及乙酸钠添加量(D)为响应值,采用4因素3水平响应面试验优化发酵条件,Box-Behnken试验设计结果见表2,方差分析结果见表3。
表2 发酵条件优化Box-Behnken试验设计与结果
Table 2 Design and results of Box-Behnken experiments for fermentation conditions optimization

试验号A 大豆粉添加量/%B 甘油添加量/%C L-精氨酸添加量/%D 乙酸钠添加量/%酸式MK产量/(mg·g-1)123456 7891 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 2.0 2.0 2.5 2.0 2.0 2.0 2.0 2.5 2.0 2.5 1.5 2.0 2.0 2.5 2.0 2.0 2.0 2.0 2.5 1.5 2.0 1.5 2.0 1.5 1.5 2.0 1.5 2.0 2.5 3.5 2.5 2.5 3.5 3.5 1.5 2.5 2.5 1.5 3.5 1.5 2.5 2.5 2.5 2.5 1.5 2.5 2.5 2.5 2.5 2.5 3.5 1.5 2.5 2.5 3.5 2.5 2.5 1.5 0.6 0.6 0.4 0.4 0.6 0.4 0.4 0.6 0.6 0.6 0.6 0.6 0.6 0.6 0.6 0.8 0.8 0.8 0.8 0.6 0.4 0.6 0.6 0.4 0.6 0.8 0.8 0.6 0.6 0.20 0.15 0.15 0.15 0.10 0.15 0.20 0.20 0.20 0.15 0.15 0.15 0.15 0.10 0.15 0.15 0.10 0.20 0.15 0.10 0.10 0.15 0.10 0.15 0.20 0.15 0.15 0.15 0.15 6.65 7.58 5.95 6.31 6.55 6.49 5.69 6.25 6.69 6.93 7.11 7.64 7.61 6.18 7.62 6.33 5.62 5.55 5.98 6.33 5.56 7.13 6.64 6.1 6.41 6.29 5.96 7.59 7.03
表3 回归模型方差分析
Table 3 Variance analysis of regression models
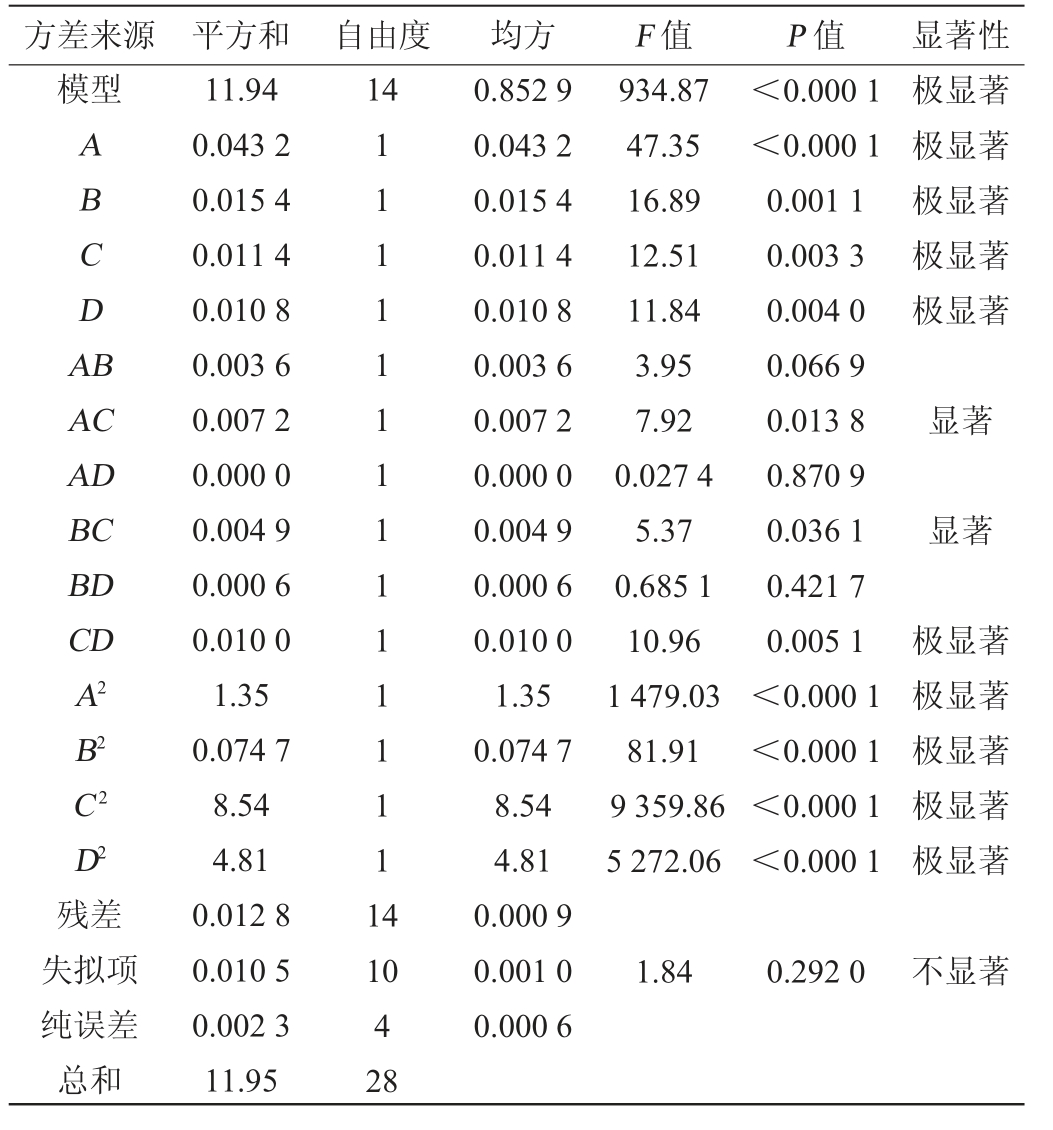
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B极显著极显著极显著极显著极显著AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差总和11.94 0.043 2 0.015 4 0.011 4 0.010 8 0.003 6 0.007 2 0.000 0 0.004 9 0.000 6 0.010 0 1.35 0.074 7 8.54 4.81 0.012 8 0.010 5 0.002 3 11.95 111111111111111 4 934.87 47.35 16.89 12.51 11.84 3.95 7.92 0.027 4 5.37 0.685 1 10.96 1 479.03 81.91 9 359.86 5 272.06<0.000 1<0.000 1 0.001 1 0.003 3 0.004 0 0.066 9 0.013 8 0.870 9 0.036 1 0.421 7 0.005 1<0.000 1<0.000 1<0.000 1<0.000 1显著显著极显著极显著极显著极显著极显著10 4 28 0.852 9 0.043 2 0.015 4 0.011 4 0.010 8 0.003 6 0.007 2 0.000 0 0.004 9 0.000 6 0.010 0 1.35 0.074 7 8.54 4.81 0.000 9 0.001 0 0.000 6 1.84 0.292 0不显著
通过Design-Expert 10.0.1软件对表2数据结果进行二次多元回归拟合,得到酸式Monacolin K产量(Y)与大豆粉添加量(A)、甘油添加量(B)、L-精氨酸添加量(C)和乙酸钠添加量(D)之间二次多元回归方程如下:
Y=-18.017 58+7.087 33A+0.478 33B+33.728 33C+106.505D-0.06AB+0.425AC-0.1AD+0.175BC+0.25BD-5CD-1.824 33A2-0.107 33B2-28.683 33C2-344.433 33D2
由表3可知,该模型P<0.0001极显著,失拟项P=0.2920>0.05,不显著,说明试验结果受到干扰极小。模型决定系数R2=0.998 9,调整决定系数R2adj=0.997 9,说明模型拟合度高,试验方法可靠,可以用于分析预测。由P值可知,模型一次项A,B,C,D,交互项CD,二次项A2,B2,C2,D2对结果有极显著的影响(P<0.01),而交互项AC、BC对结果的影响显著(P<0.05)。由F值可知,各因素对结果影响顺序为大豆粉添加量(A)>甘油添加量(B)>L-精氨酸添加量(C)>乙酸钠添加量(D)。
2.2.2 响应曲面交互作用分析
根据响应面的陡峭程度、等高线的形状及稀疏程度,可以推测各因素交互作用对酸式Monacolin K产量的影响。各种因素间交互作用对酸式Monacolin K产量的影响的响应面及等高线见图8。

图8 各因素间交互作用对酸式Monacolin K产量影响的响应面及等高线
Fig.8 Response surface plots and contour lines of effect of interaction between various factors on yield of acidic Monacolin K
由图8可知,AC、BC的互作效应对结果影响显著(P<0.05);CD互作效应的响应面曲线呈陡峭状态,等高线图接近椭圆状,这说明L-精氨酸与乙酸钠的互作效应对酸式MK产量的影响极显著(P<0.01),这与方差分析结果相吻合。
2.2.3 回归模型的验证及试验结果
通过Design-Expert10.0.1软件分析回归方程可以得出最佳发酵条件为大豆粉添加量1.97%、甘油添加量2.34%、L-精氨酸添加量0.60%、乙酸钠添加量0.15%。在此条件下,酸式Monacolin K的产量预测值为7.61 mg/g。在此基础上,设定了配比为1∶5(大米50 g装于250 mL三角瓶中)、15%接种量、1.97%的大豆粉、2.34%的甘油、0.60%的L-精氨酸和0.15%的乙酸钠,发酵24 d(前3 d 30 ℃,21 d 20 ℃),低温发酵3 d后加入L-精氨酸和低温发酵4 d后加入乙酸钠。在此最优条件进行3次平行验证试验,得到的酸式Monacolin K产量实际平均值为7.59 mg/g,与预测值相似,表明所建立的模型是稳定、可行。
3 结论
本研究以紫色红曲霉(Monascus purpureus)作为发酵菌种,酸式Monacolin K产量作为目标产物,选取L-精氨酸作为代谢调控物质,乙酸钠作为前体物质,以大米为基本基质,辅以适当的营养物质作为养分,以提高其产率。在单因素试验基础上,通过响应面法优化红曲霉固态发酵条件。最佳发酵条件:50 g/250 mL为装料量,添加1.97%的大豆粉,2.34%的甘油,0.60%的L-精氨酸,0.15%的乙酸钠。试验前3 d在常温下30 ℃进行培养,后21 d在20 ℃进行低温培养,共24 d。并且,在低温发酵第3天加入L-精氨酸,在低温发酵第4天加入乙酸钠。在此优化条件下,酸式Monacolin K产量为7.59 mg/g,比未优化前(2.99 mg/g)提高了153.85%。
[1]孙婷,王峰.红曲色素在食品中的应用[J].农产品加工,2019(18):70-72.
[2]詹子悦,赵紫微,王秀莉,等.红曲类保健食品中两种洛伐他汀的鉴定与定量分析[J/OL].分析试验室,1-10[2024-10-17].http://kns.cnki.net/kcms/detail/11.2017.TF.20240705.0927.002.html.
[3]CICERO A F G, FOGACCI F, BANACH M.Red yeast rice for hypercholesterolemia[J].Methodist Debakey Cardiovasc J,2019,15(3):192-199.
[4]HALPIN R A,ULM E H,TILL A E,et al.Biotransformation of lovastatin.V.Species differences in in vivo metabolite profiles of mouse, rat, dog,and human[J].Drug Metab Dispos,1993,21(6):1003-1011.
[5]张怡.基于代谢途径的前体对美伐他汀生物合成的影响[D].重庆:西南大学,2008.
[6]于卓然,洪厚胜.功能性红曲Monacolin K产量控制策略的研究进展[J].食品与发酵工业,2019,45(3):288-292.
[7]LI X M,SHEN X H,DUAN Z W,et al.Advances on the pharmacological effects of red yeast rice[J].Chinese J Nat Med,2011,9(3):161-166.
[8]于卓然,陈程鹏,张耀,等.基于两阶段L-谷氨酸添加的功能性红曲产酸式Monacolin K的发酵工艺优化[J].食品与发酵工业,2020,46(16):127-134.
[9]聂增宇,胡文林,许世锦,等.工业中应用离心喷雾干燥技术制备功能性红曲粉[J].食品与发酵科技,2021,57(6):54-59.
[10]刘小改,李洪媛,袁媛,等.红曲米自动化培养技术开发及工艺优化研究[J].酿酒科技,2023(4):88-94.
[11]XU B J,WANG Q J,JIA X Q,et al.Enhanced lovastatin production by solid state fermentation of Monascus ruber[J].Biot Bioproc Eng,2005,10(1):78-84.
[12]KAMATH P V,DWARAKANATH B S,CHAUDHARY A,et al.Optimization of culture conditions for maximal lovastatin production by Aspergillus terreus (KM017963) under solid state fermentation[J].HAYATI J Biosci,2015,22(4):174-180.
[13]ZHANG Y R,CHEN Z,WEN Q,et al.An overview on the biosynthesis and metabolic regulation of monacolin K/lovastatin[J].Food Funct,2020,11(7):5738-5748.
[14]刘帅.X射线诱变选育红曲霉高产Monacolin K菌株及发酵工艺优化研究[D].长沙:中南林业科技大学,2023.
[15]张安,常聪,孟霞,等.红曲固态发酵产Monacolin K工艺条件的优化[J].中国调味品,2017,42(12):38-43,49.
[16]FENG Y L,SHAO Y,ZHOU Y, et al.Production and optimization of monacolin K by citrinin-free Monascus pilosus MS-1 in solid-state fermentation using non-glutinous rice and soybean flours as substrate[J].Eur Food Res Technol,2014,239(4):629-636.
[17]孙秋婉,洪厚胜.功能性红曲固态发酵工艺优化[J].中国酿造,2024,43(1):237-243.
[18]QIN X,HAN H,ZHANG J,et al.Transcriptomic and metabolomic analyses of soybean protein isolate on Monascus pigments and monacolin K production[J].J Fungi,2024,10(7):500.
[19]FENG Y L, SHAO Y, ZHOU Y, et al.Effects of glycerol on pigments and monacolin K production by the high-monacolin K-producing but citrinin-free strain,Monascus pilosus MS-1[J].Eur Food Res Technol,2015,240(3):635-643.
[20]朱倩倩,张函,王海蛟,等.精氨酸等物质对紫色红曲菌产Monacolin K及红曲色素的影响[J].食品科学技术学报,2021,39(1):96-103.
[21]赵宽,刘宇欣,陆信曜,等.乙酸钠、烟酸对红曲菌白色变种产Monacolin K的影响[J].微生物学通报,2021,48(1):70-81.
[22]LIN L,WU S F,LI Z J,et al.High expression level of mok E enhances the production of Monacolin K in Monascus[J].Food Biotechnol,2018,32(1):35-46.