浓香型白酒以小麦、高梁等粮食为原料,以窖池作为发酵容器,经过固态发酵、蒸馏、陈酿、勾调等生产工艺制作而成[1],具有悠久的历史和深厚的文化底蕴。细菌是浓香型白酒窖池中的主要微生物,其中厚壁菌门的梭状芽孢杆菌(Clostridia)最丰富,其次是拟杆菌门(Bacteroidetes)中的拟杆菌纲(Bacteroidia),它们均可以利用谷物中的淀粉、蛋白质等成分,发酵生成呈香、呈味物质[2-3]。古菌是浓香型白酒窖泥中又一大重要功能菌群,产甲烷古菌(Methanobrevibacter)和产己酸菌(Caproiciproducens)在发酵过程中共同作用可提高窖泥的产己酸能力,是影响浓香型白酒质量关键成分己酸乙酯的重要因素[3-5]。
目前,大量的研究集中于窖泥细菌和真菌群落结构分析,鲜见关于浓香型白酒窖泥古菌群的研究报道。胡晓龙等[6]比较退化窖池不同深度窖泥中的原核微生物差异发现,产甲烷菌是窖泥古菌中的重要功能菌群,产甲烷菌含量是判定窖泥老熟的重要指标。HAN B L等[7]利用高通量测序技术比较四川邛崃地区10年与40年窖泥的微生物差异,结果表明,产己酸菌和产甲烷菌是浓香型白酒窖泥中的核心微生物。REN D L等[8]对泸州地区不同窖龄窖泥微生物研究发现,优质老窖泥中的微生物主要是以产甲烷菌为主的古菌属。CHEN C等[9]利用宏基因组测序对四川绵阳地区窖泥微生物进行研究,结果表明,主要存在的古菌有甲烷杆菌属(Methanobacterium)、甲烷囊菌属(Methanoculleus)和甲烷八叠球菌属(Methanosarcina)。产甲烷菌与浓香型白酒多种风味代谢物的形成和维持酿造微生态系统的稳定性方面起着至关重要的作用[9-12]。但产甲烷菌并不能直接产生挥发性风味化合物(例如丁酸和己酸),而是通过与水解菌、发酵菌和产乙酸菌结合,利用生物厌氧消化过程促进厌氧发酵系统中的碳循环[13-15]。另一方面,它们能够减少挥发性脂肪酸(如乙酸、乳酸、丁酸等)和解除氢胁迫作用[16-17],在白酒酿造厌氧发酵系统中维持发酵性能和复杂微生物群落的稳定性中发挥重要作用[18]。
本研究选择甘肃陇南地区某酒厂(JH)、四川宜宾地区3个不同酒厂(LZ、YQ、XG)和四川成都地区某酒厂(TC)浓香型白酒优质老窖泥样品为研究对象,基于高通量测序技术分析其古菌菌群多样性,并采用主成分分析(principal component analysis,PCA)和层次聚类分析(hierarchical clustering analysis,HCA)探究不同地区酒厂窖泥古菌菌群的差异性。以期深入挖掘不同酒厂窖泥古菌微生物群落结构和功能特征,为了解浓香型白酒窖泥中古菌微生物的多样性和差异性提供关键信息,有助于改进浓香型白酒人工窖泥培养技术。
1 材料与方法
1.1 材料与试剂
1.1.1 窖泥样品
以五点取样法采集甘肃省陇南地区某酒厂(JH)、四川宜宾地区3个不同酒厂(LZ、YQ和XG)和四川成都地区某酒厂(TC)窖泥样品,将样品置于无菌密封袋中,取样完成后快速将所取样品保存在-80 ℃冰箱中备用。
1.1.2 试剂
PowerSoil 脱氧核糖核酸(deoxyribonucleic acid,DNA)分离试剂盒:美国MoBio实验室;BIOWEST西班牙琼脂糖:上海联硕宝为生物科技有限公司;AxyPrep DNA Gel Extraction Kit试剂盒:美国Axygen Biosciences公司;NEXTFLEX Rapid DNA-Seq Kit建库试剂盒:美国Bioo Scientific公司;MiSeq Reagent Kit测序试剂盒v3:美国llumina公司。
1.2 仪器与设备
5424R高温台式冷冻离心机:德国Eppendorf公司;TL-48R粉碎研磨仪:上海万柏生物科技有限公司;QL-901旋涡混合器:海门其林贝尔仪器制造有限公司;NanoDrop2000超微量分光光度计:美国Thermo Fisher Scientific公司;QuantusTM Fluorometer微型荧光计:美国Promega公司;DYY-6C电泳仪:北京市六一仪器厂;GeneAmpR9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司。
1.3 方法
1.3.1 DNA提取和PCR扩增
根据PowerSoil DNA分离试剂盒说明书提取窖泥样品总DNA,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用超微量分光光度计测定DNA浓度和纯度;使用引物对Arch519F(5'-CAGCCGCCGCGGTAA-3')和Arch915R(5'-GTGCTCCCCCGCCAATTCCT-3')对古菌进行PCR扩增,PCR扩增体系(50 μL):5×TransStart FastPfu缓冲液10 μL,10 mmol/L 脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)1 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,Phusion超保真DNA聚合酶1 U,模板DNA 20 ng,双蒸水(ddH2O)补足至50 μL。PCR扩增程序:94 ℃预变性2 min,36个循环(94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸5 min。将同一窖泥样品的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit试剂盒进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用微型荧光计对回收产物进行检测定量,使用建库试剂盒进行建库。利用Illumina公司的Miseq PE250平台交由苏州态和生物科技有限公司进行测序。
1.3.2 数据分析
利用Trimmomatic(v0.36)、Pear(v0.9.6)对Fastq数据进行质控。对于trimmomatic采用滑动窗口策略,窗口大小设置为50 bp,平均质量值为20,最小保留序列长度为120,采用Pear(v0.9.6)去除具有N的序列;利用Flash(v1.20)、Pear(v0.9.6)根据PE的overlap关系对两端序列进行拼接处理,最小overlap设置为10 bp,错配率为0.1,得到Fasta序列;根据已知数据库用uchime方法比对去除Fasta序列的嵌合体,对于未知数据库使用自比对方法进行去除,同时去除不合要求的短序列,最后得到优化序列。将优化序列相似度97%的聚合在一起作为同一操作分类单元(operational taxonomic units,OTU),基于OTU聚类分析结果,对Chao1指数、Shannon指数和Simpson指数进行分析;基于分类学信息,在门和属水平上进行群落结构的统计分析。
1.3.3 数据分析
使用R语言4.1.2进行数据分析及绘图。使用主成分分析(PCA)不同环境样品中微生物进化上的相似性及差异性,并通过层次聚类分析(HCA)中的非加权组平均法非加权平均距离(unweighted pair group method with arithmetic average,UPGMA)构建进化树。
2 结果与分析
2.1 窖泥样品中古菌菌群Alpha多样性分析
通过Illumina MiSeq平台测序分析,共获得343 251条有效序列,质控后获得204 520高质量优化序列,平均序列长度为385.70~385.93 bp。利用稀释性曲线评估不同窖泥测序数据的合理程度,稀释性曲线不仅可以比较测序数据量不同的样本中物种的丰富度,也可以说明样本的测序数据量是否合理。不同地区窖泥样品的古菌菌群OTU稀释性曲线见图1。由图1可知,当测序深度达到20 000以上,所有窖泥样本的曲线末端趋向平缓,表明各个窖泥样本的测序数据量足够,样品中的大多数微生物能够被检测到,测序结果真实可靠,数据可以进行下一步分析。

图1 不同地区窖泥样品的古菌菌群的稀释性曲线
Fig.1 Dilution curves of archaeal communities in pit mud samples from different regions
Chao1指数反映样品中群落的丰富度(物种数量),Shannon指数以及Simpson指数反映群落的多样性。窖泥样品中古菌菌群的Alpha多样性分析结果见表1。由表1可知,宜宾地区酒厂的窖泥样品(LZ)古菌菌群丰富度最高(Chao1指数20.50),尽管宜宾地区酒厂(YQ)和成都地区酒厂(TC)窖泥样品丰富度最低(Chao1指数15.00);但宜宾地区酒厂窖泥样品(LZ)的Shannon指数最高(1.84),而宜宾地区酒厂窖泥样品(YQ)的Shannon指数最低(1.39);说明尽管宜宾地区酒厂(YQ)和成都地区酒厂(TC)窖泥样品有着相同的群落丰富度,但成都地区酒厂(TC)的群落多样性高于宜宾地区酒厂(YQ)窖泥样品。宜宾地区酒厂(XG)窖泥样品的Simpson指数最大(0.36),而宜宾地区酒厂窖泥样品(LZ)最小(0.20)。表明即使在同一地区,不同酒厂之间的窖泥古菌群落多样性也存在较大差异,这可能与当地的气候条件和窖池所处的环境条件有关。
表1 不同地区窖泥样品古菌菌群的Alpha多样性分析结果
Table 1 Results of Alpha diversity analysis of archaeal communities in pit mud samples from different regions
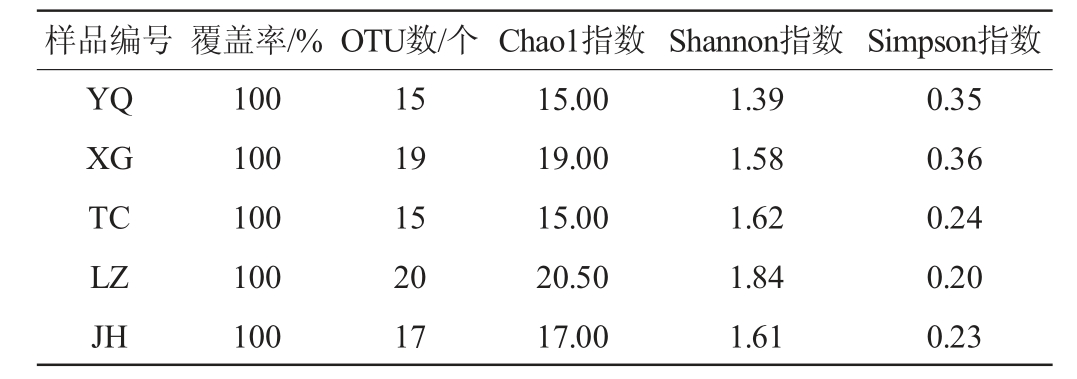
样品编号 覆盖率/% OTU数/个Chao1指数 Shannon指数 Simpson指数YQ XG TC LZ JH 100 100 100 100 100 15 19 15 20 17 15.00 19.00 15.00 20.50 17.00 1.39 1.58 1.62 1.84 1.61 0.35 0.36 0.24 0.20 0.23
2.2 窖泥样品中古菌菌群OTU Venn图分析
不同窖泥样品古菌菌群的操作分类单元数的韦恩图见图2。由图2可知,5个窖泥样品古菌菌群OTU总数为22个,窖泥样品YQ、XG、TC、LZ、JH中的OTU数分别为15个、19个、15个、20个、17个;共有的OTU数目为12个,样品TC、LZ分别存在1个特有的OTU,说明五个窖泥样品的OTU分布情况相似。
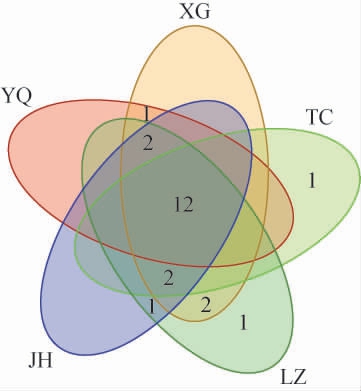
图2 不同地区窖泥样品古菌菌群的操作分类单元数的韦恩图
Fig.2 Venn diagram of operational taxonomic unit numbers of archaeal communities in pit mud samples from different regions
2.3 不同地区来源窖泥古菌菌群结构分析
5个窖泥样品共检测出古菌2门、3纲、4目、6科、9属。基于门和属水平窖泥样品古菌菌群结构见图3。
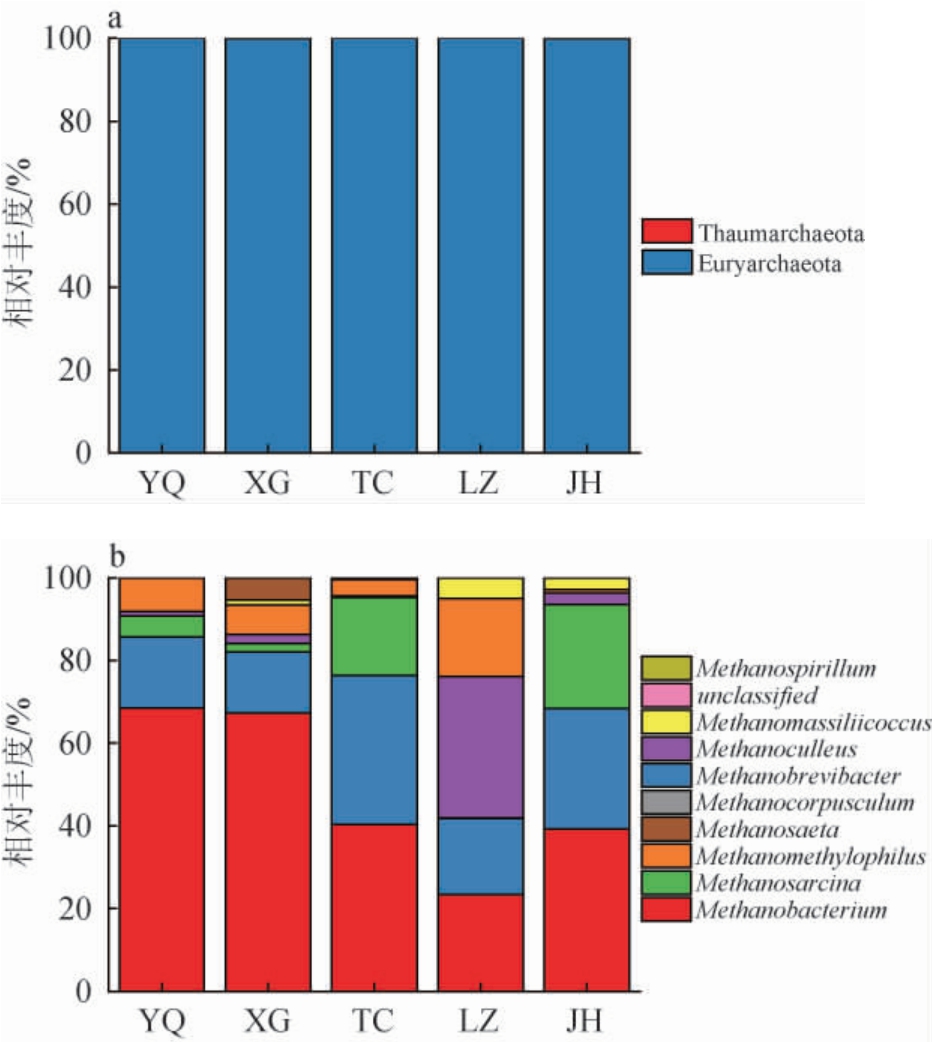
图3 基于门(a)和属(b)水平不同地区窖泥样品古菌菌群结构
Fig.3 Archaeal community structure in pit mud samples from different regions based on phylum (a) and genus (b) levels
由图3a可知,5个窖泥样品共检测出2个古菌门,包括广古菌门(Euryarchaeota)和奇古菌门(Thaumarchaeota);其中,广古菌门在五个窖泥样品中的相对丰度均>99%,说明广古菌门是绝对优势菌门。这与陈让芳等[19]对浓香型白酒窖泥古菌优势菌门的研究结论一致。因此,5种窖泥古菌微生物在门水平上的群落结构相似。
由图3b可知,5个窖泥样品共检测出古菌属9个(相对丰度>1%),包括甲烷杆菌属(Methanobacterium)、甲烷短杆菌属(Methanobrevibacter)、甲烷八叠球菌属(Methanosarcina)、甲烷囊菌属(Methanoculleus)、拟甲烷球菌属(Methanomethylophilus)、马赛甲烷球菌属(Methanomassiliicoccus)、鬃毛甲烷菌属(Methanosaeta)、甲烷粒菌属(Methanocorpusculum)和甲烷螺菌属(Methanospirillum)。将相对丰度≥10%的古菌属定义为优势古菌属。宜宾地区酒厂(YQ、XG)窖泥样品的优势古菌属均为甲烷杆菌属和甲烷短杆菌属,其相对丰度分别为68.52%、17.19%及67.27%、14.78%。成都地区(TC)窖泥样品的优势古菌属为甲烷杆菌属、甲烷八叠球菌属和甲烷短杆菌属;其相对丰度分别为40.32%、36.03%、18.90%。陇南地区(JH)窖泥样品的优势古菌属为甲烷杆菌属、甲烷短杆菌属和甲烷八叠球菌属,其相对丰度分别为39.26%、29.26%、25.18%。宜宾地区(LZ)窖泥样品的优势古菌属分别为甲烷囊菌属、甲烷杆菌属、拟甲烷球菌属和甲烷短杆菌属,其相对丰度分别为34.25%、23.39%、18.87%、18.35%。以上结果表明,成都酒厂(TC)窖泥样品与甘肃陇南酒厂(JH)窖泥优势古菌菌群相似,而宜宾地区酒厂(YQ、XG)窖泥样品的优势古菌菌群相似,但宜宾地区酒厂(LZ)窖泥样品的优势古菌属中甲烷囊菌属的相对丰度较高,与宜宾地区酒厂(XG、YQ)窖泥样品的优势古菌菌群差异较大。甲烷囊菌属属于氢营养型古菌,它们能够快速降解糟醅与黄水中的有机酸,从而提升窖泥质量[20,24-26];拟甲烷球属是宜宾地区酒厂窖泥样品(LZ)特有的古菌属;而宜宾地区酒厂(XG)窖泥样品的特有古菌属是鬃毛甲烷菌属;这可能也是宜宾地区酒厂三个窖泥之间微生物群落结构差异较大的原因。拟甲烷球菌属和鬃毛甲烷菌属均是一种以乙酸为基质的产甲烷菌,其在窖泥中能够将产酸菌代谢的大量的乙酸快速分解掉,从而有利于白酒中各种风味代谢物的生成[20]。尽管在同一地区,不同酒厂之间的古菌群落结构也存在一定的差异,这种差异可能由窖池所处的环境、酿造工艺等因素造成;而在不同地区,陇南地区酒厂(JH)、成都地区酒厂(TC)与宜宾地区酒厂(XG、YQ)窖泥样品的古菌群落虽有一定差异,但其优势古菌菌群占比最大的均为甲烷杆菌属和甲烷短杆菌属,这表明在尽管不同地区的窖泥容易受当地的气候、工艺等条件的影响[21-24],但浓香型白酒生产过程中的功能微生物菌群却表现出相同的共性,这与柴丽娟等[25]的研究结果一致。这两类产甲烷古菌属于严格的氢营养型古菌,能够利用氢气和二氧化碳生成甲烷气体从而解除产己酸菌的氢抑制效应[7-9];有利于维持窖泥微生物系统的稳定性[26-28]。王明跃等[21]比较了四川和安徽两地的窖泥微生物菌群发现,窖泥古菌菌群主要为甲烷囊菌属和甲烷八叠球菌属;与本研究结论有差异,这可能是由于不同地域、气候等条件所导致的。于春涛等[22]通过比较泸州、景芝、沧州和双城四地的窖泥微生物多样性发现,窖泥内微生物组成既有相似性也有差异性;翟磊等[23]研究发现,宜宾产区的窖泥古菌微生物组成均以甲烷短杆菌属等微生物为主,这与本研究结果一致。
2.4 主成分分析及层次聚类分析
基于古菌属水平不同窖泥样品主成分分析结果见图4。由图4可知,第一主成分(PC1)和第二主成分(PC2)的方差贡献率分别为67.59%、29.29%,累计方差贡献率为96.88%,能够较好的解释五个地区的窖泥微生物古菌群落结构差异。陇南地区酒厂(JH)、成都地区酒厂(TC)之间及宜宾地区酒厂(XG、YQ)之间的窖泥样品在PC1上距离较近,说明陇南地区酒厂(JH)及成都地区酒厂(TC)窖泥样品间、宜宾地区酒厂(XG、YQ)窖泥样品间的古菌群落结构相似,而宜宾地区酒厂(LZ)窖泥样品在PC1和PC2的距离上与其他地区的距离均较远,说明宜宾地区酒厂(LZ)窖泥样品的古菌群落结构与其余窖泥样品在属水平上存在较大差异。这可能是由于宜宾地区酒厂(LZ)窖泥样品古菌优势微生物属与其余四个酒厂窖泥样品古菌优势微生物属差异所导致的(宜宾地区酒厂(LZ)窖泥样品的优势古菌属为甲烷囊菌属)。因此,采用主成分分析可以将不同地区窖泥样品进行区分。
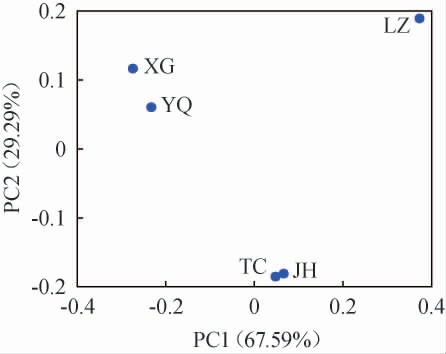
图4 基于属水平不同地区窖泥样品主成分分析得分图
Fig.4 Principal component analysis score plot of pit mud samples from different regions based on genes level
基于古菌属水平不同地区窖泥样品层次聚类分析结果见图5。由图5可知,所有窖泥样品明显分为两大类,宜宾地区酒厂(LZ)窖泥样品聚为一支,陇南地区酒厂(JH)、成都地区酒厂(TC)与宜宾地区酒厂(XG、YQ)窖泥样品聚为一支,说明宜宾地区酒厂(LZ)窖泥样品和其余四个窖泥样品的古菌群落结构差异较大。而在古菌菌群结构相似的4个窖泥样品中,宜宾地区酒厂(XG、YQ)的窖泥样品的古菌菌群结构相似,聚类为一支;陇南地区酒厂(JH)、成都地区酒厂(TC)的窖泥样品古菌菌群结构相似,聚类为一支;说明宜宾地区酒厂(XG、YQ)与陇南地区酒厂(JH)、成都地区酒厂(TC)窖泥样品微生物古菌菌群结构也存在明显差异。这与主成分分析的结果一致,五个不同地区的窖泥样品划分为三类,宜宾地区酒厂(LZ)窖泥样品一类,宜宾地区酒厂(XG、YQ)的两个窖泥样品一类,陇南地区酒厂(JH)、成都地区酒厂(TC)窖泥样品一类。因此,采用层次聚类分析可以将不同地区窖泥样品进行区分。
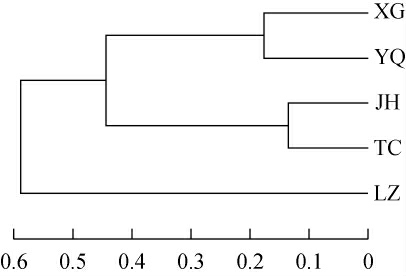
图5 基于属水平不同地区窖泥样品古菌菌群层次聚类分析结果
Fig.5 Hierarchical clustering analysis result of pit mud samples from different regions based on genes level
PCA和HCA结果均表明,宜宾地区酒厂(XG、YQ)窖泥样品之间、陇南地区酒厂(JH)与成都地区酒厂(TC)窖泥样品之间的古菌菌群结构相似;而宜宾地区酒厂(LZ)窖泥样品则与其余四个酒厂古菌菌群结构差异较大。说明即使在同一产区,发酵窖池不同深度窖泥内环境(氧气、湿度、温度、压力)不尽相同,可能导致同一产区不同来源窖泥古菌菌群组成差异;不同酒厂酿酒窖泥的氧气含量、粮食混合比例也有所不同[3],这也可能是不同酒厂窖泥古菌菌群结构存在差异的原因。而在不同的地理位置上,陇南地区酒厂(JH)、成都地区酒厂(TC)窖泥样品古菌菌群结构却表现出高度的相似性,而与宜宾地区的三个酒厂(XG、YQ、LZ)窖泥样品古菌菌群结构却不一致,地理位置虽然显著影响窖泥微生物群落组成[23],但同时也受酿酒工艺、气候条件等因素的影响,这可能是成都、宜宾和陇南三个地区酒厂窖泥古菌群落结构既有差异也有共性的原因。
3 结论
本研究利用高通量测序技术分析了不同地区窖泥古菌群落结构的多样性和差异性,结果表明,宜宾地区酒厂(LZ)窖泥样品古菌菌群丰富度和多样性最高,在门水平上,微生物菌群结构较为一致;在属水平上,甲烷杆菌属和甲烷短杆菌属是5个窖泥样品中的绝对优势古菌属,TC和JH样品的优势古菌属还包括甲烷八叠球菌属(Methanosarcina);宜宾地区酒厂窖泥样品(LZ)优势古菌属还包括甲烷囊菌属和拟甲烷球菌属;PCA和HCA结果均表明,5个窖泥样品可以划分为三类,宜宾地区酒厂(LZ)窖泥样品为一类,宜宾地区酒厂(XG、YQ)的两个窖泥样品为一类,陇南地区酒厂(JH)、成都地区(TC)窖泥样品为一类。综上所述,本研究中五个地区窖泥的古菌菌群结构既有差异也有共性,但5个窖泥样品中检测出的古菌均为产甲烷菌,说明产甲烷菌作为窖泥老熟的标志菌,其在窖泥中的分布及相对含量是影响不同地方窖泥质量的关键因素,未来可以考虑在窖泥中加入特定甲烷菌种来提高人工窖泥质量。
[1]FANG S, WANG C, YAN J.Comparing the differences of prokaryotic microbial community between pit walls and bottom from Chinese liquor revealed by 16S rRNA gene sequencing[J].Open Life Sci,2023,18(1):20220571.
[2]FU J, CHEN L, YANG S, et al.Metagenome and analysis of metabolic potential of the microbial community in pit mud used for Chinese strongflavor liquor production[J].Food Res Int,2021,143:110294.
[3]HOU Q, WANG Y, NI H, et al.Deep sequencing reveals changes in prokaryotic taxonomy and functional diversity of pit muds in different distilleries of China[J].Ann Microbiol,2022,72(1):1-14.
[4]LIU M K,TANG Y M,GUO X J,et al.Structural and functional changes in prokaryotic communities in artificial pit mud during Chinese Baijiu production[J].Appl Environ Sci,2020,5(2):e00829-19.
[5]LU M,ZHOU W,JI F,et al.Profiling prokaryotic community in pit mud of Chinese strong-aroma type liquor by using oligotrophic culturing[J].Int J Food Microbiol,2021,337:108951.
[6]胡晓龙,余苗,曹振华,等.基于高通量测序的窖泥原核微生物群落多样性在退化窖池中的空间异质性[J].食品科学,2021,42(10):86-93.
[7]HAN B L, GONG H C, REN X H, et al.Analysis of the differences in physicochemical properties,volatile compounds,and microbial community structure of pit mud in different time spaces[J].Microbiology,2024,12:e17000.
[8]REN D L, LIU S P, QIN H, et al.Heterogenetic mechanism in multidimensional pit mud with different fermentation years: From microbial structure dynamic succession to metabolism phenotype[J].Food Res Int,2024:114770.
[9]CHEN C,YANG H Q,ZHANG K Z,et al.Revealing microbiota characteristics and predicting flavor-producing sub-communities in Nongxiangx ing Baijiu pit mud through metagenomic analysis and metabolic modeling[J].Food Res Int,2024,188:114507.
[10]胡世伟,王超凡,王景春,等.浓香型白酒窖泥微生物群落及其风味成分研究进展[J].中国酿造,2023,42(12):9-12.
[11]WAN Y D,HUANG J,TANG Q X,et al.Characterizing the contribution of functional microbiota cultures in pit mud to the metabolite profiles of fermented grains[J].Foods,2024,13(11):1597.
[12]WEI W,SHEN Y,CHENG W,et al.Analysis of microbial diversity and volatile metabolites across different types of pit mud in sauce-flavored Baijiu based on nanopore sequencing and metabolomics[J].LWT-Food Sci Technol,2023,188:115465.
[13]LI J,SUN H,WANG Q,et al.Microbial community spatial structures in Luzhou-flavored liquor pit muds with different brewing materials[J].Peer J,2022,10:e12987.
[14]LIU M K,TANG Y M,GUO X J,et al.Structural and functional changes in prokaryotic communities in artificial pit mud during Chinese Baijiu production[J].Msystems,2020,5(2):00829-19.
[15]GONG Y,MA N,TANG H.Analysis of microbial community diversity and physicochemical factors in pit mud of different ages based on highthroughput sequencing[J].Can J Microbiol,2022,68(11):674-686.
[16]CHAI L J,QIAN W,ZHONG X Z,et al.Mining the factors driving the evolution of the pit mud microbiome under the impact of long-term production of strong-flavor Baijiu[J].Appl Environ Microbiol,2021,87(17):e00885-21.
[17]GAN S, ZOU Q, GUO Y, et al.Analysis of archaeal diversity in three samples from Danquan distillery[J].J Biobased Mater Bio,2023,17(4):443-450.
[18]HU X,DU H,REN C,et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Appl Environ Microbiol,2016,82(8):2506-2515.
[19]陈让芳,高健,杨燕,等.浓香型白酒窖泥原核微生物群落与挥发性风味物质相关性分析[J].食品与发酵科技,2023,59(3):9-15.
[20]PATIL S M, KURADE M B, BASAK B, et al.Anaerobic co-digester microbiome during food waste valorization reveals Methanosaeta mediated methanogenesis with improved carbohydrate and lipid metabolism[J].Bioresource Technol,2021(8):125123.
[21]王明跃,张文学.浓香型白酒两个产区窖泥微生物群落结构分析[J].微生物学通报,2014,41(8):1498-1506.
[22]于春涛,刘超.不同产区浓香型白酒窖泥中细菌多样性分析[J].食品研究与开发,2016,37(24):148-151.
[23]翟磊,于学健,冯慧军,等.宜宾产区浓香型白酒酿造生境中细菌群落结构的研究[J].食品与发酵工业,2019,46(2):1-12.
[24]CHEN L,LI Y,JIN L,et al.Analyzing bacterial community in pit mud of Yibin Baijiu in China using high throughput sequencing[J].Peer J,2020,8:e9122.
[25]柴丽娟,钱玮,钟小忠,等.浓香型白酒发酵过程中窖内古菌群落分布特征[J].生物工程学报,2020,36(12):2635-2643.
[26]张会敏,王艳丽,孟雅静,等.浓香型白酒新、老窖池池壁泥与池底泥原核菌群结构分析[J].食品科学,2020,41(18):180-187.
[27]ZHENG Y,HU X,JIA Z,et al.Co-occurrence patterns among prokaryotes across an age gradient in pit mud of Chinese strong-flavor liquor[J].Can J Microbiol,2020,66(9):495-504.
[28]ZHOU W, LIAO Z, WU Z, et al.Analysis of the difference between aged and degenerated pit mud microbiome in fermentation cellars for Chinese Luzhou-flavor Baijiu by metatranscriptomics[J].J Sci Food Agr,2021,101(11):4621-4631.