芽孢杆菌(Bacillus)是一类好氧或兼性厌氧、内生芽孢的革兰氏阳性杆菌,广泛分布于自然界的水体、土壤、空气、植物根系、植株表面和动物肠道,具有抗逆性强、快速生长和性能稳定的良好特性[1]。芽孢杆菌产物中含有丰富的蛋白酶、纤维素酶等多种活性物质,有助于调节肠道菌群平衡、降解毒性物质、提高饲料转化率、增强机体免疫力,常被用作饲料添加剂用于动物生产。有研究表明,地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(Bacillus subtilis)的替抗效果明显[2-3]。近年来,养殖业中抗生素的广泛应用使耐药基因在益生菌和致病菌之间水平传播的风险增加[4],因此,饲用益生菌的安全性问题值得关注。
贝莱斯芽孢杆菌(Bacillus velezensis)和地衣芽孢杆菌具有耐高温、耐盐碱、耐酸等特点,能合成细菌素、抑菌蛋白、脂肽类物质和聚酮化合物等次级代谢产物[5],具有广谱抗菌活性和产酶、促生长等特性。研究发现两种菌在生物防控、促进肠道微生态平衡的建立、食品发酵[6]、工业产酶[7]、污水处理等方面具有重要应用。TRINH T H T等[8]从黑胡椒根际中分离的贝莱斯芽孢杆菌RB.DS29菌株产生的蛋白酶、几丁质酶和β-葡聚糖酶能够降解真菌细胞壁,对真菌病原具有良好拮抗作用。目前,国内外关于贝莱斯芽孢杆菌和地衣芽孢杆菌的研究主要集中在菌株的分离鉴定[9]、抑菌物质分析[10]以及生防应用[11]等方面,针对菌株安全性与益生功能综合性评价的研究报道还较少。
本研究以从养殖场废弃物无害化处理池堆积物中分离筛选的3株芽孢杆菌(编号分别为V1、V2、V5)为研究对象,结合菌株形态学观察及分子生物学技术对其进行菌种鉴定,通过K-B药敏纸片扩散法、聚合酶链式反应(polymerase chain reaction,PCR)法、牛津杯试验等方法对其抗生素敏感、携带耐药基因情况等安全性、耐热、抑菌等性能进行检测,并测定不同时间段发酵上清液中蛋白酶和纤维素酶活性。以期为解析芽孢杆菌的安全性、益生特性以及应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
3株芽孢杆菌(编号分别为V1、V2、V5):分离自广西玉林市容县某养殖场废弃物无害化处理池堆积物,保藏于本实验室;国家兽医微生物菌(毒)种保藏中心(National CenterforVeterinaryCultureCollection,CVCC)199大肠埃希菌(Escherichiacoli)K88、CVCC1496大肠埃希菌O139、CVCC546金黄色葡萄球菌(Staphylococcus aureus)、CVCC2139猪霍乱沙门氏菌(Salmonella choleraesuis):国家兽医微生物菌(毒)种保藏中心。
1.1.2 化学试剂
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):北京索莱宝科技有限公司;L-酪氨酸(分析纯):天津光复精细化工有限公司;三氯乙酸、福林酚(均为分析纯):上海麦克林生化科技股份有限公司;干酪素(分析纯):北京酷莱博科技有限公司;药敏纸片:杭州滨和微生物试剂有限公司;细菌质粒抽提试剂盒:南京诺维赞生物科技有限公司;细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、DNA Ladder Marker、2×Taq Master Mix:宝生物工程(大连)有限公司;碳酸钠、磷酸氢二钠、磷酸二氢钠、氢氧化钠、盐酸、乙酸、醋酸钠(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
羧甲基纤维素钠刚果红培养基、羧甲基纤维素钠培养基:山东拓扑生物工程有限公司;胰蛋白胨大豆琼脂(tryptose soya agar,TSA)培养基、营养肉汤(nutrient broth,NB)培养基、营养琼脂(nutrient agar,NA)培养基:北京陆桥技术股份有限公司。
脱脂奶粉琼脂培养基:牛肉膏5.0 g、蛋白胨10.0 g、氯化钠5.0 g、琼脂20.0 g,溶于800 mL蒸馏水;脱脂奶粉20.0 g溶于200 mL蒸馏水,分别121 ℃灭菌20 min,两者混匀后倒板。
1.2 仪器与设备
BSA124S分析天平:德国赛多利斯集团;JJ300电子天平:常熟市双杰测试仪器厂;MSL-3020高压灭菌锅:日本SANYO公司;504G生物安全柜:美国Baker公司;Gel Doc XR+凝胶图像处理系统、T100梯度聚合酶链式反应(PCR)仪:美国Bio-Rad公司;DYY-6C电泳仪:北京六一生物科技有限公司;TS-100C摇床:上海天呈实验仪器制造有限公司;NP80分光光度计:德国Implen公司;HH-2恒温水浴锅:江苏科析仪器有限公司;Infinite F50酶标仪:奥地利帝肯公司;ECLIPSE E200显微镜:日本Nikon公司。
1.3 方法
1.3.1 菌株的鉴定
形态学观察:将-20 ℃冰箱保存的3株菌株接种于TSA培养基中,37 ℃培养18~24 h,继续活化2代,观察并记录菌落形态。用革兰氏染液进行染色经显微镜观察其菌体细胞形态。
16S rDNA序列分析:按细菌基因组DNA抽提试剂盒说明书提取DNA,以其为模板,进行16S rDNA基因序列扩增;正向引物F:(5'-AGAGTTTGATCCATGGCTCAG-3'),反向引物R:(5'-GTGTGACGGGCGGTGTGTAC-3')。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s、55 ℃退火45 s、72 ℃延伸1 min,30个循环;72 ℃后延伸5 min。PCR扩增体系(25 μL):2×Taq PCR Master Mix 12.5 μL、上下游引物(10 μmol/L)各0.5 μL、DNA模板1 μL、双蒸水(ddH2O)10.5 μL。扩增产物用1%的琼脂糖凝胶电泳检测后,将检测合格的PCR扩增产物委托华大基因有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(Basic Local Alignment Search Tool,BLAST)与已有的序列进行同源序列检索,选取同源性较高的模式菌株的16S rDNA序列,采用MEGA 11.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树,确定菌株种属。
gyrB基因序列分析[9]:使用gyrB基因通用引物(见表1)进行PCR扩增,UP1-F+UP-2R引物对应的扩增程序为:95 ℃预变性5 min;95 ℃变性45 s,60 ℃退火45 s,72 ℃延伸80 s,35个循环;72 ℃后延伸10 min。扩增产物用1%的琼脂糖凝胶电泳检测后,将检测合格的PCR扩增产物委托华大基因有限公司进行测序。将测序结果提交至NCBI的GenBank数据库中,采用基本局部比对搜索工具(BLAST)与已有的序列进行比对,选取同源性较高的模式菌株的序列,采用MEGA 11.0软件中的邻接(NJ)法构建系统发育树,进一步确定菌株种类。
表1 gyrB基因聚合酶链式反应引物序列[9]
Table 1 Primer sequences of polymerase chain reaction for gyrB gene
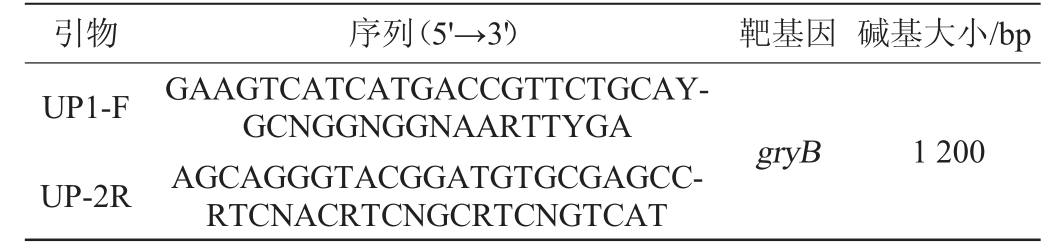
引物 序列(5'→3') 靶基因 碱基大小/bp UP1-F UP-2R GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT gryB 1 200
1.3.2 生长曲线的绘制
将活化的菌株按1%(V/V)接种量接种于100 mL营养肉汤培养基,置于37 ℃、180 r/min摇床培养48 h,每隔2 h取样测定OD600 nm值,每株菌重复3次,结果取平均值,以培养时间为横坐标,OD600nm值为纵坐标,绘制菌株生长曲线。
1.3.3 安全性试验
药物敏感性试验:选取大环内脂、氨基糖苷、β-内酰胺等10类29种抗菌药物,采用K-B纸片琼脂扩散法对分离菌株进行药敏试验。取对数生长期的菌液,将菌体浓度调整为1×108 CFU/mL,用无菌棉试子蘸取菌液均匀涂布于营养琼脂培养基,待菌液吸收完全后贴上抗生素纸片,每组重复3次,将平板置于37 ℃培养24 h,观察并测量抑菌圈直径。
耐药基因检测:分别以菌株的基因组DNA和质粒作为模板,PCR扩增四环素类、大环内脂类、氨基糖苷类、β-内酰胺类、磺胺类、氟喹诺酮类、氯霉素类共7类33个耐药基因,PCR引物、PCR扩增体系和PCR扩增条件参考文献[12],PCR扩增产物经2%琼脂糖凝胶电泳检测后判定结果。
1.3.4 耐热性试验
将菌株按1%(V/V)的接种量接种于含100 mL营养肉汤培养基的锥形瓶,分别置于37 ℃(对照组)、45 ℃、50 ℃、55 ℃、60 ℃条件下恒温30 min,置于37 ℃、180 r/min条件下振荡培养16 h,测定波长600 nm条件下的吸光度值(OD600nm值),并计算存活率,其计算公式如下:
1.3.5 抑菌特性
用琼脂扩散法检测3株菌对常见致病菌的抑制效果,以猪霍乱沙门氏菌、金黄色葡萄球菌、大肠杆菌O139、大肠杆菌K88作为指示菌,调整浓度至1×106 CFU/mL,取1 mL指示菌加入20 mL 45 ℃营养琼脂培养基,摇匀后倒入放有无菌牛津杯(Φ6 mm×8 mm×10 mm)的无菌平板中,待琼脂凝固后,用无菌镊子取出牛津杯,在孔穴中加入200 μL于37 ℃、180 r/min振荡培养24 h,经12 000 r/min条件下离心5min的菌液上清,其中一孔穴加入营养肉汤培养基作为空白对照,待上清液渗透完毕,将平板置于37 ℃恒温培养18~24 h,观察并测量抑菌圈直径。判定依据参考文献[13],抑菌圈直径>7 mm视为有抑菌作用,7~10 mm为钝敏,抑菌圈直径在10~20 mm为中敏,抑菌圈直径在>20 mm为高敏。
1.3.6 产水解酶能力测定
(1)产纤维素酶试验
用接种环蘸取菌落接种于羧甲基纤维素钠刚果红培养基,置于37 ℃恒温培养24~36 h,根据特定菌株能生成纤维素酶水解羧甲基纤维素钠产生透明圈的特性,观察是否产生水解圈,用游标卡尺分别测量水解透明圈直径H和菌落直径C的大小,计算H/C值,取平均值。
(2)产蛋白酶试验
挑单个菌落接种于脱脂奶粉琼脂培养基,置于37 ℃恒温培养24~36 h,根据特定菌株能生成蛋白酶水解脱脂奶粉产生透明圈的特性,观察是否产生水解圈,用游标卡尺测量水解透明圈直径H和菌落直径C的大小,计算H/C值,取平均值。
1.3.7 分析检测
将3株菌种按1%(V/V)接种量接种于100 mL营养肉汤培养基中,37 ℃、180 r/min摇床培养24~120 h,每隔12 h取样,得到菌株发酵液,经4 ℃、8 000 r/min离心15 min,所得上清即为粗酶液,用于纤维素酶活、蛋白酶活测定。
采用3,5-二硝基水杨酸(DNS)法测定菌株产纤维素酶活性[14]。纤维素酶活力单位定义:在50 ℃、pH 5.5条件下,1 mL粗酶液在1 min内水解羧甲基纤维素钠底物,产生相当于1 μg葡萄糖的酶量即为1个酶活力单位(U/mL)。
参考国标GB/T 28715—2012《饲料添加剂酸性、中性蛋白酶活力的测定分光光度法》测定菌株产中性蛋白酶活[15]。蛋白酶活力单位定义:在40 ℃、pH 7.2的条件下,在1 min内水解酪蛋白产生相当于1 μg酪氨酸的酶量定义为1个酶活力单位(U/mL)。
1.3.8 数据处理
每个试验重复3次,试验结果用“平均值±标准差”表示,运用GraphPad Prism 6.0对试验数据进行统计分析。
2 结果与分析
2.1 菌株的鉴定
2.1.1 形态学观察
菌株V1、V2、V5在TSA培养基的菌落及菌体形态见图1。由图1A、1B、1C可知,3株菌株的菌落相态相似,呈淡黄色、圆形,菌落靠近圆心周围隆起一圈褶皱,形成同心圆,菌落表面粗糙、干燥、无光泽,边缘较规则呈花瓣形。由图1E、1F、1G可知,通过革兰氏染色镜检观察到菌株V1、V2、V5的细胞形态呈杆状,单个或成对排列,两段钝圆,均为革兰氏阳性杆菌。
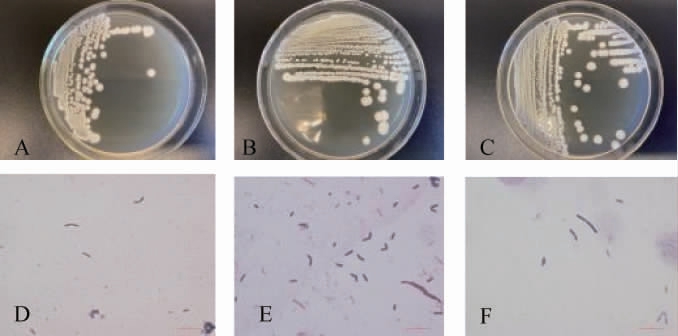
图1 菌株V1、V2、V5的菌落及细胞形态
Fig.1 Colony and cell morphology of strains V1, V2 and V5
A和D,B和E,C和F分别为菌株V1、V2、V5的菌落及细胞形态。
2.1.2 16S rDNA基因序列分析[16]
对3株菌株的16S rDNA基因序列进行测序及同源性比对分析后构建系统发育树,结果见图2。由图2可知,菌株V1、V2与同属的贝莱斯芽孢杆菌(Bacillus velezensis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、暹罗芽孢杆菌(Bacillus siamensis)和枯草芽孢杆菌(Bacillus subtilis)的16S rDNA同源性均为100%,因此无法判定菌株V1、V2具体种的归属。菌株V5与地衣芽孢杆菌(Bacillus licheniformis)NB45(GenBank登录号:MT534569.1)聚于一支,相似度为100%,结合菌落、菌体形态鉴定结果,将菌株V5鉴定为地衣芽孢杆菌(Bacillus licheniformis)。
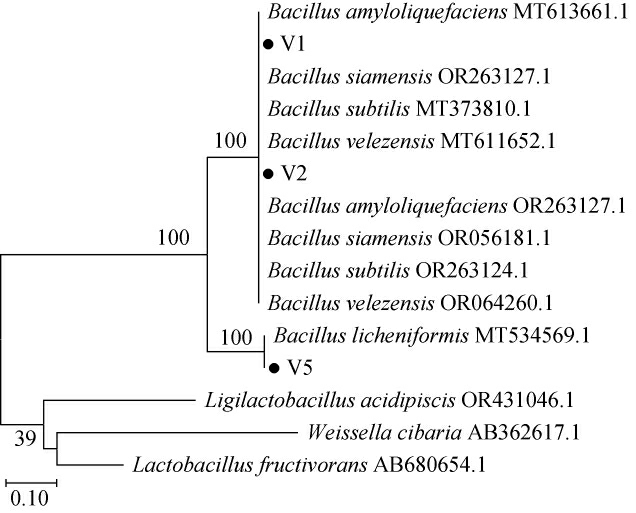
图2 菌株V1、V2及V5基于16S rDNA基因序列的系统发育树
Fig.2 Phylogenic tree of strains V1, V2 and V5 based on 16S rDNA gene sequences
2.1.3 gyrB基因序列分析
为进一步鉴定菌株V1、V2的种属,对菌株V1、V2的gyrB基因进行扩增及测序分析,菌株V1、V2的gyrB基因碱基对长度分别为1 134 bp和1 121 bp。将其与芽孢杆菌属内同源性最高的不同模式菌株的gyrB基因序列进行比对分析,同时以同属的苏云金芽孢杆菌(Bacillus thuringiensis)为外标,构建系统发育树,结果见图3。由图3可知,贝莱斯芽孢杆菌、解淀粉芽孢杆菌、暹罗芽孢杆菌和枯草芽孢杆菌分别属于4个分支,模式菌株Bacillus thuringiensis独立形成一支。贝莱斯芽孢杆菌、解淀粉芽孢杆菌和暹罗芽孢杆菌共同形成一个大的分支,菌株V1、V2与贝莱斯芽孢杆菌处于同一分支。经gyrB基因序列比对分析发现,菌株V1、V2与贝莱斯芽孢杆菌的亲缘关系更近。因此,菌株V1、V2均被鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。
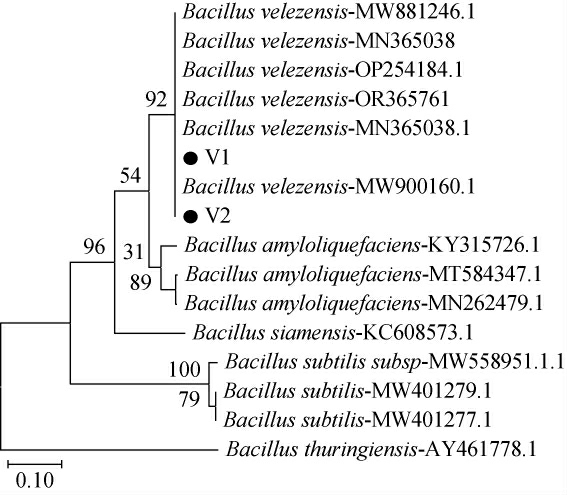
图3 菌株V1、V2基于gryB基因序列的系统发育树
Fig.3 Phylogenic tree of strains V1 and V2 based on gryB gene sequences
2.2 菌株生长特性分析
绘制3株菌株的生长曲线,结果见图4。由图4可知,0~4 h为菌株生长迟缓期,4 h后3株菌均进入对数生长期,此时菌体快速生长,分裂旺盛,持续至6 h,6~38 h为稳定期38 h后进入衰亡期。结果表明,3株菌生长较为迅速,稳定期持续的时间较长。
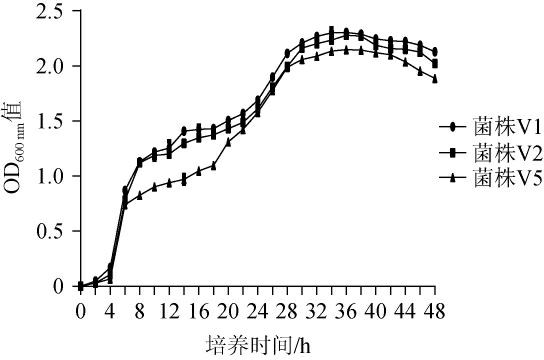
图4 菌株V1、V2及V5的生长曲线
Fig.4 Growth curves of strains V1, V2 and V5
2.3 菌株安全性评价
2.3.1 药物敏感性试验
选用10类29种抗生素药敏纸片对菌株V1、V2、V5的药物敏感性进行试验,结果见表2。
表2 菌株V1、V2及V5的药物敏感性试验结果
Table 2 Results of drug sensitivity tests of strains V1, V2 and V5
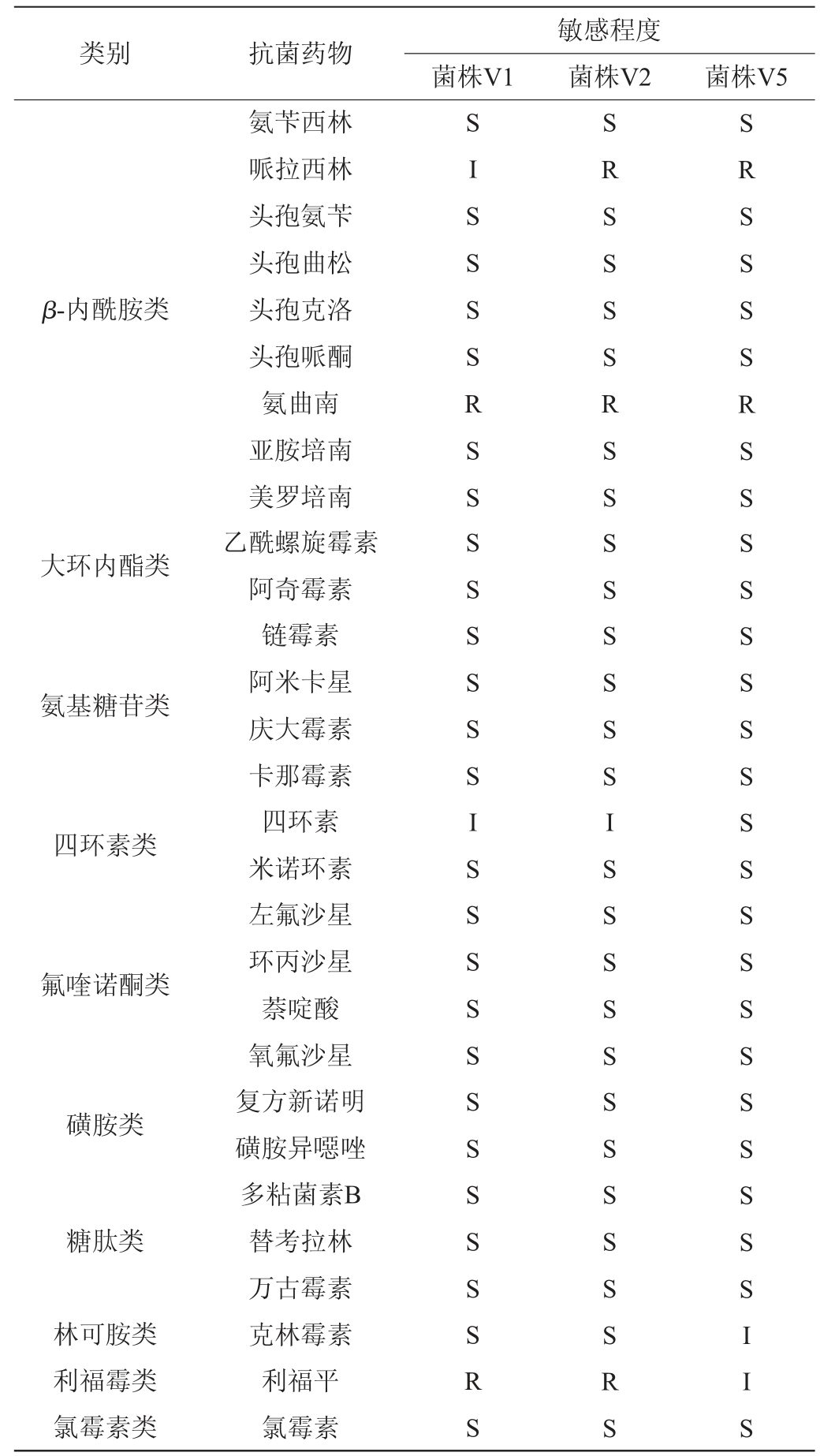
注:“S”为敏感;“I”为中介;“R”为耐药。
类别 抗菌药物 菌株V1敏感程度菌株V2 菌株V5 β-内酰胺类大环内酯类氨基糖苷类四环素类氟喹诺酮类磺胺类糖肽类林可胺类利福霉类氯霉素类氨苄西林哌拉西林头孢氨苄头孢曲松头孢克洛头孢哌酮氨曲南亚胺培南美罗培南乙酰螺旋霉素阿奇霉素链霉素阿米卡星庆大霉素卡那霉素四环素米诺环素左氟沙星环丙沙星萘啶酸氧氟沙星复方新诺明磺胺异噁唑多粘菌素B替考拉林万古霉素克林霉素利福平氯霉素SISSS SR SSS SSSSSISSSS SSSS SSSRS SRSSSSRSSSSSSSSISSSSSSSSSSSRS SRSS SS RSSSSSSS SS SSS SSSSSSSIIS
由表2可知,3株菌株均存在多重耐药性,其中,3株菌株对大环内酯类、氨基糖苷类、氟喹诺酮类、磺胺类、糖肽类、氯霉素类抗生素均表现敏感,对β-内酰胺类、四环素类、林可胺类、利福霉类抗生素表现出不同程度耐药性。菌株V5对四环素类抗生素敏感,菌株V1、V2对四环素中介,对米诺环素敏感;菌株V1、V2对利福平耐药,菌株V5对利福平中介;3株菌株对绝大部分β-内酰胺类抗生素敏感,对氨曲南均表现为耐药,菌株V2、V5对哌拉西林耐药,菌株V1对其中介。结果表明,3株菌对大多数常用抗菌药敏感,能保证其在使用过程中安全可控。
2.3.2 耐药基因检测
分别检测3株菌株的基因组DNA及质粒的7大类33个耐药基因,结果见表3。由表3可知,在菌株V5的基因组DNA和质粒中检测到femA(β-内酰胺类)耐药基因,在质粒中还检测到tetA(四环素类)耐药基因,其余31种耐药基因均未检出;而在菌株V1、V2的基因组DNA和质粒中33种耐药基因均未检出。结果表明,菌株V1、V2相对安全,菌株V5对耐药基因的传播风险待进一步验证。
表3 菌株V1、V2及V5耐药基因检测结果
Table 3 Determination results of antibiotic resistance genes of strains V1, V2 and V5
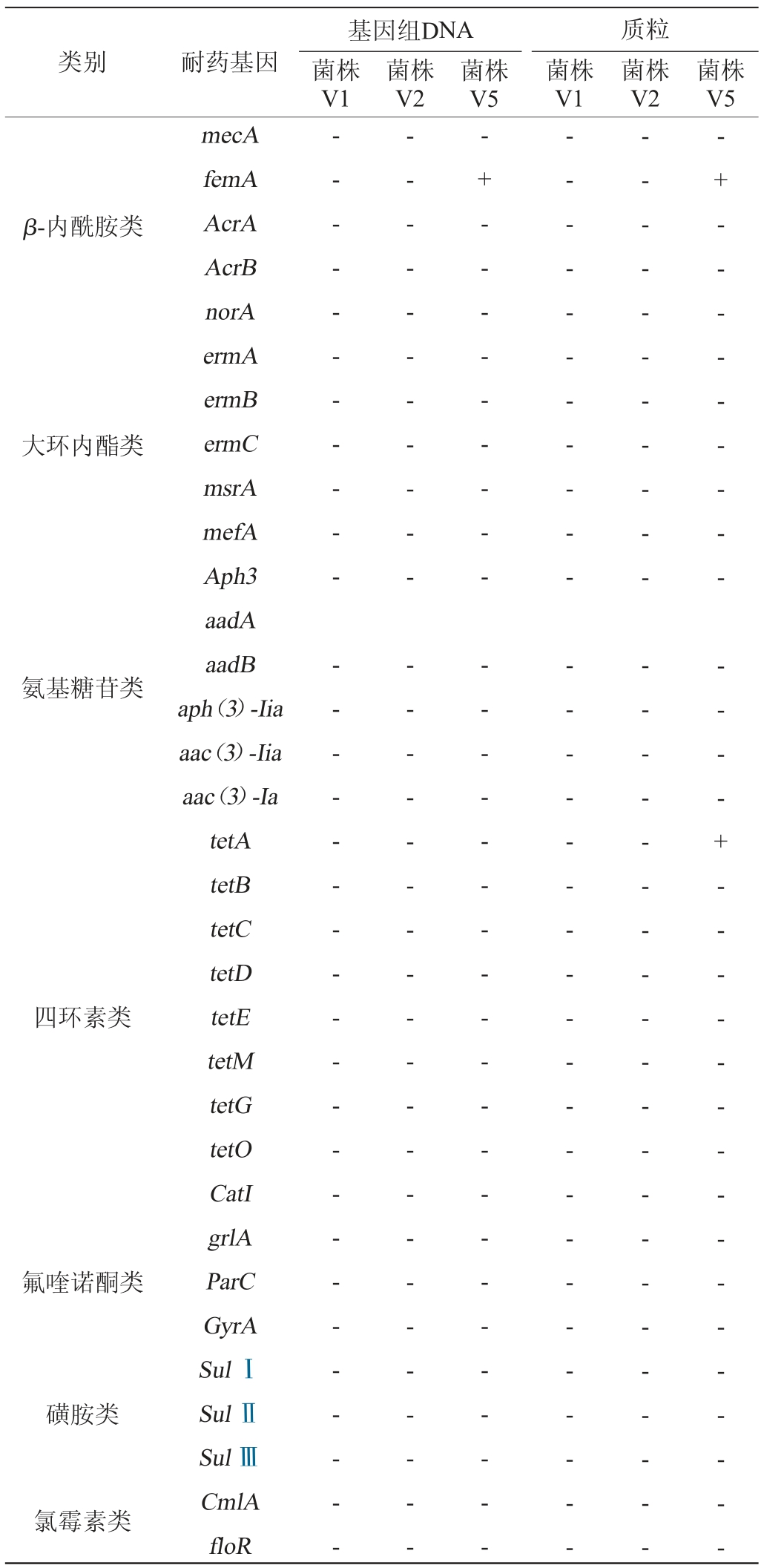
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
类别 耐药基因基因组DNA菌株V1菌株V2菌株V5质粒菌株V1菌株V2菌株V5 β-内酰胺类大环内酯类氨基糖苷类四环素类氟喹诺酮类磺胺类氯霉素类mecA femA AcrA AcrB norA ermA ermB ermC msrA mefA Aph3 aadA aadB aph(3)-Iia aac(3)-Iia aac(3)-Ia tetA tetB tetC tetD tetE tetM tetG tetO CatI grlA ParC GyrA Sul ⅠSul ⅡSul ⅢCmlA floR-- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - --- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - --+ - - - - - - - - - - - - - - - - - - - - - - - - - - - - - --- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - --- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - --+ - - - - - - - - - - - - - + - - - - - - - - - - - - - - - -
2.4 菌株耐热性试验
3株菌株的耐热性试验结果见图5。由图5可知,菌株V1、V5对温度变化影响的生长趋势一致。45 ℃时3株菌的OD600 nm值最高,随着培养温度的升高,OD600 nm值呈下降趋势。显著性分析结果显示,菌株V1在45 ℃处理后OD600nm值显著高于37 ℃对照组(P<0.05),45 ℃处理组与50 ℃处理组差异不显著(P>0.05),55 ℃处理后OD600 nm值显著低于50 ℃处理组(P<0.05),60 ℃处理组与55 ℃处理组差异不显著(P>0.05),说明45 ℃、50 ℃为菌株V1生长较适宜温度。菌株V2在温度提高至50 ℃时,生长受到抑制,55 ℃处理组的OD600nm值最低,显著低于50 ℃、60 ℃处理组(P<0.05),37 ℃、45 ℃组差异不显著(P>0.05),为菌株V2最适宜生长温度。菌株V5 60 ℃处理组OD600nm值最低,显著低于37 ℃对照组、55 ℃处理组(P<0.05),37 ℃对照组与50 ℃、55 ℃处理组差异不显著(P>0.05),显著低于45 ℃处理组(P<0.05),45 ℃处理后菌株V5活性有所提高。结果表明,3株菌株均可耐受60 ℃。
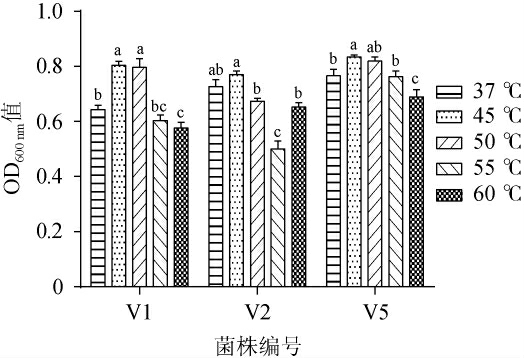
图5 菌株V1、V2及V5的耐热性试验结果
Fig.5 Results of heat tolerance tests of stains V1, V2 and V5
同菌株不同小写字母表示差异显著(P<0.05)。下同。
2.5 菌株抑菌效果分析
由图6可知,3株菌株对猪霍乱沙门氏菌、金黄色葡萄球菌、大肠杆菌O139和K88均有抑制作用,对这4种常见致病菌均为中度敏感。菌株V2对猪霍乱沙门氏菌的抑菌效果显著高于菌株V5(P<0.05),与菌株V1差异不显著(P>0.05);菌株V5对大肠杆菌O139的抑菌效果显著高于菌株V2和V1(P<0.05);3株菌株对金黄色葡萄球菌和大肠杆菌K88的抑菌效果差异不显著(P>0.05)。
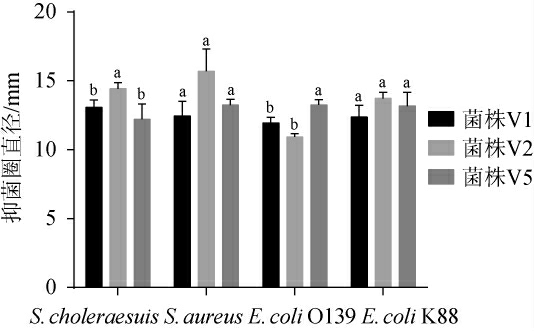
图6 菌株V1、V2及V5对4种常见致病菌的抑菌效果
Fig.6 Inhibition effect of strains V1, V2 and V5 on 4 kinds of common pathogenic bacteria
2.6 菌株产水解酶能力测定
菌株V1、V2及V5产酶H/C值测定结果见表4。由表4可知,不同菌株的产酶能力不同。菌株V1、V2能产生纤维素酶和蛋白酶透明水解圈,菌株V5仅产生纤维素酶水解圈。3株菌株产纤维素酶的H/C值依次为1.10、1.04、1.03,产蛋白酶的H/C比值分别为1.14、1.13、0。
表4 菌株V1、V2及V5产酶水解圈H/C值
Table 4 H/C values of enzyme-producing hydrolysis circles of strains V1, V2 and V5
注:同列大写字母不同表示差异极显著(P<0.01)。下同。
菌株编号 产蛋白酶H/C值 产纤维素酶H/C值V1 V2 V5 1.14±0.01A 1.13±0.17A 0B 1.10±0.040A 1.04±0.026A 1.03±0.030A
2.7 菌株产蛋白酶及纤维素酶测定结果
菌株V1、V2及V5最高蛋白酶及纤维素酶测定结果见表5。
表5 菌株V1、V2、V5最高蛋白酶活和纤维素酶活测定结果
Table 5 Determination results of the highest protease and cellulase activities of strains V1, V2 and V5

菌株编号 最高蛋白酶活力/(U·mL-1) 最高纤维素酶活力/(U·mL-1)V1 V2 V5 75.37±1.34A(48 h)78.83±1.83A(36 h)15.38±0.48B(72 h)101.00±7.17A(96 h)92.29±3.22A(96 h)83.76±5.83A(60 h)
由表5可知,菌株V1、V2、V5分别在48 h、36 h和72 h达到最高蛋白酶活力,分别为75.37 U/mL、78.83 U/mL和15.38 U/mL,菌株V1、V2最高蛋白酶活力差异不显著(P>0.05),与菌株V5最高蛋白酶活力差异极显著(P<0.01)。株菌V1、V2均在96 h纤维素酶活力最高,分别为101.0 U/mL、92.29U/mL,菌株V5在60h纤维素酶活力最高,为83.76U/mL,各组间纤维素酶活力差异不显著(P>0.05)。
3 讨论
在拮抗益生菌的应用中,除考虑益生菌对病原菌的拮抗效果外,还需评估其生物安全性。益生菌的耐药性被作为益生菌安全性评价指标之一。朱亚珠等[17]研究自然发酵海洋鱼酱油样品中分离到的贝莱斯芽孢杆菌SW5的抗生素抗性,发现其对β-内酰胺类抗生素如头孢曲松、亚胺培南及氯霉素表现敏感;张小波等[18]研究发现,鸭源贝莱斯芽孢杆菌GZZY2019对头孢哌酮、环丙沙星、氧氟沙星、复方新诺明、米诺环素、克林霉素、卡那霉素、庆大霉素、万古霉素等抗生素敏感,对四环素、哌拉西林中敏,本研究结果与其基本一致。
菌株V5的质粒中检测到femA(β-内酰胺类)和tetA(四环素类)耐药基因。MINGMONGKOLCHAI S等[19]在克劳氏芽孢杆菌中发现了氨基糖苷类、大环内酯类、β-内酰胺类和氯霉素类的抗性基因。PHELAN R W等[20]报道了枯草芽孢杆菌携带四环素类耐药基因位于可移动元件上,基因tetL位于pIM13质粒,基因tetM位于Tn5397结合转座子。细菌对四环素类抗生素耐药的分子机制包括3种,一是通过外排泵主动输出四环素分子,二是削弱四环素与核糖体之间的相互作用(核糖体保护),三是通过羟基化作用降解四环素[21]。四环素类特异性外排泵基因共有38个,tetA基因是其中之一[22]。结合药敏试验结果和耐药基因检测结果来看,菌株V1、V2无耐药基因表达,3株菌的抗生素药物敏感性检测结果与耐药基因检测结果基本一致,但也出现了耐药基因型和菌株的抗生素抗性表型不一致的情况。菌株V5的质粒中检测到四环素耐药基因tetA的表达,但其对四环素表现敏感。表明菌株V5存在四环素耐药基因,但不表达耐药表型。耐药基因型与耐药表型不一致,可能是需要其他基因协同作用才能出现耐药表型,或是还存在其他耐药基因本次试验并未研究。菌株V1、V2对β-内酰胺类的氨曲南耐药,对哌拉西林中敏或耐药,对四环素中敏,但其基因组DNA和质粒未检测到β-内酰胺类、四环素类耐药基因,即表现为表型耐药。3株菌对氨曲南均具有抗性,推测氨曲南属于固有耐药。
目前,贝莱斯芽孢杆菌由于具备广谱的抗菌活性及促进植物生长功能,常用作生物防控剂和植物生长促进剂[23]。拮抗芽孢杆菌产生的表面活性素、伊枯草菌素、泛革素等抗菌肽类物质能够造成细胞膜的损伤,破坏细菌细胞壁,导致细胞内容物外泄进而杀灭细菌[24]。甲基营养型芽孢杆菌(现归属于贝莱斯芽孢杆菌)F35产生的抗菌肽对罗非鱼片具有保鲜防腐效果,使冷冻鱼肉保质期延长4 d以上[25]。结果显示,3株芽孢杆菌能抑制肠道病原菌的生长,菌株V2对猪霍乱沙门氏菌的抑菌能力最强,菌株V5对大肠杆菌O139的抑菌能力最强。与刘韶娜等[26]的研究结果基本一致,与王婷等[27]研究结果不完全相同,其所研究地衣芽孢杆菌BL-2对大肠杆菌、沙门氏菌没有抑制效果,可能是不同来源菌株之间的遗传差异所造成,也可能是所选择的致病性菌株差异造成的。
纤维素酶和蛋白酶是重要的生物工业酶,被广泛应用于食品、皮革、动物饲料、医疗、环保和化工等行业。菌株V5在脱脂奶粉琼脂培养基上的H/C值为0,而在液体培养基生长至48 h能检测到蛋白酶活性,在72 h蛋白酶活性达到最大。贾仲昕等[28]在筛选高产中性蛋白酶芽孢杆菌时,菌株N435-3有较高H/C值,但在发酵液中检测的蛋白酶活性几乎为0。这表明H/C值可作为初步预测菌株酶活性高低的依据,与酶活性大小存在一定的相关性,但并不完全一致,仅以H/C值判定酶活力高低还不够,有必要进一步测定菌株的产酶能力。
本研究3株菌能产生蛋白酶和纤维素酶。黄悦姝等[29]从玉米根际土壤中分离获得的贝莱斯芽孢杆菌D103菌株纤维素酶活力为41.73 U/mL,对培养条件优化后酶活提高至65.94 U/mL;檀茜倩等[30]从发酵海产品中分离到2株贝莱斯芽孢杆菌,蛋白酶活力分别为8.65 U/mL和12.61 U/mL。与上述文献报道相比,3株芽孢杆菌产酶活性处于较高水平,具有一定的产酶优势。
4 结论
本研究以无害化处理堆积池样品分离到的3株芽孢杆菌(编号分别为V1、V2、V5)为研究对象,经形态学观察16S rDNA和gryB基因比对分析鉴定,其中菌株V1、V2被鉴定为贝莱斯芽孢杆菌(Bacillus velezensis),菌株V5被鉴定为地衣芽孢杆菌(Bacillus licheniformis)。3株菌对多种抗生素敏感,除菌株V5检测到femA、tetA耐药基因外,2株贝莱斯芽孢杆菌未检出耐药基因。3株菌均可耐受60 ℃温度处理。3株芽孢杆菌能抑制猪霍乱沙门氏菌、金黄色葡萄球菌、大肠杆菌O139和大肠杆菌K88等常见病原菌,均可产蛋白酶和纤维素水解酶。结果显示,3株菌最高纤维素酶活力分别为101.0 U/mL、92.29 U/mL和83.76 U/mL。最高蛋白酶活性分别为75.37 U/mL、78.83 U/mL和15.38 U/mL。研究表明3株芽孢杆菌安全性、耐热性能较好,能抑制条件致病菌,产纤维素酶活性较强,可作为益生菌应用于饲料青贮及秸秆降解等微生态制剂的开发利用。
[1]刘洋,刘晓昆,陈文浩.贝莱斯芽孢杆菌(Bacillus velezensis)物种名称的“前世今生”[J].生物技术通报,2019,35(7):230-232.
[2]KHAN S,MOORE R J,STANLEY D,et al.The gut microbiota of laying hens and its manipulation with prebiotics and probiotics to enhance gut health and food safety[J].Appl Environ Microbiol,2020,86(13):e00600-20.
[3]JHA R,DAS R,OAK S,et al.Probiotics(direct-fed microbials)in poultry nutrition and their effects on nutrient utilization, growth and laying performance,and gut health:A systematic review[J].Animals,2020,10(10):1863.
[4]MIGUEL G,BORJA S,CLARA R L D G,et al.Antibiotic resistance in probiotic bacteria[J].Front Microbiol,2013,4(7):202.
[5]肖颖,姚霓红,解泽峰,等.一株产淀粉酶的嗜热地衣芽孢杆菌的筛选及鉴定[J].武汉轻工大学学报,2023,42(2):61-67.
[6]SULTANA O F, LEE S, SEO H, et al.Biodegradation and removal of PAHs by Bacillus velezensis isolated from fermented food[J].J Microbiol Biotech,2021,31(6):999-1010.
[7]LU M Y,GAO Z X,XING S Q,et al.Purification,characterization,and chemical modification of Bacillus velezensis SN-14 fibrinolytic enzyme
[J].Int J Biol Macromol,2021,177(4):601-609.
[8]TRINH T H T,WANG S,NGUYEN B V,et al.A potent antifungal rhizobacteria Bacillus velezensis RB.DS29 isolated from black pepper(Piper nigrum L.)[J].Res Chem Int,2019,45(11):5309-5323.
[9]李贺海,王佳慧,李迎迎,等.芽胞杆菌的分离鉴定[J].中国兽医科学,2021,51(1):74-80.
[10]SALAZAR B,ORTIZ A,KESWANI C,et al.Bacillus spp.as bio-factories for antifungal secondary metabolites: Innovation beyond whole organism formulations[J].Microbial Ecol,2023,86(1):1-24.
[11]ZAID D S,CAI S Y,HU C,et al.Comparative genome analysis reveals phylogenetic identity of Bacillus velezensis HNA3 and genomic insights into its plant growth promotion and biocontrol effects[J].Microbiol Spectr,2022,10(1):e0216921.
[12]曾文婷.广西源益生菌的筛选及功能活性鉴定[D].南宁:广西大学,2021.
[13]陈曦,李欣翼,陈发顺,等.5株解淀粉芽孢杆菌的益生特性及抑菌活性研究[J].中国畜牧兽医,2023,50(5):2082-2091.
[14]中华人民共和国工业和信息化部.QB2583—2023 纤维素酶制剂[S].北京:中国轻工行业标准出版社,2023.
[15]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 28715—2012 饲料添加剂酸性、中性蛋白酶活力的测定分光光度法[S].北京:中国标准出版社,2012.
[16]缪伏荣,陈鑫珠,邱华玲,等.一株贝莱斯芽孢杆菌的分离与鉴定[J].中国农学通报,2021,37(18):109-116.
[17]朱亚珠,夏率博,陈琳,等.一株贝莱斯芽孢杆菌的生长特性及抑菌活性研究[J].食品科学技术学报,2022,40(1):85-92.
[18]张小波,温贵兰,张喜懿,等.一株鸭源贝莱斯芽孢杆菌的分离鉴定及药敏试验[J].贵州畜牧兽医,2020,44(6):48-50.
[19]MINGMONGKOLCHAI S, PANBANGRED W. Bacillus probiotics:An alternative to antibiotics for livestock production[J].J Appl Microbiol,2018,124(6):1334-1346.
[20]PHELAN R W,CLARKE C,MORRISSEY J P,et al.Tetracycline resistance-encoding plasmid from Bacillus sp.strain, isolated from the marine sponge Haliclona simulans[J].Appl Environ Microbiol,2011,77(1):327-329.
[21]叶卓幸,汤燕君,何璐茜,等.四环素类抗生素耐药研究进展:质粒介导的替加环素耐药机制[J].生态毒理学报,2022,17(4):122-140.
[22]许瑞,刘建华,胡功政,等.鸭源大肠杆菌3种tet基因的多重PCR检测[J].江西农业学报,2011,23(3):150-152.
[23]张彩文,程坤,张欣,等.贝莱斯芽胞杆菌(Bacillus velezensis)分类学及功能研究进展[J].食品与发酵工业,2019,45(17):258-265.
[24]张德锋,高艳侠,王亚军,等.贝莱斯芽孢杆菌的分类、拮抗功能及其应用研究进展[J].微生物学通报,2020,47(11):3634-3649.
[25]吴燕燕,张岩,李来好,等.甲基营养型芽孢杆菌抗菌肽对罗非鱼片保鲜效果的研究[J].食品工业科技,2013,34(2):315-318.
[26]刘韶娜,张斌,相德才,等.芽孢杆菌B13的分离鉴定及其抑菌作用研究[J].中国畜牧兽医,2019,46(2):573-581.
[27]王婷,安明轩,李正浩,等.牛源产酸芽孢杆菌的分离筛选及益生特性研究[J].动物医学进展,2023,44(10):12-18.
[28]贾仲昕,赵佳男,季芳,等.高产中性蛋白酶芽孢杆菌的筛选鉴定及酶学性质研究[J].黑龙江畜牧兽医,2023(1):106-112,132.
[29]黄悦姝,邓超,张馨月,等.贝莱斯芽孢杆菌D103产纤维素酶优化及途径分析[J].生物技术,2023,33(5):632-640.
[30]檀茜倩,王丹,王晓晴,等.发酵海产品中产蛋白酶菌株多样性及其酶学特性[J].中国食品学报,2024,24(2):62-70.