茯茶是以黑毛茶为原料经多道工艺精制而成的一种后发酵茶[1]。茯茶色泽黑褐油润,“金花”茂盛,菌香四溢,茶汤橙红透亮,滋味醇厚悠长[1-3],被誉为古丝绸之路上的“黑黄金”、“生命之茶”、“神秘之茶”。研究表明,茯茶在降低血脂、血糖、血压以及减缓肥胖等方面具有显著作用[4-6],同时茯茶具有调节人体肠道菌群[7-8]、抗氧化、抗衰老等保健功效[9-10]。
发花是茯砖茶品质特征形成的关键过程。发花是在合适的温度、湿度等条件下,在茶叶表面长出大量“金花”。目前茯茶发花主要以自然接种的传统方式进行,存在微生物菌种难以控制、易滋生杂菌、发花时间长、发花效率低等问题[11]。近年来,研究人员通过人工接种冠突曲霉进行茯茶发酵工艺及品质研究。贾洪信等[12]研究发现,在汽蒸后的黑毛茶中接种冠突曲霉于70 ℃渥堆1.5 h和28 ℃下培养发花效果最好;YAO Y等[9]利用冠突曲霉发酵绿茶,发酵7 d成功得到发花散茶茯茶,有效提高茶叶中没食子酸的含量及发酵茶的抗氧化能力。
早期的研究认为,茯茶中的“金花菌”是冠突曲霉(Aspergillus cristatum)[13]。后来大量研究的证实,“金花菌”是能在发酵黑茶上形成有性产孢结构——金色闭囊壳的一类曲霉属真菌,如冠突曲霉、灰绿曲霉(A.glaucus)、谢瓦曲霉(A. chevalieri)、针刺曲霉(A. spiculosus)、蒙地曲霉(A.montevidensis)等。研究人员从陕西、湖南不同茯砖茶样中分离得到的“金花菌”包括冠突曲霉、谢瓦曲霉、针刺曲霉、蒙地曲霉等[14-16]。
本研究利用“金花菌”——蒙地曲霉(Aspergillus montevidensis)发酵茯茶,利用超高效液相色谱-四级杆飞行时间质谱(ultra-high performance liquid chromatography quadrupole time-of-flight mass spectrometry,UHPLC-Q-TOF/MS)技术分析不同发酵时间茶汤中代谢物,并基于代谢组和转录组分析茶叶发酵过程中代谢物变化规律和差异表达基因(differentially expressed genes,DEGs)的富集特征,探究蒙地曲霉对茯茶品质形成的影响,为黑茶发酵新菌种资源开发利用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
蒙地曲霉(Aspergillus montevidensis)CGMCC 3.15762:陕西科技大学微生物实验室保藏;茶叶:湖南安化特级一品黑毛茶。
1.1.2 化学试剂
Trizol核糖核酸(ribonucleic acid,RNA)提取试剂盒:美国Invitrogen公司;Illumina TruSeqTMRNA Sample Prep Kit试剂盒:美国赛默飞公司;甲醇、乙腈、甲酸、丙醇(均为色谱纯):美国Fisher公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固体培养基:胰蛋白胨20 g/L,葡萄糖20 g/L,琼脂1.5%,pH调至7.0,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SW-CJ-1F超净工作台:苏州安泰空气技术有限公司;DSX-280KB24手提式蒸汽灭菌锅:上海申安医疗器械厂;Agilent 1290 InfnityLC超高效液相色谱(UPLC)仪、Thermo Q Exactive Focus质谱(MS)仪:美国Agilent公司。
1.3 方法
1.3.1 发酵茶叶样品制备
将蒙地曲霉接种于YPD斜面保藏培养基中,28 ℃培养7 d,获得发酵菌株。孢子悬液由无菌去离子水洗涤YPD斜面获得,经血球计数板镜检,使孢子数达到2×105 CFU/mL。将黑毛茶(20 g)与去离子水(6 mL)混合,在121 ℃下高压蒸汽灭菌20 min。待其自然冷却至室温后,将1 mL的孢子悬液接种于灭菌后的茶叶中。茶叶在28 ℃下培养,分别在发酵0、3 d、9 d和15 d后收集样品。在-50 ℃条件下冻干备用。
1.3.2 茶叶形态观察
将收集好的茶样轻轻铺展在干净、平整的平皿中,使茶叶均匀分布,在自然光下,观察茶叶表面的形态特征变化以及茶叶间金花的生长变化情况。
1.3.3 茶汤特征观察
按照国标GB/T 23776—2018《茶叶感官审评方法》冲泡黑茶方法准备茶汤。准确称取发酵不同时间点的茶叶样品各3 g,按照茶水比1∶50(g∶mL)加入150 mL沸水,冲泡10 min后过滤收集上清液,观察发酵不同时间点的茶汤特征。
1.3.4 UHPLC-Q-TOF/MS分析发酵茶叶中化合物
发酵后的茶(约5 g)在液氮中被磨成茶粉。将20 mg的茶粉溶解于1 000 μL甲醇-水溶液(3∶1,V/V),并加入同位素标记的内标混合物。在35 Hz频率下对样品进行4 min的均质处理,并在冰水浴中进行5 min的超声波处理。均质化和超声过程重复3次。之后,将样品在-40 ℃下孵育1 h,12 000 r/min条件下离心15 min。最后,将所得上清液通过0.2 μm的滤膜过滤后,注入超高效液相色谱-四极杆飞行时间质谱(UHPLC-Q-TOF/MS)系统进行分析[17]。
超高效液相色谱条件:采用HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),流动相A为95%水+5%乙腈(含0.1%甲酸),流动相B为47.5%乙腈+47.5%异丙醇+5%水(含0.1%甲酸)。梯度洗脱程序:0~10 min内A相由95%降低到5%、B相由5%增加到95%,并维持在95%,保持2 min;12~14 min内B相降为5%,并以5%平衡30 min,流速为0.40 mL/min,柱温为40 ℃,进样量为3 μL。
质谱条件:采用电喷雾离子(electrosprayionization,ESI)源,鞘气流速为50 psi,辅助气流速为13 psi,辅助气加热温度为425 ℃,毛细管温度为325 ℃、一级质谱分辨率60 000、二级质谱分辨率7 500。
定性定量方法:将原始数据导入代谢组学处理软件Progenesis QI进行基线过滤、峰识别、积分、保留时间(retention time,RT)校正、峰对齐,最终得到包含保留时间、质量-电荷比(m/z)值和峰值强度的数据矩阵。通过准确的质谱、MS/MS片段谱对代谢物进行鉴定,并将其MS2谱用于化合物注释。
1.3.5 代谢组学分析
所有实验均重复3次,数据以“平均值±标准差”表示。采用SPSS 26.0软件进行学生t检验,检验各组间代谢物的显著性差异。过滤后数据使用SIMCA 14.1进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)。选择变量重要性投影(variable important in the projection,VIP)值>1,P<0.05且表达量变化比值(|log2fold change|)≥1的差异代谢物进行进一步分析。采用Tbtools 0.655软件绘制差异代谢物热图,以显示不同组间代谢物动态变化。
1.3.6 转录组分析
使用Trizol RNA提取试剂盒提取发酵茶样品总核糖核酸(ribonucleic acid,RNA),利用Oligo磁性微球富集信使核糖核酸(messenger ribonucleic acid,mRNA)。利用Illumina TruSeqTMRNA Sample Prep Kit试剂盒构建互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)库,使用Illumina Novaseq 6000平台进行测序[18],RNA测序的原始数据上传至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库,基于每百万映射读取的基因组区域的读取计数(reads per kilobase per million mappedreads,RPKM)值分析样本间基因表达水平,假发现率(false discoveryrate,FDR)<0.05、表达量变化比值(|log2fold change|)≥1的基因为差异表达基因。在京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库对差异表达基因进行通路分析。
2 结果与分析
2.1 发酵茶叶形态及茶汤特征分析
由图1可知,接种发酵3 d后,茶叶表面无明显变化,茶叶间有少量闭囊壳产生;发酵9 d后,茶叶间有较多闭囊壳产生,蒙地曲霉生长旺盛;发酵15 d后,茶叶上均匀覆盖大量黄色闭囊壳,发酵较完全。随发酵时间的进行,茶叶间闭囊壳明显增多,茶汤色泽由橙黄色变为深琥珀色,口感醇和柔顺。发酵15 d时茶叶金花普茂且茶汤红浓透亮而富有光泽。

图1 蒙地曲霉发酵茶叶形态及茶汤特征
Fig.1 Morphology of tea leaves fermented by Aspergillus montevidensis and characteristics of tea soup
2.2 代谢组分析
2.2.1 主成分分析及正交偏最小二乘法判别分析
不同发酵时间样本共检测到338种代谢物,这些代谢物主要包括氨基酸、类黄酮、糖、有机酸和脂肪酸等。为反映不同发酵时间样本间代谢物差异大小,将不同发酵时期茶叶样本质谱数据进行主成分分析(PCA),从整体上反映样本组间及组内的变异度,观察各样本的总体趋势,判断可能存在的离散点,结果见图2a。由图2a可知,主成分1(PC1)和主成分2(PC2)的方差贡献率分别为56.4%和19.4%,组内样本聚集效果良好,组间差异明显,可以通过PCA有效区分不同发酵时期茶叶样品。进一步通过正交偏最小二乘法判别分析(OPLS-DA)分析,OPLS-DA得分散点图见图2b。由图2b可知,X轴方向模型的累积解释率(R2X)为0.946,Y轴方向模型的累积解释率(R2Y)为0.998,模型的预测能力(Q2)为0.977,样品间具有明显的空间差异,且各组内聚集性良好,表明模型稳定,OPLS-DA可以对不同发酵时期茶叶样品进行有效区分。
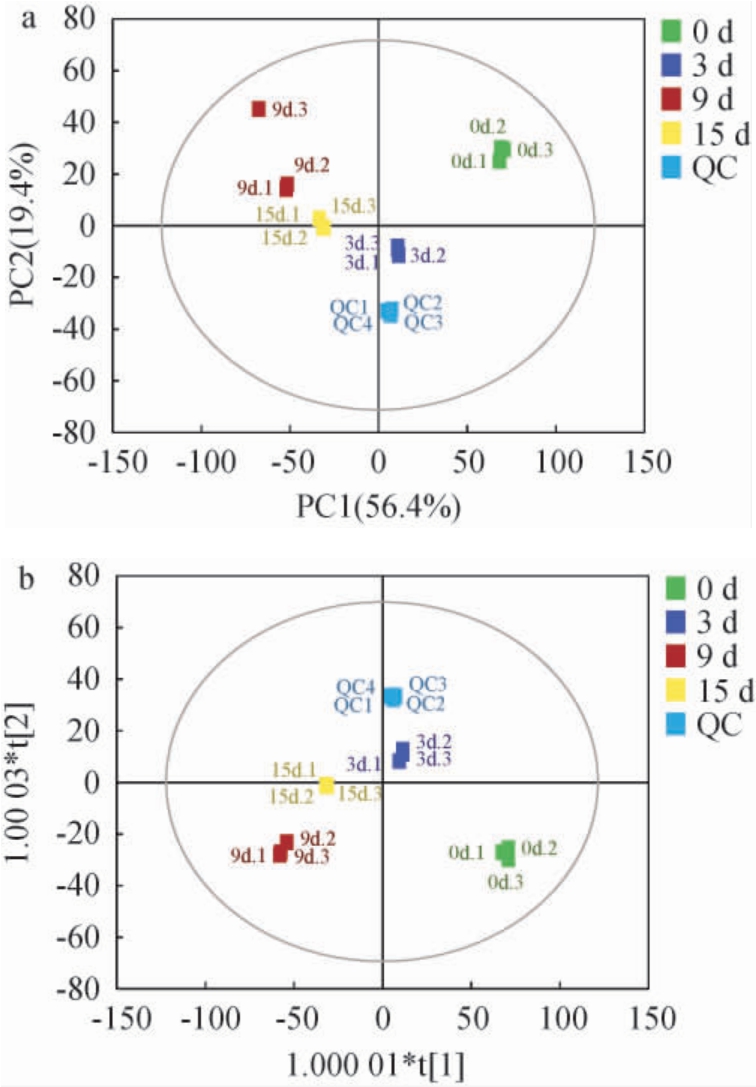
图2 不同发酵时间茶叶代谢物主成分分析(a)及正交偏最小二乘法判别分析(b)
Fig.2 Principal component analysis (a) and orthogonal partial least squares discriminant analysis (b) of metabolites in tea leaves with different fermentation time
为检查OPLS-DA模型是否过拟合,绘制不同发酵时间的茶叶代谢物的OPLS-DA置换检验结果见图3。
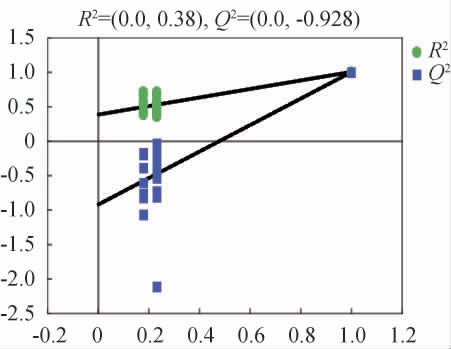
图3 不同发酵时间茶叶代谢物正交偏最小二乘法判别分析置换检验结果
Fig.3 Results of permutation test of orthogonal partial least squares discriminant analysis of metabolites in tea leaves with different fermentation time
由图3可知,不同发酵时间的茶叶两两样本组的交叉验证决定系数(Q2Y)拟合回归线斜率均>1,检测值都低于真实值,Q2Y的回归线截距<0.5,证明所建立的OPLS-DA模型对数据没有过拟合。
2.2.2 差异代谢物筛选及其在不同发酵时期的变化
以P<0.05,VIP>1,|log2fold change|≥1为标准筛选差异代谢物,结果见图4。由图4可知,与发酵0 d相比,发酵3 d、9 d、15 d样品分别检测到37个、72个、59个差异代谢物。发酵3 d和发酵0 d相比的差异代谢物共37个,其中有15个上调,22个下调。发酵9 d和发酵0 d相比的差异代谢物共72个,其中有37个上调,35个下调。发酵15 d和发酵0 d的差异代谢物共59个,其中有30个上调,29个下调。这些差异代谢物主要为氨基酸、类黄酮、糖、有机酸和脂肪酸等。
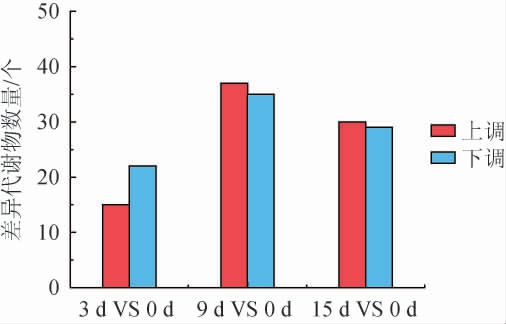
图4 不同发酵时间茶叶样品中差异代谢物数量的变化
Fig.4 Changes of differential metabolites number in tea leaves samples with different fermentation time
2.2.3 不同发酵时间茶叶样品中差异代谢物的差异分析
为进一步探索不同发酵时期茶叶代谢物差异,对上述筛选出来的不同发酵时间茶叶样品中差异代谢物进行聚类分析,并绘制热图,结果见图5。
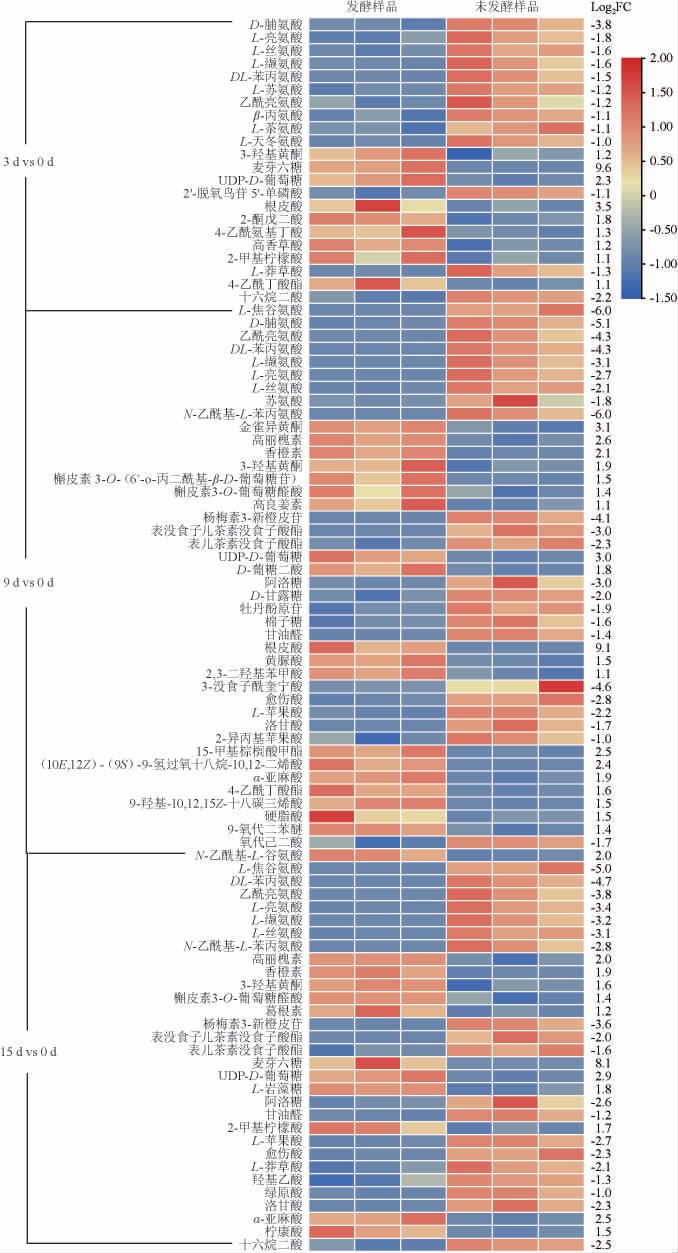
图5 不同发酵时间茶叶样品中差异代谢物的聚类分析热图
Fig.5 Cluster analysis heat map of differential metabolites in tea leaves samples with different fermentation time
(1)氨基酸类化合物差异
与未发酵茶叶样品相比,发酵3 d、9 d和15 d茶样的氨基酸类物质相对含量均以下调为主,其中D-脯氨酸、L-焦谷氨酸、苯丙氨酸等相对含量下调4.3~6.0倍。在发酵过程中“金花菌”需要消耗茶叶中的氮源维持自身的生长繁殖,因此蒙地曲霉发酵茯茶时出现氨基酸相对含量下调的现象,这与冠突曲霉发酵茯茶结果一致[19]。此外,氨基酸与茶的香气、甜度、苦味和鲜味密切相关[20]。发酵后期氨基酸组成的改变以及亮氨酸、苯丙氨酸等苦味氨基酸[21]的下调可能对茶汤滋味形成具有重要作用。
(2)类黄酮化合物差异
与未发酵茶叶样品相比,发酵3 d、9 d和15 d茶样的类黄酮类化合物(除杨梅素3-新橙皮苷、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯下调外)相对含量均以上调为主。如3-羟基黄酮、槲皮素3-O葡萄糖醛酸、高丽槐素、金雀异黄酮等上调了1.2~3.1倍。此外,在发酵9 d和发酵15 d样品中,类黄酮类物质相对含量增加。表儿茶素没食子酸酯和表没食子儿茶素没食子酸酯是具有苦涩味特征的儿茶素物质[22],发酵过程中其相对含量显著下调可能对于发酵黑茶口感醇和以及甘甜滋味形成具有重要意义。金雀异黄酮具有抗氧化作用[23],高丽槐素具有一定的抗肿瘤作用[24]。因此,蒙地曲霉发酵的黑茶可能在抗氧化、抗肿瘤等方面具有重要的保健功能。
(3)糖类化合物差异
与未发酵茶叶样品相比,发酵3 d茶样的糖类物质以上调为主,其中,麦芽六糖相对含量上调最显著(上调9.6倍);发酵9 d茶样中的糖类物质相对含量以下调为主,其中阿洛糖下调最为显著(下调3.0倍);发酵15 d上调的糖类较多,其中麦芽六糖相对含量增加最显著(上调8.1倍)。可溶性糖与茶汤的甜味感知高度相关[25],在发酵后期茶叶中可溶性糖类物质相对含量增加,增加茶汤的甜度。
(4)有机酸和脂肪酸类化合物差异
与未发酵茶叶样品相比,发酵3 d样品有机酸以上调为主,而上调脂肪酸数量和下调脂肪酸数量相同;发酵9 d和15 d样品中的有机酸以下调为主,脂肪酸以上调为主。3-没食子酰奎宁酸、十六烷二酸下调较显著,分别下调4.6倍和2.5倍。根皮酸、α-亚麻酸上调显著,分别上调9.1倍、2.5倍。α-亚麻酸属于不饱和脂肪酸,具有降血脂、抗动脉粥样硬化、保护心血管等功能[26-27];根皮酸具有降压、抑制成骨细胞衰老等功能[28]。
2.3 转录组分析
以FDR<0.05和|log2fold change|>1为标准筛选差异表达基因(DEGs),蒙地曲霉发酵黑茶15 d与发酵9 d的茶叶样品差异表达基因(DEGs)筛选结果见图6。由图6可知,随着发酵的进行,共检测到923个差异表达基因,包括722个上调表达基因和201个下调表达基因。
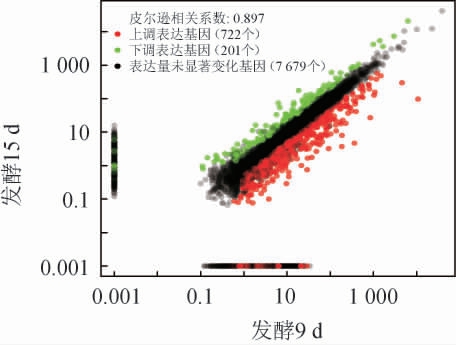
图6 发酵15 d与发酵9 d的茶叶样品差异表达基因筛选结果
Fig.6 Screening results of differentially expressed genes in tea leaves samples fermentation for 15 d and 9 d
丰富闭囊壳的形成是茯砖茶独特的品质标志[29],金花被认为具有“真菌花”的香味,对健康有益[30]。发酵黑茶15 d与发酵9 d的茶叶样品差异表达基因分析结果见表1。由表1可知,蒙地曲霉发酵茶叶15 d后,与发酵9 d相比,孢子形成基因(wetA、fluG、alb1、ayg1、arp1、arp2、abr1、abr2、tpsA、rodA和ppoA)的表达增加,这些无性基因的上调表达可以促进发酵茶中分生孢子的形成。形成这一结果的原因可能是随着发酵进行,茶叶中渗透压会增加,导致发酵15 d时分生孢子形成。此外,与发酵9 d相比,一些基因包括淀粉水解葡萄糖淀粉酶(starch hydrolyzing glucoamylase,SGA)、纤维素二糖水解酶(cellobiohydrolase,CBH)在发酵15 d后显著上调,这些基因与碳水化合物水解合成有关。氨基酸水解相关基因乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)在发酵15 d后上调,乙酰辅酶A乙酰转移酶(acetyl coenzyme A acetyltransferase,ACAA)、3-氧基异戊酸辅酶A转移酶(3-oxoacid coenzyme A transferase,OXCT)发酵后下调。糖和氨基酸含量变化可能与这些基因变化有关。
表1 发酵15 d与发酵9 d的茶叶样品差异表达基因分析
Table 1 Analysis of differentially expressed genes in tea leaves samples fermentation for 15 d and 9 d
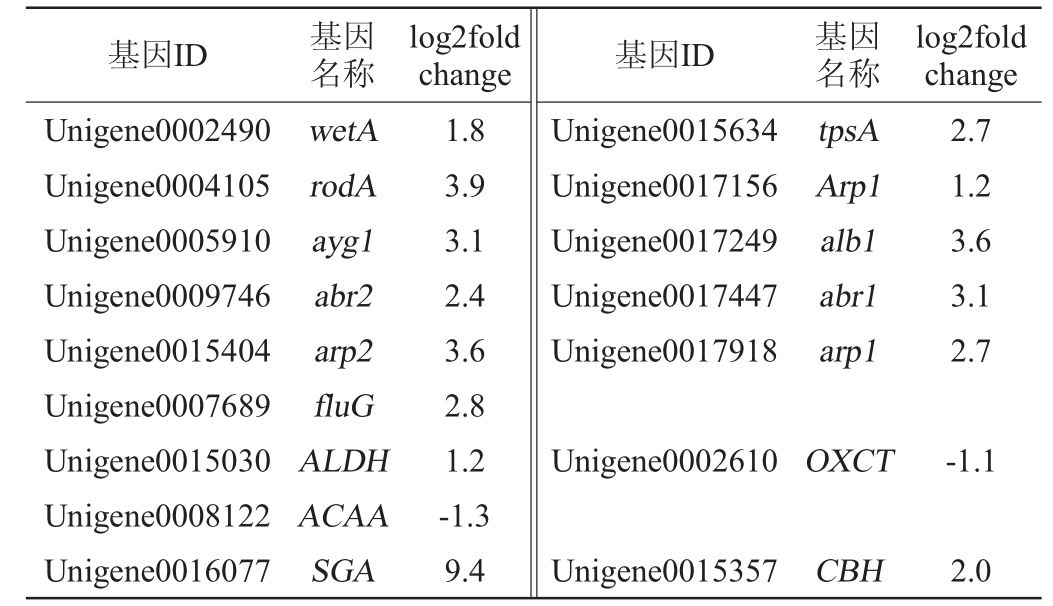
基因ID 基因名称log2fold change 基因ID 基因名称log2fold change Unigene0002490 Unigene0004105 Unigene0005910 Unigene0009746 Unigene0015404 Unigene0007689 Unigene0015030 Unigene0008122 Unigene0016077 wetA rodA ayg1 abr2 arp2 fluG ALDH ACAA SGA 1.8 3.9 3.1 2.4 3.6 2.8 1.2-1.3 9.4 Unigene0015634 Unigene0017156 Unigene0017249 Unigene0017447 Unigene0017918 tpsA Arp1 alb1 abr1 arp1 2.7 1.2 3.6 3.1 2.7 Unigene0002610OXCT -1.1 Unigene0015357 CBH 2.0
差异表达基因的KEGG富集通路分析结果见图7。
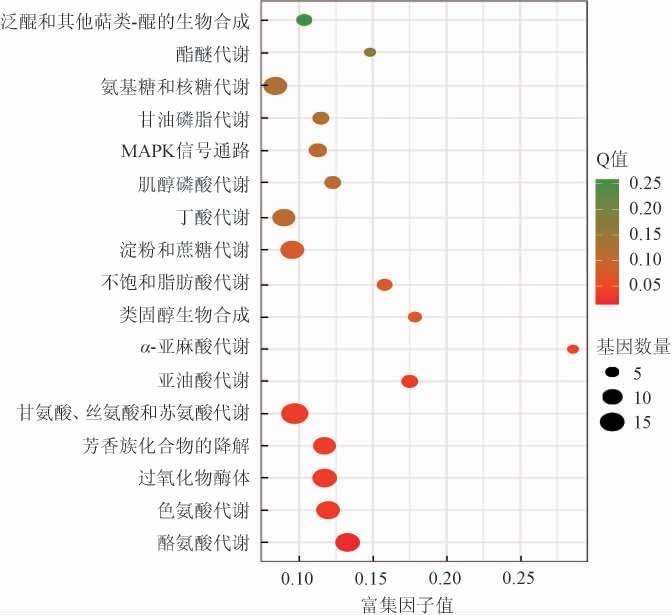
图7 差异表达基因的KEGG富集通路分析
Fig.7 KEGG enrichment pathway analysis of differentially expressed genes
由图7可知,差异基因显著富集到17个KEGG信号通路(P<0.05),主要包括酪氨酸代谢(tyrosine metabolism)、色氨酸代谢(tryptophan metabolism)、甘氨酸、丝氨酸和苏氨酸代谢(glycine,serine and threonine metabolism)、淀粉和蔗糖代谢(starch and sucrose metabolism)、氨基糖和核糖代谢(amino sugar and nucleotide sugar metabolism)、丁酸代谢(butanoate metabolism)、亚油酸代谢(linoleic acid metabolism)、α-亚麻酸代谢(alpha-linolenic acid metabolism)、不饱和脂肪酸生物合成(biosynthesis of unsaturated fatty acids)等。利用冠突曲霉发酵黑茶,其差异基因显著富集到酪氨酸代谢、色氨酸代谢、亚油酸代谢、淀粉和蔗糖代谢等代谢途径中[31]。淀粉和蔗糖代谢、酪氨酸代谢、色氨酸代谢、亚油酸代谢等这些通路的富集表明发酵会影响碳源和氮源的利用,以及次级代谢产物的前体合成。这些通路可能是造成不同发酵时间茶叶在代谢水平上有差异的原因之一。发酵茶中代谢物(如氨基酸、类黄酮、糖、有机酸和脂肪酸)的特定变化,赋予其独特的口感特征和健康效益[32]。研究结果表明,碳氮代谢在蒙地曲霉发酵茶叶品质形成中起着重要作用。这些结果暗示上述途径的活化对茯茶品质形成可能具有重要作用。
3 结论
运用代谢组和转录组对蒙地曲霉发酵黑茶不同时间代谢物和表达基因进行检测,主成分分析表明黑茶发酵过程中代谢物存在较大差异。与未发酵的茶叶样品相比,发酵3 d、9 d、15 d样品分别检测到出37个、72个、59个差异代谢物,这些物质主要属于氨基酸、类黄酮、糖、有机酸和脂肪酸等;发酵3 d、9 d和15 d茶样的多个氨基酸相对含量下调,而类黄酮类物质相对含量以上调为主,一些可溶性糖的相对含量增加;而有机酸在发酵3 d上调,发酵9 d和15 d以下调为主,脂肪酸在发酵9 d和15 d以上调为主。对蒙地曲霉发酵黑茶15 d和9 d样品的转录组比较分析发现,共筛选出923个差异表达基因,其中有722个上调表达基因和201个下调表达基因,差异基因显著富集到17个KEGG代谢通路中,主要包括氨基酸代谢、淀粉和蔗糖代谢、氨基糖和核糖代谢等。综合来看,随着发酵时间增加,茶汤苦涩味有所降低,茶汤滋味有所改善。蒙地曲霉接种发酵对黑茶风味的形成及保健作用有重要影响。
[1]杨吉霞,曾祥平,蒲慧敏,等.陕西茯砖茶的微生物多样性和群落结构[J].食品与发酵工业,2020,46(3):50-57.
[2]张舟琼,曹霞,任锡毅,等.贵州茯茶散茶发花条件优化及微生物多样性分析[J].现代食品科技,2023,39(9):62-71.
[3]冯璞阳,白亚妮,冯志珍,等.冠突散囊菌散茶发花工艺提高茯茶品质研究进展[J].茶叶,2023,49(1):9-12.
[4]YOO A,KIM M J,AHN J,et al.Fuzhuan brick tea extract prevents dietinduced obesity via stimulation of fat browning in mice[J].Food Chem,2022,377:132006.
[5]CHEN G J, XIE M H, WAN P, et al.Digestion under saliva, simulated gastric and small intestinal conditions and fermentation in vitro by human intestinal microbiota of polysaccharides from Fuzhuan brick tea[J].Food Chem,2018,244:331-339.
[6]LIANG Y,WU F H,WU D Y,et al.Fu loose tea administration ameliorates obesity in high-fat diet-fed c57bl/6j mice:a comparison with Fu brick tea and orlistat[J].Foods,2024,13(2):206.
[7]李秀平,欧阳建,唐静怡,等.茯砖茶通过调节肠道菌群和胆汁酸代谢预防肥胖及高胆固醇血症作用机制[J].食品科学,2022,43(9):136-149.
[8]LI H C,YANG S Q,FAN L J,et al.Investigating the contribution of mulberry leaf Fu tea to ameliorating metabolic disorders and remodeling gut microbiota in diabetic mice[J].Food Front,2023,4(3):1496-1510.
[9]YAO Y, WU M, HUANG Y, et al.Appropriately raising fermentation temperature beneficial to the increase of antioxidant activity and gallic acid content in Eurotium cristatum-fermented loose tea[J].LWT-Food Sci Technol,2017,82:248-254.
[10]史敏,陈雷,郭晓波,等.泾渭茯茶茶多糖对D-半乳糖衰老小鼠模型的抗衰老机制研究[J].中国美容医学,2018,27(1):81-84.
[11]罗密,俞梦瑶,禹利君,等.冠突散囊菌LJSC.2001对不同黑毛茶发花品质的影响[J].食品科学,2023,44(14):106-115.
[12]贾洪信,刘素纯,黄建安,等.影响散茶发花主要因素探讨[J].安徽农业科学,2010,38(14):7541-7543.
[13]齐祖同,孙曾美.茯砖茶中优势菌种的鉴定[J].真菌学报,1990,9(3):176-179.
[14]胥伟,吴丹,姜依何,等.黑茶微生物研究:从群落组成到安全分析[J].食品安全质量检测学报,2016,7(9):3541-3552.
[15]吕嘉枥,孟雁南,史朝烨,等.陕西茯茶中“金花菌”的ITS序列特性分析[J].陕西科技大学学报,2018,36(4):47-51.
[16]杨吉霞,曾祥平,蒲慧敏,等.陕西茯砖茶的微生物多样性和群落结构[J].食品与发酵工业,2020,46(3):50-57.
[17]LIU K H,LIU W T,DING X W,et al.The key role of LeuRS in the development of the cleistothecium and the metabolization of the flavor during the fermentation of dark tea with Aspergillus montevidensis[J].LWT-Food Sci Technol,2023,185(25):115188.
[18]张李旭,刘开辉,丁小维,等.NaCl胁迫下嗜盐蒙地曲霉Aspergillus montevidensis ZYD4的转录组及代谢组分析[J/OL].陕西科技大学学报,1-9[2025-01-07].https://doi.org/10.19481/j.cnki.issn2096-398x.20241024.001.
[19]袁旭霜.应用冠突散囊菌液态、固态发酵不同种类茶叶的作用机理[D].西安:陕西科技大学,2023.
[20]ZHU M Z,LI N,ZHOU F,et al.Microbial bioconversion of the chemical components in dark tea[J].Food Chem,2020,312:126043.
[21]黄藩,罗凡,胥亚琼,等.四川绿茶滋味品质分析及风味轮构建[J].西南农业学报,2023,36(5):943-951.
[22]庄菊花.绿茶苦涩味的物质基础研究[D].合肥:安徽农业大学,2020.
[23]SIRIVIRIYAKUL P, SRIKO J, SOMANAWAT K, et al.Genistein attenuated oxidative stress,inflammation,and apoptosis in L-arginine induced acute pancreatitis in mice[J].BMC Complement Med Ther,2022,22(1):208.
[24]傅月朦,余登香,王淑娜,等.山豆根黄酮类成分药理作用及机制研究进展[J].中草药,2022,53(19):6234-6244.
[25]WANG C M, DU X, NIE C N, et al.Evaluation of sensory and safety quality characteristics of"high mountain tea"[J].Food Sci Nutr,2022,10(10):3338-3354.
[26]王辉敏,李冠文,杨金梅,等.马齿苋多不饱和脂肪酸对高脂血症大鼠的降脂作用[J].中国粮油学报,2023,38(3):144-150.
[27]吴俏槿,杜冰,蔡尤林,等.α-亚麻酸的生理功能及开发研究进展[J].食品工业科技,2016,37(10):386-390.
[28]王玲娜,姚佳欢,马超美.绿原酸的研究进展[J].食品与生物技术学报,2017,36(11):1121-1130.
[29]CHEN G J,PENG Y J,XIE M H,et al.A critical review of Fuzhuan brick tea:processing,chemical constituents,health benefits and potential risk[J].Crit Rev Food Sci Nutr,2023,63(22):5447-5464.
[30]ZHENG X X, HONG X, JIN Y L, et al.Characterization of key aroma compounds and relationship between aroma compounds and sensory attributes in different aroma types of Fu brick tea[J].Food Chem,2022,13:100248.
[31]SUN Y J,YUAN X S,LUO Z J,et al.Metabolomic and transcriptomic analyses reveal comparisons against liquid-state fermentation of primary dark tea,green tea and white tea by Aspergillus cristatus[J].Food Res Int,2023,172:113115.
[32]ZHU Q F,GE Y H,AN N,et al.Profiling of branched fatty acid esters of hydroxy fatty acids in teas and their potential sources in fermented tea[J].J Agr Food Chem,2022,70(17):5369-5376.