支气管哮喘、鼻炎和湿疹等过敏性疾病等患者约占全世界所有住院病例的0.26%,在因过敏而住院的患者中,病死率为0.5%~1.0%[1-3],此外,长期服用过敏药还可能产生副作用[4]。在过敏的众多触发因素中,肠道微生物区系的变化损害了免疫调节和耐受性[5-6]。目前,治疗过敏反应的方法主要以局部或系统用药为主,例如抗组胺类药物、糖皮质激素类药物、钙调磷酸酶抑制剂、系统使用改善血管通透性药物等。然而,以药物治疗过敏疾病容易对患者产生副作用[7]。乳酸菌是一种安全、可食用且无副作用的益生菌,通过调节肠道微生物群以预防或治疗过敏是研究重点之一[8]。
乳酸菌通过调整肠道菌群、调节免疫参数、代谢物及肠道通透性或产生生物活性影响其他器官[9]。然而乳酸菌菌株诱导的免疫调节活性在物种之间不同,甚至在同一物种的不同菌株之间也不同[10]。如鼠李糖乳杆菌LZ260E[11]、嗜酸乳杆菌La28[12]等菌株具有不同程度的抗过敏效果。其中,乳杆菌属于乳酸菌,具备强大的安全性[13],能够产生细菌素并竞争性地排除潜在的病原体[14]。因此,饮食中添加乳杆菌可促进机体健康并降低各种疾病的风险。在实际应用中,较高的菌株存活率和细胞代谢活力是乳酸菌充分发挥益生功能的基础。通过冷冻干燥脱除水分,制成冻干粉的技术是有效的菌株保存方法,能有效抑制菌株的生长代谢和繁殖,保持菌株的原有特性[15]。然而,低温和干燥环境的胁迫同样会导致乳酸菌细胞的结构和生理功能的损害,如冰晶引起的机械损伤、关键酶的失活和脱氧核糖核酸(deoxyribonucleic acid,DNA)结构的改变等,严重时甚至死亡[16]。因此,通过优化冻干过程减轻乳酸菌细胞受损下降的程度,有助于菌株的工业化应用。汪海涛等[17]制备植物乳植杆菌冻干粉结果表明,发酵阶段活菌数在一定范围内随发酵温度、发酵时间和接种量的增加而增加,达到最高点后又开始下降。潘子怡等[18]研究表明,青春双歧杆菌菌泥中干物质与冻干保护剂的质量比为1∶1.2时可以得到最佳的冻干存活率。
本研究以发酵粘液乳杆菌(Limosilactobacillus fermentum)HCS08-005为菌种,采用冷冻干燥技术制备冻干粉,通过单因素及响应面试验优化其制备工艺条件,通过斑马鱼试验验证该菌株对类胰蛋白酶表达水平的影响,并考察其抗过敏功能,以期为益生菌冻干粉制备及过敏治疗提供理论基础,促进抗过敏功能产品的研发与生产。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
发酵粘液乳杆菌(Limosilactobacillus fermentum)HCS08-005(CGMCC No.16259):保藏于中国微生物菌种保藏管理委员会普通微生物中心;色甘酸钠(批号T2806H5162):上海源叶生物科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、N-甲基-ρ-甲氧基苯乙基胺和甲醛缩合产物(化合物48/80)、N-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐(Nbenzoyl-DL-arginine-p-nitroaniline HCl,BAPNA):美国Sigma公司。
1.1.2 培养基
基础培养基:葡萄糖20.0 g/L、酵母蛋白胨20.0 g/L、酵母浸出物5.0 g/L、柠檬酸5.0 g/L、硫酸镁0.5 g/L、硫酸锰0.2 g/L,pH值6.50。
优化培养基:酵母蛋白胨20.0 g/L、葡萄糖30.0 g/L、酵母浸出物15.0 g/L、柠檬酸5.0 g/L、L-苹果酸5.0 g/L、硫酸镁0.5 g/L、硫酸锰0.2 g/L,pH值6.50。以上培养基均于115 ℃条件下灭菌30 min。
1.1.3 实验动物
斑马鱼均饲养于28 ℃的养鱼用水中(水质:每1 L反渗透水中加入200 mg速溶海盐,电导率为450~550 μS/cm;pH为6.5~8.5;硬度为50~100 mg/L CaCO3),由杭州环特生物科技股份有限公司养鱼中心繁殖提供,实验动物使用许可证号为:SYXK(浙)2022-0004,饲养管理符合国际AAALAC认证(认证编号:001458)的要求,IACUC伦理审查号:IACUC-2023-7775-01。
1.2 仪器与设备
SZX7解剖显微镜:日本OLYMPUS公司;VertA1 CCD相机:上海土森视觉科技有限公司;CP214精密电子天平:美国OHAUS公司;SPARK多功能酶标仪:瑞士TECAN公司;6孔板:浙江贝兰伯生物技术有限公司;12孔板、96孔板:无锡耐思生命科技股份有限公司。
1.3 方法
1.3.1 发酵粘液乳杆菌HCS08-005冻干粉的制备
取发酵粘液乳杆菌HCS08-005菌种冻存管,放入37 ℃水浴锅内进行菌种复苏15~30 s,至冻存管内液体全部融化。将复苏好的菌种接种至基础培养基中37 ℃密闭培养18 h活化菌种。活化后按照5%接种量将菌悬液接种至基础培养基中,37 ℃密闭培养18 h以扩培菌种。扩培后接种至优化培养基继续发酵,发酵结束后将菌悬液以12 000 r/min离心10 min以收集菌泥。将收集到的菌泥与冻干保护剂(海藻糖12%、甘油1.0%、谷氨酸钠1.0%、VC钠0.1%)以1∶3(kg∶L)的比例混合并搅拌均匀,随后进行真空冷冻干燥。收集冻干粉后使用粉碎机粉碎至无结块粉末状,即得发酵粘液乳杆菌HCS08-005冻干粉。
1.3.2 冻干粉制备工艺优化
单因素试验:以活菌数为考察指标,在发酵粘液乳杆菌HCS08-005冻干粉的生产工艺基础上,分别考察发酵温度(35 ℃、36 ℃、37 ℃、38 ℃、39 ℃);发酵时间(9 h、12 h、15 h、18 h、21 h);接种量(1%、3%、5%、7%、9%);初始pH值(5.0、5.3、5.6、5.9、6.2);菌泥与冻干保护剂比例(1∶1、1∶2、1∶3、1∶4、1∶5)(kg∶L);冻干时间(45 h、50 h、55 h、60 h、65 h)对发酵粘液乳杆菌HCS08-005冻干粉活菌数的影响。
Plackett-Burman(PB)试验:在单因素试验结果基础上,以活菌数(Y)为考察指标,以发酵温度(X1)、发酵时间(X2)、接种量(X3)、初始pH值(X4)、菌泥与冻干保护剂比例(X5)、冻干时间(X6)共6个因素进行Plackett-Burman试验,筛选出对活菌数影响显著的因素,PB试验因素与水平见表1。
表1 冻干粉制备工艺优化Plackett-Burman试验因素与水平
Table 1 Factors and levels of Plackett-Burman tests for preparation process optimization of freeze-dried powder
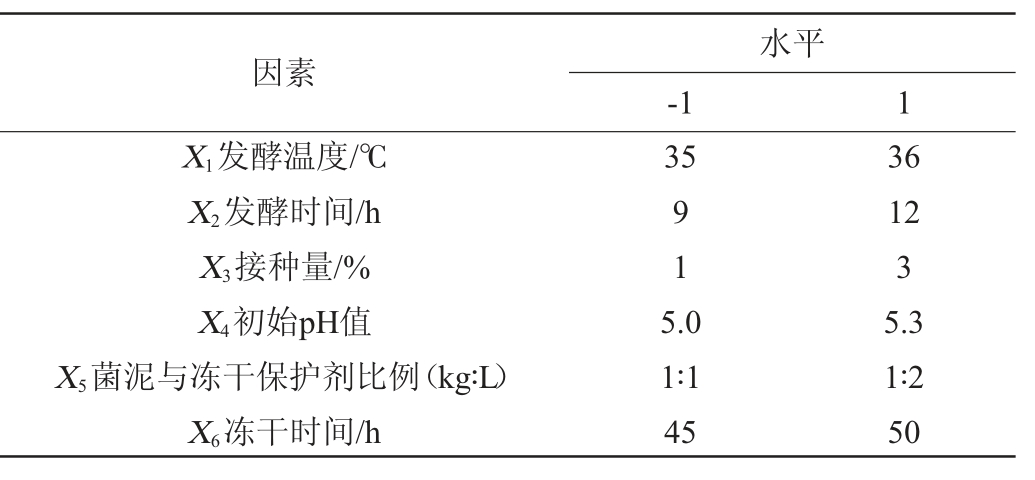
因素X1发酵温度/℃X2发酵时间/h X3接种量/%X4初始pH值X5菌泥与冻干保护剂比例(kg∶L)X6冻干时间/h水平-1 1 35 91 5.0 1∶1 45 36 12 3 5.3 1∶2 50
响应面试验:参考余萍[19]的试验方法,以活菌数(Y)为响应值,以发酵温度(A)、发酵时间(B)、接种量(C)、菌泥与冻干保护剂比例(D)为自变量,运用Design-Expert V8.0.6软件进行4因素3水平响应面试验确定最优制备工艺,Box-Behnken试验设计因素与水平见表2。
表2 冻干粉制备工艺优化Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken tests design for preparation process optimization of freeze-dried powder
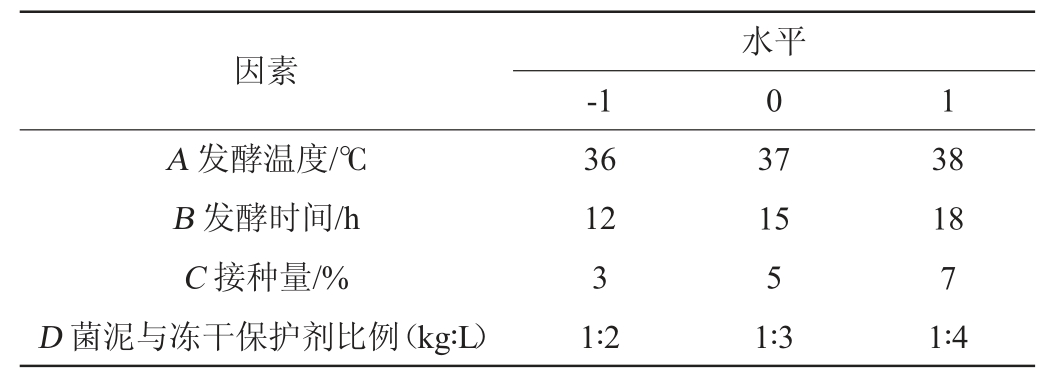
因素A 发酵温度/℃B 发酵时间/h C 接种量/%D 菌泥与冻干保护剂比例(kg∶L)-1水平0 1 36 12 3 1∶2 37 15 5 1∶3 38 18 7 1∶4
1.3.3 最大耐受浓度及抗过敏功效评价
选择化合物48/80作为肥大细胞激活剂,诱导斑马鱼肥大细胞脱颗粒,释放类胰蛋白酶,建立类过敏模型,释放的类胰蛋白酶越多,表明过敏程度越严重。通过类胰蛋白酶水平的高低来验证发酵粘液乳杆菌HCS08-005冻干粉的抗过敏效果。随机选取受精后4 d野生型AB品系斑马鱼于6孔板中,每孔处理30尾斑马鱼。以纯水为溶剂配制发酵粘液乳杆菌HCS08-005冻干粉质量浓度分别为31.2 μg/mL、62.5 μg/mL、125 μg/mL、250 μg/mL、500 μg/mL、1 000 μg/mL和2 000 μg/mL,阳性对照组给予1 000 μg/mL质量浓度的色甘酸钠,同时设置正常对照组和模型对照组,每孔容量为3 mL,重复3次平行。除正常对照组外,其余各实验组均水溶给予1.5 μg/mL化合物48/80建立斑马鱼类过敏模型。所有组别均水溶给予100 μg/mL BAPNA,28 ℃处理24 h后,测定斑马鱼对发酵粘液乳杆菌HCS08-005冻干粉的最大耐受浓度(maximum tolerance concentration,MTC),观察斑马鱼表型状态。将液体转移至96孔板中,250 μL/孔,利用多功能酶标仪检测各组OD405nm值,以该指标反映斑马鱼类胰蛋白酶表达水平,评价发酵粘液乳杆菌HCS08-005冻干粉抗过敏功效。
1.3.4 统计学分析
数据采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),并利用Duncan's法进行多重比较,P<0.05表明差异显著。
2 结果与分析
2.1 单因素试验结果
由图1A可知,随发酵温度在35~37 ℃范围内的增加,冻干粉活菌数增加;当发酵温度为37 ℃时,活菌数达到最大值为6.32×1011CFU/g;继续增加发酵温度,活菌数降低。因此,确定最适发酵温度为37 ℃。由图1B可知,随发酵时间在9~15 h范围内的增加,冻干粉活菌数增加;当发酵时间为15 h时,活菌数达到最大值,为6.01×1011 CFU/g;继续增加发酵时间,活菌数降低。因此,确定最适发酵时间为15 h。由图1C可知,随着接种量在1%~5%范围内的增加,冻干粉活菌数增加;当接种量为5%时,酵母菌活菌数达最大值6.28×1011 CFU/g;继续增加接种量,活菌数降低。因此,确定最适接种量为5%。由图1D可知,当初始pH值为5.0~5.6时,冻干粉活菌数逐渐增加;当初始pH值为5.6时,冻干粉活菌数最高,为6.15×1011 CFU/g;继续增加初始pH值,活菌数下降。由图1E可知,当菌泥与冻干保护剂比例为1∶1~1∶3(kg∶L)时,活菌数逐渐增加;当菌泥与冻干保护剂比例为1∶3(kg∶L)时,活菌数达到最高值,为6.15×1011CFU/g;继续增加冻干保护剂质量,活菌数降低。因此,确定最适菌泥与冻干保护剂比例为1∶3(kg∶L)。由图1F可知,随冻干时间在45~55 h范围内的增加,冻干粉活菌数增加;当冻干时间为55 h时,活菌数达到最大值,为6.22×1011 CFU/g;继续增加冻干时间,活菌数降低。因此,确定最适冻干时间为55 h。
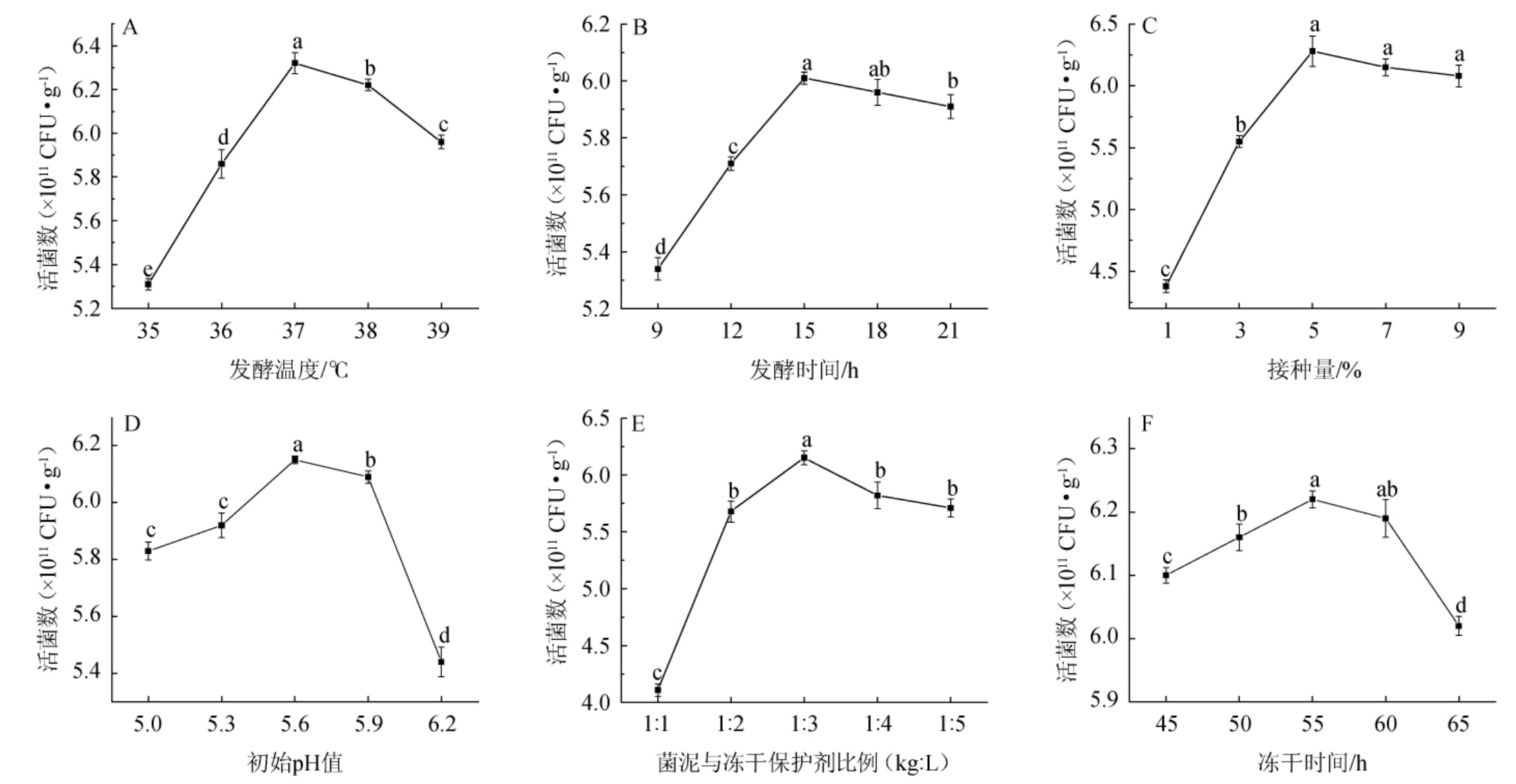
图1 发酵温度(A)、发酵时间(B)、接种量(C)、初始pH值(D)、菌泥与冻干保护剂比例(E)和冻干时间(F)对冻干粉活菌数的影响
Fig.1 Effect of fermentation temperature (A), fermentation time (B), inoculum (C), initial pH (D), ratio of bacterial mud and freeze-drying protective agent (E) and freeze-drying time (F) on the viable bacterial count in freeze-dried powder
不同字母表示组间差异显著(P<0.05)。
2.2 Plackett-Burman试验设计结果与分析
以发酵温度(X1)、发酵时间(X2)、接种量(X3)、初始pH值(X4)、菌泥与冻干保护剂比例(X5)、冻干时间(X6)为考察因素,Plackett-Burman试验设计及结果见表3,Plackett-Burman试验方差分析结果见表4。
表3 冻干粉制备工艺优化Plackett-Burman试验设计与结果
Table 3 Design and results of Plackett-Burman tests for preparation process optimization of freeze-dried powder
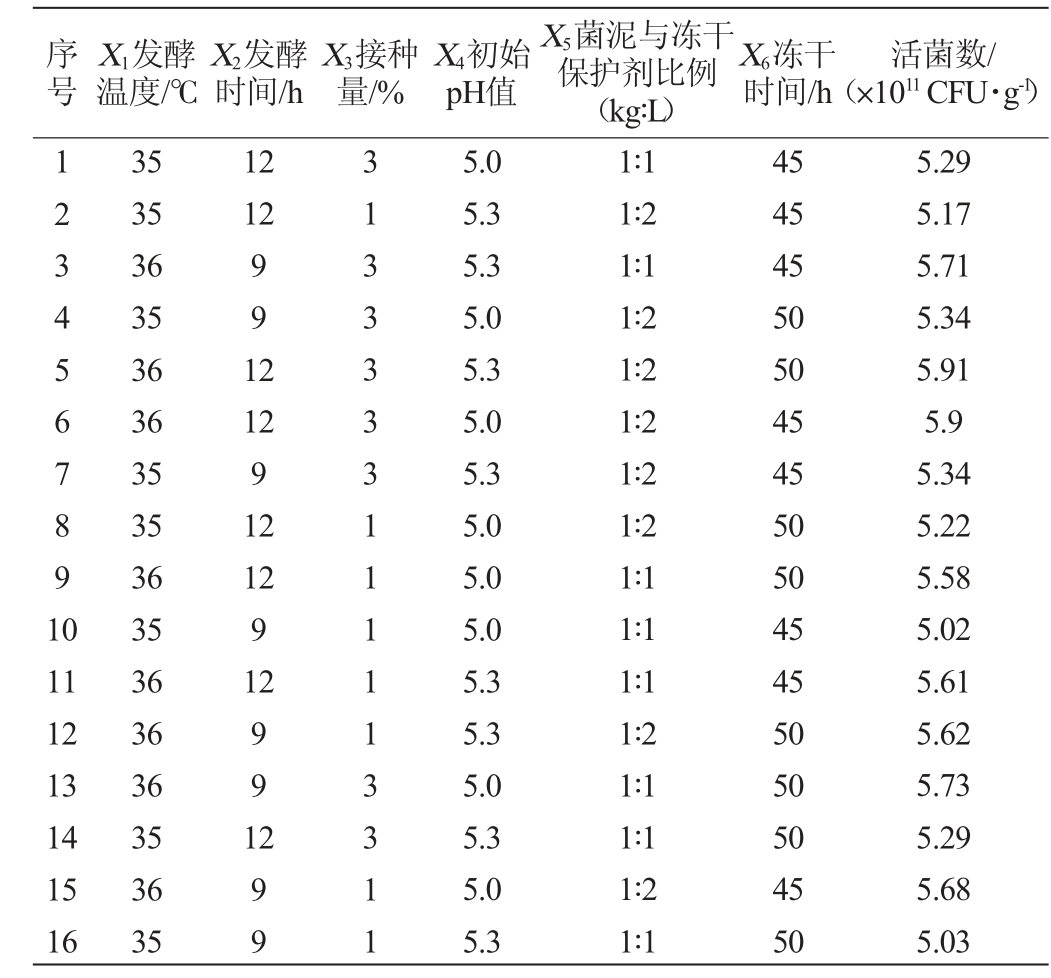
序号X1发酵温度/℃X2发酵时间/h X3接种量/%X4初始pH值X5菌泥与冻干保护剂比例(kg∶L)X6冻干时间/h活菌数/(×1011 CFU·g-1)1234567891 0 12 12 991 2 11 12 13 14 15 16 35 35 36 35 36 36 35 35 36 35 36 36 36 35 36 35 12 9 12 12 9 12 991 299 3133333111113311 5.0 5.3 5.3 5.0 5.3 5.0 5.3 5.0 5.0 5.0 5.3 5.3 5.0 5.3 5.0 5.3 1∶1 1∶2 1∶1 1∶2 1∶2 1∶2 1∶2 1∶2 1∶1 1∶1 1∶1 1∶2 1∶1 1∶1 1∶2 1∶1 45 45 45 50 50 45 45 50 50 45 45 50 50 50 45 50 5.29 5.17 5.71 5.34 5.91 5.9 5.34 5.22 5.58 5.02 5.61 5.62 5.73 5.29 5.68 5.03
表4 冻干粉制备工艺优化Plackett-Burman试验方差分析结果
Table 4 Results of variance analysis of Plackett-Burman tests for preparation process optimization of freeze-dried powder
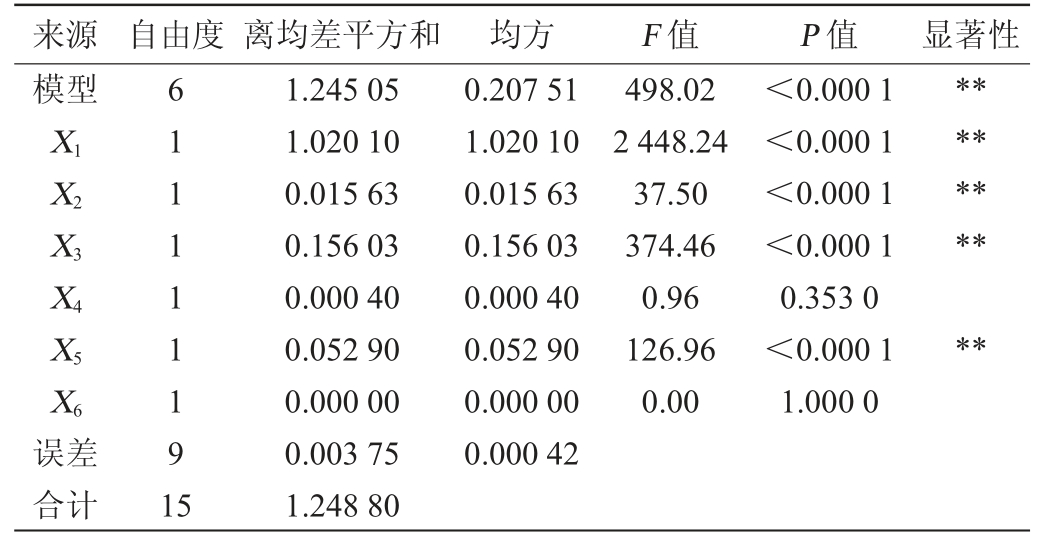
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
来源 自由度 离均差平方和 均方 F 值 P 值 显著性模型X1 X2 X3 X4 X5 X6 498.02 2 448.24 37.50 374.46 0.96 126.96 0.00<0.000 1<0.000 1<0.000 1<0.000 1 0.353 0<0.000 1 1.000 0**********误差合计611111191 5 1.245 05 1.020 10 0.015 63 0.156 03 0.000 40 0.052 90 0.000 00 0.003 75 1.248 80 0.207 51 1.020 10 0.015 63 0.156 03 0.000 40 0.052 90 0.000 00 0.000 42
由表4可知,主效应显著(P值<0.01),模型的决定系数R2为99.70%,调整决定系数R2Adj为99.50%,说明该方程能解释试验选取的6个因素。其中,发酵温度、发酵时间、接种量、菌泥与冻干保护剂比例对活菌数影响极显著(P<0.01),初始pH值、冻干时间(h)对活菌数影响不显著(P>0.05)。因此,发酵温度、发酵时间、接种量和菌泥与冻干保护剂比例是关键因素。
2.3 响应面试验结果与分析
以活菌数(Y)作为响应值,以发酵温度(A)、发酵时间(B)、接种量(C)、菌泥与冻干保护剂比例(D)为自变量,采用Box-Behnken软件设计响应面试验,试验设计及结果见表5,方差分析见表6。
表5 冻干粉制备工艺优化Box-Behnken试验设计及结果
Table 5 Design and results of Box-Behnken tests for preparation process optimization of freeze-dried powder
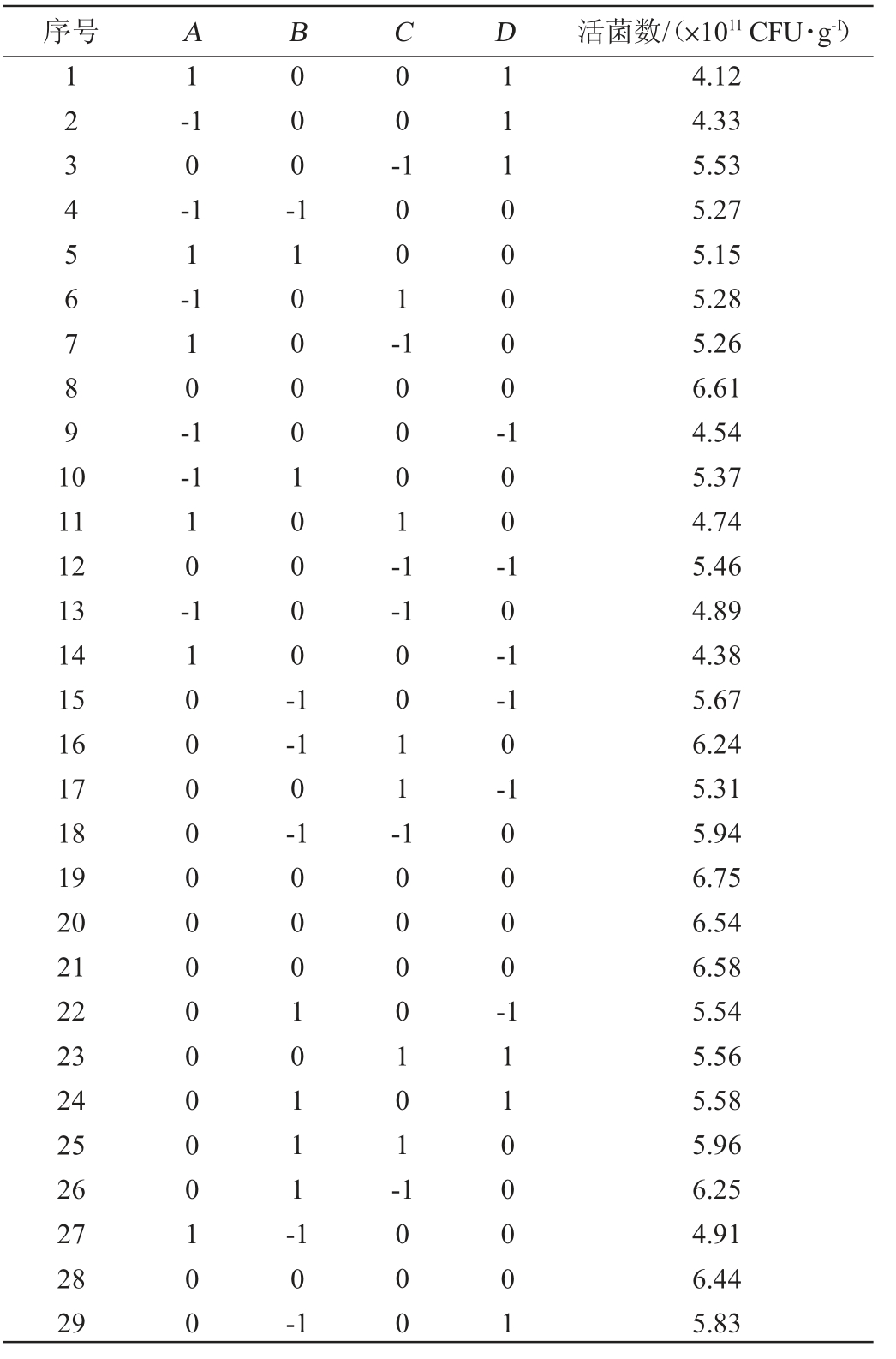
序号 A B C D 活菌数/(×1011 CFU·g-1)1234567891 0 1-1 0-1 1-1 000-00-10-1 1001-11100000--1 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 10-10001-1 100-11000000000000100 11000010000-1-1 10-1-1 0-1 0011--1 0-1 00010111-10000101-0000-10-1 1000 11100001 4.12 4.33 5.53 5.27 5.15 5.28 5.26 6.61 4.54 5.37 4.74 5.46 4.89 4.38 5.67 6.24 5.31 5.94 6.75 6.54 6.58 5.54 5.56 5.58 5.96 6.25 4.91 6.44 5.83
表6 回归模型方差分析
Table 6 Variance analysis of regression model
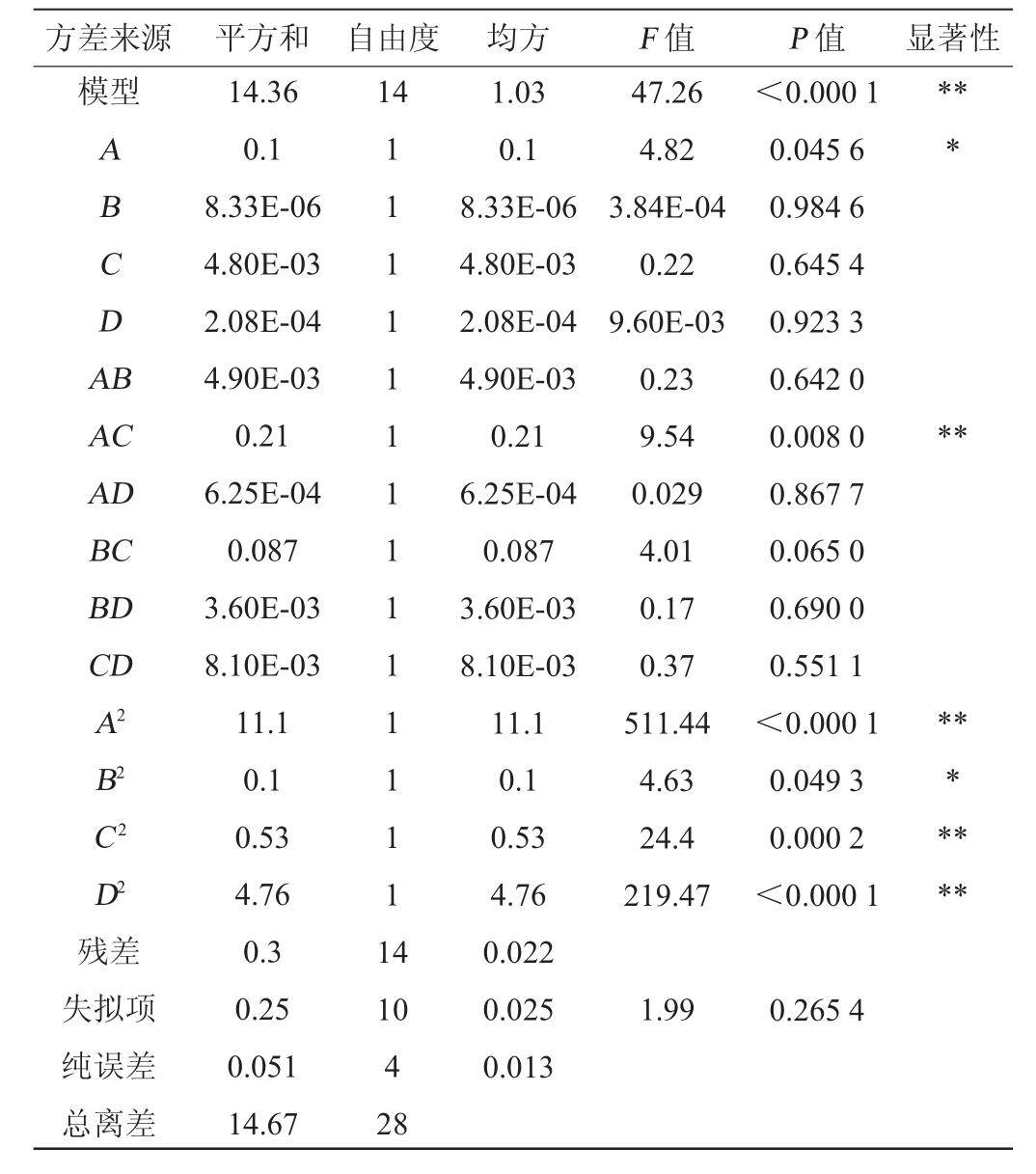
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B***AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差总离差14.36 0.1 8.33E-06 4.80E-03 2.08E-04 4.90E-03 0.21 6.25E-04 0.087 3.60E-03 8.10E-03 11.1 0.1 0.53 4.76 0.3 0.25 0.051 14.67 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 47.26 4.82 3.84E-04 0.22 9.60E-03 0.23 9.54 0.029 4.01 0.17 0.37 511.44 4.63 24.4 219.47<0.000 1 0.045 6 0.984 6 0.645 4 0.923 3 0.642 0 0.008 0 0.867 7 0.065 0 0.690 0 0.551 1<0.000 1 0.049 3 0.000 2<0.000 1*********10 4 28 1.03 0.1 8.33E-06 4.80E-03 2.08E-04 4.90E-03 0.21 6.25E-04 0.087 3.60E-03 8.10E-03 11.1 0.1 0.53 4.76 0.022 0.025 0.013 1.99 0.265 4
采用Design-Expert V 8.0.6软件对表3的试验结果进行多元二次回归拟合分析,得到回归方程:
Y=6.58-0.093A-(8.333E+004)B-0.020C+(4.167E-003)D+0.035AB-0.23AC-0.012AD-0.15BC-0.030BD+0.045CD-1.31A2-0.12B2-0.29C2-0.86D2。
由表6可知,模型极显著(P值<0.01),失拟项不显著(P值=0.265 4>0.05),说明回归模型拟合良好,选择合理。模型决定系数R2为0.979 3,调整决定系数R2adj为0.958 6,表明该模型能够解释95.86%的响应值变化。由P值可知,交互项AC,二次项A2、C2、D2对结果影响极显著(P<0.01),一次项A、二次项B2对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。由F值可知,影响活菌数的因素次序为发酵温度(A)>接种量(C)>菌泥与冻干保护剂比例(D)>发酵时间(B)。
根据响应面及等高线判断两个因素间交互作用对结果的影响,响应面越陡峭,等高线越趋于椭圆形,则表示两个因素之间的互作对结果影响越明显,即对响应值的影响越大[20]。发酵温度及接种量间交互作用对活菌数影响的响应曲面及等高线见图2。由图2可知,其响应曲面陡峭,等高线趋于椭圆形,说明其交互作用对活菌数影响极显著,这与方差分析结果一致。
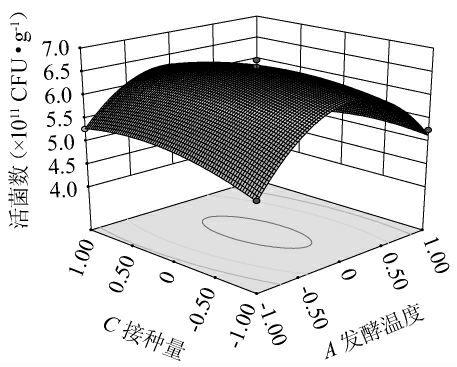
图2 发酵温度及接种量间交互作用对活菌数影响的响应曲面及等高线
Fig.2 Response surface plot and contour lines of effect of interaction between fermentation temperature and inoculum on the viable bacterial count
2.4 模型验证
采用Design Expert V8.0.6软件分析预测,最优冻干粉制备工艺条件为:发酵温度36.97 ℃,发酵时间为15 h,接种量为4.98%,菌泥与冻干保护剂=1∶3(kg∶L)。在此优化条件下,活菌数预测值为6.59×1011 CFU/g。为方便实际操作,将制备工艺条件修正为:发酵温度37 ℃,发酵时间15 h,接种量5%,菌泥与冻干保护剂比例1∶3(kg∶L),在此条件下进行3次平行验证试验,活菌数实际值为6.40×1011 CFU/g,与预测值接近,表明该模型可靠。
2.5 最大耐受浓度(MTC)及抗过敏功效实验结果
发酵粘液乳杆菌HCS08-005冻干粉抗过敏功效及最大耐受浓度(MTC)实验结果见表7。
表7 发酵粘液乳杆菌HCS08-005冻干粉最大耐受浓度及抗过敏功效
Table 7 Maximum tolerable concentration and anti-allergic effect of Limosilactobacillus fermentum HCS08-005 freeze-dried powder

注:“**”表示与模型对照组比较,差异极显著(P<0.01)。
组别 质量浓度/(μg·mL-1) 益生菌数/(CFU·mL-1) 死亡数/尾 死亡率/% 表型 OD405 nm值正常对照组模型对照组阳性对照组—— -发酵粘液乳杆菌HCS08-005冻干粉组1 000 31.2 62.5 125 250 500 1 000 2 000 3.12×106 6.25×106 1.25×107 2.50×107 5.00×107 1.00×108 2.00×108 0 0 0 0 0 0 0 0 0 0 0 0 00 0 0 0 0 0 0未见明显异常未见明显异常未见明显异常与模型对照组状态相似与模型对照组状态相似与模型对照组状态相似与模型对照组状态相似与模型对照组状态相似较模型对照组状态严重较模型对照组状态严重0.209±0.001**0.824±0.006 0.191±0.005**0.489±0.006**0.364±0.005**0.290±0.003**0.344±0.004**0.476±0.012**--
由表7可知,正常对照组和模型对照组斑马鱼表型未见明显异常,质量浓度31.2 μg/mL、62.5 μg/mL、125 μg/mL、250 μg/mL、500 μg/mL的发酵粘液乳杆菌HCS08-005冻干粉组与模型对照组相比,斑马鱼体态和运动能力相似,质量浓度1 000 μg/mL、2 000 μg/mL的发酵粘液乳杆菌HCS08-005冻干粉组与模型对照组相比,斑马鱼出现体态消瘦、运动能力下降、侧翻等状态。因此,斑马鱼对发酵粘液乳杆菌HCS08-005冻干粉MTC为500 μg/mL。
过敏反应是一种严重的急性多系统反应,其产生原因是肥大细胞的脱颗粒[21-22]。在众多颗粒中,类胰蛋白酶被认为是判定肥大细胞活化水平最有价值的生物标志物[23]。由表7可知,模型对照组OD405nm值为0.824,正常对照组OD405 nm值为0.209,表明与模型对照组比较,正常对照组OD405 nm值极显著降低(P<0.01),表明斑马鱼过敏模型建立成功。阳性对照组OD405 nm值为0.191,与模型对照组比较,类胰蛋白酶表达水平极显著降低(P<0.01)。不同质量浓度的发酵粘液乳杆菌HCS08-005冻干粉组与模型对照组比较,类胰蛋白酶表达水平极显著降低(P<0.01),其中,质量浓度125 μg/mL的发酵粘液乳杆菌HCS08-005冻干粉组OD405 nm值为0.290,其抗过敏效果最好。
乳酸菌暴露产生的信号可能有助于防止生命早期的过敏反应[24]。发酵粘液乳杆菌HCS08-005冻干粉28 ℃处理24 h就能将斑马鱼的类胰蛋白酶水平降低至正常水平。推测菌剂能够瞬时进入斑马鱼肠道内定植,通过诱导全身粘膜免疫反应来增强宿主防御系统,从而减轻过敏反应[22]。陈涛等[25]研究发现,发酵乳杆菌E1在体内能显著抑制化合物48/80刺激斑马鱼分泌类胰蛋白酶,抑制率为80.03%,这与本实验结果相似。
3 结论
发酵粘液乳杆菌HCS08-005冻干粉的最佳制备工艺条件为:发酵温度37 ℃,发酵时间15 h,接种量5%,菌泥与冻干保护剂比例为1∶3(kg∶L)。在此优化条件下,活菌数为6.40×1011 CFU/g。斑马鱼试验结果表明,斑马鱼对发酵粘液乳杆菌HCS08-005冻干粉的MTC为500 μg/mL。不同质量浓度发酵粘液乳杆菌HCS08-005冻干粉均能极显著降低类胰蛋白酶表达水平(P<0.01)。结果表明,发酵粘液乳杆菌HCS08-005冻干粉具有抗过敏功效。
[1]LAHA A, MOITRA S, PODDER S.A review on aero-allergen induced allergy in India[J].Clin Exp Allergy,2023,53(7):711-738.
[2]周晓鹰,唐颖娟,魏涛,等.环境因素和过敏性疾病[J].常州大学学报(自然科学版),2019,31(4):76-85.
[3]TURNER P,CAMPBELL D E,MOTOSUE M S,et al.Global trends in anaphylaxis epidemiology and clinical implications[J].J Aller Cl Imm Pract,2020,8(4):1169-1176.
[4]江苏省药品不良反应监测中心.美国FDA对抗哮喘、抗过敏药孟鲁司特(Singulair)的严重精神健康副作用发出警告;建议限制过敏性鼻炎的使用[J].药学与临床研究,2020,28(2):124.
[5]艾自琴.变应性鼻炎患者肠道菌群多样性研究[D].贵阳:贵州医科大学,2023.
[6]SHU S A,YUEN A W T,WOO E,et al.Microbiota and food allergy[J].Clin Rev Allerg Immu,2019,57(1):83-97.
[7]莫秀梅,刘俊峰,林颖,等.特应性皮炎中西医结合临床实践指南(草案)[J].中国中西医结合皮肤性病学杂志,2024,23(3):249-258.
[8]秦孟春,张玲芳,胡顺安,等.乳酸菌的抗食物过敏及免疫调节特性的研究进展[J].中国酿造,2024,43(6):14-20.
[9]韩雪冰,元香南,方俊,等.乳酸菌维持动物肠道健康的研究进展[J].中国科学:生命科学,2023,53(4):464-479.
[10]STEINER N C,LORENTZ A.Probiotic potential of Lactobacillus species in allergic rhinitis[J].Int Arch Allergy Imm,2021,182(9):807-818.
[11]刘燕,周杏荣,刘洋,等.鼠李糖乳杆菌LZ260E体内抗过敏活性研究[C]//中国食品科学技术学会.中国食品科学技术学会第二十届年会论文摘要集:2023年卷.长沙:中国食品科学技术学会,2023:2.
[12]赵林森,齐世华,崔文静,等.一株具有免疫调节及抗过敏功能的嗜酸乳杆菌La28及其应用:CN201610381849.7[P].2016-10-12.
[13]KULLAR R, GOLDSTEIN E J C, JOHNSON S, et al. Lactobacillus bacteremia and probiotics:A review[J].Microorganisms,2023,11(4):896.
[14]张乐.产细菌素乳酸菌的筛选及其益生性能评价[D].无锡:江南大学,2023.
[15]CHEN H,CHEN S,LI C,et al.Response surface optimization of lyoprotectant for Lactobacillus bulgaricus during vacuum freeze-drying[J].Prep Biochem Biotech,2015,45(5):463-475.
[16]苗维娜,赵亮.冷冻干燥影响乳酸菌发酵活力机制的研究进展[J].食品工业科技,2022,43(21):36-44.
[17]汪海涛,宋佳,余萍,等.植物乳植杆菌HCS03-001冻干粉制备工艺优化及抗幽门螺杆菌的功效[J].生物技术进展,2024,14(2):287-294.
[18]潘子怡,陈则华,毛丙永,等.青春双歧杆菌冻干保护剂筛选及高密度冻干工艺优化[J].食品与生物技术学报,2024,43(2):23-29.
[19]余萍.鼠李糖乳酪杆菌RH0121冻干工艺优化及降血糖作用的研究[J].中国微生态学杂志,2023,35(6):681-688.
[20]GRYGORCEWICZ B,GLIZ′NIEWICZ M,OLSZEWSKA P,et al.Response surface methodology application for bacteriophage-antibiotic antibiofilm activity optimization[J].Microorganisms,2023,11(9):2352.
[21]VARRICCHI G, ROSSI F W, GALDIERO M R, et al.Physiological roles of mast cells:Collegium internationale allergologicum update 2019[J].Int Arch Allergy Imm,2019,179(4):247-261.
[22]TSAI Y T,CHENG P C,PAN T M.The immunomodulatory effects of lactic acid bacteria for improving immune functions and benefits[J].Appl Microbiol Biot,2012,96(4):853-862.
[23]韩煦.类胰蛋白酶在包虫致过敏反应中对心肌细胞损伤作用的研究[D].乌鲁木齐:新疆医科大学,2020.
[24]李永玲,贾鲲鹏.益生菌在儿科过敏反应或哮喘疾病中应用研究进展[J].医药卫生,2022(4):58-63.
[25]陈涛,郑康帝,陈丹,等.发酵乳杆菌E1在制备治疗或预防过敏性疾病药物中的应用:CN202310180248.X[P].2023-05-05.