枸杞(Lycium chinense Mill.)为茄科枸杞属落叶灌木[1],因为其丰富的营养成分,通常被用来制作枸杞酒和枸杞醋等产品。果皮微生物资源丰富,对于果酒和果醋的品质有一定的影响[2]。表皮微生物会受到叶际微生物的影响,同时叶片是植物进行光合作用的重要器官,为植物提供养分和能量[3],微生物群落利用叶片中碳水化合物、有机酸、糖醇等营养物质进行定殖[4]。变形菌门(Pseudomonadota)、拟杆菌门(Bacteroidota)和芽孢杆菌门(Bacillota)等为常见的叶际细菌类群,假单胞菌属(Pseudomonas)、伊文氏杆菌属(Erwinia)、芽孢杆菌属(Bacillus)等为常见的叶际细菌属[5]。子囊菌门(Ascomycota)和担子菌门(Basidiomycota)等为常见的叶际真菌优势类群[6],枝孢属(Cladosporium)、链格孢属(Alternaria)和青霉属(Penicillium)等为常见的叶际真菌属[7]。同一种植物的叶际微生物群落结构具有一定的相似性,而不同种类植物的叶际微生物群落结构存在一定差异[8]。果皮微生物与叶际微生物之间关联密切[9],魏玉洁等[10]研究发现,新疆酿酒葡萄产区3个葡萄园的土壤、葡萄叶片和酿酒葡萄中的细菌和真菌群落组成中,葡萄叶片和葡萄果实中的细菌和真菌群落组成相似性较高,而土壤与叶片、葡萄样品的微生物群落组成相似性较低。因此,研究叶际微生物的群落组成也显得尤为重要。
高通量测序技术是现阶段解析微生物多样性常用的检测技术之一。HUANG T等[11]采用高通量测序技术分析了8个枸杞品种贮藏前后表皮细菌群落组成特征,发现贮藏144 h后,枸杞表皮的优势属由马赛菌属和假单胞菌属演变为泛菌属。LI Y等[12]运用高通量测序技术分析了宁夏、青海和新疆三地枸杞根际土壤真菌群落结构,发现子囊菌门和毛霉菌门是优势门。康娥儿[13]分析了宁夏主栽枸杞根际土壤微生物群落,发现细菌群落属水平中,未鉴别和身份不明菌属为主要菌属,说明细菌群落在属水平上还有绝大部分新的物种待研究。
本研究利用高通量测序技术对西藏林芝地区苦味红枸杞果实表皮(LH)、苦味红枸杞叶际(LHF)和日喀则地区红枸杞果实表皮(ZH)、红枸杞叶际(ZHF)微生物群落多样性进行分析,并对西藏不同地区枸杞果实表皮和叶际优势细菌属、优势真菌属之间以及枸杞果实表皮优势细菌属与优势真菌属之间的相关性进行分析,以期为西藏本土枸杞果实表皮和叶际微生物资源的开发和利用提供参考,并且为藏产枸杞表皮有益微生物的分离与应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品的采集与处理
2023年9月从西藏日喀则市白朗县(纬度29°13'33.68″N,经度89°09'27.33″E)和林芝市巴宜区(纬度29°40'14.05″N,经度94°20'19.47″E)采集日喀则红枸杞以及林芝苦味红枸杞两个品种的果实及叶片样品,分别编号为林芝苦味红枸杞果实表皮(LH)、林芝苦味红枸杞叶际(LHF)、日喀则红枸杞果实表皮(ZH)、日喀则红枸杞叶际(ZHF)。
1.1.2 化学试剂
Fast脱氧核糖核酸(deoxyribonucleic acid,DNA)Spin Kit试剂盒:美国MP Biomedicals公司;AxyPrep DNA凝胶回收试剂盒:美国Axygen公司;琼脂糖:美国Invitrogen公司。
1.2 仪器与设备
AL204电子天平:梅特勒-托利多仪器有限公司;5418R高速冷冻离心机:德国Eppendorf 公司;NanoDrop2000微量分光光度计:美国Thermo公司;Tocan 240凝胶成像系统:上海领成生物科技有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Biorad 公司;DYY-15D电泳仪:北京六一生物科技有限公司。
1.3 方法
1.3.1 样品采集
随机选取10株生长一致的枸杞树,用无菌剪刀分别采集每株枸杞树上的成熟果实及叶片,混合均匀后置于无菌袋中,每组3个重复,-20 ℃保存备用。
称取50 g枸杞果实或者枸杞叶片样品,加入200 mL 磷酸盐缓冲液(0.1 mol/L,pH7.0),200 r/min涡旋30 min,超声处理20 min,0.22 μm无菌滤膜过滤,取出滤膜并剪碎置于无菌离心管中,-80 ℃保存备用[14]。
1.3.2 高通量测序
采用FastDNA Spin Kit试剂盒提取样品中的总DNA,提取步骤根据试剂盒说明书进行,完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。以其为模板,采用特异引物799F(5'-AACMGGATTAGATACCCKG-3')和1193R(5'-ACGTCATCCCCACCTTCC-3')PCR扩增细菌16S rRNA基因V5-V7区序列。PCR扩增体系(20 μL):5×FastPfuBuffer 4 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(2.5 mmol/L)2 μL,引物799F(5 μmol/L)0.8 μL,引物1193R(5 μmol/L)0.8 μL,FastPfu Polymerase(5 U/μL)0.4 μL,牛血清白蛋白(bovine serum albumin,BSA)(20 mg/mL)0.2 μL,Template DNA(10 ng/μL)1 μL,补双蒸水(ddH2O)至20 μL;PCR扩增条件为95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,13个循环;72 ℃再延伸10 min。真菌ITS(Internal Transcribed Spacer)基因采用特异引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')进行PCR扩增,PCR扩增体系共35个循环,其他条件与细菌一致。随后将经琼脂糖凝胶电泳检测得到的PCR产物,送至上海美吉生物医药科技有限公司于MiSeq PE300 测序仪(Illumina公司)进行高通量测序。
1.3.3 高通量测序数据分析
利用Qiime1.9.1对Illumina MiSeq测序所得的原始序列进行去噪、拼接和质控后,使用Uparse11(相似度97%)和Usearch11进行可操作分类单元(operational taxonomic unit,OTU)聚类和统计分析,用Greengenes 13.8数据库和UNITE 8.0数据库分别对细菌和真菌进行物种分类学注释,利用Qiime1.9.1分析平台、Mothur1.30.2和R语言3.3.1进行Alpha多样性、Beta多样性、物种组成分析,使用派森诺云平台进行关联热图的绘制。
2 结果与分析
2.1 高通量测序结果分析
西藏不同地区枸杞果实表皮和叶际样品微生物稀释曲线和属水平韦恩图,结果见图1。由图1A和图1B可知,随着测序深度的增加,所有样品的稀释曲线都趋于平缓,表明测序量可以很好地反映样品中的微生物群落结构和多样性[15-16]。由图1C可知,细菌群落组成在属水平上,四个样品共有31个细菌属,两种枸杞果实表皮共有2个细菌属,两个地区枸杞叶际共有28个细菌属,林芝枸杞果实表皮与其叶际共有10个细菌属,日喀则枸杞果实表皮与其叶际共有20个细菌属,林芝枸杞果实表皮特有10个细菌属,叶际特有40个细菌属,日喀则枸杞果实表皮特有24个细菌属,叶际特有83个细菌属。由图1D可知,真菌群落组成在属水平上,四个样品共有28个真菌属,两个枸杞果实表皮的共有4个真菌属,林芝枸杞果实表皮有97个真菌属,日喀则枸杞果实表皮特有29个真菌属;两产地枸杞叶际共有5个真菌属,林芝枸杞叶际中有49个真菌属,日喀则枸杞叶际中有75个真菌属;林芝枸杞果实表皮与叶际共有真菌属为81个,日喀则枸杞果实表皮与叶际共有真菌属为32个。结果表明,不同产地枸杞果实表皮与叶际微生物群落结构存在一定的异同。
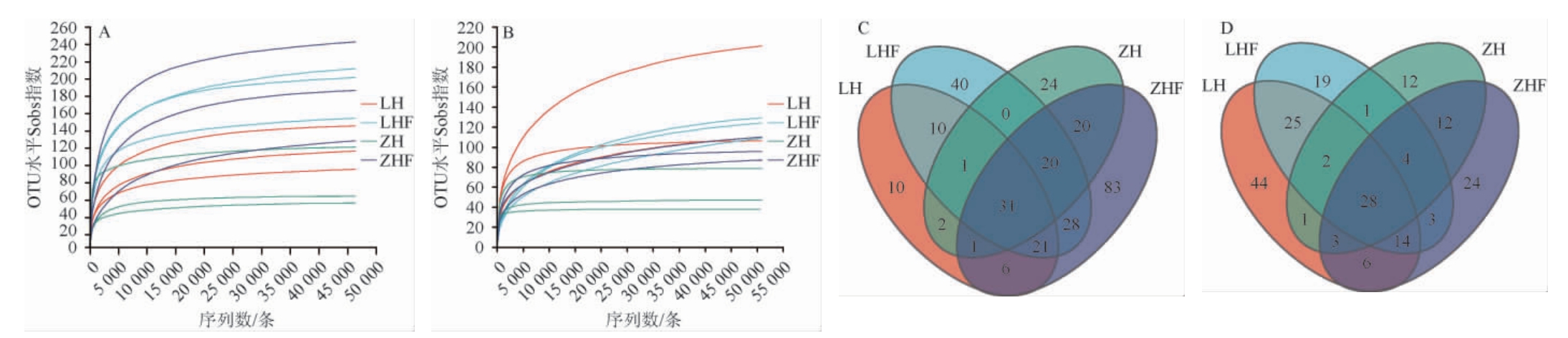
图1 西藏不同地区枸杞果实表皮和叶际样品微生物稀释曲线(A,B)和属水平韦恩图(C,D)
Fig.1 Dilution curves (A, B) and Venn diagrams at the genus level (C, D) of microorganisms in fruit epidermis and phyllosphere samples of Lycium chinense from different regions of Tibet
A:细菌稀释曲线;B:真菌稀释曲线;C:细菌属水平韦恩图;D:真菌属水平韦恩图。
2.2 微生物序列及多样性分析
由表1可知,林芝红枸杞、林芝红枸杞叶际、日喀则红枸杞和日喀则红枸杞叶际样品中分别获得163个、303个、157个和344个细菌OTUs以及246个、187个、107个和174个真菌OTUs。Shannon和Simpson指数可用来评估微生物群落的多样性水平,而Chao1指数和Ace指数则可反映微生物群落的物种丰富度[17-18]。当Chao1、Ace和Shannon指数越大,Simpson指数越小,表明样品的物种多样性和丰富度越高。由表1亦可知,根据叶际样品中细菌的Ace、Chao1和Shannon指数均高于枸杞果实表皮样品,且Simpson指数均低于枸杞果实表皮样品,表明叶际样品的细菌多样性和丰富度均高于枸杞果实表皮样品;叶际样品的细菌多样性和丰富度均高于真菌;林芝红枸杞表皮真菌多样性和丰富度高于细菌;日喀则红枸杞表皮细菌丰富度高于真菌,而多样性低于真菌。结果表明,不同种源地枸杞表皮与叶际微生物多样性差异明显。
表1 西藏不同地区枸杞果实表皮及叶际样品微生物群落多样性分析
Table 1 Diversity analysis of microbial communities of fruit epidermis and phyllosphere samples of Lycium chinense from different regions of Tibet
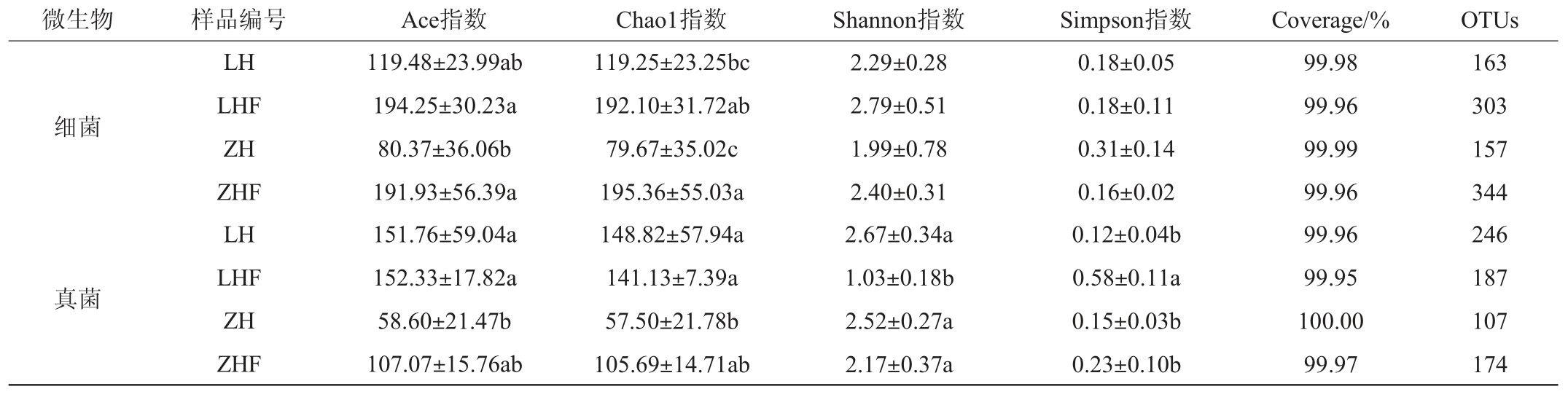
微生物 样品编号 Ace指数 Chao1指数 Shannon指数 Simpson指数 Coverage/% OTUs细菌真菌LH LHF ZH ZHF LH LHF ZH ZHF 119.48±23.99ab 194.25±30.23a 80.37±36.06b 191.93±56.39a 151.76±59.04a 152.33±17.82a 58.60±21.47b 107.07±15.76ab 119.25±23.25bc 192.10±31.72ab 79.67±35.02c 195.36±55.03a 148.82±57.94a 141.13±7.39a 57.50±21.78b 105.69±14.71ab 2.29±0.28 2.79±0.51 1.99±0.78 2.40±0.31 2.67±0.34a 1.03±0.18b 2.52±0.27a 2.17±0.37a 0.18±0.05 0.18±0.11 0.31±0.14 0.16±0.02 0.12±0.04b 0.58±0.11a 0.15±0.03b 0.23±0.10b 99.98 99.96 99.99 99.96 99.96 99.95 100.00 99.97 163 303 157 344 246 187 107 174
2.3 微生物群落结构分析
西藏不同地区枸杞果实表皮及叶际样品门水平细菌和真菌相对丰度见图2。
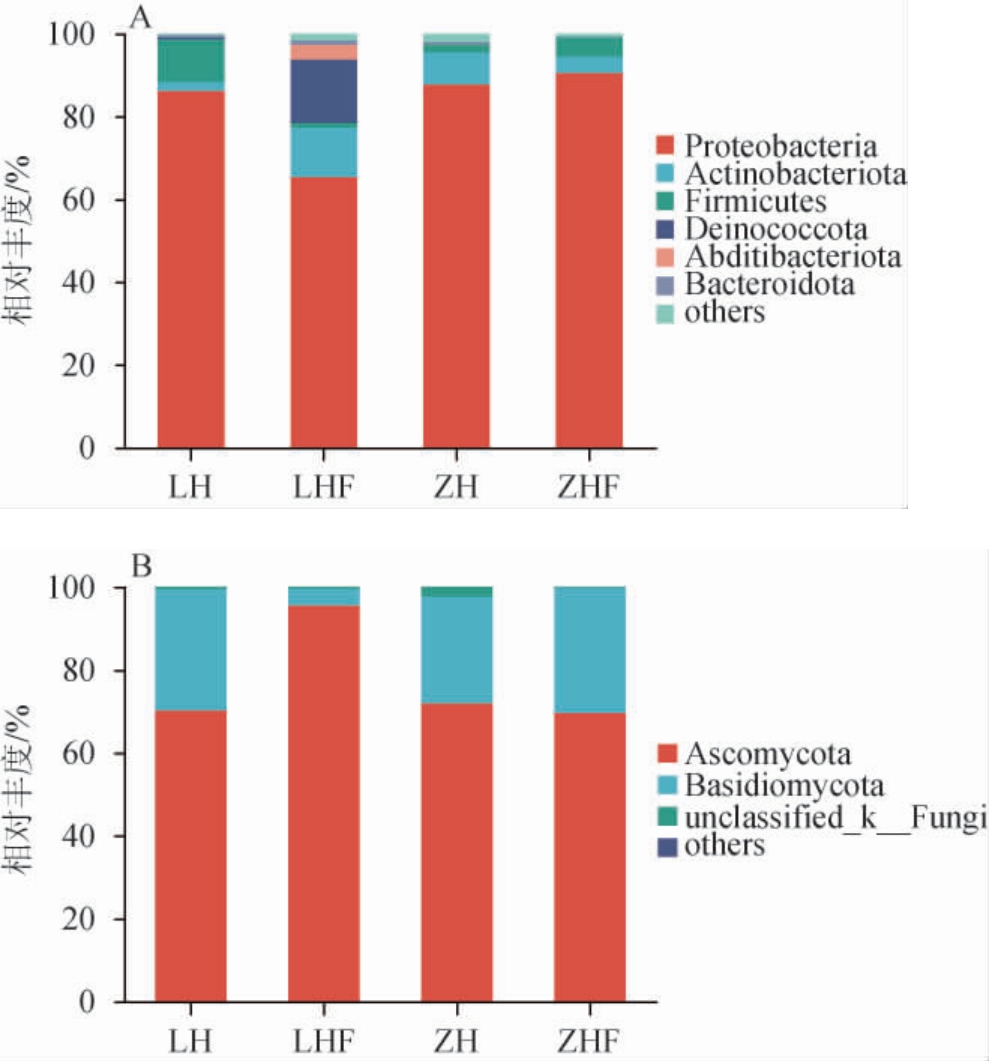
图2 西藏不同地区枸杞果实表皮及叶际样品基于门水平细菌(A)和真菌(B)相对丰度
Fig.2 Relative abundance of bacteria (A) and fungi (B) of fruit epidermis and phyllosphere samples of Lycium chinense from different regions of Tibet at phylum level
由图2A可知,在相对丰度>1.00%条件下,变形菌门(Proteobacteria)为四个样品的优势细菌门,其相对丰度为65.4%~90.6%,栖热菌门(Deinococcota)(15.3%)和隐杆菌门(Abditibacteriota)(3.6%)为林芝枸杞叶际的特有优势细菌门,在果实表皮中也少量存在(相对丰度<0.4%)。由图2B可知,在相对丰度>1.00%条件下,子囊菌门(Ascomycota)(69.7%~95.6%)为四个样品中的优势真菌门(相对丰度>1.00%),其次为担子菌门(Basidiomycota)(4.1%~30.2%)。
西藏不同地区枸杞果实表皮及叶际样品属水平细菌和真菌相对丰度见图3。由图3可知,在属分类水平上,样品中细菌隶属393属,样品中真菌隶属276属。由图3A可知,在相对丰度>2%的条件下,林芝枸杞果实表皮中,马赛菌属(Massilia)(35.1%)为优势细菌属,其次为泛菌属(Pantoea)(21.4%)、假单胞菌属(Pseudomonas)(10.9%)和类芽孢杆菌属(Paenibacillus)(9.7%)。unclassified_f__Alcaligenaceae(28.6%)为林芝枸杞叶际优势细菌属,其次为奇异球菌属(Deinococcus)(15.3%),奇异球菌属(Deinococcus)、类芽孢杆菌属(Paenibacillus)、寒冷杆菌属(Frigoribacterium)和(Abditibacterium)为林芝枸杞果实和叶际的特有细菌属。在日喀则枸杞果实表皮中,unclassified_f__Alcaligenaceae(49.6%)为优势细菌属,其次为unclassified_o__Enterobacterales(11.2%)、unclassified_p__Proteobacteria(7.6%)和泛菌属(Pantoea)(4.7%)。泛菌属(Pantoea)(45.4%)是日喀则枸杞叶际优势属,其次为unclassified_o__Enterobacterales(12.7%)、unclassified_f__Alcaligenaceae(12.5%)和假单胞菌属(Pseudomonas)(10.3%)。葡萄球菌属(Staphylococcus)和短波单胞菌属(Brevundimonas)为日喀则枸杞果实和叶际特有细菌属,欧文氏杆菌属(Erwinia)和unclassified_f__Erwiniaceae为日喀则枸杞果实表皮特有细菌属,说明不同枸杞果实果皮和叶际细菌群落组成存在差异。
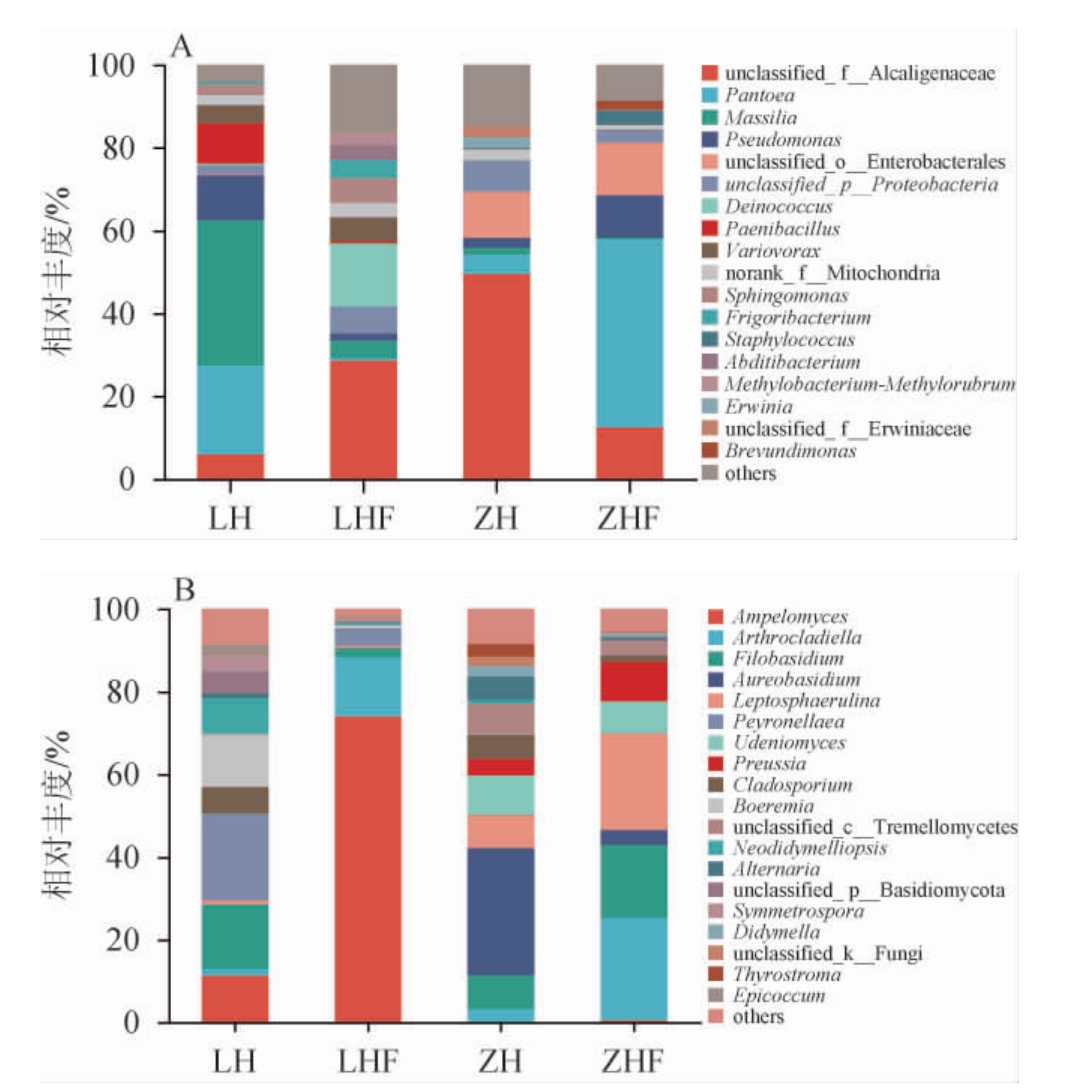
图3 西藏不同地区枸杞果实表皮及叶际样品基于属水平细菌(A)和真菌(B)相对丰度
Fig.3 Relative abundance of bacteria (A) and fungi (B) of fruit epidermis and phyllosphere samples of Lycium chinense from different regions of Tibet at genus level
由图3B可知,在相对丰度>2%的条件下,林芝枸杞表皮的优势真菌属为派伦霉属(Peyronellaea)(20.9%),其次相对丰度较高的真菌属还有线黑粉酵母属(Filobasidium)(15.6%)、Boeremia(12.7%)、白粉寄生孢属(Ampelomyces)(11.4%)和Neodidymelliopsis(8.6%)。派伦霉属(Peyronellaea)(73.9%)为林芝枸杞叶际真菌群落组成中优势真菌属,其次为节丝壳属(Arthrocladiella)(14.4%)。Symmetrospora和附球菌属(Epicoccum)为林芝枸杞果皮和叶际的特有真菌属,其相对丰度分别为3.6%、0.5%、2.2%和0.3%。日喀则枸杞表皮真菌群落组成中,短梗霉属(Aureobasidium)(30.8%)为优势菌真菌属,其次相对丰度较高的真菌属还有Udeniomyces(9.4%)、线黑粉酵母属(Filobasidium)(8.1%)、小光壳属(Leptosphaerulina)(8.0%)、unclassified_c__Tremellomycetes(7.2%)、枝孢属(Cladosporium)(5.8%)和链格孢属(Alternaria)(5.7%)。日喀则红枸杞叶际的优势真菌属为节丝壳属(Arthrocladiella)(24.8%)和小光壳属(Leptosphaerulina)(23.4%),其次相对丰度较高的真菌属还有线黑粉酵母属(Filobasidium)(17.7%)、光黑壳属(Preussia)(9.7%)和Udeniomyces(7.7%)。短梗霉属(Aureobasidium)、光黑壳属(Preussia)和Thyrostroma为日喀则枸杞果实表皮和叶际特有的真菌属,其相对丰度分别为30.8%、3.6%、4.2%、9.7%、3.1%和0.04%。枝孢属广泛存在于土壤和植物体内,能合成多种类型的化合物,如生物碱、醌类、萜类和醌类等[19]。日喀则枸杞表皮含有较为丰富的枝孢属,说明日喀则枸杞果实表皮可能存在具有生物活性功能的益生微生物[14]。
结果表明,不同地区枸杞表皮与叶际中各自有其特有的菌属,且优势微生物菌群及其相对丰度存在明显差异。
2.4 微生物Beta多样性分析
为了分析西藏不同地区枸杞表皮与叶际微生物群落结构组成差异,在OTU水平上对其进行细菌和真菌群落主成分分析(principal component analysis,PCA),结果见图4。
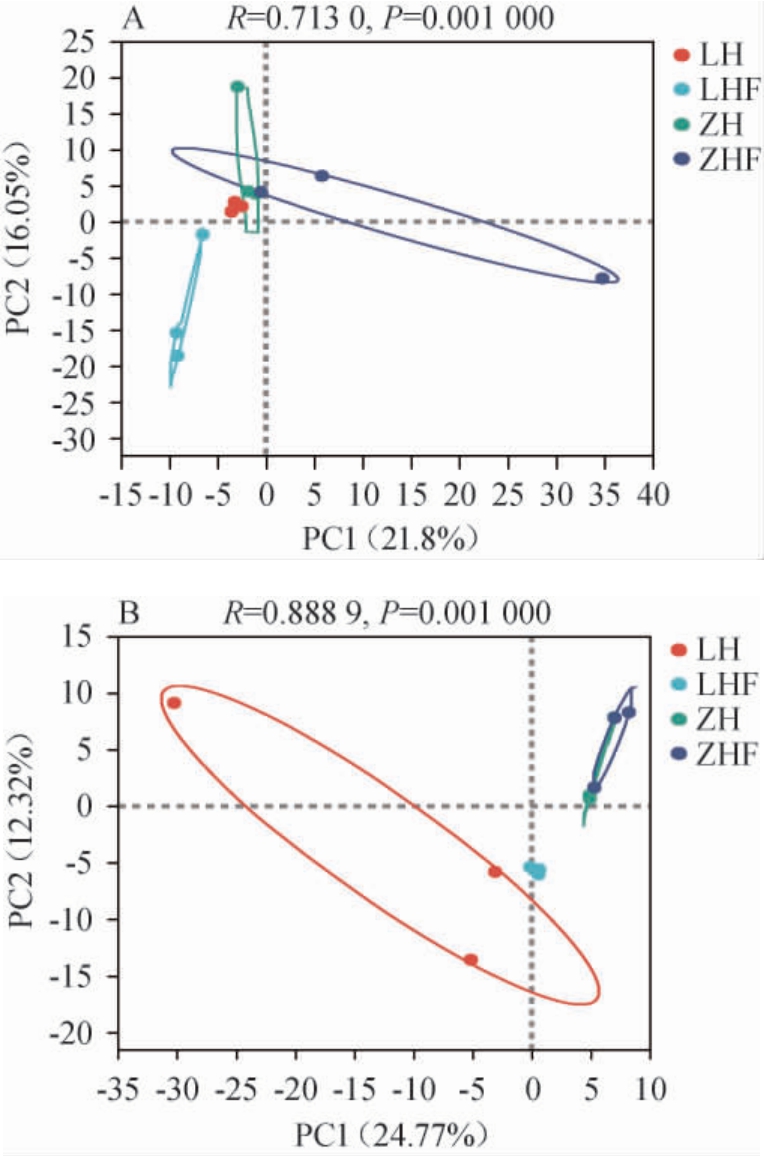
图4 基于细菌(A)和真菌(B)OTU水平西藏不同地区枸杞表皮与叶际样品主成分分析
Fig.4 Principal component analysis of fruit epidermis and phyllospheric samples of Lycium chinense from different regions of Tibet based on bacteria (A) and fungi (B) OTU level
由图4A可知,在细菌群落中,PC1和PC2对结果的解释度分别为21.8%和16.05%,LH、ZH和ZHF位于同一象限,说明这3个样品的细菌群落结构组成较为相似,但ZHF组内样品点距离较远,说明其细菌群落组成相似度不高。由图4B可知,在真菌群落中,PC1和PC2对结果的解释度分别为24.77%和12.32%,ZH和ZHF有重叠,表明两个样品的大部分真菌群落在OTU水平上相同,LH和LHF各为一类,且LH组内样品点距离较远,表明其真菌群落组成的相似度较低。
2.5 优势菌属的相关性分析
2.5.1 枸杞果实表皮和叶际样品中优势细菌属的相关性分析
在相对丰度>2%条件下,对枸杞表皮和叶际样品中的细菌属进行关联性分析(不包括未注释到明确分类地位的细菌属),结果见图5。
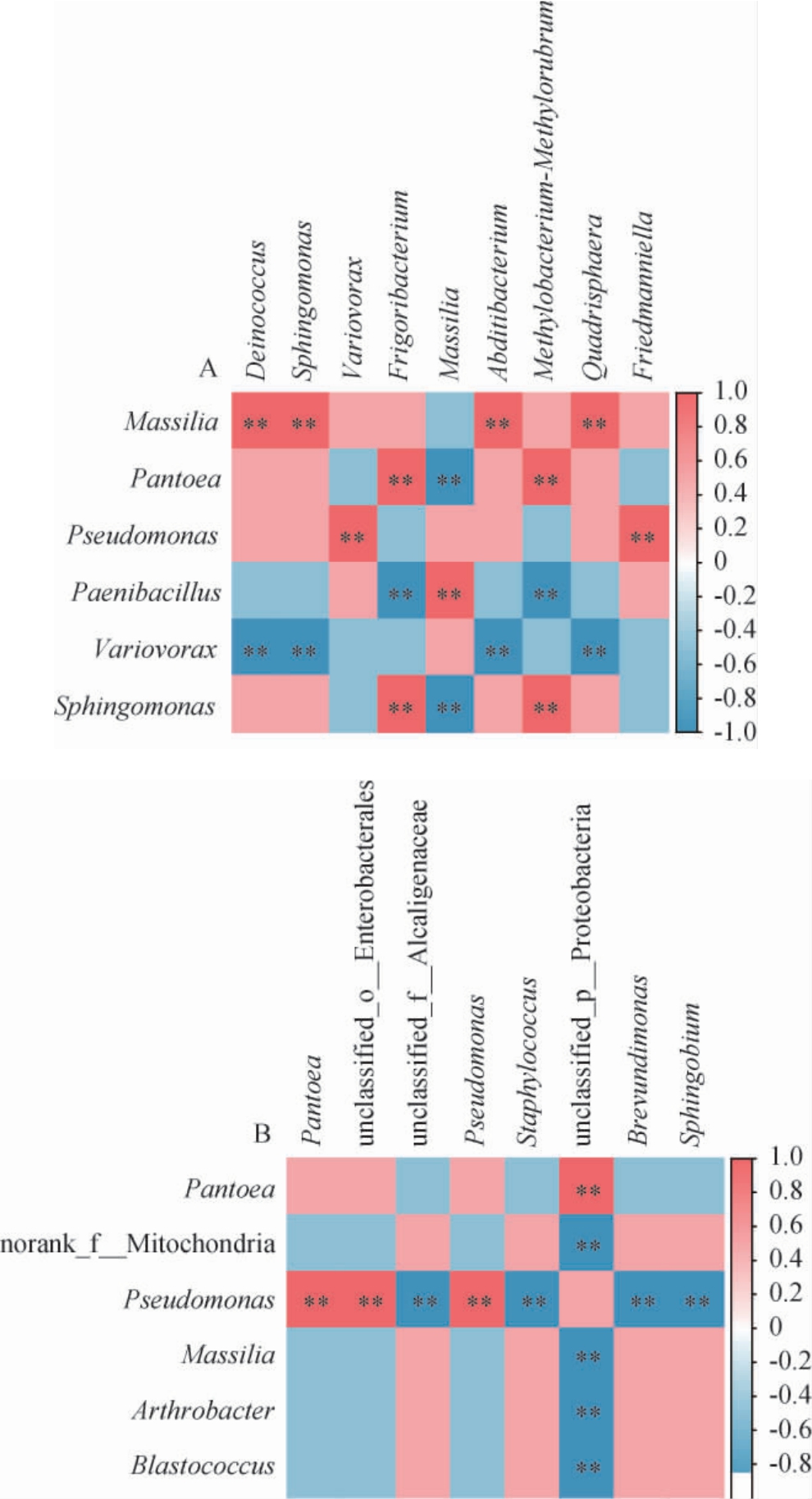
图5 西藏林芝(LH,LHF)(A)及日喀则(ZH,ZHF)(B)地区枸杞果实表皮和叶际样品中优势细菌属的相关性分析
Fig.5 Correlation analysis of dominant bacterial genera of fruit epidermis and phyllosphere samples of Lycium chinense from Nyingchi(LH, LHF) (A) and Shigatse (ZH, ZHF) (B) regions of Tibet
“**”表示相关性极显著(P<0.01)。下同。
由图5A可知,LH样品中的马赛菌属(Massilia)和LHF样品中的奇异球菌属(Deinococcus)、鞘氨醇单胞菌属(Sphingomonas)、Abditibacterium 和Quadrisphaera呈极显著正相关(P<0.01),而LH样品中的贪噬菌属(Variovorax)与LHF样品中的这些菌属呈极显著负相关(P<0.01)。LH样品中的泛菌属(Pantoea)和鞘氨醇单胞菌属(Sphingomonas)与LHF样品中的寒冷杆菌属(Frigoribacterium)和Methylobacterium-Methylorubrum呈极显著正相关(P<0.01),与马赛菌属(Massilia)呈极显著负相关(P<0.01),而类芽孢杆菌属(Paenibacillus)与之相反。LH样品中的假单胞菌属(Pseudomonas)与LHF样品中的贪噬菌属(Variovorax)和弗莱德门菌属(Friedmanniella)呈极显著正相关(P<0.01)。由图5B可知,ZH样品中的假单胞菌属(Pseudomonas)与ZHF样品中的泛菌属(Pantoea)、unclassified_o__Enterobacterales和假单胞菌属(Pseudomonas)呈极显著正相关(P<0.01),与unclassified_f__Alcaligenaceae、葡萄球菌属(Staphylococcus)、短波单胞菌属(Brevundimonas)和鞘脂菌属(Sphingobium)呈极显著负相关(P<0.01)。ZH样品中的norank_f__Mitochondria、马赛菌属(Massilia)、节杆菌属(Arthrobacter)和芽球菌属(Blastococcus)与ZHF样品中的unclassified_p__Proteobacteria呈极显著负相关(P<0.01),而ZH样品中的泛菌属(Pantoea)与ZHF样品中的unclassified_p__Proteobacteria呈极显著正相关(P<0.01)。由此可见,枸杞果实表皮优势细菌属与叶际优势细菌属相互影响。
2.5.2 枸杞表皮和叶际样品中优势真菌属的关联分析
在相对丰度>2.00%条件下,对枸杞表皮和叶际样品中的真菌属进行关联性分析(不包括未注释到明确分类地位的真菌属),结果见图6。

图6 西藏林芝(LH,LHF)(A)及日喀则(ZH,ZHF)(B)地区枸杞果实表皮和叶际样品中优势真菌属的相关性分析
Fig.6 Correlation analysis of dominant fungal genera of fruit epidermis and phyllosphere samples of Lycium chinense from Nyingchi(LH, LHF) (A) and Shigatse (ZH, ZHF) (B) regions of Tibet
由图6A可知,LH样品中的派伦霉属(Peyronellaea)和枝孢属(Cladosporium)与LHF样品中的白粉寄生孢属(Ampelomyces)呈极显著正相关(P<0.01),与节丝壳属(Arthrocladiella)呈极显著负相关(P<0.01);而LH样品中的白粉寄生孢属(Ampelomyces)、Symmetrospora和维希尼克氏酵母属(Vishniacozyma)与之相反。LH样品中的Neodidymelliopsis和附球菌属(Epicoccum)与LHF样品中的线黑粉酵母属(Filobasidium)呈极显著正相关(P<0.01);LH样品中的Boeremia与LHF样品中的派伦霉属(Peyronellaea)呈极显著正相关(P<0.01);LH样品中的线黑粉酵母属(Filobasidium)和链格孢属(Alternaria)分别和LHF样品中的派伦霉属(Peyronellaea)和线黑粉酵母属(Filobasidium)极显著负相关(P<0.01)。由图6B可知,ZH样品中的短梗霉属(Aureobasidium)和Udeniomyces与ZHF中的小米壳属(Leptosphaerulina)呈极显著正相关(P<0.01),与光黑壳属(Preussia)呈极显著负相关(P<0.01);而ZH样品中的小米壳属(Leptosphaerulina)、枝孢属(Cladosporium)、链格孢属(Alternaria)和节丝壳属(Arthrocladiella)与之相反。ZH样品中的线黑粉酵母属(Filobasidium)与ZHF样品中的枝孢属(Cladosporium)呈极显著正相关(P<0.01),与线黑粉酵母属(Filobasidium)和暗色球菌属(Phaeococcomyces)(酵母属)呈极显著负相关(P<0.01);而ZH样品中的光黑壳属(Preussia)与之相反。ZH样品中的Thyrostroma、亚隔孢壳属(Didymella)和Neodidymelliopsis与ZHF样品中的短梗霉属(Aureobasidium)呈极显著正相关(P<0.01),与节丝壳属(Arthrocladiella)呈极显著负相关(P<0.01)。由此可见,枸杞表皮真菌的分布及相对丰度与叶际真菌息息相关,相互影响。
2.5.3 枸杞果实表皮中优势细菌与优势真菌间的相关性分析
在相对丰度>2.00%条件下,对枸杞表皮中的细菌属与真菌属进行相关性分析(不包括未注释到明确分类地位的细菌属和真菌属),结果见图7。由图7A可知,LH样品真菌属中的派伦霉属(Peyronellaea)和枝孢属(Cladosporium)与细菌属的泛菌属(Pantoea)和鞘氨醇单胞菌属(Sphingomonas)呈极显著正相关(P<0.01),与类芽孢杆菌属(Paenibacillus)呈极显著负相关(P<0.01);而真菌属的白粉寄生孢属(Ampelomyces)、Symmetrospora和维希尼克氏酵母属(Vishniacozyma)与之相反。真菌属的Neodidymelliopsis和附球菌属(Epicoccum)与细菌属的贪噬菌属(Var iovorax)呈极显著正相关(P<0.01),与马赛菌属(Massilia)呈极显著负相关(P<0.01);而链格孢属(Alternaria)与之相反。真菌属的线黑粉酵母属(Filobasidium)和Boeremia分别与细菌属的假单胞菌属(Pseudomonas)呈极显著正相关(P<0.01)和呈极显著负相关(P<0.01)。
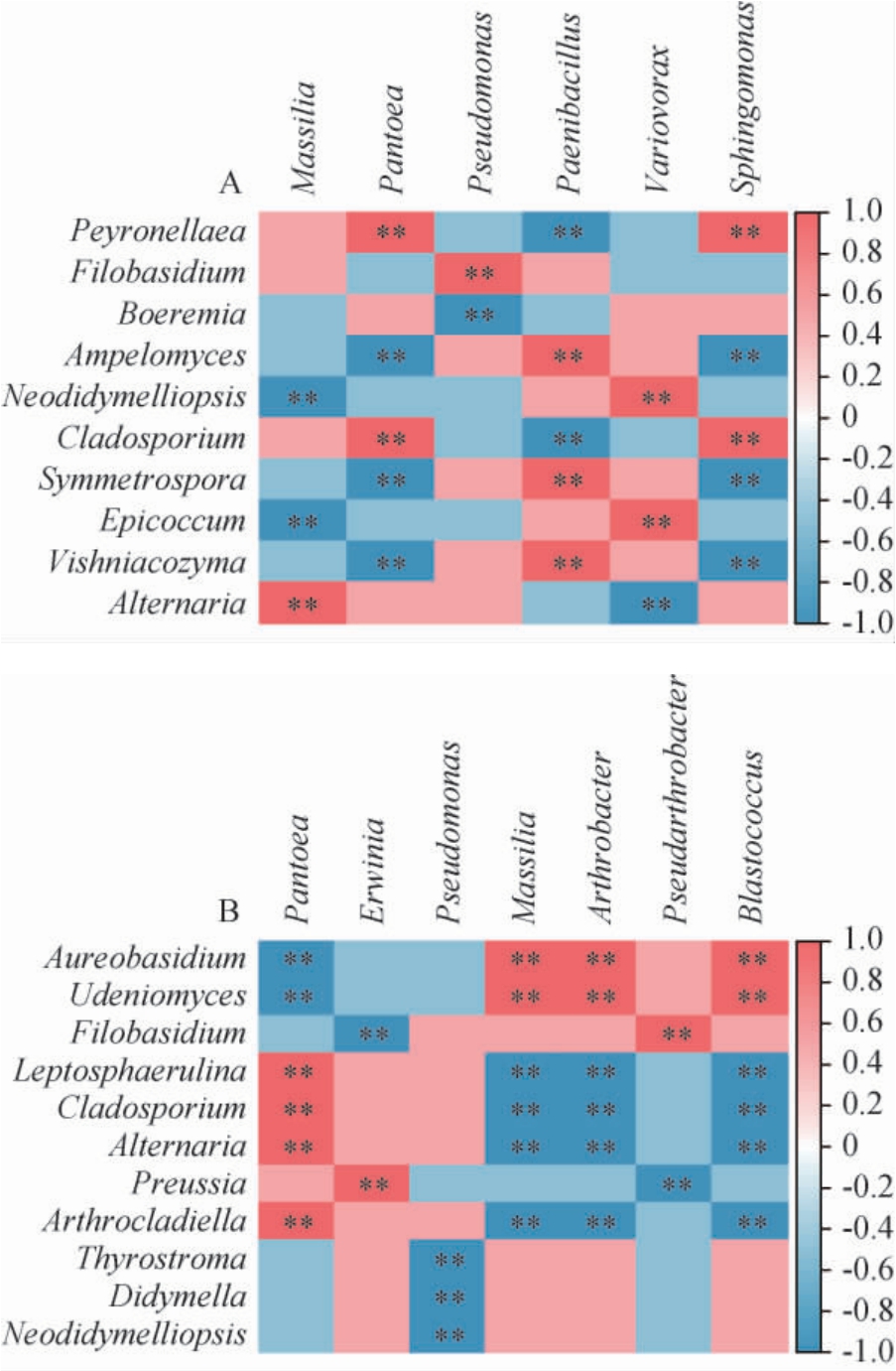
图7 西藏林芝(A)及日喀则(B)地区枸杞果实表皮样品中优势真菌属与细菌属的相关性分析
Fig.7 Correlation analysis of dominant fungal and bacterial genera of fruit epidermis samples of Lycium chinense from Nyingchi(A) and Shigatse (B) regions of Tibet
由图7B可知,ZH样品中真菌属的小米壳属(Leptosphaerulina)、枝孢属(Cladosporium)、链格孢属(Alternaria)和节丝壳属(Arthrocladiella)与细菌属的泛菌属(Pantoea)呈极显著正相关(P<0.01),与马赛菌属(Massilia)、节杆菌属(Arthrobacter)和芽球菌属(Blastococcus)呈极显著负相关(P<0.01);而真菌属中的短梗霉属(Aureobasidium)和Udeniomyces与之相反。真菌属中的线黑粉酵母属(Filobasidium)与细菌属的假节杆菌属(Pseudarthrobacter)呈极显著正相关(P<0.01),与欧文氏杆菌属(Erwinia)呈极显著负相关(P<0.01);而真菌属的光黑壳属(Preussia)与之相反。真菌属的Thyrostroma、亚隔孢壳属(Didymella)和Neodidymelliopsis与细菌属的假单胞菌属(Pseudomonas)均呈极显著负相关(P<0.01)。LH样品的Symmetrospora和维希尼克氏酵母属(Vishniacozyma)受表皮中生防菌类芽孢杆菌属(Paenibacillus)的正向调控,也受泛菌属(Pantoea)和鞘氨醇单胞菌属(Sphingomonas)的负向调控,而枸杞表皮生防细菌属假单胞菌属(Pseudomonas)对枸杞表皮线黑粉酵母属(Filobasidium)的相对丰度呈正向调节;ZH样品的线黑粉酵母属(Filobasidium)受表皮中假节杆菌属(Pseudarthrobacter)的正向调控。由此可见枸杞表皮真菌与枸杞表皮细菌之间存在共生和互作关系。
3 讨论
本研究利用高通量测序技术对西藏产区枸杞和叶际微生物群落结构和多样性进行了分析。结果表明,在门分类水平上,变形菌门(Proteobacteria)是枸杞表皮与叶际的优势细菌门,子囊菌门(Ascomycota)是优势真菌门。在属分类水平上,马赛菌属(Massilia)是LH表皮的优势细菌属,unclassified_f__Alcaligenaceae是LHF和ZH样品的优势细菌属,泛菌属(Pantoea)是ZHF样品的优势细菌属;LH和LHF样品的优势真菌属均为派伦霉属(Peyronellaea),ZH样品的优势真菌属为短梗霉属(Aureobasidium),ZHF样品的优势真菌属为节丝壳属(Arthrocladiella)和小光壳属(Leptosphaerulina),两地枸杞表皮和叶际的微生物群落组成差异较大,这可能是由两地的海拔差异,枸杞品种和田间管理方式的不同等因素造成的。需要注意的是,欧文氏杆菌属(Erwinia)是人类第一个发现的植物病原细菌,会引起植物最常见的软腐病,也有植物萎蔫和坏死,由欧文氏菌属导致的细菌性软腐病在全世界均有分布,本研究发现欧文氏杆菌属(Erwinia)是ZH特有细菌属,因此要注意防治[20]。同时,各样品中也检测出多种生防菌,如类芽孢杆菌属(Paenibacillus)[21]、假单胞菌属(Pseudomonas)[22]、短波单胞菌属(Brevundimonas)[23]和附球菌属(Epicoccum)[24]等,这些有益微生物可能利用微生物种间或种内的抗生、竞争、重寄生、溶菌作用,或者通过微生物代谢产物诱导植物抗病性等,来抑制某些病原微生物的生长和增殖,以达到增产和提高质量的目的[25]。本研究检测到的马赛菌属(Massilia)和鞘氨醇单胞菌属(Sphingomonas)还具有降解有机污染物,提高植物对重金属离子的富集能力,在污染土壤生物修复中发挥着关键作用[26]。有研究表明光黑壳属(Preussia)能够产生吲哚乙酸和赤霉素,在促进植物生长以及产量提升方面发挥显著作用[27];以上有益菌可开发成生物防治剂,为后期生防菌的培育提供研究基础[28]。α多样性分析结果表明,叶际样品的细菌多样性和丰富度均高于枸杞果实表皮样品;LHF和ZHF的细菌多样性和丰富度均高于真菌;LH的真菌多样性和丰富度高于细菌;ZH的细菌丰富度高于真菌,而多样性低于真菌。通过对样品间真菌和细菌关联性分析,发现林芝枸杞表皮的Symmetrospora和维希尼克氏酵母属(Vishniacozyma)受表皮中生防菌类芽孢杆菌属(Paenibacillus)的正向调控,也受泛菌属(Pantoea)和鞘氨醇单胞菌属(Sphingomonas)的负向调控,而枸杞表皮生防细菌属假单胞菌属(Pseudomonas)对枸杞表皮线黑粉酵母属(Filobasidium)呈正相关;日喀则枸杞表皮的线黑粉酵母属(Filobasidium)受表皮中假节杆菌属(Pseudarthrobacter)的正向调控。
4 结论
本研究通过高通量测序技术对林芝、日喀则两地枸杞果实表皮及叶际微生物群落结构及多样性进行了分析,解析不同地区的枸杞表皮及叶际微生物群落结构差异。枸杞叶际的细菌多样性和丰富度均高于果实表皮,不同产地枸杞果实表皮与叶际微生物群落结构存在一定的异同,且不同种源地枸杞表皮与叶际微生物多样性差异明显。变形菌门(Proteobacteria)为优势细菌门,子囊菌门(Ascomycota)为优势真菌门。马赛菌属(Massilia)为林芝枸杞果实表皮中优势细菌属,奇异球菌属(Deinococcus)为林芝枸杞叶际优势细菌属,泛菌属(Pantoea)(未分类的菌属除外)为日喀则枸杞果实表皮中和叶际优势属。派伦霉属(Peyronellaea)为林芝枸杞表皮和叶际中的优势真菌属,短梗霉属(Aureobasidium)为日喀则枸杞表皮中的优势菌真菌属,节丝壳属(Arthrocladiella)为日喀则红枸杞叶际的优势真菌属。相关性分析结果表明,枸杞表皮的部分优势菌属受叶际的部分优势菌属正向或负向的显著影响,优势细菌属和优势真菌属之间相互影响。
[1]蒋锡龙,孙玉霞,董兴全,等.不同酿酒酵母发酵桃果酒香气成分研究[J].食品工业科技,2013,34(21):91-96.
[2]VINCENT R,OLIVIER C,ALINE L.Inventory and monitoring of wine microbial consortia[J].Appl Microbiol Biot,2007,75(1):149-164.
[3]邹青青,吴含玉,刘东焕,等.植物光合作用的三维特性研究进展[J].植物学报,2022,57(2):250-258.
[4]刘宇星,董醇波,邵秋雨,等.叶际微生物与植物健康研究进展[J].微生物学杂志,2022,42(2):88-98.
[5]崔穆峰,胡跃华,袁燕,等.叶际微生物群落的研究进展[J/OL].云南民族大学学报(自然科学版),1-17[2024-09-24].http://kns.cnki.net/kcms/detail/53.1192.n.20240506.1440.002.html.
[6]杨宽,王慧玲,叶坤浩,等.叶际微生物及与植物互作的研究进展[J].云南农业大学学报(自然科学版),2021,36(1):155-164.
[7]AHMED A,GIULIA M N D L,OLGA S C,et al.Metabarcoding analysis of fungal diversity in the phyllosphere and carposphere of Olive(Olea europaea)[J].PloS One,2015,10(7):e0131069.
[8]YANG C H, CROWLEY D E, BORNEMAN J, et al.Microbial phyllosphere populations are more complex than previously realized[J].P Natl Acad Sci,2001,98(7):3889-3894.
[9]WEI Y,WU Y,YAN Y,et al.High-throughput sequencing of microbial community diversity in soil, grapes, leaves, grape juice and wine of grapevine from China[J].PloS One,2018,13(3):e0193097.
[10]魏玉洁,邹弯,马文瑞,等.应用高通量测序技术研究新疆产区葡萄果实、叶片及果园土壤微生物多样性[J].食品科学,2018,39(6):162-170.
[11]HUANG T,QIN K,YAN Y M,et al.Bacterial community diversity on the surface of Chinese wolfberry fruit and its potential for biological control[J].Food Sci Technol,2022,42:e93422.
[12]LI Y,CHEN K,LIU S,et al.Diversity and spatiotemporal dynamics of fungal communities in the rhizosphere soil of Lycium barbarum L.:A new insight into the mechanism of geoherb formation[J].Arch Microbiol,2022,204(3):197.
[13]康娥儿.宁夏主栽枸杞根际土壤微生物群落特征分析[D].银川:宁夏大学,2022.
[14]何萍,王健强,高潭,等.西藏林芝地区不同品种葡萄果实表皮微生物群落结构组成分析[J].中国酿造,2022,41(12):144-149.
[15]孟静南.基于高通量测序技术研究温度对鸡皮和鸭皮中细菌多样性的影响[D].郑州:河南农业大学,2019.
[16]GU J S,LIU T,HOU J,et al.Analysis of bacterial diversity and biogenic amines content during the fermentation processing of stinky tofu[J].Food Res Int,2018,111:689-698.
[17]HUANG P M,CHEN Z H,LI W Z,et al.Inquiry of modulatory role of sea buckthorn fruit oil on dyslipidemia and gut microbiota in hyperlipidemia mice[J].Food Sci Hum Wellness,2024,9:98.
[18]强晓晶,刘磊,黄帆,等.紫花苜蓿根际土壤真菌和不同部位内生真菌的菌群组成及多样性分析[J].中国草地学报,2024,46(4):78-89.
[19]董锦润,李靖,陈玉惠,等.枝孢属真菌次生代谢产物中化学成分及其生物活性的研究进展[J].中草药,2021,52(19):6076-6087.
[20]彭炜.植物细菌性病害和病原细菌分类研究进展[C]//中国植物保护学会(China Society of Plant Protection).公共植保与绿色防控.四川省农业管理干部学院,2010:10.
[21]闫博巍,闫凤超,赵婷婷,等.类芽孢杆菌源抗病基因在作物病害防治上的应用研究进展[J].现代化农业,2019(8):4-8.
[22]NASSAL D, SPOHN M, ELTLBANY N, et al.Effects of phosphorusmobilizing bacteria on tomato growth and soil microbial activity[J].Plant and Soil,2018,427(1-2):17-37.
[23]章亚博,王丽伟,赵敏,等.人参土传病害生防微生物及其抑菌促生机制研究进展[J].中国植保导刊,2022,42(5):20-26,33.
[24]SENA A,CHAIBUB A A,CORTES M V C B,et al.Increased enzymatic activity in rice leaf blast suppression by crude extract of Epicoccum sp.[J].Tropical Plant Pathol,2013,38(5):387-397.
[25]李斌,史鸿翔,刘兰兰,等.园林植物女贞不同生态位细菌群落结构及其多样性[J].微生物学报,2022,62(2):686-702.
[26]HE W, MALLAVARAPU M, WU C Y, et al.Endophyte-assisted phytoremediation: Mechanisms and current application strategies for soil mixed pollutants[J].Crit Rev Biotechnol,2020,40(1):31-45.
[27]KHDIJA A H, SHAHZAD R, KHAN L A, et al. Preussia sp.BSL-10 producing nitric oxide,gibberellins,and indole acetic acid and improving rice plant growth[J].J Plant Interact,2018,13(1):112-118.
[28]LASTOCHKINA O,SEIFIKALHOR M,ALINIAEIFARD S,et al.Bacillus spp.:Efficient biotic strategy to control postharvest diseases of fruits and vegetables[J].Plants,2019,8(4):97.