红茶菌(kombucha),又名康普茶、海宝,最早起源于我国渤海地区,是一种通过茶叶、水、蔗糖按一定比例混合后自然发酵而成的传统发酵饮料[1]。红茶菌口感独特,且富含益生菌[2]、细菌纤维素[3]、有机酸、茶多酚[4]等功效成分,在抗菌、抗炎、调节肠道、保肝护肝、降血压、降血糖、抗癌等方面均展现出一定的效果[5],深受消费者喜爱。目前,传统红茶菌饮品仍以天然混合菌种体系的作坊式加工为主,存在发酵周期长、发酵条件控制难、产品品质不稳定、安全隐患突出等问题,严重限制了产业的发展[6]。
研究表明,红茶菌是由醋酸菌、酵母菌、乳酸菌等组成的共生发酵体系[7],不同的微生物菌群所产生的醇、醛、酸、酯等小分子代谢物种类决定了红茶菌的风味品质及保健功效[8]。不同来源的红茶菌受到产地温度、湿度等环境因素的影响,菌相组成各不相同,导致风味品质差异较大[9]。GREENWALT C J等[10]报道称红茶菌的发酵是由需氧细菌和酵母菌共同驱动的,它们通常存在于漂浮的纤维素膜(floating cellulose mat)中;SIEVERS M等[11]研究红茶菌60 d发酵过程,发现优势微生物为木醋杆菌(Acetobacterxylinum)和结合酵母属(Zygosaccbaromyces sp.),且由酵母菌先将蔗糖转化为葡萄糖和果糖供细菌(醋酸菌、乳酸菌)代谢利用,产生的醋酸和葡萄糖酸使pH值降至较低水平(<3.0)。MALBAŠA R等[12]优化发酵14 d红茶菌的最佳碳源浓度,发现蔗糖添加量70 g/L条件下,pH值较高、乙酸浓度较低、乳酸浓度较高,蔗糖利用率高。VELIC′ANSKI A S等[13]以香蜂叶(Lemon Balm)为唯一氮源发酵红茶菌,结果发现,发酵7 d后乙酸、总酚含量和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除活性均高于传统以茶叶为氮源的产品,迷迭香酸为主要的酚类化合物,可能提供一定的生物活性。要实现风味品质好、保健功效强的红茶菌的规模化稳定生产,高品质商业发酵剂的开发是关键,但目前针对红茶菌中发酵性能优异优势菌株的分离鉴定及筛选分析还鲜有报道。
本研究选择发酵风味品质较佳的市售红茶菌产品为研究对象,利用选择性培养基从样品中分离、筛选出优势微生物,通过形态学观察及分子生物学技术对其进行鉴定,明确红茶菌发酵过程中优势微生物的种类;对筛选出的优势菌株的生长特性、发酵特性及耐受性进行分析,进一步筛选出优良菌株,以期得到可提升红茶菌风味品质及健康功效的优良菌株,为红茶菌饮料实现标准化、工业化生产奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
红茶菌菌膜及菌液:市售,产地为辽宁、河北、山东、陕西、河南、广东等6个不同省份的传统发酵红茶菌产品各1个,经4 ℃冷链2 d内运输至实验室。红茶叶:福建立香茶业有限公司;白砂糖:昆明馋小雅食品有限公司。
1.1.2 试剂
酵母浸粉、蛋白胨(均为生化试剂):青岛高科技工业园海博生物技术有限公司;葡萄糖、Na2HPO4(均为分析纯):山东西亚化学工业有限公司;乙醇(分析纯):天津市科密欧化学试剂有限公司;一水合柠檬酸(分析纯):天津市凯通化学试剂有限公司;琼脂(生化试剂):广州赛国生物科技有限公司;细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;27F DNA引物、1492R DNA引物、Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、琼脂糖、Goldview核酸染料、6×loading buffer、DNA Marker、50×TAE溶液:生工生物工程(上海)股份有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、MRS琼脂培养基、酵母浸出粉胨葡萄糖(yeast extracts peptone glucose,YPD)培养基:青岛高科技工业园海博生物技术有限公司。
醋酸菌增菌培养基:葡萄糖20 g/L,酵母浸粉5 g/L,蛋白胨5 g/L,Na2HPO4 2.7 g/L,柠檬酸1.15 g/L。121 ℃条件下灭菌15 min。
1.2 仪器与设备
GI54DS高压灭菌器:致微(厦门)仪器有限公司;SWCJ-2D超净工作台:苏州博莱尔净化设备有限公司;LRHS-150-II恒温恒湿培养箱:上海跃进医疗器械有限公司;MQT-60HR台式振荡培养箱:上海旻泉仪器有限公司;HX-PCR96梯度聚合酶链式反应热循环仪、HX-10F掌上型恒温金属浴:上海沪析实业有限公司;PowerPac Basic电泳仪、ChemiDoc MP凝胶成像仪:伯乐生命医学产品(上海)有限公司;GL-20G-II冷冻离心机、TGL-16C离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 红茶菌的制备
先用沸水将不锈钢容器、发酵瓶、纱布等进行清洁杀菌;称取6.0 g红茶叶置于不锈钢容器中,加开水(>95 ℃)1 L浸泡15 min后,用多层纱布过滤去茶渣,得到澄清的茶汤;称取40.0 g白砂糖加入茶汤中,充分搅拌混匀,冷却备用。在经沸水杀菌后的发酵瓶中分别加入800 mL上述加糖后的茶汤,并接入200 mL 6个不同区域购买的红茶菌菌液,并用无菌纱布(8层)将发酵瓶封口,室温避光静置培养,发酵5~7 d后按TRAN T等[9]的方法进行感官评价。从以上6个样品中选取感官品质较佳的红茶菌产品2个,用于后续菌种分离纯化过程。
1.3.2 菌种的分离和纯化
在超净工作台中吸取5 mL红茶菌样品菌液加入45 mL无菌生理盐水充分振荡混匀,均质拍打2 min后进行梯度稀释,选取10-5、10-6、10-7三个浓度梯度样品分别吸取100 μL于多种选择性培养基平板上均匀涂布。其中,PDA平板在30 ℃培养3~5 d,MRS平板在37 ℃厌氧培养2~3 d,PDA平板在30 ℃培养2~3 d。选取有一定菌落且不互相重叠的平板,记录菌落形态、颜色、大小等,并挑选典型菌落进行平板划线,得到的单菌落与体积分数50%甘油按1∶1混合后置于冻存管中,在-80 ℃超低温冰箱中保存。
1.3.3 微生物分子生物学鉴定
DNA的提取:取冻存菌悬液按1%接种比例进行2次活化复壮,在8 000 r/min条件下高速离心2 min得到菌种沉淀。根据细菌DNA提取试剂盒操作步骤提取上述活化菌株DNA,得到的DNA置于无菌的1.5 mL离心管中冷冻密封-20 ℃保存,作为PCR扩增的模板。
酵母菌PCR扩增:以提取得到的DNA为模板,利用通用引物NL1(5'-XXX-3')及NL4(5'-XXX-3')对酵母菌的26S rDNA进行PCR扩增。PCR扩增体系为30 mL,包括:Taq PCR Master Mix 15 μL、两种引物各1 μL、DNA模板2 μL、双蒸水(ddH2O)11 μL;PCR扩增程序为:预变性4 min(94 ℃),变性30 s(95 ℃)、退火30 s(52 ℃)、延伸45 s(72 ℃)、循环35次,再彻底延伸10 min(72 ℃),4 ℃条件下保存。
细菌PCR扩增:以提取得到的DNA为模板,利用通用引物27F(5'-XXX-3')及1492R(5'-XXX-3')对细菌的16S rDNA进行PCR扩增;PCR扩增体系为30 μL,包括:Taq PCR Master Mix 15 μL、两种引物各1 μL、DNA模板2 μL、双蒸水11 μL;PCR扩增程序为:预变性4 min(94 ℃),变性30 s(95 ℃)、退火30 s(55 ℃)、延伸90 s(72 ℃)、循环35次,再彻底延伸10 min(72 ℃),4 ℃条件下保存。
采用1.5%琼脂糖凝胶电泳对PCR产物进行检测,对琼脂糖凝胶电泳中条带清晰、大小正确的PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,将返回的序列首尾拼接后上传至美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)GenBank数据库中进行基本局部比对搜索工具(Basic Local Alignment Search Tool,BLAST)(https://blast.ncbi.nlm.nih.gov/Blast.cgi)同源性比对,选取同源性较高的模式菌株,确定从红茶菌样品中筛选出的优势微生物种类(同源性>98%)。采用MEGA 10.0软件中邻接法(neighbor joining,NJ)对优势菌株的系统发育树进行构建,从而进一步挖掘菌群结构及功能信息。
1.3.4 酵母菌特性分析
产乙醇能力的测定:将活化后的筛选酵母菌株以2%(V/V)的接种量接种于YPD液体培养基中,在30 ℃条件下培养72 h后,采用重铬酸钾比色法测定筛选菌株产乙醇能力[14]。
还原糖含量的测定:将筛选酵母菌接种至YPD液体培养基中,在30 ℃条件下培养72 h后采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法测定还原糖含量[15]。
生长曲线的测定:将筛选酵母菌按5%(V/V)的接种量接入YPD培养基中,在30 ℃条件下培养,以未接种YPD液体培养基为对照,每组设置两个平行,每隔2 h测定培养液在波长600 nm处的OD600 nm值,连续测48 h,绘制酵母菌的生长曲线。
耐受性实验:将筛选酵母菌划线接种于YPD固体培养基中,分别在25 ℃、30 ℃、35 ℃、40 ℃条件下培养72 h。通过观察菌株的生长情况,反映其温度耐受性[16]。用乳酸调节YPD液体培养基的pH值为2.0、3.0、4.0、5.0。按接种量2%接入不同pH值的15 mL试管中(内放倒置的杜氏小管),30 ℃恒温静置培养72 h。通过观察各杜氏小管内气体充盈情况,判断各菌株的pH耐受性[17]。以YPD培养基为基础,配制不同葡萄糖质量浓度(300 g/L、350 g/L、400 g/L、450 g/L、500 g/L)的固体培养基。将酵母菌株划线接种在不同葡萄糖浓度的YPD培养基中,于30 ℃恒温培养48 h。通过观察菌株在不同蔗糖浓度培养基中的生长情况,判断各菌株的糖耐受性[18]。
1.3.5 醋酸菌及乳酸菌特性分析
产酸能力的测定:将活化后的菌株按接种量10%(V/V)接种于装液量为50 mL/500 mL醋酸菌增菌培养基或MRS液体培养基中,随后在30 ℃/37 ℃、150 r/min条件下振荡培养72 h。按照国标GB/T 12456—2021《食品中总酸的测定》[19]方法测定样品的总酸含量。
生长曲线的测定:将活化后的优势醋酸菌或乳酸菌菌株按接种量5%(V/V)接种于醋酸菌增菌培养基或MRS液体培养基中,在30 ℃/37 ℃条件下培养,以未接种发酵组为对照,每隔2 h测定培养液在波长600 nm处的OD600 nm值,连续测48 h,绘制醋酸菌和乳酸菌的生长曲线。
耐受性的测定:将活化后的优势醋酸菌或乳酸菌菌株按接种量5%(V/V)接种于相应发酵培养基中,分别于25 ℃、30 ℃、35 ℃、40 ℃条件下在转速150 r/min的振荡培养箱中培养24 h,测定培养液在波长600 nm下的OD600nm值。将活化后的优势醋酸菌或乳酸菌菌株在对数生长期按接种量10%(V/V)接种于装液量为50 mL/500 mL的相应培养基中(乙醇体积分数分别为6%、8%、10%、12%);随后置于30 ℃、150 r/min的恒温振荡培养器中培养24 h,测定培养液在波长600 nm下的OD600nm值。将活化后的优势醋酸菌或乳酸菌菌株在对数生长期按接种量10%(V/V)接种于pH值分别为2、3、4、5的醋酸菌增菌培养基或MRS液体培养基。以自然pH组(pH 6.2±0.2)作为对照组,置于30 ℃/37 ℃、150 r/min条件下培养24 h,测定培养液在波长600 nm下的OD600nm值。
1.3.6 数据处理
所有实验进行3次平行实验,结果以“平均值±标准值”表示,所有实验数据采用SPSS 20.0进行数据统计;采用单因素方差分析(analysis of variance,ANOVA)进行显著性检验,用P<0.05表示差异显著。
2 结果与分析
2.1 微生物的分离、纯化及形态学特征
采用涂布平板分离法和平板划线分离法,经筛选培养基分离纯化;在PDA培养基上分离纯化出18株菌株,挑取颜色、形态差异明显、典型的单菌落分为6组,分别命名为P1(3株)、P2(8株)、P3(1株)、C1(3株)、C2(2株)和M(1株);各组选择较典型的菌株,其菌落形态和细胞形态见图1。由图1A可知,P1、P2、P3组菌落颜色为白色、灰白色或淡黄色,边缘整齐,菌落表面光滑,呈湿润或黏稠状,质地柔软,符合酵母菌的形态学分析;C1、C2组菌落颜色为灰白色,呈不规则形状,较为干燥,表面粗糙;M组菌落颜色为乳白色,呈圆形,表面较光滑,菌落较小。由图1B可知,C1、C2组菌株经革兰氏染色后为阴性,呈现红色或粉红色短杆状,这符合醋酸菌的特征[20];M组菌株经革兰氏染色后为阳性,呈现紫色杆状,符合乳酸菌菌体特征[21]。
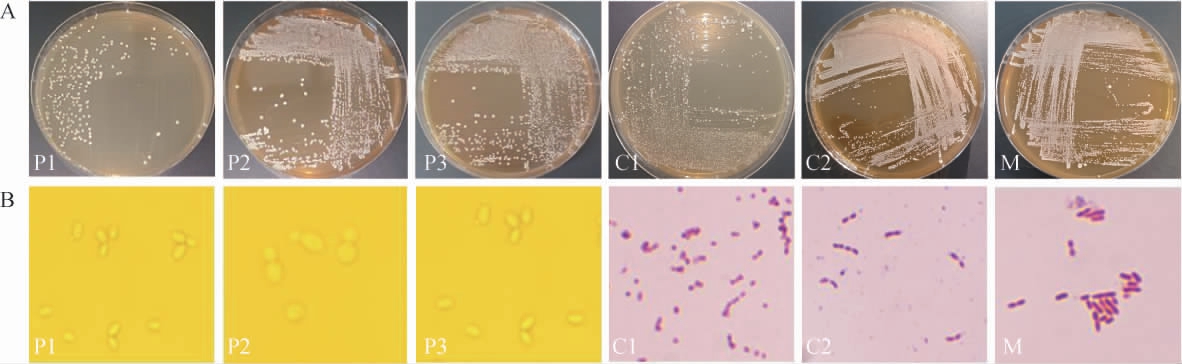
图1 代表菌株的菌落(A)及细胞(B)形态
Fig.1 Colony (A) and cell (B) morphology of representative strains
2.2 分子生物学鉴定
使用GenBank数据库对以上筛选出的优势菌株26S rDNA和16S rDNA碱基序列进行BLAST同源性检索,选取同源性高于98%的26S rDNA和16S rDNA序列进行多序列比较,在MEGA 11.0软件中以邻接法进行1 000次的相似度重复计算,构建优势菌株系统发育树,结果见图2。

图2 筛选菌株基于26S rDNA和16S rDNA基因序列的系统发育树
Fig.2 Phylogenetic tree of screened strains based on 26S rDNA and 16S rDNA gene sequences
由图2可知,P1组菌株与酿酒酵母(Saccharomyces cerevisiae)同源性最高(96%),均被鉴定为酿酒酵母(Saccharomycescerevisiae),分别编号为P1-SC1、P1-SC2、P1-SC3;P2组菌株与拜耳接合酵母(Zygosaccharomycesbailii)同源性最高(97%),均被鉴定为拜耳接合酵母(Zygosaccharomyces bailii),分别编号为P2-ZB1、P2-ZB2、P2-ZB3、P2-ZB4、P2-ZB5、P2-ZB6、P2-ZB7、P2-ZB8;P3组菌株与达文波特星形酵母(Starmerella davenportii)同源性达到100%,被鉴定为达文波特星形酵母(Starmerella davenportii),编号为P3-SD;C1组菌株与中间驹形杆菌(Komagataeibacter intermedius)同源性最高,均被鉴定为中间驹形杆菌(Komagataeibacter in termedius),分别编号为C1-KI1、C1-KI2、C1-KI3;C2组菌株与氧化葡糖杆菌(Gluconobacter oxydans)同源性最高,均被鉴定为氧化葡糖杆菌(Gluconobacter oxydans),分别编号为C2-GO1和C2-GO2;M组菌株与清酒乳酸杆菌(Lactobacillussakei)同源性达到99%,被鉴定为清酒乳酸杆菌(Lactobacillus sakei),编号为M-LS。
2.3 酵母菌特性分析
2.3.1 产乙醇能力
酵母菌属兼性厌氧菌,在无氧环境下会将碳源分解产生CO2和乙醇,产乙醇能力是评价酵母菌发酵性能的重要指标之一[22]。红茶菌中不同优势酵母菌菌株产乙醇能力测定结果见图3。由图3可知,在P1组中,菌株P1-SC1、P1-SC2、P1-SC3均为酿酒酵母,其中菌株P1-SC3产乙醇能力最强,乙醇含量达到4.8%;其次是菌株P1-SC1,乙醇含量为3.9%;而菌株P1-SC2较弱,乙醇含量为1.8%。在P2组中,菌株P2-ZB5产乙醇能力最强,乙醇含量达到5.8%;菌株P2-ZB1、P2-ZB2、P2-ZB3、P2-ZB4、P2-ZB6和P2-ZB7产乙醇能力均较强(乙醇含量>2.0%);而菌株P2-ZB8产乙醇能力较弱(乙醇含量1.7%)。菌株P3-SD为达文波特星形酵母,产乙醇能力达到3.0%。因此,弃去产乙醇能力相对较弱的菌株P1-SC2、P2-ZB8,其余菌株用于下一步实验。
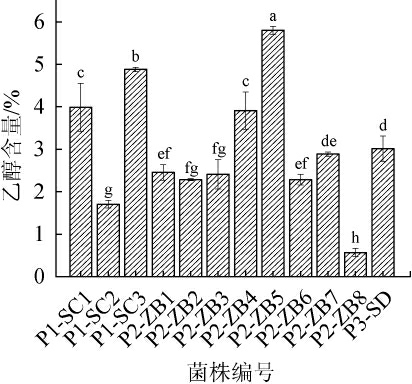
图3 红茶菌中不同优势酵母菌菌株产乙醇能力比较
Fig.3 Comparison of ethanol production capacity of different dominant yeast strains in kombucha
不同小写字母表示菌株间存在显著差异(P<0.05)。下同。
2.3.2 酵母菌还原糖消耗能力
还原糖的消耗量可以作为衡量酵母菌生长和代谢能力的直接指标[23]。红茶菌中不同优势酵母菌发酵液中还原糖含量测定结果见图4。由图4可知,菌株P1-SC1和P1-SC3的发酵液中还原糖含量较低(<0.23 g/L),表明这些菌株的还原糖消耗量较大,碳源代谢能力较优。对于P2组菌株,菌株P2-ZB4、P2-ZB5和P2-ZB7的剩余还原糖含量较低(<0.40 g/L),显示出较强的碳源代谢能力;而菌株P2-ZB1、P2-ZB2、P2-ZB3和P2-ZB6剩余还原糖含量显著高于其他拜耳接合酵母菌株(P<0.05),碳源代谢能力较差。菌株P3-SD剩余还原糖含量也较低(0.42 g/L),具备较好的发酵潜力。因此,选择还原糖消耗能力相对较强的菌株P1-SC1、P1-SC3、P2-ZB4、P2-ZB5、P2-ZB7进行下一步实验。
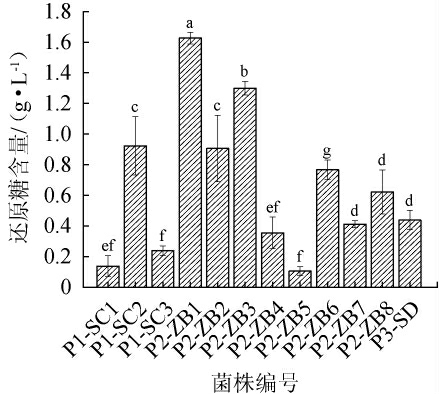
图4 红茶菌中不同优势酵母菌菌株发酵液中还原糖含量比较
Fig.4 Comparison of reducing sugar contents in fermentation broth from different dominant yeast strains in kombucha
2.3.3 酵母菌生长特性
选取乙醇产量较高(>2.8 g/L)、还原糖消耗能力强(<0.48 g/L)的菌株(P1-SC1、P1-SC3、P2-ZB4、P2-ZB5、P2-ZB7、P3-SD)绘制生长曲线,结果见图5。
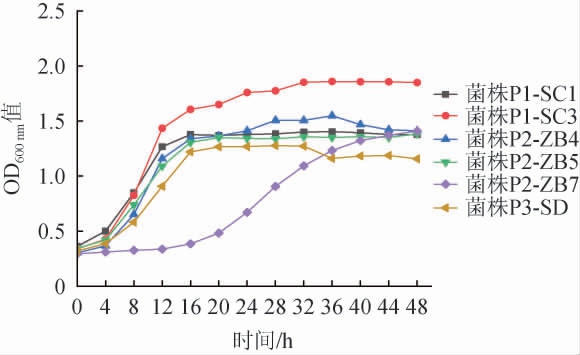
图5 红茶菌中不同优势酵母菌菌株生长曲线
Fig.5 Growth curves of different dominant yeast strains in kombucha
由图5可知,菌株P1-SC1、P1-SC3、P2-ZB4、P2-ZB5、P3-SD这5株菌在0~16 h生长趋势基本一致;培养时间在0~4 h间,菌株生长较缓慢,处于迟滞期;在培养时间4~16 h间,菌株迅速生长繁殖,对应对数生长期;当培养时间>16 h,菌株P1-SC3仍缓慢增长,而其他4株菌生长趋势趋于平缓,进入稳定期。菌株P2-ZB7在0~16 h生长缓慢,为迟滞期;培养时间在16~40 h之间,菌株迅速生长,进入对数生长期;培养时间>40 h,菌株生长趋势较为平缓,进入稳定期。菌株P1-SC1、P1-SC3、P2-ZB4、P2-ZB5在整个培养期生长状况类似,菌株P2-ZB7生长较为缓慢,而菌株P1-SC3在整个培养期展现了最为旺盛的生长能力。菌株P1-SC1、P1-SC3、P2-ZB4、P2-ZB5、P2-ZB7、P3-SD表现出显著的生长优势,具备较强的生长能力和适应性。
2.3.4 酵母菌耐受性分析
温度对发酵食品中的酵母菌的代谢产物的类型和数量具有显著影响,不同酵母菌株的最适生长温度存在较大差异[24]。菌株P1-SC1、P1-SC3、P2-ZB4、P2-ZB5、P2-ZB7、P3-SD耐受性试验结果见表1。由表1可知,在25~30 ℃范围内,所有菌株均能正常生长;当温度升高至35 ℃时,菌株P1-SC1和P1-SC3依然能够旺盛生长,而其他菌株的生长则受到不同程度的抑制,其中菌株P2-ZB4和P2-ZB7的生长被完全抑制,表明其温度耐受性较差;当温度进一步升高至40 ℃时,6株酵母菌的生长均被完全抑制,这可能是由于高温条件下,酵母菌的三磷酸腺苷酶等关键酶的活性受到严重抑制,从而影响了酵母的能量代谢[25]。
表1 红茶菌中不同优势酵母菌菌株耐受性试验结果
Table 1 Results of tolerance tests of different dominant yeast strains in kombucha
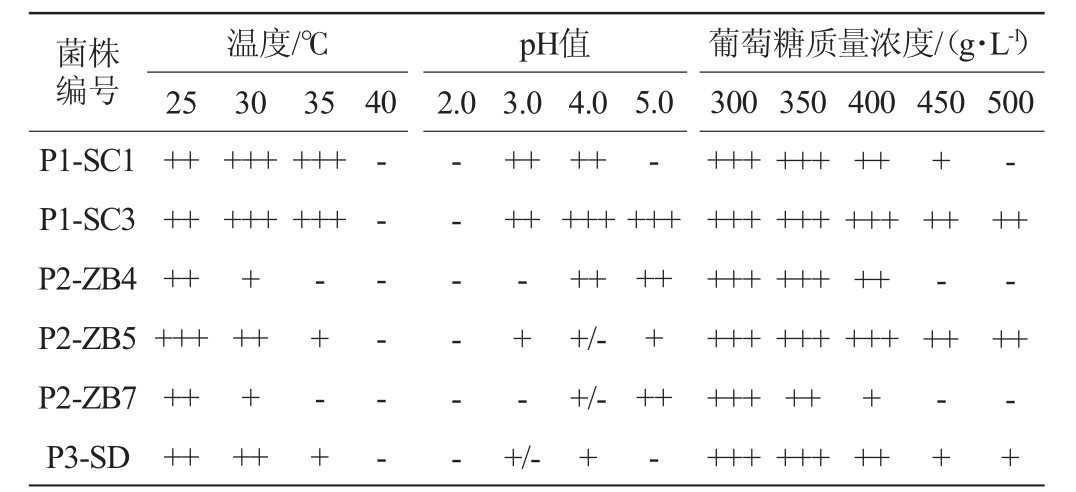
注:“-”表示杜氏小管中无气体产生;“+”表示杜氏小管中产生1/2气体;“++表示杜氏小管中产生3/4气体;“+++”表示杜氏小管中充满气体。
菌株编号P1-SC1 P1-SC3 P2-ZB4 P2-ZB5 P2-ZB7 P3-SD温度/℃25 30 35 pH值2.0 3.0 4.0 40 5.0葡萄糖质量浓度/(g·L-1)300 350 400 450 500+++++++++++++++++++++++++++++++++++-+--+ - +-- - - - --- - - - --+ -++-++++-+++/-++++++++/-+/-+++++++++-++++++++++++++++++++++++++++++++++++++++++++++++-+-+
由表1可知,当pH值为2.0时,各菌株的产气能力均被完全抑制;当pH值升高到3.0时,菌株P1-SC1和P1-SC3展现出较强的产气能力,菌株P2-ZB5和P3-SD的产气能力相对较弱,菌株P2-ZB4和P2-ZB7的产气能力则被完全抑制;进一步提高pH值至4.0时,各菌株均表现出不同程度的产气能力,其中菌株P1-SC1、P1-SC3和P2-ZB4的产气能力较强;当pH值达到5.0时,菌株P1-SC3、P2-ZB4和P2-ZB7仍具有较强的产气能力,而菌株P1-SC1和P3-SD的产气能力则被完全抑制。
葡萄糖可为酵母菌的生长繁殖提供必需的碳源,但当葡萄糖浓度较高时会改变酵母菌细胞膜的渗透压,从而抑制其生命活动[26]。由表1可知,在葡萄糖质量浓度在300 g/L,各菌株生长均较旺盛;葡萄糖质量浓度升高至400 g/L时,菌株P1-SC3和P2-ZB5仍保持较强的生长活性,而菌株P1-SC1、P2-ZB4、P2-ZB7和P3-SD的生长活性略有下降;当葡萄糖质量浓度达到450~500 g/L时,所有菌株的生长均受到不同程度的抑制;其中,菌株P1-SC3和P2-ZB5生长活性有所下降,菌株P2-ZB4和P2-ZB7在葡萄糖质量浓度450g/L时生长被完全抑制;菌株P1-SC1、P2-ZB4和P2-ZB7在葡萄糖质量浓度为500 g/L的时候停止生长。因此,在高葡糖质量浓度下(>450 g/L),菌株P2-ZB4、P2-ZB7生长完全停滞,糖耐受能力较差,菌株P1-SC3和P2-ZB5在葡萄糖质量浓度300~500 g/L都能良好生长,具有较好糖耐受性。
综上,酵母菌P1-SC3具有较强的生长特性、发酵特性及耐受性。
2.4 醋酸菌及乳酸菌特性分析
2.4.1 醋酸菌及乳酸菌产酸能力测定
红茶菌中不同优势醋酸菌和乳酸菌产酸量测定结果见图6。由图6可知,菌株C1-KI1、C1-KI2、C1-KI3同属于中间驹形杆菌,其中C1-KI3菌株产酸能力最强,达到2.52 g/L;菌株C1-KI1产酸能力稍弱,为1.61 g/L;菌株C1-KI2产酸能力最弱,为1.13 g/L。C2组中,菌株C2-GO1产酸能力强,为3.16 g/L;菌株C2-GO2产酸能力弱,为1.45 g/L。清酒乳酸杆菌M-LS产酸能力强,达到3.33 g/L。因此,菌株C1-KI3、C2-GO1和M-LS产酸能力较强。
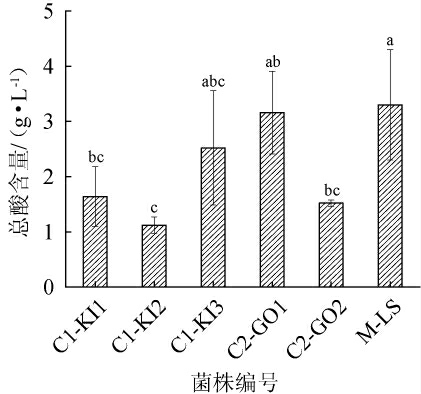
图6 红茶菌中不同优势醋酸菌和乳酸菌产酸量比较
Fig.6 Comparison of acid production of different dominant acetic acid bacteria and lactic acid bacteria strains in kombucha
2.4.2 醋酸菌及乳酸菌生长特性
红茶菌中不同优势醋酸菌和乳酸菌生长曲线测定结果见图7。由图7可知,醋酸菌C1-KI1、C1-KI3、C2-GO1生长趋势基本一致,在培养时间为0~8 h时生长缓慢,对应迟滞期;在培养时间为8~32 h菌株生长迅速,进入对数生长期;在培养时间>32 h之后,菌株缓慢生长,达到稳定期;菌株C1-KI3的OD600nm值略高于菌株C1-KI1和C2-GO1。菌株M-LS在0~16 h快速繁殖,处于对数生长期;培养时间>16 h时,菌株仍缓慢生长,进入稳定期;且在约40 h时菌落数达到最大值(OD600 nm值=1.632)。因此,菌株C1-KI3和M-LS展现出较强的生长能力。
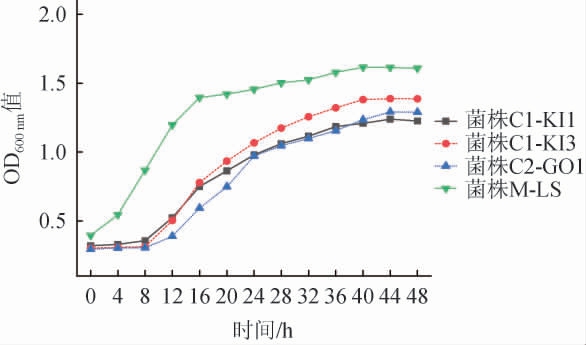
图7 红茶菌中不同优势醋酸菌及乳酸菌生长曲线
Fig.7 Growth curves of different dominant acetic acid bacteria and lactic acid bacteria strains in kombucha
2.4.3 醋酸菌及乳酸菌耐受性
红茶菌中不同优势醋酸菌和乳酸菌耐受性试验测定结果见图8。由图8A可知,当温度在25~40 ℃时,随温度上升醋酸菌C1-KI1、C1-KI3、C2-GO1生长量呈现先上升后下降的趋势;在温度30 ℃时达到极值,OD600 nm值分别为1.08、0.47、0.36,说明红茶菌中醋酸菌的最适生长温度在30 ℃左右。当温度>30 ℃之后,生长量显著下降(P<0.05),这可能是由于细菌细胞膜的流动性增加,导致营养物质的转运效率降低,从而抑制了生长[27]。菌株C1-KI1在各温度条件下生长量均显著高于菌株C1-KI3和C2-GO1(P<0.05),展现出较强的生长特性及温度耐受性。乳酸菌M-LS生长量也呈现先上升后下降的趋势;在温度35 ℃时,OD600nm值(1.09)达到极值,说明菌株M-LS的最适生长温度在35 ℃左右。因此,在温度<30 ℃时,红茶菌中优势醋酸菌和乳酸菌均具有较好的温度耐受能力。
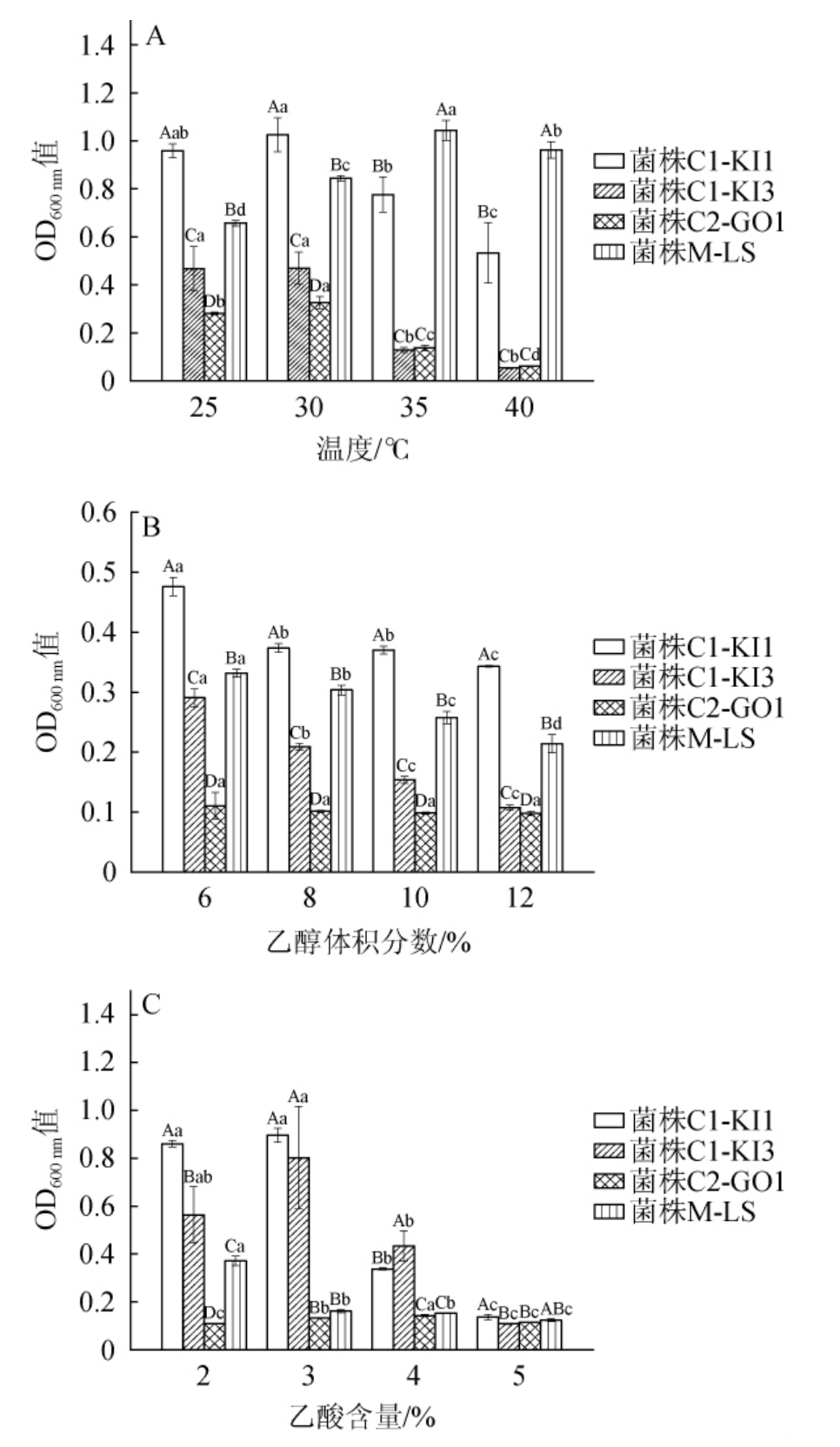
图8 红茶菌中不同优势醋酸菌及乳酸菌温度(A)、乙醇(B)和乙酸(C)耐受性试验结果
Fig.8 Results of temperature (A), ethanol (B) and acetic acid (C)tolerance tests of different dominant acetic acid bacteria and lactic acid bacteria strains in kombucha
不同大写字母表示相同温度、乙醇体积分数、乙酸含量不同菌株间差异显著(P<0.05),不同小写字母表示同一菌株不同温度、乙醇体积分数、乙酸含量差异显著(P<0.05)。
由图8B可知,在乙醇体积分数为6%~12%时,随着乙醇体积分数的增加,醋酸菌C1-KI1、C1-KI3、C2-GO1生长量呈下降趋势;且菌株C1-KI1在乙醇体积分数为6%时,生长量最高(OD600nm=0.48)。在整个过程中菌株C1-KI1的生长量要显著高于菌株C1-KI3、C2-GO1(P<0.05)。菌株M-LS随着乙醇体积分数的增加生长量也呈下降趋势;在乙醇体积分数为6%时,菌株M-LS的OD600nm最高达0.29。相比之下,菌株C1-KI1、M-LS在高乙醇体积分数(12%)下仍维持相对较高的生长量。
由图8C可知,乙酸含量为2%~5%的范围内逐渐增加时,醋酸菌的生长量呈现先增加后减少的趋势;其中菌株C1-KI1、C1-KI3生长量在乙酸含量为3%时达到极值,OD600 nm值分别为0.89、0.78。而随着乙酸含量的增加,M-LS生长量受到显著抑制(P<0.05),表明其耐乙酸性能较弱。
综上,中间驹形杆菌C1-KI1和清酒乳酸杆菌M-LS具有较强的产酸能力、生长特性及耐受性。
3 结论
本研究利用选择性培养基从传统红茶菌中筛选得到酵母菌12株,包括酿酒酵母(Saccharomyces cerevisiae)3株,拜耳接合酵母(Zygosaccharomyces bailii)8株,达文波特星形酵母(Starmerella davenportii)1株;醋酸菌5株,包括中间驹形杆菌(Komagataeibacter intermedius)3株,氧化葡糖杆菌(Gluconobacter oxydans)2株;乳酸菌1株,为清酒乳酸杆菌(Lactobacillus sakei)。酵母菌P1-SC1、P1-SC3、P2-ZB4、P2-ZB5、P2-ZB7、P3-SD表现出较佳的产乙醇能力(乙醇含量>3.0%)和还原糖消耗能力(还原糖含量<0.42 g/L);其中,菌株P1-SC1、P1-SC3生长最为旺盛,且能在温度35 ℃、pH值3.0、葡萄糖含量>450 g/L条件下生长。菌株C1-KI1、C1-KI3、C2-GO1和M-LS的产酸能力较强(1.61g/L~3.30g/L);其中,菌株M-LS生长最为旺盛,且与C1-KI1都能在温度40℃、乙醇含量12%条件下生长(OD600nm值>0.3)。综上,酿酒酵母P1-SC3具有较强的生长特性、发酵特性及耐受性,中间驹形杆菌C1-KI1和清酒乳酸杆菌M-LS具有较强的产酸能力、生长特性及耐受性。
本研究揭示了红茶菌中多种优势微生物的种类及其发酵特性,为发酵条件下菌群结构调控、发酵产品质量提升提供了新思路和技术支持,为进一步优化红茶菌的工业化发酵生产提供了理论依据。
[1]CHAKRAVORTY S, BHATTACHARYA S, CHATZINOTAS A, et al.Kombucha tea fermentation:Microbial and biochemical dynamics[J].Int J Food Microbiol,2016,220:63-72.
[2]王茜,伍小丫,田文欣,等.红茶菌饮料原料开发及其营养功能研究进展[J].食品工业科技,2022,43(20):321-327.
[3]赵育,苏乔,张悦,等.红茶菌菌膜的特性及应用[J].食品与生物技术学报,2024,43(2):11-22.
[4]汪鹏辉,张慧霞,刘斌杰,等.红茶菌群中菌株相互作用影响菌体生长和代谢[J].微生物学通报,2021,48(2):426-436.
[5]XU S, WANG Y, WANG J, et al.Kombucha reduces hyperglycemia in type 2 diabetes of mice by regulating gut microbiota and its metabolites[J].Foods,2022,11(5):754.
[6]OLIVEIRA Í A C L,ROLIM V A O,GASPAR R P L,et al.The technological perspectives of kombucha and its implications for production[J].Fermentation,2022,8(4):185.
[7]刘思琪,樊璐瑶,王硕,等.红茶菌功能性微生物开发与利用研究进展[J].食品工业科技,2024,45(11):388-395.
[8]杨莉,籍保平,周峰,等.红茶菌主要功能菌株发酵糖茶水条件的研究[J].食品科学,2008,29(6):142-145.
[9]TRAN T, GRANDVALET C, VERDIER F, et al.Microbiological and technological parameters impacting the chemical composition and sensory quality of kombucha[J].Compr Rev Food Sci Food Safety,2020,19(4):2050-2070.
[10]GREENWALT C J, LEDFORD R A, STEINKRAUS K H.Kombucha,the fermented tea:microbiology,composition,and claimed health effects[J].J Food Protect,1998,61(7):976-981.
[11]SIEVERS M,LANINI C,WEBER A,et al.Microbiology and fermentation balance in a kombucha beverage obtained from a tea fungus fermentation[J].Syst Appl Microbiol,1995,18(4):590-594.
[12]MALBAŠA R,LONCˇAR E,DJURIC′ M,et al.Effect of sucrose concentration on the products of Kombucha fermentation on molasses[J].Food Chem,2008,108(3):926-932.
[13]VELIC′ANSKI A S,CVETKOVIC′ D D,MARKOV S L,et al.Antioxidant and antibacterial activity of the beverage obtained by fermentation of sweetened lemon balm(Melissa officinalis L.)tea with symbiotic consortium of bacteria and yeasts[J].Food Technol Biotech,2014,52(4):420-429.
[14]何川,章登政,张俊,等.重铬酸钾-DNS比色法测定发酵液中乙醇含量[J].生命科学研究,2013,17(1):1-5.
[15]王印壮,丁玉峰,段定定,等.葡萄酵素发酵过程中的酵母菌筛选及品质变化分析[J].食品与发酵工业,2022(10):70-77.
[16]国家质量监督检验检疫总局,国家标准化管理委员会.GB/T 24399—2009 黄豆酱[S].北京:中国标准出版社,2009.
[17]KUNDIYANA D K, WILKINS M R, MADDIPATI P, et al.Effect of temperature,pH and buffer presence on ethanol production from synthesis gas by"Clostridium ragsdalei"[J].Bioresource Technol,2011,102(10):5794-5799.
[18]VERDUYN C,POSTMA E,SCHEFFERS W A,et al.Physiology of Saccharomyces cerevisiae in anaerobic glucose-limited chemostat cultures[J].J Gen Microbiol,1990,136(3):395-403.
[19]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB/T 12456—2021 食品中总酸的测定[S].北京:中国标准出版社,2021.
[20]JOJIMA Y,MIHARA Y,SUZUKI S,et al.Saccharibacter floricola gen.nov., sp.nov., a novel osmophilic acetic acid bacterium isolated from pollen[J].Int J Syst Evol Micr,2004,54(6):2263-2267.
[21]乌素,杨晓艳,班瑞,等.三株乳酸菌形态特征的研究[J].农产品加工,2019,6(12):19-21.
[22]田辉,谢引荣,王琰,等.三种传统发酵食品中酵母菌的分离鉴定与特性分析[J].中国酿造,2022,41(3):87-92.
[23]蒋昌勇,王毅,汪玲玲,等.酵母复配发酵对蜂蜜酒品质的影响[J].中国酿造,2024,43(9):164-169.
[24]李亿,秦艳,申乃坤,等.酿酒酵母pdc基因缺陷菌株的构建及其丙酮酸发酵特性[J].食品与发酵工业,2020,46(8):7-12.
[25]MEJÍA-BARAJAS J A,MONTOYA-PEREZ R,SALGADO-GARCIGLIA R, et al.Oxidative stress and antioxidant response in a thermotolerant yeast[J].Braz J Microbiol,2017,48(1):936-940.
[26]温洪宇,史进,王璐.发酵醋醅酵母菌的分离、生长特性及分子鉴定[J].中国酿造,2013,32(2):48-52.
[27]NIU D,WANG L H,ZENG X A,et al.Effect of ethanol adaption on the inactivation of Acetobacter sp.by pulsed electric fields[J].Innov Food Sci Emerg Technol,2019,52:25-33.