食醋是饮食中占据主导地位的调味品,因微生物在开放环境下通过各种作用机制相互影响酿制而成[1-2]。早在春秋战国时期[3],就已经有了食醋的记载,当时,醋还被视为奢侈品[4],主要用于富贵人家的宴席,直到汉代醋的规模化生产才正式启动,等到唐代时,食醋被人们也逐渐发现了它的药用价值和保健功能[5-6]。小米醋作为食醋种类的一种,具有抑菌杀菌、软化血管、降低血压和预防心脏病的作用[7-8]。
食醋的发酵离不开各种微生物的协同作用,其中酵母菌是酒精发酵过程中的主要功能微生物,除产乙醇之外,还为其他菌种提供营养物质,提升食醋的风味和品质[9]。PARPINELL G P等[10]将筛选的耐低温酵母用于葡萄酒发酵生产,发现该菌株可降低挥发酸,提高多酚含量。冯涛等[11]从葡萄园土壤中分离筛选出4株酵母菌,经分子生物学鉴定得到3株酿酒酵母(Saccharomyces cerevisiae),1株异常威客汉逊酵母(Wickerhamomyces anomalus)S4。WANG C X等[12]根据啤酒酵母的基因型和在合成培养基中的发酵特性,首次筛选出6株耐葡萄糖、温度和SO2较高的本土酿酒酵母(Saccharomyces cerevisiae)。目前,针对酿酒酵母的筛选主要集中在白酒行业,在食醋中涉及较少,其对产品风味及稳定性具有重要作用,因此筛选发酵性能优良的酿酒酵母对稳定提升小米醋醋体品质具有重要意义。
本试验主要对山西襄汾小米醋发酵过程中的大曲、酒精发酵阶段酒醪进行酵母菌的分离筛选,并对其进行产酒、产酯能力及耐受性分析,并通过形态学观察、生理生化试验及分子生物学技术对优良酵母菌进行鉴定,并将其应用于小米醋制备。旨在提高小米醋醋体风格品质,解决小米醋醋体稳定性难以保障等问题,提供可靠思路及产业指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
大曲、酒醪:内蒙古盛谷酿造食品有限公司大曲取样8个,酒醪取样8个;山西襄汾三盛合小米醋酿造有限公司大曲取样8个,酒醪取样8个;商业酿酒酵母(Saccharomyces cerevisiae)(英纳帝斯酵母ENARTIS488):中国微生物菌种保藏中心。
1.1.2 化学试剂
淀粉酶(酶活5万U/mL)、糖化酶(酶活10万U/mL):河南庆飞食品配料有限公司;磷酸二氢钾、七水硫酸镁、葡萄糖、乳糖、麦芽糖、蔗糖(均为分析纯):天津市鑫铂特化工有限公司;酵母膏、酵母浸粉、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;硝酸钾、硝酸钠(均为分析纯):天津市北联精细化学品开发有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)固体培养基:酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖2 g/L,琼脂20 g/L,蒸馏水1 000 mL。121 ℃灭菌20 min。
YEPD液体培养基:酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,蒸馏水1 000 mL。121 ℃灭菌20 min。
无氮合成培养基:葡萄糖20 g/L,磷酸二氢钾1.5 g/L,七水硫酸镁0.5 g/L,酵母膏0.2 g/L,琼脂20 g/L,蒸馏水1 000 mL。115 ℃灭菌15 min。
氮源同化培养基:葡萄糖20 g/L,酵母膏0.2 g/L,七水硫酸镁0.5 g/L,磷酸二氢钾1.0 g,蒸馏水1 000 mL。115 ℃灭菌15 min。
发酵培养基:酵母膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,蒸馏水1 000 mL。115 ℃灭菌20 min。
1.2 仪器与设备
KG-SX-700立式压力蒸汽灭菌锅:上海莱睿科学仪器有限公司;CX23光学显微镜:奥林巴斯(中国)有限公司;HWS-250B电热恒温培养箱:天津市泰斯特仪器有限公司;XJ220A-SCS电子分析天平:上海天美天平仪器有限公司;LPH-A pH计:北京兰杰柯科技有限公司;TU1901双光束紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 酵母菌的分离纯化
大曲用研钵捣碎后常温储存、酒醅于4 ℃冰箱冷藏保存。称取10 g大曲或酒醅放入90 mL无菌生理盐水中,置于28 ℃、120 r/min充分振荡30 min。取1 mL菌液加入含有9 mL无菌生理盐水试管中,进行梯度稀释,吸取10-4~10-6的各梯度溶液0.2 mL涂布于含有2%脱氧胆酸钠溶液的YEPD固体培养基平板中,抑制霉菌生长。将平板置于30 ℃恒温培养箱中倒置培养48 h。待菌落长出后,挑选光滑、湿润、黏稠的优势酵母菌单菌落,进行2~3次分离纯化,对符合条件的单菌落进行编号,并转移到斜面培养基上,于4 ℃冰箱中保存备用。同时将纯化后的酵母菌与30%甘油1∶1混合,存放在2 mL的EP管中,保存于-80 ℃冰箱[13]。
1.3.2 优良酵母菌的鉴定
形态学观察:将筛选酵母菌株在YEPD固体培养基上划线,并置于28 ℃条件下培养48 h。培养结束后,观察并记录其菌落特征。在载玻片上滴加一滴蒸馏水,用无菌接种环挑取在YEPD固体培养基上培养48 h的酵母菌在蒸馏水中,盖上盖玻片于显微镜下观察其细胞形态。
生理生化试验:碳源同化、氮源同化试验参照杨惠婷等[14-15]。
分子生物学鉴定:利用乙醇沉淀法提取酵母菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,选用通用引物ITS1F1(5'-TCC GTA GGT GAA CCT GCG G-3')和ITS4R4(5'-TCC TCC GCT TAT TGA TAT GC-3'),通过聚合酶链反应(polymerase chain reaction,PCR)扩增菌株26S rDNA基因并测序。PCR扩增体系(50 μL):模板2 μL,2×Taq Mix25 μL,引物ITS5(10 pmol/L)1 μL,引物ITS4(10 pmol/L)1 μL,双蒸水(ddH2O)21 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性10 s,53 ℃退火10 s,72 ℃延伸45 s,35个循环;72 ℃再延伸5 min。采用1%琼脂糖凝胶电泳对PCR扩增产物检测合格后委托北京颇凡森诺生物科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,利用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源序列比对,获取同源性较高的模式菌株的26S rDNA基因序列,采用MEGA11.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.3 筛选酵母菌发酵性能测定
从斜面挑取一环菌于1.5 mL的YEPD液体培养基中,将其于30 ℃、150 r/min振荡培养36 h后,将其转移到装液量为100 mL/250 mL YEPD液体培养基中,在30 ℃、150 r/min继续振荡培养36 h,即为种子液。按照10%(V/V)的比例将种子液接种到装液量为100 mL/250 mL发酵培养基中,使用8层纱布进行初步封口,确保培养环境的透气性,于30 ℃、150 r/min条件下培养24 h后,为保持发酵过程无氧环境,再用保鲜膜封口无氧发酵7 d,测定筛选菌株产酒及产酯能力。
1.3.4 筛选酵母菌耐受性测定
将产醇、产酯高的菌株接种于YEPD液体培养基活化,以2%(V/V)接种量分别接种于体积分数为5%、7%、9%、11%、13%的无水乙醇,pH值为2.0、2.5、3.0、3.5、4.0的稀盐酸,质量浓度为100 g/L、200 g/L、300 g/L、400 g/L、500 g/L葡萄糖的10 mL YEPD液体培养基中,于30 ℃、150 r/min振荡培养24 h,在波长600 nm处测定吸光度值,每个菌种3次重复,以商业酿酒酵母作为对照,灭菌YEPD液体培养基作为空白[16-17],考察筛选菌株的耐受性。
1.3.5 筛选菌株应用于小米醋制备酒精发酵
菌种活化:将前期筛选得到的酵母菌优良菌株于YEPD液体培养基中活化,于28 ℃、150 r/min振荡培养24h,得到菌株活化液。取适量活化菌液于5000r/min条件下离心5 min,收集菌体,弃上清液,加入等量的生理盐水重悬菌体第一次,混匀后再次于5 000 r/min条件下离心5 min,弃上清液,再次用等量生理盐水重悬菌体第二次,混匀,调整细胞浓度约1×106~1×108 CFU/mL时,得到菌株种子液,备用。
小米醋的制备:称取定量小米,将小米和水以料液比1∶3(g∶mL)混合,升温至95 ℃时加入淀粉酶液化30 min,待自然降温到60 ℃,加入糖化酶糖化,得到小米糖化醪。将糖化醪灭菌后装于2 000 mL广口瓶内,待温度降到35 ℃左右时,将菌株种子液以10%接种量进行接种,用单层无菌纱布覆盖瓶口,通气发酵1 d,之后用玻璃塞及保鲜膜封口,在发酵期间每隔24 h采集样品,测定其还原糖及酒精度含量变化,直至还原糖含量下降,酒精度趋于平稳发酵结束。酒精发酵结束后,过滤发酵米酒醪以去除残渣,调整至合适的酒精度后,加入活化好的醋酸菌悬液。在30 ℃、170 r/min条件下摇床培养,直到酸度达到4~7 g/100 mL。最后,添加2%NaCl终止醋酸发酵,通过淋醋、杀菌得到成品小米醋。
1.3.6 分析检测
(1)理化指标
酒精度测定:参照GB/5009.225—2023《酒和食用酒精中乙醇浓度的测定》[18];总酯、还原糖测定:参照GB/T 19777—2013《地理标志产品山西老陈醋》[19]。
(2)感官评价
小米醋的感官评价参照魏雪鼎等[20-21]的方法,满分100分,感官评价标准见表1。
表1 小米醋感官评价标准
Table 1 Sensory evaluation standards of millet vinegar

项目 评价标准 评分/分色泽(20分)香气(30分)色泽均匀,有光泽色泽较均匀,光泽欠佳色泽不均匀清香协调,无异味香气较浓或较淡,无异味香气较浓或较淡,有异味18~20 12~17 0~11 25~30 20~24 0~19
续表

项目 评价标准 评分/分口味(30分)体态(20分)酒味浓厚,酒体完整酒味较淡薄酒味淡薄质地均匀,酒醪清澈质地均匀,酒醪较清澈酒醪不清澈25~30 20~24 0~19 15~20 9~14 0~8
1.3.7 数据处理
每个试验平行3次,利用Excel 2019、Origin7.5软件进行数据处理和作图,数据结果以“平均值±标准差”表示。
2 结果与分析
2.1 酵母菌的分离筛选
从内蒙古及山西地区大曲及酒醅样品中共分离纯化出24株酵母菌,其中从内蒙古大曲中共分离出10株酵母菌,分别编号为QR01、QR02、QR08、QR09、QY10、QY11、QY13、QY14、SY18、SY21,从内蒙古酒醪中共分离出3株酵母菌,分别编号为QJ05、QJ06、QJ07;从山西大曲中共分离出8株酵母菌,分别编号为SX03、SX04、SX12、SH22、SH24、YC19、YC20、YC23,从山西酒醪中共分离出3株酵母菌,分别编号为SJ15、SJ16、SJ17。
2.2 筛选菌株的菌落及细胞形态
24株分离菌株中代表菌株的菌落形态和细胞形态见图1。由图1可知,筛选酵母细胞形态主要为圆形、椭圆形、卵圆形等,繁殖方式均为芽殖,且为多端出芽,菌落呈乳白色,表面粗糙,不易挑取。
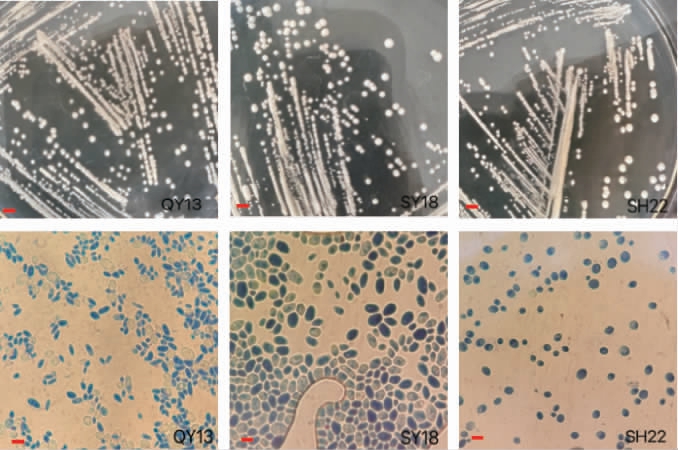
图1 代表菌株菌落及细胞形态
Fig.1 Colony and cell morphology of representative strains
2.3 筛选菌株生理生化试验
筛选酵母菌生理生化试验结果见表2。由表2可知,在碳源同化试验中,所有菌株均可利用葡萄糖发酵;除菌株QR01外,所有菌株对乳糖不利用;除菌株QR01、SX04、QJ05、QR09、QY11、SJ15、SY18不利用蔗糖,其余菌株均可综合利用蔗糖产生气体;菌株QR01、QR02、SX03、QR08、SX12、QY13、QY14、YC19、YC20、SY21、SH22、SH24麦芽糖试验结果为阳性,其余菌株均不利用麦芽糖发酵。除此之外,菌株SX04、QJ05、QR09、QY11、SJ15、SY18只利用葡萄糖,其余糖类均不利用。在氮源同化试验中,菌株QR01、QR02、QY10、QY11、QY14、SJ17、YC19、SY20、SY21、YC23、SH24均可同化硝酸钾和硝酸钠;除菌株SX03、SX04、QJ06、QJ07、QR08、QR09、SX12、SJ15、SJ16、YC20不能同化硝酸钾外,其余菌株均能同化硝酸钾;菌株QR02、QY10、QY11、QY14、SJ15、SJ16、SJ17、SY18、YC19、SY21、YC23、SH24均能同化硝酸钠,其余菌株不同化。综合以上生理生化试验结果,对照《酵母菌特征与鉴定手册》[22]和《真菌鉴定鉴定手册》[23]初步断定24株菌为酵母菌属(Saccharomyces sp.)。
表2 筛选菌株生理生化试验结果
Table 2 Physiological and biochemical experiment results of screened strains
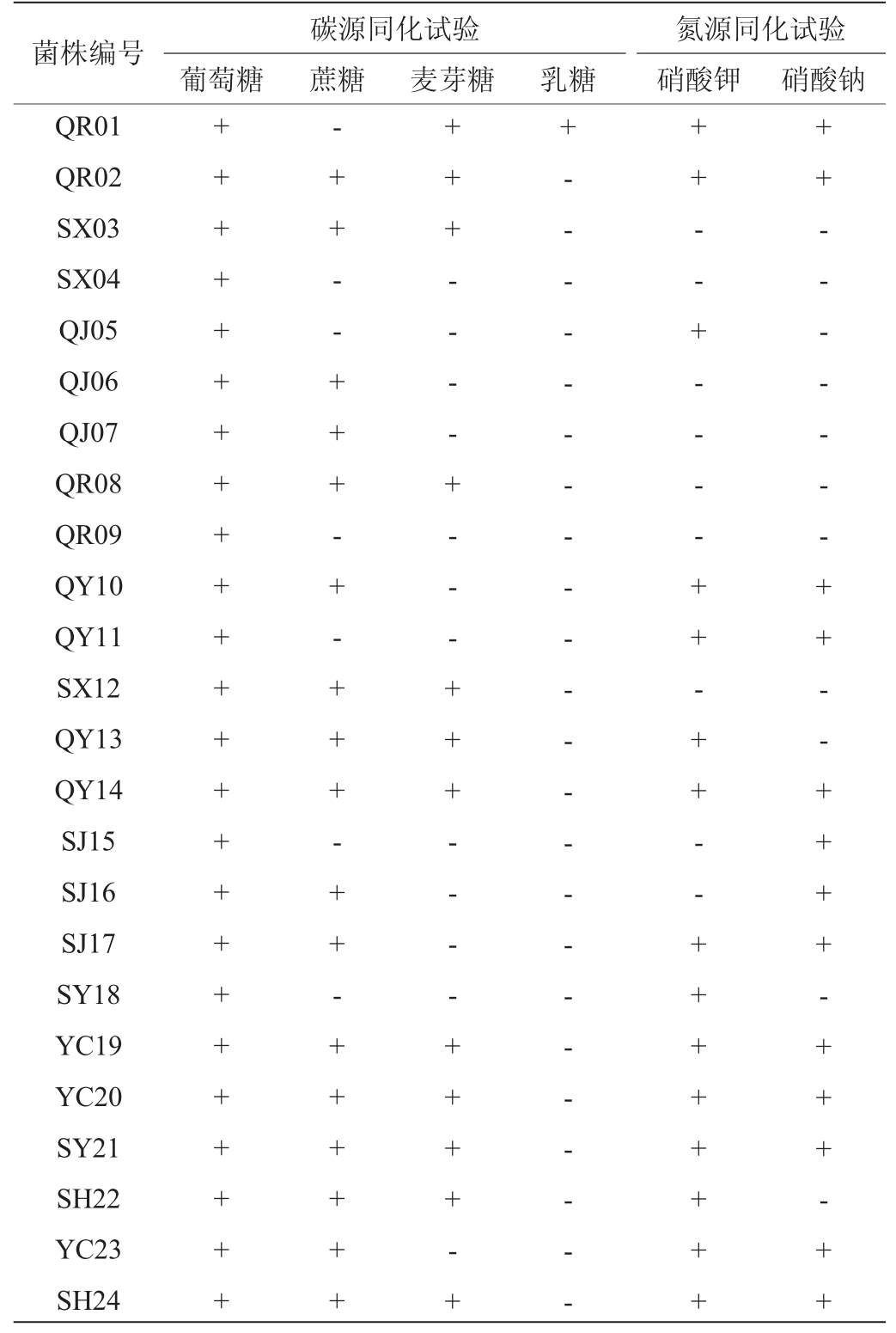
注:“-”表示结果呈阴性;“+”表示结果呈阳性。
菌株编号QR01 QR02 SX03 SX04 QJ05 QJ06 QJ07 QR08 QR09 QY10 QY11 SX12 QY13 QY14 SJ15 SJ16 SJ17 SY18 YC19 YC20 SY21 SH22 YC23 SH24碳源同化试验葡萄糖 蔗糖 麦芽糖乳糖氮源同化试验硝酸钾 硝酸钠++++++++++++++++++++++++-+ + - - + + + - + - + + + - + + - + + + + + +++ + - - - - + - - - + + + - - - - + + + + - ++- - - - - - - - - - - - - - - - - - - - - - -++ - - + - - - - + + - + + - - + + + + + + + +++ - - - - - - - + + - - + + + + - + + + - + +
2.4 筛选酵母菌发酵性能
筛选酵母菌产酒精及产酯能力测定结果见图2。由图2a可知,24株菌产酒精能力在1.8%vol~7.0%vol之间,菌株QR01、QJ05、QY10、QY11、SX12、QY13、SY18、SY21、SH22及对照菌产酒能力较强,为6.3%vol~7.0%vol之间,其中菌株QY10、QY11与QR01、QJ05产酒能力存在显著差异(P<0.05);菌株SX03、SX04、QJ06、QJ07、SJ15、YC19、YC23产酒能力适中,为4.5%vol~5.6%vol之间,其中菌株YC19、YC23与SX03、SX04、QJ06、QJ07、SJ15产酒能力存在显著差异(P<0.05);菌株QR02、QR08、QR09、QY14、SJ16、SJ17、YC20、SH24产酒能力差,产酒低于4.0%vol,其中菌株QR02、QR08、QR09之间产酒能力差异不显著(P>0.05)、菌株QY14与其余产酒能力差的菌株之间差异显著(P<0.05)。该结果与王媛慧等[24-25]相比,本研究有6株菌产酒能力达到6.4%vol以上,产酒能力较优。
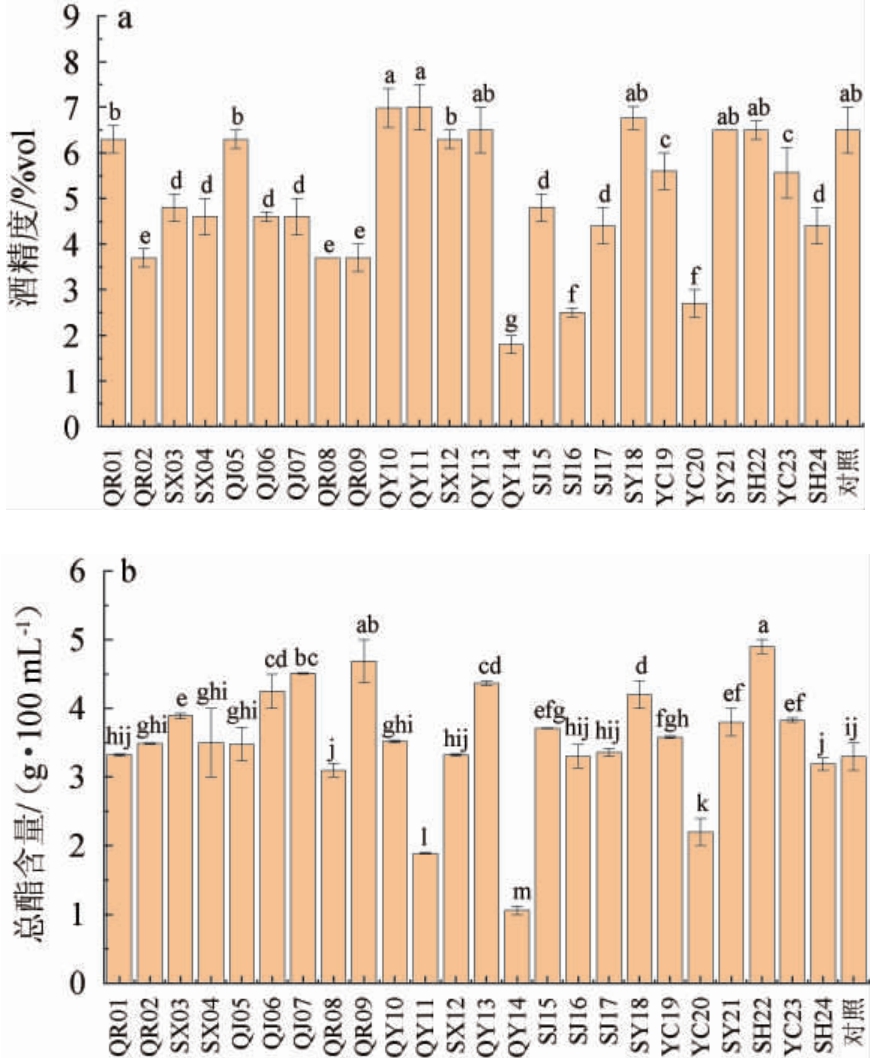
图2 筛选酵母菌产酒精(a)及产酯(b)能力测定结果
Fig.2 Determination results of alcohol (a) and ester (b) production capacities of screened yeasts
不同小写字母表示差异显著(P<0.05)。
在酒精发酵过程中,酵母菌不仅将糖类转化为酒精,同时生成多种风味物质,对最终品品质起着关键作用[26-27]。由图2b可知,24株菌产酯能力为1.06~4.90 g/100 mL,菌株QJ06、QJ07、QR09、QY13、SY18、SH22产酯能力较强,分别为4.25 g/100 mL、4.51 g/100 mL、4.69 g/100 mL、4.37 g/100 mL、4.20 g/100 mL、4.90 g/100 mL,其中菌株SY18、SH22与其余4株产酯能力强的菌株存在显著性差异(P<0.05);菌株QR01、QR02、SX03、SX04、QJ05、QY10、SX12、SJ15、SJ17、YC19、SY21、YC23产酯能力适中,为3.89~3.32 g/100 mL,其中菌株QR01、SX12、SJ17之间;QR02、SX04、QJ05、QY10之间;SY21、YC23之间产酯能力差异不显著(P>0.05);菌株QR08、QY11、QY14、SJ16、YC20、SH24及对照菌产酯能力差,产酯能力低于3.30 g/100 mL,其中菌株SJ16、对照菌与其余5株产酯能力差的菌株存在显著性差异(P<0.05)。该结果与于迪等[28-29]研究结果相比,该研究有7菌株产酯能力在质量浓度4.10 g/100 mL以上,表明所筛菌株产酯能力较好。
结果表明,菌株QR01、QJ05、QY10、QY11、SX12、QY13、SY18、SY21、SH22产酒能力较强,菌株QJ06、QJ07、QR09、QY13、SY18、SH22产酯能力突出,可用于后续试验研究。
2.5 筛选酵母菌环境耐受性
醇类会影响酵母相关膜及代谢通道的稳定性,阻碍酵母生长和糖利用能力[30-31]。由图3a可知,随着乙醇体积分数的增加,各菌株OD600 nm值呈下降趋势。在乙醇体积分数为5%~7%时,除菌株QJ07、QR09外,其余菌株生长较好;当乙醇体积分数升至9%时,除菌株QJ06、QY13、SY18、SH22及对照菌外,各菌株基本停止生长,OD600 nm值分别为0.23、0.27、0.17、0.26、0.28、0.30、0.29、0.30;当乙醇体积分数为11%时,菌株QJ06及对照菌生长开始下降;OD600nm值分别为0.32、0.64,乙醇体积分数达到13%时,菌株QY13、SY18及SH22较其他筛选菌株及对照菌生长较好,OD600nm值分别为0.69、0.73、0.72,高浓度酒精对其影响较小,表现出较好的酒精耐受性。与毛祥等[32]研究结果相比,本研究中有3株菌能耐受乙醇体积分数13%,所筛菌株耐酒精能力更强。

图3 筛选酵母菌乙醇(a)、酸(b)及葡萄糖(c)耐受性
Fig.3 Ethanol (a), acid (b) and glucose (c) tolerance of screened yeasts
作为合成酯类物质的底物,酒醪的酒精和醋醅中酸类物质对酵母菌的生长代谢和生物活性有重要作用,能影响细胞间的代谢传递及酶活性,在较低或较高的pH值下会影响酵母菌的生长代谢能力[33]。由图3b可知,随着pH值不断降低,12株菌OD600nm值均呈现下降趋势。在pH值为3.5时,菌株QJ07、QR09基本停止生长,OD600nm值为0.38、0.54;当pH值为2.5时,菌株QR01、QJ05、QJ06、QY10、QY11、SX12、SY21及对照菌基本停止生长,OD600 nm值分别为0.53、0.65、0.59、0.65、0.50、0.53、0.67、0.65,而菌株QY13、SY18、SH22在pH值为2.5的酸性条件下,OD600nm值仍达到0.83、0.84、0.91,优于对照菌及其他筛选菌株;pH值为2.0时,所有菌株均停止生长。本研究所筛菌株QY13、SY18、SH22与蒋羽柔等[34]研究结果相似,所筛菌株适用于大曲、酒醪中偏酸的发酵环境。
糖类是酵母增殖发酵所必需营养物质,在酒精发酵过程中,如果发酵醪液的糖度过高,将会导致酵母菌细胞失水,进而破坏其细胞结构,引发体内酶活性丧失,抑制酵母菌生长和发酵[35]。由图3c可知,随着葡萄糖含量的不断升高,所有菌株生长开始呈下降趋势。在葡萄糖为300 g/L,所有菌株均呈现较好的生长情况;当葡萄糖含量为400 g/L时,QJ05、QJ07、QR09、QY10、QY11基本停止生长,OD600 nm值分别为0.52、0.47、0.52、0.55、0.64;葡萄糖含量为500 g/L时,菌株QR01、QJ06、SX12、SY21及对照菌生长受到抑制,而菌株QY13、SY18、SH22在500 g/L葡萄糖下仍表现出较强的耐受性,OD600nm值仍分别高达0.88、0.95、0.89。
结果表明,菌株QY13、SY18、SH22 的耐受性较优,可耐受乙醇体积分数13%、pH值2.5、葡萄糖质量浓度500 g/L。因此,确定 菌株QY13、SY18、SH22为优良酵母菌,进行进一步鉴定。
2.6 优良酵母菌的分子生物学鉴定
将菌株QY13、SY18和SH22的序列结果上传到NCBI数据库进行相似度对比,基于26S rDNA基因序列构建菌株QY13、SY18和SH22系统发育树,结果见图4。由图4可知,3株菌与序列号NG_063315.1的Saccharomyces cerevisiae展现出最高的相似性,菌株QY13、SY18及SH22与酿酒酵母(Saccharomyces cerevisiae)序列同源性相比较,亲缘性最近,序列相似度达到98%以上。因此,菌株QY13、SY18和SH22均被鉴定为酿酒酵母(Saccharomyces cerevisiae)。
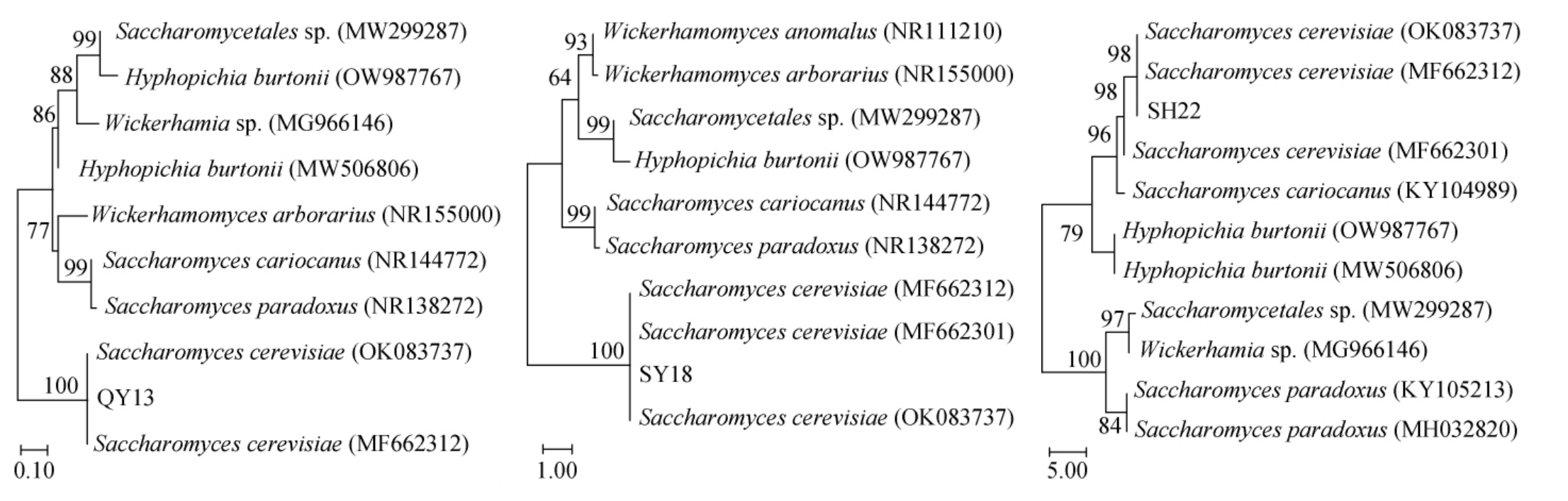
图4 基于26S rDNA基因序列构建菌株QY13、SY18及SH22系统发育树
Fig.4 Phylogenetic tree of strains QY13, SY18 and SH22 based on 26S rDNA gene sequence
2.7 优良酵母菌在小米醋制备酒精发酵中的应用
还原糖的变化可以反映酒精发酵的发酵状态。将前期筛选鉴定得到的酿酒酵母QY13、SY18、SH22应用于小米醋酒精发酵中,还原糖及酒精度变化结果见图5。
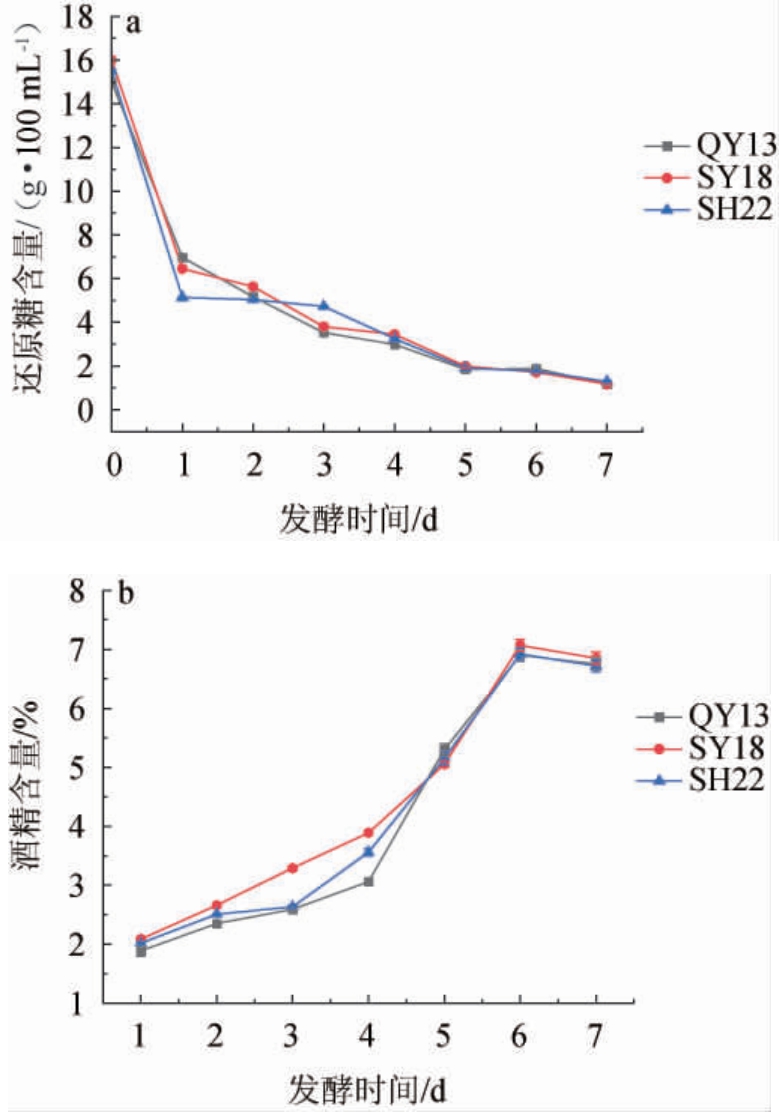
图5 菌株QY13、SY18、SH22发酵醪液中还原糖(a)及酒精度(b)变化
Fig.5 Changes of reducing sugar (a) and alcohol content (b) in mash fermented by strains QY13, SY18 and SH22
由图5a可知,0 d时酿酒酵母QY13、SY18及SH22发酵醪液中初始还原糖含量分别为15 g/100 mL、16 g/100 mL、15.5 g/100 mL。随着发酵进行,由于酒精发酵时大量酵母菌生长繁殖消耗糖类物质转为乙醇而使其含量降低。2 d后酿酒酵母QY13、SY18及SH22发酵醪液中还原糖含量整体呈现下降趋势,发酵7 d时酿酒酵母QY13、SY18及SH22发酵醪液中还原糖含量分别降低到1.12 g/100 mL、1.16g/100mL、1.25 g/100 mL。
通过测定酒精浓度及变化情况可以有效地反映发酵状态及发酵程度。由图5b可知,随着发酵进行,酿酒酵母QY13、SY18及SH22发酵醪液中酒精度逐渐增加,发酵6 d 时酒精度达到最高,分别为6.90%vol、7.07%vol、6.92%vol。发酵6 d后酒精度有所降低,考虑原因为随着发酵时间延长,发酵液中还原糖含量相对较少,导致糖转化酒精度有限,致使酒精含量降低。此外,酿酒酵母SY18发酵醪液中酒精度在整个酒精发酵阶段相对于酿酒酵母QY13 和SH22要高,在发酵结束时,酒精度仍为6.27%vol。
结果表明,酒精发酵阶段通过接种酿酒酵母QY13、SY18、SH22有利于还原糖的大量消耗,提升产酒效率,降低发酵时间。
2.8 优良酵母菌应用于小米醋制备酒精发酵阶段感官评价结果
3株酿酒酵母应用于小米醋制备酒精发酵阶段,小米醋的感官评价结果见图6。
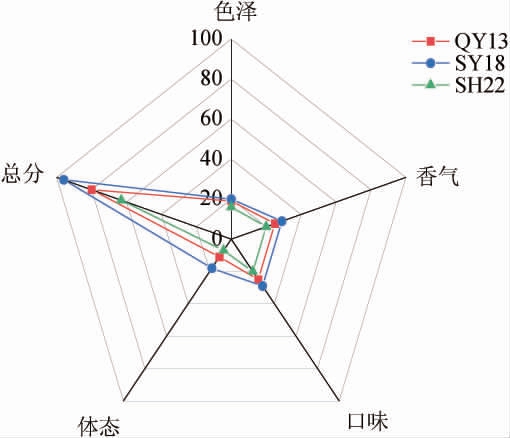
图6 不同菌株制备小米醋感官评价雷达图
Fig.6 Sensory evaluation radar map of millet vinegar prepared by different strains
由图6可知,其中酿酒酵母SY18、QY13、SH22应用于酒精发酵制备小米醋感官评分分别为95分、85分、80分。在香气、口味、体态方面,酿酒酵母SY18发酵酒液制备小米醋最优,整体香气协调,酒味浓厚。综上,酿酒酵母SY18能够丰富小米醋香气,提升感官品质。
3 结论
本研究从小米醋大曲及酒醅样品中分离得到24株菌,经过发酵性能及耐受性试验筛选得到3株优良酵母菌QY13、SY18、SH22,其可耐受乙醇体积分数13%、pH 2.5及500 g/L葡萄糖。经分子生物学鉴定这3株菌均为酿酒酵母(Saccharomyces cerevisiae)。其中酿酒酵母SY18在小米醋酒精发酵过程中较酿酒酵母QY13、SH22产酒能力高,醪液酒精度为7.07%vol,其制备小米醋感官评分为95分。
本研究从小米醋发酵过程样品中筛选出一株发酵性能优良、产酒能力较强的酿酒酵母菌SY18,后续可深入研究酿酒酵母在酒精发酵阶段的微生物群落变化以及对风味形成机制的影响,研发适用于小米醋的优良酵母菌株发酵剂,拓展其应用前景。
[1]JIANG Y J, LV X C, ZHANG C, et al.Microbial dynamics and flavor formation during the traditional brewing of Monascus vinegar[J].Food Res Int,2019,125:108531.
[2]FAN S W,PAN T H,LI G Q.Evaluation of the physicochemical content and solid-state fermentation stage of Zhenjiang aromatic vinegar using near-infrared spectroscopy[J].Int J Food Eng,2020,16(12):0127.
[3]白仁杰.历史、传说与象征符号:山西醋文化研究[J].贵阳:贵州师范大学,2018.
[4]朱瑶迪,邹小波,石吉勇,等.镇江香醋固态发酵过程分析[J].中国食品学报,2014,14(8):256-261.
[5]邵向丽,赵爽,刘书亮,等.四川麸醋醋醅中优良醋酸菌的筛选及其产酸特性[J].食品工业科技,2015,36(6):203-207.
[6]邓朝霞.永春老醋发酵过程中有机酸和生物胺变化分析及其细菌菌群结构分析[D].福州:福建师范大学,2014.
[7]PENG M Y,ZHANG X J,HUANG T,et al.Komagataeibacter europaeus improves community stability and function in solid-state cereal vinegar fermentation ecosystem: Non-abundant species plays important role[J].Food Res Int,2021,150:110815.
[8]文明.小米绿豆醋酿造工艺研究[D].晋中:山西农业大学,2022.
[9]LIU N,MIAO S,QIN L K.Screening and application of lactic acid bacteria and yeasts with L-lactic acid-producing and antioxidant capacity in traditional fermented rice acid[J].Food Sci Nut,2020,8(11):6095-6111.
[10]PARPINELL G P,RICCI A,FOLEGATTII B,et al.Unraveling the potential of cryotolerant Saccharomyces eubayanus in Chardonnay white wine production[J].LWT-Food Sci Technol,2020,134:110183.
[11]冯涛,王旭增,王一非,等.葡萄园土壤中酿酒酵母的分离鉴定及其发酵葡萄酒香气成分分析[J].食品科学,2018,39(14):213-220.
[12]WANG C X,LI S Y,YANG J X, et al.The impact of indigenous Saccharomyces cerevisiae and Schizosaccharomyces japonicus on typicality of crystal grape(Niagara)wine[J].Food Res Int,2022,159:111580.
[13]舒学香,周文,吴霞,等.猕猴桃果酒酿造专用酵母菌株的筛选[J].中国酿造,2021,40(8):99-104.
[14]杨惠婷.浙江地区酿酒酵母的优选鉴定及发酵特性的研究[D].呼和浩特:内蒙古农业大学,2022.
[15]郑树炀.山河陈醋酒精发酵菌群研究及工艺优化[D].晋中:山西农业大学,2018.
[16]谭川川,何劲,魏雨萌,等.一株耐单宁酵母菌的筛选、鉴定及发酵特性[J].食品与发酵工业,2023,49(15):47-53.
[17]宋佳佳.苏皖地区酿酒酵母的筛选鉴定及其发酵特性研究[D].呼和浩特:内蒙古农业大学,2022.
[18]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 5009.225—2023 食品安全国家标准酒和食用酒精中乙醇浓度的测定[S].北京:中国标准出版社,2023.
[19]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 19777—2013 地理标志产品山西老陈醋[S].北京:中国标准出版社,2013.
[20]魏学鼎,孙文超.酿酒酵母的筛选及其发酵性能应用研究[J].粮食与油脂,2024,37(3):117-121,153.
[21]包怡红,梁爽,骆嘉原.蓝靛果果酒降酸酵母菌的筛选鉴定及其发酵特性[J].现代食品科技,2424,40(9):74-86.
[22]巴尼特,胡瑞卿.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:20-24.
[23]WEI J C.真菌鉴定手册[M].青岛:青岛海洋大学出版社,1979:102-117.
[24]王媛慧.山西老陈醋大曲中优良酵母菌的分离鉴定及发酵应用研究[D].晋中:山西农业大学,2014.
[25]赵广河,胡梦琪,陆玺文,等.桃金娘果酒酵母菌的筛选鉴定及生长特性分析[J].中国酿造,2023,42(9):103-108.
[26]彭东,蒋雪薇,陈幽,等.高盐稀态酱醪中耐盐生香酵母的筛选及生香特性研究[J].食品与发酵工业,2020,46(13):76-84.
[27]STEENSELS J,MEERSMAN E,SNOEK T,et al.Large-scale selection and breeding to generate industrial yeasts with superior aroma production[J].Appl Environ Microbiol,2014,80(22):6965-6975.
[28]于迪.山西老陈醋优良菌株的筛选及原位强化发酵工艺研究[D].晋中:山西农业大学,2018.
[29]袁英豪,何梦娇,唐春麟,等.醋源生香酵母的筛选及其特性研究[J].食品与发酵工业,2024,50(15):63-71.
[30]ISHMAYANA S,KENNEDY U J,LEARMONTH R P.Further investigation of relationships between membrane fluidity and ethanol tolerance in Saccharomyces cerevisiae[J].World J Microbiol Biotechnol,2017,33(12):218.
[31]QIU Z L,JIANG R R.Improving Saccharomyces cerevisiae ethanol production and tolerance via RNA polymerase II subunit Rpb7[J].Biotechnol Biofuels,2017,10:125.
[32]毛祥,夏玙,张芸曌,等.四川麸醋曲药中酵母菌的分离鉴定及发酵特性[J].食品科学技术学报,2018,36(6):21-27.
[33]王辉,袁婷玉,白卫东,等.青梅自然发酵液中酵母菌的分离鉴定及特性研究[J].食品科技,2021,46(8):16-21.
[34]蒋羽柔,蔡建,高秀,等.云南杨梅发酵液中酵母菌筛选及耐受性研究[J].中国酿造,2024,43(3):145-150.
[35]冯莉,陈雪,李丽,等.5株克鲁维毕赤酵母的酿造学特性[J].中国食品学报,2018,18(12):66-73.