百香果(Passiflora edulis)俗称“鸡蛋果”,是西番莲科、西番莲属的一种多年生草质至半木质藤本攀附果树,在我国气候温暖的广西、云南等地有大规模种植[1]。百香果富含各种营养成分,如维生素、有机酸、花色苷、黄酮类物质、果胶等[2-5],具有抗炎、抗氧化、降血糖和抗焦虑等保健功效[6-9]。百香果果皮占整个鲜果质量的50%以上,目前对百香果的加工集中在果肉,大多数果壳会在果肉利用完后被丢弃,造成了极大的资源浪费和环境污染[10],因此,将百香果果皮应用于果酒酿造,可充分利用果壳废弃物,提高百香果的经济价值,增加企业经济效益。
果酒是以新鲜水果为原料,通过酵母菌发酵生产的一种新型健康饮品,近些年呈快速增长态势,逐渐成为研究热点[11-14]。由于百香果果皮中含有丰富的果胶,需要在酿酒时添加果胶酶提高出汁率,而在酿酒过程中果胶酶的分解会产生大量甲醇,会严重影响人们的身体健康[15]。有研究表明,人体摄入过多甲醇会造成视神经细胞损伤,摄入超过12.5 g就足以致命[16-17]。因此,获得低甲醇含量的果酒对于提升果酒品质和安全性具有重要意义。如今,对于果酒中甲醇含量控制的研究主要集中于原料的处理及发酵工艺的优化[18-19]。影响果酒风味和理化性质的关键要素是菌种[20],而目前市场上能够降低酿酒过程中甲醇含量的酵母菌种类较少,所以选择性能优良的酵母菌及良好的发酵工艺条件对提高果酒的产量和品质极为重要。
因此,本研究以果园土壤、新鲜百香果、百香果自然发酵液以及腐烂百香果等为材料,从中分离筛选具有低甲醇含量发酵性能适合百香果果皮发酵的酵母菌,并通过形态学观察及分子生物学技术对其进行菌种鉴定,为开发一款低产甲醇的百香果果酒产品提供科学指导和理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
新鲜百香果、腐果下的土壤、腐果附近的土壤、腐烂根部、新翻耕土壤及田埂中的土壤:桂林万禾农产品有限公司百香果种植基地。
1.1.2 试剂
葡萄糖、蔗糖、硫酸镁、硼酸、无水乙醇、磷酸氢二钾、偏重亚硫酸钠、乙二胺四乙酸二钠(均为分析纯):西陇科学股份有限公司;氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)、氯霉素(均为分析纯)、叔戊醇、甲醇、乙醇(均为色谱纯):上海易恩化学技术有限公司;酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:上海尚宝生物科技有限公司;SanTaq Plus聚合酶链式反应(polymerase chain reaction,PCR)扩增试剂盒:上海生工生物工程股份有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)液体培养基:参考伍鹤等[21]的方法并稍作修改,取200 g土豆切碎,加蒸馏水约1 L,煮沸20 min,16层纱布过滤,于滤液中加20 g葡萄糖,氯霉素0.1 g,加蒸馏水定容至1 L。PDA固体培养基:PDA液体培养基中加入2%的琼脂粉,121 ℃高压蒸汽灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体(固体)培养基:参考王犁烨等[22]的方法并稍作修改,添加0.1 g/L的氯霉素。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
LRH-250-Z型振荡培养箱:韶关市泰宏医疗器械有限公司;ZWY-2102C型恒温培养振荡器、ZHJH-C112C型超净工作台:上海智城分析仪器制造有限公司;BXM-30R型立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;GC1690型气相色谱仪:杭州捷岛科学仪器有限公司;2720 Thermal cycler PCR仪:沐滕实验设备(上海)有限公司;VIS-7220N可见光分光光度计:北京瑞利分析仪器有限公司。
1.3 方法
1.3.1 酵母菌的分离
百香果果园土壤中酵母菌的分离:称取1 g腐果下的土壤、腐果附近的土壤、新翻耕土壤及田埂土壤分别加入500mL PDA液体培养基中,28 ℃、120 r/min条件下培养48 h;挑取杯壁上的白色菌落及菌悬液,划线于PDA固体培养基,28 ℃条件下培养48 h,挑取形态不同的酵母菌划线于PDA固体培养基平板,28 ℃条件下培养48 h后,挑取单菌落纯化后进行保藏。
新鲜百香果果皮中酵母菌的分离:称取10 g新鲜百香果果皮加入200 mL YPD液体培养基中,28 ℃、120 r/min条件下富集培养48 h;取0.1 mL富集液涂布于YPD固体培养基平板,28 ℃条件下恒温培养48 h,挑取单菌落纯化后进行保藏。
百香果发酵液中酵母菌的分离:称取100 g新鲜百香果,加200 mL水打成浆,置于28 ℃恒温培养箱自然发酵1周;1周后发酵醪液中产生很多气泡并伴随有淡淡酒香味,挑取不同白色菌落划线于YPD固体培养基平板,28 ℃条件下静置培养48 h后,挑取单菌落纯化后进行保藏。
腐烂百香果中酵母菌的分离:新鲜百香果放置至表面长白色菌落并镜检为酵母后,挑取不同白色菌落划线于YPD固体培养基平板,28 ℃条件下静置培养48 h,挑取单菌落纯化后进行保藏。
新鲜百香果果汁中酵母菌的分离:取新鲜百香果果肉,研磨,过滤,取0.1 mL涂布于YPD固体培养基平板上,28 ℃条件下静置培养48 h,挑取单菌落纯化后进行保藏。
腐烂根部酵母菌的分离:将长有白色菌落的百香果根部剪碎,放入100 mL YPD液体培养基中,于28 ℃、150 r/min条件下振荡培养48 h,取1环菌液划线于YPD固体培养基平板,于28 ℃条件下静置培养48 h,挑取单菌落纯化后进行保藏。
1.3.2 优良酵母菌菌株的筛选
(1)产酒精能力及产气性能比较
参考李凯等[23]的方法,对分离得到的菌株进行TTC平板筛选及产气性能比较,显色越深,表明菌株产酒精能力越强;产气量越大,表明菌株的发酵能力越强。通过观察培养基上显色部位颜色的深浅及杜氏小管发酵产气速度和产气量,筛选出发酵能力强的酵母菌。
(2)发酵力比较
挑取筛选菌株接种于YPD液体培养基中,于28 ℃条件下培养24 h,制备种子液。将百香果果皮粉碎后,加入1.5倍质量的蒸馏水进行榨汁得到百香果果汁。取80 mL百香果果皮汁加入100 mL三角锥形瓶中,置于87 ℃水浴锅杀菌10 min,冷却至30 ℃左右,按3%(V/V)的接种量分别接种筛选酵母菌的种子液,密封,称质量,置于20 ℃条件下发酵;发酵过程每隔12 h测定1次质量,直至质量损失<0.2 g,即表示发酵结束。以发酵时间为横坐标,CO2质量损失为纵坐标,绘制发酵力曲线,确定菌株发酵力强弱。
(3)耐受性能分析
参考董琦楠等[24]的方法分析筛选菌株的耐受性,并做部分调整。高糖耐受试验:将已排空气泡的杜氏小管置于含24%、28%、30%葡萄糖的YPD液体培养基中,并以5%(V/V)的接种量接种筛选酵母菌的种子液,28 ℃、120 r/min条件下培养1周后观察杜氏小管产气量。乙醇耐受性试验:将筛选得到的酵母菌种子液以5%(V/V)的接种量,分别接种于乙醇体积分数分别为6%、9%、12%的100 mL YPD液体培养基中,28 ℃、120 r/min条件下培养4 d,并且每12 h测定菌液在波长600 nm处的吸光度值。
1.3.3 低产甲醇酵母菌菌株的筛选
参照文献[25],采用筛选得到的酵母菌株酿造百香果果皮果酒,参考GB 5009.266—2016《食品安全国家标准食品中甲醇的测定》[26]和GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》[27]分别测定百香果果皮果酒中的甲醇和乙醇含量,筛选低产甲醇的酵母菌。
1.3.4 优良酵母菌菌株的鉴定
形态学观察[28]:将优良酵母菌菌株划线接种于YPD固体培养基上,28 ℃条件下静置培养48 h,观察菌落形态;挑取YPD固体培养基上单菌落,使用美兰染液对单菌落进行染色,在光学显微镜下观察其形态,对菌株进行初步形态学鉴定。
分子生物学鉴定:参照酵母基因组DNA提取试剂盒说明书提取优良酵母菌菌株的基因组DNA,以其为模板,采用引物N1(5'-GCATATCAATAAGCGGAGGAAAA-3')和N4(5'-GCTCCGTGTTTCAAGACGG-3')PCR扩增26S rDNA D1/D2区基因序列,PCR扩增体系:2×Taq PCR MasterMixII 10 μL,引物N1、N4各0.5 μL,DNA模板2 μL,用双蒸水(ddH2O)补足至20 μL。PCR扩增参数:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸45 s,共35个循环;72 ℃再延伸5 min;4 ℃保存。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,委托生工生物工程(上海)技术服务有限公司进行测序。将测序获得的26S rDNA D1/D2区基因序列提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索,选取同源性较高的模式菌株的26S rDNA D1/D2区基因序列,采用MEGA 11.0中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.5 数据处理与统计分析
每组试验重复3次,采用Excel 2019进行数据处理统计,结果用“平均值±标准差”表示,采用Origin 2018绘图。
2 结果与分析
2.1 优良酵母菌的分离、初筛
从不同材料中共分离得到22株酵母菌,编号分别为TgT、TgH、XT1、XT3、LZ、F13Y、gp0、gp1、gp2、gp3、Fg、Lg1、Lg2、gz、FgFJ3、FgFJ1、FgFJ2、XT2、F1Y、F1R、F2R、F2Y。
2.1.1 产酒精能力筛选结果
22株酵母菌菌株的TTC显色结果见图1。由图1可知,菌株TgT、TgH、XT1、XT3、LZ、F13Y不显色,菌株gp0、gp1、gp2、gp3显浅粉色,菌株Fg、Lg1、Lg2、gz、FgFJ3显粉红色,菌株FgFJ1、FgFJ2显红色以及菌株XT2、F1Y、F1R、F2R、F2Y显深红色。因此,选择显色的16株酵母菌菌株进行杜氏小管产气性能比较。
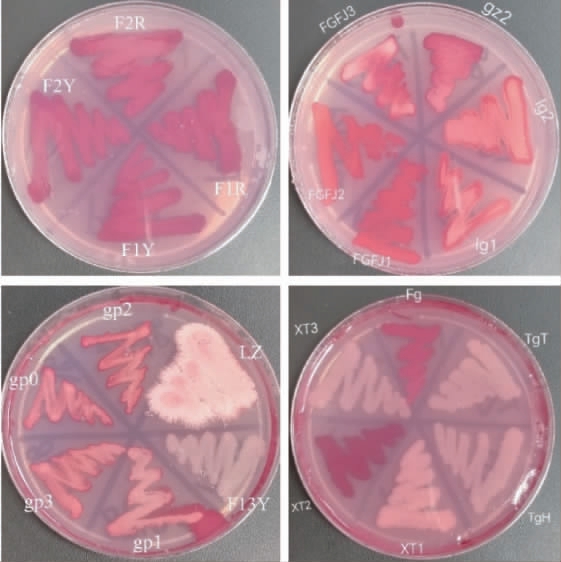
图1 22株酵母菌菌株的2,3,5-氯化三苯基四氮唑显色结果
Fig.1 Coloration results of 2,3,5-triphenyltetrazolium chloride of 22 yeast strains
2.1.2 产气能力筛选
16株酵母菌菌株的杜氏小管产气试验结果见表1。
表1 16株酵母菌菌株的杜氏小管产气试验结果
Table 1 Duchenne tube gas production test results of 16 yeast strains
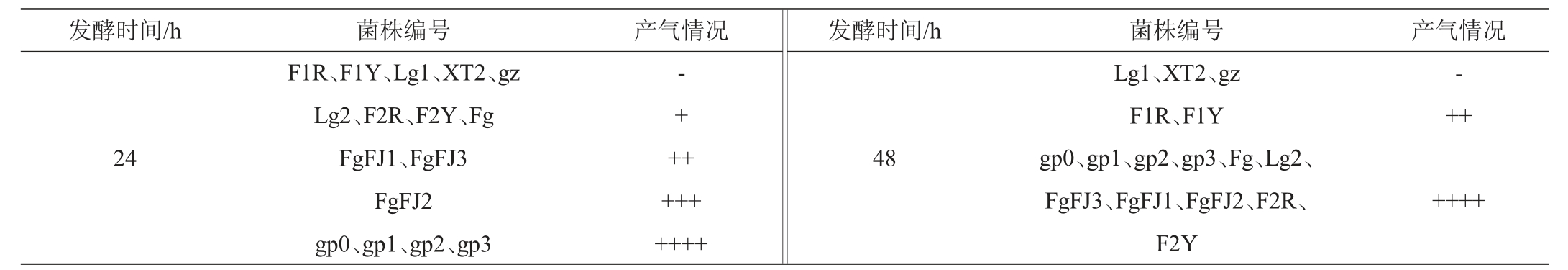
注:“-”表示完全不产气;“+”表示产气量为杜氏小管的1/4;“++”表示产气量为杜氏小管的1/2;“+++”表示产气量为杜氏小管的3/4;“++++”表示气体充满整个杜氏小管。
发酵时间/h 菌株编号 产气情况 发酵时间/h 菌株编号 产气情况24 F1R、F1Y、Lg1、XT2、gz Lg2、F2R、F2Y、Fg FgFJ1、FgFJ3 FgFJ2 gp0、gp1、gp2、gp3-+ +++++++++48 Lg1、XT2、gz F1R、F1Y gp0、gp1、gp2、gp3、Fg、Lg2、FgFJ3、FgFJ1、FgFJ2、F2R、F2Y-++++++
由表1可知,16株酵母菌菌株在28 ℃条件下恒温静置发酵48 h后,11株酵母菌菌株产气充满整个杜氏小管,打开并闻到淡淡的酒香味,说明这些酵母生长及起酵能力较强,可能具有较高的发酵效率和发酵力,而其他5株酵母菌菌株在发酵48 h时产气量无法充满整个杜氏小管,表明这些菌株生长和发酵能力有限,无法满足果酒发酵对酵母菌的要求,故选择菌株gp0、gp1、gp2、gp3、Fg、Lg2、FgFJ3、FgFJ1、FgFJ2、F2R、F2Y共11株菌株测定发酵力。
2.1.3 发酵力筛选
11株酵母菌菌株在不同发酵时间的CO2释放量见表2。由表2可知,菌株Lg2的CO2总释放量最低(0.942 g),其余菌株的CO2总释放量均>1 g,其中,菌株gp0、gp1、gp2、gp3的CO2总释放量均>6 g,且菌株gp3的CO2总释放量最多,为6.287 g,即菌株gp3发酵能力最强。由表2亦可知,11株酵母菌菌株均在发酵第2天达到最高发酵速率,且菌株gp0、gp1、gp2、gp3的发酵速率均明显高于其他菌株,即这4株菌株的发酵力最强,其中,菌株gp2在发酵起始阶段CO2释放最快。综上,选择菌株gp0、gp1、gp2、gp3、Fg、FgFJ3、FgFJ1、FgFJ2、F2R、F2Y共10株菌株进行耐受性测试。
表2 11株酵母菌菌株在不同发酵时间CO2的释放量
Table 2 CO2 emission of 11 yeast strains at different fermentation time

CO2释放量/g 1 d 2 d 3 d 4 d菌株编号 CO2总释放量/g FgFJ1 FgFJ2 FgFJ3 Fg gp0 gp1 gp2 gp3 Lg2 F2Y F2R 0.715±0.079 0.586±0.018 0.484±0.026 0.459±0.014 3.624±0.122 3.637±0.108 4.076±0.046 3.758±0.106 0.299±0.033 0.582±0.056 0.617±0.009 0.367±0.024 0.389±0.052 0.251±0.039 0.245±0.008 1.447±0.078 1.419±0.104 1.120±0.017 1.413±0.034 0.174±0.018 0.320±0.024 0.263±0.019 0.340±0.017 0.311±0.055 0.189±0.020 0.196±0.015 0.792±0.007 0.833±0.081 0.583±0.110 0.733±0.049 0.194±0.058 0.324±0.016 0.200±0.034 0.295±0.026 0.296±0.032 0.134±0.019 0.137±0.022 0.391±0.029 0.386±0.104 0.274±0.050 0.384±0.043 0.274±0.016 0.195±0.058 0.221±0.020 1.717±0.092 1.583±0.025 1.058±0.015 1.038±0.018 6.254±0.029 6.274±0.032 6.052±0.010 6.287±0.119 0.942±0.055 1.420±0.093 1.302±0.052
2.1.4 耐受性筛选
(1)高糖耐受试验
10株酵母菌菌株在含有杜氏小管的高糖培养基(葡萄糖添加量分别为24%、28%、30%)中发酵5 d后,所有菌株的产气均充满整个杜氏小管,说明这10株酵母菌菌株耐糖能力较强,符合前期果酒酿造试验中20%~30%初始加糖量的要求[29]。
(2)乙醇耐受性试验
10株酵母菌菌株的乙醇耐受性见图2。
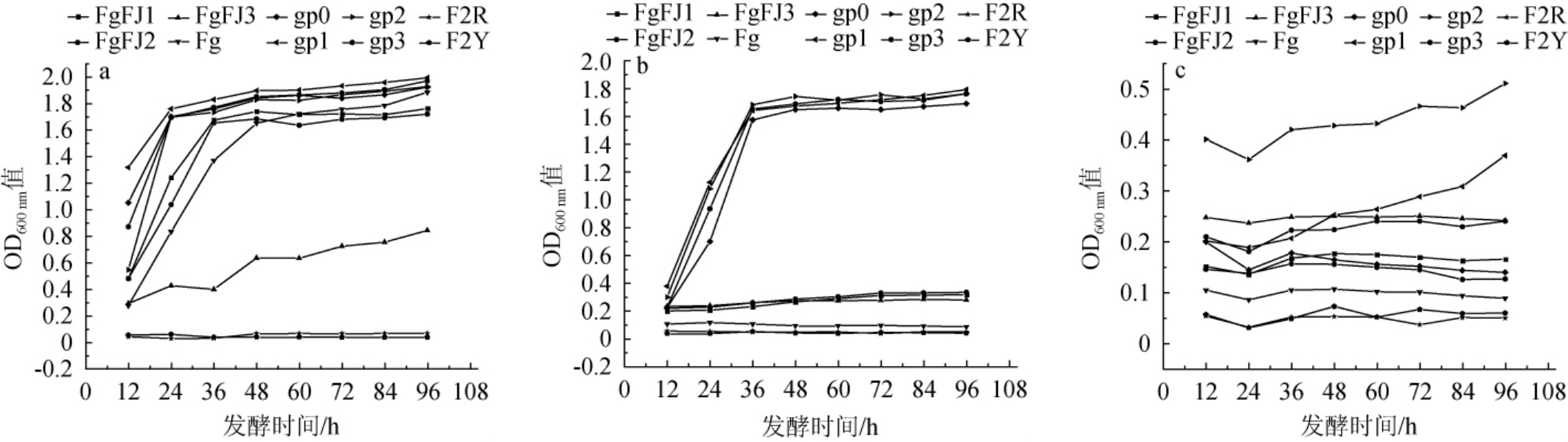
图2 10株酵母菌菌株对体积分数6%(a)、9%(b)及12%(c)乙醇的耐受性
Fig.2 Tolerance of 10 yeast strains to 6% (a), 9% (b) and 12% (c) ethanol
由图2a可知,菌株gp0、gp1、gp2、gp3、Fg、FgFJ1、FgFJ2对体积分数6%乙醇的耐受性均较好,其中菌株gp1的耐受性最强;菌株FgFJ3对体积分数6%乙醇的耐受性中等;菌株F2Y、F2R对体积分数6%乙醇的耐受性最弱。由图2b可知,菌株gp0、gp1、gp2、gp3对体积分数9%乙醇的耐受性均较高,其中菌株gp2的耐受性最强,菌株gp0耐受性最弱;菌株FgFJ1、FgFJ2、FgFJ3对体积分数9%乙醇的耐受性较低;菌株Fg、F2Y、F2R对体积分数9%乙醇的耐受性最弱。由图2c可知,菌株gp2对体积分数12%乙醇的耐受性最高;菌株F2Y、F2R对体积分数12%乙醇的耐受性最弱。综上,选择耐受性较好的菌株gp0、gp1、gp2、gp3、Fg、FgFJ3、FgFJ1、FgFJ2共8株菌株进行发酵性能研究。
2.2 低产甲醇酵母菌菌株的筛选
采用筛选得到的8株酵母菌菌株发酵百香果果皮果酒,测定酒样的甲醇含量与乙醇含量,结果见图3。
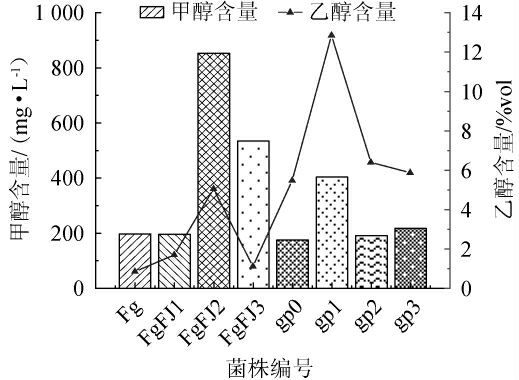
图3 8株酵母菌菌株发酵百香果果皮果酒中甲醇和乙醇含量测定结果
Fig.3 Determination results of methanol and ethanol content in passion fruit peel wine fermented by 8 yeast strains
由图3可知,菌株FGFJ2、FGFJ3、gp1发酵百香果果皮果酒中的甲醇含量>400 mg/L,高于国标GB/T 15037—2006《葡萄酒》中的规定红葡萄酒甲醇含量≤400 mg/L,白、桃红葡萄酒甲醇含量≤250 mg/L[30],其余5株菌株发酵百香果果皮果酒中的甲醇含量均<400 mg/L,但菌株Fg、FGFJ1发酵百香果果皮果酒的乙醇含量太低,不适合发酵果酒。菌株gp0、gp2、gp3发酵百香果果皮果酒的乙醇含量均>5%vol,甲醇含量均<400mg/L,乙醇含量分别为5.46%vol、6.38%vol、5.86%vol,甲醇含量分别为163.95 mg/L、192.04 mg/L、202.98 mg/L。故筛选菌株gp0、gp2、gp3为低产甲醇的优良的菌株。
2.3 低产甲醇酵母菌菌株的鉴定
2.3.1 形态学观察
酵母菌菌株gp0、gp2、gp3的形态学观察结果见图4。
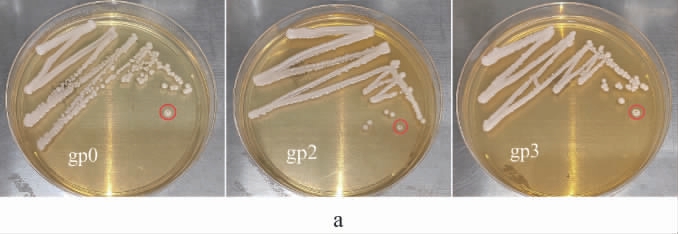
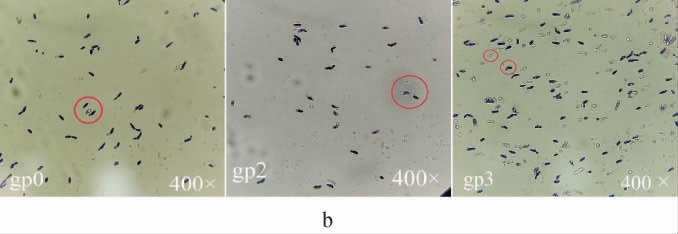
图4 酵母菌菌株gp0、gp2及gp3的菌落(a)及细胞(b)形态
Fig.4 Morphology of colony (a) and cell (b) of yeast strains gp0,gp2 and gp3
由图4可知,3株酵母菌菌株的菌落表面光滑且湿润,菌落颜色呈灰白色,经培养后均有淡淡酒香味;细胞呈圆形、椭圆形及卵圆形。
2.3.2 分子生物学鉴定
基于26S rDNA D1/D2基因序列构建菌株gp0、gp2及gp3的系统发育树,结果见图5。

图5 基于26S rDNA D1/D2基因序列菌株gp0、gp2及gp3的系统发育进化树
Fig.5 Phylogenetic tree of gp0, gp2 and gp3 strains based on 26S rDNA D1/D2 gene sequences
由图5可知,菌株gp0、gp2、gp3均与酿酒酵母(Saccharomyces cerevisiae)的亲缘关系最近。结合形态学特征及生理生化试验,鉴定菌株gp0、gp2、gp3鉴定均为酿酒酵母(Saccharomyces cerevisiae)。
3 结论
本研究以百香果种植基地的新鲜百香果、腐果下的土壤、腐果附近的土壤、新翻耕土壤以及田埂中的土壤等为原材料,采用传统培养分离法从中共分离得到22株酵母菌,通过产酒精能力、产气性能、发酵力及耐受性分析,初筛得到8株适用于果酒酿造的酵母菌菌株,通过百香果果皮果酒发酵试验,筛选得到3株低产甲醇的酵母菌菌株,编号分别为gp0、gp2、gp3,其发酵果酒中甲醇含量分别为163.95 mg/L、192.04 mg/L、202.98 mg/L,乙醇含量分别为5.46%vol、6.38%vol、5.86%vol。经形态学观察及分子生物学鉴定,菌株gp0、gp2、gp3均为酿酒酵母(Saccharomycescerevisiae)。本研究为今后生产低甲醇含量果酒奠定了基础,对未来开发优良品质的百香果果酒产品提供菌种,促进我国果酒酿造行业的发展具有重要意义。
[1]樊鸿艳,粟君,陈宇豪,等.百香果化学成分及生物活性研究进展[J].农产品加工,2022(12):95-100.
[2]张丽敏,彭熙,蔡国俊,等.不同搭架方式百香果营养成分分析及综合评价[J].食品工业科技,2021,42(21):33-40.
[3]陈雪梅,刘夏蕾,林标声,等.百香果果皮主要有效成分连续提取工艺[J].热带作物学报,2023,44(2):405-418.
[4]HERRERA-RAMIREZ J,MENESES-MARENTES N,DIAZ T P M.Optimizing the extraction of anthocyanins from purple passion fruit peel using response surface methodology[J].J Food Measure Charact, 2020,14(1):185-193.
[5]龚文玲,传均强,徐洪磊,等.商业酿酒酵母发酵百香果果酒的品质及抗氧化性分析[J].中国酿造,2023,42(3):135-139.
[6]CORDOVA F M,ZIBADI S,WATSON R R.Chapter 47-antioxidant and anti-inflammatory actions of passion fruit peel extract in modifying osteoarthritis,hypertension,and asthma[M].San Diego:Academic Press,2013:45-46.
[7]谭敏华,廖志强,冯卫华,等.紫色百香果果皮多酚存在形式及抗氧化活性[J].食品研究与开发,2021,42(16):53-58,76.
[8]QUEIROZ M D,JANEBRO D I,CUNHA M A.Effect of the yellow passion fruit peel flour (flavicarpa.) in insulin sensitivity in type 2 diabetes mellitus patients[J].Nutr J,2012,11(1):89-98.
[9]NOREEN S,AQSA M,NAJEEB U,et al.Banana fruit pulp and peel involved in antianxiety and antidepressant effects while invigorate memory performance in male mice: Possible role of potential antioxidants[J].Pakistan J Pharm Sci,2017,30(3):989-995.
[10]汪美凤,李文娟,吴双双,等.百香果果皮生物活性成分提取与开发利用研究进展[J].安徽农业科学,2022,50(19):16-19,24.
[11]程宏桢.百香果果酒酿造及果皮综合利用研究[D].南昌:江西农业大学,2021.
[12]赵广河,胡梦琪,陆玺文,等.发酵果酒加工工艺研究进展[J].中国酿造,2022,41(4):27-31.
[13]鲁云风,张四普,牛佳佳,等.猕猴桃百香果酒工艺条件优化[J].食品研究与开发,2022,43(1):105-109.
[14]陈永,方小丹,卢珍兰,等.甘蔗龙眼桂花梨百香果复合发酵饮品配方优化[J].食品研究与开发,2022,43(13):89-94.
[15]黎英,周荣池,刘夏蕾,等.百香果皮果胶的理化及凝胶特性[J].食品与发酵工业,2020,46(12):140-146.
[16]EELLS J T,MCMARTIN K E,BLACK K,et al.Formaldehyde poisoning.Rapid metabolism to formic acid[J].J Am Med Associat,2019,246(11):1237-1238.
[17]张香.椪柑酒中甲醇、杂醇油生成规律及调控研究[D].长沙:湖南农业大学,2021.
[18]CABAROGUL T.Methanol contents of Turkish varietal wines and effect of processing[J].Food Control,2004,16(2):177-181.
[19]王小东.低甲醇、发酵型柿子果酒酿造工艺的研究[D].杨凌:西北农林科技大学,2017.
[20]龚文玲,传均强,徐洪磊,等.商业酿酒酵母发酵百香果果酒的品质及抗氧化性分析[J].中国酿造,2023,42(3):135-139.
[21]伍鹤,李珂,赵琳,等.蓝莓果酒专用酵母的分离、筛选及鉴定[J].食品与发酵工业,2014,40(12):56-60.
[22]王犁烨,陈新军,卢丕超,等.紫外诱变选育高产酒精及酸的酿酒酵母[J].中国酿造,2019,38(1):104-108.
[23]李凯,王金晶,李永仙,等.红芯火龙果酒酿酒酵母的筛选及鉴定[J].食品与发酵工业,2019,45(5):115-120.
[24]董琦楠,叶冬青,梁艳英,等.高产酸本土非酿酒酵母菌株的筛选及发酵性能研究[J].中国酿造,2021,40(8):70-75.
[25]张会香,程鑫,林楠,等.百香果果壳发酵低甲醇含量果酒工艺优化[J].食品研究与开发,2023,44(12):153-159.
[26]中华人民共和国国家卫生健康委员会,国家食品药品监督管理总局.GB/5009.266—2016 食品安全国家标准食品中甲醇的测定[S].北京:中国标准出版社,2016.
[27]中华人民共和国国家卫生健康委员会,国家食品药品监督管理总局.GB/5009.225—2022 食品安全国家标准 酒和食用酒精中乙醇浓度的测定[S].北京:中国标准出版社,2022.
[28]刘晓柱,李银凤,张远林,等.鲜食葡萄来源酵母菌的鉴定及其酿造学特性分析[J].中国酿造,2021,40(3):48-53.
[29]程雅芳,曹慕明,陈国品,等.带壳百香果与甘蔗汁混酿复合果酒工艺研究[J].中国酿造,2019,38(3):201-205.
[30]国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15037—2006 葡萄酒[S].北京:中国标准出版社,2006.