香气由挥发性物质组成,这些物质可以通过刺激鼻中的嗅觉感受器使人感觉到气味。影响食醋香气的物质主要包括醇类、酮类、醛类、酸类、酯类、杂环类[1],不同食醋香气物质不同,形成了各具特色的风格和感官品质[2]。山西老陈醋以高粱、麸皮为主要原料,大曲为糖化发酵剂,经低温酒精发酵、高温固态醋酸发酵、熏醅、淋醋、陈酿等工艺酿制而成[3]。酵母菌为山西老陈醋酿造过程中优势真菌属[4-5],在发酵过程中能够产生醇、醛、酯、酸等多种芳香化合物[6-7],对产品风味的形成有重要影响[8-10]。酵母最适生长温度一般为28~35 ℃[11],适宜在37 ℃以上生长的酵母为高温酵母[12-13],高温酵母可在较高温度下进行正常的生长代谢活动[14],有利于风味物质的产生及发酵产量的提高[15]。因此选育具有耐温性能的产香酵母菌株,是提升产品感官品质的一个有效手段。
目前,关于耐高温产香酵母的研究集中于在白酒生产方面,吕枫等[16]从浓香型白酒窖醅中筛选得到耐高温产香酵母菌Y12,在40 ℃条件下,与商品化酵母相比产酒精能力更好(6.3%vol),残糖量更少(84.43 g/L)。牟飞燕等[17]从清香型大曲中筛选到耐高温产香酵母B-6,其可耐受温度39 ℃、酒精度9%vol,pH值3、葡萄糖质量浓度400 g/L的环境条件,发酵产酯类物质相对含量占比最高(86.7%)。目前,鲜见从山西老陈醋酿造过程中筛选酵母菌的研究报道。
本研究经过透明圈法初筛,耐高温、耐乙醇复筛,从山西老陈醋酿造过程取样筛选耐高温产香酵母,通过形态观察、生理生化及分子生物学对筛选菌株进行鉴定,并将所筛选菌株制作成酵母麸曲,通过单因素及正交试验进行麸曲制作工艺优化,并应用于高粱汁发酵,采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)结合气相色谱-质谱联用(gas chromatography mass spectrometer,GC-MS)法测定发酵产物中挥发性风味成分,为丰富微生物种质资源库及提升老陈醋风味奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料酒醪、醋醅样品:山西紫林醋业股份有限公司;小麦、麸皮、高粱:市售。
1.1.2 试剂
盐酸、浓硫酸、氢氧化钠、氯化钠、酚酞、葡萄糖、硫酸铜、酒石酸钾钠乙酸钠、己酸、乙醇(均为分析纯):天津欧博凯化工有限公司;葡萄糖(分析纯)、酵母膏、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;Ipure真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京索莱宝科技有限公司;重氮蓝B盐(diazonium blue B,DBB):上海阿拉丁生化科技股份有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:北京奥博星生物技术有限责任公司。
产酯筛选培养基:PDA培养基与乳化液按9∶1混合,琼脂1.8%,自然pH,121 ℃高压蒸汽灭菌20 min。其中乳化液为聚乙烯醇(polyvinyl alcohol,PVA)溶液和三丁酸甘油酯按9∶1混合,聚乙烯醇(PVA)溶液为3 g聚乙烯醇(PVA)加蒸馏水100 mL,加热充分溶解制得。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:蛋白胨10 g,酵母膏10 g,葡萄糖10 g,蒸馏水1 L,自然pH值。121 ℃高压蒸汽灭菌20 min。
高粱汁培养基:高粱粉碎至60目,100 g高粱粉加入400 mL 水中,润料4 h,加淀粉酶0.3%,100 ℃水浴2 h,降温至60 ℃,加入糖化酶0.2%,60 ℃条件下保温2 h,分装,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
Agilent 7080A-5975C气质联用仪:安捷伦科技(中国)有限公司;SW-CJ-IFD超净工作台:苏州金净净化设备有限公司;202型电热恒温干燥箱:天津泰斯特仪器有限公司;AR124CN电子天平、ZL-002 pH计:奥豪斯仪器有限公司;DZKW-4电子恒温水浴锅:北京中兴伟业仪器有限公司;Alkomat酒精检测仪:福林斯(徐州)生化技术有限公司;XB-K-25血球板计数器:上海求精生化试剂仪器有限公司。
1.3 方法
1.3.1 产香酵母的分离及初筛
分别采集山西老陈醋生产酒精发酵第1天、3天、5天、7天、9天、11天、13天、15天的酒醪样品和醋酸发酵第0、2天、4天、6天、8天、10天的醋醅样品,分别称取10 g样品加入装有90 mL带玻璃珠的无菌生理盐水的三角瓶中,30 ℃、120 r/min振荡30 min,稀释至合适梯度于PDA培养基进行涂布,30 ℃恒温培养120 h。挑选具典型酵母形态特征的单菌落于PDA培养基中进行纯化培养。纯化后菌株斜面培养,保存于4 ℃冰箱备用。将纯化的酵母菌株接种于产酯筛选培养基平板上,30 ℃恒温培养72 h,记录透明圈直径(D)与菌落直径(d),计算D/d,选取比值较大的菌株复筛。
1.3.2 耐高温、耐乙醇产香酵母的复筛
将初筛得到的酵母菌株接种于PDA培养基,30 ℃培养24 h,使用染色法计数[18],用无菌生理盐水将其制备为菌体浓度约为1.0×107 CFU/mL的菌悬液,接种于YPD培养基中,分别置于30 ℃、35 ℃、40 ℃、45 ℃、50 ℃,120 r/min振荡培养24 h,测定菌体浓度(OD600nm值),并通过嗅闻筛选出产生酯香气味的酵母菌株[16]。
将筛选出的耐高温产香酵母菌株制备为菌体浓度约为1.0×107 CFU/mL的菌悬液,接种于含体积分数8%乙醇的YPD培养基中,30 ℃、120 r/min培养24 h后,以无菌YPD液体培养基为空白,测定菌体浓度(OD600 nm值),筛选出耐乙醇能力强的耐高温产香酵母,以上每组处理平行3次。
1.3.3 产香酵母的鉴定
形态学观察:将筛选获得的产香酵母菌株接种于PDA培养基,30 ℃培养2 d,观察其菌落特征,并进行显微观察。
生理生化试验:参照《酵母菌的特征与鉴定手册》[19]对筛选出的菌株进行生理生化试验。
分子生物学鉴定:使用Ipure真菌基因组DNA提取试剂盒提取DNA,以其为模板,采用通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')扩增真菌ITS rDNA基因片段。扩增体系(25 μL):2(Taq Master Mix 12.5 μL,引物ITS和ITS4各2 μL,DNA模板5 μL,双蒸水(ddH2O)补齐至25 μL。聚合酶链式反应(polymerase chain reaction,PCR)扩增条件:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,共循环25次;72 ℃最终延伸5 min。扩增好的PCR产物用1%琼脂糖凝胶检测DNA浓度后,委托广州艾基因生物科技公司进行ITS rDNA测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库中,使用基本局部比对搜索工具(basic local alignment search tool,BLAST)软件进行同源性对比,得到与待测物种序列相似性最大的同源序列,采用MEGA5.0软件的邻接(neighbor-joining,NJ)法构建系统发育树,确定菌株种属关系。
1.3.4 酵母麸曲制备工艺流程及操作要点
操作要点:以麸皮为原料,以粮水比为1.0∶1.0(g∶mL)加水,拌匀,121 ℃条件下灭菌20 min,趁热摇散,冷却至30 ℃后接种4%菌体浓度约为1.0×107 CFU/mL的筛选菌株菌悬液,30 ℃培养24 h后,得到麸曲成曲。
1.3.5 酵母麸曲培养条件优化
单因素试验:在1.3.4基础上,以成曲中扣囊复膜酵母数量为评价指标,分别考察粮水比(1.0∶0.8、1.0∶0.9、1.0∶1.0、1.0∶1.1、1.0∶1.2(g∶mL)),接种量(2%、4%、6%、8%、10%),培养温度(24 ℃、26 ℃、28 ℃、30 ℃、32 ℃),培养时间(20 h、24 h、28 h、32 h、36 h)对成曲中筛选菌株生物量的影响,以上每组处理平行3次。
正交优化试验:在单因素试验结果的基础上,以粮水比(A)、接种量(B)、培养温度(C)和培养时间(D)为影响因素,以生物量为考察指标,进行4因素3水平正交试验,正交试验因素及水平见表1。
表1 酵母麸曲培养条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for culture conditions optimization of yeast Fuqu

水平 A 粮水比(g∶mL) B 接种量/% C 培养温度/℃ D 培养时间/h 1 2 3 1∶0.9 1∶1.0 1∶1.1 3 4 5 26 28 30 24 28 32
1.3.6 酵母麸曲发酵产物挥发性风味物质检测分析方法
按20%(V/V)的接种量将产香酵母种子液接种于高梁汁培养基中,28 ℃条件下发酵5 d,采用顶空固相微萃取(HSSPME)结合气相质谱(GC-MS)对发酵产物进行分析。
顶空固相微萃取(HS-SPME):萃取头老化温度250 ℃,准确称取2 g样品,3 g饱和NaCl溶液于样品瓶中,将SPME萃取头通过瓶盖插入样品的顶空部分,退出纤维头,顶空吸附20 min后,将萃取头插入GC-MS气相进样口解吸2 min。
气相色谱条件:色谱柱为HP-5MS(30 m×0.25 mm×0.25 μm);进样口温度为250 ℃;辅助加热器开启250 ℃;升温程序为初始温度35 ℃,保持5 min,后以5 ℃/min升至180 ℃,再以12 ℃/min升至240 ℃,保持10 min;载气为高纯氦气(He),流速为0.8 mL/min,不分流。
质谱条件:电子电离(electron ionization,EI)源;电子能量70 ev;离子源温度200 ℃;四级杆温度150 ℃;扫描模式Scan;扫描质量范围33~450 aum。
定性定量分析:与美国国家标准技术研究所(national institution of standards technology)20.0谱库中化合物的质谱信息匹配进行定性;按照峰面积归一化法进行相对定量分析。
1.3.7 数据处理与分析
采用Excel2019、SPSS26.0、Origin2022软件进行数据分析及作图。
2 结果与分析
2.1 产香酵母菌的筛选
2.1.1 产香酵母菌的初筛
采用产酯筛选培养基对样品中分离出的酵母菌进行初筛,结果见表2。由表2可知,产生透明圈的有14株,菌株D/d值范围为1.24~3.96,其中菌株ZLCY-93的D/d最大,为3.96。选取D/d≥2.8的菌株ZLCY-73、ZLCY-74、ZLCY-93和ZLCY-1088进行复筛。
表2 产酯酵母菌株初筛结果
Table 2 Result of initial screening of ester-producing yeasts
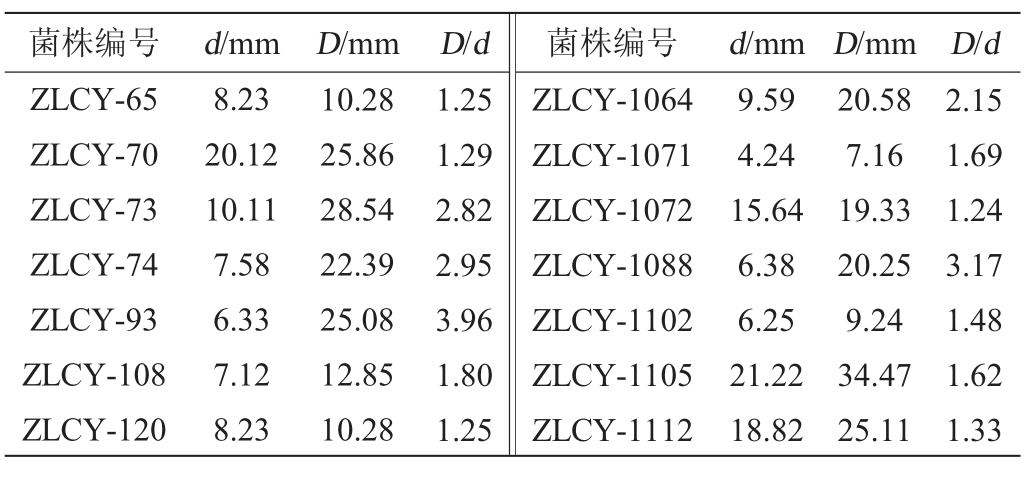
菌株编号 d/mm D/mm D/d 菌株编号 d/mm D/mm D/d ZLCY-65 ZLCY-70 ZLCY-73 ZLCY-74 ZLCY-93 ZLCY-108 ZLCY-120 8.23 20.12 10.11 7.58 6.33 7.12 8.23 10.28 25.86 28.54 22.39 25.08 12.85 10.28 1.25 1.29 2.82 2.95 3.96 1.80 1.25 ZLCY-1064 ZLCY-1071 ZLCY-1072 ZLCY-1088 ZLCY-1102 ZLCY-1105 ZLCY-1112 9.59 4.24 15.64 6.38 6.25 21.22 18.82 20.58 7.16 19.33 20.25 9.24 34.47 25.11 2.15 1.69 1.24 3.17 1.48 1.62 1.33
2.1.2 耐高温、耐乙醇产香菌株的复筛
耐高温产香酵母菌生物量检测结果见图1。由图1a可知,在培养温度45℃条件下,菌株ZLCY-73、ZLCY-74、ZLCY-93和ZLCY-1088仍能够生长,在50 ℃条件下4株菌可生长,但生长明显受限,当培养温度为50 ℃时,以上4株菌的OD600 nm平均值分别为0.276、0.304、0.320、0.317。同时,4株菌株菌的发酵液菌均呈现出较强的果香型气味。因此,以上4株酵母菌,均具有在较高温度条件下发酵产香的能力。由图1b可知,相同培养条件下,4株菌对体积分数8%乙醇耐受性差异显著(P<0.05),其中,菌株ZLCY-93在含体积分数为8%乙醇的YPD培养基中生长状况最好,OD600nm值为1.245。因此,选用菌株ZLCY-93为目标菌株进行后续研究。
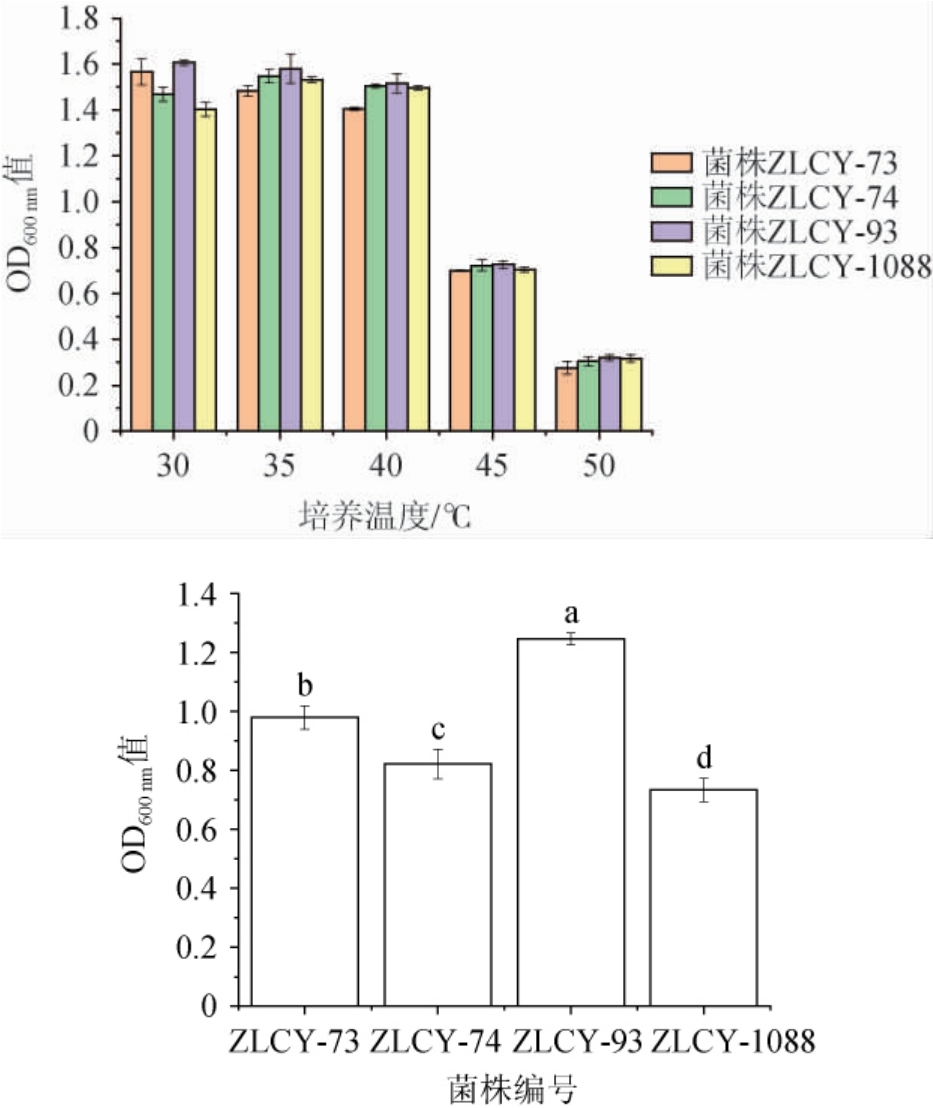
图1 耐高温(a)、耐乙醇(b)产香酵母菌生物量检测结果
Fig.1 Detection results of aroma-producing yeasts biomass with high temperature (a) and ethanol (b) resistant
不同字母表示差异显著(P<0.05)。
2.2 菌株ZLCY-93的鉴定
2.2.1 形态学观察
菌株ZLCY-93的菌落及显微形态见图2。由图2可知,在PDA培养基30 ℃培养48 h,菌株ZLCY-93菌落呈现圆形、白色、表面凸起、不透明;具有典型的二型性,既存在大量分支状的有隔假菌丝,又产生酵母状的芽殖细胞。
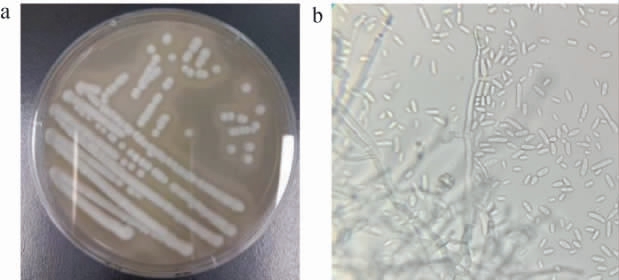
图2 菌株ZLCY-93的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of strain ZLCY-93
2.2.2 生理生化试验结果
菌株ZLCY-93生理生化试验结果见表3。由表3可知,菌株ZLCY-93糖发酵试验及碳源(葡萄糖、麦芽糖、淀粉及乙醇)同化试验结果均呈阳性,其他试验结果呈阴性。参照《酵母菌的特征与鉴定手册》[19],结合形态观察结果,因此,初步鉴定菌株ZLCY-93为复膜孢酵母属(Saccharomycopsis)。
表3 菌株ZLCY-93生理生化试验结果
Table 3 Results of physiological and biochemical tests of strain ZLCY-93
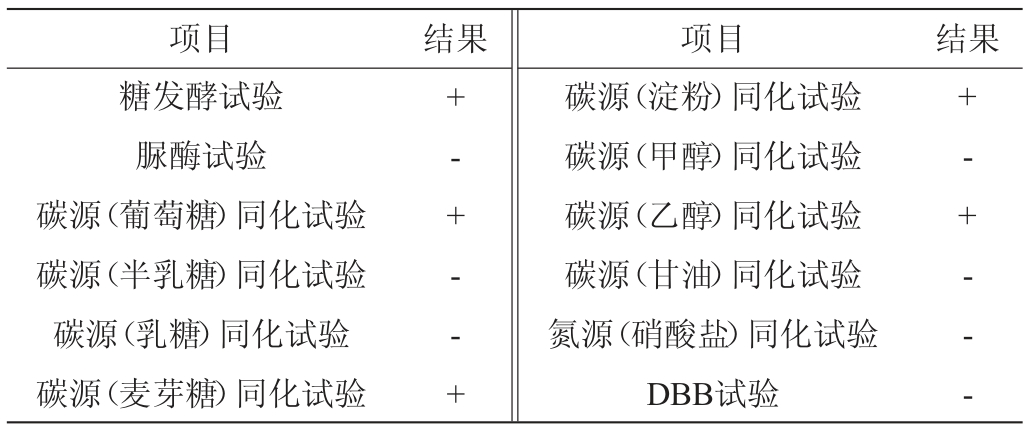
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
项目 结果 项目 结果糖发酵试验脲酶试验碳源(葡萄糖)同化试验碳源(半乳糖)同化试验碳源(乳糖)同化试验碳源(麦芽糖)同化试验+- + - - +碳源(淀粉)同化试验碳源(甲醇)同化试验碳源(乙醇)同化试验碳源(甘油)同化试验氮源(硝酸盐)同化试验DBB试验+- + - - -
2.2.3 分子生物学鉴定
菌株ZLCY-93的系统发育树见图3。由图3可知,菌株ZLCY-93与扣囊复膜酵母(Saccharomycopsis fibuligera)及异常威克汉姆酵母(Wickerhamomyces anomalus)聚于一支,最大序列相似度为100%,结合其形态观察、生理生化试验结果,鉴定菌株ZLCY-93为扣囊复膜酵母(Saccharomycopsis fibuligera)。
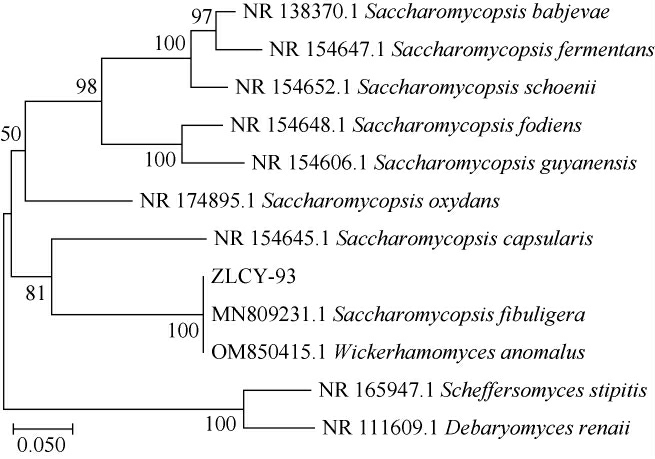
图3 基于ITS rDNA基因序列菌株ZLCY-93的系统发育树
Fig.3 Phylogenetic tree of strain ZLCY-93 based on ITS rDNA gene sequence
2.3 麸曲制备条件的优化
2.3.1 不同培养条件对麸曲中酵母生物量的影响
菌株ZLCY-93麸曲培养条件优化单因素试验结果见图4。由图4a可知,当粮水比为1.0∶0.8~1.0∶1.0(g∶mL)时,酵母菌数逐渐增加;当粮水比为1.0∶1.0(g∶mL)时,酵母菌数达最大值,为1.59×109 CFU/g;继续提高水的比例,酵母菌数量下降。因此,确定最佳粮水比为1.0∶1.0(g∶mL)。由图4b可知,当接种量为2%~4%时,酵母菌数逐渐增加;当接种量为4%时,酵母菌数达最大值,为1.59×109 CFU/g;继续增加接种量,酵母菌数逐渐下降。接种量的大小,对麸曲制备的周期有较大影响。接种量过小,同等培养条件下,菌体生长量不足,延长培养时间。接种量过大,会导致初期营养消耗过快和氧气缺乏,且会过多摄入代谢废物,降低生产效率[22]。因此,确定最佳接种量为4%。由图4c可知,随着培养温度在24~28 ℃范围内的升高,酵母菌数逐渐增加;当培养温度为28 ℃时,酵母菌数达到最大值,为1.62×109 CFU/g;继续升高培养温度,酵母菌数有所下降。因此,确定最佳培养温度为28 ℃。由图4d可知,当培养时间为20~28 h时,酵母菌数逐渐增加;当培养时间为28 h时,酵母菌数达到最大值,为1.64×109 CFU/g;继续延长培养时间,酵母菌数有所下降。因此,确定最佳培养时间为28 h。
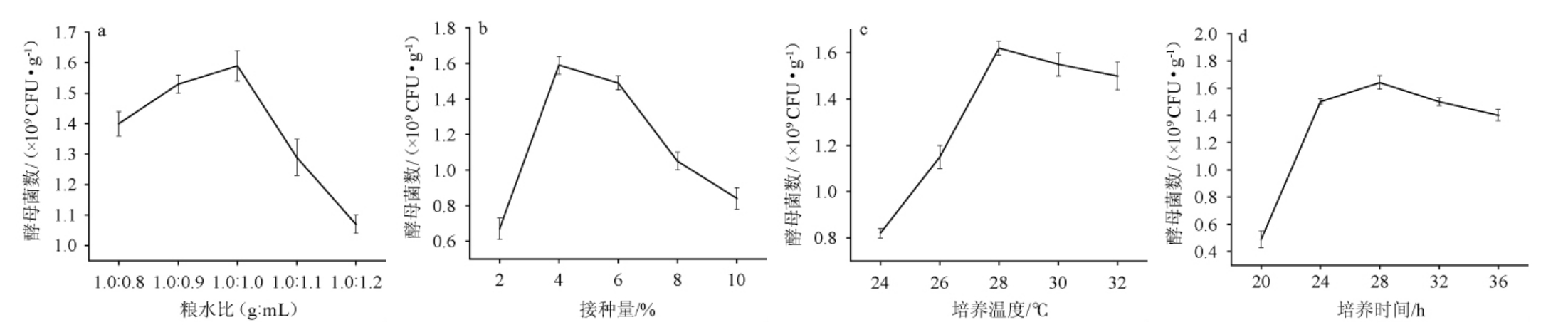
图4 粮水比(a)、接种量(b)、培养温度(c)及培养时间(d)对酵母菌数的影响
Fig.4 Effects of grain and water ratio (a), inoculum (b), culture temperature (c) and culture time (d) on yeasts count
2.3.2 麸曲制备条件优化正交试验结果与分析
由表4可知,根据极差分析,对ZLCY-93麸曲生物量影响因素依次为培养温度(C)>接种量(B)>培养时间(D)>粮水比(A)。ZLCY-93麸曲培养条件最佳方案组合为A2B3C2D2,即粮水比1.0∶1.0(g∶mL),接种量5%,培养温度28 ℃,培养时间为28 h。对正交试验结果进行验证试验,ZLCY-93麸曲的酵母菌数可达1.72×109 CFU/g。
表4 酵母麸曲培养条件优化正交试验结果与分析
Table 4 Results and analysis of orthogonal tests for culture conditions optimization of yeast Fuqu
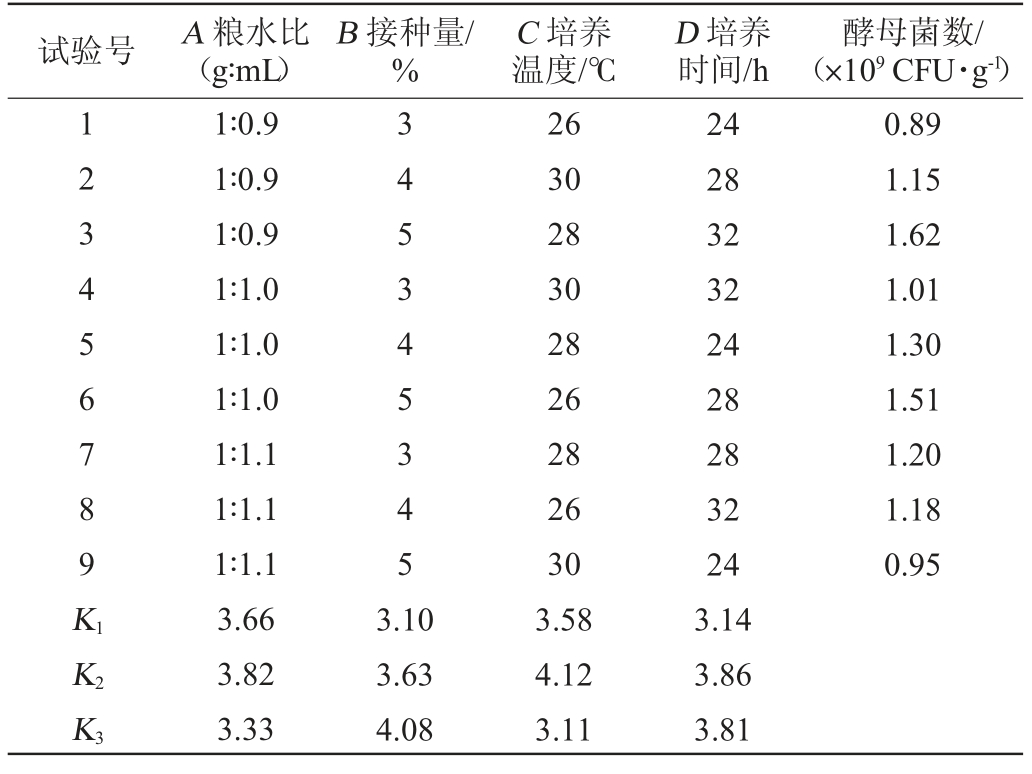
试验号 A 粮水比(g∶mL)B 接种量/%C 培养温度/℃D 培养时间/h酵母菌数/(×109 CFU·g-1)123456789K1 345345345 0.89 1.15 1.62 1.01 1.30 1.51 1.20 1.18 0.95 K2 K3 1∶0.9 1∶0.9 1∶0.9 1∶1.0 1∶1.0 1∶1.0 1∶1.1 1∶1.1 1∶1.1 3.66 3.82 3.33 3.10 3.63 4.08 26 30 28 30 28 26 28 26 30 3.58 4.12 3.11 24 28 32 32 24 28 28 32 24 3.14 3.86 3.81
续表

试验号 A 粮水比(g∶mL)B 接种量/%C 培养温度/℃D 培养时间/h酵母菌数/(×109 CFU·g-1)k1 k2 k3极差R 1.22 1.27 1.11 0.16 1.03 1.21 1.36 0.33 1.19 1.37 1.04 0.34 1.05 1.29 1.27 0.24
2.4 ZLCY-93麸曲产香试验
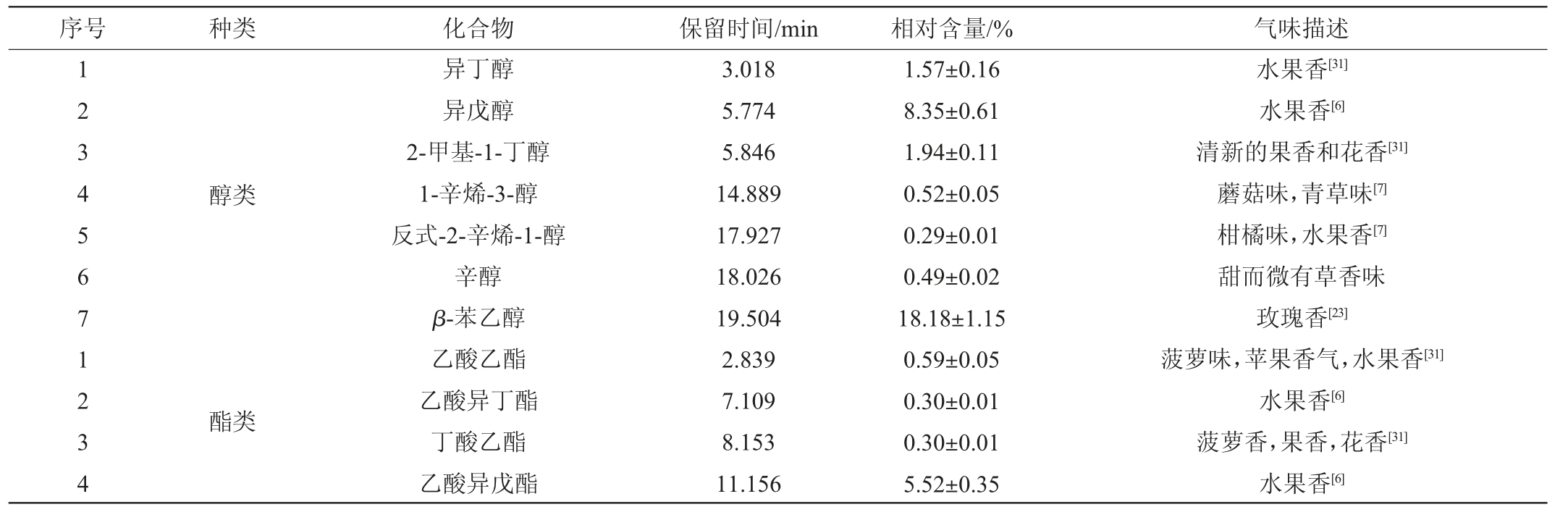
利用HS-SPME-GC-MS对发酵后的高粱汁中的挥发性风味物质进行分析,结果见表5。
表5 ZLCY-93麸曲发酵产物挥发性风味成分GC-MS分析结果
Table 5 Results of volatile flavor components in fermentation products of strain ZLCY-93 Fuqu analyzed by GC-MS
序号 种类 化合物 保留时间/min 相对含量/% 气味描述123 45671234醇类酯类异丁醇异戊醇2-甲基-1-丁醇1-辛烯-3-醇反式-2-辛烯-1-醇辛醇β-苯乙醇乙酸乙酯乙酸异丁酯丁酸乙酯乙酸异戊酯3.018 5.774 5.846 14.889 17.927 18.026 19.504 2.839 7.109 8.153 11.156 1.57±0.16 8.35±0.61 1.94±0.11 0.52±0.05 0.29±0.01 0.49±0.02 18.18±1.15 0.59±0.05 0.30±0.01 0.30±0.01 5.52±0.35水果香[31]水果香[6]清新的果香和花香[31]蘑菇味,青草味[7]柑橘味,水果香[7]甜而微有草香味玫瑰香[23]菠萝味,苹果香气,水果香[31]水果香[6]菠萝香,果香,花香[31]水果香[6]
续表
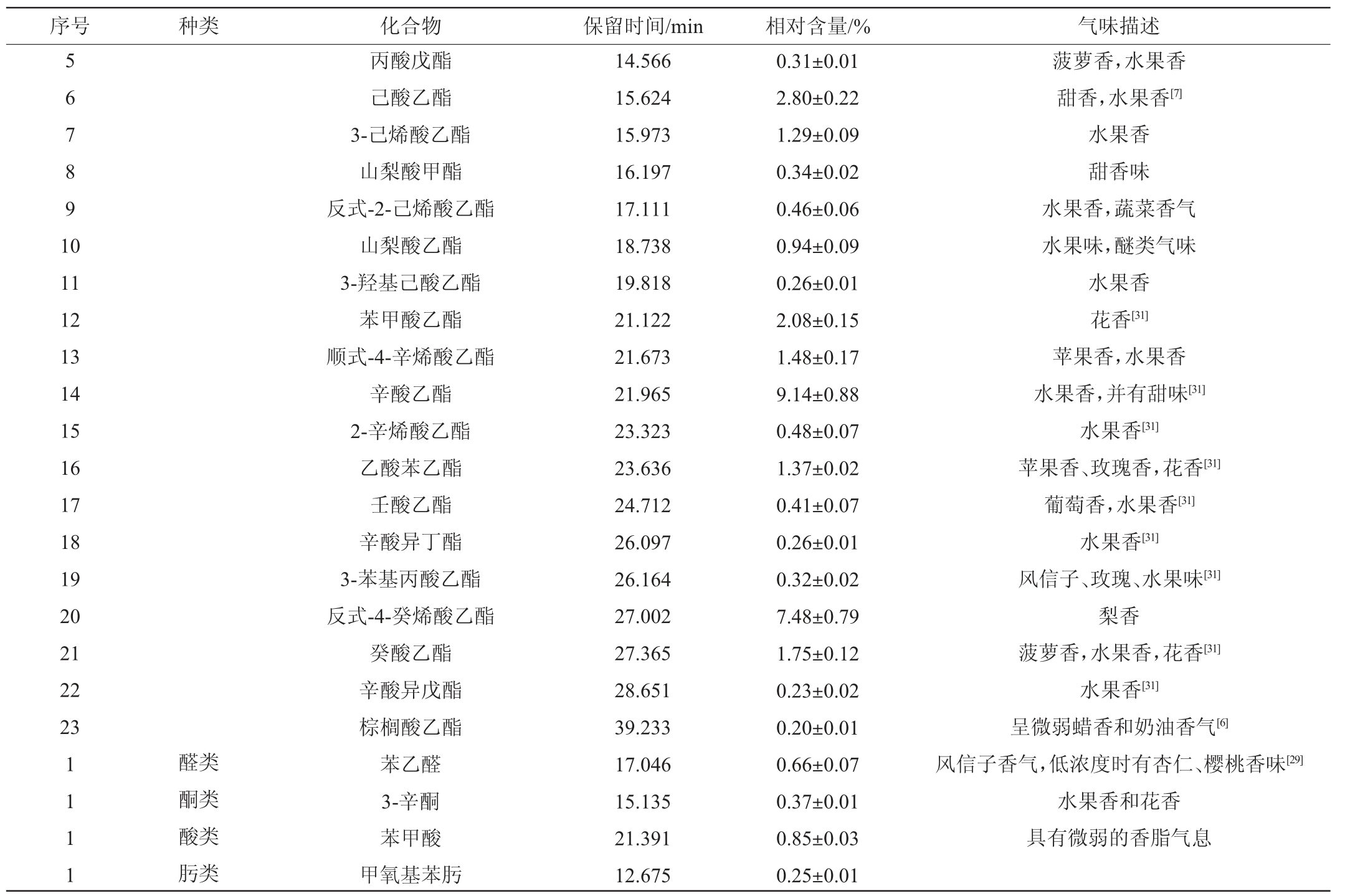
序号 种类 化合物 保留时间/min 相对含量/% 气味描述5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 20 21 22 23 1 1 1 1醛类酮类酸类肟类丙酸戊酯己酸乙酯3-己烯酸乙酯山梨酸甲酯反式-2-己烯酸乙酯山梨酸乙酯3-羟基己酸乙酯苯甲酸乙酯顺式-4-辛烯酸乙酯辛酸乙酯2-辛烯酸乙酯乙酸苯乙酯壬酸乙酯辛酸异丁酯3-苯基丙酸乙酯反式-4-癸烯酸乙酯癸酸乙酯辛酸异戊酯棕榈酸乙酯苯乙醛3-辛酮苯甲酸甲氧基苯肟14.566 15.624 15.973 16.197 17.111 18.738 19.818 21.122 21.673 21.965 23.323 23.636 24.712 26.097 26.164 27.002 27.365 28.651 39.233 17.046 15.135 21.391 12.675 0.31±0.01 2.80±0.22 1.29±0.09 0.34±0.02 0.46±0.06 0.94±0.09 0.26±0.01 2.08±0.15 1.48±0.17 9.14±0.88 0.48±0.07 1.37±0.02 0.41±0.07 0.26±0.01 0.32±0.02 7.48±0.79 1.75±0.12 0.23±0.02 0.20±0.01 0.66±0.07 0.37±0.01 0.85±0.03 0.25±0.01菠萝香,水果香甜香,水果香[7]水果香甜香味水果香,蔬菜香气水果味,醚类气味水果香花香[31]苹果香,水果香水果香,并有甜味[31]水果香[31]苹果香、玫瑰香,花香[31]葡萄香,水果香[31]水果香[31]风信子、玫瑰、水果味[31]梨香菠萝香,水果香,花香[31]水果香[31]呈微弱蜡香和奶油香气[6]风信子香气,低浓度时有杏仁、樱桃香味[29]水果香和花香具有微弱的香脂气息
由表5可知,除乙醇外,ZLCY-93麸曲发酵高粱汁发酵产物中共检测到挥发性风味物质34种。醇类物质7种,相对含量为31.34%,其中相对含量最高的是β-苯乙醇(18.18%),β-苯乙醇是白酒、葡萄酒、黄酒、啤酒和面包等多种发酵食品中含有的风味物质,具有玫瑰花香[23-25]。许多微生物都被鉴定为具有β-苯乙醇合成能力,其中大多数为真核生物[26]。真核生物以葡萄糖为碳源,经糖酵解途径、磷酸戊糖途径和莽草酸途径等一系列复杂的合成途径生成苯丙酮酸,最终进入艾氏途径生成2-苯乙醇[27]。酯类物质23种,相对含量为38.31%,其中乙酸乙酯、乙酸异丁酯、乙酸异戊酯、己酸乙酯、乙酸苯乙酯、棕榈酸乙酯等为山西老陈醋中常见酯类物质[28-30]。酵母菌中酯类形成途径主要有乙醇或高级醇、脂肪酸、辅酶A和酰基转移酶等物质参与,包括乙酸酯和乙酯两类,它们由酵母通过不同的代谢机制形成,但均具有类似水果的芳香,如草莓、甜果、青苹果、香蕉等气味[31]。所检测到的酯类物质中,含量较高的为辛酸乙酯(9.14%)、反式-4-癸烯酸乙酯(7.48%)、乙酸异戊酯(5.52%)、己酸乙酯(2.80%)、苯甲酸乙酯(2.08%),其香气均以花果香为主[6,31]。醛类、酮类、酸类、肟类均只有1种,分别为苯乙醛、3-辛酮、苯甲酸、甲氧基苯肟,相对含量分别为0.66%、0.37%、0.85%、0.25%。酯类和醇类物质是发酵类物质香气的主要来源,优化后的ZLCY-93麸曲应用于高粱汁的发酵,除乙醇外,产生的酯类和醇类物质占挥发性物质总量的69.68%,证明其具有良好的产香性能。
3 结论
本研究通过传统分类方法从山西老陈醋来源样品中筛选到一株耐高温且耐乙醇的产香酵母,编号ZLCY-93,经鉴定为扣囊复膜酵母(Saccharomycopsis fibuligera)。用该菌株制作产香麸曲,以酵母菌数为响应值,通过单因素和正交试验对麸曲的培养条件进行优化,得到最佳培养条件为:粮水比1.0∶1.0(g∶mL),接种量5%,培养温度28 ℃,培养时间为28 h,在此优化条件下,ZLCY-93麸曲的酵母菌数可达1.72×109 CFU/g。将该培养条件下制得的麸曲应用于高粱汁的发酵,共检出挥发性风味物质34种,其中,酯类23种、醇类7种、醛类、酮类、酸类、肟类各1种。酯类及醇类物质相对含量为69.68%,表明该产香麸曲具有良好的产香性能。后续可将该工艺制得的麸曲应用于生产实际中,以提高发酵产物中香气成分的含量,提升食醋产品感官品质。
[1]魏世东,王素英,娄婷婷,等.食醋中挥发性风味物质及其检测方法研究进展[J].食品研究与开发,2022,43(24):215-24.
[2]王敏,沈广玥,宋佳,郑宇.中国谷物醋风味研究进展[J].食品科学技术学报,2021,39(4):29-36.
[3]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 19777—2013 地理标志产品山西老陈醋[S].北京:中国标准出版社,2013.
[4]朱丹,孙晓琪,张慧如,等.山西老陈醋发酵过程中真菌菌群结构及多样性[J].中国酿造,2023,42(6):103-108.
[5]HOU Z X,ZHANG J H,DANG L,et al.Correlation analysis of microbial community changes and physicochemical characteristics in aged vinegar brewing[J].Foods,2023,12(18):3430.
[6]段国锋.大曲来源的5株酵母菌在果醋发酵中的应用研究[D].晋中:山西农业大学,2022.
[7]李媚媛,刘安琪,唐道埔,等.产香气化合物微生物的研究进展[J].食品科学,2023,44(19):259-69.
[8]YANG Q,YAO H,LIU S,et al.Interaction and application of molds and yeasts in Chinese fermented foods[J].Front Microbiol,2022,12:664.
[9]李柔,刘源,宋开阔,等.非酿酒酵母与酿酒酵母在米酒混菌发酵中的相互作用机制分析[J].食品与发酵工业,2024,50(2):41-47.
[10]ZHU Y P,ZHANG F F,ZHANG C N,et al.Dynamic microbial succession of Shanxi aged vinegar and its correlation with flavor metabolites during different stages of acetic acid fermentation[J].Sci Rep, 2018, 8(1):8612.
[11]祁艳华,覃启剑,汪斌,等.酵母耐高温分子机制的研究进展[J].广西科学,2022,29(1):13-22,33.
[12]PRADO C D D,MANDRUJANO G P L,SOUZA J P D,et al.Physiological characterization of a new thermotolerant yeast strain isolated during Brazilian ethanol production and its application in high temperature fermentation[J].Biotechnol Biofuels,2020,13(1):178-192.
[13]费文斌,雍晓雨,徐俊,等.1株耐热产乙醇酵母的分离、鉴定与性能测试[J].江苏农业科学,2015,43(3):319-322.
[14]刘辉,何太波,赵国淼,等.耐高温酿酒酵母菌的筛选及发酵性能研究[J].酿酒科技,2020(6):46-49.
[15]余婷婷,赖世强,曹文涛,等.酱香型白酒高温堆积糟醅中耐高温酵母的筛选及鉴定[J].酿酒科技,2014(6):24-26.
[16]吕枫,赵兴秀,李仕鲁,等.酱香型白酒窖醅中耐高温产香酵母的筛选及性能研究[J].中国酿造,2020,39(11):43-47.
[17]牟飞燕,夏博宇,张维,等.清香大曲中高耐受性功能酵母的筛选[J].中国酿造,2023,42(11):163-168.
[18]国家市场监督管理总局,国家标准化管理委员会.GB 7300.501—2021饲料添加剂第5部分:微生物酿酒酵母[S].北京:中国标准出版社,2021.
[19]BARNETT J A.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:116-119.
[20]刘霄,黄治国,卫春会,等.扣囊复膜酵母麸曲制备及其在小曲白酒中的应用[J].食品科学,2025,46(1):56-63.
[21]李洪媛,马美荣,周林艳,等.根霉酵母混合麸曲在清香型白酒生产中的应用[J].酿酒科技,2021(9):123-130.
[22]黄佳玲,刘建华,刘艳梅,等.种曲接种量对酱油制曲及发酵的影响[J].食品安全导刊,2023(25):143-147.
[23]张学林,季斌,许玲,等.清香型大曲中产β-苯乙醇酵母的分离、鉴定及在白酒酿造中的应用[J].中国酿造,2022,41(1):123-127.
[24]孙宝国,黄明泉,王娟.白酒风味化学与健康功效研究进展[J].中国食品学报,2021,21(5):1-13.
[25]THOMPSON B, MACHAS M, NIELSEN D R.Creating pathways towards aromatic building blocks and fine chemicals[J].Curr Opin Biotech,2015,36:1-7.
[26]杨晓,陈芳,李景明.植物中2-苯乙醇的合成研究进展[J].园艺学报,2010,37(10):1690-1694.
[27]李园子,高靖怡,王凤寰,等.2-苯乙醇合成研究进展[J].生物工程学报,2024,40(6):1694-1710.
[28]郭鑫磊,王宏霞,施明丽,等.不同陈酿年份四大名醋有机酸及挥发性风味物质比较分析[J].中国酿造,2023,42(7):58-64.
[29]郑宇,赵翠梅,吴亚楠,等.山西老陈醋风味物质组成特征及风味轮分析[J].食品科学技术学报,2019,37(4):24-34.
[30]LIANG J J,XIE J C,LI H,et al.Aroma constituents in Shanxi aged vinegar before and after aging[J].J Agr Food Chem,2016,64(40):7597-7605.
[31]王飞,王晓宇,赵擎豪,等.果酒增香酿造技术研究进展[J].食品科学,2023,44(13):244-252.