吡嗪类化合物是指苯环的1,4位含有两个氮原子的杂环化合物,在食品发酵过程中普遍存在[1],具有类似于炒坚果、烤肉的香气,吡嗪类化合物香气阈值较低,具有烘托其他香味物质作用,同时可使白酒的香气更为丰满,对白酒口感风格形成起到关键作用[2],是促进白酒特定风味形成的决定性风味物质之一[3]。此外,该类化合物还具有一定健康功效,具有改善血液循环、扩张血管和护肝等功能,被称为白酒中健康因子[4]。在白酒酒醅的发酵过程中,吡嗪类化合物主要是由美拉德和微生物代谢产生,酱香型、兼香型和芝麻香型白酒中吡嗪类化合物含量较高,其中酱香型白酒中吡嗪类化合物含量为所有白酒之最,其原因与酿造工艺中高温环节相关,其中高温大曲和高温堆积过程富集较多[5],关于高温大曲中吡嗪类化合物的研究较多,但关于酱香型白酒堆积发酵过程中吡嗪类化合物研究较少,吡嗪类化合物与酱香型白酒堆积发酵环境条件、微生物等的相关性研究更少,酱香型白酒堆积发酵过程中吡嗪类化合物的合成机制尚不清楚。
白酒酒醅发酵过程是一个复杂的微生态系统,在产品形成过程中,酒醅微生物与代谢产物、酿造环境之间存在着复杂的生态学关系[6]。陈莹琪等[7]采用顶空固相微萃取-气相色谱-质谱(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)联用技术和高通量测序研究浓香型大曲微生物菌群演替与吡嗪类化合物的关系,探究制曲过程中微生物相互作用对吡嗪类物质合成的影响,结果表明,吡嗪类物质合成相关微生物与制曲过程中大曲微生物之间多呈正相关,仅嗜热真菌属(嗜热子囊菌属)等少数微生物表现出负相关。 吴成等[8]采用高通量测序技术分析酱香型白酒4轮次堆积发酵酒醅中理化因子、风味物质与微生物群落的相关性,结果表明,微生物群落与理化指标、风味物质形成存在复杂的作用关系:水分含量与库德里阿兹威毕赤酵母(Pichia kudriavzevii)等酵母菌呈正相关,与疏棉状嗜热丝孢菌(Thermomyces lanuginosus)、壮观丝衣霉(Byssochlamys spectabilis)、肋状曲霉(Aspergillus costiformis)等丝状真菌呈负相关;淀粉和还原糖含量与芽孢杆菌属(Bacillus)呈正相关,与P.kudriavzevii呈负相关。同时,酵母菌主要与醇类物质如丙醇、异丁醇、异戊醇、β-苯乙醇等呈极显著正相关(P<0.01),而丝状真菌和细菌主要与酸类和酯类物质如乙酸、丙酸、异丁酸、乳酸乙酯、油酸乙酯、己酸丁酯等呈极显著正相关(P<0.01)。朱安然等[9]以酱香型白酒第一轮次糟醅为研究对象,探究槽醅、酿造环境微生物群落结构组成及演替规律,并分析其与理化因子的关联作用,结果表明,一轮次堆积发酵6 d糟醅中细菌和酵母菌的菌落总数达到最大值,分别为(3.45±0.15)×106CFU/g和(40.5±2.50)×104CFU/g;堆积发酵6d后未被分类的乳杆菌科细菌(unclassifiedLactobacillaceae)(91.23%~91.77%)和毕赤酵母属(Pichia)(32.84%~91.00%)分别为绝对的优势细菌和真菌属,其中unclassified Lactobacillaceae与糟醅水分含量和酸度呈显著正相关,Pichia与糟醅水分含量和还原糖含量呈显著正相关。微生物溯源分析表明,堆积发酵0 d和堆积发酵3 d糟醅中优势微生物主要来源于堆积地面(32.44%~57.37%)和生产器具(26.89%~50.74%),堆积发酵6 d至窖池发酵43 d糟醅中优势微生物主要来源于窗台墙壁等物体表面(86.41%~87.31%)。
本研究以酱香型白酒第三轮次堆积发酵酒醅为研究对象,采用顶空固相微萃取-气相色谱-串联质谱(HSSPME-GC-MS/MS)技术检测酒醅中吡嗪类物质,通过宏基组测序技术解析微生物群落结构,并结合常规检测方法分析酒醅中理化指标,系统解析第三轮次酒醅堆积发酵过程中吡嗪类化合物与微生物群落及理化指标之间相互作用关系,为揭示酱香白酒堆积发酵过程吡嗪类化合物合成机制提供理论参考,旨在提高酱香型白酒中吡嗪类化合物含量,对稳定酱香型白酒品质有重要意义。
1 材料与方法
1.1 材料与试剂
第三轮次堆积发酵酒醅:贵州省仁怀市茅台镇某酒厂制酒车间。
CretMagTM Power Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit:苏州白垩纪生物科技有限公司;NEXTflexTM Rapid DNA-Seq Kit:美国Omega BioTek公司;双链DNA(double-stranded DNA,dsDNA)荧光定量检测试剂盒/Qubit dsDNA HS Assay Kit:美国ThermoFisher公司;DNA分选磁珠:Yeasen生物科技(香港)有限公司;氯化钠、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)(均为分析纯):国药集团化学试剂有限公司;2-羟基苯甲酸甲酯-3,4,5,6-d4(内标,质量浓度10 μg/mL)(色谱纯):美国Sigma-Aldrich公司;正己烷(色谱纯):德国Merck公司。
1.2 仪器与设备
CovarisM220非接触式超声波DNA破碎仪:美国Covaris公司;NanoDrop200分光光度计:美国Thermo Scientific公司;TBS-380荧光定量仪:美国TurnerBioSystems公司;Research Plus 3122000019可调式微量移液器:德国Eppendorf公司;SPME Arrow固相微萃取装置:瑞士CTCAnalyticsAG公司;GS-MS萃取头、DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm):美国Agilent公司;Covaris M220自动聚焦超声波破碎仪:美国Covaris公司。
1.3 方法
1.3.1 样品采集
第二轮次蒸馏酒醅加曲完成堆积收堆记为0 h,第三轮次酱香型白酒堆积发酵酒醅及取样示意图见图1。每隔24 h取一次样品,至入窖发酵前完成取样,取样位置如图1b中A、B、C、D、E五点,将A、B、C、D、E样品混匀作为一个样品,每个样品平行采集三份,共取得酒醅样品15个。样品采集后立即装入无菌自封袋中,于4 ℃条件下带回实验室,-80 ℃保藏。同时记录取样时酒醅的温度。

图1 酱香型白酒堆积发酵酒醅(a)及取样示意图(b)
Fig.1 The fermented grains for stacking fermentation of sauce-flavor Baijiu(a)and sampling schematic diagram(b)
1.3.2 吡嗪类化合物的测定吡嗪类化合物的测定采用HS-SPME-GC-MS/MS法[10]。
HS-SPME萃取条件:在60 ℃恒温条件下,振荡5 min,120 μm DVB/CWR/PDMS萃取头插入样品顶空瓶,顶空萃取15 min,于250 ℃下解吸5 min,然后进行GC-MS分离鉴定。 采样前萃取头在Fiber Conditioning Station中250 ℃下老化5 min。
气相色谱条件:DB-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm),载气为高纯氦气(He)(纯度≥99.999%),恒流流速1.2 mL/min,进样口温度250 ℃,不分流进样,溶剂延迟3.5 min。程序升温为40 ℃保持3.5 min,以10 ℃/min升至100℃,再以7℃/min升至180 ℃,最后以25℃/min升至280℃,保持5 min。
质谱条件:电子电离(electronic ionization,EI)源,离子源温度230 ℃,四级杆温度150 ℃,质谱接口温度280 ℃,电子能量70 eV,扫描方式为选择离子监测(selected ion monitoring,SIM)模式。
定性定量方法:定性定量离子参考GB 23200.8—2016《水果和蔬菜中500种农药及相关化学品残留量的测定气相色谱-质谱法》。 通过美国国家标准技术研究所(National Institute of Standards and Technology,NIST)标准图谱库,依据吡嗪类化合物的保留时间(retention time,RT)、保留指数(retentionindex,RI)、定性离子、定量离子等开展定性分析。以2-羟基苯甲酸甲酯-3,4,5,6-d4为内标(质量浓度为10 μg/mL),计算相对含量,其计算公式如下[11]:
式中:Xi为待测样品中化合物含量,μg/g;Vs为内标物体积,μL;Cs为内标物质量浓度,μg/mL;M为待测样品质量,g;Is为内标物峰面积;Ii为待测样品中化合物的峰面积。
1.3.3 理化指标测定
还原糖含量测定:采用3,5-二硝基水杨酸(DNS)法[12];淀粉含量测定:采用硫酸蒽酮法[13];粗蛋白含量测定:根据GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氨法;总酸含量测定:根据GB 12456—2021《食品中总酸的测定》中的酸碱滴定法;水分含量测定:根据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中的直接干燥法。所有理化指标均以干基计。
糖化酶、酸性蛋白酶(acid proteinase,ACP)、α-淀粉酶(α-amylase,α-AL)酶活的测定方法均采用酶标法[14]。糖化酶酶活定义:1 g酶粉或1 mL酶液,在40 ℃,pH 4.6条件下,每小时水解可溶性淀粉产生1 mg葡萄糖的酶量为1个酶活力单位(U/g)。 酸性蛋白酶酶活定义:1 g酶粉或1 mL酶液,在40 ℃、pH 3.5件下,1 min水解酪素产生1 μg酪氨酸为1个酶活力单位(U/g)。α-淀粉酶(α-AL)酶活定义:1 g酶于40 ℃,pH 6.0条件下,每小时液化可溶性淀粉1 g即为一个酶活力单位(U/g)。
1.3.4 DNA提取、建库与宏基因组测序
称取0.5 g的酒醅,利用CretMagTM Power Soil DNA Kit进行15个酒醅样品DNA抽提。完成基因组DNA抽提后,利用TBS-380荧光定量仪检测DNA浓度,利用NanoDrop200检测DNA纯度,利用1%琼脂糖凝胶电泳检测DNA完整性。然后通过Covaris M220自动聚焦超声波破碎仪将DNA片段化,筛选约400 bp的片段,然后使用NEXTflexTM Rapid DNA-Seq Kit进行建库,最后委托武汉百奥维凡生物科技有限公司使用Illumina NovaSeq测序平台,进行宏基因组测序。
1.3.5 数据处理
使用Fastp0.20.0软件(https://github.com/OpenGene/fastp)对原始数据进行剪切、去除低质量序列,使用MEGAHIT 1.1.2软件(https://github.com/voutcn/megahit)对优化序列进行拼接组装[15],用CD-HIT 4.6.1软件[16](http://www.bioinformatics.org/cd-hit/)对所有样品预测出来的基因序列进行聚类(参数为:95%identity、90%coverage),每类取最长的基因作为代表序列,构建非冗余基因集。 使用R软件进行绘图,R语言stats包3.5.0在微生物属和吡嗪类化合物中计算出Spearman相关系数(R>0.6)以检测微生物群落与吡嗪类化合物之间的相关性、理化指标与吡嗪类化合物之间的相关性。
2 结果与分析
2.1 酱香型白酒第三轮次酒醅堆积发酵过程中吡嗪类化合物含量变化
通过HS-SPME-GC-MS/MS分析第三轮次酒醅堆积发酵过程中的吡嗪类化合物,共检测出35种吡嗪类化合物,其中含量前15的吡嗪类化合物在第三轮次酒醅堆积发酵过程中的峰面积见图2。由图2可知,35种吡嗪类化合物中含量最多的是2-乙酰基-3-甲基吡嗪,这与张春林等[17]研究结果不一致,目前尚未有文献报道检测出此吡嗪类化合物,含量排名第二的是四甲基吡嗪,这与丁海龙等[18]报道基本一致。第三轮次酒醅堆积发酵5 d时,含量前3的吡嗪类化合物(2-乙酰基-3-甲基吡嗪、四甲吡嗪和3-乙基-2,5-二甲基吡嗪)呈现先降低(前3 d)后增加(第4天)又降低(第5天)的变化趋势。堆积发酵第1天吡嗪类化合物较高原因可能与堆积过程中加入高温大曲有关[19];在第2天、第3天含量减少,可能是堆积过程中微生物将吡嗪类化合物作为底物转化成其他物质[20];堆积发酵第4天,吡嗪类化合物含量快速增加可能与有较高的堆积温度有关(35 ℃),因为吡嗪类化合物的生成与美拉德反应有密切关系,温度升高有利于美拉德反应的进行[21-22],随后第5天吡嗪类化合物的含量降低,可能是因为较高的温度(46 ℃)使得其挥发而造成逸散[23]。
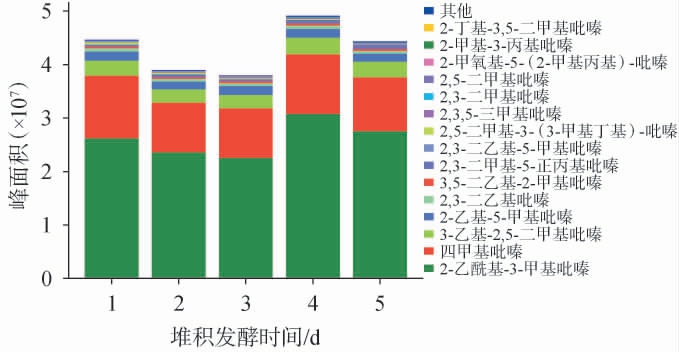
图2 酒醅堆积发酵过程中含量前15吡嗪类化合物峰面积
Fig.2 Peak area of top 15 pyrazines in contents of fermented grains during stacking fermentation process
2.2 酱香型白酒第三轮次酒醅堆积发酵过程理化指标变化
堆积发酵过程是一个复杂的微生态系统,酒醅微生物与代谢产物、酿造环境之间存在复杂的生态关系,白酒生产过程中酿造环境参数的变化对微生物代谢产生重要影响,这些主要参数有环境因素(如温度等)、理化因素(总酸、还原糖等)、化学因素(乙酸、乙醇等)[24]。第三轮次酱香型白酒酒醅第1天到第5天(取样温度依次是24 ℃、26 ℃、28 ℃、35 ℃、46 ℃)理化指标及酶活变化结果见图3。由图3a可知,淀粉和还原糖含量的变化呈先上升后下降、再上升再下降的趋势,含量变化范围分别为134.03~125.06 mg/g和25.70~10.49 mg/g,淀粉出现这种变化现象原因可能是堆积发酵过程中“破堆移位”操作,因此第4天相同取样位置淀粉含量比前3 d均高[25];粗蛋白含量呈上升趋势,含量变化范围为152.97~165.99 g/kg;总酸先降低后升高后又略升高,第4天含量为最低(9.89 g/kg),总酸变化范围为9.89~11.85 g/kg;水分含量发酵前3 d平稳,之后快速上升,发酵第5天最高,为48.65%。 由图3b可知,α-淀粉酶活平均值为16.53 U/g,基本保持稳定;酸性蛋白酶先是急速下降,然后又升高随后降低,其中发酵第2天时最低,为12.30 U/g;糖化酶活性一直呈上升趋势,变化范围为3.77~8.00 U/g,第5天时为最高。 本研究结果与吴成等[8-9]研究结果变化趋势基本一致。
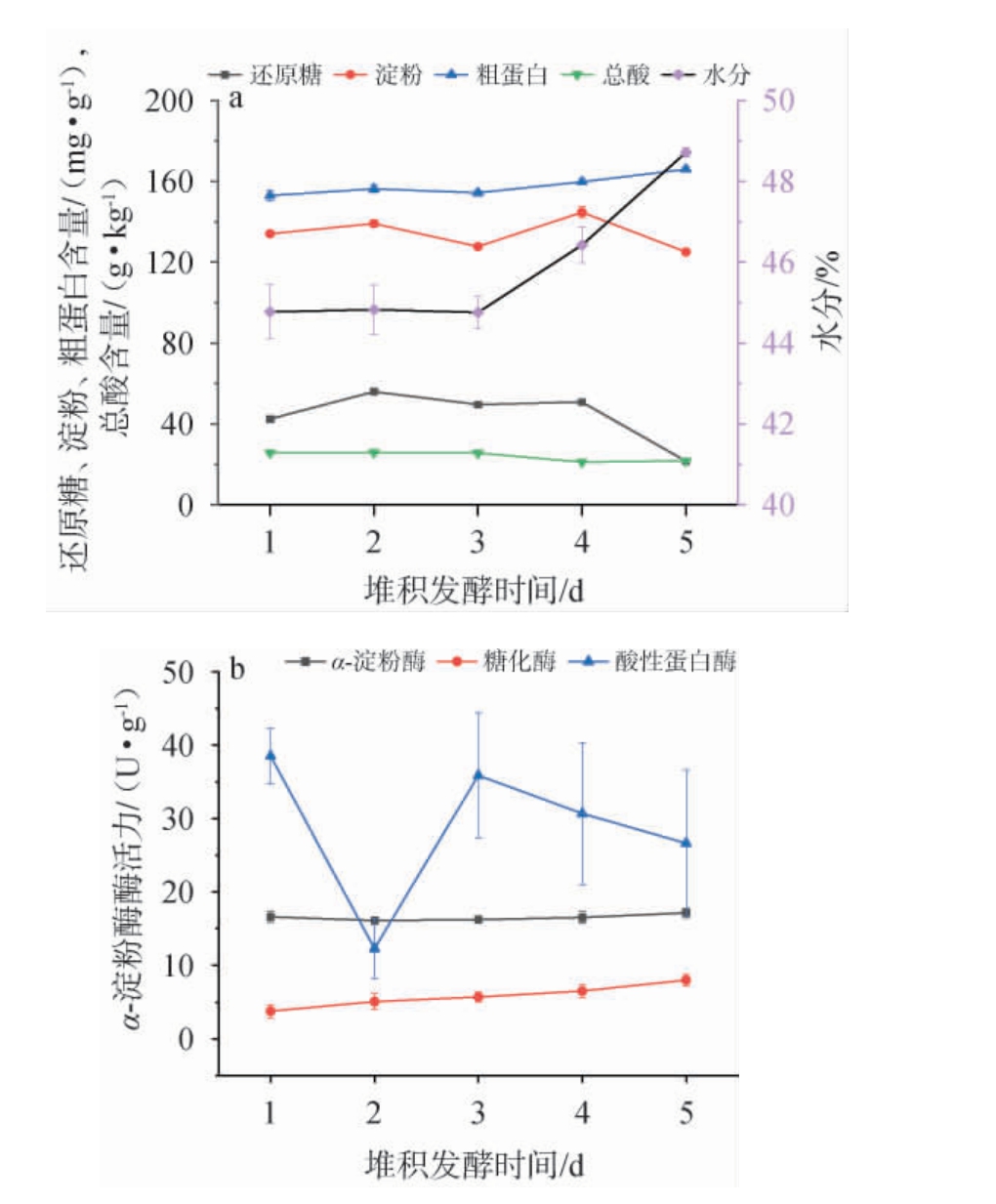
图3 酱香型白酒酒醅堆积发酵过程中理化指标(a)及α-淀粉酶酶活(b)的变化
Fig.3 Changes of physicochemical indicators (a) and α-amylase activities (b) of fermented grains during stacking fermentation process
2.3 酱香型白酒第三轮次酒醅堆积发酵过程中优势微生物演替规律
采用宏基因组学检测技术分析堆积发酵过程中微生物变化规律,第三轮次酱香型白酒酒醅堆积发酵过程中相对丰度前15细菌属和真菌属的变化,结果见图4。
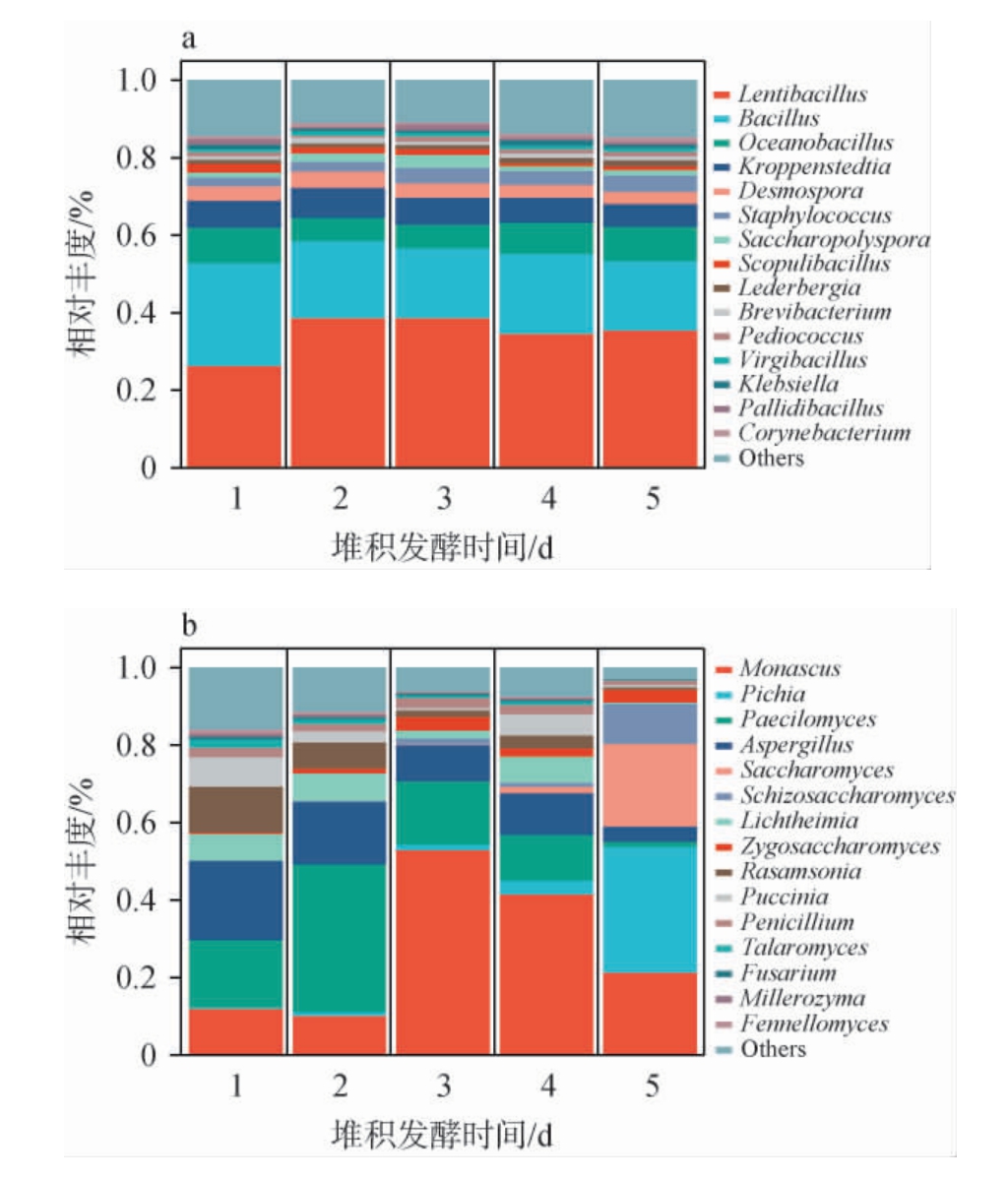
图4 基于属水平酒醅堆积发酵过程中细菌(a)和真菌(b)群落结构分析结果
Fig.4 Analysis results of bacterial (a) and fungal (b) communities structure of fermented grains during stacking fermentation process based on genus level
由图4a可知,各发酵时间段优势细菌属相对丰度差异不大,主要优势细菌属有慢生杆状菌属(Lentibacillus)、芽孢杆菌属(Bacillus)、海洋芽胞杆菌属(Oceanobacillus)、克罗彭斯特菌属(Kroppenstedtia)、 链孢子菌属(Desmospora)、葡萄球菌属(Staphylococcus)等,其中慢生杆状菌属(Lentibacillus)占绝对优势,相对丰度为26.21%~38.59%。 王欢等[26]研究发现,慢生杆状菌属(Lentibacillus)在酱香型白酒发酵优势菌之一,在堆积发酵中能分泌代谢降解蛋白质及淀粉的水解酶,形成酱香或酱香前体物质。 芽孢杆菌属(Bacillus)在酿酒中可以提高发酵效率、改善酒的品质和风味,例如表现高淀粉酶和蛋白酶活性,相对丰度为17.84%~26.53%,相对丰度整体呈现减少趋势,最后一天相对丰度最少(17.84%)。 海洋芽胞杆菌属(Oceanobacillus)在第2天相对丰度最少,为5.96%,第1天相对丰度最高,为9.15%,其在酿酒过程中通过代谢产生各种有机酸与乙醇反应生产脂肪酸酯,成为白酒的主体香型成分[27]。克罗彭斯特菌属(Kroppenstedtia)在堆积发酵第2天相对丰度最高,为7.75%,堆积发酵第5天相对丰度最少,为5.95%,研究表明,克罗彭斯特菌属(Kroppenstedtia)能够促进吡嗪类化合物的产生[28]。
由图4b可知,酒醅堆积发酵过程中,真菌微生物群落结构差异较大,红曲霉属(Monascus)相对丰度先增加后减少,第3天相对丰度最高,为52.83%。 酒醅堆积发酵过程起到大量富集毕赤酵母属(Pichia)的作用,在第1天其相对丰度为0.28%,第5天相对丰度为32.41%,毕赤酵母属(Pichia)在酱香型白酒酿造过程中起到产酯生香的作用,同时也有糖化和产酒作用[29]。 拟青霉属(Paecilomyces)在堆积发酵第2天相对丰度达到最大,为38.08%,该菌能分泌淀粉酶、蛋白酶和纤维素酶等多种水解酶,对降解酿造原料和推动呈香呈味物质的形成有重要贡献[30]。曲霉属(Aspergillus)相对丰度随着堆积时间延长逐渐降低(20.49%~3.95%);酵母属(Saccharomyces)和裂殖酵母属(Schizosaccharomyces)在第4天开始富集,第5天相对丰度达到最大值(分别为21.36%和20.21%),这与堆积发酵是最大限度网络环境中微生物尤其是酵母菌的结论相一致[31]。
综上,与堆积发酵之前相比,堆积发酵后酒醅中细菌微生物群落结构基本不变,但真菌微生物群落结构差异较大,尤其是酵母菌类微生物聚集较多。
2.4 相关性分析
2.4.1 酱香型白酒酒醅堆积发酵过程中吡嗪类化合物与微生物相关性分析
使用Spearman的计算方法,选择相关系数R>0.6,选取堆积发酵酒醅中优势细菌和真菌与吡嗪类化合物进行相关性分析,结果见图5。由图5a可知,2,5-二甲基-3-(3-甲基丁基)-吡嗪与岩石芽孢杆菌属(Scopulibacillus)呈极显著正相关(P<0.01),与葡萄球菌属(Staphylococcus)呈极显著负相关(P<0.01),与莱德伯格氏菌属(Lederbergia)呈显著负相关(P<0.05);四甲基吡嗪与海洋芽胞杆菌属(Oceanobacillus)呈极显著正相关(P<0.01),与糖多孢菌属(Saccharpolyspora)呈极显著负相关(P<0.01),与慢生杆状菌属(Lentibaccillus)呈显著负相关(P<0.05);2-乙基-5-甲基吡嗪与枝芽孢杆菌属(Virgibacillus)、慢生杆状菌属(Lentibaccillus)呈极显著负相关(P<0.01);2-乙酰基-3-甲基吡嗪与克雷伯氏菌属(Klebsiella)呈极显著正相关(P<0.01),与岩石芽孢杆菌属(Scopulibacillus)呈显著负相关(P<0.05);2,3-二乙基-5-甲基吡嗪与海洋芽胞杆菌属(Oceanobacillus)呈显著正相关(P<0.05),与慢生杆状菌属(Lentibaccillus)呈显著负相关(P<0.05);2,3-二乙基吡嗪、3-乙基-2,5-二甲基吡嗪与克雷伯氏菌属(Klebsiella)呈显著正相关(P<0.05);2,3-二甲基-5-正丙基吡嗪与Scopulibacllus呈极显著负相关(P<0.01);2-甲氧基-5-(2-甲基丙基)-吡嗪与克雷伯氏菌属(Klebsiella)呈显著负相关(P<0.05)。
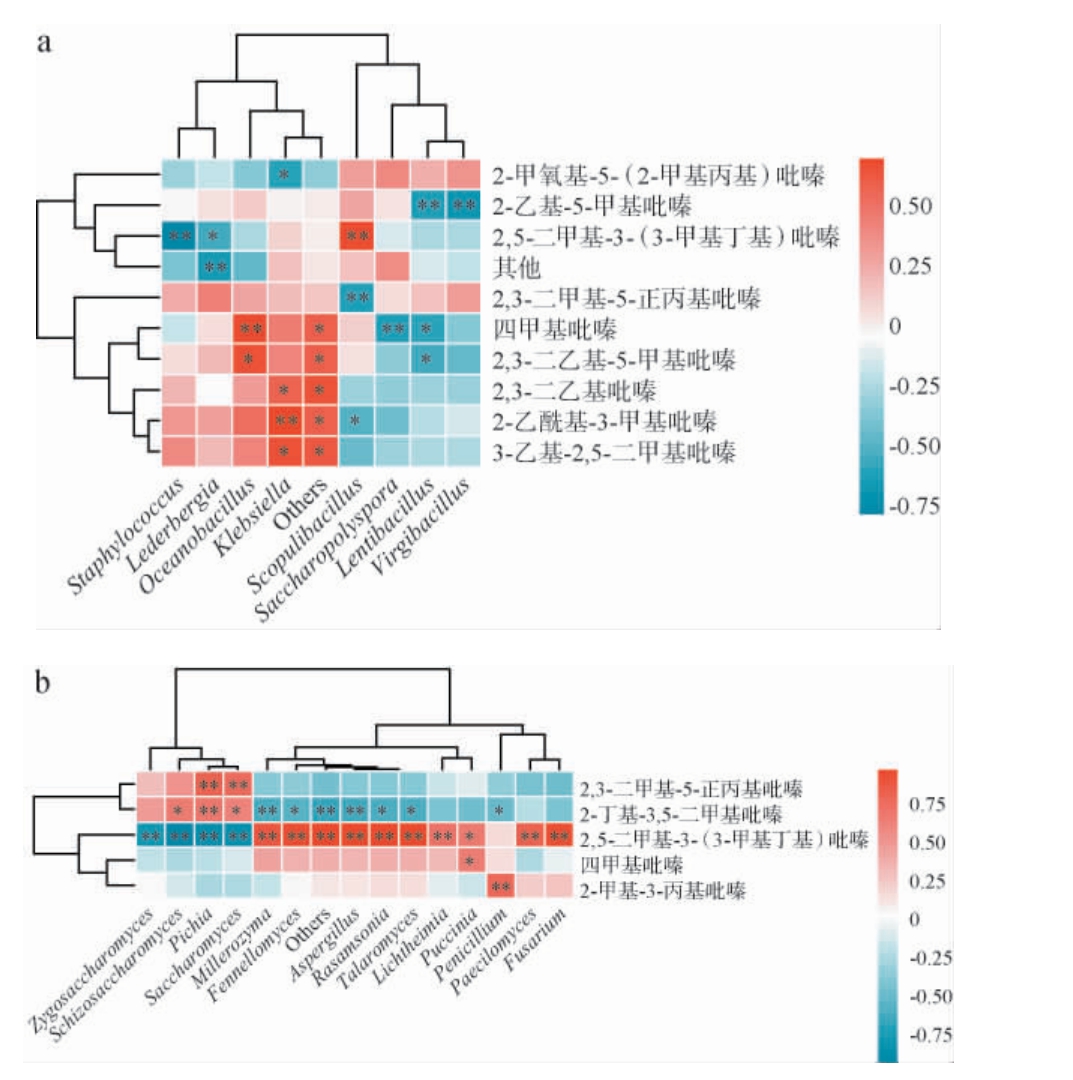
图5 酒醅堆积发酵过程中吡嗪类物质与细菌(a)和真菌(b)相关性分析
Fig.5 Correlation analysis of pyrazines and bacteria (a), fungi (b) of fermented grains during the pile fermentation process
“*”表示显著相关(P<0.05);“**”表示极显著相关(P<0.01)。下同。
由图5b可知,2,5-二甲基-3-(3-甲基丁基)-吡嗪与米勒酵母属(Millerozyma)、芬尼菌属(Fennellomyces)、烟曲霉属(Aspergillus)、埃默森罗萨氏菌(Rasamsomia)、篮状菌属(Talaromyces)、横梗霉属(Lichtheimia)、拟青霉属(Paecilomyces)、镰刀菌属(Fusarium)呈极显著正相关(P<0.01),与拟青霉属(Paecilomyces)呈显著正相关(P<0.01),与裂殖酵母属(Schizosaccharomyces)、酵母菌属(Saccharomyces)、毕赤酵母属(Pichia)、接合酵母属(Zygosaccharomyces)呈极显著负相关(P<0.01);2-丁基-3,5-二甲基吡嗪与毕赤酵母属(Pichia)呈极显著正相关(P<0.01),与裂殖酵母属(Schizosaccharomyces)、酵 母 菌 属(Saccharomyces)呈 显著正相关(P<0.05),与烟曲霉属(Aspergillus)、米勒酵母属(Millerozyma)呈极显著负相关(P<0.01),与芬尼菌属(Fennellomyces)、埃默森罗萨氏菌(Rasamsomia)、篮状菌属(Talaromyces)、青霉属(Penicillium)呈显著负相关(P<0.05);2,3-二甲基-5-正丙基吡嗪与毕赤酵母属(Pichia)、酵母菌属(Saccharomyces)呈极显著正相关(P<0.01);2-甲基-3-丙基吡嗪与拟青霉属(Paecilomyces)呈极显著正相关(P<0.01);四甲基吡嗪与柄锈属(Puccinia)呈显著正相关(P<0.05)。
堆积发酵酒醅中绝大部分吡嗪类物质的合成与克雷伯氏菌属(Klebsiella)、海洋芽胞杆菌属(Oceanobacillus)等细菌相关,此前有报道克雷伯氏菌属(Klebsiella)能够产生酯类、酸类等化合物[32],关于产2-乙酰基-3-甲基吡嗪鲜有报道,其产吡嗪的代谢机理有待进一步研究。 此外,吡嗪类化合物合成还与多种真菌相关,如子囊菌属(Millerozyma)、芬尼菌属(Fennellomyces)、烟曲霉属(Aspergillus)、埃默森罗萨氏菌(Rasamsomia)等,这与陈莹琪等[7]报道的吡嗪类物质与多种真菌呈正相关一致。 综上,酒醅微生物群落结构可影响吡嗪类风味物质的生成。
2.4.2 酱香型白酒酒醅堆积发酵过程中吡嗪类化合物与理化指标相关性分析
使用Spearman的计算方法,选择相关系数R>0.6,分析研究吡嗪类化合物与理化指标的相关性,结果见图6。由图6可知,粗蛋白含量和酸性蛋白酶活性对吡嗪类化合物的合成影响比较大。其中,2,5-二甲基-3-(3-甲基丁基)-吡嗪与总酸呈显著正相关(P<0.05),与粗蛋白、糖化酶呈极显著负相关(P<0.01);2,3-二甲基-5-正丙基吡嗪与粗蛋白呈极显著正相关(P<0.01),与含水量和糖化酶呈显著正相关(P<0.05),与总酸、酸性蛋白酶呈显著负相关(P<0.05)。四甲基吡嗪和2,3,5-三甲基吡嗪与酸性蛋白酶呈极显著正相关(P<0.01);2-乙酰基-3-甲基吡嗪与含水量和粗蛋白呈显著正相关(P<0.05)。结果表明,粗蛋白及酸性蛋白酶是影响吡嗪类物质合成的关键理化指标。
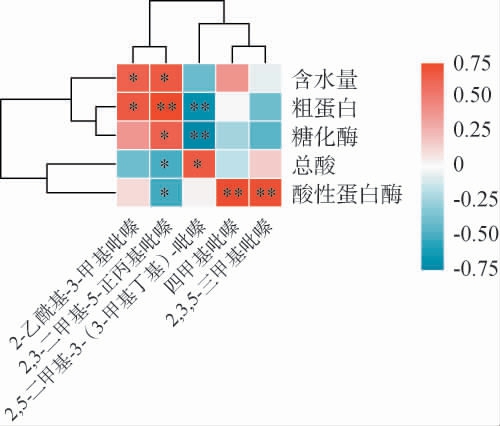
图6 酒醅堆积发酵过程中吡嗪类物质与理化指标相关性分析
Fig.6 Correlation analysis of pyrazines and physicochemical indicators of fermented grains during the pile fermentation process
3 结论
采用HS-SPME-GC-MS/MS测定酱香型白酒第三轮次堆积酒醅中吡嗪类化合物的含量,酒醅堆积发酵过程中共检测出35种吡嗪类化合物,含量较高的分别是2-乙酰基-3-甲基吡嗪(3.83~5.48 μg/g)和四甲基吡嗪(1.58~2.10 μg/g)。对理化指标检测结果显示总酸、α-淀粉酶活含量保持基本平稳略有降低;总淀粉、酸性蛋白酶和还原糖的含量成下降趋势;糖化酶活性和粗蛋白呈上升趋势;水分略有降低然后升高。
采用宏基因组学测序技术对堆积发酵酒醅中微生物群落进行分析,发现堆积发酵过程中优势细菌有慢生杆状菌属(Lentibacillus)、芽孢杆菌属(Bacillus)、海洋芽胞杆菌属(Oceanobacillus)等。堆积发酵第四天开始大量富集酵母属(Saccharomyces)、毕赤酵母属(Pichia)等。在堆积发酵过程中红曲霉属(Monascu)、拟青霉属(Paecilomyces)先增加后降低,曲霉属(Aspergillus)相对丰度随着堆积时间进行逐渐降低。总体来看,细菌群落结构整体相对稳定,真菌群落结构差异较大。
吡嗪类化合物与微生物菌群、理化指标相关性分析结果表明,2,5-二甲基-3-(3-甲基丁基)-吡嗪与岩石芽孢杆菌属(Scopulibacillus)及米勒酵母属(Millerozyma)、芬尼菌属(Fennellomyces)等真菌属及粗蛋白、糖化酶呈极显著相关(P<0.01),四甲基吡嗪与海洋芽胞杆菌属(Oceanobacillus)、糖多孢菌属(Saccharpolyspora)及酸性蛋白酶呈极显著相关(P<0.01)。本研究通过探讨酱香白酒堆积发酵过程中吡嗪类化合物、微生物及理化指标的动态变化,为酱香白酒堆积发酵过程中吡嗪类化合物生成机制解析提供理论依据。
[1]郭学武,范恩帝,马冰涛,等.中国白酒中微量成分研究进展[J].食品科学,2020,41(11):267-276.
[2]孙细珍,熊亚青,倪兴婷,等.吡嗪类化合物对酱香型白酒香气特征的影响分析[J].食品与发酵工业,2025,51(1):305-311.
[3]FAN W L, XU Y, ZHANG Y H, et al.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].J Agr Food Chem,2007,55:995662.
[4]罗强,刘杰,刘志刚.酱香型白酒中吡嗪类化合物体外抗炎作用研究[J].中国酿造,2019,38(7):156-160.
[5]王奕芳,周容,张明春,等.白酒中重要的功能化合物吡嗪的研究进展[J].酿酒,2018,45(6):20-24.
[6]张钰婷.基于代谢组学的酱香型白酒第四轮次发酵过程中酒醅微生物功能及影响因子分析[D].宜宾:四川轻化工大学,2023.
[7]陈莹琪,陈杰,周耀进,等.浓香型大曲微生物菌群演替与吡嗪类物质合成的关系[J].食品科学,2023,44(2):222-230.
[8]吴成,程平言,谢丹,等.酱香型白酒4轮次堆积发酵理化因子、风味物质与微生物群落相关性分析[J].食品科学,2023,44 (2):240-247.
[9]朱安然,汪地强,胡建锋,等.酱香型白酒一轮次糟醅微生物群落结构及溯源分析[J].食品科学,2025,46(4):117-125.
[10]杨金川,黄家岭,白雪梅,等.SPE-GC-MS/MS法同时检测贵州酱香型白酒中12种吡嗪类化合物[J].中国酿造,2025,44(2):261-267.
[11]VALENTINA L, ANGIOLA F, SARA P P, et al.HS-SPME-GC-MS metabolomics approach for sperm quality evaluation by semen volatile organic compounds (VOCs) analysis[J].Biomed Phys Eng Express,2019,5(1):015006.
[12]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:197-198.
[13]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:202-204.
[14]商海林.中高温大曲高产糖化酶及蛋白酶活力菌株的筛选与应用研究[D].济南:齐鲁工业大学,2024.
[15]LI D,LIU C M,LUO R,et al.MEGAHIT:An ultra-fast single-node solution for large and complex metagenomics assembly via succinct de Bruijn graph[J].Bioinformatics,2015,31(10):1674-1676.
[16]FU L,NIU B,ZHU Z,et al.CD-HIT:Accelerated for clustering the nextgeneration sequencing data[J].Bioinformatics,2012,28(23):3150-3152.
[17]张春林,杨亮,李喆,等.酱香型白酒酒醅堆积微生物多样性及其与风味物质的关系[J].食品科技,2022,47(4):111-118.
[18]丁海龙,沈小娟,宋川,等.中国白酒健康功能成分吡嗪类化合物研究进展[J].中国酿造,2022,41(9):8-12.
[19]朱艳美,陈亨业,邓高琼,等.高温大曲白酒中吡嗪类化合物的检测、来源、香气和功能活性研究进展[J].食品工业科技,2023,44(5):420-428.
[20]吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[21]吕晓凤.高产吡嗪类化合物的芽孢杆菌在芝麻香白酒中的应用研究[D].济南:齐鲁工业大学,2023.
[22]MA S Y,LUO H B,ZHAO D,et al.Environmental factors and interactions among microorganisms drive microbial community succession during fermentation of Nongxiangxing Daqu[J].Biores Technol,2021,345:126549.
[23]MULLER R,SUGIMA R.Pyrazines:Occurrence,formation and biodegradation[J].Appl Microbiol Biot,2010,85(5):1315-1320.
[24]戴奕杰,李宗军,田志强,等.酱香型白酒酿造过程中微生物及其代谢产物研究进展[J].酿酒科技,2018(11):85-96.
[25]袁再顺.“破堆移位”对酱香型白酒冬季堆积发酵的影响研究[D].贵阳:贵州大学,2019.
[26]王欢,席德州,黄永光,等.酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性分析[J].食品科学,2020,41(2):188-195.
[27]李悦明,王泽欣,徐建春,等.一种酿酒用海洋产酸菌株及其应用:CN201811183960.0[P].2021-04-02.
[28]吴双全,柴丽娟,黄廷财,等.酱香型白酒堆积酒醅中象牙色克罗彭斯特德菌的分离筛选及其代谢特性解析[J].微生物学报,2024,64(7):2502-2521.
[29]戎梓溢,白茹,闫学娇,等.酱香型白酒酿造微生态中酵母菌的研究进展[J].食品研究与开发,2022,43(13):180-188.
[30]朱治宇.茅台镇酱香型白酒酿造区域霉菌多样性特征研究[D].贵阳:贵州大学,2020.
[31]胡春红,李新涛,卢君,等.酱香型白酒酒醅堆积过程酵母菌、酶活力及代谢产物变化规律[J].中国酿造,2024,43(6):66-73.