清香型白酒作为中国白酒三大主体香型之一[1],以高粱为主料、小麦与豌豆为辅料,经地缸固态发酵与清蒸二次清工艺酿制,酒体绵甜协调,传统代表为山西汾酒[2]。该工艺将发酵过程明确划分为大米查和二米查两个阶段:大米查酒醅由酿酒原料高粱经蒸煮糊化、摊晾下曲后入缸发酵制得;二米查酒醅则是在大米查出缸蒸馏取酒后、对糟醅再次蒸煮糊化、摊晾下曲并续米查发酵获得。因工艺差异,不同发酵阶段蒸馏出酒的风味有一定差异,大米查酒清香纯正,二米查酒清香中略透糟香,风味层次分明[3]。
清香型白酒酒醅发酵过程中,水分及淀粉含量等理化指标的变化会影响微生物代谢活动,进而影响白酒风味特征[4]。 因此,研究酒醅发酵过程中理化指标及微生物菌群的动态变化有助于阐明清香型白酒酿造机制。 成冬冬等[3]研究结果表明,清香型大曲白酒大米查、二米查酒醅中的水分可以促进糖化和发酵,酸度的增加可以促进酯类物质形成。贾丽艳等[5-6]研究发现,子囊菌纲的腹膜孢酵母属、酵母属、假丝酵母属、有孢汉逊酵母属和有孢圆酵母属为传统清香型白酒大米查、二米查发酵主要优势菌群。雷振河[6]研究表明,醋酸杆菌科和乳杆菌科是清香型发酵酒醅中优势原核微生物,而假丝酵母和毕赤酵母科是优势真核微生物。然而,目前关于系统解析清香型白酒酒醅发酵过程中理化指标与微生物菌群相关性的研究鲜见报道。
本研究以清香型白酒大米查和二米查酒醅为研究对象,采用常规检测方法及高通量测序技术分析其发酵过程中理化指标及微生物菌群变化,并基于检测结果进行主坐标分析(principal co-ordinates analysis,PCoA)、冗余分析(redundancy analysis,RDA)。旨在解析清香型白酒的酿造机理,为发酵过程中微生物的调控和代谢机制提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 酒醅样品
大米查酒醅、二米查酒醅:采用多点取样法分别采集武汉某酒企清香型白酒大米查酒醅发酵第0天、7天、14天、21天、28天样品(分别标记为D-0、D-7、D-14、D-21、D-28)以及二米查酒醅发酵同期样品(分别标记为E-0、E-7、E-14、E-21、E-28)。
1.1.2 试剂
Fast脱氧核糖核酸(deoxyribonucleic acid,DNA) Spin Kit for Soil DNA抽提试剂盒: 美国MP Biomedicals公司;Biowest Agarose琼脂糖:西班牙Biowest公司;AxyPrep DNA Gel Extraction Kit:美国Axygen公司;NEXTFLEX Rapid DNA-Seq Kit建库试剂盒:美国Bioo Scientific公司;MiSeq Reagent Kit测序试剂盒:美国Illumina公司。
Spin Kit for Soil DNA抽提试剂盒: 美国MP Biomedicals公司;Biowest Agarose琼脂糖:西班牙Biowest公司;AxyPrep DNA Gel Extraction Kit:美国Axygen公司;NEXTFLEX Rapid DNA-Seq Kit建库试剂盒:美国Bioo Scientific公司;MiSeq Reagent Kit测序试剂盒:美国Illumina公司。
1.2 仪器与设备
Eppendorf 5430R小型离心机、Eppendorf 5424R高速台式冷冻离心机:德国Eppendorf公司;BioTek ELx800型酶标仪:美国Biotek公司;NanoDrop 2000超微量分光光度计:美国Thermo Fisher Scientific公司;FastPrep-24 5G MP研磨仪:美国MP公司;QL-901型旋涡混合器:海门市其林贝尔仪器制造有限公司;DYY-6C电泳仪:北京市六一仪器厂;ABI GeneAmp 型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司。
型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司。
1.3 方法
1.3.1 理化指标检测水分、还原糖、淀粉含量及酒精度、酸度测定:参照T/CBJ 004—2018《固态发酵酒醅通用分析方法》。
1.3.2 Illumina MiSeq高通量测序分析
DNA提取:采用Fast DNA Spin Kit for Soil试剂盒抽提0.5 g酒醅样本的总DNA,通过1%琼脂糖凝胶电泳检验DNA完整性。
Spin Kit for Soil试剂盒抽提0.5 g酒醅样本的总DNA,通过1%琼脂糖凝胶电泳检验DNA完整性。
PCR扩增:采用细菌引物341F(5'-ACTCCTACGGGAGGCAGCAG-3')、806R(5'-GGACTACHVGGGTWTCTAAT-3')PCR扩增16S rRNA的V3-V4区基因序列;采用真菌引物ITS1F(5'-TCCGTAGGTGAACCTGCGG-3')、ITS1R(5'-GCTGCGT-TCTTCATCGATGC-3')扩增ITS1区基因序列。PCR扩增体系(50μL):分别提取样品中细菌和真菌DNA各10 ng,细菌、真菌上下游引物各1 μL,PCR混合液25 μL,采用双蒸水(ddH2O)定容至50 μL。 PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35次循环;72 ℃终延伸5 min[7]。 将PCR产物纯化后送往上海美吉生物医药科技有限公司进行测序。
1.3.3 生物信息学分析
对原始测序数据进行质量评估,剔除低质量序列,同时对双端测序数据进行拼接。然后对优化后的序列进行嵌合体检测,使用UPARSE 7.1以97%相似度阈值进行操作分类单元(operational taxonomic units,OTU)聚类,分别对细菌16S rRNA基因序列及真菌ITS序列进行物种注释。
1.3.4 数据处理
通过Shannon指数、Simpson指数等指标评估菌群Alpha多样性,采用SPSS26.0分析Wilcoxon秩和组间差异,通过主坐标分析(PCoA)可视化样本间群落结构差异,利用R语言vegan包进行冗余分析(RDA),探究环境因子与微生物群落结构的相关性,采用Origin 2022绘图。
2 结果与分析
2.1 大米查酒醅、二米查酒醅发酵过程中理化指标的变化
大米查、二米查酒醅发酵过程中理化指标的变化见图1。水分作为酒醅发酵过程的关键指标,既受微生物代谢活动的动态调控,又为菌群生长繁殖提供必要的环境条件[8]。由图1a可知,发酵0~28 d内,大米查、二米查酒醅水分含量呈先升高后平稳的趋势。发酵时间分别为7 d、14 d时,水分含量基本不变,当发酵结束时,大米查、二米查酒醅水分含量分别为63.23%和68.51%。其原因可能是,大米查酒醅发酵过程中,淀粉水解会消耗更多的水分,二米查进入到发酵中后期,原料结构疏松,吸湿性增强,且微生物在分解残余糖类及复杂有机物的同时产生水分[9]。
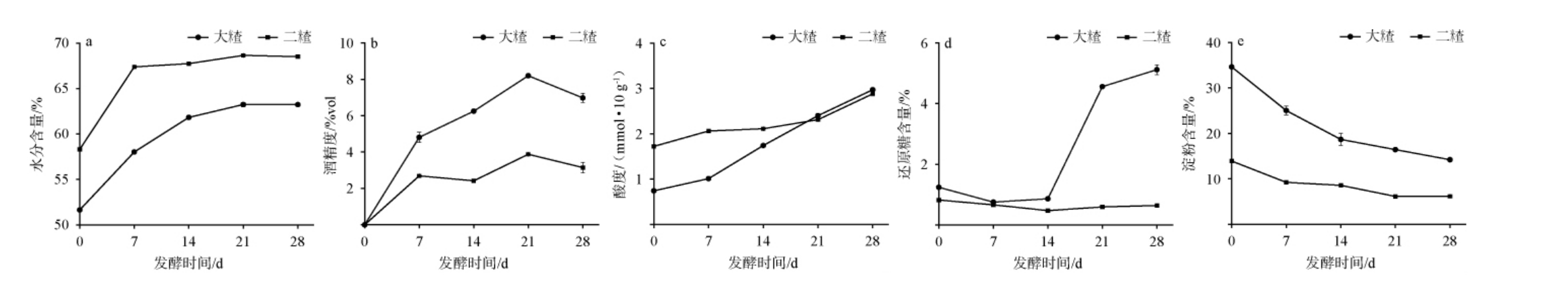
图1 大米查、二米查酒醅发酵过程中理化指标的变化
Fig.1 Changes of physicochemical indexes of Dacha and Ercha fermented grains during fermentation process
酒精度作为反映酵母菌生长代谢的核心指标,既受酵母增殖活性的影响,又可反映发酵产醇效率[10]。由图1b可知,随着发酵时间在0~21 d的增加,大米查及二米查酒醅的酒精度均呈升高趋势;当发酵时间为21 d时,大米查及二米查酒醅的酒精度均达到最高值分别为8.20%vol和3.88%vol;发酵时间>21 d,酒精度均下降;发酵结束时,大米查及二米查酒醅的酒精度分别为6.98%vol、3.15%vol。大米查酒醅发酵过程中酒精度均高于二米查酒醅。其原因可能是,发酵0~21 d时,大米查酒醅原料中淀粉等底物充足,酵母菌生长代谢旺盛,酒精含量增加,之后温度降低,酵母菌代谢活动受到抑制,厌氧微生物利用酒精进行生长繁殖;二米查酒醅因前期淀粉消耗较多,且产酸菌增殖竞争营养,导致酵母产醇能力受限,这种“大米查增速快、峰值高,二米查达峰早、幅度低”的差异,体现了清香型白酒“前紧、中挺、后缓落”的典型发酵特征[3]。
酒醅酸度作为反映产酸菌代谢活性的关键指标,既受微生物群落结构变化的影响,又可调控发酵环境的酸碱平衡[11]。 由图1c可知,发酵时间为0~21 d时,大米查及二米查酒醅酸度均缓慢增加,二米查酒醅酸度整体高于大米查酒醅;发酵时间为21~28 d时,大米查、二米查酒醅酸度均明显增加,且两者无明显差异;发酵结束时,大米查、二米查酒醅酸度分别为2.97 mmol/10 g、2.88 mmol/10 g。这可能是由于发酵前期0~7 d产酸菌受酵母竞争抑制而增殖较慢,发酵后期21~28 d酵母菌代谢活动受到抑制后,产酸菌占据优势并加速分解残余营养物质生成有机酸[12]。
酒醅中淀粉与还原糖含量可作为反映底物代谢进程的核心指标,为菌群生长代谢提供碳源基础[13]。由图1d知,发酵时间为0~14 d时,大米查酒醅还原糖含量呈先下降后上升趋势;当发酵时间为14~28 d时,大米查酒醅还原糖含量明显上升;发酵结束时,大米查酒醅还原糖为5.12%。发酵时间为0~28 d时,二米查酒醅还原糖含量整体稳定在0.47%~0.82%。分析原因大米查酒醅呈现“下降-上升-再上升”的三阶段模式,其可能是由于微生物群落结构的影响[3]。 大米查在发酵前期淀粉水解产糖与微生物消耗速率平衡,后发酵后期因温度降低、乙醇积累及微生物活性稳定,糖消耗量小于生成量[14];二米查酒醅初始底物较少,产糖与耗糖始终处于低水平。
由图1e可知,发酵0 d时,大米查和二米查酒醅淀粉含量分别为34.61%、13.92%,随着发酵的进行,淀粉含量均下降;当发酵结束时,其淀粉含量分别为14.22%和6.18%。
综上所述,发酵过程中,大米查酒醅因淀粉发酵前期(0~7 d)丰富,酒精转化效果好,但发酵后期(21~28 d)高醇高酸环境导致代谢停滞,还原糖含量为5.12%,奠定酒体醇厚基调;二米查则侧重快速产酸,因发酵前期(0~7 d)淀粉含量较低,导致发酵过程中还原糖含量变化不明显,可赋予酒体清雅纯净特质。二者体现“前紧、中挺、后缓落”的南方清香型白酒典型发酵模式。
2.2 大米查、二米查酒醅发酵过程中微生物菌群Alpha多样性分析
操作分类单元(OTU)是基于序列相似性聚类形成的分类单元,用于代表微生物群落中观测到的物种或分类单位[15]。Coverage反映样本中微生物群落的覆盖度,其数值越高,则样品中序列被测出的概率越高[16];Shannon指数越高表明群落多样性越高[17];Chao1指数值越大表明群落中物种越丰富[18]。大米查、二米查酒醅发酵过程中细菌、真菌菌群Alpha多样性分析见表1。由表1可知,大米查、二米查酒醅样品细菌、真菌Coverage均达到99.94%以上,反映测序数据覆盖到大米查、二米查样品中所有的生物物种;大米查、二米查酒醅中的细菌OTU数量分别在60~229个和38~162个之间,大米查、二米查酒醅中真菌OTU数量分别在25~52个和38~48个之间,说明在酒醅发酵过程中,细菌的丰富度及多样性高于真菌。随着发酵时间的延长,大米查酒醅中细菌、真菌的Shannon指数整体均呈先降低后有所升高的变化趋势,而Chao1指数均整体呈先降低后升高的趋势。由此可见,大米查酒醅发酵初期(0d),适宜的水分活度与弱酸性环境,有利于微生物繁殖,群落丰富度和多样性较高;随着发酵进行,营养底物耗竭导致细菌多样性下降。 二米查酒醅发酵过程中细菌和真菌的Shannon指数呈波动变化趋势;细菌的Chao1指数呈持续降低的趋势,而真菌的Chao1指数呈先上升后降低的趋势。综上,大米查、二米查酒醅发酵过程中细菌、真菌菌群Alpha多样性存在明显差异。
表1 大米查、二米查酒醅发酵过程中细菌、真菌菌群Alpha多样性分析结果
Table 1 Alpha diversity analysis results of bacterial and fungal community of Dacha and Ercha fermented grains during fermentation process
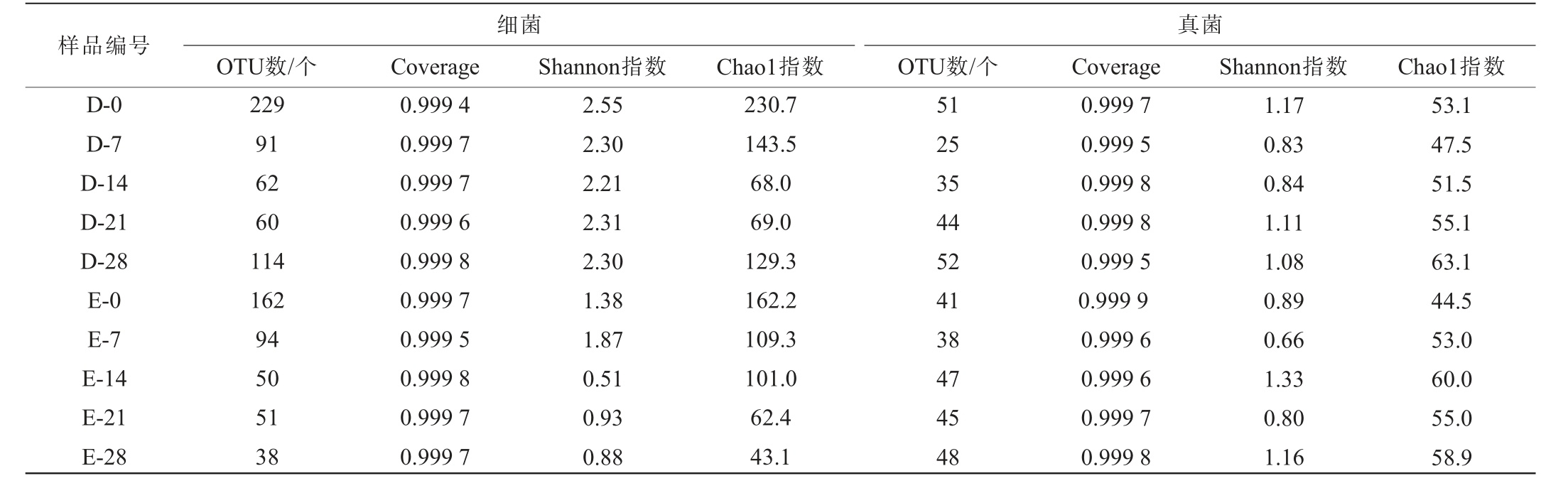
样品编号D-0 D-7 D-14 D-21 D-28 E-0 E-7 E-14 E-21 E-28细菌OTU数/个 Coverage Shannon指数Chao1指数真菌OTU数/个 Coverage Shannon指数 Chao1指数229 91 62 60 114 162 94 50 51 38 0.999 4 0.999 7 0.999 7 0.999 6 0.999 8 0.999 7 0.999 5 0.999 8 0.999 7 0.999 7 2.55 2.30 2.21 2.31 2.30 1.38 1.87 0.51 0.93 0.88 230.7 143.5 68.0 69.0 129.3 162.2 109.3 101.0 62.4 43.1 51 25 35 44 52 41 38 47 45 48 0.999 7 0.999 5 0.999 8 0.999 8 0.999 5 0.999 9 0.999 6 0.999 6 0.999 7 0.999 8 1.17 0.83 0.84 1.11 1.08 0.89 0.66 1.33 0.80 1.16 53.1 47.5 51.5 55.1 63.1 44.5 53.0 60.0 55.0 58.9
2.3 大米查、二米查酒醅发酵过程中微生物菌群结构分析
2.3.1 细菌菌群结构分析
基于门和属水平大米查、二米查酒醅发酵过程中细菌菌群结构见图2。由图2a可知,在门水平上,两种酒醅样品共鉴定出21个细菌门,注释到3个优势细菌门(平均相对丰度>1.0%),分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)。 其中,厚壁菌门(Firmicutes)在大米查、二米查酒醅整个发酵过程中均为绝对优势菌群(平均相对丰度分别为87.86%和85.50%),且其相对丰度先增加后趋于稳定。 变形菌门(Proteobacteria)和放线菌门(Actinobacteria)在发酵初期(0~7 d)相对丰度整体呈降低趋势。

图2 基于门(a)和属(b)水平大米查、二米查酒醅发酵过程中细菌菌群结构
Fig.2 Bacterial community structure of Dacha and Ercha fermented grains during fermentation process based on phylum (a)and genus (b) levels
由图2b可知,在属水平上,两种酒醅样品中共检出250种细菌属,注释到5个优势细菌属(平均相对丰度>1.0%),分别为乳酸杆菌属(Lactobacillus)、克罗彭斯特菌属(Kroppensteditia)、红球菌属(Rhodococcus)、假单胞菌属(Pseudomonas)和片球菌属(Pediococcus)。 乳酸杆菌属(Lactobacillus)为大米查和二米查酒醅发酵过程中的主要优势细菌属(其平均相对丰度分别为88.61%与59.05%),其在大米查酒醅中相对丰度从发酵起始(0 d)的8.21%急剧上升至7 d的83.37%,7~28 d基本保持稳定(83.37%~88.61%)。 其在二米查酒醅中相对丰度在发酵0~7 d期间内较低(1.24%~9.01%),发酵至14 d时,其相对丰度增加至92.87%,之后持续小幅上升,发酵结束时,其相对丰度达97.19%。乳酸杆菌属通过代谢糖类生成乳酸、乙酸等有机酸[19],不仅能有效抑制病原菌(如假单胞菌属)增殖[20],其营造的酸性环境还可协同筛选耐酸功能菌群,强化发酵体系稳定性。同时,这些有机酸是发酵前期pH下降的主因,与高乙醇浓度协同形成酸-醇胁迫环境[21],并为乳酸乙酯等酯类风味物质提供合成前体。在发酵起始(0 d)时,克罗彭斯特菌属(Kroppenstedtia)在大米查和二米查酒醅初始相对丰度分别为22.55%和79.04%。然而,其相对丰度随发酵的进行逐渐降低,发酵结束时,其相对丰度均降至1.0%。 该菌属在发酵前期相对丰度较高,对醋酸、乳酸及乙酸乙酯合成具积极作用[22],发酵后期由于其耐酸能力有限,在酸-醇胁迫环境下被乳酸杆菌属取代,功能随之弱化。除上述菌属外,发酵0 d时大米查酒醅的主要优势微生物菌属为红球菌属、假单胞菌属和芽孢杆菌属,而二米查酒醅以代尔夫特菌属(Delftia)和链霉菌属(Streptomyces)为主。 此外,在大米查酒醅中片球菌属在发酵0 d相对丰度较低(0.96%),7 d上升至6.75%,21 d相对丰度达到最高值9.70%,这可能是由于片球菌属为兼性厌氧菌,且大米查酒醅水分>60%的环境利于其生长,因此发酵中后期丰度上升。 综上,大米查、二米查酒醅发酵过程中的细菌菌群结构存在一定差异。
2.3.2 真菌菌群结构分析
在门和属水平上对大米查、二米查酒醅发酵过程中真菌菌群结构进行分析,结果见图3。 由图3a可知,两种酒醅样品在发酵过程中共检测出2个真菌门,分别为子囊菌门(Ascomycota)和担子菌门(Basidiomycota)。 其中子囊菌门在所有酒醅样品中均检出,其在大米查、二米查酒醅中平均相对丰度均>99%,在整个真菌群落中占绝对优势地位[23]。这与李艳婷等[24]报道结果一致,子囊菌门不仅是清香型酒醅中的优势真菌类群,也是浓香、酱香型白酒及食醋、面包等多种发酵食品中的主要真菌种群[25]。
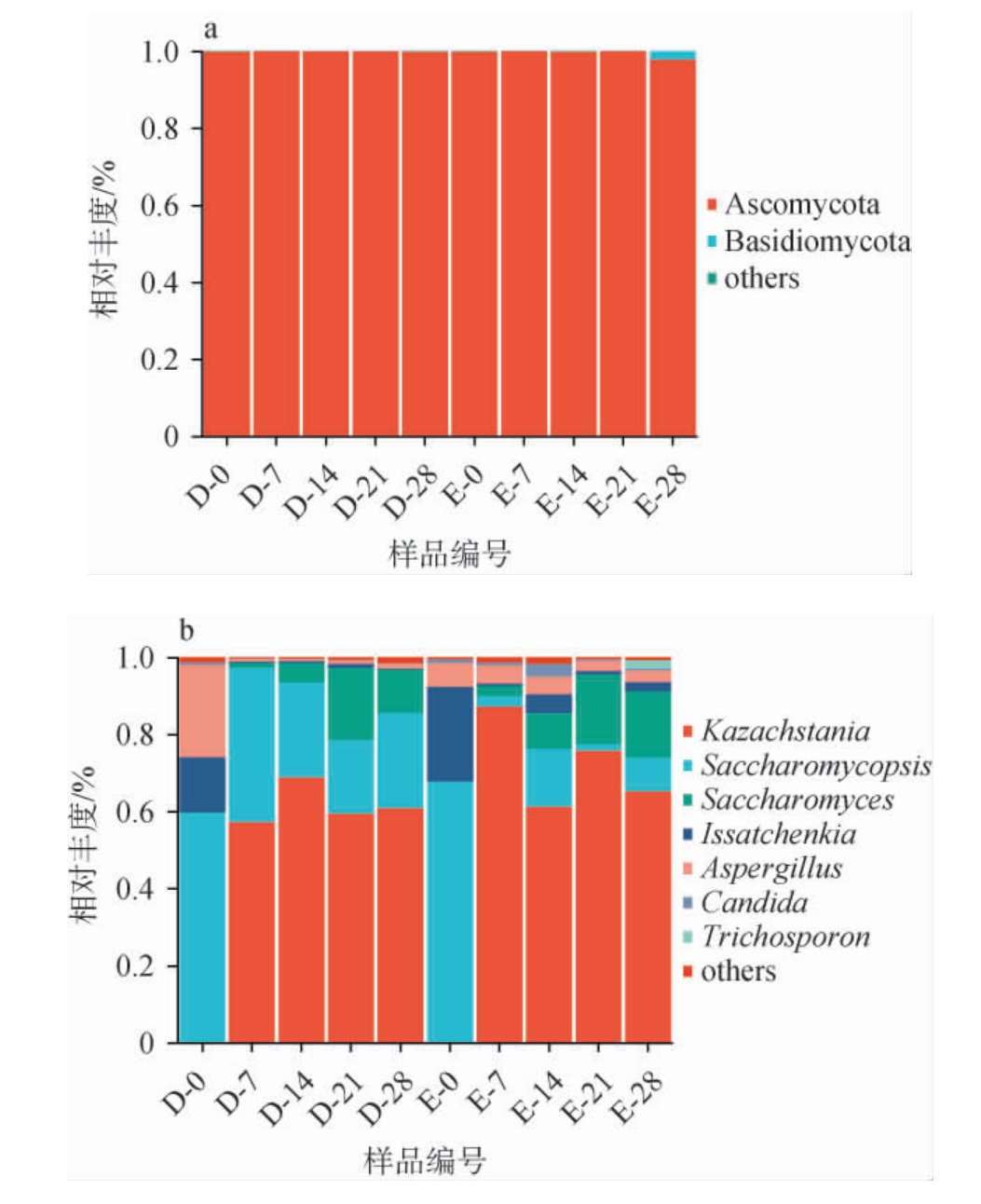
图3 基于门(a)和属(b)水平大米查、二米查酒醅发酵过程中真菌菌群结构
Fig.3 Fungal community structure of Dacha and Ercha fermented grains during fermentation process based on phylum (a)and genus (b) levels
将相对丰度>1%的菌属定义为优势菌属,这类菌属对发酵过程和白酒风味组成起关键作用。由图3b可知,两种酒醅样品中共检出48种真菌属,注释到7个优势细菌属(平均相对丰度>1.0%),分别为哈萨克斯坦酵母属(Kazachstania)、复膜孢酵母属(Saccharomycopsis)、酵母属(Saccharomyces)、伊萨酵母属(Issatchenkia)、曲霉属(Aspergillus)、假丝酵母属(Candida)和丝孢酵母属(Trichosporon)。 其中,哈萨克斯坦酵母属和复膜孢酵母属的平均相对丰度较高,在大米查、二米查酒醅样品发酵过程中起主导作用。发酵起始0 d时,大米查、二米查酒醅中的主要真菌属为复膜孢酵母属、伊萨酵母属和曲霉属,发酵7~28 d期间,两种酒醅的主要真菌属转变为哈萨克斯坦酵母属、复膜孢酵母属和酵母属,与发酵初期的真菌属组成存在明显差异。 随着发酵的进行,大米查、二米查酒醅中哈萨克斯坦酵母属呈现爆发式演替特征:在大米查酒醅中, 该菌属相对丰度于7 d达57.32%,14 d升至最高值(68.91%),后在28 d稳定至60.93%;在二米查酒醅中,该菌属增长更快,7 d相对丰度即达87.29%,发酵结束(28 d)时为65.35%。大米查酒醅在发酵起始淀粉含量较高(34.61%),可持续提供碳源,延长哈萨克斯坦酵母属的活性周期,促进酯类合成[26]。XU S S等[27]研究表明,该菌属在发酵初期10 d基因表达活跃,通过调控酯合成通路显著促进乙酸酯及中链脂肪酸乙酯生物合成。而二米查酒醅发酵初期淀粉含量较低(13.92%),碳源短缺迫使该菌属提前进入衰亡期[28]。复膜孢酵母菌属在发酵进程中发挥核心功能,通过分泌蛋白酶与淀粉水解酶类[29],驱动淀粉基质降解。该菌属在大米查酒醅中相对丰度由发酵0 d的59.65%持续下降至发酵21 d的19.09%,发酵结束(28 d)小幅回升至24.76%;该菌属在二米查酒醅中的相对丰度由发酵0 d的67.79%逐渐下降至发酵结束(28 d)的8.63%。 大米查酒醅中,复膜孢酵母菌属分泌的淀粉酶可将淀粉降解后生成还原糖[30],为后期哈萨克斯坦酵母属的酒精转化与酯类合成提供碳源;而二米查酒醅中底物含量较少,导致其糖化、发酵能力不足[31]。此外,大米查、二米查酒醅中的酵母属在发酵0 d相对丰度较低,7 d时提高,21 d达到最高值(分别为18.78%和18.16%)。这可能是由于发酵过程中糖分积累且形成厌氧环境,酵母属开始快速增殖,主导酒精发酵过程,使酒精度迅速升高。
2.4 大米查、二米查酒醅发酵过程中微生物菌群结构差异分析
主坐标分析(PCoA)常用来研究样品间微生物群落结构的相似性和差异性[32]。基于Bray-Curtis对大米查、二米查酒醅发酵过程中微生物菌群结构进行主坐标分析,结果见图4。
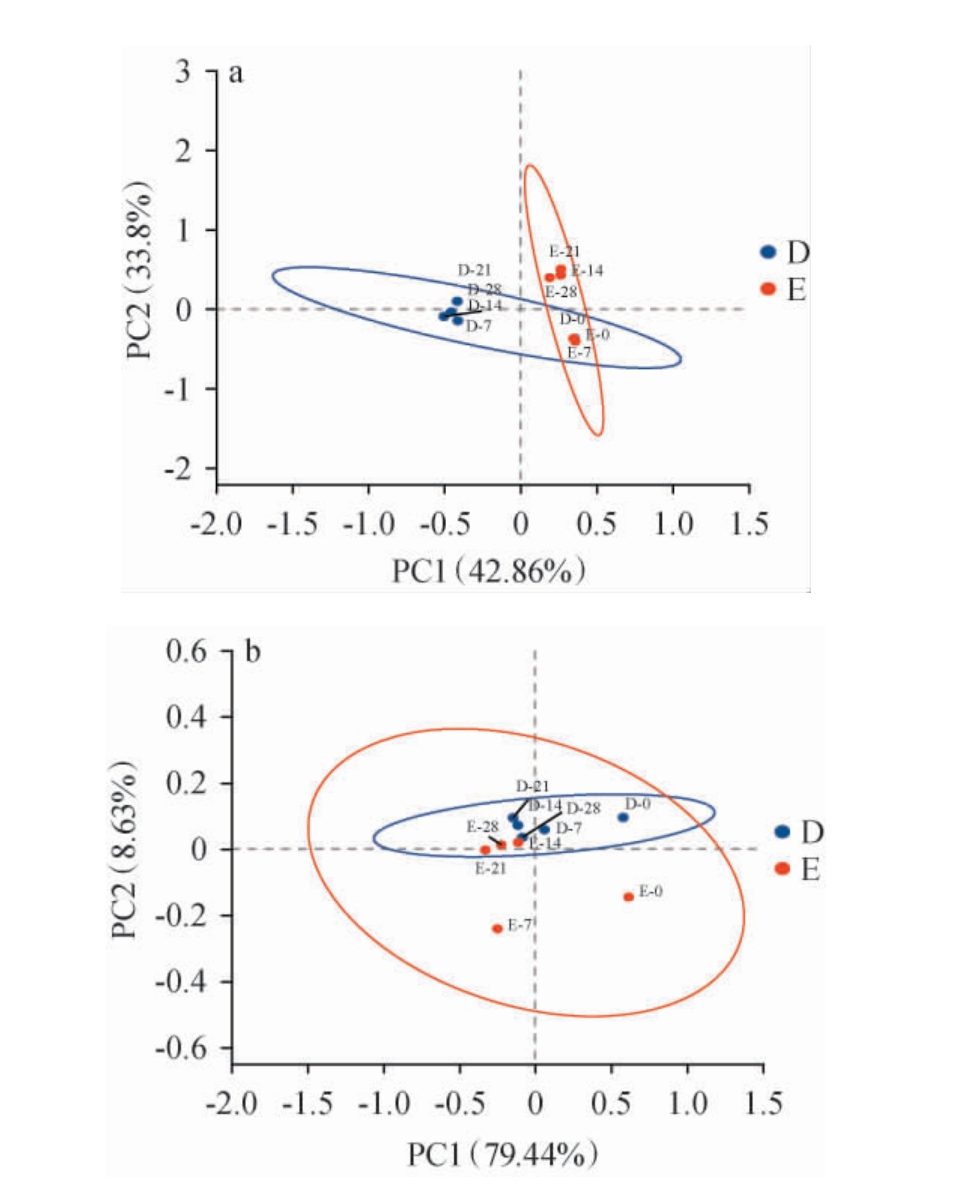
图4 大米查和二米查酒醅发酵过程中细菌菌群(a)和真菌菌群(b)的主坐标分析结果
Fig.4 Principal coordinate analysis results of bacterial (a) and fungal (b) community of Dacha and Ercha fermented grains during fermentation process
由图4a可知,大米查酒醅、二米查酒醅发酵过程中细菌群落组成呈现聚类特征,划分为两个集群:酒醅样品(D-0、D-7、D-14、D-21、D-28、E-0、E-7)和二米查酒醅(E-0、E-7、E-14、E-21、E-28)。该聚类结果表明,大米查与二米查酒醅发酵过程中细菌群落组成存在明显差异。进一步分析发现,D-0、E-0和E-7样品的聚集性较强,说明发酵初期,大米查、二米查酒醅细菌群落结构表现出较高的稳定性及一定的相似性,而发酵前后酒醅细菌群落差异明显。由图4b可知,大米查、二米查酒醅真菌群落组成上呈现聚类特征可分为两个集群:一个集群包含大部分酒醅样品(D-0、D-7、D-14、D-21、D-28、E-14、E-21、E-28),另一个集群则主要由E-0和E-7样品构成,这直观反映出样品E-0和E-7与其他酒醅样品在真菌群落结构上存在明显差异。此外,样品D-0与其他酒醅样品之间也存在一定差异性,表明发酵初期大米查、二米查酒醅的真菌群落组成复杂且具有较大的差异性,而随着发酵的进行,大米查、二米查酒醅的真菌群落组成逐渐一致,这与上述微生物菌群结构分析结果相符。
2.5 大米查、二米查酒醅发酵过程中理化指标及微生物菌群结构冗余分析
冗余分析(RDA)是通过线性模型探究微生物群落与环境因素相关联的主要多元分析方法,揭示环境、样品、菌群之间复杂的相互关系[33]。将理化指标(水分、酸度、酒精度、淀粉含量及还原糖含量)与相对丰度排名前3的细菌属、真菌属进行相关性分析,结果见图5。 由图5a可知,乳酸杆菌属与水分、酒精度、酸度、还原糖呈显著正相关(P<0.05),与淀粉呈极显著负相关(P<0.01),表明其在高水分、高酸醇环境下大量增殖,且依赖淀粉消耗实现代谢;克罗彭斯特菌属、红球菌属与淀粉呈正相关,与水分、酸度、酒精度及还原糖呈负相关,体现其在发酵前期(淀粉丰富、水分及酸度等指标较低时)的优势地位。其中,水分作为微生物代谢的环境基础,与乳酸杆菌属正相关,间接推动发酵后期酸醇积累和群落结构稳定;淀粉作为核心碳源,其消耗直接驱动克罗彭斯特菌属、红球菌属衰落、乳酸杆菌属崛起的细菌群落演替[34]。由图5b可知,复膜孢酵母属与淀粉含量呈显著正相关(P<0.05),与水分等呈负相关,说明其在发酵前期(淀粉充足、水分适宜时)主导淀粉降解;哈萨克斯坦酵母属和酵母属与水分、酒精度、酸度及还原糖呈正相关(P<0.05),与淀粉呈负相关,体现其在发酵中后期(淀粉消耗、水分、酸度及酒精度升高时)主导酒精发酵的特性。其中,水分作为真菌代谢的环境因子,为哈萨克斯坦酵母属和酵母属酒精发酵提供微环境支持;淀粉消耗驱动复膜孢酵母属衰落,哈萨克斯坦酵母属和酵母属崛起的真菌群落演替,同时酸、醇积累进一步强化这一过程[35]。综上,淀粉消耗直接驱动细菌与真菌群落的演替更迭,而酸度、酒精度与水分则通过改变微环境间接调控群落结构。

图5 大米查和二米查酒醅发酵过程中理化指标与细菌菌群(a)、真菌菌群(b)冗余分析结果
Fig.5 Redundancy analysis results of physicochemical indexes and bacterial (a) and fungal (b) community of Dacha and Ercha fermented grains during fermentation process
3 结论
本研究通过采用常规理化检测方法结合高通量测序揭示南方清香型白酒大米查、二米查酒醅发酵过程中理化性质及微生物菌群结构变化。结果表明,大米查、二米查酒醅发酵过程中水分、酒精度及淀粉含量变化趋势相似,而酸度及还原糖含量变化趋势存在一定差异;当发酵结束时,与二米查酒醅相比,大米查酒醅酒精度、水分、还原糖及淀粉含量、酸度均较高。大米查、二米查酒醅发酵过程中优势细菌属包括乳酸杆菌属、克罗彭斯特菌属、红球菌属、假单胞菌属和片球菌属;优势真菌属包括哈萨克斯坦酵母属、复膜孢酵母属、酵母属、伊萨酵母属、曲霉属、假丝酵母属和丝孢酵母属。PCoA结果表明,发酵初期(0~7 d),大米查、二米查酒醅细菌群落结构较为相似,而真菌群落结构差异较大。 RDA分析表明,淀粉含量作为关键驱动因子,其消耗直接驱动细菌与真菌群落的演替更迭,而酸度、酒精度与水分则通过改变微环境间接调控群落结构相关性。该结果阐明了酒醅微生态与理化因子的互作规律,为工艺优化与品质提升提供理论靶点。
[1]赵欣怡,甄攀,赵鑫锐,等.清香型白酒立醅期酒醅中主体酸和细菌菌群结构动态解析[J].食品与发酵工业,2022,48(9):26-33.
[2]田德雨,闫子茹,危晶晶,等.清香型白酒酿造微生物和风味物质的研究进展[J].中国酿造,2021,40(4):20-25.
[3]成冬冬,董灿灿,徐媛媛,等.清香型白酒酒醅理化指标变化规律研究[J].食品科技,2022,47(6):92-97.
[4]张淼,黄怡,蔡文超,等.宣城地区中温大曲品质及微生物多样性解析[J/OL].食品与发酵工业,1-11[2025-10-31].https://doi.org/10.13995/j.cnki.11-1802/ts.043636.
[5]贾丽艳,田宇敏,王晓勇,等.传统清香型白酒发酵过程中真菌群落结构及其动态演替[J].中国食品学报,2020,20(10):303-308.
[6]雷振河.采用高通量测序技术分析清香型白酒酿造微生物[J].食品与发酵工业,2015,41(9):164-167.
[7]毛文定,冯文聪,孙威,等.不同香型白酒酿造大曲微生物群落与理化指标关联分析[J].中国酿造,2024,43(7):147-153.
[8]贾丽艳,郭晋田,刘帅,等.清香型白酒发酵过程中微生物及理化指标的变化规律[J].中国食品学报,2020,20(8):162-167.
[9]汪彩莉,程险峰,李晓环,等.高温大曲贮存过程中部分理化指标与微生物群落演替变化规律研究[J].酿酒科技,2023(2):19-22,28.
[10]赵才贤.酱香型白酒大曲和酒醅的微物群落结构特征及其变化规律研究[D].贵阳:贵州大学,2021.
[11]马世源.五粮浓香型白酒风味组解析及关联酒醅微生物的研究[D].自贡:四川轻化工大学,2022.
[12]高江婧.浓香型白酒窖泥微生物菌群的风味贡献及稳态机制研究[D].无锡:江南大学,2022.
[13]卫春会,甄攀,张兰兰,等.汾酒酒醅发酵过程中真菌群落的变化规律[J].食品科学,2021,42(14):121-128.
[14]韩韶.清香型酒醅发酵过程理化性质变化规律研究[J].中国食品工业,2024(10):104-106.
[15]刘悦,王馨怡,陈钱峰,等.甬优稻谷真菌群落多样性及优势菌种鉴定[J/OL].中国食品学报,1-9[2025-10-31].https://link.cnki.net/urlid/11.4528.TS.20250527.1231.004.
[16]王景.16S rRNA基因二代测序中的测序深度与测序错误对微生物群落多样性分析的影响[D].上海:上海交通大学,2018.
[17]赵雅琦,罗丽霞,李志刚,等.槟榔根系分泌物促生组分对连作胡椒根际微生物群落的影响[J].热带作物学报,2025,46(8):2009-2018.
[18]赵欣,张钰婧,陈旭峰,等.不同生产模式和季节下山西老陈醋酒精和醋酸发酵微生物菌落总数最高峰时期真菌群落的对比分析[J].食品工业科技,2025,46(12):197-205.
[19]YANG X Y, PENG Z, HE M N, et al.Screening, probiotic properties,and inhibition mechanism of a Lactobacillus antago-nistic to Listeria monocytogenes[J].Sci Total Environ,2024,906:167587.
[20]ZHANG L,LI W L,PENG Z,et al.Effect of microbial community on the formation of flavor components in cigar tobacco leaves during air-curing[J].BMC Microbiol,2025,25(1):56.
[21]BAI C Y,FAN B Y,HAO J M,et al.Changes in microbial community diversity and the formation mechanism of flavor metabolites in industrialscale spontaneous fermentation of Cabernet Sauvignon wines[J].Foods,2025,14(2):235.
[22]JIANG B,LIU J Z,WANG J N,et al.Adaptive evolution for the efficient production of high-quality D-lactic acid using engineered Klebsiella pneumoniae[J].Microorganisms,2024,12(6):1167.
[23]李娜,崔梦君,倪慧,等.基于Illumina MiSeq高通量测序技术分析高温大曲发酵过程中真菌群落结构演替规律[J].中国酿造,2025,44(5):169-174.
[24]李艳婷,郭尚,郭霄飞,等.清香型白酒发酵过程中微生物群落结构变化及与理化性质的相关性[J].中国食品学报,2023,23(5):330-340.
[25]王雪山,杜海,徐岩.清香型白酒发酵过程中微生物种群空间分布[J].食品与发酵工业,2018,44(9):1-8.
[26]李彬彬,龙正玉,包爱明,等.酸汤中微生物与风味物质及其相互关系的研究进展[J].食品与生物技术学报,2025,44(3):11-21.
[27]XU S S,HU W Q,ZHOU H,et al.Metatranscriptomic insights into the mechanism of'Multiple Qu'utilization in Jian-flavor Baijiu fermentation[J].Food Res Int,2025,200:115463.
[28]游玲,周荣清,谭壹,等.Kazachstania属酵母在浓香型白酒糟醅中的分布特征及发酵功能[J].生物技术通报,2021,37(6):108-116.
[29]MU Y L,LI Y S,WU Y M,et al.The key proteolytic enzyme analysis of industrial Aspergillus oryzae at solid-state koji fermentation with a local database extension[J].Food Biosci,2024,58:103738.
[30]孙思佳,翟磊,许玲,等.扣囊复膜孢酵母CICC 33077在芝麻香型白酒高温大曲生产中的应用[J].酿酒科技,2018(7):76-82.
[31]曾波,饶家权,邹永芳,等.浓香型白酒酒醅发酵过程中微生物群落结构演替及其与理化指标相关性[J].食品科学,2024,45(7):111-118.
[32]YUAN X,ZHANG J A,CHANG F Y,et al.Effects of nitrogen reduction combined with bio-organic fertilizer on soil bacte-rial community diversity of red raspberry orchard[J].PLoS ONE,2023,18(7):e0283718.
[33]WANG X Q, CUI H Y, SHI J H, et al.Relationship between bacterial diversity and environmental parameters during com-posting of different raw materials[J].Bioresource Technol,2015,198:395-402.
[34]LI T, HUANG J R, TIAN X D, et al.Physicochemical evolution of sorghum grain starch under the condition of solid-state fermentation of Baijiu[J].Int J Bio Macromol,2024,282:137225.
[35]邹云曼.酱香型白酒糟醅核心真菌多样性及发酵特性研究[D].贵阳:贵州大学,2023.