乳酸菌是食品发酵过程中重要的微生物,其通过代谢产生有机酸、醇、细菌素和功能因子等物质,从而延长食品保藏期、改善食品品质以及赋予发酵食品独特风味和益生功能。围绕乳酸菌的食品研究与开发已逐步形成一个系统的产-研体系,包括发酵乳制品、发酵果蔬制品、发酵肉制品和发酵酒制品等,处于不同生态位中的乳酸菌可能表现出不同的生长特性、不同程度的耐受性、丰富的功能特性等生物学特性[1-2]。分选获得菌株后,通常会研究其生物学特性,包括生长曲线、产酸性、耐受性能(耐酸、耐胆盐、耐人工肠胃液等)、生长最适条件以及抑菌性能等,以此选育出功能性益生乳酸菌,丰富发酵食品的微生物资源[3-4]。
乳酸菌过量生长繁殖,其代谢产物会严重影响发酵食品的品质和风味,如造成袋装发酵食品涨袋、发酵乳品的后酸化和白酒酿造过程中“乳-乙比例”不协调等[5-7]。 为了保证发酵食品的风味和品质,现阶段主要通过改变发酵条件和添加抗生素等抑菌物质来控制食品发酵中乳酸菌生物量,特异性抑制其生态位最接近的竞争者——其他乳酸菌等近缘菌,从而在激烈的微生物竞争中占据优势,主导群落演替[8]。但改变发酵条件影响发酵食品的品质和风味,而且抗生素的过度使用和抗性菌株的产生,也会使人类健康面临巨大的挑战和威胁。 研究发现,乳酸菌自身群体感应所产生的细菌素作为一种无抗药性、无残留、安全性高的天然蛋白类抗菌剂,且可以抑制近缘菌,例如来源于植物乳植杆菌WCFS1、C11、LPC010、KW30、LMG2379等的细菌素对乳杆菌、片球菌、明串珠菌等有抑制作用,这为解决上述发酵食品实际生产面临的问题提供了有效策略[9-10]。此外,细菌素的产量除受菌株自身遗传学特质影响外,发酵条件对细菌素的产量有着很大的影响,如培养基成分、培养温度、初始pH值和有机溶剂的添加等[11-12]。
植物乳植杆菌(Lactiplantibacillus plantarum)Y36选育于清香型白酒酒醅,其发酵上清液具有广谱抑菌性,能有效抑制革兰氏阴性和革兰氏阳性菌株,通过在排除有机酸及过氧化氢后仍具有抑菌活性,且对蛋白酶敏感,该抑菌物质可能归于细菌素类,但仍需进一步鉴定[13]。 本研究以L.plantarum Y36为研究对象,采用比浊法研究其生长特性,通过平板计数法考察其耐酸、耐乙醇、耐胆盐及人工模拟肠胃液的能力;进一步研究L.plantarum Y36发酵上清液对同样清香型酒醅来源近缘菌的抑制,并探究发酵条件(发酵时间、发酵温度、发酵初始pH)以及外源物质(甘油、吐温-80、乙醇和NaCl)添加量对近缘菌株的抑菌作用。旨在掌握该菌株在不同条件下的生长特性及对其近缘菌的抑制作用,从而有效地控制和管理菌株,为乳酸菌在食品防腐领域的应用提供新的思路和方法。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
植物乳植杆菌(Lactiplantibacillus plantarum)Y36、Y37、Y15-1、Y36和SL32-2,布氏乳杆菌(Lactobacillus buchneri)SL45,短乳杆菌(Lactobacillus brevis)SL6l、SL21、MC46和MC46-2,戊糖乳杆菌(Lactobacillus pentosus)LB27:山西师范大学传统酿造与微生物实验室保存。
1.1.2 化学试剂
葡萄糖(分析纯):天津市北辰方正试剂厂;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;牛肉浸粉(生化试剂):南京全隆生物技术有限公司;酵母提取物(生化试剂):上海金畔生物科技有限公司;柠檬酸氢二胺、氯化钠、磷酸二氢钾、磷酸氢二钾、氢氧化钠、硫酸镁、磷酸氢二钠、硫酸锰、乙酸钠、无水乙醇(均为分析纯):天津市科密欧化学试剂有限公司;吐温-80:上海麦克林生化科技有限公司;琼脂粉、牛胆盐(均为生化试剂)、胃蛋白酶(3 000~3 500 NFU/g)、胰蛋白酶(250 NFU/mg):北京索莱宝科技有限公司;盐酸(分析纯):洛阳市化学试剂厂;丙三醇(分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
MRS液体培养基:葡萄糖20 g/L,蛋白胨10 g/L,牛肉浸粉5 g/L,酵母粉4 g/L,柠檬酸氢二胺2 g/L,磷酸氢二钾2 g/L,乙酸钠5g/L,硫酸镁0.5 g/L,硫酸锰0.25 g/L,吐温-80 1 mL/L,蒸馏水定容至1 L,调节pH为6.2~6.4。121 ℃高压蒸汽灭菌20 min。
MRS固体培养基:MRS液体培养基中添加1.5%琼脂。
1.2 仪器与设备
HH-6型数显恒温水浴锅:常州荣华仪器制造有限公司;PHS-3C型pH计:上海雷磁仪器厂;V-1800PC型可见分光光度计:上海美谱达仪器有限公司;GI80DS型立式压力蒸汽灭菌锅:上海博讯实业有限公司;ZHJH-C1112B型智诚超净工作台、ZXMP-R1230型恒温培养箱:上海智城分析仪器制造有限公司;D-37520型离心机:赛默飞世尔科技(中国)有限公司;BSA124S型分析天平(感量0.000 1 g):METTLERTOLEDO(上海)有限公司。
1.3 方法
1.3.1 L.plantarum Y36的生长特性和产酸性能测定
将L.plantarumY36甘油菌化冻后取100μL接种于10mL的MRS液体培养基中,37 ℃条件下静置培养24 h,得到种子液。将种子液以2%(V/V)的接种量接种于MRS液体培养基中,37 ℃条件下静置培养30 h,每隔2 h测定发酵液的吸光度值(OD600 nm)值和pH值,以发酵时间为横坐标,OD600 nm值和发酵液pH值为纵坐标,绘制生长曲线和产酸曲线[14]。
1.3.2 L.plantarum Y36的最适初始pH值和最适发酵温度
将L.plantarum Y36种子液按2%的接种量分别接种于初始pH值分别为3.0、4.0、5.0、6.0、7.0的MRS液体培养基中,37 ℃条件下静置培养12 h,通过测定菌液的OD600 nm值,确定菌株Y36生长的最适初始pH值[15]。 将种子液按2%的接种量接入MRS液体培养基中,分别在温度25 ℃、30 ℃、37 ℃、40 ℃、45 ℃条件下静置培养,测定菌液的OD600 nm值,确定菌株Y36生长的最适发酵温度[16]。
1.3.3 L.plantarum Y36的耐受性分析
耐酸性试验:胃液的pH值一般在2.5~3.5之间,而食物在胃中消化需要的时间一般为1~3 h,因此选择pH值为3.0作为本次试验的条件。 将L.plantarum Y36种子液以2%(V/V)的接种量接种到pH值为3.0的MRS液体培养基中,以未经处理的MRS培养基为空白对照,37 ℃下静置培养,分别取培养1 h、2 h和3 h时的菌液进行梯度稀释并涂布,使用平板计数法计数,菌株存活率计算公式如下[17]:
式中:S为菌株存活率,%;N1为试验组活菌数,CFU/mL;N0为对照组活菌数,CFU/mL。
乙醇耐受性试验:将L.plantarum Y36种子液以2%(V/V)的接种量分别接种到乙醇体积分数分别为2%、4%、6%、8%和10%的MRS液体培养基中,以MRS培养基为空白对照,37 ℃下静置培养12 h后对菌液进行梯度稀释,涂布计数,使用平板计数法计数,菌株存活率计算公式如下[18]:
胆盐耐受性试验:将L.plantarumY36种子液以2%(V/V)的接种量分别接种到胆盐含量分别为0.1%、0.2%、0.3%的MRS液体培养基中,以MRS培养基为空白对照,37 ℃下静置培养1 h、2 h、3 h时,分别取定量菌液进行梯度稀释和涂布计数,使用平板计数法计数,计算耐胆盐存活率[19]。
人工胃肠液耐受性试验:将L.plantarum Y36种子液活化2代后得到菌悬液,将此菌悬液在4 ℃、4 500 r/min条件下离心10min,随后用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤两次,并调整菌体浓度,使其OD600 nm值约为1.0,制得菌悬液。 取适量菌悬液进行梯度稀释后涂布培养,记录菌株初始活菌数N0。参考《中国药典》2010版配制模拟胃肠液,取1 mL待测菌悬液接种于9 mL pH为3.0的人工模拟胃液中,37 ℃静置孵育3 h,取菌液进行稀释涂布,采用平板计数法计算活菌数N1,测定菌株在酸性胃液条件下的耐受性。将1 mL人工胃液消化的菌悬液接种于9 mL pH为6.8的人工模拟肠液中,在37 ℃下静置培养4 h。取定量菌悬液进行梯度稀释,选取适当梯度的稀释液进行涂布计数,用平板计数法计算活菌数N2,人工模拟胃肠液中菌株存活率计算公式如下[20]:

式中:N0为菌株初始活菌数,CFU/mL;N1为菌株在人工胃液中孵育3 h后的活菌数,CFU/mL;N2为人工胃液消化的菌悬液在人工肠液中孵育4 h后的活菌数,CFU/mL。
1.3.4 L.plantarum Y36发酵上清液对相同酒醅来源近缘乳酸菌的抑制作用
将L.plantarum Y36种子液以2%(V/V)的接种量接入MRS培养基中,37 ℃静置培养24 h,于4 000 r/min条件下离心20 min,收集发酵上清液,用0.22 μm滤膜过滤除菌,-20 ℃保藏备用。
以相同清香型白酒酒醅来源的近缘乳酸菌L.plantarum Y37、Y15-1、Y36和SL32-2,L.buchneri SL45,L.brevis SL6l、SL21、MC46和MC46-2,L.pentosus LB27为指示菌,采用比浊法[21]测定菌株Y36发酵上清液对相同酒醅来源的近缘乳酸菌的抑制作用。将指示菌种子液分别以2%(V/V)的接种量接入MRS培养基中,同时按5%(V/V)的接种量加入无菌菌株Y36发酵上清液,以未添加菌株Y36发酵上清液为对照(CK),37 ℃下静置培养12 h,检测发酵液OD600 nm值,抑菌率计算公式如下[22]:
式中:ACK为未添加菌株Y36发酵上清液的发酵液的OD600nm值;A样为添加菌株Y36发酵上清液的发酵液的OD600nm值。
1.3.5 发酵条件对菌株Y36发酵上清液抑制近缘菌MC46的影响
将菌株Y36种子液以2%(V/V)的接种量接种于MRS液体培养基中,分别在不同发酵时间(2 h、4 h、6 h、8 h、10 h、12 h、14 h、16 h、18 h、20 h、22 h、24 h、26 h、28 h)、发酵温度(25 ℃、30 ℃、37 ℃、40 ℃、45 ℃)及初始pH值(3.0、4.0、5.0、6.0、7.0)条件下,静置培养24 h后,收集发酵液,并离心收集上清,将菌株MC46种子液以2%(V/V)的接种量接入MRS培养基中,同时按5%(V/V)的接种量加入无菌菌株Y36发酵上清液,以未添加菌株Y36发酵上清液为对照(CK),37 ℃下静置培养12 h,检测菌体发酵液OD600 nm值,分别考察发酵时间、发酵温度及初始pH对菌株Y36发酵上清液抑制近缘菌MC46的影响。
1.3.6 外源添加物对菌株Y36发酵上清液抑制近缘菌MC46的影响
将菌株Y36种子液按2%(V/V)的接种量接种到MRS液体培养基中,再分别添加1%、2%、3%、4%、5%甘油,0.1%、0.3%、0.5%吐温-80,0.5%、1.0%、1.5%、2.0%、2.5%(V/V)乙醇和0.5%、1.0%、1.5%、2.0%、2.5%NaCl,37 ℃培养24 h。收集发酵液,离心收集上清液,将菌株MC46种子液以2%(V/V)的接种量接入MRS培养基中,同时按5%(V/V)的接种量加入无菌菌株Y36发酵上清液,以未添加菌株Y36发酵上清液为对照(CK),37 ℃下静置培养12 h,检测菌体发酵液OD600 nm值,研究外源添加物对菌株Y36发酵上清液抑制近缘菌MC46的影响[10]。
2 结果与分析
2.1 菌株Y36的生物学特性
2.1.1 菌株Y36的生长特性和产酸能力
菌株Y36的生长特性和产酸能力结果见图1。 由图1可知,菌株Y36的生长曲线呈S型,可以观察到明显的延滞期(0~4 h)、对数生长期(4~18 h)和稳定期(18~24 h)。菌株Y36经过4 h的延滞期后进入对数期,发酵液的OD600 nm值迅速增加,生长速率均明显加快,至18 h菌株发酵液的OD600nm值达到4.78,此后OD600 nm值无明显变化,趋于平缓生长,菌株进入稳定期阶段。 由图1亦可知,在发酵时间为0~12 h时,随着菌株Y36的快速生长,产酸速度也较快,pH快速下降,由5.50降至4.09,发酵18 h后,pH值降至3.83,发酵液的pH趋于平稳。当发酵时间为28 h,发酵液的pH值为3.65。
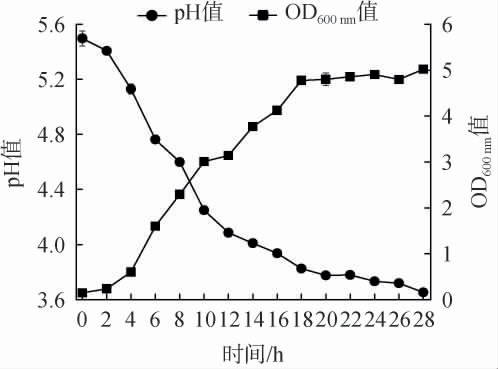
图1 菌株Y36的生长曲线和产酸能力
Fig.1 Growth curve and acid-producing capacities of strain Y36
2.1.2 菌株Y36的最适发酵温度与初始pH值
培养基初始pH值及发酵温度对菌株Y36生物量的影响结果见图2。由图2A可知,随着发酵温度在25~45 ℃范围内的升高,发酵液的OD600nm值呈现先上升后下降的趋势。当发酵温度为25~37 ℃时,OD600 nm值随温度升高而上升;当发酵温度为37 ℃时,OD600 nm值最高,为7.82;当发酵温度>37 ℃之后,发酵液的OD600nm值显著下降。因此,菌株Y36最适发酵温度为37 ℃。
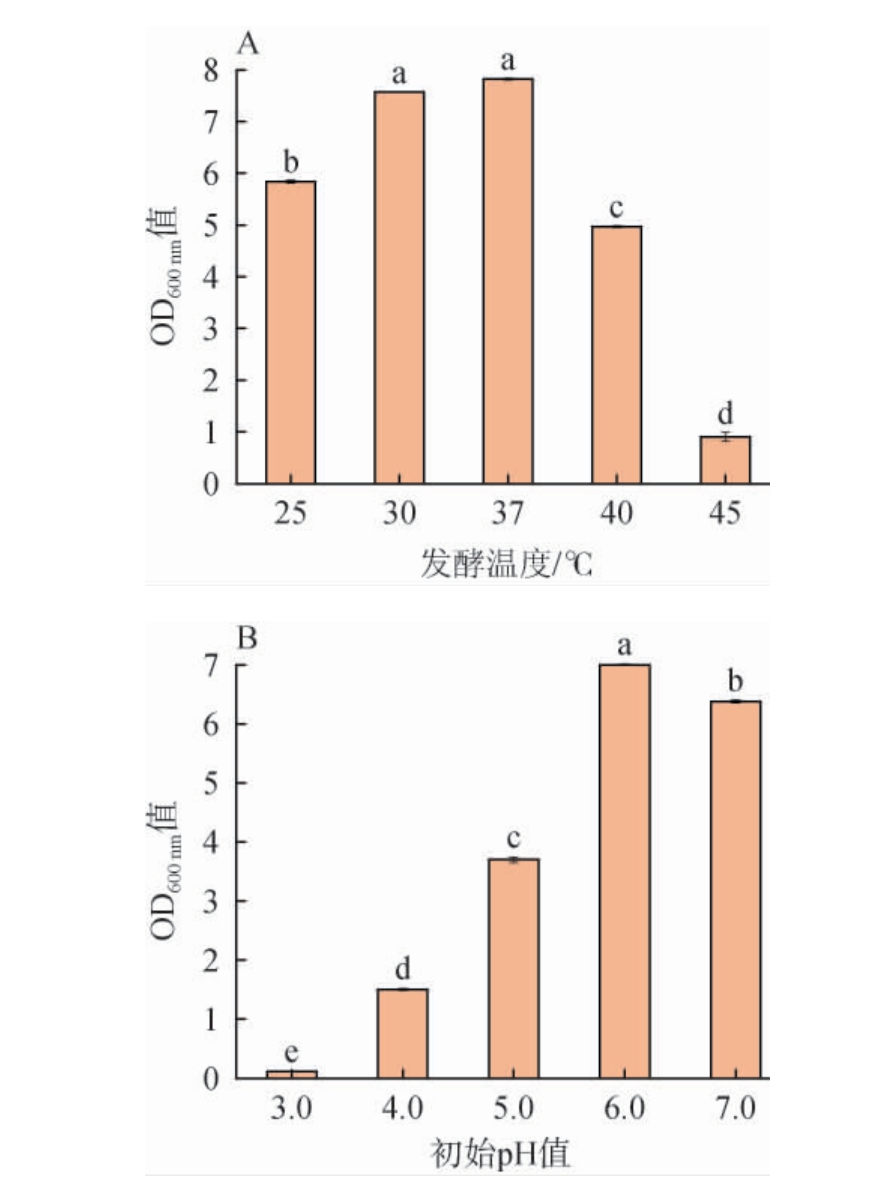
图2 菌株Y36最适发酵温度(A)与初始pH值(B)
Fig.2 Optimal fermentation temperature (A) and initial pH values (B)of stain Y36
不同小写字母表示差异显著(P<0.05)。下同。
由图2B可知,在初始pH为3.0的条件下,菌株Y36的生物量很低,基本不生长,随着初始pH值在3.0~7.0范围内的升高,OD600 nm值呈现先增长后降低的趋势。当初始pH值为3.0~6.0时,OD600 nm值随初始pH值升高而上升;当初始pH为6.0时,OD600 nm值达到最高,OD600 nm值为7.0;当初始pH升高至7.0时,发酵液的OD600nm值显著下降。因此,菌株Y36最适培养基初始pH为6.0。
2.1.3 菌株Y36的耐受性测定
乳酸菌作为益生菌,要发挥调节肠道菌群、增强免疫力等作用,其前提是必须有足够数量的活菌能够耐受胃部的强酸环境(pH可达1.5~4.5)并存活下来,进而到达肠道定植。体外模拟胃液(通常pH 3.0,处理3 h)是筛选益生菌的标准方法[23]。 将菌株Y36在pH 3.0条件下处理1 h、2 h、3 h,研究其耐酸性能,结果见表1。 由表1可知,在pH 3.0条件下,随着处理时间的延长,菌株Y36的存活率呈现降低趋势。在处理1 h时,菌体的存活率均能达到51.05%,说明在短时间内对pH 3.0的酸性环境有较强的耐受性。 当处理时间延长至3 h时,菌株的存活率为20.76%。
表1 菌株Y36酸受性试验结果
Table 1 Results of acid tolerance experiments of strain Y36

菌株时间1 h活菌数/(CFU·mL-1)存活率/% 存活率/%Y36 (2.38±2.12)×106 (5.5±0.71)×106 (1.03±1.42)×107 20.76 3 h活菌数/(CFU·mL-1) 存活率/%51.05 35.04 2 h活菌数/(CFU·mL-1)
在传统乳酸菌与酵母菌共同发酵乳制品中,乳酸菌发酵至适应于酵母菌增殖的酸性条件时,酵母菌开始进行酒精发酵,并不断地大量累积酒精,乙醇成为胁迫乳酸菌生长代谢的重要因子之一[24-25]。 乙醇胁迫可引起细胞膜结构改变,破坏膜功能,导致细胞内中心碳代谢受阻,并且可通过刺激细胞内活性氧的产生诱导细胞凋亡,高体积分数乙醇甚至会造成菌体大量死亡[26]。将菌株Y36接入无水乙醇体积分数为2%、4%、6%、8%和10%的MRS液体培养基,胁迫生长12 h,测其OD600 nm值,研究其乙醇耐受能力,结果见图3。
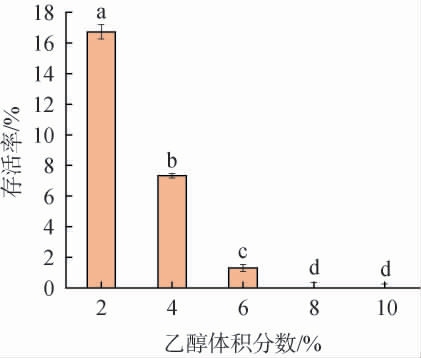
图3 菌株Y36乙醇耐受性试验结果
Fig.3 Results of ethanol tolerance experiments of strain Y36
由图3可知,在不同体积分数的无水乙醇胁迫下菌株Y36均有不同的存活率,且随着无水乙醇体积分数的增大,菌株的存活率持续降低,在体积分数为2%、4%和6%的无水乙醇胁迫下,菌株可存活,存活率分别为16.73%、7.33%和1.31%,当乙醇体积分数增加到8%、10%时,菌株几乎不生长。因此,菌株最高可耐受乙醇体积分数为6%。
胆盐是肠道中的一种消化剂,能破坏细菌细胞膜。 乳酸菌必须耐受肠道胆盐环境,才能顺利到达肠道并定植,进而调节菌群、抑制病原菌等[27],耐胆盐能力是筛选和评价益生乳酸菌的关键核心指标之一[28]。将菌株Y36在牛胆盐含量为0.1%、0.2%和0.3%条件下分别处理1 h、2 h、3 h,研究其胆盐耐受能力,结果见表2。由表2可知,随着胆盐含量的增加,菌体的存活率呈下降趋势,在0.1%的胆盐含量下,处理3 h菌株的存活率为91.05%,说明其在低含量胆盐中有较强的耐受力;不同胆盐含量条件下,随着处理时间的延长,菌株的存活率无明显变化;同一时间,随着胆盐含量的增加,菌株的存活率下降。在胆盐含量为0.2%、0.3%的条件下,处理3 h菌株存活率无明显变化,存活率均在80%以上。蔡爽等[29]从健康仔猪粪便样品中分离纯化得到1株乳酸菌,在胆盐含量为0.3%条件下存活率为109.95%,表现出较强的耐受性。而陈穗莲等[30]从江香猪盲肠内容物分离的1株乳酸菌在含0.3%猪胆盐的条件下存活率为14%。与之相比,说明菌株Y36具有较强的高胆盐耐受性,具备在肠道中定植的潜力。
表2 菌株Y36胆盐耐受性试验结果
Table 2 Results of bile salt tolerance experiments of strain Y36
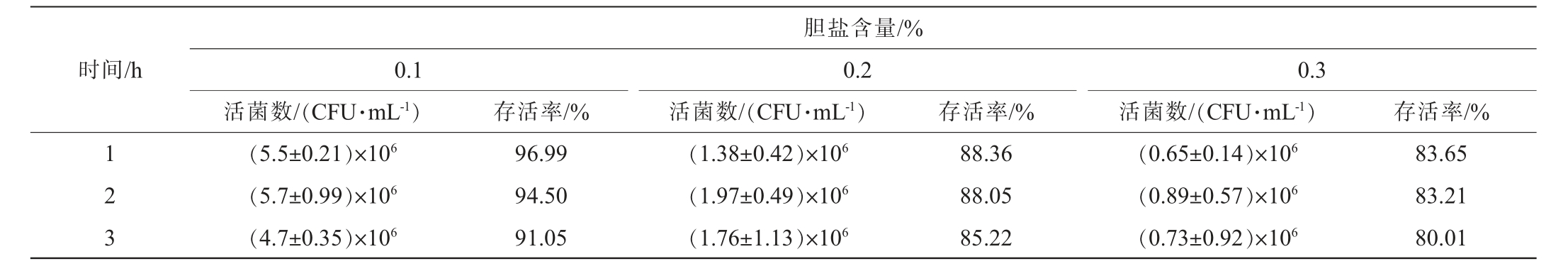
时间/h胆盐含量/%0.1活菌数/(CFU·mL-1)0.2活菌数/(CFU·mL-1)存活率/% 存活率/%0.3活菌数/(CFU·mL-1) 存活率/%1 2 3(5.5±0.21)×106(5.7±0.99)×106(4.7±0.35)×106 96.99 94.50 91.05(1.38±0.42)×106(1.97±0.49)×106(1.76±1.13)×106 88.36 88.05 85.22(0.65±0.14)×106(0.89±0.57)×106(0.73±0.92)×106 83.65 83.21 80.01
将菌株Y36进行人工模拟胃液和人工模拟肠液处理,计算不同处理后的菌体存活率,研究其人工胃肠液耐受性,结果见表3。
表3 菌株Y36人工模拟胃肠液耐受性试验结果
Table 3 Results of artificial simulated gastrointestinal fluid tolerance experiments of strain Y36

菌株0 h活菌数/(CFU·mL-1)3 h活菌数/(CFU·mL-1)存活率/%7 h活菌数/(CFU·mL-1)存活率/%Y36 (1.26±1.15)×109 (1.66±0.58)×106 13 (2.87±1.53)×105 2.2
由表3可知,菌株Y36经过人工胃液处理3 h后,存活率为13%,经人工肠液处理7 h后,存活率降低为2.2%。说明菌株Y36对胃肠液的耐受能力较差。
2.2 菌株Y36发酵上清液对相同酒醅来源近缘乳酸菌的抑制作用
将菌株Y36发酵24 h时,收集发酵上清液,考察菌株Y36发酵上清液对相同酒醅来源的10株近缘菌的抑制作用,结果见图4。由图4可知,菌株Y36的发酵上清液对除自身外的9株指示菌都有不同程度的抑制作用,抑制效果从大到小依次是菌株MC46>菌株Y15-1>菌株SL21>菌株Y37>菌株SL61>菌株SL45>菌株MC46-2>菌株SL32-2>菌株LB27,抑菌率分别为61.25%、55.75%、51.22%、50.11%、49.12%、44.58%、10.53%、6.75%、4.63%,其中对菌株MC46的抑制作用显著(P<0.05)。 来源于不同植物乳植杆菌的细菌素(植物乳植杆菌素)通常可杀死或抑制植物乳植杆菌的近缘种属菌株,但抑菌谱有所差异。 有的植物乳植杆菌素抑菌谱相对较宽,可同时杀死或抑制植物乳植杆菌的远缘种属菌株,包括其他革兰氏阴性和阳性菌如假单胞菌、格氏李斯特菌等,如植物乳植杆菌素LP84、MXG-68、Q7等;有的细菌素抑菌谱较窄,如植物乳植杆菌素A、S、KW30、NC8β等对嗜温型或嗜热型乳酸菌菌株(如:片球菌属、乳杆菌属等)具有抑制效果;部分植物乳植杆菌素甚至对真菌具有良好的抑菌效果,如植物乳植杆菌素P158、SLG1、L3[31]。细菌素对不同菌株的抑制能力有所差异,可能是由于细菌素的结构性质和抑菌机理不同导致的,也可能是因为同一菌株会产生多种细菌素,导致抑菌能力有所差异。
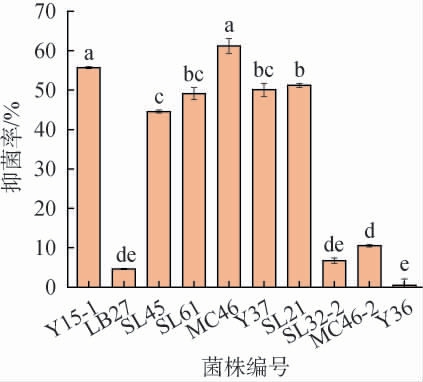
图4 菌株Y36发酵上清液对自身及其他9株相同酒醅来源乳酸菌的抑制作用
Fig.4 Inhibition of strain Y36 fermentation supernatant on itself and 9 other lactic acid bacteria from the same fermented grains
2.3 发酵条件对菌株Y36发酵上清液抑制近缘菌MC46的影响
乳酸菌细菌素的产生与菌株所处的外界环境密切相关,其中发酵时间、发酵温度、培养基初始pH等培养条件为显著影响条件。 发酵条件对菌株Y36发酵上清液抑制近缘菌MC46的影响,结果见图5。
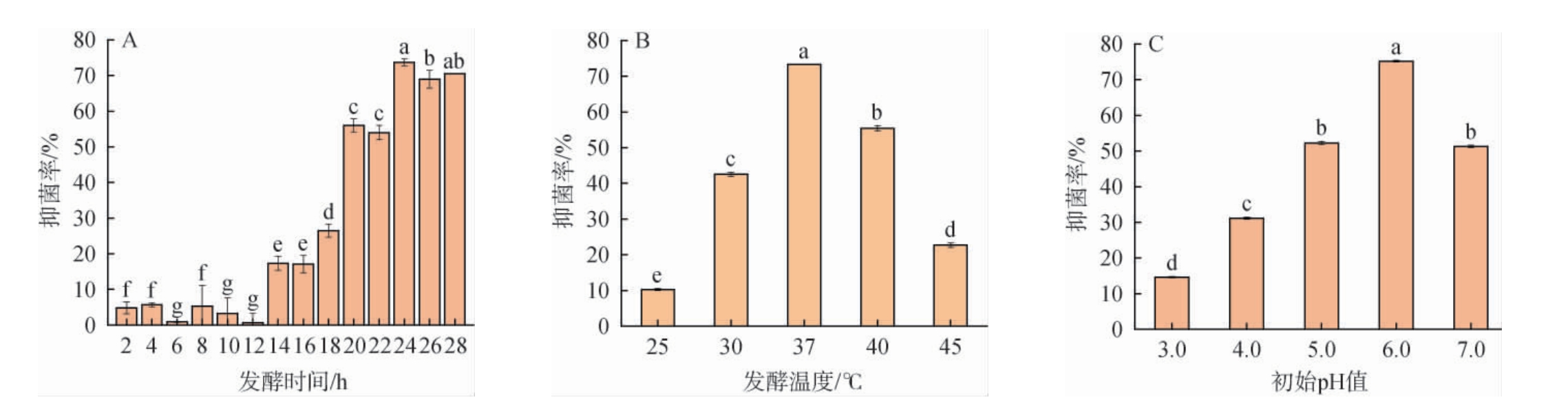
图5 发酵时间(A)、发酵温度(B)和初始pH(C)对菌株Y36发酵上清液抑制菌株MC46的影响
Fig.5 Effects of fermentation time (A), fermentation temperature (B) and initial pH (C) on the inhibition of fermentation supernatant of strain Y36 on strain MC46
由图5A可知,菌株Y36从发酵时间14h开始对菌株MC46抑菌率显著增加,此时,菌株Y36处于对数生长期,之后随着培养时间延长抑菌率逐渐增加,直到24 h达到最大,此时的抑菌率为73.70%。前期菌体生物量低,产生的细菌含量较低,当菌体生物量增多,细菌素的含量也会随之增多。细菌素合成与细菌所处生长阶段存在一定联系,有的菌株在生长迟缓期就开始产生细菌素,而有的菌株则在对数生长期和稳定期才会大量产生和积累细菌素[32]。 此外,培养时间超过24 h之后,抑菌率有所下降,这可能是因为产生的细菌素会被吸附至产生菌株细胞表面,发酵液中细菌素含量减少,相对抑菌能力下降[33]。
由图5B可知,随发酵温度的升高,菌株Y36发酵液对菌株MC46抑菌率呈先上升后下降趋势。 当发酵温度为37 ℃时,可以保持较高的抑菌稳定性,抑菌率为73.31%,说明在此温度培养下,菌株产细菌素的产量较高。在低于或高于37 ℃时,抑菌率均低于56%。 可能是由于细菌素属于蛋白质类似物,培养温度对于微生物的生长和细菌素的合成来说是至关重要,培养温度过低,乳酸菌会生长缓慢甚至停止生长;培养温度过高,细菌素易变性失活。 研究发现,不同乳酸菌的生长的最适温度与细菌素合成最适温度无明显差异,如粪大肠杆菌RZSC5[34]、酸酸双球菌13[35]等菌株所产的细菌素,但是也有乳酸菌的生长及其细菌素的合成所需的最佳温度和pH有所差异,如马其顿链球菌ACA-DC 198生长的最适温度为42.3 ℃,而细菌素合成的最适温度则为20~25 ℃[36]。
由图5C可知,随着发酵初始pH值的升高,菌株Y36发酵液对菌株MC46抑菌率呈现先上升后下降趋势。当初始pH值为6.0时, 发酵液相比于其他初始pH值条件抑菌率最高,为75.21%。可能由于在不同pH值条件下,细菌素的转录翻译过程受到了阻碍或菌体细胞对细菌素的吸附能力不同[33]。
2.4 外源添加物对菌株Y36发酵上清液抑制近缘菌MC46的影响
除发酵条件会影响发酵上清液抑菌能力外,培养基的成分也至关重要。 不同浓度的甘油、吐温-80、乙醇和NaCl对菌株Y36发酵上清液抑制近缘菌MC46的影响结果表4。
表4 外源添加物对菌株Y36发酵上清液抑制菌株MC46的影响
Table 4 Effect of exogenous additives on inhibition of fermentation supernatant of strain Y36 on strain MC46

外源添加物 添加量/% 抑菌率/%甘油1 2 3 4 5吐温-80乙醇NaCl 0.1 0.3 0.5 0.5 1.0 1.5 2.0 2.5 0.5 1.0 1.5 2.0 2.5 50.99±0.44 53.69±0.41 66.98±0.24 51.87±0.53 33.33±0.30 61.01±0.29 64.31±0.21 72.16±0.30 51.15±0.16 61.35±0.35 62.45±0.48 65.25±0.62 68.35±0.15 48.31±0.15 46.11±0.20 33.61±0.35 29.54±0.26 10.89±0.25
由表4可知,随着甘油添加量的增加,菌株Y36发酵上清液对菌株MC46的抑菌率呈先上升后下降趋势,当甘油添加量在1%~3%时,菌株MC46被抑制;当甘油添加量达到3%时,菌株Y36发酵上清液对菌株MC46的抑菌率最大,为66.98%;甘油添加量>3%之后,菌株Y36发酵上清液对菌株MC46的抑制下降明显。说明甘油的添加在一定程度上可以抑制细菌的生长并提升上清液抑菌物质产量[9]。原因可能是甘油在低浓度下能够刺激菌体的快速生长进而快速分泌细菌素,当分泌至胞外的浓度达到一定阈值时,则会反馈作用细菌,促使菌株分泌更多细菌素;同时在降解过程中甘油能够被分解形成磷酸二羟丙酮(dihydroxyacetone phosphate DHAP),这一物质能够维持细胞内的氧化还原平衡,为进一步合成细菌素提供稳定的胞内环境。但高浓度的甘油则会降低细菌素的合成,可能原因是浓度过高会使得菌体生长环境的水分活度降低,进而导致渗透压发生改变[9,37]。
由表4可知,当培养基中吐温-80添加量为0.1%、0.3%和0.5%时,菌株Y36发酵上清液对菌株MC46抑菌率分别为61.01%、64.31%、72.16%,抑菌物质产量与吐温-80添加量在一定范围内呈正相关,吐温-80添加量为0.5%时,抑菌物质的产量最高,抑菌效果最显著。分析其原因,吐温-80可以通过降低菌体与培养基之间的接触面表面张力,来提高乳酸菌细胞膜的通透性以便促进抑菌物质的产生。除此之外吐温80可以提供营养类物质有助于菌体的生长,随之细菌素产量也增加[38-39]。
由表4可知,随着乙醇体积分数的增加,在一定范围内抑菌率逐渐升高,添加乙醇体积分数为0.5%、1.0%、1.5%、2.0%、2.5%时,菌株Y36发酵上清液对菌株MC46抑菌率分别为51.15%、61.35%、62.45%、65.25%、68.35%。 究其原因,可能是因为低浓度的乙醇胁迫下,细胞膜的通透性稍微增加,刺激乳酸菌的代谢活动,增加其生长速率和代谢产物的生成[40]。且不同乙醇浓度下,对不同乳酸菌菌株生物膜的影响也有所差异[26]。
由表4可知,随着盐添加量的增加,菌株Y36发酵上清液对菌株MC46的抑菌能力呈下降趋势。当NaCl添加量为0.5%、1.0%、1.5%、2.0%和2.5%时,菌株Y36发酵上清液对菌株MC46抑菌率分别为48.31%、46.11%、33.61%、29.54%、10.89%。高浓度的盐会使菌株Y36分泌抑菌物质的产量降低,抑菌能力减弱。研究发现,不同浓度的NaCl对抑菌物质的产生有影响,各菌株对NaCl的响应浓度也不同,徐莹等[41]研究发现,随着培养条件中NaCl的浓度升高,产细菌素的能力呈先上升后下降的趋势,1%的浓度时,抑菌效果最好;L.plantarum KLDS1.0391面对NaCl胁迫时,细菌素合成能力随NaCl质量分数提高逐渐下降[42]。
3 结论
清香型白酒酒醅来源的L.plantarum Y36在MRS液体培养基中生长良好,呈现典型的S型生长曲线,4 h进入对数期,至18 h进入稳定期;该菌株产酸能力强,发酵28 h可使发酵液pH降至3.65;最适生长温度和初始pH分别为37 ℃和6.0;在pH 3.0条件下处理3 h存活率为20.76%;菌株最高可耐受6%vol的乙醇;在0.1%~0.3%的胆盐浓度下处理3 h,存活率均保持在80%以上;经人工模拟胃肠液处理后存活率为2.2%;L.plantarum Y36的发酵上清液对同酒醅来源的多种近缘乳酸菌具有差异化的抑制作用,其中对L.brevis MC46的抑制效果最为显著;菌株Y36发酵上清液对菌株MC46抑菌率最佳的培养时间、发酵温度和初始pH分别为24 h、37 ℃和6.0;最佳添加甘油、吐温-80、乙醇、NaCl最佳添加量分别为3%、0.5%、2.5%、0.5%。该研究结果为L.plantarum Y36的发酵食品中调控微生物群落、抑制有害菌生长等方面的应用提供了实验依据。
[1]ZAPAS′NIK A,SOKOLOWSKA B,BRYLA M.Role of lactic acid bacteria in food preservation and safety[J].Foods,2022,11(9):1283.
[2]林瑾.抑菌活性乳杆菌L1612的筛选、基因组学及其发酵优化研究[D].广州:华南理工大学,2023.
[3]曹佳,毛烨宇,匡鸿钰,等.猪源益生菌的筛选、功能及其应用研究进展[J/OL].饲料工业,1-11[2025-08-14].https://link.cnki.net/urlid/21.1169.S.20250522.1227.004.
[4]周佳乐,李苗云,赵莉君,等.三种肉源乳酸菌生长特性及其发酵特性的研究[J].食品与发酵工业,2025,51(11):163-170.
[5]张兰威.袋装酸菜贮藏和流通期间发生胀袋的微生物学研究及预防措施[J].食品科学,2000,21(5):44-45.
[6]DESHWAL G K,TIWARI S,KUMAR A,et al.Review on factors affecting and control of post-acidification in yoghurt and related products[J].Trends Food Sci Tech,2021,109:499-512.
[7]钟婧威,刘功良,屈春云,等.白酒酿造中乳酸乙酯调控的研究进展[J].食品研究与开发,2024,45(20):209-216.
[8]马静静,王小芬,高丽娟,等.秸秆发酵中乳酸菌复合系SFC-2对杂菌的抑制作用[J].微生物学报,2008(7):879-886.
[9]张雅婷,徐凯,王正杰,等.群体感应介导的乳酸菌益生作用研究进展[J].工业微生物,2024,54(3):85-92.
[10]满丽莉,向殿军.植物乳杆菌素的抑菌特性及应用研究进展[J].中国调味品,2024,49(12):215-220.
[11]方利敏.产细菌素乳酸菌的筛选鉴定及其细菌素合成的培养优化及诱导作用研究[D].南昌:江西农业大学,2021.
[12]肖珊,李轩伊,王志贤,等.乳酸菌产细菌素生物学特性的研究及培养条件的优化[J].食品安全质量检测学报,2020,11(16):5620-5626.
[13]王萌萌,史瑛,李智琪,等.清香酒醅中高产细菌素乳酸菌的筛选及其细菌素特性研究[J].食品工业科技,2020,41(16):102-107.
[14]韦票.瘤胃源饲用微生物的筛选及复合菌剂发酵中药渣效果的研究[D].杨凌:西北农林科技大学,2021.
[15]席琳乔,吴书奇,史卉玲,等.青贮玉米优良乳酸菌的分离与筛选[J].贵州农业科学,2016,44(3):102-105.
[16]白长胜.禽用乳酸菌SR1发酵条件优化[J].发酵科技通讯,2022,51(1):15-18.
[17]余萍,曹蓝,矫艳平,等.副干酪乳杆菌HCS17-040的筛选鉴定及其益生特性[J].食品与机械,2021,37(11):28-33.
[18]金丹,蒋艾廷,乔传丽,等.新疆酸马奶中乳酸菌的乙醇耐受性及蛋白酶性质研究[J].食品工业科技,2017,38(13):136-139.
[19]印伯星.副干酪乳杆菌的分离鉴定及肠道耐受性研究[J].中国乳品工业,2019,47(5):4-7.
[20]范洪臣,茜琳,韩雪,等.黏豆包发酵液中乳酸菌分离鉴定及其益生性能[J].食品研究与开发,2023,44(23):161-167.
[21]邓书武,叶有芳,刘雪萍,等.金花茶叶水提物不同极性部位体外抑菌活性研究[J].广东化工,2023,50(4):81-83.
[22]韩天奇,刘伊索,任大勇,等.外源诱导及共培养对植物乳杆菌J23合成细菌素Lac-B23的影响研究[J].食品安全质量检测学报,2023,14(7):104-112.
[23]何宇星,其其日力格,刘玮,等.潜在益生作用乳酸菌的筛选鉴定及其生物学特性[J].现代食品科技,2021,37(11):50-57,67.
[24]雍霖宣,王晓丹,舒伯精,等.乳酸菌乙醇胁迫的应答机制研究进展[J].工业微生物,2022,52(5):43-51.
[25]YUAN L,ZHAO H,LIU L,et al.Heterologous expression of the puuE from Oenococcus oeni SD-2a in Lactobacillus plantarum WCFS1 improves ethanol tolerance[J].J Basic Microb,2019,59(11):1134-1142.
[26]朱晓青,李博,陈芳怡,等.不同乳酸菌响应乙醇胁迫生物膜形成的差异性分析[J].食品安全质量检测学报,2025,16(8):161-169.
[27]URDANETA V,CASADESU′S J.Interactions between bacteria and bile salts in the gastrointestinal and hepatobiliary tracts[J].Front Med,2017,4:300280.
[28]徐凡,张臣臣,潘丽娜,等.乳杆菌在胆盐MRS培养基中的传代稳定性[J].现代食品科技,2024,40(4):46-54.
[29]蔡爽,陈涛,毛宗林,等.一株强抗逆性猪源乳酸菌的筛选及生物学特性研究[J].中国饲料,2022(11):23-29.
[30]陈穗莲,张伟,黄云,等.一株香猪源乳酸菌的分离鉴定及生物学特性研究[J].饲料工业,2024,45(10):113-118.
[31]满丽莉,向殿军.植物乳杆菌素的抑菌特性及应用研究进展[J].中国调味品,2024,49(12):215-220.
[32]吕燕妮,李平兰,周伟.戊糖乳杆菌31-1菌株产细菌素发酵条件优化[J].微生物学通报,2005,32(3):13-19.
[33]匡珍,李学英,陶乐仁,等.乳酸乳球菌K6产Nisin Z的条件优化[J].中国食品学报,2020,20(10):115-123.
[34]LEROY F,VUYST L D.Bacteriocin production by Enterococcus faecium RZS C5 is cell density limited and occurs in the very early growth phase[J].Int J Food Microbiol,2002,72(1-2):155-164.
[35]ALTUNTAS E G,COSANSU S,AYHAN K.Some growth parameters and antimicrobial activity of a bacteriocin-producing strain Pediococcus acidilactici 13[J].Int J Food Microbiol,2010,141(1-2):28-31.
[36]BERGHE E, SKOURTAS G, TSAKALIDOU E, et al. Streptococcus macedonicus ACA-DC 198 produces the lantibiotic,macedocin,at temperature and pH conditions that prevail during cheese manufacture[J].Int J Food Microbiol,2006,107(2):138-147.
[37]DOI Y.Glycerol metabolism and its regulation in lactic acid bacteria[J].Appl Microbiol Biot,2019,103(13):5079-5093.
[38]李伟栋.产细菌素乳酸菌的筛选、培养条件优化及生物学特性的研究[D].大庆:黑龙江八一农垦大学,2016.
[39]NEL H A,BAUER R,VANDAMME E J,et al.Growth optimization of Pediococcus damnosus NCFB 1832 and the influence of pH and nutrients on the production of pediocin PD-1[J].J Appl Microbiol,2001,91(6):1131-1138.
[40]朱敏,李宝坤,蒋彩虹,等.乙醇胁迫对植物乳杆菌D5-5代谢活力的影响[J].食品与生物技术学报,2016,35(12):1300-1306.
[41]徐莹,梁红敏.影响植物乳杆菌T102生长与产细菌素能力的因素[J].中国乳品工业,2014,42(9):22-25.
[42]孙思睿,万峰,赵鹏昊,等.luxS基因对盐胁迫下植物乳杆菌生长及细菌素合成的影响[J].食品科学,2019,40(14):69-76.