酱香型白酒以其独一无二的酿造工艺和风味著称,具有“酱香突出,幽雅细腻,酒体醇厚,回味悠长”的风格特点,深受国内外消费者的喜爱[1]。其酿造过程遵循“12987”古法流程,即一年生产周期内经历下沙和糙沙两次投料、九次蒸煮、八次发酵、七次取酒,其中第3、4、5轮次的基酒因其产酒量高,香气结构协调,酱香突出而被称作“大回酒”[2-3]。
酱香型白酒的发酵过程分为堆积发酵和窖内发酵。堆积发酵是形成酱香风味的关键环节,通过网罗环境微生物实现“二次制曲”,为窖内发酵提供功能微生物和酱香前体物质[4],窖内发酵是指堆积发酵结束后的糟醅在窖池内进行长达一个月的厌氧发酵,是富集微生物、塑造窖内微生物结构的关键阶段,并通过微生物群落代谢进一步转化为各种风味物质[5-6]。整个工艺的复杂性为微生物群落演替与风味形成提供了独特生态位。
在酱香型白酒窖内发酵过程中,糟醅微生物群落的组成结构始终存在着动态变化。如黄慧芹等[7]研究发现,在第四轮次窖内糟醅发酵过程中,枝芽孢菌属(Virgibacillus)和克罗彭斯特菌属(Kroppenstedtia)是发酵前期(0~7 d)的优势菌属,从第14天开始,乳酸杆菌属(Lactobacillus)演替为绝对的优势菌属且一直维持至出窖。万旗钰等[8]研究发现,随着发酵周期的进行,微生物群落组成结构差异显著,相较第一轮次,第二轮次的优势细菌属相对丰度占比更大,真菌属的多样性及其相对丰度占比更小。WANG W等[9]研究了第五和第六轮次窖内糟醅发酵的空间异质性,发现真菌在不同层次的相对丰度差异比细菌更大,例如伊萨酵母属(Issatchenkia)在第五和第六轮次的出窖糟醅中,上层糟醅相对丰度为59.6%和91.1%,远高于下层糟醅的相对丰度29.5%和32.2%。在整个窖内糟醅发酵过程中,微生物群落的演替通常都伴随理化因子的动态变化[10]。例如,发酵过程中乳酸菌的代谢活动会产生各种有机酸降低pH值,而低pH环境对于酸敏感微生物具有很大的抑制作用[11]。同时,窖内糟醅发酵过程中的微生物组成结构还受到水分、还原糖、淀粉的影响[12]。目前,关于酱香型白酒窖内糟醅发酵过程的研究,大多聚焦于微生物群落组成的变化。然而,对于菌群的演替规律以及驱动因子的探讨却较为缺乏,特别是针对作为大回酒之一的第三轮次窖内发酵过程的研究报道较鲜见。
因此,本研究采用常规分析方法及高通量测序技术解析糟醅发酵过程中理化因子及微生物群落的多样性,探究糟醅发酵过程中理化因子及微生物群落结构变化,并对结果进行聚类分析(clushering analysis CA)、线性判别分析效应大小(lineal discriminant analysis effect size,LEfSe)、线性判别分析(lineal discriminant analysis,LDA)、冗余分析(redundancy analysis,RDA)及共现性网络分析,阐明糟醅发酵过程中的驱动因素。以期为酱香型白酒生产工艺的优化与标准化提供理论支撑,助力实现发酵过程的精准调控,进而提升原酒品质与出酒率,为酱香型白酒酿造过程中微生物群落的调控提供基础研究和科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
糟醅样品:泸州市古蔺县茅溪镇四川国醴酱酒酒业有限公司。对糟醅发酵过程的第0、4、8、15、22、30天进行取样(样品编号分别为F0、F4、F8、F15、F22、F30)。取样方式参考邹恬杏等[13]的方法,根据窖池高度,将其分为上、中、下三层(窖池高度为290 cm,下层高度为60 cm,中层高度为145 cm,上层高度为230 cm),每层分别取窖池长、宽边对角线中点及四周边缘位置的样品,将每层所取得的样品混合均匀后作为该发酵节点的样品(约为300 g)。 为保持生物学重复,设置三口窖池作为平行窖池(样品编号分别为Fn_1、Fn_2、Fn_3)。将取得的样品分为两份,一份放入-20 ℃用于理化指标的检测,另一份放入-80 ℃用于微生物群落的检测。
1.1.2 试剂
五水硫酸铜、四水酒石酸钾钠、氢氧化钠、一水葡萄糖、三水亚甲基蓝、酚酞、浓盐酸、无水乙醇(均为分析纯):成都市科隆化学品有限公司;Fast脱氧核糖核酸(deoxyribonucleic acid,DNA) SpinKitForSoil试剂盒:美国MP公司;Illumina TruSeq DNA样品制备LT试剂盒:美国Life公司。
SpinKitForSoil试剂盒:美国MP公司;Illumina TruSeq DNA样品制备LT试剂盒:美国Life公司。
1.2 仪器与设备
ME104-02电子天平:梅特勒-托利多仪器(上海)有限公司;84-1A6S磁力搅拌器:上海司乐仪器有限公司;DL-1实验电炉:北京市永光明医疗仪器有限公司;DHG-9240A鼓风干燥箱:上海一恒科学仪器有限公司;MLS-530L立式压力蒸汽灭菌器:重庆雅马拓科技有限公司;NC2000 Nanodrop脱氧核糖核酸(DNA)含量测定仪、2720聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Thermo Scientific公司;Tissuelyser-48研磨仪:上海净信实业发展有限公司;DYY-6C电泳仪:北京六一生物科技有限公司。
1.3 方法
1.3.1 糟醅理化因子检测方法
糟醅理化因子(水分、酸度、还原糖和淀粉含量):参照中国酒业协会团体标准T/CBJ004—2018《固态发酵酒醅通用分析方法》的方法测定[14]。
1.3.2 糟醅DNA提取与PCR扩增
糟醅DNA提取:样品经过研磨后,使用Fast DNA Spin Kit For Soil试剂盒进行DNA提取,用0.8%琼脂糖凝胶电泳对DNA提取质量,利用Nanodrop 2000对DNA进行定量。
Spin Kit For Soil试剂盒进行DNA提取,用0.8%琼脂糖凝胶电泳对DNA提取质量,利用Nanodrop 2000对DNA进行定量。
PCR扩增:细菌选用16S rRNA V3-V4区扩增和测序,引物选用338F(5'-barcode-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3'),PCR扩增程序为:98 ℃预变性5 min,然后进入25次循环(98 ℃变性30 s、52 ℃退火30 s、72 ℃延伸45 s),最后在72 ℃保持5 min,12 ℃保存。真菌选用ITS1区扩增和测序,引物选用ITS5(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS2(5'-GCTGCGTTCTTCATCGATGC-3'),PCR扩增程序为:98 ℃预变性5 min,然后进入30次循环(98 ℃变性30 s、55 ℃退火45 s、72 ℃延伸45 s),最后在72 ℃保持5 min,12 ℃保存。
1.3.3 高通量测序与序列处理
高通量测序:用2%琼脂糖凝胶电泳对PCR扩增产物进行纯化,并利用Illumina TruSeq DNA样品制备LT试剂盒的说明书进行建库,最后在Illumina Miseq平台上进行2×250 bp的双端测序。测序由南京派森诺基因科技有限公司进行。
序列处理:将测序得到的原始序列数据使用demux插件进行解码处理,cutadapt插件进行引物切除,然后使用DADA2插件对序列进行质量过滤、去噪、拼接和嵌合体去除等数据处理,最终获得扩增子序列变体(amplicon sequence variant,ASV)代表序列和丰度信息。 基于ASV代表序列及丰度信息,进行物种分类注释、群落多样性分析和物种差异分析等。
1.3.4 数据处理与统计分析
使用Excel 2021记录理化因子和数据预处理,使用IBM SPSS Statistics 26.0对理化因子进行方差分析,使用Origin 2024绘制理化因子的点线图。 扩增子测序数据在派森诺基 因 云 平 台(https://www.genescloud.cn/project/list/AnalysisList)进行分析,并借助云平台绘制微生物物种组成分析图、RDA图、相关性热图等。
2 结果与分析
2.1 酱香型白酒第三轮次糟醅发酵过程中理化因子变化
对酱香型白酒第三轮次糟醅发酵过程的酸度、水分、还原糖和淀粉含量进行测定,结果见图1。由图1A可知,酸度和水分含量均随着发酵时间在0~30 d范围内的增加而呈现逐渐上升的趋势,其中酸度的变化幅度为1.89~3.33 mmol/10 g,水分含量的变化幅度为49.79%~54.05%。由图1B可知,淀粉含量初期最高,为23.84%,随着发酵时间在0~30 d范围内的增加,淀粉含量逐渐下降,至发酵结束时淀粉含量为18.55%。发酵时间为0~30 d时,还原糖含量呈现先升高后降低的趋势。在发酵时间为0~8 d时,还原糖含量从1.04%增加至1.34%;在发酵时间为8 d时,还原糖含量最高,为1.34%;在发酵时间为8~15 d时,还原糖含量急速下降;在发酵时间为15~30 d时,还原糖含量缓慢下降,出窖时还原糖含量为0.42%。从淀粉和还原糖含量前期的变化趋势可以看出,在发酵前8 d,淀粉含量从23.84%下降至21.88%,而还原糖含量从1.04%上升至1.34%,这期间可能是由于淀粉被微生物分解为还原糖的速率超过了还原糖消耗的速率,导致了还原糖含量的增加。
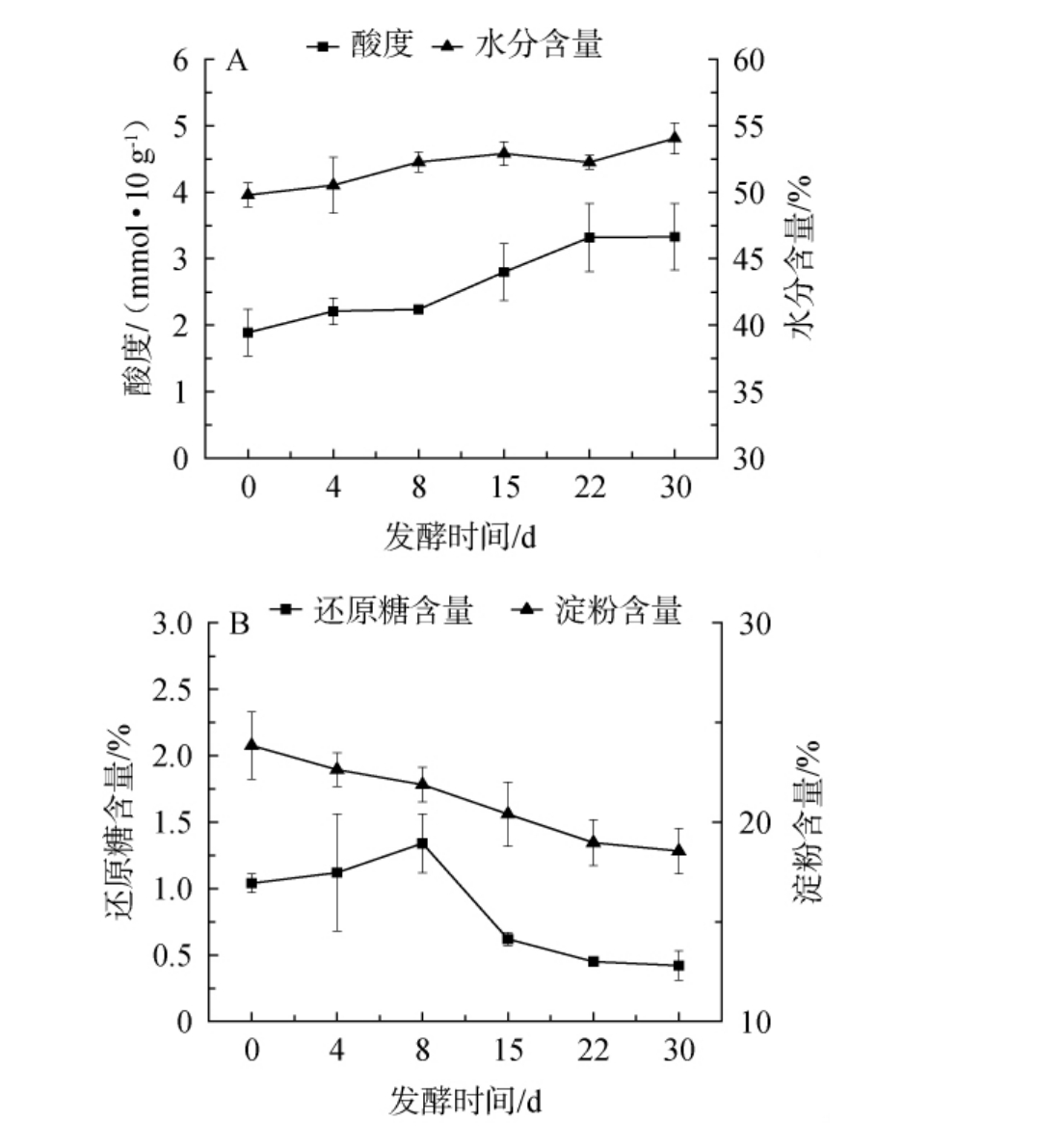
图1 酱香型白酒第三轮次糟醅发酵过程中酸度、水分含量(A),还原糖、淀粉含量(B)的变化
Fig.1 Changes of acidity, moisture contents (A), reducing sugar,starch contents (B) in the third round fermented grains during fermentation process of sauce-flavor Baijiu
2.2 糟醅微生物群落的Alpha-多样性分析
Alpha-多样性通常用于表征物种在生境内和生境间的多样性,以综合评价其总体多样性。Chao1指数反映了物种的丰富度,其数值越高表示丰富度越高;Simpson指数和Shannon指数反映了物种的多样性,其数值越高表示多样性越大;Coverage指数是指各样品(克隆)文库的覆盖率,其数值越高,则样品中序列被测出概率越高,该指数反映本次测序结果是否代表了样品中微生物的真实情况。酱香型白酒第三轮次糟醅微生物群落的Alpha多样性分析结果见表1。 由表1可知,随着发酵时间在0~30 d范围内的进行,糟醅细菌和真菌的Chao1指数、Simpson指数、Shannon指数都随之下降,表明糟醅微生物群落的丰度和多样性逐渐减少,推测是由于发酵后期窖池内处于高温厌氧环境,且糟醅的酸度和乙醇含量较高,抑制了大部分细菌和真菌的生长繁殖[15]。值得注意的是,在酱香型白酒第三轮次窖内发酵初期,糟醅中的细菌群落多样性与丰度均高于真菌群落;而到发酵结束时,真菌群落的丰度与多样性则高于细菌群落。糟醅的细菌和真菌群落的Coverage指数均>99%,说明测序结果能覆盖糟醅中的微生物群落,具有较好的代表性,可用于后续分析。
表1 酱香型白酒第三轮次糟醅发酵过程中细菌和真菌群落的Alpha-多样性分析结果
Table 1 Alpha-diversity analysis results of bacteria and fungi communities in the third round fermented grains during fermentation process of sauce-flavor Baijiu
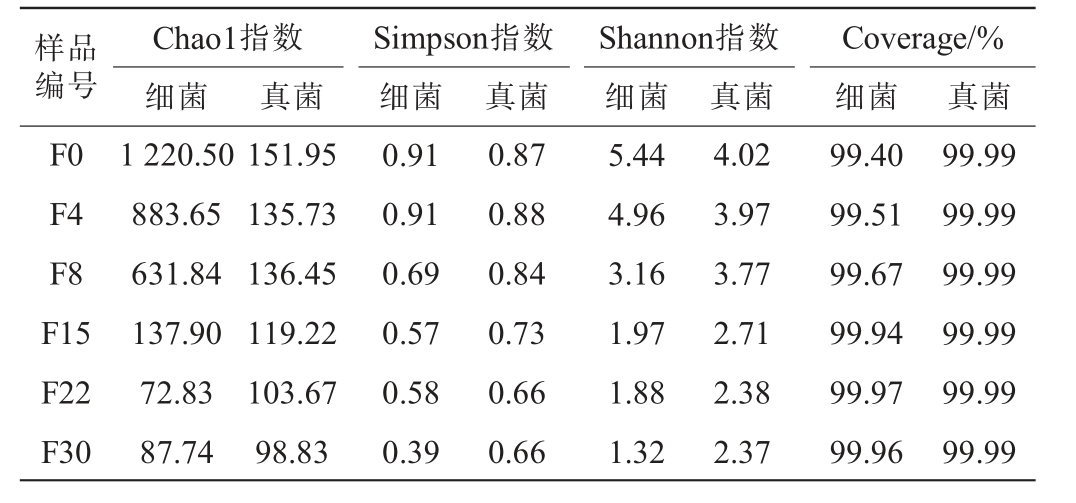
样品编号F0 F4 F8 F15 F22 F30 Chao1指数细菌真菌Simpson指数细菌真菌 真菌Shannon指数细菌Coverage/%细菌 真菌1 220.50 883.65 631.84 137.90 72.83 87.74 151.95 135.73 136.45 119.22 103.67 98.83 0.91 0.91 0.69 0.57 0.58 0.39 0.87 0.88 0.84 0.73 0.66 0.66 5.44 4.96 3.16 1.97 1.88 1.32 4.02 3.97 3.77 2.71 2.38 2.37 99.40 99.51 99.67 99.94 99.97 99.96 99.99 99.99 99.99 99.99 99.99 99.99
2.3 糟醅发酵过程微生物群落演替规律
酱香型白酒糟醅发酵过程微生物群落演替规律见图2。由图2可知,在第三轮次糟醅发酵过程中共检测出305个细菌属、185个真菌属,将平均相对丰度<1%的细菌属和真菌属归为others。第三轮次糟醅发酵过程中主要有12种优势细菌属(平均相对丰度>1%),分别是Lactobacillus、Kroppenstedtia、Virgibacillus、海洋芽孢杆菌属(Oceanobacillus)、芽孢杆菌属(Bacillus)、Unclassified_f_Bacillaceae、醋酸杆菌属(Acetobacter)、鞘氨醇单胞菌属(Sphingomonas)、Unclassified_f_Lactobacillaceae、Unclassified_c_Bacilli、厌氧杆菌属(Anaerosalibacter)和高温放线菌属(Thermoactinomyces);优势真菌属共有13种,分别为哈萨克斯坦酵母属(Kazachstania)、嗜热子囊菌属(Thermoascus)、酵母菌属(Saccharomyces)、微 囊 菌 属(Microascus)、嗜 热 真 菌 属(Thermomyces)、Unclassified_f_Aspergillaceae、丝衣霉属(Byssochlamys)、罗 森 氏 菌 属(Rasamsonia)、红 曲 霉 属(Monascus)、毕赤酵母属(Pichia)、枝孢菌属(Cladosporium)、曲霉属(Aspergillus)和假散囊菌属(Pseudeurotium)。

图2 基于属水平酱香型白酒第三轮次糟醅发酵过程中细菌(A)和真菌(B)群落结构分析
Fig.2 Analysis of bacterial(A)and fungal(B)communities structure in the third round fermented grains during fermentation process of sauce-flavor Baijiu based on genus level
由图2A可知,发酵0~4 d时,Kroppenstedtia、Virgibacillus、Oceanobacillus、Bacillus、Acetobacter、Anaerosalibacter、Thermoactinomyces为优势细菌属。但随着糟醅发酵的进行,它们的平均相对丰度逐渐降低,其中Acetobacter、Anaerosalibacter和Thermoactinomyces这3个细菌属的降幅比例尤为显著。入窖之初,Acetobacter、Anaerosalibacter和Thermoactinomyces的平均相对丰度分别为7.14%、1.29%和1.16%,而到发酵第4天,其平均相对丰度均降至1%以下。从发酵第8天开始,Lactobacillus成为优势细菌属,平均相对丰度为74.29%,并且逐渐升高,至发酵第30天时,其平均相对丰度高达95.94%,为糟醅发酵过程中的绝对优势细菌属。此外,除了酱香型白酒,在浓香型白酒和特香型白酒的糟醅中也观察到了类似的情况[16-17]。 总体而言,糟醅在发酵0~4 d内,细菌属的多样性较高,细菌群落的生态分布呈现出“多菌属博弈”的情况,此时Kroppenstedtia为主要的优势菌属;从发酵第8天开始,细菌属的多样性开始降低,Lactobacillus成为了主要的优势菌属并直到发酵结束,此时窖内糟醅细菌群落的生态分布呈现出“优势菌属独占”的情况[18],以上研究结论与胡小霞等[19]的研究结果一致。
由图2B可知,在整个发酵过程中,Kazachstania和Thermoascus为主导优势真菌属,前者平均相对丰度均>30%,后者平均相对丰度均>10%。研究发现,除了糟醅,Kazachstania还广泛分布于泡菜、青稞饲料等植物乳酸发酵过程[20-21],在乳酸发酵过程中同化乳酸,并水解葡萄糖醛糖苷作为异型发酵乳酸菌的代谢底物,促进其利用果糖产乙酸[22]。游玲等[23]从浓香型白酒糟醅中分离出了Kazachstania的两个常见菌种,分别为K.exigua和K.humilis,发现这两个菌种均可产多种高级脂肪酸乙酯,并且对白酒产量具有重要影响。除此之外,Kazachstania还可以通过与其他微生物相互作用从而影响糟醅发酵,如张霞等[24]研究发现,在自然混菌发酵体系中,K.humilis可抑制L.acetotolerans产乳酸,而L.acetotolerans又能促进K.humilis产乙醇。Thermoascus常被报道为酱香型白酒高温大曲的优势真菌属[25],在大曲发酵中可以参与编码与糖化和酒精发酵相关的酶,具有产酒生香的能力[26],因此,糟醅中的Thermoascus可能来源于大曲中[27]。随着发酵时间的进行,Saccharomyces和Microascus从刚入窖时平均相对丰度仅占1.45%和1.17%,到出窖时二者平均相对丰度均>10%,分别为13.28%和17.06%。 与之相反的是,Thermomyces和Byssochlamys从刚入窖时的高平均相对丰度(11.80%和9.13%)至发酵第4天时有缓慢的升高(14.36%和10.89%),在发酵第8天时开始骤降(7.86%和1.46%),到发酵结束时二者的平均相对丰度仅占2.35%和1.20%。 同时,其余的真菌属也有此类现象,如Unclassified_f_Aspergillaceae、Rasamsonia、Monascus和Pichia从刚入窖时的高平均相对丰度(2.60%、1.98%、2.86%和5.38%),到出窖时平均相对丰度均<1%。
2.4 糟醅发酵过程中优势微生物群落聚类分析
在长达一个月的窖内发酵过程中,不同发酵阶段的理化因子和微生物群落的相互影响状态不同,WANG L等[28]认为微生物组成的差异归因于环境因子,并将第四轮次的窖内发酵周期分为两个阶段,分别为P1(0~12 d)和P2(12~30 d)。 为探究糟醅发酵过程中的微生物群落演替特征,将平均相对丰度>1%的细菌属和真菌属分别进行聚类分析,结果见图3。
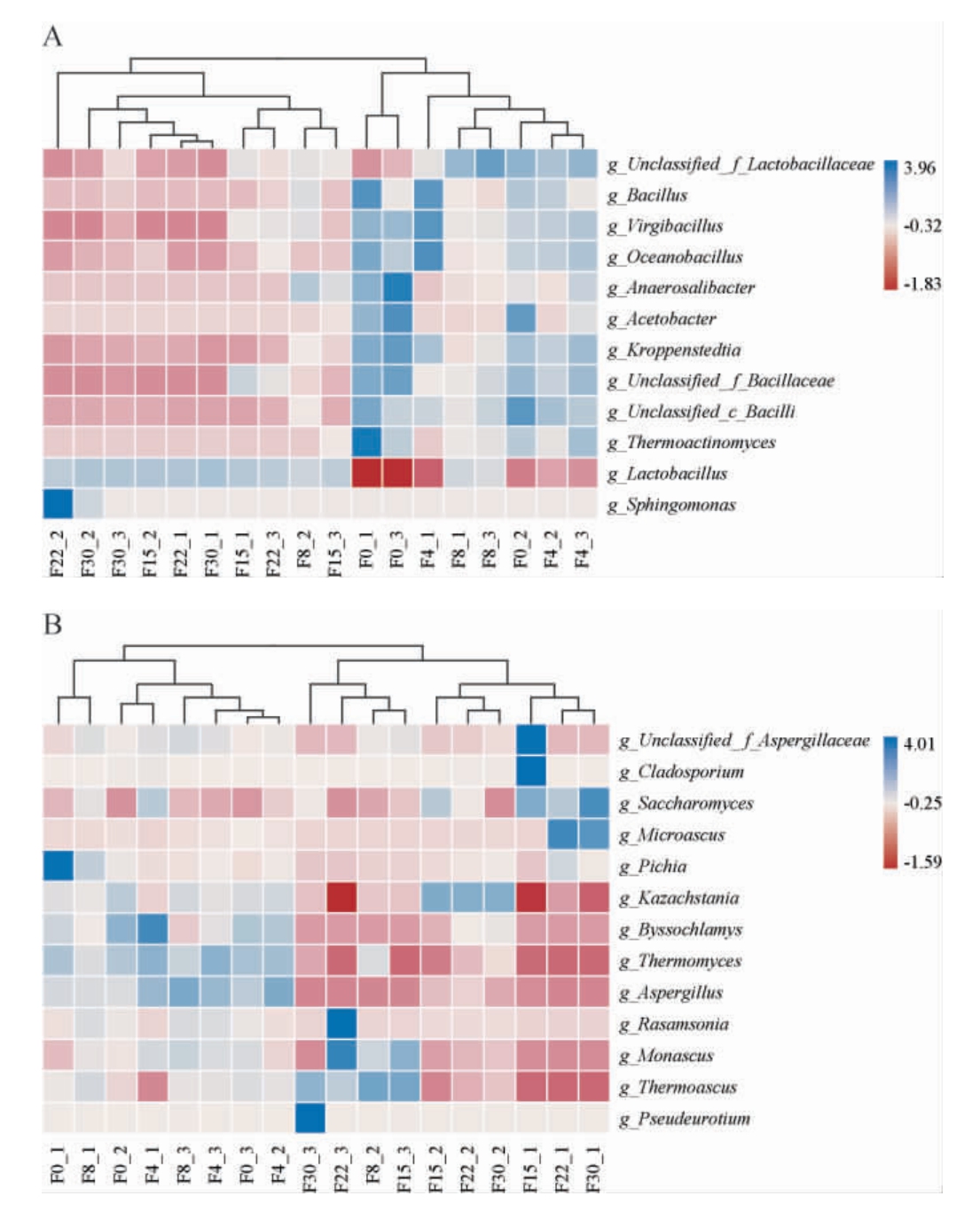
图3 酱香型白酒第三轮次糟醅发酵过程中优势细菌属(A)和优势真菌属(B)聚类分析
Fig.3 Cluster analysis of dominant bacterial genera (A) and dominant fungal genera (B) in the third round fermented grains during fermentation process of sauce-flavor Baijiu
由图3A可知,样品F0、F4和F8中的细菌属可归属为第一类,样品F15、F22和F30中的细菌属可归属为第二类。其中Kroppenstedtia、Virgibacillus和Bacillus等细菌属在样品F0、F4和F8中相对丰度较高(平均相对丰度分别为12.23%~48.63%、3.96%~9.77%和1.57%~6.66%),而在样品F15、F22和F30中相对丰度较低(平均相对丰度分别为1.48%~4.20%、0.42%~1.74%和0.07%~0.13%)。 由图3B可知,样品F0、F4和F8中的真菌属可归属为第一类,样品F15、F22和F30中的真菌属可归属为第二类。 其中Byssochlamys、Thermomyces和Aspergillus等真菌属在样品F0、F4和F8中相对丰度较高(平均相对丰度分别为1.46%~10.89%、7.86%~14.36%和1.70%~3.17%),而在样品F15、F22和F30中相对丰度较低(平均相对丰度分别为0.29%~1.20%、0.34%~2.35%和0.11%~0.22%)。因此,结合微生物群落的演替规律及聚类分析,可将糟醅细菌属和真菌属的发酵过程分为两个阶段,分别为发酵前期(Q)(0~8d)和发酵中后期(ZH)(15~30d)。
2.5 糟醅发酵过程中微生物群落差异分析
为对比糟醅发酵过程中微生物群落差异性,运用线性判别分析效应大小(LEfSe)结合线性判别分析(LDA)值>3对样品展开评估,结果见图4。

图4 酱香型白酒第三轮次糟醅发酵过程中细菌和真菌群落差异线性判别分析效应大小分析
Fig.4 Lineal discriminant analysis effect size analysis of bacterial and fungal communities differences in the third round fermented grains during fermentation process of sauceflavor Baijiu
A,B:LEfSe多级五种层级树图;C,D:属水平LDA值分布柱状图。
由图4A和4C可知,在发酵过程中,共筛选出11种差异细菌属。 在发酵前期共有9种细菌标志物种,分别为Kroppenstedtia、Virgibacillus、Bacillus、Acetobacter、Anaerosalibacter、Thermoactinomyces、Oceanobacillus、假纤细芽孢杆菌属(Pseudogracilibacillus)和火山渣芽孢杆菌属(Scopulibacillus);在发酵中后期共有2两种细菌标志物种,分别为Lactobacillus和不动杆菌属(Acinetobacter)。 值得注意的是,11种差异细菌属中有8种细菌属为优势细菌属(平均相对丰度>1%)。其中,发酵前期的Kroppenstedtia和发酵中后期的Lactobacillus是LDA值最高的优势细菌属(LDA值>5)。Lactobacillus在发酵过程具有较强的碳水化合物代谢能力,能够利用糖类产生乳酸,导致糟醅在发酵过程中酸度不断升高,同时乳酸能与乙醇通过酯化反应生成乳酸乙酯,其产生的有机酸类物质也与酒体酸味呈现显著的相关性[29]。Kroppenstedtia是酱香型白酒酿造过程脂肪酸生物合成的功能微生物,通过编码α-淀粉酶,参与到大曲发酵过程的碳水化合物代谢[30-31]。吴双全等[32]研究发现,Kroppenstedtia有助于堆积发酵糟醅风味化合物的产生,特别是醇类、酸类和吡嗪类等酱香型白酒特征风味物质。
由图4B和4D可知,在发酵过程中,共筛选出4种差异真菌属。Byssochlamys、Aspergillus、Thermomyces和德巴利酵母属(Debaryomyces)是糟醅发酵前期的真菌标志物种,并且前三种均为优势真菌属(平均相对丰度>1%)。其中,Byssochlamys是发酵前期LDA值最高的优势真菌属(LDA值>4)。 酱香型白酒酿造过程中的Byssochlamys主要来源于高温大曲,它具有产生阿魏酸酯酶、α-淀粉酶等生物活性酶类的能力,参与白酒风味成分的生成[33]。
综上可知,在发酵前期(0~8 d),共筛选出9种差异细菌属和4种差异真菌属,Kroppenstedtia和Byssochlamys分别是LDA值最大的细菌标志物种和真菌标志物种。在发酵中后期(15~30 d),共筛选出2种差异细菌属,Lactobacillus是LDA值最大的细菌标志物种。
2.6 糟醅发酵过程中优势微生物群落与理化因子冗余分析
酱香型白酒窖内发酵过程中,糟醅微生物群落组成存在显著差异,随着发酵时间的进行,理化因子的动态变化会影响微生物群落,而微生物又会通过代谢作用产生乙醇、有机酸等代谢产物从而影响理化因子。因此,水分、酸度、还原糖、淀粉等理化因子可通过作用于糟醅微生物菌群的代谢,从而间接调节白酒的风味和品质。
为了揭示不同发酵阶段菌群演替的主要驱动因素,对优势微生物群落(平均相对丰度>1%)与理化因子进行冗余分析(RDA),结果见图5。
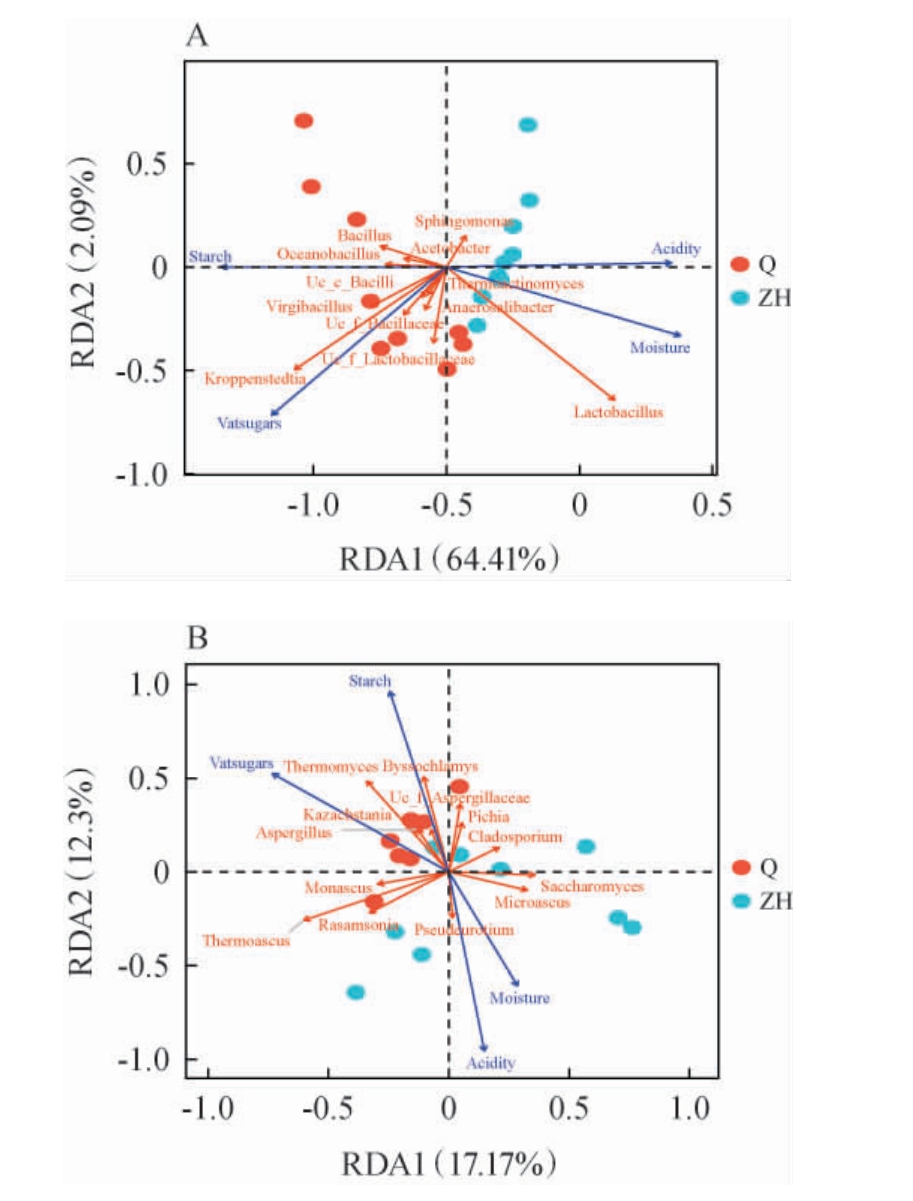
图5 酱香型白酒第三轮次糟醅发酵过程中优势细菌(A)和优势真菌(B)与理化因子的冗余分析
Fig.5 Redundancy analysis between dominant bacteria (A),dominant fungi (B) and physiochemical factors in the third round fermented grains during fermentation process of sauce-flavor Baijiu
由图5A可知,发酵前期菌群与淀粉、还原糖含量呈正相关,发酵中后期菌群与水分含量、酸度呈正相关。在优势细菌群落方面,Kroppenstedtia、Virgibacillus、Bacillus等细菌属与淀粉和还原糖含量呈正相关,Lactobacillus、Sphingomonas细菌属与水分含量和酸度呈正相关。 值得一提的是,在发酵中后期,Lactobacillus是绝对的优势微生物,因此水分含量和酸度是驱动糟醅发酵中后期微生物群落演替的关键因素。由图5B可知,在优势真菌群落方面,糟醅发酵前期的Kazachstania、Thermomyces、Byssochlamys等 真 菌 属 与 还原糖和淀粉含量呈正相关,发酵中后期的Thermoascus、Saccharomyces、Microascus等真菌属与水分含量和酸度呈正相关。 综上,淀粉和还原糖含量是糟醅发酵前期菌群演替的主要驱动因素,水分含量和酸度是糟醅发酵中后期菌群演替的主要驱动因素。
2.7 糟醅发酵过程中优势微生物群落与理化因子相关性分析
为了更进一步了解理化因子对优势菌群的影响,采用Spearman相关系数R>0.5且P<0.05评估微生物与理化指标的相关性,结果见图6。由图6A可知,Lactobacillus与酸度和水分含量呈高度显著正相关(P<0.001),与淀粉和还原糖含量呈显著负相关(P<0.01),与之相反,Kroppenstedtia、Virgibacillus、Oceanobacillus等其余优势细菌属与酸度和水分含量呈显著负相关(P<0.05),与淀粉和还原糖含量呈显著正相关(P<0.05)。由图6B可知,还原糖和淀粉含量与Thermomyces、Unclassified_f_Aspergillaceae、Byssochlamys、Aspergillus等6种真菌属呈显著正相关(P<0.05),酸度和水分含量与Thermomyces、Byssochlamys等5种真菌属呈显著负相关(P<0.05)。
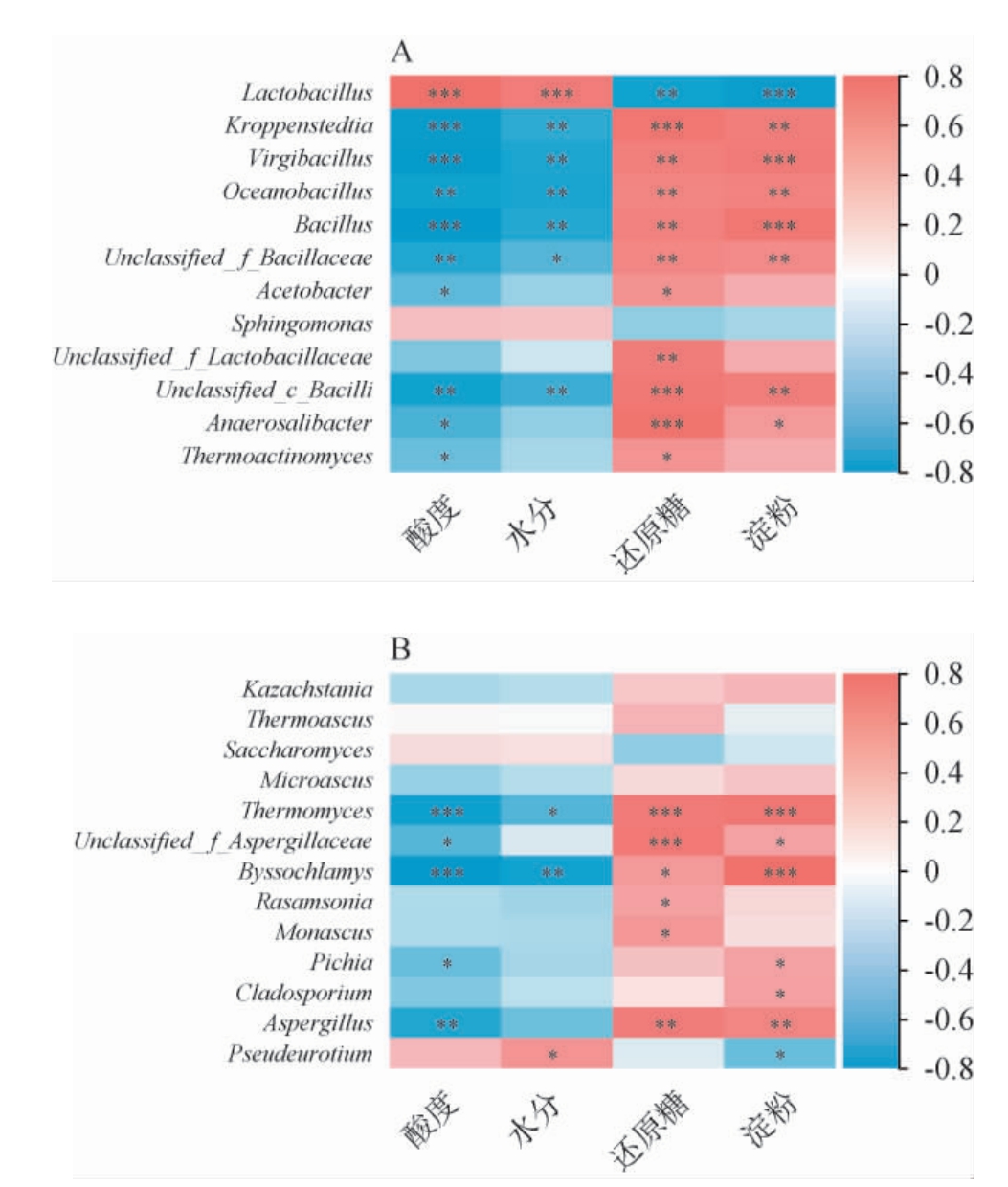
图6 酱香型白酒第三轮次糟醅发酵过程中优势细菌(A)和优势真菌(B)与理化因子的相关性分析热图
Fig.6 Correlation analysis heat map of dominant bacteria (A) and dominant fungi (B) with physiochemical factors in the third round fermented grains during fermentation process of sauce-flavor Baijiu
“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01),“***”表示高度显著相关(P<0.001)。
相关性分析表明,在不同发酵阶段的细菌和真菌菌群演替均受到理化因子不同程度的驱动。 相较于真菌群落,理化因子对细菌群落的影响更大。
2.8 糟醅微生物群落间的共现网络分析
除了环境因子与微生物之间的相互关系,微生物群落之间的相互作用,即生物因子,在调节微生物群落结构和驱动菌群演替以及相应的风味合成中也起着关键作用。为了揭示糟醅在发酵过程中的优势细菌属和优势真菌属(平均相对丰度>1%)之间的相互作用关系,基于Spearman算法(相关系数|ρ|>0.5且P<0.05)进行共现网络分析,结果见图7。由图7可知,优势菌群之间由22个节点和103条边组成,其中包括85种显著正相关以及18种显著负相关(P<0.05)。有14个节点拥有10条及以上的边,其中包含10个细菌属如Lactobacillus、Kroppenstedtia、Virgibacillus等,以及4个真菌属如Byssochlamys、Aspergillus、Thermomyces和Monascus,表明它们可能在菌群的演替中发挥着重要作用。值得注意的是,在微生物群落的共现网络中,细菌群落的网络关联性整体高于真菌。
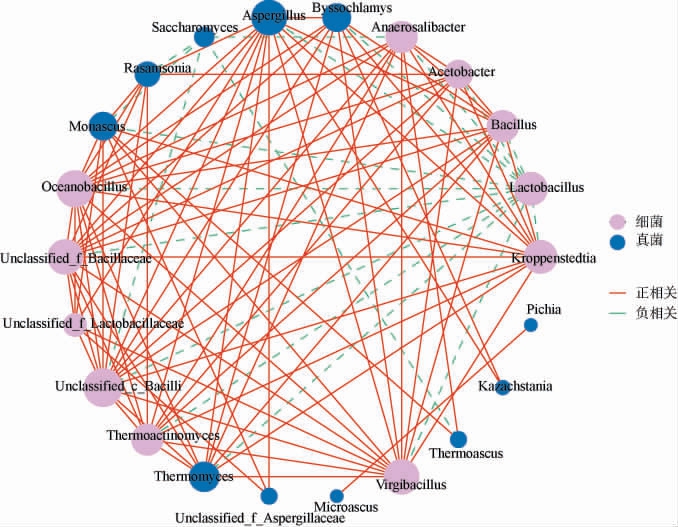
图7 酱香型白酒第三轮次糟醅发酵过程中优势微生物菌属共现网络分析
Fig.7 Co-occurrence network analysis of dominant microbial genera in the third round fermented grains during fermentation process of sauce-flavor Baijiu
Kroppenstedtia、Virgibacillus、Oceanobacillus等这些在发酵前期平均相对丰度较高的细菌属之间均为正相关,并且它们与其余优势细菌属和真菌属之间也呈正相关关系。与之相反的是,Lactobacillus则与大部分发酵前期平均相对丰度较高的Virgibacillus、Oceanobacillus等细菌属和Thermomyces、Monascus真菌属呈负相关。由图7可知,发酵中后期占主导地位的细菌属(如Lactobacillus)和真菌属(如Kazachstania、Thermoascus、Microascus)与其余的微生物之间关联性较少。其中Lactobacillus主要是与发酵前期高平均相对丰度的菌群呈负相关关系,与发酵后期的菌群没有直接的相关性;而Kazachstania等发酵后期平均相对丰度较高的真菌属与其余菌群的连接边均<5条,在共现网络分析中的作用远不及低平均相对丰度的菌群,如细菌属Anaerosalibacter,真菌属Aspergillus,它们分别拥有12和14条边。由此可得,在发酵后期,平均相对丰度较高的微生物在厌氧、高酒精度、高酸度等特定环境下具有高度特化的代谢能力,它们可独立完成关键生态功能,以减少对其他物种的依赖[34]。 这种“功能自给性”使其共现关系多呈竞争或中性,而非协同互惠,从而降低了与其他节点的连接强度[35]。
3 结论
本研究聚焦于酱香型白酒第三轮次窖内发酵过程糟醅,分析了理化因子、微生物群落结构在不同发酵时间的演替规律,并揭示了菌群演替的驱动因子以及相关性。结果表明,糟醅的酸度和水分含量随着发酵时间的进行呈现逐渐上升的趋势,还原糖含量先升高后降低,淀粉含量随发酵进行逐渐下降。 高通量测序结果表明,糟醅发酵过程主 要 有Lactobacillus、Kroppenstedtia、Virgibacillus等12种优势细菌属、Kazachstania、Thermoascus、Saccharomyces等13种优势真菌属。根据菌群演替的规律及聚类分析,将糟醅发酵过程分为发酵前期(0~8d)和发酵中后期(15~30d),其中Kroppenstedtia(LDA值>5)和Byssochlamys(LDA值>4)分别是发酵前期LDA值最大的细菌标志物种和真菌标志物种;Lactobacillus(LDA值>5)是发酵中后期LDA值最大的细菌标志物种。淀粉和还原糖含量是发酵前期菌群演替的驱动因素,与Kroppenstedtia、Virgibacillus、Thermomyces、Byssochlamys等微生物呈显著正相关(P<0.05);水分含量和酸度是发酵中后期菌群演替的驱动因素,与Lactobacillus呈高度显著正相关(P<0.001),相较于真菌群落,理化因子对细菌群落的影响更大。微生物群落之间共现网络分析结果显示,优势菌群之间包括85对呈正相关以及18对呈负相关,并且细菌属间关联性整体强于真菌属。 本研究解析了酱香型白酒第三轮次糟醅微生物群落的演替以及驱动因子,为酱香型白酒窖内发酵优化调控提供理论基础。
[1]何东梅,马宇,黄永光,等.机械化酱香型轮次基酒风味结构及特征酯类化合物解析[J].食品科学,2021,42(10):269-275.
[2]DAI Y,TIAN Z,MENG W,et al.Microbial diversity and physicochemical characteristics of the Maotai-flavored liquor fermentation process[J].J Nanosci Nanotechno,2020,20(7):4097-4109.
[3]孙优兰,骆红波,王金龙,等.酱香型白酒不同轮次基酒风味特征分析[J].食品与发酵工业,2024,50(17):343-352.
[4]赵亮,闵卓,吴福勇,等.酱香型酒醅堆积发酵过程中优势菌群和稀有菌群对细菌总群落演替模式的影响[J].食品科学,2022,43(2):168-175.
[5]王玉荣,侯强川,田龙新,等.酱香白酒第四轮次窖池不同分层酒醅微生物群落与理化性质差异分析[J].现代食品科技,2023,39(2):180-187.
[6]YANG L,CHEN R,LIU C,et al.Spatiotemporal accumulation differences of volatile compounds and bacteria metabolizing pickle like odor compounds during stacking fermentation of Maotai-flavor Baijiu[J].Food Chem,2023,426:136668.
[7]黄慧芹,徐友强,李微微,等.北京地区酱香型白酒第四轮次入窖酒醅中微生物及风味物质的变化[J].食品工业科技,2024,45(1):97-107.
[8]万旗钰,程玉鑫,黄永光,等.酱酒1、2轮次窖池不同醅层微生态结构与酸性化合物组成解析及其相关性预测[J].食品科学,2024,45(4):88-95.
[9]WANG W,XU Y,HUANG H,et al.Correlation between microbial communities and flavor compounds during the fifth and sixth rounds of sauceflavor Baijiu fermentation[J].Food Res Int,2021,150:110741.
[10]GUAN T,LIN Y,CHEN K,et al.Physicochemical factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese strong-flavor Baijiu[J].Front Microbiol,2020,11:2090.
[11]KANG J, HUANG X, LI R, et al.Deciphering the core microbes and their interactions in spontaneous Baijiu fermentation: A comprehensive review[J].Food Res Int,2024,188:114497.
[12]曾波,饶家权,邹永芳,等.浓香型白酒酒醅发酵过程中微生物群落结构演替及其与理化指标相关性[J].食品科学,2024,45(7):111-118.
[13]邹恬杏,苏伟,母应春,等.洞酿酱香酒第四轮次酒醅发酵过程中微生物群落与挥发性代谢物分析[J].中国酿造,2023,42(6):64-71.
[14]中国酒业协会.T/CBJ004—2018 固态发酵酒醅通用分析方法[S].北京:中国标准出版社,2018.
[15]邱显平,黄桥,杨静,等.浓香型白酒在新、老窖池发酵过程中酒醅微生物群落结构差异分析[J].中国酿造,2024,43(1):50-56.
[16]文悦,张宿义,宋攀,等.浓香型白酒酒醅发酵过程中微生物群落阶段性演替规律及形成机理[J].食品科学,2025,46(19):144-157.
[17]LIU J,CHEN Y,FU G,et al.Improvement of the flavor of major ethyl ester compounds during Chinese Te-flavor Baijiu brewing by Wickerhamomyces anomalus[J].Food Biosci,2022,50:102022.
[18]CHEN L,QIN X,WANG G,et al.Oxygen influences spatial heterogeneity and microbial succession dynamics during Baijiu stacking process[J].Biores Technol,2024,403:130854.
[19]胡小霞,黄永光,涂华彬,等.酱香型白酒1轮次酿造细菌的菌群结构[J].食品科学,2020,41(14):175-182.
[20]曾骏,陈安均,蒲彪,等.传统四川泡菜中酵母菌的动态变化规律[J].食品科学,2014,35(7):81-85.
[21]SANTOS M C, GOLT C, JOERGER R D, et al.Identification of the major yeasts isolated from high moisture corn and corn silages in the United States using genetic and biochemical methods[J].J Dairy Sci,2017,100(2):1151-1160.
[22]CORSETTI A,LAVERMICOCCA P,MOREA M,et al.Phenotypic and molecular identification and clustering of lactic acid bacteria and yeasts from wheat(species Triticum durum and Triticum aestivum)sourdoughs of Southern Italy[J].Int J Food Microbiol,2001,64(1-2):95-104.
[23]游玲,周荣清,谭壹,等.Kazachstania属酵母在浓香型白酒糟醅中的分布特征及发酵功能[J].生物技术通报,2021,37(6):108-116.
[24]张霞,郑佳,赵东,等.多粮浓香型白酒中特征酵母菌与耐酸乳杆菌的关系[J].微生物学通报,2019,46(7):1571-1581.
[25]何猛超,任义平,熊林,等.茅台地区不同高温大曲微生物群落结构解析[J].中国酿造,2022,41(6):51-57.
[26]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153:110955.
[27]WANG X, DU H, ZHANG Y, et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microb,2018,84(4):e02369-17.
[28]WANG L,TANG P,ZHAO Q,et al.Difference between traditional brewing technology and mechanized production technology of Jiangxiangxing Baijiu: Micro ecology of zaopei, physicochemical factors and volatile composition[J].Food Res Int,2024,192:114748.
[29]WANG L, WANG Y Y, WANG D Q, et al.Dynamic changes in the bacterial community in Moutai liquor fermentation process characterized by deep sequencing[J].J I Brewing,2015,121(4):603-608.
[30]ZHANG J,DU R,NIU J,et al.Daqu and environmental microbiota regulate fatty acid biosynthesis via driving the core microbiota in soy sauce aroma type liquor fermentation[J].Int J Food Microbiol, 2024, 408:110423.
[31]ZHU Q, CHEN L, PENG Z, et al.The differences in carbohydrate utilization ability between six rounds of sauce-flavor Daqu[J].Food Res Int,2023,163:112184.
[32]吴双全,柴丽娟,黄廷财,等.酱香型白酒堆积酒醅中象牙色克罗彭斯特德菌的分离筛选及其代谢特性解析[J].微生物学报,2024,64(7):2502-2521.
[33]唐佳代,刘力萍,龙亚飞,等.不同感官特性酱香大曲真菌群落结构与理化特性[J].食品科学,2022,43(14):193-198.
[34]PADHI P, WORTH C, ZENITSKY G, et al.Mechanistic insights into gut microbiome dysbiosis-mediated neuroimmune dysregulation and protein misfolding and clearance in the pathogenesis of chronic neurodegenerative disorders[J].Front Neurosci,2022,16:836605.
[35]YAN H,DU W,JI S,et al.Bacterial composition and interactions in raw milk and teat skin of dairy cows[J].Fermentation,2022,8(5):235.