以预防为主导、注重维护健康的观念正在逐渐成为当今社会的主流健康理念。功能饮料近年来的规模持续扩大。据统计,至2023年底,中国功能饮料市场的总价值已达到1 569.04亿元人民币,相较于2022年增长了8.5%[1]。γ-氨基丁酸(γ-aminobutyric acid,GABA),作为一种新兴的功能性成分,在人体内参与多种代谢过程,具备安定神经系统、降低血压与血糖水平等多种生物活性作用[2-5]。 因此,它被广泛应用于药品制造、保健品开发以及功能性食品生产。
GABA是一种由谷氨酸在谷氨酸脱羧酶作用下转化而成的非蛋白质氨基酸,广泛分布于动植物体内[6-7]。2009年,中国卫生部正式将GABA认定为一种新的食品资源,每日摄入量不得超过500 mg。欧洲食品安全局则建议GABA的日膳食摄入上限为550 mg。GABA在食品工业中的应用日益广泛,特别是在饮料领域,GABA的应用潜力受到了市场的普遍认可。自20世纪80年代起,人们开始尝试开发GABA成分的饮料;通过厌氧发酵技术处理后的茶饮,其GABA含量显著提高[8-9],如今市场上已经出现了多种类型的高GABA含量茶饮,以及乳酸菌饮料[10]、草本植物饮料[11]、风味饮料、果蔬汁饮料、蛋白饮料以及固体饮料[12]。 然而值得注意的是,过量摄入GABA可能会抑制中枢神经系统活动,导致疲劳感增强或反应速度下降等问题,存在潜在的安全隐患[5,13]。因此,建立能适用于饮料中GABA含量检测的方法,并开展相关人膳食暴露风险评估显得尤为重要。
当前,对于GABA的测定主要采用了纸层析法[14],Berthelot比色法[15-16],高效液相色谱技术[17-19]以及高效液相色谱串联质谱分析[20-22]。 在使用纸层析法与Berthelot比色法时,存在其他氨基酸干扰、重现性差、灵敏度低及定量准确性不足等问题;鉴于GABA缺乏发光基团,其在紫外和可见光下检测响应较弱,采用高效液相色谱测定时需要对其进行衍生化处理,存在操作复杂繁琐、耗时长,衍生物不稳定性,不适合大规模样本检测的问题;相比之下,利用超高效液相色谱串联质谱技术(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)测定GABA,可以避免衍生处理的繁琐操作,具有高效、专属性好,重复性好,准确度高、灵敏度高的优点。
本研究采用超高效液相色谱串联质谱法建立饮料中GABA的测定方法,对市售产品进行含量测定,并基于测定结果进行饮料中GABA的膳食暴露风险评估,以期为国家在相关领域的风险评估以及监管提供强有力的技术支撑。
1 材料与方法
1.1 材料与试剂
66份饮料样品(茶饮料33份,咖啡饮料12份,植物饮料8份,果蔬汁饮料7份,蛋白饮料3份,其他饮料3份):市售。
乙腈、乙酸铵(均为色谱纯):美国Thermo Fisher Scientific公司;γ-氨基丁酸标准品(纯度>98%):北京曼哈格生物科技有限公司;聚醚砜滤膜(0.22 μm):天津亿鼎鑫分析仪器有限公司。
1.2 仪器与设备
岛津30A超高效液相色谱仪、Sciex4000 Q TRAP三重四级杆液质联用系统:美国AB SCIEX公司;XPR106DUH/AC分析天平:德国赛多利斯公司;IRM IDH30超声仪:德国IRM Technology GmbH公司。
1.3 方法
1.3.1 标准溶液的配制
标准储备溶液的制备:准确称取GABA标准品10 mg(精确至0.01 mg)置于10 mL容量瓶中,用水溶解并定容,制成1 mg/mL的标准储备溶液。
标准工作溶液的制备:精密吸取标准储备溶液适量,用水配制成质量浓度依次为1 ng/mL、5 ng/mL、10 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL的标准工作溶液,用于制作标准曲线。
1.3.2 样品前处理
精确称量2 g已均匀混合的样品(精度0.01 g),置于100 mL容量瓶内,加入适量的水,超声5 min,恢复至室温后,用水定容至刻度,摇匀。将标准品溶液中GABA的质量浓度稀释至标准曲线的有效范围内,过滤膜,所得滤液供仪器分析。
1.3.3 分析条件
超高效液相色谱条件:Agilent Zorbax HILIC色谱柱(2.1×100mm,3.5μm);柱温为35℃;进样量为2μL;流动相A:5 mmol/L乙酸铵溶液;流动相B:乙腈;流速为0.40 mL/min;具体的流动相梯度洗脱程序见表1。
表1 流动相梯度洗脱程序
Table 1 Gradient elution program of mobile phase

时间/min 流动相A/% 流动相B/%0.00 0.50 4.00 4.50 5.00 5.50 7.50 10 10 30 50 50 10 10 90 90 70 50 50 90 90
三重四级杆质谱条件:采用电喷雾离子源(electrospray ionization,ESI);正离子扫描;多反应监测(multiple reaction monitoring,MRM)模式;离子源温度为450 ℃;离子化电压为5 500 V;喷雾气为40 psi;辅助气为40 psi。GABA的定量离子、定性离子及质谱参数见表2。
表2 γ-氨基丁酸测定质谱参数
Table 2 Mass spectrometry parameters for γ-aminobutyric acid determination

注:“*”代表定量离子。
名称 母离子(m/z) 碎片离子(m/z) 去簇电压/DP 碰撞能量/eV γ-氨基丁酸 104.2 87.1*69.1 45.1 15 15 15 17 23 30
1.3.4 膳食暴露风险评估
通过计算饮料中GABA的危害商(hazard quotient,HQ)来评估其膳食暴露风险[23-24]。当HQ值>1时,说明膳食暴露风险较高;当HQ值<1时,说明膳食暴露风险相对较小。HQ的计算公式如下:
式中:“检出含量”为饮料样品中检出GABA的具体含量,mg/kg;“平均膳食量”的数据来源于《中国居民饮料、乳类、茶水和酒消费状况调查报告》[25];按照平均体质量60 kg进行计算;ADI(acceptable dailyintake)代表每日允许摄入量。
1.3.5 数据分析
采用美国AB SCIEX公司的Analyst 1.6.3软件进行分析处理,Microsoft Office Excel 2016软件进行统计分析。
2 结果与分析
2.1 色谱条件的优化
2.1.1 色谱柱的选择
GABA是亲水化合物,在常规的C18色谱柱上几乎不被保留,需要采用亲水色谱柱来实现其有效分离[22,26]。实验考察了四种不同填料、品牌和规格的色谱柱,结果见图1。由图1可知,Waters UPLC HSS T3 C18色谱柱(2.1×100mm,1.7μm)与ThermoRSLC120C18色谱柱(2.1×100mm,2.2 μm)两种常规C18色谱柱对GABA的保留能力较弱,出峰时间在1 min左右,不能实现对GABA的有效分离;Agilent Zorbax HILIC色谱柱(2.1×100 mm,3.5 μm)和Waters BEH Amide色谱柱(2.1×50 mm,1.7 μm)两种亲水作用色谱柱显著改善了GABA的保留行为,能够实现样品中GABA的有效分离。但是GABA在WatersBEH Amide色谱柱上会出现色谱峰拖尾的现象,相比之下,利用Agilent Zorbax HILIC色谱柱可以获得更为理想的色谱峰。基于上述考察结果,选择了Agilent Zorbax HILIC(2.1×100 mm,3.5 μm)作为分析色谱柱。
HSS T3 C18色谱柱(2.1×100mm,1.7μm)与ThermoRSLC120C18色谱柱(2.1×100mm,2.2 μm)两种常规C18色谱柱对GABA的保留能力较弱,出峰时间在1 min左右,不能实现对GABA的有效分离;Agilent Zorbax HILIC色谱柱(2.1×100 mm,3.5 μm)和Waters BEH Amide色谱柱(2.1×50 mm,1.7 μm)两种亲水作用色谱柱显著改善了GABA的保留行为,能够实现样品中GABA的有效分离。但是GABA在WatersBEH Amide色谱柱上会出现色谱峰拖尾的现象,相比之下,利用Agilent Zorbax HILIC色谱柱可以获得更为理想的色谱峰。基于上述考察结果,选择了Agilent Zorbax HILIC(2.1×100 mm,3.5 μm)作为分析色谱柱。
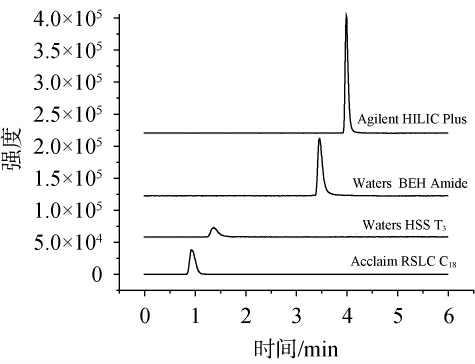
图1 不同色谱柱对γ-氨基丁酸峰型的影响
Fig.1 Effect of different chromatographic columns on the peak shape of γ-aminobutyric acid
2.1.2 流动相的选择
乙腈是亲水色谱柱的常用有机流动相,而在水相中添加适量的乙酸铵能够改善GABA的峰型,并增强其离子化效率,提高灵敏度[27]。实验考察了两种的流动相体系,分别为乙腈+水、乙腈+乙酸铵,从分离效果、峰形质量及响应强度三个方面进行评估。结果表明,在乙腈-水的流动相体系中GABA会出现色谱峰拖尾的情况;而在乙腈-乙酸铵的流动相体系中,峰形能得到明显改善,同时还能增强了目标化合物的响应。 实验进一步对乙酸铵浓度进行了考察,分别考察了2 mmol/L、5 mmol/L、10 mmol/L和20 mmol/L的乙酸铵对分离效果的影响,结果表明,γ-氨基丁酸的保留时间为4.51 min,5 mmol/L乙酸铵条件下GABA的响应强度优于2 mmol/L,但浓度增加至10 mmol/L和20 mmol/L时,并未观察到更优的效果。基于考察结果,最终选择乙腈-5 mmol/L乙酸铵作为流动相。
2.2 质谱条件的优化
通过直接进样标准品的方法来优化质谱分析条件。采用100 ng/mL的GABA标准溶液作为样品,直接注入质谱仪进行测试。研究表明,在正离子模式下,GABA能够产生显著的质谱信号;相比之下,在负离子模式下则几乎没有检测信号。 在ESI+全扫描模式中,观察到了m/z为104.2的[M+H]+分子离子峰,并在此基础上调整了离子源的相关参数。 进一步通过二级质谱分析,选择了三个具有较好稳定性和响应度的特征碎片离子,其m/z分别为87.1、69.1和45.1,结果见图2。其中,m/z87.1处的碎片离子响应最好,推测该碎片可能是母离子失去NH3后形成的[M-NH3+H]+离子,实验选择m/z 87.1作为定量离子,而另外两个碎片离子作为定性离子。
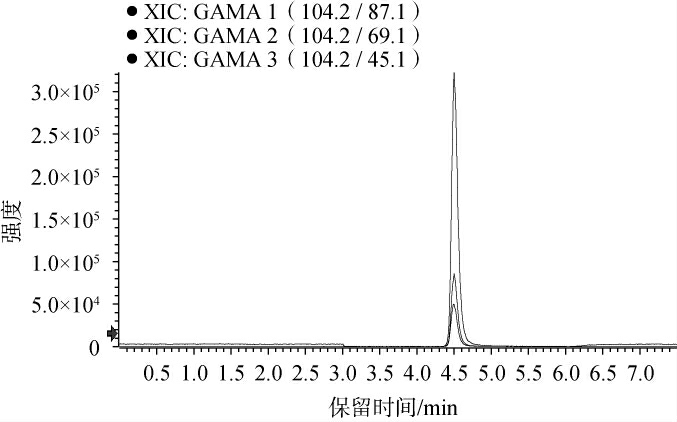
图2 γ-氨基丁酸的离子提取图
Fig.2 Ion extraction diagram of γ-aminobutyric acid
响应强度由高到低的碎片离子分别为:m/z:87.1、m/z:69.1、m/z:45.1。
2.3 前处理条件的优化
2.3.1 提取时间的考察
GABA是小分子氨基酸,具有良好的水溶性而难溶于有机溶剂[7],实验选用纯水作为提取溶剂[26],采用超声作为提取方式。考察不同超声提取时间(5 min、10 min及15 min)对GABA提取量的影响,结果表明,延长超声时间并未显著提升目标化合物的提取含量,因此选择5 min作为超声提取时间。
2.3.2 净化方式的选择
在液相色谱串联质谱技术的电喷雾离子化阶段,食品基质里的非挥发性成分会与目标分析物竞争离子化机会,影响离子化效率,产生基质效应。 降低或消除基质效应的前处理方法包括蛋白质沉淀、液-液萃取、固相萃取、样品稀释[28-29]。 研究表明,在满足灵敏度的前提下,采用样品稀释法可以达到最佳效果[30]。 基于前期的研究,饮料中含有较高水平的GABA,可以通过稀释法来降低基质效应而同时保证检测灵敏度,实验选择样品稀释法作为净化方式。
2.4 基质效应的考察
采用已知含量的样品,对不同稀释倍数下的基质效应进行考察[22]。 将样品中目标化合物的测定值与实际值之比定义为K,根据基质效应的强度划分,当K≤0.5或K≥1.5,为强基质效应;而当0.5<K<0.8或者1.2<K<1.5时,为中等基质效应;当0.8≤K≤1.2,为弱基质效应,通常情况下可以忽略不计[32-33]。考察样品稀释倍数对基质效应的影响,结果见图3。
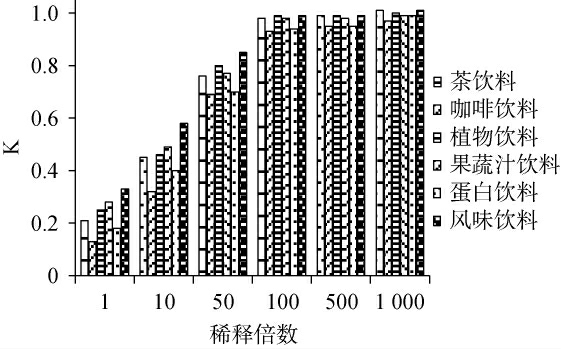
图3 在不同稀释倍数下饮料中γ-氨基丁酸的K值
Fig.3 K-values of γ-aminobutyric acid in beverages at different dilution ratios
由图3可知,基质效应随稀释倍数增大而减弱,当六种饮料样本稀释倍数达到100时,K值为0.93~0.99,表明基质效应可以忽略。因此,在前处理过程中决定采用100倍稀释度,并利用溶剂标准曲线法来进行定量分析。
2.5 线性范围、检出限和定量限
通过所建立的方法对标准工作溶液进行了分析,以GABA定量离子峰面积(y)作为纵坐标,GABA质量浓度(x)为横坐标绘制了线性回归方程。 结果显示,在1~200 ng/mL范围内,GABA标准曲线的线性回归方程为y=1 616.97x+92.5,相关系数r达到了0.999 9。 采用信噪比法来确定该方法的检出限和定量限,表明此条件下饮料中的GABA检出限可达25 μg/kg;定量限为50 μg/kg。
2.6 加标回收率和精密度试验
本研究通过添加不同质量浓度(50 μg/kg、100 μg/kg、500μg/kg)标准物质,依照1.3.2“样品前处理”及1.3.3“分析条件”进行回收率考察。每个加标水平考察6个平行样本,计算各水平的回收率及其相对标准偏差(relative standard deviation,RSD),结果见表3。 由表3可知,饮料中GABA三个不同加标水平下的平均回收率为99.08%~101.21%,精密度试验结果RSD为1.12%~3.21%。上述考察结果符合GB5009.295—2023《食品安全国家标准化学分析方法验证通则》的相关规定,表明该方法准确性高且稳定,适用于快速准确地测定饮料中GABA的含量。
表3 γ-氨基丁酸的加标回收率和精密度试验结果相对标准偏差
Table 3 Spiked recovery rates and relative standard deviation of precision tests results of γ-aminobutyric acid

化合物 加标水平/(μg·kg-1) 平均回收率/% RSD/%γ-氨基丁酸50 100 500 101.21 100.17 99.08 3.21 1.12 1.56
2.7 实际样品测定
本研究采用所建立的检测方法,对市场上66批次饮料中的GABA含量进行了测定,结果见表4。
表4 不同饮料中γ-氨基丁酸含量的测定结果
Table 4 Determination results of γ-aminobutyric acid in different beverages
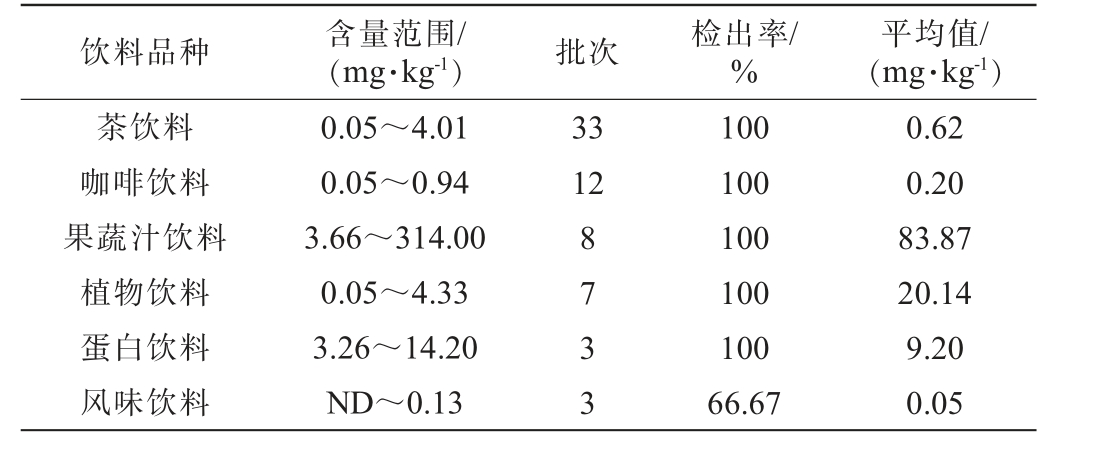
饮料品种 含量范围/(mg·kg-1) 批次 检出率/%平均值/(mg·kg-1)茶饮料咖啡饮料果蔬汁饮料植物饮料蛋白饮料风味饮料0.05~4.01 0.05~0.94 3.66~314.00 0.05~4.33 3.26~14.20 ND~0.13 33 12 8733 100 100 100 100 100 66.67 0.62 0.20 83.87 20.14 9.20 0.05
由表4可知,除了一批风味饮料(其配料为水、三氯蔗糖及天然薄荷提取物)未检测出GABA外,其余65批次饮料中均检测到了该物质,这表明GABA在各类饮料产品中普遍存在。 值得注意的是,果蔬汁类饮料中的GABA平均含量最高,其中一批次的复原橙汁(配料为水和浓缩橙汁)的GABA含量达到了314 mg/kg。 研究结果显示,相较于其他类型,果蔬汁饮料中的GABA含量水平更高。
2.8 膳食风险评估
根据中华人民共和国国家卫生健康委员会发布的2009年第12号公告中关于GABA的日推荐摄入量,假设成年人平均体质量为60 kg,推算出GABA的每日允许摄入量(ADI)为8.33 mg/(kg·bw)。本研究选取了实际检测样本作为分析对象,参考《中国居民饮料、乳类、茶水和酒消费状况调查报告》提供的饮料平均消费量(注:此报告未提供风味饮料的具体消费信息),按照1.3.4所述方法对不同饮料中GABA的膳食风险进行评估,结果见表5。
表5 饮料中γ-氨基丁酸的膳食风险评估结果
Table 5 Results of the dietary risk assessment of γ-aminobutyric acid in beverage
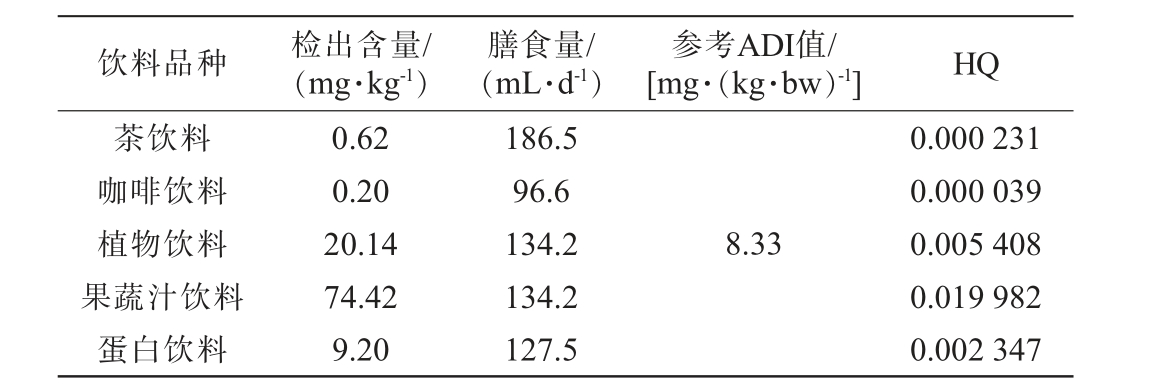
饮料品种 检出含量/(mg·kg-1)膳食量/(mL·d-1)参考ADI值/[mg·(kg·bw)-1] HQ茶饮料咖啡饮料植物饮料果蔬汁饮料蛋白饮料0.62 0.20 20.14 74.42 9.20 186.5 96.6 134.2 134.2 127.5 8.33 0.000 231 0.000 039 0.005 408 0.019 982 0.002 347
由表5可知,饮料中的GABA的危害商(HQ值)远低于安全阈值1,这意味着通过饮料摄入GABA所带来的膳食风险较低。
3 结论
本研究建立了快速测定饮料中GABA含量的超高效液相色谱串联质谱分析方法。 样品经过纯水超声提取后,采用稀释法降低基质效应,在乙腈-5 mmol/L乙酸铵的流动相条件下,经由亲水色谱柱Agilent Zorbax HILIC分离后,采用外标法定量。该方法前处理简便快捷、准确性高、精密度好,能够实现饮料中GABA的快速精确测定。 利用所建立的方法对市场上销售的部分饮料进行了GABA含量的测定,基于测定结果进行了膳食风险评估,结果显示饮料中GABA的膳食风险较低。本研究成果可以为后期饮料中GABA风险评估和政府监管提供有力的技术支撑。
[1]中研网.2024年功能饮料行业现状与发展趋势分析[EB/OL].(2024-7-4)[2024-07-08].https://www.chinairn.com/news/20240704/113200164.shtml.
[2]INOUE K,SHIRAI T,OCHIAI H,et al.Blood-pressure-lowering effect of a novel fermented milk containing γ-aminobutyric acid(GABA) in mild hypertensives[J].Eur J Clin Nutr,2003,57(3):490-495.
[3]MARQUES T,PATTERSON E,WALL R,et al.Influence of GABA and GABA-producing Lactobacillus brevis DPC 6108 on the development of diabetes in a streptozotocin rat model[J].Benef Microb,2016,7(3):409-420.
[4]SUWANMANON K,HSIEH P C.Effect of γ-aminobutyric acid and nattokinase-enriched fermented beans on the blood pressure of spontaneously hypertensive and normotensive Wistar-Kyoto rats[J].J Food Drug Anal,2014,22(4):485-491.
[5]YAMATSU A,YAMASHITA Y,PANDHARIPANDE T,et al.Effect of oral γ-aminobutyric acid(GABA)administration on sleep and its absorption in humans[J].Food Sci Biotechnol,2016,25(2):547-551.
[6]ZHU X J, LIAO J R, XIA X L, et al.Physiological and Itraq-based proteomic analyses receal the function of exogenous γ-aminobutyric acid(GABA) in improving tea plant (Camellia sinesis L.) tolerance at cold temperature[J].BMC Plant Biol,2019,19(1):1646-1654.
[7]吴群,邓江,彭天浩,等.米皮糠中γ-氨基丁酸的薄层鉴别方法及应用研究[J].药食同源杂志,2025,1(6):1-5.
[8]马燕,段双梅,赵明.富含γ-氨基丁酸食品的研究进展[J].氨基酸和生物资源,2016,38(3):1-6.
[9]TSUSHIDA T,MURAI T.Conversion of glutamic acid to gama-aminobutyric acid in tea leaves under anaerobic conditions[J].Agr Biol Chem,1987,51(11):2865-2871.
[10]林杨,孙建,顾美英,等.富含γ-氨基丁酸功能性乳酸菌饮料的配方及稳定性研究[J].中国酿造,2021,40(8):215-221.
[11]杨天予,刘一倩,马挺军.富含γ-氨基丁酸藜麦发酵饮料工艺优化[J].食品工业科技,2019,40(16):169-175.
[12]艾学东.γ-氨基丁酸的生理活性及其在饮料中的应用现状[J].饮料工业,2017,20(5):67-69.
[13]BHAGWAGAR Z,WYLEZINSKA M,JEZZARD P,et al.Reduction in occipital cortex gamma-aminobutyric acid concentrations in medicationfree recovered unipolar depressed and bipolar subjects[J].Biol Psych,2007,61(6):806-812.
[14]张晖,徐永,姚惠源.纸层析法定量测定米胚芽中的γ-氨基丁酸[J].无锡轻工大学学报,2004,23(2):101-103.
[15]闫朝阳,李旭,马钰柯,等.Berthelot比色法测定γ-氨基丁酸含量的实验条件优化[J].济南大学学报(自然科学版),2020,34(3):306-312.
[16]万蓝婷,李暄妍,程建峰,等.Berthelot比色法测定植物叶片中γ-氨基丁酸(GABA)含量的体系优化[J].植物生理学报,2021,57(7):1462-1472.
[17]郭莹,李景辉,李霄霄,等.HPLC法测定中国白酒中的γ-氨基丁酸和核苷类物质[J].食品研究与开发,2021,42(1):153-158.
[18]郭旭光,尹玉云,徐晓楠.高效液相-柱后衍生-荧光检测法测定保健品中γ-氨基丁酸的含量[J].河南预防医学杂志,2020,31(12):894-896.
[19]程威威,周婷,吴跃,等.高效液相色谱法测定发芽糙米中γ-氨基丁酸含量[J].食品科学,2014,35(12):98-101.
[20]秦宇,候蓓蓓,张斌骏,等.超高效液相色谱-串联质谱法测定南瓜中γ-氨基丁酸的含量[J].食品安全质量检测学报,2020,11(2):528-532.
[21]黎亮星,张迪.高效液相色谱-质谱联用法测定粮食制品中γ-氨基丁酸的含量[J].辽宁化工,2019,48(5):490-492.
[22]刘晓茂,杨志伟,崔宗岩,等.超高效液相色谱-串联质谱法同时测定芦笋保健食品中L-茶氨酸和γ-氨基丁酸[J].食品科技,2018,43(3):277-281.
[23]林涛,彭丽媛,陈兴连,等.滇红茶加工过程中氟虫腈及其代谢物降解规律分析及膳食暴露评估[J].食品工业科技,2020,21(41):218-223.
[24]钟玉心,陈悦铭,王宇,等.SPE-HPLC法快速测定食品中的米酵菌酸及其膳食风险评估[J].食品工业科技,2021,42(17):256-262.
[25]刘爱东,李宁.中国居民饮料、乳类、茶水和酒消费状况调查报告[M].北京:中国农业出版社,2020:19-26.
[26]李晓彤,吴丹妮,陈军辉,等.亲水作用色谱-串联质谱法测定茶叶中γ-氨基丁酸和茶氨酸[J].理化检验-化学分册,2019,55(2):130-134.
[27]闵宇航,黄璐瑶,余晓琴,等.超高效液相色谱-串联质谱法测定酱卤肉制品中1-甲基咪唑、2-甲基咪唑及4-甲基咪唑[J].食品工业科技,2021,42(10):261-266.
[28]苏萌,艾连峰.液相色谱-串联质谱基质效应及其消除方法[J].食品安全质量检测学报,2014,5(2):511-515.
[29]史君,吕永恒.如何消除食品质谱分析的基质效应[J].中国食品工业,2022(1):54-55.
[30]DAMS R,HUESTIC M A,LAMBERT W E,et al.Matrix effect in bioanalysis of illicit drugs with LC-MS/MS: Influence of ionization type,sample preparation,and biofluid[J].J Am Soc Mass Spectrom,2003,14(11):1290-1294.
[31]刘娜,唐睿艺,佘城,等.酒类产品中γ-氨基丁酸的测定及其膳食风险评估[J].食品与发酵工业,2024,50(6):254-259.
[32]刘进玺,秦珊珊,冯书惠,等.高效液相色谱-串联质谱法测定食用菌中农药多残留的基质效应[J].食品科学,2016,37(18):171-177.
[33]余晓琴,闵宇航,刘斯琪,等.QuEChERS EMR-Lipid 净化结合超高效液相色谱串联质谱法快速测定食品中非法添加工业染料[J].食品科学,2024,45(16):268-283.