药食同源原料发酵开发酵素可改善风味并拓展产品形态[1]。 植物酵素是以植物为原料,经微生物发酵制得的含有特定生物活性成分的产品(参照中国轻工业行业标准QB/T 5323—2018《植物酵素》),核心在于益生菌代谢生成活性成分(多糖、多酚等)的增效作用。 人参酵素[2]、铁皮石斛酵素[3]和归芪参草功能酵素[4]等药食同源的酵素已有相关研究报道。 发酵可提升桑葚等药食同源原料活性成分生物利用度,但仍存资源效率低、机理不明等挑战[5]。
黄精作为药食同源中的中药材,以其块茎为主要有效成分[6-8]。 黄精富含多糖、低聚糖、甾体皂苷、多酚、黄酮、氨基酸和微量元素等成分,具有抗氧化、降血糖、降血脂和免疫调控等多种生理功能[9-10]。 其中,黄精包括多花黄精、滇黄精、热河黄精和卷叶黄精,其中滇黄精(Polygonatum kingianum Coll.et Hemsl.)为云南道地药材,其药用记载始见于《名医别录》[11],富含多糖、皂苷等活性成分[12],因兼具抗炎、抗氧化及护肝活性[13],素有“气血双补之王”的称号。陈安徽等[14]研究表明,黄精酵素口服液中钙、铁、锌主要以可溶态有机结合态存在,其含量丰富且易于人体吸收,为功能评价提供了科学依据。同时,杨婧娟等[15]获得的黄精酵素超氧化物歧化酶(superoxide dismutase,SOD)活力为131.95 U/g,为黄精酵素的制备奠定了基础。但目前黄精酵素研究多集中于单一菌种发酵,对复合菌系协同增效机制及发酵前后品质对比研究鲜见报道。
本研究以滇黄精为原料,以植物乳植杆菌(Lactiplantibacillus plantarum)Lp-29、动物双歧杆菌乳亚种(Bifidobacterium animalis subsp.lactis)WYB66及长双歧杆菌(Bifidobacterium longum)WB195为发酵菌种,制备滇黄精酵素,通过单因素试验及响应面法优化发酵工艺条件,并分析发酵前后生物活性成分含量及抗氧化能力。以期增强其生物活性,为滇黄精在功能性食品领域的开发提供思路。
1 材料与方法
1.1 材料与试剂
滇黄精:云南普洱市售;红糖:市售;复合益生菌粉(植物乳植杆菌(Lactiplantibacillus plantarum)Lp-29、动物双歧杆菌乳亚种(Bifidobacterium animalis subsp.lactis)WYB66、长双歧杆菌(Bifidobacterium longum)WB195、麦芽糊精):山东君益生物工程有限公司;福林酚、没食子酸、芦丁标准品(纯度>98%):上海士锋生物科技有限公司;苯酚、D-无水葡萄糖、硝酸铝、氢氧化钠、亚硝酸钠:国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS+):天津市众联化学试剂有限公司。
1.2 仪器与设备
SJ-32A全功能调理机:东莞市瑟诺电器有限公司;致微GR60DA灭菌锅:致微(厦门)仪器有限公司;AE224电子天平:上海舜宇恒平科学仪器有限公司;DK-98ⅡA电热恒温水浴锅、WPL-125BE电热恒温培养箱、WGLL-230BE电热鼓风干燥箱、TST-R0-10(超)纯水机:天津市泰斯特仪器设备有限公司;L420医用离心机:湖南湘仪实验室仪器开发有限公司;UV-1900紫外可见分光光度计:上海元析仪器有限公司。
1.3 方法
1.3.1 滇黄精酵素加工工艺流程及操作要点
滇黄精→清洗、切片→调整糖度、打浆→灭菌→接种发酵→过滤→成品
操作要点:
清洗、切片:将挑选出的块茎饱满、表皮完整的新鲜滇黄精用清水清洗去除杂质,切片厚度2~3 mm,均匀一致后备用。
打浆、调整糖度:按滇黄精与水料液比为1∶4(g∶mL)加水,添加11%红糖作为碳源,采用SJ-32A全功能调理机进行均质化打浆,浆液混合均匀。
灭菌:将混合浆液置于灭菌锅中高温灭菌(100 ℃、15 min),以消除杂菌污染。
接种发酵:灭菌后浆液冷却至37 ℃,按0.4%接种量接种复合益生菌(植物乳植杆菌Lp-29∶动物双歧杆菌乳亚种WYB66∶长双歧杆菌WB195=1∶1∶1),转移至恒温培养箱(37 ℃)中静置发酵6 d,pH值降至(3.3±0.1)且稳定24 h,微生物活菌数达106 CFU/mL,发酵液产生典型酸香风味时发酵结束。
过滤:发酵结束后,以双层无菌纱布过滤去除残渣,获得澄清酵素液,即得滇黄精酵素成品,于4 ℃冷藏保存。
1.3.2 滇黄精酵素发酵工艺条件优化
单因素试验:在上述加工工艺基础上,依次考察料液比(1∶2、1∶3、1∶4、1∶5、1∶6(g∶mL))、接种量(0.2%、0.4%、0.6%、0.8%、1.2%)、红糖添加量(3%、5%、7%、9%、11%、13%)、发酵时间(0、1 d、2 d、3 d、4 d、5 d、6 d、7 d)对滇黄精酵素总黄酮含量及感官评分[16]的影响。
响应面试验:在单因素试验的基础上,选择对滇黄精酵素总黄酮含量及感官评分影响较大的料液比(A)、接种量(B)、红糖添加量(C)为自变量,设计3因素3水平Box-Behnken试验优化发酵工艺条件,响应面试验因素与水平见表1。
表1 发酵工艺优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken tests for fermentation process optimization
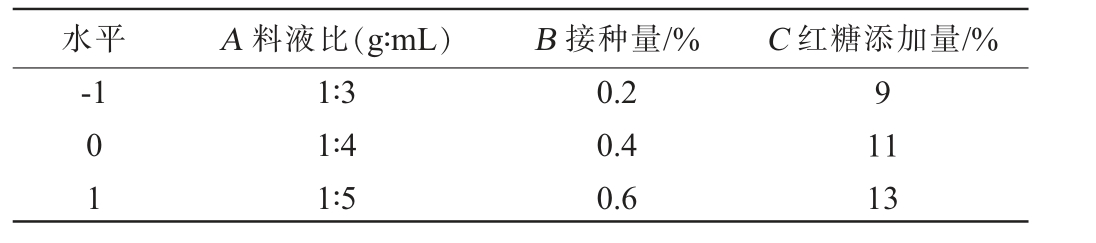
水平 A 料液比(g∶mL) B 接种量/% C 红糖添加量/%-1 9 01 1∶3 1∶4 1∶5 0.2 0.4 0.6 11 13
1.3.3 感官评分
参照QB/T 5323—2018《植物酵素》中对于食用植物酵素的感官要求和张丽华等[17]采用的9分制评分法对滇黄精酵素进行感官评分,将待检样品置于相同的容器中并隐藏其编号,选择经过感官评定训练的评定人员20名,分别从滇黄精酵素的色泽、滋味、香气、组织形态4个方面进行评分,满分为36分,结果取20人平均分。 滇黄精酵素感官评分标准见表2。
表2 滇黄精酵素感官评分标准
Table 2 Sensory evaluation standards of Polygonatum kingianum Jiaosu

项目 评价标准 评分/分色泽滋味色泽光亮鲜丽,均匀适中色泽程度较深呈褐色,色泽过深酸甜爽口,口感协调柔和,无麻涩感酸味或甜味较重,口感比较粗糙,略有麻涩感酸味或甜味过重,口感粗糙刺激,麻涩感明显7~9 4~6 1~3 7~9 4~6 1~3
续表

项目 评价标准 评分/分香气组织形态发酵香味和滇黄精气味协调,无异味滇黄精气味浓重,发酵香味较淡气味不协调,酸味过重,有异味澄清明亮,无悬浮物及沉淀较为澄清明亮,无明显悬浮物或沉淀浑浊,有悬浮物或沉淀7~9 4~6 1~3 7~9 4~6 1~3
1.3.4 综合评分的计算
基于单因素试验结果,发现感官评分对产品接受度贡献显著高于总黄酮含量,故采用“多指标加权综合评分法”(感官评分权重60%+总黄酮含量权重40%)作为响应值[18]。
综合评分(Y)=(总黄酮含量/最高总黄酮含量)×40%+(感官评分/最高感官评分)×60%
1.3.5 指标测定
黄酮含量的测定:采用NaNO2-Al(NO3)3-NaOH显色法[18];多糖的测定:采用苯酚硫酸法[19];多酚含量的测定:采用福林酚法[20];ABTS+自由基清除测定:参照参考文献[21]的方法,修改预孵育时间为6 min并使用波长734 nm检测。DPPH自由基清除能力测定:参照参考文献[22]的方法,调整反应时间为30 min并采用波长517 nm测定。 羟基自由基清除能力:参照参考文献[22]的方法,调整硫酸亚铁-过氧化氢体系反应时间为10 min,并采用水杨酸显色法(终浓度0.1 mmol/L)测定。
1.3.6 数据处理
采用“平均值±标准差”形式表示数据,利用Origin 2018绘图,Design-Expert8.0进行响应面分析,IBM SPSS Statistics 26.0进行单因素方差分析(P<0.05)以及最小显著差数(least significant difference,LSD)、邓肯多重比较分析。
2 结果与分析
2.1 发酵工艺优化单因素试验结果
2.1.1 料液比的选择
料液比对滇黄精酵素感官评分及总黄酮含量的影响见图1。
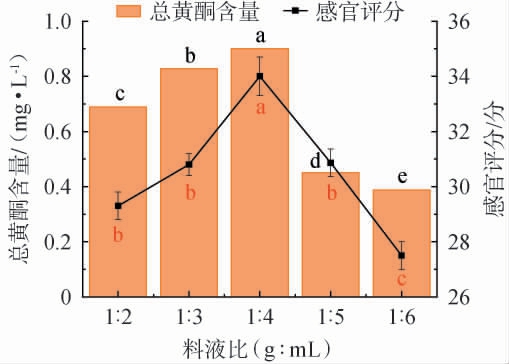
图1 料液比对滇黄精酵素感官评分及总黄酮含量的影响
Fig.1 Effect of material-to-liquid ratio on sensory evaluation score and total flavonoids contents of Polygonatum kingianum Jiaosu
同一指标小写字母不同表示差异显著(P<0.05)。下同。
由图1可知,随着液体比例的增加,总黄酮含量及感官评分逐渐增加,当料液比为1∶4(g∶mL)时总黄酮含量及感官评分均达到最高,分别为0.90 mg/L、34分,其原因可能是,液体比例较低时,不利于其对底物中有效成分的利用;液体比例较高时,可降低有效营养物质浓度,不能维持菌株的生长需求,从而阻碍其生长;因此,在适宜的料液比条件下,复合益生菌才能维持良好的生长状态,充分发酵[23]。 因此,确定最佳料液比为1∶4(g∶mL)。
2.1.2 接种量的选择
由图2可知,随着接种量在0.2%~1.2%范围内增加时,总黄酮含量及感官评分均呈先上升后下降的趋势;当接种量分别为0.4%、0.6%时,总黄酮含量及感官评分均达到最大值(0.823 mg/L、32.3分),其原因可能是因为接种量较低时,发酵不充分;接种量较高时,代谢负荷加重,虽加速发酵进程,但产物过度酸化且营养消耗增加,导致代谢产物积累减少[24]。因此,确定最佳接种量为0.4%。
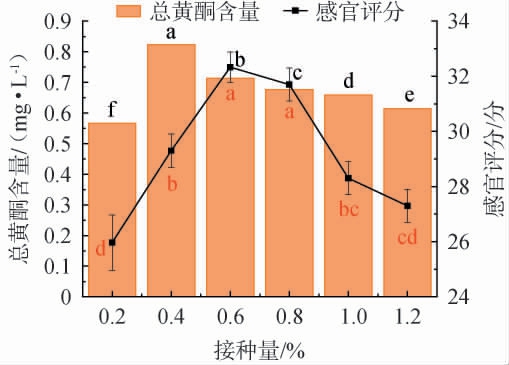
图2 接种量对滇黄精酵素感官评分及总黄酮含量的影响
Fig.2 Effect of inoculum on sensory evaluation score and total flavonoids contents of Polygonatum kingianum Jiaosu
2.1.3 红糖添加量的选择
由图3可知,随着红糖添加量在3%~11%范围内增加时,滇黄精酵素中总黄酮含量和感官评分均呈先上升后下降的趋势;当红糖添加量为11%时,总黄酮含量及感官评分均达到最大值,分别为0.809 mg/L、34.3分。 其原因可能是碳源供给不足时,微生物生长代谢受限,导致次级代谢产物生成量降低,当红糖添加量过高,抑制微生物生长[25],影响滇黄精酵素的整体品质。 因此,确定最佳红糖添加量为11%。
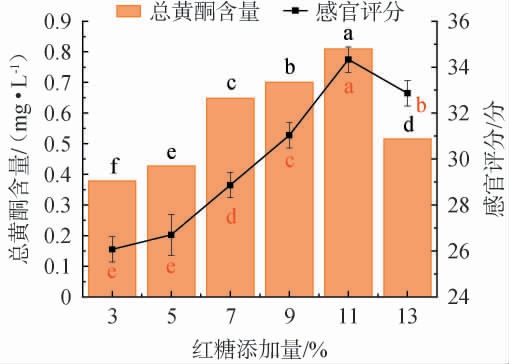
图3 红糖添加量对滇黄精酵素感官评分及总黄酮含量的影响
Fig.3 Effect of brown sugar addition on sensory evaluation score and total flavonoids contents of Polygonatum kingianum Jiaosu
2.1.4 发酵时间的选择
由图4可知,随着发酵时间在0~7 d范围内增加时,滇黄精酵素中总黄酮含量和感官评分均呈先上升后下降的趋势;当发酵时间为6 d时,总黄酮含量及感官评分均达到最大值,分别为0.87 mg/L、33.3分。 其原因可能是,复合益生菌通过其代谢活动,使黄酮类物质释放到溶液中,随着发酵时间的延长,微生物生长进入稳定期,其代谢活动趋于平衡,导致总黄酮含量的增加速度放缓[26]。此外,微生物产生的风味化合物可能会迅速积累,导致感官评分提高。然而,当发酵时间过长时,这些风味化合物可能会发生转化或降解,从而导致感官评分下降[27]。因此,确定最佳发酵时间为6 d。
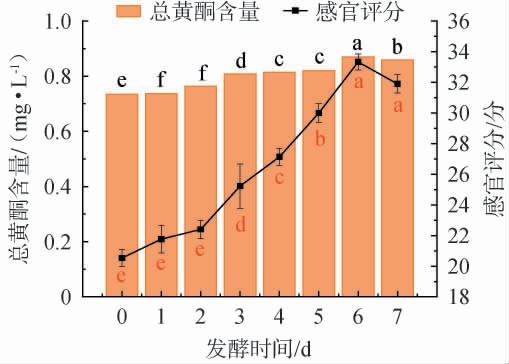
图4 发酵时间对滇黄精酵素感官评价及总黄酮含量的影响
Fig.4 Effect of fermentation time on sensory evaluation score and total flavonoids contents of Polygonatum kingianum Jiaosu
2.2 发酵工艺优化响应面试验结果
根据单因素试验结果,选择对综合评分影响较大的因素进行响应面试验优化。因此,固定发酵时间为6 d,以料液比(A)、接种量(B)与红糖添加量(C)为自变量,以综合评分(Y)为响应值,进行3因素3水平响应面试验。响应面试验结果见表3,回归模型方差分析结果见表4。
表3 发酵工艺优化Box-Behnken试验设计与结果
Table 3 Design and results of Box-Behnken tests for fermentation process optimization
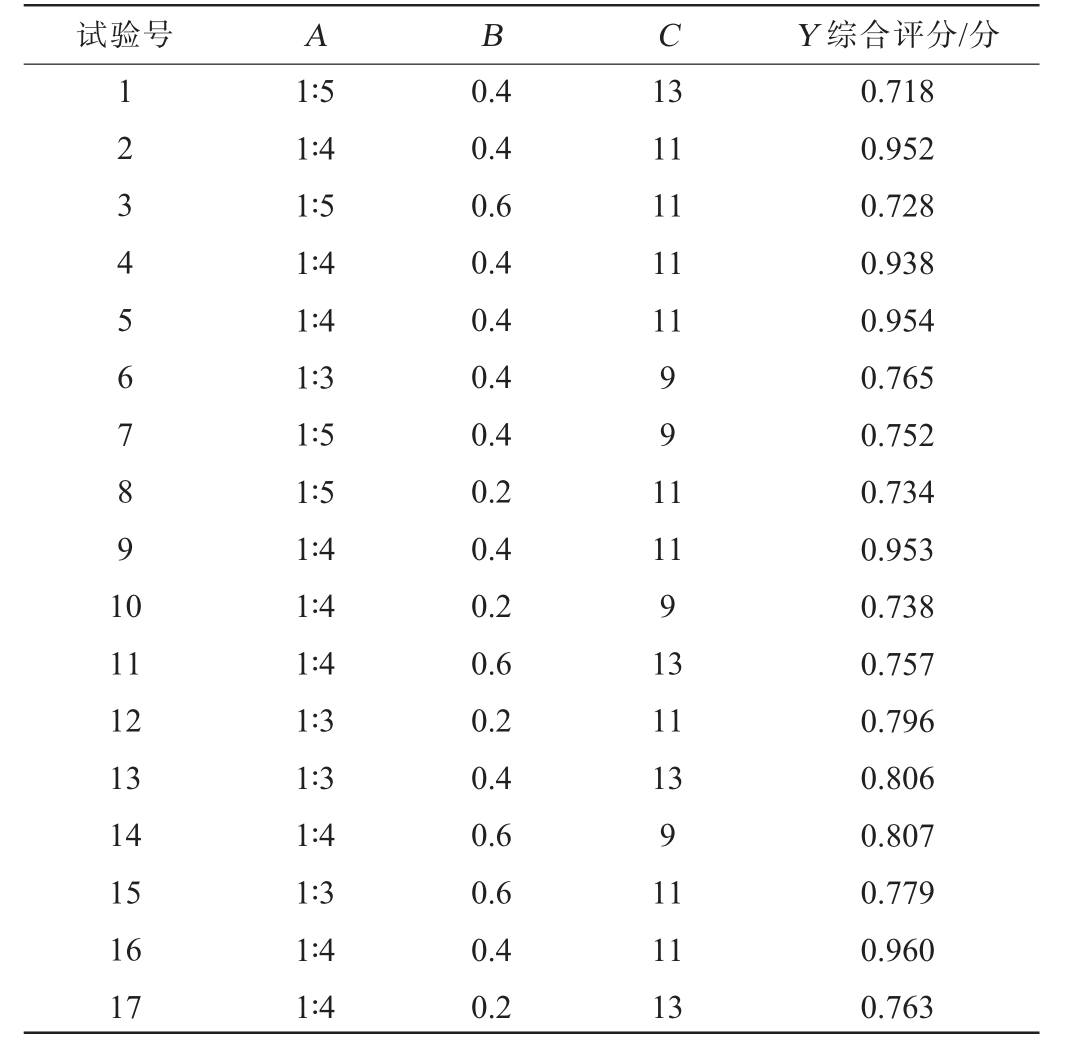
试验号 A B C Y 综合评分/分1234567891 0 13 11 11 11 11 991 1 11 12 13 14 15 16 17 1∶5 1∶4 1∶5 1∶4 1∶4 1∶3 1∶5 1∶5 1∶4 1∶4 1∶4 1∶3 1∶3 1∶4 1∶3 1∶4 1∶4 0.4 0.4 0.6 0.4 0.4 0.4 0.4 0.2 0.4 0.2 0.6 0.2 0.4 0.6 0.6 0.4 0.2 11 9 13 11 13 9 11 11 13 0.718 0.952 0.728 0.938 0.954 0.765 0.752 0.734 0.953 0.738 0.757 0.796 0.806 0.807 0.779 0.960 0.763
表4 回归模型方差分析
Table 4 Variance analysis of regression model
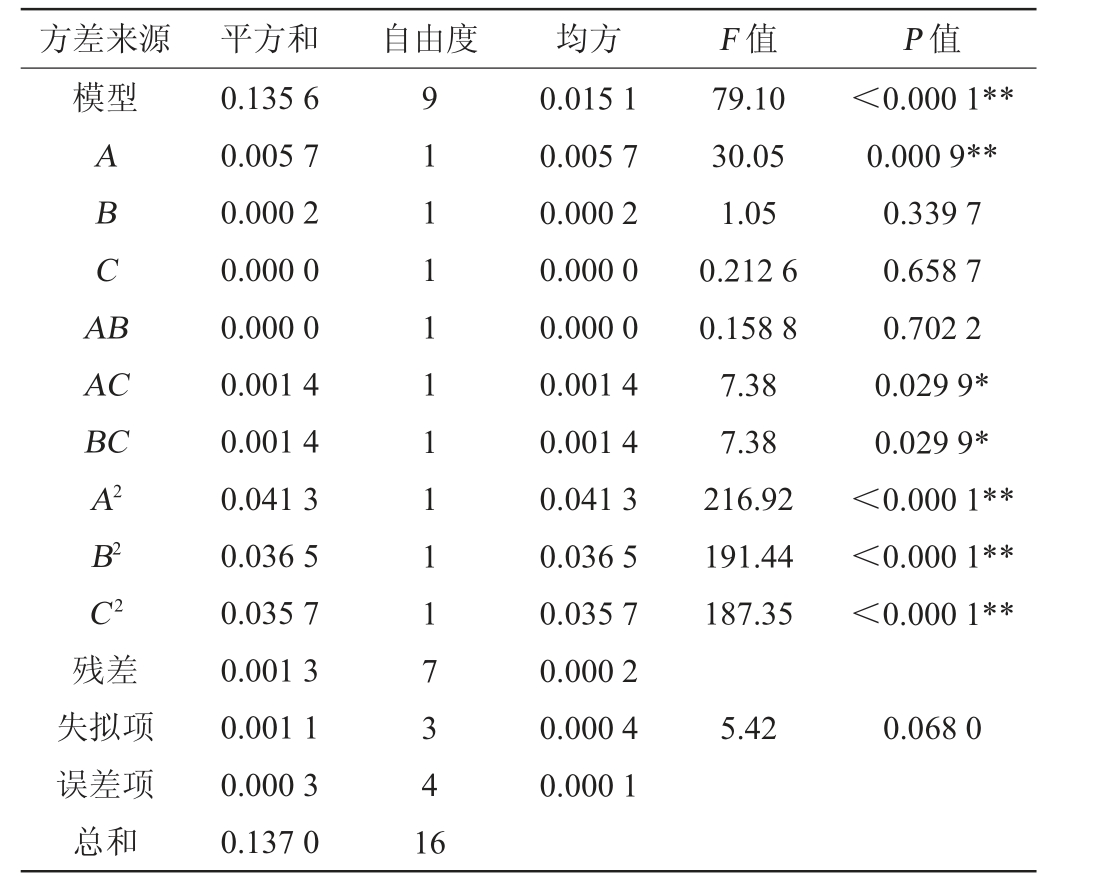
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值模型ABCA B AC BC A2 B2 C2残差失拟项误差项总和0.135 6 0.005 7 0.000 2 0.000 0 0.000 0 0.001 4 0.001 4 0.041 3 0.036 5 0.035 7 0.001 3 0.001 1 0.000 3 0.137 0 91111111117341 6 0.015 1 0.005 7 0.000 2 0.000 0 0.000 0 0.001 4 0.001 4 0.041 3 0.036 5 0.035 7 0.000 2 0.000 4 0.000 1 79.10 30.05 1.05 0.212 6 0.158 8 7.38 7.38 216.92 191.44 187.35<0.000 1**0.000 9**0.339 7 0.658 7 0.702 2 0.029 9*0.029 9*<0.000 1**<0.000 1**<0.000 1**5.42 0.068 0
采用Design-Expert 8.0软件对表3的试验结果进行多元二次回归拟合分析,得到综合评分(Y)与料液比(A)、接种量(B)与红糖添加量(C)的多元二次回归方程:

由表4可知,模型极显著(P<0.000 1),失拟项不显著(P>0.05)。 模型决定系数R2=0.990 3,校正决定系数R2Adj=0.977 7,说明该回归模型与实际试验相符合,具有较高的拟合度,可用于预测最佳发酵工艺参数。由P值可知,一次项A及二次项A2、B2、C2对结果影响极显著(P<0.01),交互项AC和BC对结果影响显著(P<0.05);由F值可知,料液比(A)、接种量(B)与红糖添加量(C)对滇黄精酵素综合评分的影响顺序依次为A>B>C。
各因素间交互作用对滇黄精酵素综合评分影响的响应曲面及等高线见图5。响应曲面的斜度越明显,表示响应值受各种因素的影响越显著;等高线呈斜交椭圆状,显示两种因素的交互性非常显著[28]。由图5可知,交互项AC、BC的响应曲面斜度最明显,等高线为椭圆形且分布密集,表明它们之间存在着显著的交互作用,这与方差分析结果一致。
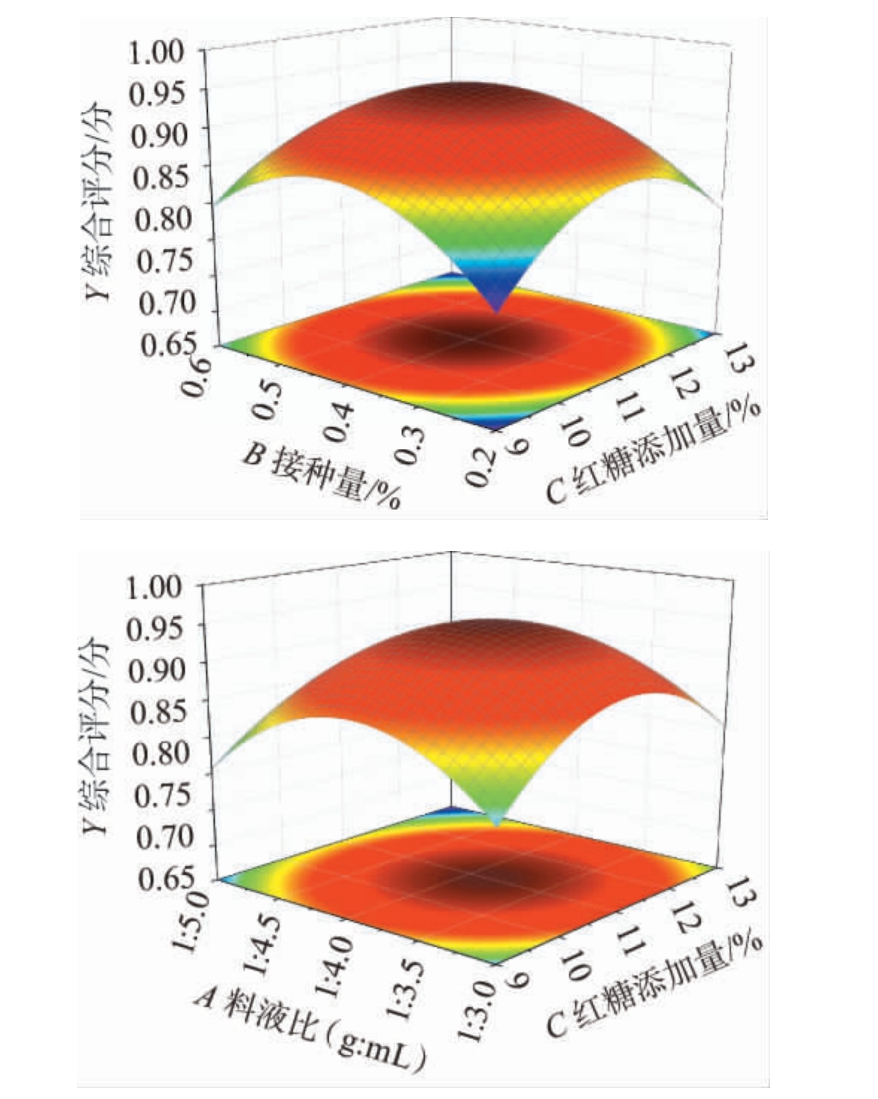
图5 各因素间交互作用对滇黄精酵素综合评分影响的响应曲面及等高线
Fig.5 Response surface plots and contour lines of effect of interaction between various factor on comprehensive evaluation score of Polygonatum kingianum Jiaosu
基于响应面回归模型的结果预测,滇黄精酵素最佳发酵工艺参数为料液比1∶3.865(g∶mL)、接种量0.405%、红糖添加量10.998%,在该条件下,滇黄精酵素综合评分预测值为0.953分。 为方便操作,将发酵工艺条件修正为:料液比1∶4(g∶mL)、接种量0.4%、红糖添加量11%,在此条件下进行3次平行试验验证,得到综合评分实际值为0.94分,与预测值相差不大,说明回归方程准确性高,具有实用价值,可用于对滇黄精酵素发酵工艺参数的分析预测。
2.3 滇黄精酵素发酵前后品质分析
滇黄精酵素发酵前后各项品质指标测定结果见表5。
表5 滇黄精酵素发酵前后品质指标的测定结果
Table 5 Determination results of quality indicators of Polygonatum kingianum Jiaosu before and after fermentation
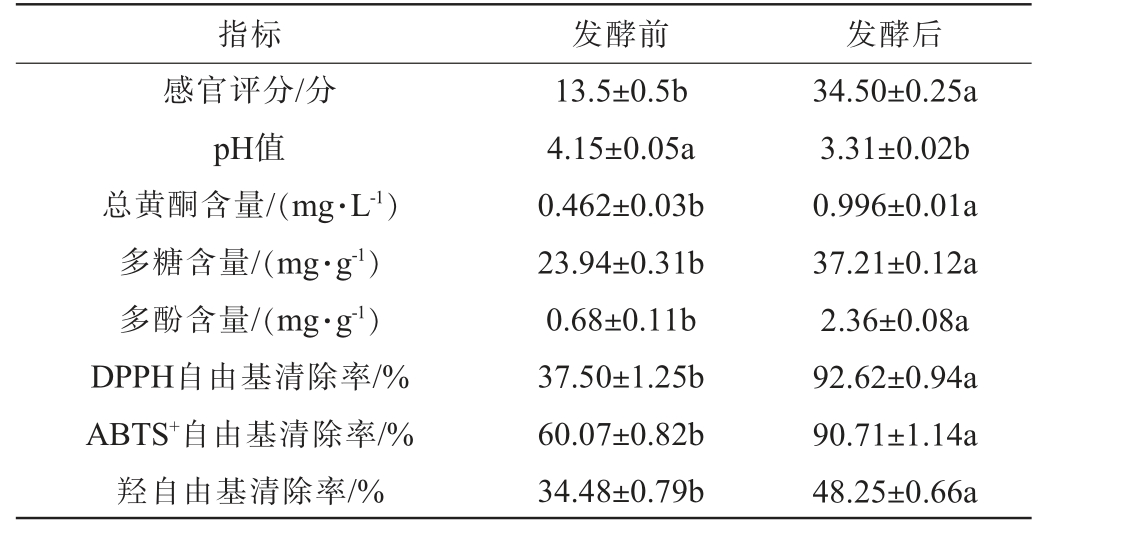
指标 发酵前 发酵后感官评分/分pH值总黄酮含量/(mg·L-1)多糖含量/(mg·g-1)多酚含量/(mg·g-1)DPPH自由基清除率/%ABTS+自由基清除率/%羟自由基清除率/%13.5±0.5b 4.15±0.05a 0.462±0.03b 23.94±0.31b 0.68±0.11b 37.50±1.25b 60.07±0.82b 34.48±0.79b 34.50±0.25a 3.31±0.02b 0.996±0.01a 37.21±0.12a 2.36±0.08a 92.62±0.94a 90.71±1.14a 48.25±0.66a
由表5可知,滇黄精酵素发酵前后的pH值由4.15下降至3.31,原因为基质中的糖类物质经复合益生菌的同型乳酸发酵途径代谢后转化为有机酸释放到酵素中[29]。感官评分由13.5分显著升高至34.5分(P<0.05),可能为发酵过程中的破壁作用,使细胞质中的大量营养素得到释放,降低了滇黄精本身的麻涩感;同时,益生菌代谢产生的风味物质赋予了滇黄精酵素独特、协调的酸香风味[29]。总黄酮含量由0.462 mg/L显著增加至0.996 mg/L(P<0.05),可能是微生物分泌的酶能够水解结合态的黄酮苷元,将其转化为游离态或更易溶的形式[26],同时发酵过程的破壁作用使细胞内黄酮类物质更充分释放[16]。 多糖含量由23.94 mg/g显著增加至37.21 mg/g(P<0.05),原因是微生物在生长代谢过程中会合成并分泌胞外多糖(exopoly saccharides,EPS)[30];同时,微生物酶系对原料中大分子多糖的降解作用,将其转化为分子质量更小、溶解性更好、更易被提取测定的寡糖或小分子多糖[19]。多酚含量由0.68 mg/g显著增加至2.36 mg/g(P<0.05),双歧杆菌通过磷酸戊糖途径产生的烟酰胺腺嘌呤二核苷酸磷酸(nicotinamideadeninedinucleotidephosphate,NADPH)可能参与酚类物质的生物转化,这可能是多酚含量提升的关键机制[31];同时,微生物酶系也可能水解结合态多酚,释放游离酚类[26]。DPPH自由基清除率由37.50%显著提高至92.62%(P<0.05),ABTS+自由基清除率由60.07%显著提高至90.71%(P<0.05),羟自由基清除率由34.48%显著提高至48.25%(P<0.05),可能是因为上述总黄酮、多糖、多酚等核心生物活性成分含量的显著增加是提升抗氧化活性的直接物质基础[13];同时,发酵产生的特定代谢产物(如某些有机酸、肽段、细菌EPS)及益生菌本身也可能贡献直接的抗氧化作用[29]。
3 结论
该研究以滇黄精为原料,以植物乳植杆菌、动物双歧杆菌乳亚种及长双歧杆菌为发酵菌种,制备滇黄精酵素,通过单因素试验及响应面法优化发酵工艺条件,并分析发酵前后生物活性成分含量及抗氧化能力。本研究确定滇黄精酵素的最优发酵工艺条件为:料液比1∶4(g∶mL)、接种量0.4%、红糖添加量11%和发酵时间6 d。 在此优化条件下,滇黄精酵素的综合评分为0.94分。发酵后滇黄精酵素的pH值降低,总黄酮、多糖和多酚含量增加,抗氧化活性显著提升,表明复合益生菌发酵增强了滇黄精在功能性食品中的应用价值。本研究为开发滇黄精这一传统药食两用植物的功能性产品提供了科学依据。
[1]饶智,陈彦坤,刘斌,等.“药食同源”植物酵素研究进展[J].食品与发酵工业,2020,46(9):290-294.
[2]刘涛.人参酵素生物转化及发酵工艺研究[D].广州:华南理工大学,2018.
[3]聂昌平,孙悦,吴丹.铁皮石斛酵素含片的制备工艺[J].食品工业,2019,40(10):27-29.
[4]胡肖利.归芪参草功能酵素的制备与抗自由基活性的研究[D].兰州:兰州理工大学,2018.
[5]任富慧,乔舒敏,李绪久,等.我国药食同源物质发酵产品研究进展[J].中国果菜,2024,44(5):8-14.
[6]蔡媛,刘浩,孔文平,等.多花黄精内生菌群落结构多样性及其与有效成分含量相关性研究[J].中草药,2021,52(3):4023-4029.
[7]XIE Y, JIANG Z W, YANG R, et al.Polysaccharide-rich extract from polygonatum kingianumprotects hematopoiesis in bone marrow suppressed by triple negative breast cancer[J].Biomed Pharmacother,2021,137(6):111338.
[8]LIU J,LI T Y,CHEN H Y,et al.Structural characterization and osteogenic activity in vitro of novel polysaccharides from the rhizome of Polygonatum sibiricum[J].Food Funct,2021,12(14):6626-6636.
[9]任洪民,邓亚羚,张金莲,等.药用黄精炮制的历史沿革、化学成分及药理作用研究进展[J].中国中药杂志,2020,45(17):4163-4182.
[10]LI L,THAKUR K,LIAO B Y,et al.Antioxidant and antimicrobial potential of polysaccharides sequentially extracted from Polygonatum cyrtonema Hua[J].Int J Biol Macromol,2018,114:317-323.
[11]徐宇琳,王元忠,杨美权,等.黄精的本草考证及民族用法[J].中国实验方剂学杂志,2021,27(17):237-250.
[12]陈淼芬,黄子豪,周栋,等.炮制对黄精蛋白氨基酸组成及营养价值的影响[J].食品与发酵工业,2024,50(12):170-177.
[13]杨壮,刘怡琳,李隆熙,等.固态发酵制备黄精多糖的工艺优化、理化特性及抗氧化活性[J].食品与发酵工业,2024,50(7):92-98.
[14]陈安徽,陈尚龙,巫永华,等.黄精酵素口服液中钙、铁和锌的形态分析[J].现代食品科技,2016,32(1):272-277.
[15]杨婧娟,张希,谭书宇,等.黄精发酵工艺的初步研s究[J].食品研究与开发,2016,37(17):81-88.
[16]王印壮,费鹏,马艳莉,等.黄精山楂复合酵素发酵工艺优化及品质变化[J].食品研究与开发,2022,43(19):124-133.
[17]张丽华,王小媛,刘梦培,等.植物乳杆菌发酵红枣汁的工艺条件优化及体外抗氧化活性[J].中国食品学报,2019,19(1):83-88.
[18]李仁杰,丁建秋,姜玮伦等.紫外-可见分光光度法测定刺玫果中总黄酮的含量[J].人参研究,2019,31(4):41-42.
[19]程茜菲,张玩涛,王飞娟,等.黄精多糖提取工艺优化及其吸湿、保湿性能研究[J].中国野生植物资源,2024,43(2):20-25.
[20]LI L F,BUT W C,ZHANG Q W,et al.A specific and bioactive polysaccharide marker for Cordyceps[J].Carbohyd Polym,2021,269:118343.
[21]MEZA A,ROJAS P,CELY-VELOZA W,et al.Variation of isoflavone content and DPPH scavenging capacity of phytohormone-treated seedlings after in vitro germination of cape broom(Genista monspessulana)[J].S Afr J Bot,2020,130:64-74.
[22]WU H C, CHEN H M, SHIAU C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomberau striasicus)[J].Food Res Int,2003,36(9):949-957.
[23]张惠捷,罗盟錡,王金龙,等.响应面法优化混合益生菌发酵银杏叶药渣工艺条件的研究[J].中国饲料,2022(24):108-114.
[24]任婷婷,岳田利,魏欣,等.益生菌发酵苹果浆工艺优化及发酵前后挥发性风味成分分析[J].食品科学,2019,40(8):87-93.
[25]袁磊,张国华,何国庆,等.发酵条件对红茶菌发酵品质及风味的影响[J].食品科学,2017,38(2):92-97.
[26]刁欢,张珍,余伟群,等.微生物发酵提高黄芪中黄酮类物质含量的研究[J].长江大学学报(自科版),2017,14(8):4-7,3.
[27]吉艳莉,李瑞英,郭萌,等.不同发酵菌种及发酵时间对蛋酪风味成分的影响[J].食品与发酵工业,2020,46(2):214-221.
[28]王紫琳,刘俐彤,杨会,等.高山黑蜜酸奶的制备工艺优化及品质分析[J].食品工业科技,2023,44(7):215-225.
[29]全琦,刘伟,左梦楠,等.乳酸菌发酵果蔬汁的风味研究进展[J].食品与发酵工业,2022,48(1):315-323.
[30]徐家盛.大肠杆菌中EP--bifido途径的构建用于高效生产乙酰辅酶A衍生物[D].济南:山东大学,2018.